|
СИНДРОМЫ КРИТИЧЕСКИХ СОСТОЯНИЙ И МЕТОДЫ ИНТЕНСИВНОЙ
ТЕРАПИИ
Интенсивная терапия (ИТ) инфекционных больных — комплекс
мероприятий, применяемых при критических состояниях или угрозе их развития
и направленных на подавление жизнедеятельности возбудителей болезни, детоксикацию,
восстановление и/или поддержание жизненно важных органов и систем в оптимальном
режиме функционирования. Основными организационными принципами ИТ являются
ее неотложность, предупредительный характер (превентивность) и интернозологический
подход к выбору патогенетических лечебных средств и методов. Они реализуются
специальной подготовкой инфекционистов и врачей смежных специальностей,
а также развертыванием соответствующих подразделений — палат, блоков или
отделений ИТ, оснащенных необходимым оборудованием, контрольно-диагностической
и лечебной аппаратурой.
Подавление жизнедеятельности возбудителей болезни — этиотропная терапия
проводится с учетом нозологической формы заболевания, чувствительности
микробов к применяемым антибиотикам и химиотерапевтическим средствам. При
этом необходимо иметь в виду возможное усиление интоксикации вследствие
массивного бактериолиза, токсическое воздействие самих химиотерапевтических
препаратов, анафилактогенное влияние гетерологических биопрепаратов.
Использование противомикробных средств при проведении интенсивной терапии
нередко реализуется на фоне нарушения функций органов и систем, осуществляющих
проникновение вводимых препаратов к очагу инфекции и их выведение из организма.
В ряде случаев лечение осуществляется до установления этиологии заболевания.
При неуточненной нозологической форме тяжело протекающей бактериальной
инфекции, подозрении на сепсис после забора крови и других биологических
жидкостей для последующего микробиологического исследования проводится
так называемая эмпирическая моно- или комбинированная терапия. В качестве
препаратов для монотерапии используют такие антибиотики как меропенем,
имипенем/циластин, цефтриаксон, цефалоспорины IV поколения (кейтен, максипин),
фторхинолоны. При подозрении на стафилококковый сепсис эффективно применение
ванкомицина. В качестве комбинированной антибиотикотерапии наиболее часто
назначают комбинации цефалоспоринов III поколения (цефтриаксон, цефотаксим,
цефтазидим) с аминогликозидами (гентамицин, нетромицин, амикацин). В случаях
подозрения на синегнойный сепсис эффективны тикарциллин/клавуланат, азтреонам
в сочетании с аминогликозидами. После выделения возбудителя и определения
его антибиотикограммы или в случаях установления клинически нозологической
формы инфекционного заболевания предпочтительнее монотерапия.
Смена противомикробных препаратов целесообразна при отсутствии терапевтического
эффекта в течение 48—72 ч, при появлении нежелательных реакций (токсических,
аллергических и др.), а также в случаях высокой потенциальной токсичности
этиотропного препарата и полиорганной недостаточности.
Особую опасность представляют определенные сочетания антибиотиков
с патогенетическими средствами, в частности аминогликозидов и салуретиков
(лазикса). При использовании седативных средств (литические смеси, натрия
оксибутират и др.) следует избегать введения стрептомицина, аминогликозидов,
полимиксина, поскольку их взаимодействие может привести к тотальной миорелаксации,
особенно на фоне гипокалиемии. У больных с заболеваниями системы крови,
с лейкопенией в сочетании с резкой нейтропенией необходимо воздержаться
от применения хлорамфеникола.
Препараты или их комбинации применяют преимущественно внутривенно в
максимально допустимых терапевтических концентрациях, особенно в случаях
генерализованных инфекций. Учитывая возможный массивный бактериолиз с развитием
инфекционно-токсического шока, первые их введения необходимо осуществлять
на фоне инфузионно-дезинтоксикационной терапии и глюкокортикостероидов.
Возможны другие пути введения антибиотиков и химиопрепаратов, обеспечивающих
их максимальную концентрацию в очагах инфекции (эндолюмбальное или интракаротидное
при менингитах, внутриполостное в случаях амебных абсцессов печени или
легких и др.). Следует учесть факторы патогенетической терапии, которые
могут увеличивать или снижать концентрацию антибиотиков.
Максимальные терапевтические дозы антибиотиков (особенно так называемые
мегадозы) могут существенно изменять внутреннюю среду организма и функции
жизненно важных органов. Так, 1 г калиевой соли пенициллина содержит 1,7
ммоль калия, следовательно, при введении 25 млн ЕД этого антибиотика будет
обеспечена минимальная суточная потребность в ионах калия. Введение 1 г
натриевой соли пенициллина, метициллина, карбенициллина обеспечивает дополнительное
поступление в жидкостные пространства соответственно 2,0—3,0—4,7 ммоль
натрия. Необходимо учитывать побочные неблагоприятные воздействия различных
групп антибиотиков для того, чтобы назначением соответствующих патогенетических
средств (глюкокортикостероидов, гепатопротекторов, ангиопротекторов, инфузионных
средств) предупредить или уменьшить их проявления.
Применение антибиотиков в комлексной интенсивной терапии инфекционных
больных предполагает постоянный учет их элиминации и метаболизма, особенно
в различных возрастных группах, при развитии полиорганной недостаточности.
Так, при острой почечной недостаточности существует опасность усиления
токсического эффекта тех антибиотиков, которые в неизмененной форме выводятся
с мочой (пенициллины, аминогликозиды, цефалоспорины и др.) В таких случаях
оптимальная суточная лечебная доза антибиотиков (А) определяется с учетом
стандартной суточной дозы при нормальной функции почек (S), среднего почасового
диуреза при темпе мочеотделения менее 30 мл/ч (Д) и массы тела больного
(М) по формуле: А =0,03 • S • Д • М. Можно использовать соответствующие
расчеты по концентрации креатинина в сыворотке крови по специальным формулам,
приводимым в пособиях и руководствах по реаниматологии и интенсивной терапии
или в аннотациях к некоторым антибиотикам.
В случаях заболеваний с синдромом энтерита и профузной диареей прием
противомикробных средств внутрь следует проводить с более частыми интервалами,
учитывая их ускоренный пассаж с жидкими испражнениями и нарушение всасывания
через слизистую оболочку кишечника.
В связи с широким применением инвазивных методов обследования и интенсивной
терапии возникает опасность госпитальной инфекции, обусловленной условно-патогенной
флорой (эпидермальный стафилококк, грамотрицательная кишечная флора и др.).
Диагностика ее основывается на бактериологических методах исследований.
Для подтверждения причинной связи выделенного микроба с госпитальной инфекцией
может быть использована реакция агглютинации с аутокультурой в динамике.
Выбор антибактериальных средств в таких случаях определяется антибиотикограммой.
Таким образом, назначение антибактериальных средств для лечения больных,
находящихся в критическом состоянии, предполагает не столько увеличение
их доз, сколько учет всех факторов патогенеза каждой конкретной болезни,
влияющих на фармококинетику и фармакодинамику используемых препаратов.
Антибиотики, выводящиеся с желчью или метаболизирующиеся в печени (тетрациклины,
линкомицин), следует применять с особой осторожностью больным с острым
или хроническим гепатитом, со стеатозом печени, в случаях острой печеночной
недостаточности или угрозы ее развития. Больным с печеночной энцефалопатией
для предупреждения гнилостных процессов в кишечнике целесообразно назначать
внутрь те антибактериальные препараты, которые плохо всасываются в кровь
из желудочно-кишечного тракта (канамицин, неомицин и др.).
При проведении детоксикационных мероприятий необходимо исходить из
того, что так называемый синдром общей интоксикации обусловлен воздействием
как микробных токсинов, так и избытком биологически активных веществ, особенно
из группы цитокинов, поступающих в кровь в ответ на микробную агрессию,
а также продуктов альтерации воспаленных тканей, токсических метаболитов
вследствие нарушения гемодинамики и/или функции экскреторных органов.
Если применение средств этиотропной терапии определяется нозологической
формой инфекционного заболевания, то методы интенсивной патогенетической
терапии имеют интернозологический характер. Они зависят от синдромов критических
состояний, которые отражают стереотипный характер ответной реакции организма
на агрессию различных групп возбудителей. Основные клинико-патогенетические
синдромы критических состояний и факторы риска их развития представлены
в табл. 19.

Дифференциация ИТ по клинико-патогенетическим синдромам предполагает
применение патогенетических средств и методов соответствующих механизму
их развития и органным расстройствам. В то же время она проводится на фоне
осуществления таких обязательных мероприятий, как уход, энергообеспечение,
коррекция нарушений гомеостаза и др.
Уход за больными должен обеспечить противоэпидемический режим, профилактику
госпитальной инфекции, оптимальные условия для функционирования жизненно
важных органов и систем, предупреждение осложнений, связанных с тяжелым
течением болезни и/или критическим состоянием.
Полноценное питание и энергообеспечение являются важным звеном в системе
интенсивной терапии. Истощенным или высоколихорадящим больным назначают
дополнительные парентеральное или энтеральное питание (до 5000 ккал/сут).
Планирование инфузионной терапии проводят с учетом обеспечения достаточным
количеством пластического и энергетического материалов, витаминами и микроэлементами,
коррекции водно-электролитного баланса и кислотно-основного состояния,
необходимости внутривенного введения лечебных препаратов. Эти мероприятия
являются обязательными. На их фоне осуществляется дифференцированная интенсивная
терапия в зависимости от характера критического состояния.
Инфекционио-токсический шок (ИТШ) — острая недостаточность
кровообращения (острая циркуляторная недостаточность) и обусловленные ею
тяжелые метаболические расстройства и полиорганная патология. Он наблюдается
чаще при бактериальных инфекциях, характеризующихся массивной бактериемией
(менингококцемия, брюшной тиф, лептоспироз и др.), но может возникнуть
при тяжелом течении гриппа, геморрагических лихорадок, риккетсиозов, стафилококковой
интоксикации. Причиной его могут быть некоторые простейшие (малярийные
плазмодии) и грибы.
Шоковая реакция развивается в ответ на массивное поступление
в кровь микробных токсинов, чаще эндотоксинов, чему может способствовать
усиленный бактериолиз после введения антибиотиков бактерицидного действия.
При грамотрицательной эндотоксинемии «токсинный удар» приводит к резкому
повышению содержания цитокинов, адреналина и других биологически активных
веществ. Наступает спазм артериол и посткапиллярных венул. Устремляющаяся
по артериовенозным шунтам кровь не выполняет своей транспортной функции,
что ведет к артериализации венозной крови, к ишемии тканей и метаболическому
ацидозу. В последующем происходит выброс в кровь гистамина с углублением
шоковой реакции и превалированием гистамина при одновременной гипореактивности
к адреналину.
Спазм артериол сменяется их парезом с сохранением гипертонуса сфинктеров
посткапиллярных венул. Происходит депонирование крови в капилляронах с
повышением ее гидростатического давления, выходом жидкой части в экстравазальное
пространство. Депонированию крови в периферическом сосудистом русле способствует
диссеминированное внутрисосудистое свертывание крови (ДВС), происходящее
одновременно с нарушениями сосудистого тонуса.
ДВС вызывается высвобождением тканевого тромбопластина вследствие ишемического
повреждения эндотелия сосудов, активацией системы комплемента и фактора
Хагемана, выделением из форменных элементов тромбопластиноген-фактора III,
антигепаринового фактора, усилением синтеза, мобилизацией фибриногена и
фактора VII. Диссеминированная гиперкоагуляция с образованием микротромбов,
наряду со склеиванием эритроцитов при сгущении крови, создают феномен «запруды»
(сладжа), существенно ухудшая реологические свойства крови и прохождение
ее по системе капилляронов. Со временем происходит стимуляция естественного
фибринолиза при одновременном снижении коагуляционного потенциала вследствие
использования факторов свертывания. Наступает коагулопатия потребления
с геморрагическими проявлениями.
На уровне органов и систем возникает вначале относительная, а затем
абсолютная гиповолемия, уменьшается венозный возврат крови к сердцу. От
нарушений микроциркуляции, ДВС, гипоксии и метаболического ацидоза страдают
в первую очередь почки, легкие и печень. Уменьшение перфузии почек, ишемия
с резким падением клубочковой фильтрации, интерстиииальный отек ведут к
острой почечной недостаточности. Формируется «шоковое легкое» с характерным
для него интерстициальным отеком, лейкоцитарной инфильтрацией, гиалинизацией
межальвеолярных перегородок, внутрисосудистым застоем, рассеянным спадением
респиронов. Возникает острая паренхиматозная дыхательная недостаточность.
Клинические проявления. В ранней фазе шока (I степень) артериальная
гипотензия может отсутствовать. Характерны признаки резко выраженной интоксикации,
миалгии, боли в животе без определенной локализации, усиление головной
боли, подавленность, чувство тревоги или, наоборот, возбуждение, беспокойство,
тахикардия, уменьшение пульсового давления. Наиболее типичным проявлением
нарушения микроциркуляции является снижение темпа мочевыделения (менее
25 мл/ч для взрослых). Шоковый индекс повышается до 0,7—1,0.
Фаза выраженного шока (II степень) проявляется более выраженными
клиническими признаками циркуляторной недостаточности. Критически падает
артериальное давление (максимальное ниже 11,9 кПа или 90 мм рт. ст.) при
частом (более 100 уд/мин) слабого наполнения пульсе. Шоковый индекс достигает
1,0-1,4. Отмечаются гипотермия, бледная, влажная, холодная кожа, акроцианоз.
Дыхание учащенное. Усиливаются заторможенность и апатия.
В фазе декомпенсированного шока (III степень) происходит дальнейшее
падение артериального давления при нарастании тахикардии. Шоковый индекс
возрастает до 1,5 и более. Нарастает общий цианоз, появляются признаки
полиорганной недостаточности (одышка, олигоанурия, иногда желтуха). В крови
— декомпенсированный метаболический ацидоз, лактатцидемия, гипоксемия.
В поздней стадии шока (IV степень) температура тела снижается
до субнормального уровня, кожа холодная, землистого оттенка, цианотичные
пятна вокруг составов, а затем по всему телу. Выражен симптом «белого пятна».
Токовый индекс более 1,5. Анурия. Острая паренхиматозная дыхательная недостаточность.
Нитевидный пульс. Возможны повторные кровотечения, непроизвольная дефекация.
Сомноленция,
переходящая в сопор и кому. Полиорганная недостаточность приобретает необратимый
характер.
На течение ИТШ определенный отпечаток накладывают патогенетические
особенности отдельных нозологических форм. Так, при менинго-кокцемии, геморрагических
лихорадках доминирует геморрагический синдром. Шок у больных гриппом чаще
развивается в периоде бактериальных осложнений, а у больных лептоспирозом
— с началом антибактериальной терапии.
Разновидностью ИТШ является так называемый синдром токсического шока,
обусловленный поступлением в кровь стафилококковых экзотоксинов у больных
очаговой инфекцией, при использовании женщинами гигиенических тампонов.
В подобных случаях, кроме типичных расстройств микроциркуляции, наблюдаются
диффузная эритематозная или полиморфная сыпь, гиперемия слизистых оболочек,
боли в горле, иногда конъюнктивит.
Программа интенсивной терапии. Основными целями терапевтических мероприятий
при ИТШ являются восстановление микроциркуляции и купирование диссеминированного
внутрисосудистого свертывания, которые проводят одновременно путем настойчивой
инфузионной терапии и внутривенного введения фармакологических препаратов.
В качестве инфузионных средств используют попеременно кристаллоидные
и коллоидные растворы. Вначале применяют 0,9% раствор натрия хлорида (в
качестве растворителя для антимикробных средств), за-тем — лактасоль, энергетические
полиионные растворы с инсулином в объеме до 1500 мл. Их чередуют с коллоидными
растворами (альбумин, реополиглюкин), способствующими перемещению жидкости
из интерстициального во внутрисосудистое пространство. Тем самым уменьшаются
интерстициальный отек, гиповолемия, сгущение крови, агрегация форменных
элементов, устраняется сладж, осуществляется неспецифическая дезинтоксикация.
На фоне стабилизации гемодинамики целесообразно применить реоглюман, который,
одновременно с улучшением реологических свойств крови, стимулирует диурез,
способствуя купированию почечной недостаточности. С целью уменьшения метаболического
ацидоза показано введение 300-400 мл 5% раствора натрия гидрокарбоната.
Общее количество инфузионных растворов при их непрерывном капельном введении
может быть доведено до 4000—6000 мл. При этом количество коллоидных растворов
не должно превышать 1200—1500 мл, в том числе синтетических — 800—1000
мл. Сигналом к снижению скорости и уменьшению количества вводимых инфузионных
растворов является повышение центрального венозного давления (до 140 мм
и выше) и/или сохранение анурии.
Для воздействия на отдельные патогенетические механизмы ИТШ применяют
фармакологические препараты одновременно с инфузионными средствами. Их
вводят через резинку систем внутривенных вливаний или вместе с кристаллоидными
нещелочными растворами. Наиболее эффективными считаются глюкокортикостероиды
в дозах, эквивалентных 10-15 мг преднизолона на 1 кг массы тела больного.
В начале лечения одномоментно вводят 90-120 мг преднизолона и другие препараты
в эквивалентных дозах. В случаях ИТШ I-II степени при положительном эффекте
дальнейшее введение глюкокортикостероидов повторяют в тех же дозах с интервалами
в 6-8 ч. При шоке III-IV степени, отсутствии положительных гемодинамических
сдвигов на фоне внутривенных капельных инфузий осуществляют повторные введения
60-90 мг преднизолона через каждые 15-20 мин. Считается, что массивные
фармакологические дозы глюкокортикостероидов способствуют восстановлению
кровообращения на уровне капилляронов, снимая спазм прекапилляров и посткапиллярных
венул. После достижения устойчивого положительного эффекта переходят на
обычные при тяжелом заболевании разовые и суточные дозы. В последнее время
клинический эффект массивных доз глюкокортикостероидов при лечении больных
ИТШ подвергается сомнению, так как сравнительные исследования не выявили
их преимущества перед инфузионными средствами и препаратами, нормализующими
кровообращение.
С целью стабилизации гемодинамики, в частности, восстановления почечного
кровотока, показано медленное введение допамина (50 мг в 250 мл 5% раствора
глюкозы со скоростью 18—20 капель/мин.). Коррекции микроциркуляции, повышению
неспецифичной резистентности организма, нормализации гемостаза и реологических
свойств крови способствует внутривенное введение трентала (пентоксифиллина).
Массивную инфузионную терапию сочетают с введением сердечных гликозидов,
комплекса витаминов, особенно аскорбиновой кислоты, с коррекцией электролитного
баланса.
Важным по значимости фармакологическим средством выведения больного
из ИТШ является гепарин, с введения которого фактически и должна начинаться
интенсивная терапия, особенно на ранних стадиях шока, когда преобладает
диссеминированное свертывание крови. Его вводят внутривенно, вначале одномоментно,
а затем капельно — по 5 тыс. ЕД под контролем времени свертывания крови
(не более 18 мин). В случаях ИТШ III—IV степени целесообразно введение
ингибиторов фибринолиза — протеиназ (контрикал — 20 000 ЕД или др.) в обязательном
сочетании с гепарином.
Вышеуказанные терапевтические мероприятия проводят на фоне постоянной
ингаляции через носоглоточные катетеры хорошо увлажненного кислорода со
скоростью 5 л/мин. Функционально выгодное положение больного - с приподнятыми
до 15° ногами. Для контроля диуреза необходима постоянная катетеризация
мочевого пузыря. Мочеотделение до 0,5-1,0 мл в 1 мин свидетельствует об
адекватной перфузии паренхиматозных органов и является основным показателем
эффективности терапевтических мероприятий. При этом восстановление исходного
уровня артериального давления не должно быть самоцелью. Использование адреномиметинов
(адреналин, мезатон) допустимо при отсутствии эффекта от вышеперечисленных
мероприятий. При стабилизации гемодинамических показателей могут применяться
методы экстракорпоральной детоксикации, ГБО. После выведения больного из
ИТШ необходимо продолжать интенсивную терапию, направленную на купирование
возможной дыхательной («шокового легкого»), почечной («шоковой почки»),
печеночной недостаточности.
Инфекционно-токсическая энцефалопатия (ИТЭ) — острая
церебральная недостаточность в результате прямого и/или опосредованного
воздействия микробов и/или их токсинов на центральную нервную систему.
Острое нарушение функции ЦНС в результате прямого воздействия микробов
и/или их токсинов является наиболее частым проявлением нейро-инфекций (бактериальные,
вирусные менингиты, энцефалиты, менинго-энцефалиты), некоторых риккетсиозов
(сыпной тиф), бактериальных инфекций с напряженной бактериемией и высокой
степенью интоксикации эндотоксинами (тяжелые формы брюшного тифа, чума
и др.). Опосредованное воздействие на ЦНС наблюдается в результате нарушения
микроциркуляции в головном мозге из-за вазопатических свойств возбудителей
(риккетсиозы, грипп, геморрагические лихорадки), резкого ухудшения реологических
свойств крови в результате интенсивной паразитемии (малярия), снижения
системного кровотока (ИТШ, острое обезвоживание и др.). Инфекционно-токсическая
энцефалопатия может быть одним из клинических проявлений острой недостаточности
функции печени (вирусные гепатиты, лептоспироз), почек (геморрагические
лихорадки, лептоспироз, малярия), легких (грипп, орнитоз, тотальные вирусные
и бактериальные пневмонии), тяжелых нарушений водно-электролитного баланса
и КОС. Таким образом, ИТЭ в большинстве случаев выступает и как следствие,
и как манифестное проявление других критических состояний.
Патоморфологическими эквивалентами ИТЭ являются различной
степени отек-набухание головного мозга с гипоксией и ацидозом. Повышается
проницаемость клеточных мембран, возникает церебральная гипертензия. Однако
энцефалопатия не всегда протекает с повышением внутричерепного давления.
Клинические симптомы ИТЭ отражают различной степени нарушения сознания,
которые могут проявляться в виде его угнетения и/или изменения. Угнетение
сознания — непродуктивная форма нарушения функции ЦНС — характеризуется
снижением уровня бодрствования, угнетением интеллектуальных функций, дефицитом
психической и двигательной активности. Оно протекает в виде сомноленции
(оглушения), сопора и комы. Изменение сознания — продуктивная форма нарушения
функции ЦНС — проявляется извращенным восприятием окружающей среды и собственной
личности, дезинтеграцией психических функций. Оно характеризуется сумеречными
расстройствами сознания (спутанное, затемненное), амнезией, аменцией, онейроидным
синдромом, делирием.
Нарушения сознания при различных инфекциях могут сопровождаться неврологическими
расстройствами, степень выраженности которых зависит от патогенеза того
или иного заболевания. В связи с патоморфологическими и клиническими проявлениями
ИТЭ часто обозначается как синдром отека-набухания головного мозга или
как коматозное состояние.
По глубине угнетения ЦНС инфекционно-токсическая энцефалопатия подразделяется
на три степени, которые характеризуют динамику (фазность) как нарастания,
так и обратного развития патологического процесса.
ИТЭ I степени проявляется сомноленцией (оглушенностью), при которой
угнетение сознания протекает с сохранением словесного контакта. Больные
заторможены, сонливы, ответы на вопросы дают, как правило, односложные,
замедленные, быстро истощаются. Изменения сознания наблюдаются не всегда,
возможна дезориентация в месте и времени, эмоциональная неустойчивость,
а иногда неадекватное и даже агрессивное поведение.
ИТЭ II степени — сопор, угнетение сознания с отсутствием словесного
контакта, но сохранением более или менее адекватной реакции на болевые,
звуковые раздражения, чаще в виде защитных движений, нечленораздельной
речи. Могут наблюдаться психомоторное возбуждение, иногда бред.
При переходе ИТЭ в III степень — кому, наблюдается полная утрата сознания
и восприятия окружающей среды. Реакция на болевые раздражения отсутствует,
возможны беспорядочные неадекватные движения. Глаза на боль не открываются.
При глубокой коме — полное отсутствие спонтанных движений.
Из неврологических расстройств для ИТЭ характерны вначале нистагм,
симптомы орального автоматизма, асимметрия брюшных и сухожильных рефлексов,
иногда патологические рефлексы. При углублении энцефалопатии (комы) патологические
рефлексы становятся отчетливо выраженными, происходит угнетение сухожильных,
периостальных и других рефлексов, наступают мышечная атония, непроизвольные
мочеиспускания и дефекация.
Вышеуказанные основные клинические проявления ИТЭ обычно сочетаются
с симптомами тяжело протекающего заболевания или другими признаками критических
состояний. В случаях ИТЭ I—II степени довольно часто наблюдается психомоторное
возбуждение. Иногда оно усиливается вследствие нарушения воздухопроводимости
верхних дыхательных путей (западение языка), региональных нарушений кровообращения
(неудобное положение или принудительная фиксация больного), переполнения
мочевого пузыря и т.п. Энцефалопатия нередко сопровождается синдромом церебральной
гипертензии, особенно при нейроинфекциях, с характерными симптомами раздражения
мозговых оболочек.
Основными критериями диагностики являются клинические симптомы, результаты
спинномозговой пункции, данные электроэнцефалографии.
Программа интенсивной терапии. К базисным мероприятиям
при синдроме ИТЭ относят профилактику осложнений, связанных с угнетением
и, в особенности, выключением сознания, противоотечную и антигипок-сическую
терапию, купирование гипертермии и психомоторного возбуждения.
Профилактика осложнений включает функционально выгодное положение на
боку со слегка запрокинутой головой, оптимизацию воздухо-проходимости дыхательных
путей (аспирация слизи из ротоглотки, применение специальных воздуховодов,
интубация или трахеостомия), предупреждение пролежней, анкилозов, высыхания
и изъязвления роговой оболочки глаз. Для предупреждения регургитации содержимого
желудка вводят назогастральный зонд, через который, кроме удаления скапливающейся
в желудке жидкости, осуществляется энтеральное питание больных, находящихся
в состоянии комы.
Антигипоксическая терапия состоит из купирования психомоторного
возбуждения (внутривенное введение 20% раствора натрия оксибутирата в дозе
60—90 мг/кг, внутримышечно — диазепама по 2—4 мл 0,5% раствора или литической
смеси), постоянной (через носоглоточные катетеры) ингаляции увлажненного
кислорода, проведения общего или местного охлаждения организма. Следует
учитывать противопоказания для применения отдельных классов седативных
средств в случаях энцефалопатии, обусловленной острой печеночной или почечной
недостаточностью (морфинов, барбитуратов, хлоралгидрата, производных фенотиазина
и др.).
Для уменьшения отека-набухания головного мозга назначают парентерально
глюкокортикостероиды в суточных дозах, эквивалентных 90—120 мг преднизолона.
Показана инфузионно-дезинтоксикационная терапия с одновременным форсированием
диуреза салуретиками. В качестве инфузионных средств используют гемодез
(не более 400 мл/сут), лактасоль, энергетические полиионные растворы, 5%
раствор глюкозы. Количество и скорость их введения определяются состоянием
диуреза, расчетными потерями жидкости. Необходима осторожность в случаях
сочетания ИТЭ с церебральной гипертензией, требующей, проведения энергичной
дегидратационной терапии.
Из специальных методов лечения применяют экстракорпоральную детоксикацию
и ГБО. Мероприятия ИТ должны быть комплексными и проводиться одновременно
с лечением основного патологического процесса, обусловившего церебральную
недостаточность. Критерием эффективности является восстановление сознания.
Церебральная гипертензия (ЦГ) — повышение внутричерепного давления
в результате гиперпродукции ликвора (при воспалении мозговых оболочек),
отека-набухания головного мозга (энцефалиты, менингоэнцефалиты) или его
токсического поражения вследствие инфекционной интоксикации, острой недостаточности
функции выделительных органов.
Клинические симптомы церебральной гипертензии. Она проявляется
нарастающей головной болью, гиперестезией, повторной рвотой. Характерны
менингеальные симптомы Кернига, Брудзинского, Гийена, ригидность затылочных
мышц. Умеренно повышается артериальное давление, что является рефлекторной
защитной реакцией (рефлекс Кохера—Кушинга), обеспечивающей адекватное мозговое
кровообращение при отеке-набухании головного мозга в жестко ограниченном
объеме черепа. Наблюдаются брадикардия, лихорадка, гиперемия и «сальность»
лица. Нарушается функция ЦНС, что проявляется симптомами инфекционно-токсической
энцефалопатии. Она наблюдается не во всех случаях повышения внутричерепного
давления, в то время как опасность последнего связана с такими критическими
последствиями, как вклинение мозга в большое затылочное отверстие или в
вырезку мозжечкового намета.
Вклинение продолговатого мозга в большое затылочное отверстие развивается
остро на фоне прогрессирующей энцефалопатии. При этом появляются общий
цианоз, брадипное и брадикардия, падает артериальное давление, лихорадка
сменяется гипотермией. Отмечается мышечная атония, двигательная активность
отсутствует. Зрачки становятся максимально расширенными, исчезает их реакция
на свет, прекращаются движения глазных яблок. Сухожильные рефлексы резко
снижаются, вплоть до полного их отсутствия. Перестают вызываться пирамидные
симптомы. Отмечаются непроизвольные дефекация и мочеиспускание.
При вклинении головного мозга в вырезку мозжечкового намета появляются
размашистые беспорядочные движения, более выраженные в верхних конечностях.
Зрачки становятся неравномерными, реакция их на свет ослабевает. Резко
повышаются сухожильные рефлексы и патологические пирамидные симптомы. На
фоне усиленной потливости растет температура тела. Характерная для ЦГ брадикардия
переходит в тахикардию, сохраняется или появляется артериальная гипертензия.
В терминальной стадии тахипное переходит в дыхание типа Биота или Чейна—Стокса.
Симптомокомплекс вклинения мозга обычно развивается стремительно, а
его угроза относит церебральную гипертензию в разряд критических состояний,
требующих неотложных реанимационных мероприятий.
Программа интенсивной терапии. Основная цель лечения в случаях
острого повышения внутричерепного давления у инфекционных больных состоит
в срочных дегидратационных мероприятиях. В экстренных случаях целесообразно
использовать осмотические диуретики — концентрированные 20% раствор маннитола
или 30% раствор мочевины, которые необходимо ввести внутривенно со скоростью
120—140 капель/мин в разовых дозах 1,0—1,5 г/кг. Применение мочевины не
показано больным с почечной или печеночной недостаточностью. Осмотические
диуретики способствуют быстрому перемещению воды из экстравазального пространства
во внутрисосудистое русло, приводя тем самым к уменьшению отека-набухания
головного мозга, т.е. церебральной гипертензии. Однако при этом увеличивается
объем циркулирующей крови, что требует осторожности при сопутствующих гипертонической
болезни и органических заболеваниях сердца, а также инфекциях, осложненных
миокардитом или геморрагическим синдромом.
Более широкое распространение в качестве дегидратационных средств приобрели
салуретики (лазикс, фуросемид по 40—80 мг внутривенно). Хотя диуретическое
их действие наступает уже через 3—4 мин, противоотечный, дегидратационный
эффект проявляется в более поздние сроки. Салуретики применяют как самостоятельно,
так и после получения эффекта от осмодиуретиков.
Концентрированные кристаллоидные и коллоидные растворы, в частности
20-25% раствор глюкозы, растворы альбумина следует применять осторожно
в связи с возможным феноменом «отдачи» («рикошета»).
В качестве дегидратационных средств может быть использован реоглюман-комбинированный
препарат, объединяющий лечебные свойства реополиглюкина и маннитола. Его
вводят внутривенно капельно по 500 мл 2 раза в сутки в случаях, если не
нужна экстренная дегидратация. С этой же целью используют глицерин по 2
г/кг массы тела внутрь через назогастральный зонд или посредством питья
вместе с фруктовыми соками и водой.
В случаях появления признаков дислокации головного мозга проводятся
экстренные реанимационные мероприятия — больного переводят на ИВЛ, эндолюмбально
вводят 40—60 мл изотонического раствора натрия хлорида, осуществляют энергичную
дегидратацию.
Диуретики применяют обязательно в сочетании с инфузионно-дезинтоксикационной
терапией, для чего одновременно с достижением дегид-ратационного эффекта
внутривенно вводят лактасоль, квартасоль, глюкозо-калиевые смеси и другие
изоосмотические кристаллоидные растворы. Минимальное их количество должно
соответствовать объему выделенной мочи. При более длительном применении
диуретиков важное значение в системе лечебных мероприятий приобретает коррекция
водно-электролитного баланса. Повышенный диурез может способствовать, особенно
у маленьких детей, переходу церебральной гипертензии в гипотензию, клинические
проявления которых (энцефалопатия) трудно дифференцировать.
Дегидратационные средства сочетаются при необходимости с лечением инфекционно-токсической
энцефалопатии, применением соответствующих нозологической форме заболевания
этиотропных и патогенетических средств.
Дегидратационный синдром (ДС) - острый дефицит воды в
организме в результате преобладающих потерь жидкости над ее поступлением.
Он всегда сопровождается нарушениями электролитного баланса, преимущественно
калия и натрия, изменениями кислотно-основного состояния чаще в сторону
метаболического ацидоза. Различают изотонический, гипертонический и гипотонический
типы обезвоживания. При тяжелом течении инфекционных заболеваний чаще встречаются
изотонический и гипертонический типы дегидратации.
Изотоническая дегидратация возникает у больных острыми диарейными кишечными
инфекциями (холера, гастроинтестинальная форма сальмонеллеза и др.). При
этом под воздействием бактериальных токсинов резко усиливается транссудация
изотонической, бедной белком жидкости в просвет тонкой кишки, избыток которой
не в состоянии реабсорбироваться в нижних отделах кишечника. В результате
наступает уменьшение объема плазмы со снижением количества циркулирующей
крови и ее сгущением. Происходит перемещение жидкости из интерстициального
во внутрисосудистое пространство, которое не может компенсировать продолжающихся
потерь жидкой безбелковой части крови. В связи с этим на первое место выступают
гемодинамические расстройства, нарушения микроциркуляции. Они приводят
к дегидратационному шоку и острой почечной недостаточности.
При дефиците жидкости около 2 л появляются общая слабость, тахикардия,
ортостатические нарушения кровообращения при нормальном артериальном давлении
в лежачем положении. С увеличением дефицита жидкости до 4 л появляется
жажда, усиливается слабость. Тахикардия становится выраженной, артериальное
давление снижается уже в положении лежа. При этом шоковый индекс приближается
к 1,0. С дальнейшей потерей жидкости (до 10% от массы тела) гемодинамические
расстройства усиливаются, шоковый индекс становится больше 1,0. Появляются
признаки нарастающего нарушения микроциркуляции, ацидоза (акроцианоз, судороги),
снижается тургор кожи. Голос становится хриплым. По мере нарастания дегидратации
наступает афония. Черты лица заостряются, больной как бы усыхает, кожа
становится морщинистой («руки прачки»), глазные яблоки мягкие, вокруг глаз
темные круги (симптом «очков»). Судороги, наблюдающиеся вначале в икроножных
мышцах, переходят в общие тонические. Развивается олигоанурия. Такое состояние
расценивают как дегидратационный шок, требующий экстренной инфузионной
регидратации. Сознание нарушается лишь в терминальном состоянии.
Гипертоническая дегидратация возникает у высоколихорадящих больных
(тифопаратифозные заболевания, сыпной тиф и др.), у коматозных больных,
в случаях нарушения глотания (ботулизм, стволовые энцефалиты и др.), вследствие
повышенных потерь воды (гипотонической жидкости) путем перспирации и/или
недостаточного поступления ее в организм. В результате происходит повышение
коллоидно-осмотического давления крови, что ведет к перемещению воды из
интерстиция, а затем из клеток во внутрисосудитое пространство. Возникает
клеточная дегидратация, вследствие чего среди клинических проявлений доминируют
жажда, сухость кожи и слизистых оболочек, различной степени энцефалопатия,
олигурия. Если не восполнены потери 6-8 л воды, то на фоне усиления нарушений
сознания появляются выраженные гемодинамические расстройства, шоковый индекс
становится больше 1, наступает олигоанурия.
При дегидратационном синдроме, особенно в случаях дегидратациейного
шока с падением максимального артериального давления ниже 11,9 кПа, страдает
почечный кровоток («почка при шоке») с развитием в течение 5—8 ч необратимых
изменений («шоковая почка») и острой почечной недостаточности. Последняя
становится определяющей в прогнозе критических состояний даже при восстановленных
потерях жидкости и объеме циркулирующей крови.
Программа интенсивной терапии. Лечебные мероприятия при дегидратационном
синдроме должны быть энергичными и своевременными, упреждающими возможные
необратимые функциональные и морфологические нарушения, связанные с обезвоживанием
и нарушениями гемодинамики. Они проводятся дифференцированно, в зависимости
от характера и степени обезвоживания.
При изотонической дегидратации в случаях отсутствия рвоты и профузной
диареи, небольших потерь жидкости (шоковый индекс 1, нет олигоанурии) регидратационная
терапия может проводиться путем приема внутрь глюкозо-солевых растворов
типа «Оралит», «Регидрон» и др. В домашних или полевых условиях оральный
регидратационный раствор готовят, добавляя к 1 л кипяченой воды одну чайную
ложку поваренной соли и 8 чайных ложек сахара. Однако при неукротимой рвоте
и профузной диарее, нарастании обезвоживания до уровня дегидратационного
шока, необходимо проведение внутривенной регидратационной инфузионной интенсивной
терапии. Она проводится в два этапа. Первый этап представляет собой так
называемую первичную регидратацию, направленную на быстрейшее выведение
больного из шока. Суть ее состоит во внутривенном введении в течение двух
часов водно-солевых растворов, равных расчетным потерям жидкости, определяемым
по формуле: VMJI=4•103•(D— 1,025)•Р, где V — дефицит жидкости, D — относительная
плотность плазмы больного, Р — масса тела в кг. При шоке количество регидратационных
растворов равно 10% массы тела больного. Одновременно проводят коррекцию
метаболического ацидоза. Используют растворы «Квартасоль», «Ацесоль», «Лактасоль»,
«Хлосоль», «Трисоль». В практической работе чаще применяют раствор «Трисоль»
(натрия хлорида — 5 г, натрия гидрокарбоната — 4 г, калия хлорида 1 г на
1 л дважды дестиллированной воды). В крайнем случае, допустимо использование
изотонического раствора натрия хлорида. Инфузионные растворы вводят подогретыми
до 38— 39°С, со скоростью 100—200 мл/мин первые 2 л, затем по 50—75 мл/мин.
Критериями эффективности и завершения первичной регидратации являются улучшение
самочувствия больного, прекращение рвоты, исчезновение акроцианоза и судорог,
а главное — снижение шокового индекса менее 1 ,0 и восстановление диуреза.
В последующем проводят так называемую компенсаторную или корригирующую
регидратацию, которая состоит во внутривенном введении вышеуказанных растворов
в количестве и темпе, равным потерям жидкости организмом больного (объем
испражнений, мочи и рвотных масс, перспирация). После прекращения рвоты
целесообразно перейти на частичное возмещение потерь жидкости путем приема
внутрь глюкозно-солевых растворов.
Интенсивная терапия в случаях гипертонической дегидратации состоит
во внутривенном введении 5% раствора глюкозы, обильном питье. Объем инфузионных
средств определяют расчетными потерями воды организмом больного или по
содержанию натрия в плазме больного.
При обезвоживании больным противопоказаны коллоидные инфузионные растворы
(полиглюкин, реополиглюкин, гемодез и др.), так как в силу их экспандерного
эффекта усиливается перемещение воды в сосудистое русло из интерстициального
и внутриклеточного пространств с усилением их дегидратации. Противопоказано
использование прессорных аминов с целью повышения артериального давления,
так как они способствуют ухудшению микроциркуляции, особенно в почках,
что ведет к развитию необратимой почечной недостаточности. Необходим осторожный,
более сдержанный темп внутривенного введения регидратационных растворов
больным с риском развития острой сердечной недостаточности
(пожилой возраст, сопутствующие гипертоническая болезнь, хроническая
коронарная недостаточность, пороки сердца и др.). Поэтому очень важны контроль
за ЦВД, данными электрокардиографии и содержанием электролитов в крови.
Острая дыхательная недостаточность (ОДН) представляет собой острое
нарушение газообмена между атмосферным воздухом и кровью больного в результате
поражения аппарата внешнего дыхания. В зависимости от характера и локализации
патологического процесса в органах дыхания нарушается вентиляция легких
(острая вентиляционная дыхательная недостаточность) или альвеолярно-капиллярный
газообмен (острая паренхиматозная дыхательная недостаточность).
Причиной острой вентиляционной дыхательной недостаточности у инфекционных
больных могут быть нейропаралитические расстройства дыхания или нарушение
трахеобронхиальной проходимости. Нейропаралитические расстройства дыхания
являются следствием нарушения центральной нервной регуляции дыхания (вирусные
и бактериальные энцефалиты, инфекционно-токсическая энцефалопатия II—III
степени) или иннервации дыхательных мышц (ботулизм, дифтерия, полиомиелит,
полирадикулоэнцефаломиелиты различной этиологии, восходящий паралич и др.).
Нарушения нервной регуляции дыхания могут быть обусловлены ятрогенными
факторами — передозировкой седативных средств (нарушение центральной регуляции
дыхания), результатом побочного неблагоприятного эффекта стрептомицина
(курареподобное действие), натрия оксибутирата у больных с гипокалиемией
(нарушение синаптической передачи возбуждения дыхательным мышцам).
У больных столбняком важная роль в развитии острой вентиляционной дыхательной
недостаточности принадлежит ларингоспазму. Последний может наблюдаться
(правда, очень редко) у больных корью, ветряной оспой (изъязвление голосовых
связок).
При ботулизме, бульбарной форме полиомиелита, стволовых энцефалитах,
кроме изменений нервной регуляции дыхания, ухудшается проходимость на уровне
верхних дыхательных путей в результате параличей мышц глотки и гортани,
скопления в под- и надгортанных пространствах густой вязкой слизи, регургитации
содержимого желудка. Однако частичная или полная обтурация дыхательных
путей в инфекционной патологии чаще обусловлена воспалительным процессом.
Так, при дифтерии гортани возникает истинный круп с нарушением воздухопроходимости
гортани из-за образования фибринных пленок, отека слизистой оболочки. У
больных корью в результате отека слизистой оболочки подсвязочного пространства
может развиться ложный круп.
Нарушение проходимости нижних дыхательных путей на уровне трахеи, бронхов,
бронхиол чаще отмечается при острых респираторных инфекциях. Под воздействием
вирусов или вирусно-бактериальных ассоциаций острый воспалительный процесс
ведет к обтурации дыхательных путей патологическим содержимым (гнойно-некротические
массы) и/или к бронхоспазму. Особенно опасен бронхиолит у больных респираторно-синцитиальной
инфекцией. Фактором риска развития обтурационного трахеобронхита являются
сопутствующие бронхиальная астма, хронический бронхит. При инфекциях, осложненных
плевритом или плевропневмонией (корь, грипп и др.), снижение вентиляции
легких может быть следствием болевого тормоза дыханию.
Острая паренхиматозная дыхательная недостаточность (нарушение альвеолярно-капиллярного
газообмена) наблюдается при инфекциях с поражением легких (пневмонии),
при ИТШ и дегидратационном шоке в результате уменьшения перфузии легких
(«шоковое легкое»). В случаях крайне тяжелого течения гриппа ОДН иногда
является следствием геморрагического отека легких. Отек легких может быть
обусловлен гипергидратацией при избыточной инфузионной терапии больных
с олигоанурией или острой сердечной недостаточностью.
По клиническим проявлениям и степени тяжести ОДН подразделяется на
4 стадии. I стадия протекает скрыто, о ней можно судить лишь по учащенному
дыханию и появлению одышки, по чувству нехватки воздуха при легкой физической
нагрузке. II (субкомпенсированная) стадия ОДН характеризуется одышкой,
ощущением удушья даже в покое, появлением цианоза губ и ногтей, тахикардией,
участием в дыхании вспомогательных мышц. При III (декомпенсированной) стадии
дыхательной недостаточности резко усиливаются цианоз и ощущение удушья,
появляется психомоторное возбуждение, нарастает тахикардия, падает артериальное
давление. В дыхании участвуют вспомогательные мышцы. Больные часто принимают
вынужденное положение. С переходом в IV (терминальную) стадию резко нарушается
глубина и ритм дыхания. Разлитой цианоз, пульс нитевидный. Артериальная
гипотензия, резкое угнетение сознания, вплоть до комы.
При дифтерийном крупе различают 3 стадии:
» крупозного кашля (охриплость голоса, грубый «лающий» кашель);
» стеноза (одышка, шумное «пилящее» дыхание, участие в нем вспомогательных
мышц, цианоз, беспокойство, чувство страха, вынужденное положение);
» асфиксии (распространенный цианоз, частый нитевидный пульс, артериальная
гипотензия, расширенные зрачки, потеря сознания). Отек легких протекает
в 2 стадиях: интерстициального отека (отсутствие хрипов над легкими при
прогрессирующих одышке, тахикардии, цианозе) и альвеолярного отека, при
котором появляется кашель с пенистой мокротой и кровью, а над легкими прослушиваются
обильные влажные разнокалиберные хрипы.
Для объективной оценки типа и степени тяжести ОДН используют результаты
определения газов крови (Расо и Ра0 ), оксигемоглобина и кислотно-основного
состояния. Ключевое значение имеет исследование в динамике насыщения крови
кислородом.
Программа интенсивной терапии. Лечение больных с ОДН проводят
дифференцированно, с учетом этиологии и особенностей патогенеза инфекционного
заболевания, а также типа дыхательной недостаточности.
Общими мероприятиями интенсивной терапии больных с синдромом острой
дыхательной недостаточности являются обеспечение проходимости дыхательных
путей, обогащение кислородом вдыхаемого воздуха, применение противовоспалительных
средств, улучшение кровообращения в легких, а при необходимости — искусственная
вентиляция (ИВЛ). Поддержание проходимости дыхательных путей при нейропаралитических
расстройствах дыхания и коматозных состояниях достигается освобождением
надгортанного пространства от скоплений слизи, остатков пищи, предупреждение
регургитации содержимого желудка. В случаях параличей мышц глотки, гортани,
западения языка при коме могут быть использованы специальные воздуховоды,
проводят интубацию или трахеостомию. У больных с параличами основных дыхательных
мышц методом выбора является ИВЛ. При крупе (дифтерия, корь) назначают
глюкокортикостероиды (внутривенно по 90—120 мг преднизолона или других
ГКС в эквивалентных дозах), антигистаминные препараты (димедрол, супрастин),
седативные средства. При появлении психомоторного возбуждения показаны
натрия оксибутират, литическая смесь, диазепам и др. Больным дифтерийным
(истинным) крупом может потребоваться трахеостомия. В случаях коревого
(ложного) крупа эффективным может оказаться дополнительное применение противоотечных
(преднизолон, лазикс парентерально) и отвлекающих мер (горчичные ножные
ванны).
При ларингоспазме у больных столбняком, бешенством решающее значение
имеет противосудорожная терапия (20% раствор натрия оксибутирата по 10
мл внутривенно, литические смеси, 5% раствор диазепама 2—4 мл внутримышечно,
хлоралгидрат — до 2,0 г в клизме) в сочетании с барбитуратами и миорелаксантами.
Использование миорелаксантов предполагает перевод больных на ИВЛ.
Важное значение имеет постоянная санация трахеобронхиального дерева
с целью обеспечения его воздухе проходимости. Необходимость ее диктуется,
кроме удаления продуктов воспалительного процесса, избыточным образованием
в условиях гипоксии бронхиального секрета, повышенной его вязкостью (особенно
у высоко лихорадящих больных с гипертонической дегидратацией), нарушением
функции мерцательного эпителия. При тяжело протекающих инфекциях в силу
разных причин нередко угнетается кашлевой рефлекс, а сам кашель становится
неэффективным. Самым доступным методом разжижения мокроты является .достаточное
увлажнение вдыхаемого воздуха с помощью ингаляторов, а также аэрозольная
терапия муколитическими средствами. Обычно применяют теплую стерильную
воду, 2~4% раствор натрия гидрокабоната, а также такие муколитические средства,
как трипсин или химотрипсин (по 10 мг), ацетилцистеин (0,6-0,8 г), рибонуклеаза
(25 мг) или дезоксирибо-нуклеаза (10 мг), бромгексин (4 мг) и др. Муколитики
применяют в комплексных аэрозолях в сочетании с бронходилятаторами (2,5%
раствор эуфиллина 5 мл), антигистаминными средствами (1% раствор димедрола
1 мл), глюкокортикостероидами (преднизолон 30 мг и др.). Необходимо учитывать,
что непременным условием для разжижения мокроты является устранение гипертонической
дегидратации, а наиболее эффективное средство — вода, входящая в состав
различных муколитических смесей. В качестве эффективных бронхорасширяющих
препаратов целесообразно использовать стимулятор бета-адренорецепторов
— беротек (фенотерола гидробромид) или алупент (орципреналина сульфат)
в виде аэрозолей.
Стимуляцию кашля достигают механическим раздражением слизистой глотки,
надавливанием на перстневидный хрящ, под яремную вырезку, а также путем
глубокого вдоха с последующим максимальным выдохом и одновременным сжатием
нижней части грудной клетки. Удалению мокроты из глубоких отделов трахеобронхиального
дерева способствуют также постуральный дренаж, лечебная перкуссия легких,
вибрационный массаж грудной клетки. Если скопившаяся в трахее и бронхах
мокрота не отходит, то прибегают к отсасыванию секрета катетером, введенным
через носовой ход после обезболивания слизистой оболочки носоглотки или
посредством лечебной бронхоскопии.
Улучшение состава вдыхаемой газовой смеси путем обогащения ее кислородом
имеет важное значение в лечении дыхательной недостаточности и является
одним из первостепенных мероприятий интенсивной терапии. Самым доступным
способом при спонтанном дыхании является подача хорошо увлажненного кислорода
со скоростью 5 л/мин через носоглоточные катетеры. При этом содержание
его во вдыхаемой смеси не превышает 40%, что позволяет использовать эту
процедуру в постоянном режиме.
При недостаточной эффективности вышеуказанных мероприятий и резко выраженном
нарушении газообменной функции легких прибегают к ИВЛ, Показаниями для
искусственной вентиляции легких являются прекращение спонтанного дыхания,
резкое нарушение его ритма (учащение более 40 раз/мин), избыточная работа
дыхательных мышц (участие в дыхании вспомогательной мускулатуры), прогрессирующие
симптомы гиповентиляции и гипоксии. К ним относятся цианоз, серовато-землистый
цвет кожи, потливость, тахипноэ или значительное затруднение дыхания, беспокойство
и/или возбуждение, чувство удушья, нарушение сердечной деятельности. Кроме
того, учитывают функционально-лабораторные показания к ИВЛ: снижение жизненной
емкости легких менее 15 мл/кг, а также Ра0 менее 9,3 кПа (70 мм рт.ст.)
при дыхании чистым кислородом и повышении Расо более 7,3 кПа (55 мм рт.ст.).
Интенсивная терапия в случаях вентиляционно-перфузионного дисбаланса
состоит в проведении мероприятий, направленных на купирование легочных
и внелегочных патологических процессов, способствующих паренхиматозной
дыхательной недостаточности. К ним относятся противошоковые мероприятия,
лечение острой сердечной недостаточности, оптимизация кровообращения. В
случаях пневмоний, включая геморрагические, на фоне активной противомикробной
терапии используют глкжокортикостероиды, гепарин. Проводят активный лаваж
трахеобронхиального дерева. Существенное значение имеет оксигенотерапия,
при необходимости — ГБО. При отеке легких рекомендуют ингаляцию кислорода
с парами 70% этилового спирта или вдыхания 10% раствора анти-фомсилана
или других пеногасителей. Показаны салуретики с целью противоотечной (дегидратационной)
терапии. В случаях острой сердечной недостаточности, особенно при артериальной
гипертензии, положительный эффект оказывает уменьшение венозного возврата
крови. Этому способствуют полусидячее или сидячее положение больного, горячие
ножные ванны, накладывание (временно!) жгутов на нижние конечности. Более
эффективно внутривенное капельное введение ганглиоблокатора арфонада (50
мг в 250 мл 5% раствора глюкозы) со скоростью 15-20 капель/мин под контролем
артериального давления. Обязательно применение сердечных гликозидов, по
показаниям — коронаролитиков, купирование психомоторного возбуждения с
помощью натрия оксибутирата или других средств, не угнетающих дыхательный
центр.
Критериями эффективности лечебных мероприятий являются улучшение самочувствия
больных, устранение проявлений энцефалопатии, одышки, чувства удушья, цианоза.
К объективным показателям успешной интенсивной терапии относятся нормализация
газового состава крови и ее кислотно-основного состояния.
Острая печеночная недостаточность — комплексный клинико-патогенетический
синдром, отражающий острое нарушение дезинтоксикационной и синтетической
функций печени, характеризующийся энцефалопатией в сочетании с геморрагическим
синдромом. Она наблюдается при инфекциях с поражением печени (вирусные
гепатиты, лептоспироз и др.), чаще у больных вирусным гепатитом В.
В патогенезе острой печеночной недостаточности существенное значение
имеют массивность агрессии возбудителя болезни и/или сильный тип реагирования
на инфекцию. Поэтому патогенетически она в большей мере связана с цитолитическим
синдромом. Развивается, как правило, острый массивный некроз паренхимы
печени или реже острый функциональный паралич гепатоцитов на фоне их диффузной
дистрофии. В результате массивного цитолиза с повышением проницаемости
мембран наступают гипокалиемия и метаболический алкалоз. Нарушаются детокси-цирующая,
синтетическая и другие функции печени. В крови накапливаются ароматические
(тирозин, триптофан) и серосодержащие (метионин, цистеин и др.) аминокислоты,
низкомолекулярные жирные кислоты (масляная, валериановая, капроновая),
некоторые производные пировиноградной кислоты (ацетоны и 2,3-бутиленгликоль)
и другие церебротоксические вещества. Хотя концентрация в крови каждого
из них небольшая, порою ничтожная, все вместе они оказывают выраженный
церебротоксический эффект, клинически проявляющийся энцефалопатией.
Вторым по значимости патогенетическим звеном острой печеночной недостаточности
является нарушение синтетической функции печени, в частности, альбумина
и в особенности факторов свертывания крови (I, II, V, VII, IX, X, XII).
В результате наступает своеобразная коагулопатия дефицита, характеризующаяся
исходной гипокоагуляцией с кровоточивостью, крупными внутренними кровоизлияниями,
а в терминальной стадии — массивными кровотечениями в желудочно-кишечном
тракте. При этом всасывающиеся из кишечника продукты гнилостного распада
крови являются дополнительным, достаточно существенным, фактором интоксикации.
Тяжесть состояния больных усугубляется геморрагической анемией.
Под влиянием церебротоксических веществ, нарастающей гипоксии происходит
отек-набухание головного мозга, а в результате массивных кровотечений может
развиться геморрагический шок с острой почечной недостаточностью. Все вышеизложенное
характеризует печеночную недостаточность при остро протекающих инфекциях
— так называемую печеночно-клеточную, «распадную», неазотогенную печеночную
кому.
У больных с хроническим гепатитом — циррозом печени развивается азотогенная,
шунтовая, обходная печеночная кома, вызванная в основном аммиачной интоксикацией.
Ее ведущим механизмом является портосистемное коллатеральное шунтирование.
Коагулопатия дефицита обусловлена отсутствием массы печеночных клеток,
способных синтезировать факторы свертывания крови. В связи с этим наблюдаются
массивные, практически не поддающиеся остановке желудочно-кишечные или
из расширенных вен пищевода кровотечения.
В литературе понятие острой печеночной недостаточности часто заменяется
термином «печеночная кома», что не совсем правильно. Во-первых, кома представляет
собою терминальное проявление инфекционно-токсической (печеночной) энцефалопатии.
Во-вторых, патогенетический каскад острой печеночной недостаточности не
исчерпывается лишь одной церебральной недостаточностью. Немаловажную роль
играют геморрагический синдром, нарушение выделительной и других функций
печени, имеющие другие, чем ИТЭ, проявления, которые требуют соответствующего
терапевтического воздействия. И наконец понятие комы ориентирует практического
врача на преимущественно неврологические симптомы острой печеночной недостаточности,
в то время как другие ее признаки могут появляться намного раньше, что
позволяет своевременно диагностировать это критическое состояние, и следовательно,
повышает эффективность терапевтических мероприятий.
Клиническая картина острой печеночной недостаточности у больных вирусными
гепатитами вначале характеризуется нарастающей желтухой, усилением общей
слабости, головокружениями. Характерны ощущения «провала», нередки раздражительность
больных, сонливость днем, бессонница ночью. Ухудшение аппетита переходит
в анорексию, появляются и нарастают отвращение к пище, извращение обоняния.
Нормальная при обычном течении гепатита температура тела переходит в субфебрильную,
лейкопения с лимфомоноцитозом сменяется нейтрофильным лейкоцитозом, а брадикардия
— тахикардией. Уже в ее начальном периоде довольно типичны признаки геморрагического
синдрома в виде петехиальной экзантемы, повторных носовых кровотечений,
кровоточивости десен. По мере нарастания печеночной недостаточности появляются
признаки внутреннего кровотечения — резко положительная реакция на скрытую
кровь, а затем дегтеобразный стул, рвота цвета «кофейной гущи». К прогностическим
признакам печеночной недостаточности относятся снижение протромбинового
индекса, уменьшение размеров печени, которая становится мягкой и болезненной.
Ранними же симптомами
энцефалопатии являются изменение почерка, утрата способности правильно
рисовать простые геометрические фигуры, совершать простые арифметические
действия (сложение, вычитание, обратный счет), нарушение альфа-ритма электроэнцефалограммы.
На этом фоне энцефалопатия прогрессирует от неадекватного поведения,
сомноленции, сопора с приступами психомоторного возбуждения до комы с полной
утратой сознания и арефлексией в терминальной стадии. По мере угнетения,
а затем и выключения сознания на ЭЭГ появляются дельта-волны, медленные
альфа- и дельта-волны с постепенным их угасанием.
Программа интенсивной терапии. Интенсивная терапия больных с синдромом
острой печеночной недостаточности всегда должна быть упреждающей, до появления
признаков энцефалопатии. Поэтому ее необходимо начинать при тяжелом течении
болезни, особенно в случаях падения протромбинового индекса ниже 60—55%.
Лечение таких больных включает систему общепринятых во всех случаях мероприятий
— базисную терапию, на фоне которых осуществляется применение специальных
методов лечения.
Базисная терапия предполагает должное энергообеспечение больных, энтеральную
и парентеральную неспецифическую дезинтоксикацию, коррекцию нарушений водно-электролитного
баланса и КОС, белкового и углеводного обменов. Ключевыми факторами являются
стабилизация мембран, блокада энзимов лизосом, предупреждение и лечение
коагулопатии.
Учитывая свойственные печеночной недостаточности анорексию, а нередко
и повторные рвоты, энергообеспечение проводят путем внутривенного введения
энергетических смесей, состоящих из концентрированных растворов глюкозы
с солями калия и магния. При этом одновременно в соответствии с количеством
вводимой глюкозы применяют инсулин. Для введения концентрированных растворов
глюкозы необходима катетеризация крупных вен (подключичной). Кроме парентерального
питания (энергообеспечения), больным в коматозном состоянии целесообразно
вводить энпиты через назогастральный зонд. Можно использовать для этих
целей детские питательные смеси.
Коррекцию белкового и азотного обмена предпочтительнее проводить с
использованием официнальных растворов аминокислот, предназначенных специально
для лечения больных с поражением печени (гепа-стерил). Из коллоидных инфузионных
средств препаратами выбора должны быть альбумин или протеин. Количество
инфузионных растворов определяется балансом жидкости, потребностями в корригирующей
и заместительной терапии. Больные, находящиеся только на парентеральном
питании, должны в течение суток получить не менее 6,0 калия хлорида или
других препаратов калия примерно в эквивалентных дозах. Коррекцию КОС проводят
только по соответствующим показателям. Учитывая характерные для острой
печеночной недостаточности гипокалиемию и связанный с ней метаболический
алкалоз, введение щелочных растворов (натрия гидрокарбоната) без определения
КОС недопустимо.
С целью неспецифической дезинтоксикации можно использовать гемодез
по 400 мл/сут в течение не более 4 дней подряд. Предупреждение и/или снижение
эндогенной интоксикации, в значительной мере ухудшающей течение острой
печеночной недостаточности, достигается ежедневными промываниями желудка
через назогастральный зонд, высокими или сифонными клизмами, назначением
энтеросорбентов (угольные сорбенты, энтеродез, полифепан, микрокристаллическая
целлюлоза). Энтеральный метод детоксикации имеет существенное значение
в случаях желудочно-кишечных кровотечений, так как при гнилостном разложении
крови из кишечника всасываются гепатотоксические и церебротоксические вещества.
Этому препятствует прием внутрь плохо всасывающихся антибиотиков (канамицин
и др.) в среднетерапевтических дозах.
Оптимальное количество инфузионных растворов составляет около 3,5 л/сут.
Введение их целесообразно сочетать со стимуляцией диуреза, для чего предпочтительнее
использование верошпирона (по 0,025 г 3—4 раза в сутки). Использование
салуретиков должно быть осторожным в связи с их способностью к стимуляции
выведения калия. Оно допустимо лишь в случаях необходимости более энергичной
дегидратации. Применение маннитола опасно, так как этот препарат способствует
увеличению О ЦК за счет первоначального экспандерного эффекта и повышения
гидростатического давления крови, что в условиях резко сниженного коагуляционного
потенциала ведет к массивным кровотечениям и внутренним кровоизлияниям.
Мочевина при печеночной недостаточности противопоказана. С известной степенью
осторожности с целью комплексной инфузионно-дезинтоксикационной терапии
может быть использован реоглюман.
Обязательными компонентами интенсивной терапии больных с острой печеночной
недостаточностью являются глюкокортикостероиды (ГКС), а также ингибиторы
протеиназ. Глюкокортикостероиды целесообразно использовать в качестве средства
превентивного лечения. В период же развития печеночной недостаточности
все противопоказания к их применению становятся относительными. Суточная
доза ГКС эквивалентна 180—240 мг преднизолона, введение только парентеральное.
Противовоспалительный и мембраностабилизирующий эффект целесообразно усилить
ингибиторами протеиназ (трасилол, контрикал, эпсилонами-нокапроновая кислота
в максимальных суточных дозах при дробном их введении). Их применение способствует
снижению аутолиза гепатоцитов и уменьшению геморрагического синдрома за
счет угнетения фибринолиза. Для предупреждения кровотечений, коррекции
гемостаза обязательно использование свежезамороженной плазмы. По показаниям
применяют препараты фибриногена, протромбина. Геморрагическая анемия должна
купироваться переливаниями свежезаготовленной одногруппной и резус-совместимой
крови (взятой непосредственно перед трансфузией).
Синдром энцефалопатии (комы), характерный для острой печеночной
недостаточности, предполагает использование комплекса мероприятий, применяемых
при интенсивной терапии больных с ИТЭ (см. выше).
Для купирования психомоторного возбуждения целесообразнее применение
натрия оксибутирата, который, кроме противосудорожного эффекта, обладает
антигипоксическими свойствами, но он противопоказан при выраженной гипокалиемии.
Как и во всех случаях ИТЭ необходима постоянная ингаляция хорошо увлажненного
кислорода через носоглоточные катетеры. Важным элементом ухода должна быть
профилактика осложнений, обусловленных коматозным состоянием больных.
Специальные методы интенсивной терапии больных с синдромом ИТЭ осуществляются
на фоне основных мероприятий. Наибольшим терапевтическим эффектом обладает
гипербарическая оксигенация.
С целью неспецифической дезинтоксикации возможно проведение плазмо-
или лимфосорбции в специальных режимах, препятствующих усилению геморрагического
синдрома (коагулопатических кровотечений). Эффективной может быть операция
обменного переливания крови. Используют фракционный метод с однократным
извлечением не более 300 мл крови больного и ее замещением свежезаготовленной
(еще теплой) донорской одногруппной и резус-совместимой кровью. Общее оптимальное
количество замещенной крови составляет 2—2,5 л/сут. В настоящее время опробованы
методы перфузии крови больного через ксенопечень (свиную), пласты ксенопечени,
через специально обработанные гепатоциты и, наконец, орто- или гетеротопическая
трансплантация печени. Однако они малодоступны для широкого практического
применения, а эффективность пока что не превышает таковую при ГБО и экстракорпоральной
детоксикации, осуществляемых на фоне непрерывно проводимой базисной терапии.
Результативность лечебных мероприятий оценивают по нарастанию в крови
уровня протромбина и по обратному развитию энцефалопатии.
Острая почечная недостаточность (ОПН) — острое нарушение
выделительной функции почек с задержкой воды, азотистых продуктов метаболизма,
калия, магния в сочетании с метаболическим ацидозом. В зависимости от патогенетических
механизмов различают преренальную, ре-нальную и субренальную формы ОПН.
В инфекционной патологии встречаются преренальные и ренальные формы.
Пререналъная ОПН первоначально не связана с непосредственным поражением
почек, а обусловлена критическими состояниями с глубокими расстройствами
системного кровообращения (инфекционно-токсический, дегидратационный или
анафилактический шок). В случаях падения систолического артериального давления
ниже 9,3 кПа (70 мм рт.ст.) почечный кровоток нарушается в такой степени,
что клубочки перестают фильтровать первичную мочу. Длительное, более 8
ч, нарушение микроциркуляции в почках ведет к гипоксии, ацидозу и необратимым
структурным изменениям.
Реналъная ОПН — следствие непосредственного первичного поражения нефронов,
эндотелия почечных канальцев (лептоспироз, геморрагическая лихорадка с
почечным синдромом). При этом немаловажную роль играет синдром ДВС. Недостаточность
функции почек может быть обусловлена обтурацией почечных канальцев дериватами
гемоглобина при массивном гемолизе после приема различных химиопрепаратов
больными с дефицитом глюкозо-фосфатдегидрогеназы (гемоглобинурийная лихорадка).
Независимо от точки приложения агрессивного фактора, в результате гипоксии
наступает нефронекроз. Ухудшается или прекращается выделительная функция
почек, в крови повышается количество мочевины, креатинина. Накопление азотистых
шлаков ведет к нарушению функции ЦНС, проявляющейся энцефалопатией различной
степени. Метаболический ацидоз, гиперкалиемия, повышение осмолярности плазмы
со снижением объема выделяемой почками воды способствуют гипергидратации
с угрозой отека легких, головного мозга, острой сердечной недостаточности.
Клиническая картина ОПН во многом зависит от характера инфекции и от
стадии ОПН. Начальная стадия последней не имеет специфических проявлений.
Для ее диагностики важны учет патогенеза инфекционного заболевания, результаты
лабораторных анализов, позволяющих выявить еще клинически не манифестированные
повышения в крови мочевины и креатинина. Существенное значение имеют систематический
(почасовой) учет количества мочи, определение ее относительной плотности
и наличия патологических элементов.
II (олигоанурическая) стадия ОПН характеризуется олигурией (менее 500
мл/сут) или анурией (менее 50 мл/сут). Одновременно с критическим уменьшением
диуреза снижается относительная плотность мочи (до 1005-1008). Она мутная,
с повышенным количеством белка, эритроцитов, лейкоцитов, цилиндров и особенно
клеток почечного эпителия. В крови резко возрастает концентрация креатинина,
мочевины, аммиака, закономерно выявляются гиперкалиемия и метаболический
ацидоз. Накопление азотистых шлаков, ацидоз проявляются уремическим синдромом
с преобладанием признаков поражения ЦНС. Появляются или усиливаются головная
боль, иногда беспокойство, раздражительность. Кожа сухая, гиперемирована.
Наблюдается мучительная жажда. Возможны рвота, метеоризм, иногда диарея.
Выделяющиеся через слизистую оболочку желудочно-кишечного тракта азотистые
шлаки способствуют ее изъязвлению и возникновению желудочно-кишечных кровотечений.
Характерны одышка и тахикардия. По мере усиления анурии появляются и усиливаются
расстройства сознания (энцефалопатия). Возбуждение сменяется сомноленцией,
сопором, комой, для которой характерно частое шумное дыхание (респираторная
компенсация метаболического ацидоза). В терминальной стадии нарушается
ритм дыхания (дыхания Чейна—Стокса, Куссмауля). Смерть наступает при явлениях
отека легких, отека-набухания головного мозга, которые могут быть спровоцированы
избыточной инфузионной терапией. Возможна остановка сердца вследствие гиперкалиемии.
При благополучном разрешении олигоанурии наступает III — стадия — полиурия.
Постепенно в течение 4—5 дней суточное количество мочи увеличивается до
4—6 л и более. Однако при этом экскреторная функция почек остается нарушенной,
что проявляется предельно низкой относительной плотностью мочи, небольшим
нарастанием еще в течение 2—3 сут гиперазотемии. В этот период при отсутствии
надлежащей коррекции водно-электролитного баланса определенную опасность
представляют угроза дегидратации и гипокалиемии. Тем не менее, примерно
в течение 2 нед постепенно начинает снижаться содержание в крови мочевины,
креатинина, остаточного азота с нормализацией диуреза и выделительной функции
почек.
Прекращение полиурии и нормализация содержания в крови азотистых шлаков
соответствует фазе реконвалесценции. Она может затягиваться до одного года
и не требует специальной, тем более интенсивной терапии. Но больных следует
отнести к группе повышенного риска развития почечной недостаточности при
повторных инфекциях, возбудители которых обладают вазопатическим эффектом
(грипп, геморрагические лихорадки, стрептококковая инфекция и т.п.).
Программа интенсивной терапии. Средства и методы лечения инфекционных
больных в начальной фазе ОПН должны быть направлены в первую очередь на
нейтрализацию агрессивного фактора, способного вызвать нарушение функции
почек.
Предупреждение и лечение преренальной почечной недостаточности заключается
в восстановлении системной гемодинамики и микроциркуляции в почках. Комплекс
мероприятий при остром обезвоживании включает противошоковую и энергичную
регидратационную терапию. Устранение гиповолемии, артериальной гипотензии,
оптимизация реологических свойств крови достигают соответствующей состоянию
больного инфузионной терапией. Устранение дегидратации и восстановление
ОЦК проводят одновременно с коррекцией КОС (метаболического ацидоза) путем
внутривенного введения 4% раствора натрия гидрокарбоната (200—400 мл),
предупреждением ДВС синдрома, особенно в случаях инфекционно-токсического
шока или заболеваний с повышенной свертываемостью крови (геморрагические
лихорадки, менингококцемия и др.). На фоне стабилизации гемодинамических
показателей (АД, ЦВД) целесообразно введение маннитола (20% 400 мл) или
реоглюмана (400 мл) с целью предупреждения ишемии почек, стимуляции их
функциональной способности. Маннитол нельзя вводить в случаях отрицательной
маннито-ловой пробы (отсутствие увеличения мочевыделения на 30—40 мл/ч
после введения 100 мл 20% раствора маннитола в течение 5—15 мин), а также
при уже наступивших нефронекрозе и стойкой анурии. Стимулировать почечную
фильтрацию можно путем применения фуросемида (60—80 мг). Для предупреждения
острой почечной недостаточности у шоковых больных на фоне энергичной инфузионной
терапии показаны препараты, улучшающие почечный кровоток (допамин, эуфиллин).
Необходимо иметь в виду, что допамин вызывает вазодилятацию почечных сосудов
в малых дозах (50 мг препарата в 250 мл 5% раствора глюкозы со скоростью
15-18 кап/мин), при более быстрой инфузии — эффект противоположный.
Превентивная интенсивная терапия в случаях угрозы (I стадии) ренального
типа ОПН состоит в применении этиотропных и патогенетических средств в
соответствии с нозологической формой заболевания, вызывающего поражение
почек. При ГЛПС показано раннее введение гепарина (по 5000 ЕД 3—4 раза
в сутки). Больным лептоспирозом необходимо применение (еще до подтверждения
диагноза) антибиотиков и специфического иммуноглобулина, но обязательно
в сочетании с глюкокортикостероидами для предупреждения ИТШ. При лечении
больных малярией в случаях появления признаков гемолитической лихорадки
отменяют препарат, вызвавший гемолиз, проводят интенсивную инфузионно-дезинтоксикационную
терапию со стимуляцией диуреза. Оптимальным вариантом в таких случаях является
управляемая гемодилюция.
В олигоанурической фазе ОПН требуется комплексная интенсивная терапия
и применение при необходимости специальных методов лечения. С целью борьбы
с азотемией назначают соответствующую диету, подавляют белковый катаболизм
(введение анаболических гормонов — ретаболила, неробола и др. в среднетерапевтических
дозах в сочетании с концентрированными растворами глюкозы), удаляют азотистые
шлаки путем повторных промываний желудка и толстой кишки 2% раствором натрия
гидрокарбоната и использования энтеросорбентов (энтеродез, полифе-пан,
микрокристаллическая целлюлоза и др.). Важно полное извлечение из желудка
и кишечника воды для предупреждения гипергидратации.
Борьба с гипергидратацией является основой консервативной интенсивной
терапии олигоанурии. Для этого жизненно необходимо строгое соблюдение водного
баланса. Общее количество воды, которое можно ввести больному, должно суммарно
соответствовать объему выделенной мочи, перспирации воды через легкие и
кожу (при нормальной температуре тела — 800 мл и дополнительно по 500 мл
на каждый градус повышения температуры тела сверх 37°С), а также потерям
жидкости с испражнениями или рвотой. При этом необходимо учитывать, что
в организме в ходе метаболизма в течение суток вырабатывается около 250
мл эндогенной воды. При наличии гипергидратации возможна стимуляция выделения
жидкости внепочечными путями, в частности, с помощью диареи, вызываемой
слабительными. Такая процедура способствует одновременному удалению избытка
калия и азотистых шлаков. Стимуляцию потоотделения достигают с помощью
настоя малины (за сутки можно получить до 2 л пота), но не за счет повышения
температуры тела. Учет водного баланса лучше всего контролировать с помощью
кровати-весов.
Парентеральное введение жидкости ограничивают внутривенными вливаниями
концентрированных (20-30%) растворов глюкозы (500 мл) с инсулином, 4-5%
раствора натрия гидрокарбоната (100-200 мл). 10% раствора кальция глюконата
(40 мл).
При отсутствии артериальной гипотензии следует провести одномоментную
стимуляцию диуреза. Ее проводят в следующей обязательной последовательности
внутривенного введения лечебных препаратов: 5% раствор натрия гидрокарбоната
— 200 мл, 2,4% раствор эуфиллина — 10 мл, 1% раствор фуросемида — 10 мл.
Повторно проводить такую процедуру при отсутствии эффекта не следует. Нельзя
в таких случаях применять в качестве стимулятора диуреза маннитол, так
как при наступившем нефронекрозе (полная анурия!) он не будет удален из
организма, а распределится в тканях, удерживая в них воду в силу своего
осмотического эффекта. Противопоказаны мочевина и ртутные диуретики, антибиотики
с побочным нефротоксическим эффектом (аминогликозиды, цефалоспорины и др.),
калий и калийсодержащие препараты. Следует избегать введения глюкокортикостероидов,
способствующих усилению азотемии и гиперкалиемии в связи с их катаболическим
воздействием.
При отсутствии эффекта от проводимой терапии, продолжении анурии проводят
экстракорпоральный гемодиализ. Показаниями для него являются: прогрессирующее
ухудшение состояния, повышение в крови мочевины свыше 33,3 ммоль/л и креатинина
более 884 мколь/л, калия — более 7 ммоль/л. Срочный экстракорпоральный
гемодиализ нужен в случаях опасной для жизни гипергидратации, особенно
при угрозе отека легких, мозга или острой сердечной недостаточности.
В стадии полиурии терапию вначале проводят в таком же строгом режиме,
как при олигоанурической фазе ОПН. В последующем с началом снижения в крови
азотистых шлаков осуществляют коррекцию водно-электролитного баланса. Показано
преимущественное возмещение жидкости естественным путем в соответствии
с жаждой. При массивном внутривенном введении водно-электролитных растворов
возможно ятро-генное удлинение полиурической стадии. Реконвалесценты подлежат
длительному наблюдению в связи с медленным восстановлением функции почек.
Синдром диссеминированпого внутрисосудистого свертывания крови
(ДВС синдром) — одно из наиболее распространенных вторичных расстройств
гемостаза. Он наблюдается при тяжелых формах менингококковой инфекции,
лептоспироза, геморрагических лихорадок, брюшного тифа, риккетсиоза, шигеллеза,
вирусных гепатитов, гриппа и др. Причиной его развития могут быть инфекционно-токсический
шок, сепсис, обширные диструктивные и воспалительно-некротические процессы
во внутренних органах.
Как известно, свертывание крови состоит из двух одновременно протекающих
процессов: постоянного образования сгустков внутри сосудов и их растворения
— фибринолиза. При преобладании диссеминированного внутрисосудистого свертывания
происходит блокада микроциркуляторного русла рыхлыми массами фибрина и
агрегатами клеток, что ведет к нарушению кровоснабжения жизненно важных
органов и их дисфункции. Нарастающая мобилизация плазменных факторов коагуляции
(протромбина — тромбина — фибриногена и др.), а также тромбоцитов и других
клеток крови в множественные свертки и микротромбы сопровождается активацией
фибринолиза. Прогрессирующее потребление факторов коагуляции может быть
настолько быстрым и значительным, что они не успевают восполняться за счет
естественного поступления из мест продукции. В результате преобладает фибринолиз
и кровь теряет способность к свертыванию. Наступает так называемая коагулопатия
потребления с множественной массивной кровоточивостью. Следует учитывать,
что при этом могут одновременно сосуществовать множественный микротромбоз
(диссеминированное внутрисосудистое свертывание) и усиленный фибринолиз.
В сочетании с повышенной ломкостью сосудов развивается массивная кровоточивость.
При остром синдроме ДВС возможны переходы от одного состояния (гиперкоагуляции)
к другому (коагулопатии потребления), однако общая направленность этого
процесса сохраняется от диссеминированного внутрисосудистого свертывания
к коагулопатии потребления.
В связи с этим условно принято разграничение ДВС синдрома на отдельные
клинике-коагулопатические стадии.
I стадия ДВС — гиперкоагуляция. Нет кровотечения или кровотечение лишь
на месте механической травмы и с выраженными сгустками. Они плотные, хорошо
ретрагируют, осадок эритроцитов скудный. Время свертывания крови по Ли-Уайту
в пределах нормы (5-11 мин) или укорочено. Количество тромбоцитов в норме
(175-300 • 109/л) или увеличено. Тест-тромбин 5-11 с. Продукты деградации
фибриногена (ПДФ) не определяются.
II стадия ДВС — коагулопатия потребления без активации фибринолиза.
Кровотечение с образованием рыхлых, но не лизирующихся сгустков. Время
свертывания крови на нижней границе нормы или удлинено до 13-15 мин. Количество
тромбоцитов снижено (до 100-150- 109/л). Сгусток крови рыхлый, выполняет
весь объем пробирки, лизируется более 1 часа. Тест-тромбин увеличен до
60 с. Проба на продукты деградации фибринолиза слабо положительная (+).
III стадия ДВС - коагулопатия потребления с начинающейся генерализацией
фибринолиза. Повышенная кровоточивость мест инъекций, петехии на коже,
ее мраморность. Время свертывания крови — более 15 мин. Количество тромбоцитов
снижено до 100 • 109/л и менее. Сгустки небольшие, лизируются наполовину
или полностью в течение 15-20 мин. Тест-тромбин 1-3 мин. Проба на продукты
деградации фибриногена положительная (++).
IV стадия ДВС— генерализованный фибринолиз или полное несвертывание
крови. Распространенная кровоточивость слизистых оболочек, мест инъекций,
желудочно-кишечное, легочное кровотечение, гематурия. Петехии и экхимозы,
возможны массивные кровоизлияния под кожу в местах сдавливания. Геморрагическая
энантема. Время свертывания крови удлинено до 30 мин и более. Сгустки либо
не образуются или они небольшие, быстро лизирующиеся. Количество тромбоцитов
менее 100-109/л. Тест-тромбин — более 3 мин. Резко положительная (+++)
проба на продукты деградации фибриногена.
При благоприятном течении, своевременно проводимых терапевтических
мероприятиях развитие синдрома ДВС можно остановить на любой стадии, чаще
— II-III. Вышеуказанными признаками далеко не исчерпываются изменяющиеся
при ДВС показатели гемостаза. Более расширенный их перечень представлен
в табл 20. В то же время оценивая многочисленные, порою очень сложные тесты
можно утверждать, что достаточно высокую информативность, при сравнительной
простоте и оперативности выполнения, имеют признаки:
» время свертывания нестабилизированной крови по Ли—Уайту; » уровень
протромбина по Квику;
» концентрация фибриногена по Р. А. Рутенбергу;
» количество тромбоцитов в периферической крови;
» паракоагуляционные тесты;
» спонтанный фибринолиз по М. А. Котовщиковой.
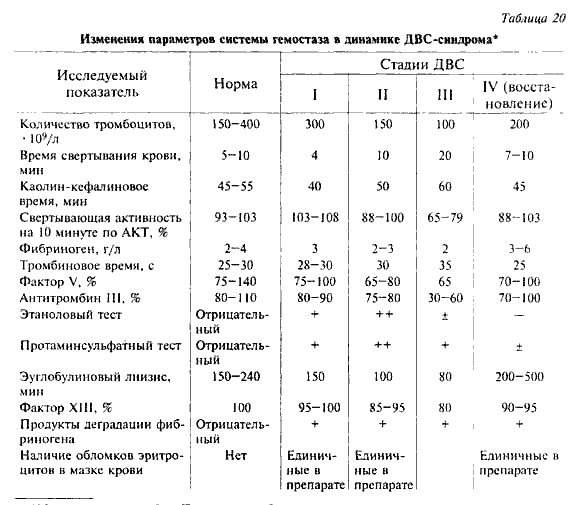
При некоторых инфекциях нарушения системы свертывания крови имеют свои
особенности. В частности, у больных тяжелыми формами вирусных гепатитов
изначально отмечается дефицит факторов свертывания, синтезируемых печенью.
В подобных случаях, по нашему мнению, более оправдан термин «коагулопатия
дефицита», предполагающий соответствующую схему коррекции гемостаза. У
больных гриппом, геморрагическими лихорадками, риккетсиозами (сыпным тифом)
вследствие вазопатического действия возбудителей преобладающим является
нарушение целостности эндотелия сосудов и диссеминированное образование
микротромбов, а коагулопатия развивается не во всех случаях. Возможен не
диссеминированный, а очаговый (местный) ДВС-синдром (гемоколит
при шигеллезах, кишечное кровотечение у больных брюшным тифом, так
называемые ранние гриппозные энцефалиты или первичные гриппозные пневмонии).
Поэтому диагностика и тактика интенсивной терапии больных с ДВС-синдромом
основываются прежде всего на учете особенностей патогенеза той или иной
инфекции.
Интенсивная терапия должна быть направленной в первую очередь на купирование
факторов, инициировавших и поддерживающих синдром ДВС. К этой группе мероприятий
следует отнести рациональную этиотропную и энергичную патогенетическую
терапию инфекций с потенциальной угрозой нарушений системы свертывания
крови. Необходимы своевременные и адекватные меры по профилактике и выведению
больных из таких критических состояний, как инфекционно-токсический шок,
острая печеночная и почечная недостаточности (см. выше). Эти мероприятия
являются фоном, на котором осуществляются меры по восстановлению равновесия
свертывающих, антикоагулянтных и фибринолитических свойств крови.
На ранних стадиях ДВС основными целями интенсивной терапии являются
остановка диссеминированного свертывания крови и восстановление ее реологии.
Для этого вводят гепарин в малых дозах 1000—5000 ЕД через 4—8 ч внутривенно
и подкожно. Повторные введения осуществляются в 0,9% растворе натрия хлорида
или 5% раствора глюкозы (100 мл). Количество и темп введения гепарина определяются
необходимостью поддерживать время свертывания крови на уровне 15—20 мин
по Ли—Уайту. Эффективность терапии гепарином возрастает, если его вводить
со свежезамороженной плазмой, в которой в сбалансированном количестве содержатся
все факторы гемостаза. Целесообразна предварительная гепаринизация свежезамороженной
плазмы, для чего рекомендуется вводить 10—25 ЕД гепарина на 100 мл плазмы.
Образование при этом комплекса антитромбин III-гепарин способствует более
быстрому обрыву диссеминированного свертывания крови.
Для улучшения реологических свойств крови, устранения блокады микроциркуляторного
русла свертками крови показано введение реополиглюкина по 400—800 мл/сут
в сочетании с такими дезагрегантами, как трентал (100 мг в 100 мл 0,9%
раствора натрия хлорида) или дипиридамол по 10 мг, но не более 150—200
мг/сут внутривенно при темпе инфузии до 200 мкг/мин.
В случаях выраженного геморрагического синдрома (ДВС III—IV стадии),
когда фибринолиз преобладает над процессами коагуляции, приоритетными являются
введение ингибиторов протеиназ и фибринолиза. С этой целью показаны введения
апротинина (до 200000 КИЕ каждые 2—3 ч), который оказывает ингибирующее
действие на все ферментные системы крови, снижая ее фибринолитическую активность.
Кроме того, антипротеиазы обладают антиагрегационным и дезагрегационным
эффектами. Однако ингибиторы протеиназ и фибринолиза необходимо обязательно
применять в сочетании с гепарином (2500 ЕД внутривенно, а затем подкожно
— не более 5000-7500 ЕД). При отсутствии эффекта или в случаях профузного
кровотечения показаны дополнительные введения свежезамороженной плазмы
(до 1,5 л в течение короткого промежутка времени).
Больным вирусным гепатитом с геморрагическим синдромом, который является
одним из ранних и объективных показателей острой печеночной недостаточности,
показаны переливания свежезамороженной плазмы (1,5—2 л/сут) в сочетании
с фибриногеном, сухим тромбином и другими факторами свертывания, в зависимости
от показателей коагулограммы. При геморрагической анемии осуществляют заместительную
терапию свежеконсервированной кровью до повышения уровня гемоглобина (100
г/л) и гематокрита (не ниже 0,35 л/л). Противопоказаны осмодиуретики.
При локальных кровотечениях, в частности желудочно-кишечных, у больных
брюшным тифом, наряду с воздействием на системный гемостаз, применяют местные
кровоостанавливающие средства: внутрь эпсилон-аминокапроновую кислоту (5%
раствор — 100 мл), гемостатическую губку, а также охлаждение (пузырь со
льдом, прием охлажденной жидкости). Парентерально — адроксон (0,025% раствор
— 5 мл внутримышечно), этамзилат (12,5% раствор 2 мл внутримышечно). Осуществляют
контроль за гемодинамикой.
При инфекциях с выраженным вазопатическим воздействием возбудителей
(сыпной тиф и другие риккетсиозы, геморрагические лихорадки, грипп и др.)
с целью предупреждения диссеминированного пристеночного тромбообразования,
особенно у лиц пожилого возраста, применяют антикоагулянты, в частности
гепарин в дозах, указанных выше и под контролем времени свертывания крови.
С профилактической целью в случаях легкого и среднетяжелого течения могут
быть использованы малые дозы ацетилсалициловой кислоты (0,1 г/сут внутрь),
угнетающие внутрисосудистую коагуляцию посредством стимуляции простациклина.
В системе мероприятий интенсивной терапии больных с синдромом ДВС,
особенно на фоне предшествовавшей тяжелой инфекционной интоксикации, могут
быть использованы глюкокортикостероиды и лечебный плазмаферез. Терапевтическая
эффективность последнего состоит в деблокировании системы фагоцитируюших
макрофагов продуктами протеолитического взрыва и другими экзогенными (микробные
токсины) и эндогенными (избыток биологически активных веществ, ЦИК) токсическими
субстанциями.
Рациональная терапия в случаях ДВС-синдрома трудно укладывается в определенные
стандартные схемы. Она может и должна меняться в соответствии с особенностями
патогенеза, состояния больного и фазности (стадийности) коагулопатических
процессов. Для лечения больных должны привлекаться специалисты-гемотрансфузиологи,
а по возможности специализированные реанимационно-гематологические бригады. |