|
шок ПАТОФИЗИОЛОГИЯ ТРАНСПОРТ КИСЛОРОДА ТЕРАПИЯ ДРУГИЕ ФОРМЫ ШОКА КАРДИОГЕННЫЙ ШОК СЕПТИЧЕСКИЙ ШОК НЕЙРОГЕННЫЙ (СПИНАЛЬНЫЙ) ШОК . НАПРЯЖЕННЫЙ ПНЕВМОТОРАКС, ТРОМБОЭМБОЛИЯ ЛЕГОЧНЫХ АРТЕРИЙ И ТАМПОНАДА СЕРДЦА РЕЗЮМЕ
Шок подразумевает неадекватную перфузию тканей. Снижение кровотока в тканях в конечном счете является определяющим моментом, хотя существует и множество других причин. Он возникает из-за нарушений четырех отдельных, но взаимозависимых систем: сердца, объема циркулирующей крови, резистентности артериол (постнагрузка) и емкости венозного русла (преднагрузка). Клинические проявления и симптомы шока, которые наблюдаются у большинства хирургических больных, связаны с гиповолемией. У молодых больных без сопутствующих заболеваний первыми признаками бывают беспокойство и возбуждение, обусловленные гиперкатехоламинеми-ей. Классические проявления гиповолемического шока не развиваются до тех пор, пока потеря объема циркулирующей крови не достигнет 30%. После достижения этого порога у больного отмечается падение артериального давления, развиваются тахикардия и профузное потоотделение. При менее выраженных формах шока уровень артериального давления поддерживается за счет возрастания периферического сопротивления и небольшой тахикардии, представляющей попытку увеличения минутного сердечного выброса. Это ведет к уменьшению пульсового давления. Поскольку сердце работает в усиленном режиме, оно нуждаемся в большем количестве кислорода. Чтобы обеспечить адекватную деятельность сердца и головного мозга, в периферических тканях развивается шунтирование крови. Легкие формы гиповолемии хорошо переносятся и компенсируются организмом за счет перемещения крови из внеклеточного пространства в сосуды, что сопровождается аутогемодилюцией. Это чрезвычайно медленный процесс. Во время быстро развивающегося геморрагического шока гематокрит не изменяется, поскольку теряется целевая кровь, а организм еще не успевает переместить ее по осмотическому градиенту, чтобы вызвать аутогемодилюцию. Во время шока отмеча-ются биохимические изменения, связанные с гипофизарно-адреналовым отом на стресс, ответом органов на редукцию в них кровотока, а так обусловленные снижением- специфических функций органов. Немедленный ответ гипофизарно-адреналовой системы заключается в симпатикотонии и повышении тонуса микрососудов за счет выделяющихся из надпочечников катехоламинов и кортизола. Это вызывает известные ответы на стресс в виде отрицательного баланса азота и задержки в организме натрия и воды. По прошествии некоторого времени снижение кровотока в тканях вызывает нарушения их оксигена-ции. В связи с этим включается анаэробный гликолиз с продукцией молочной кислоты, что сопровождается изменением рН внутри клеток. Действительно, рН периферической крови (по крайней мере в начальной стадии экспериментального шока у животных) может не отражать степени нарастания внутриклеточного ацидоза. Выраженность функциональной недостаточности органов зависит от продолжительности и тяжести шока. Эта недостаточность может заключаться в одних случаях лишь в легких проявлениях острой почечной недостаточности, связанной с гиповолемией, а в других — приобретать характер полиорганной недостаточности, нередко со смертельным исходом. Полностью механизмы развития такой недостаточности неясны, однако представляется, что они связаны с перенапряжением и последующим расстройством механизмов, обеспечивающих гомеостаз и направленных на воспалительный ответ при попытке организма компенсировать снижение эффективного циркулирующего объема крови. Исследования состава жидкостей в организме после геморрагического шока показывают, что в дополнение к снижению объема крови наблюдается дефицит внеклеточной жидкости, равноценный дефициту плазмы. Восстановления только лишь объема потерянной крови недостаточно для эффективного лечения больного. Введение соответствующих объемов изотонических растворов вместе с гемотрансфузиями приводит к значительному снижению летальности от шока. Поэтому компейсатор-ная реакция организма в виде перемещения внеклеточной жидкости в сосуды может в более позднем периоде шока оказаться вредной, если не проводится адекватная инфузионная терапия. Набухание клеток при перемещении жидкости ведет к изменению мембранного потенциала, поскольку в клетки с водой поступают натрий и хлориды, а калий при этом теряется. Эти изменения, приводящие при определенных обстоятельствах к снижению мембранного потенциала клетки, сопровождаются нарушением синтеза и утилизации обладающих высокой энергией молекул АТФ. Во время тяжелого шока перфузия почек зачастую прекращается. Почки могут переносить перераспределение крови в пользу таких жизненно важных органов, как сердце и головной мозг, в течение примерно 1,5 ч. После этого в них остро развиваются повреждения в виде некроза канальцевого эпителия, являющегося наиболее частой причиной острой почечной недостаточности, наблюдающейся' у пациентов, выведенных из гиповолемического шока. Острый некроз канальцевого эпителия почек характеризуется азотемией и нарастанием содержания в крови азота мочевины. Это может сочетаться, а может и не сочетаться со снижением диуреза после выведения больного из состояния шока. Скорость клубочковой фильтрации, даже при адекватном диурезе, снижена. Острый некроз, канальцевого эпителия, наблюдаемый после геморрагического шока, сопровождается необычно высокой экскрецией натрия с мочой, при этом его фракционная экскреция I(UNa/PNa) (Pcr/Ucr)'100] бывает больше 1. У больных с олигурией это превосходный способ отличать их от больных с неполноценно леченным шоком или больных с постобструктив-ной азотемией, у которых фракционная экскреция натрия, являющаяся показателем резорбции натрия и воды в почечных канальцах, будет меньше 1. Если больной был более успешно и быстро выведен из гиповолемического шока, на передний план выступает другой вид органной недостаточности. Респираторный дистресс-синдром взрослых (РДСВ) у пострадавших с тяжелой травмой встречается весьма часто. Он также известен как «шоковое легкое», «легкое Дананга» или «травматическое влажное.легкое». Рентгенологическим признаком служит картина отека легких, однако при инвазивном кардиомониторинге было установлено, что давление в левом предсердии не повышается. Возникает патологическая проницаемость капилляров. Гипоксемия у этих пострадавших не купируется даже при повышении концентрации кислорода при искусственной вентиляции легких, указывая на шунтирование кровотока в легких как на причину дальнейшего ухудшения вентиляционно-перфузионного отношения. Из-за переполнения жидкостью экскурсия легких прогрессивно ухудшается. Повышения давления заклинивания в легочных капиллярах и других признаков левожелудочковой сердечной недостаточности нет. У многих таких пострадавших в крови первоначально отмечается снижение РСО2 из-за гипервентиляции, связанной с попыткой улучшить окси-генацию крови. В патофизиологический механизм развития РДСВ оказывается вовлеченным эффективный объем остаточного воздуха: после выдоха в легких остается меньше воздуха, так как остаточное пространство заполнено жидкостью. Отсутствие улучшения оксигенации периферической крови, даже при вентиляции 100% кислородом, указывает не только на нарушение диффузии газов, но служит также подтверждением шунтирования крови в легких. Оно возникает в результате расстройства существующих в норме механизмов ответа. Обычно в легком, когда альвеолы закупорены слизью, снижение напряжения остаточного кислорода вызывает сокращение капилляров, снабжающих кровью эти альвеолы, и выключает, таким образом, пер-фузию невентилируемых альвеол. При РДСВ значительное шунтирование крови развивается за счет того же механизма (рис. 4.1 и 4.2). Вопрос о причине развития РДСВ продолжает интенсивно изучаться. Существует ряд причин (табл. 4.1), однако в конечном счете все сводится к повышению проницаемости капилляров в условиях нормального давления в левом предсердии и нарушению координации вентиляционного и перфузионного механизмов. 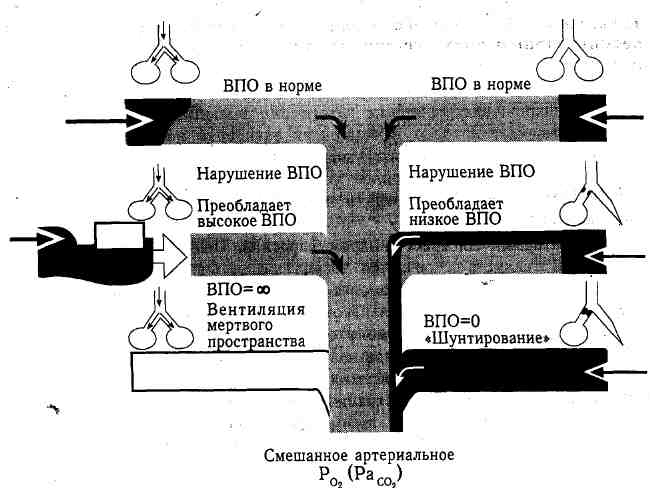
Рис. 4.1. Диаграмма нарушений вентиляционно-перфузионного отношения (ВПО).
Рис.4.2. Диаграмма нарушений координации перфузии (Перф.) и вентиляций (Вент.) в легком. Обозначения: ВПО — вентиляционно-перфузионное отношение, N— норма. Таблица 4.1. Патологические состояния, сопровождающиеся респираторным дистресс-синдромом у взрослых (РДСВ) или вызывающие его
Продолжение табл.^44
* Наиболее частые причины РДСВ. Лечебная тактика при этом синдроме сводится к поддержанию основных систем жизнеобеспечения организма. В раннем периоде должны применяться интубация и искусственная вентиляция легких, особенно если Рао2 становится ниже 65 мм рт. ст. Положительный эффект от искусственной вентиляции достигается за счет использования оставшихся функциональных резервов благодаря увеличению переменного объема и созданию положительного давления на выдохе (ПДВ). Это должно вовлекать в функционирование спавшиеся или частично спавшиеся альвеолы и может улучшить вентиляционно-перфузионное отношение. ПДВ не является панацеей. Создание уровней выше 20 см вод. ст. в ряде случаев сопровождается развитием напряженного пневмоторакса. У пациентов должна быть обеспечена максимальная кислород-транспортирующая способность крови за счет поддержания концентрации гемоглобина на уровне около 10 г%. Установлено, что в случаях, когда имеется перегрузка организма жидкостью, применение диуретиков не улучшает оксигенации крови. Применение антибиотиков не показано до тех пор, пока из мокроты не высеваются микроорганизмы и пока не проявляются признаки воспаления, обусловленные развитием пневмонии. Наконец, лечение РДСВ должно заключаться в лечении вызвавшего его состояния, будь то гиповолемический шок или нелеченный должным образом сепсис. Ни одна дискуссия о шоке обычно не обходится без обсуждения вопроса о транспорте кислорода. Кислород-гемоглобиновая диссоциация графически может быть представлена в виде S-образной кривой. В обычном состоянии насыщение крови кислородом на 50% (Р50) достигается при парциальном давлении кислорода 27 мм рт. ст. После этого насыщение кислородом крови резко возрастает в сторону полного насыщения при парциальном давлении кислорода 70-80 мм рт. ст. При более быстрой кислород-гемоглобиновой диссоциации и выходе кислорода из крови кривая смещается вправо, при более медленной — влево (рис. 4.3). В этом случае кислород быстрее покидает кровь. Смещение влево сопровождается снижением показателя Р^. Повышение показателя Ра или смещение вправо является благоприятным признаком. Сродство гемоглобина к кислороду могут нарушать различные факторы (они указаны в табл. 4.2). Вещество 2,3-ДФГ присутствует в эритроцитах. Долго хранившаяся консервированная кровь при ее переливании содержит очень мало 2,3-ДФГ, что сопровождается снижением показателя Р50. 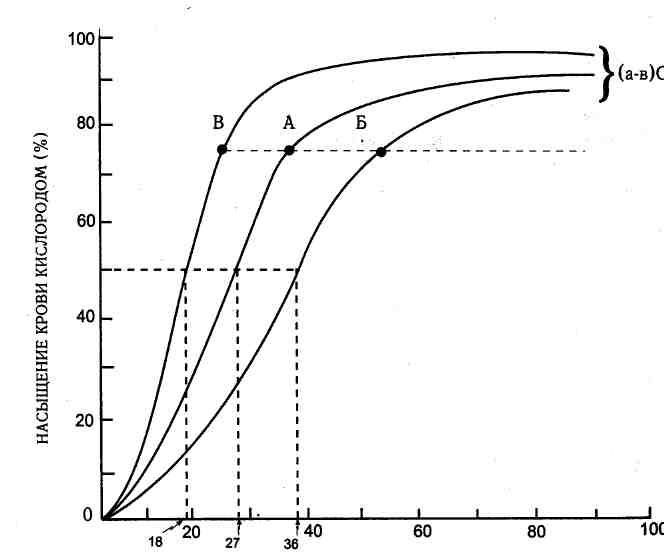
ПАРЦИАЛЬНОЕ ДАВЛЕНИЕ КИСЛОРОДА, ММ рт. СТ. Рис. 4.3. Кривая гемоглобин-кислородной диссоциации в норме (А), при смещении кривой вправо (Б) и влево (В). Отметки соответствующих значений Р50 на горизонтальной оси обозначают парциальное давление кислорода (в мм рт. ст.), необходимое для 50 % насыщения гемоглобина кислородом. Следует обратить внимание на то, как кривая смещается влево. Артериовенозное различие по кислороду (а-в) 02 может быть поддержано только за счет снижения парциального давления кислорода в венозной крови. (По: Shappell S. D., Lenfant С. J. М. / / Anesthesiology, — 1972. — Vol. 37. — P. 127.)
Таблица 4.2. Факторы,
влияющие на сродство
гемоглобина к кислороду
По: Shapelli S.D., Lenfant C.J.M. Adaptive, genetic and iatrogenic alterations of the oxyhemoglobin dissociation curve //Anesthesiology. — 1971. — Vol. 37. — P. 127. Терапия шока направлена на восполнение дефицита объема циркулирующей крови за счет быстрых инфузий изотонических растворов и крови. В начале лечения через два внутривенных катетера струйно необходимо вливать Рингер-лактат. Если признаки шока сохраняются, следует начать переливание крови, когда известен источник кровотечения и удается его остановить, хотя бы временно. Развитие ацидоза во время проведения интенсивной прртивошоковой терапии однозначно указывает на ее неадекватность; для устранения ацидоза следует ввести дополнительные объемы инфузионных растворов, но не раствор соды. Никакого преимущества в применении коллоидных растворов, таких как альбумин, по сравнению с кристаллоидами при лечении шока нет. Гипотония купируется за счет продолженных инфузий. Вазопрессоры не играют роли в терапии гиповоле-мического шока, поскольку они усиливают спазм уже спазмированных сосудов и способствуют дальнейшему ухудшению перфузии периферических тканей. Наоборот, казалось бы, что раннее начало применения вазо-дилататоров должно улучшать перфузию периферических тканей при шоке; на больных, однако, польза от их клинического применения не была подтверждена. Хотя результаты давно проводившихся исследований убеждают в том, что при геморрагическом шоке наблюдается угнетение функций надпочечников, в стандартных ситуациях стероиды в противошоковой терапии не применяются. Важно отличать геморрагический шок от других форм шока, таких как кардиогенный, нейрогенный или септический. Возможность прямого измерения минутного сердечного выброса и давления в предсердиях позволяет осуществлять такую дифференцировку с большей точностью. В отличие от гиповолемического кардиогенный шок является результатом несоответствия между объемом крови и возможностями миокарда по ее перекачиванию. Это обычно связано со снижением сократимости сердечной мышцы в результате ее ишемии. Давление в предсердиях при этом состоянии в отличие от геморрагического шока повышено, однако минутный сердечный выброс остается низким. Как и при геморрагическом шоке, организм пытается компенсировать это состояние повышением периферического сопротивления. Такая попытка, однако, может создать для миокарда дополнительную нагрузку по преодолению сосудистого сопротивления при -сокреаз^^ Сердце пытается в свою очередь компенсировать это за счет тахикардии, однако уже измененная сердечная мышца не может эффективно работать с усиленной нагрузкой. Доставка;кислорода в ткани ухудшается, а его экстракция из крови увеличивается. У таких больных наблюдается положительный эффект от применения диуретиков и ино-тропных препаратов, таких как, например, добутамин, которые увеличивают сократимость миокарда и снижают постнагрузку (системное сосудистое сопротивление). Препараты наперстянки улучшают сократимость миокарда и могут несколько снизить частоту сердечных сокращений, вызванную трепетанием предсердий, что позволяет улучшить наполнение желудочков в диастолу. Так называемый «теплый шок» является ответом на медиаторы и токсины, выделяемые лейкоцитами при сепсисе. В отличие от геморрагического и кЪрдиогенного шоков минутный сердечный выброс при этом состоянии увеличен, часто до гипердинамического уровня. Системное сосудистое сопротивление снижено, что сопровождается уменьшением артериального давления. Конечности пациента при этом шоке оказываются теплыми, кро-воток в них хороший. Однако из-за дисфункции на клеточном уровне экстракция кислорода из крови ухудшена, что ведет к уменьшению арте-риовенозной разницы по содержанию кислорода. Для постановки правильного диагноза важную роль играют такие проявления инфекционного процесса, как лихорадка и лейкоцитоз. Лечение заключается в выявлении источника инфекции и его устранении. Патогенетическое лечение состоит в повышении объема циркулирующей крови за счет инфузий и применения инотропных препаратов, которые способствуют повышению периферического сопротивления. НЕЙРОГЕННЫЙ (СПИНАЛЬНЫЙ) ШОК . Внезапное падение тонуса резистивных; сосудов, как это наблюдается при повреждении спинного мозга, ведет к венозному застою за счет снижения венозного возврата крови в правые отделы сердца, а также к расширению артерий и^артериол. Артериальное давление падает, но. рефлекторной тахикардии при этом у таких пострадавших не возникает. Конечности теплые. Лечение заключается в умеренном увеличении объема циркулирующей крови за счет инфузий с целью приведения его в соответствие с изменившимся объемом сосудистого русла и в назначении вазопрессоров, таких как неосинефрин, для повышения артериального тонуса. Изолированное повреждение головного мозга не вызывает нейрогенного шока. НАПРЯЖЕННЫЙ ПНЕВМОТОРАКС, ТРОМБОЭМБОЛИЯ ЛЕГОЧНЫХ АРТЕРИЙ И ТАМПОНАДА СЕРДЦА Все три указанных состояния сопровождаются снижением минутного сердечного выброса за счет ухудшения наполнения кровью желудочков сердца. Трудность заключается в том, что они сопровождаются картиной, сходной с таковой при кардиогенном шоке, однако должны немедленно диагностироваться и лечение, проводимое при этом, должно быть специфичным. При напряженном пневмотораксе смещение средостения вызывает перегиб полых вен на уровне правого предсердия, что ведет к блокированию венозного возврата и в результате последнего — к гипотонии. Пневмоторакс может быть распознан по ряду клинических признаков, таких как отклонение трахеи от срединной линии, набухание шейных вен и коробочный звук при перкуссии грудной клетки на стороне поражения. Пневмоторакс должен быть устранен путем пункции иглой большого диаметра во втором межреберье на передней поверхности грудной клетки, а затем — путем торакоцентеза и активного вакуумного дренирования плевральной полости. Диагноз напряженного пневмоторакса — диагноз клинический; если ожидать его рентгенологического подтверждения, то диагноз уже может оказаться ненужным — больной умрет. Тромбоэмболия легочных артерий вызывает падение артериального давления благодаря снижению притока крови к левым отделам сердца. Это возникает за счет комбинации механического фактора в виде закупорки крупным тромбоэмболом и компенсаторного спазма легочных сосудов при эмболии многочисленными мелкими тромбоэмболами. У больных с катетерами Свана—Ганца (Swan—Ganz) определяется моментальное значительное повышение центрального венозного давления при низком или нормальном давлении заклинивания в легочных капиллярах. Выявление внезапно развившейся гипоксемии помогает установлению правильного диагноза. При тампонаде сердца механическое препятствие расширению его камер во время диастолы нарушает их нормальное наполнение в это время. Для него характерно уравнивание давления в камерах сердца. Появление триады Бека (Beck) в виде глухости сердечных тонов, гипотонии и повышения центрального венозного давления должно наводить на мысль о возможной тампонаде. Поскольку в шуме травматологического помещения бывает трудно расслышать приглушение тонов сердца при аускультации, следует начать эмпирическое лечение, которое заключается в перикардиоцентезе или, при показаниях, расширенном хирургическом вмешательстве. Таблица 4.3. Характеристики различных форм шока (критических состояний )
МОК — минутный объем кровообращения,
Характеристики различных форм шока отражены в табл. 4.3. Немедленная диагностика и коррекция развившегося состояния для таких больных являются вопросом жизни и смерти. |
||||||||||||||||||||||||||||||||||||||||||||||||||||