|
ГАСТРОЭНТЕРОЛОГИЯ
ГЛАВА 78. ХИРУРГИЯ ПИЩЕВОДА 1. Опишите четыре этапа лечения желудочно-пищеводного рефлюкса. Какие существуют показания для выполнения антирефлюксных операций? 1-й этап. Терапия
без вовлечения лекарственных средств включает изменение диеты (следует
избегать употребления кофеина, алкоголя и шоколада), похудание, отказ от
курения, подъем головного конца кровати. Также не следует принимать пищу
перед сном, носить тесную одежду. Кроме того, показан прием антацидных
препаратов.
2. Какие обследования необходимо проводить перед операцией у пациентов с желудочно-пищеводным рефлюксом? Рентгеноскопия верхних
отделов желудочно-кишечного тракта с использованием бариевой взвеси. Главная
роль рентгеноскопии верхних отделов желудочно-кишечного тракта с использованием
бариевой взвеси состоит в выявлении и определении типа грыжи пищеводного
отверстия диафрагмы (хиатальной грыжи). Исследование с бариевой взвесью
может также использоваться для подтверждения наличия желудочно-пищеводного
рефлюкса, хотя чувствительность и специфичность этого мето-
3. Каковы физиологические принципы антирефлюксных операций? Операции, выполняемые для лечения желудочно-пищеводного рефлюкса, направлены на восстановление функций дистального пищеводного сфинктера, с тем чтобы создаваемое им давление хотя бы в 2 раза превышало давление в желудке в покое. Основными принципами антирефлюксных операций являются восстановление анатомического положения пищеводно-желудочного перехода и увеличение длины внутрибрюшного отдела пищевода, которая не должна уменьшаться при повышении давления в брюшной полости. Эти операции не будут увеличивать сопротивление дистального пищеводного сфинктера, поскольку перистальтические волны пищевода преодолевают сократительную силу сфинктера. 4. Какие антирефлюксные операции в настоящее время выполняются хирургами? Антирефлюксные операции могут выполняться как с помощью лапароскопической техники, так и традиционными открытыми способами. К основным антирефлюксным операциям, выполняемым с помощью лапароскопической техники, относятся фундопликация по Ниссену (при этом дно желудка на 360° оборачивается вокруг внутрибрюшного отдела пищевода в виде манжеты), фундопликация по Тупе (дно желудка на 270° оборачивается вокруг внутрибрюшного отдела пищевода по задней поверхности) и кардиопексия с использованием круглой связки печени. Чаще всего в клинической практике применяется фундопликация по Ниссену по методике, описанной Де Мистером для открытых операций. При этом дно желудка оборачивается в виде манжеты длиной 2 см вокруг внутрибрюшного отдела пищевода на 360°. В пищеводе при этом должен находиться дилататор большого диаметра (50-60F). К открытым операциям относятся фундопликация по Ниссену; операция Белей Марка IV (Belsy Mark IV) — окутывание внутрибрюшного отдела пищевода дном желудка на 270°; фундопликация по Хиллу (Hill) — восстановление срединной дугообразной связки (fig. arcuatum medianum) и установка протеза Ангельчика (Angelchik). 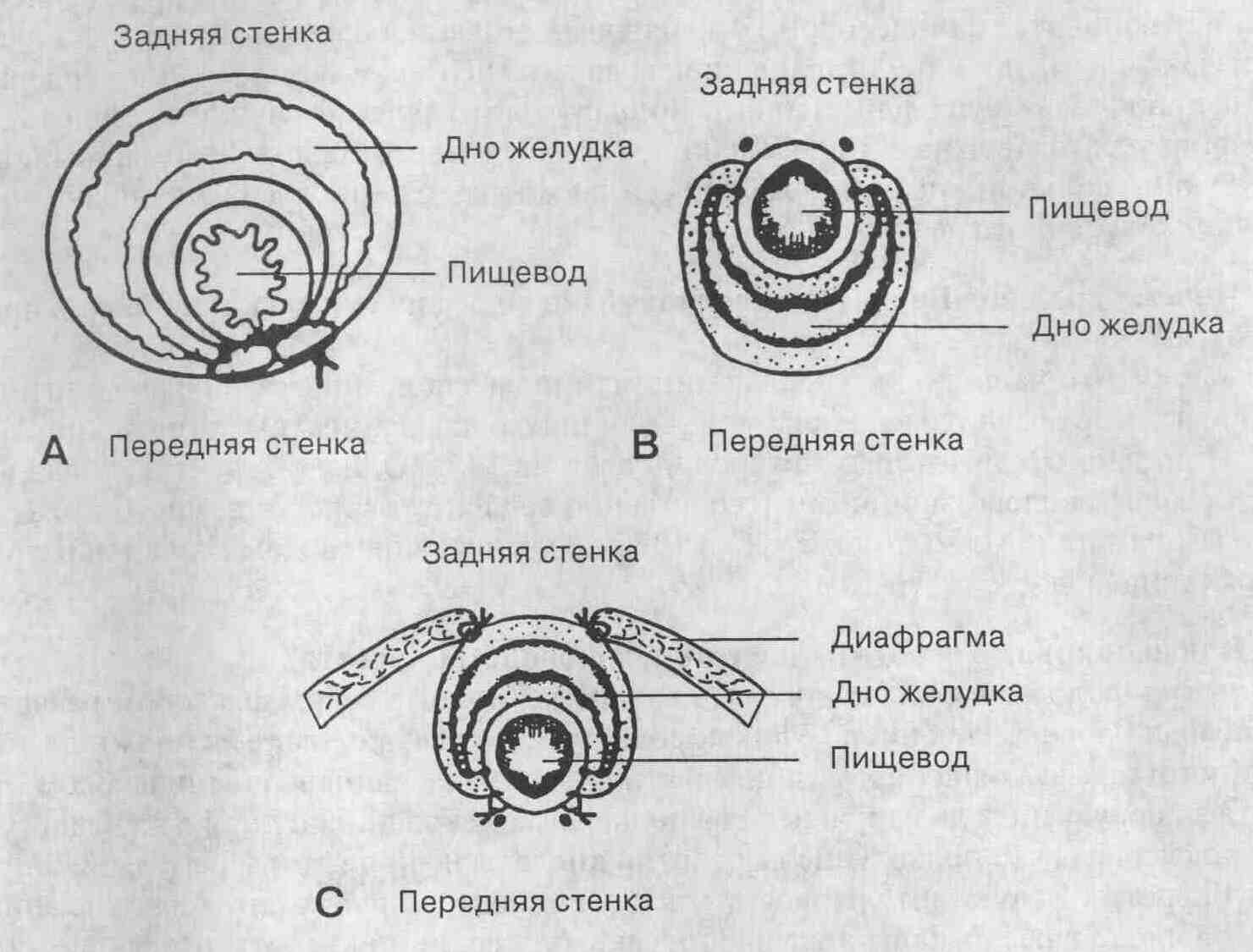 5. Какова частота хороших результатов и возможных осложнений этих операций? После оперативного лечения желудочно-пищеводный рефлюкс у пациентов пропадает в 85-95 % случаев. К побочным эффектам и осложнениям операций относятся развитие дисфагии (2-10 %), избыточное скопление газов в желудке (0-8 %), нарушение механизма рвоты (5 %) и образование желудочного свища (1 %). К поздним осложнениям относятся рецидив желудочно-пищеводного рефлюкса (0-10 %) и "соскальзывание" манжеты Ниссена (1-2 %). 6. Что такое пищевод Барретта? Пищевод Барретта — это приобретенное заболевание, при котором наблюдается метаплазия поврежденного плоского эпителия пищевода с трансформацией в цилиндрические клетки, которые в дальнейшем подвергаются пролиферации с образованием аномального эпителия. Существуют две разновидности пищевода Барретта — с развитием в пищеводе кишечного и желудочного эпителия. У почти 15 000 пациентов, которым по различным причинам была выполнена ФГДС, эпителий Барретта был обнаружен с частотой 7,4 на 1000 пациентов. У пациентов с симптомами желудочно-пищеводного рефлюкса — с частотой 80,1 на 1000 пациентов. С точки зрения физиологии, у пациентов с пищеводом Барретта увеличивается время воздействия на слизистую оболочку нижних отделов пищевода как кислого, так и щелочного содержимого, происходят ослабление (иногда полная утрата) функций нижнего пищеводного сфинктера, задержка в пищеводе пищи и желудочного содержимого, повышение продукции соляной кислоты в желудке, а также увеличение двенадцатиперстнокишечно-желудочного рефлюкса. 7. Почему пищевод Барретта имеет такое большое значение в клинической практике? Считается, что чаще всего аденокарцинома пищевода возникает на фоне эпителия Барретта. Риск развития аденокарциномы пищевода у пациентов с пищеводом Барретта, по данным некоторых авторов, достигает 13 %. Однако в действительности риск развития аденокарциномы в собственно сегменте Барретта намного ниже. По данным клиники Мэйо, только у 2 из 104 пациентов с пищеводом Барретта развился рак пищевода. 8. Как необходимо лечить пациентов с пищеводом Барретта? Несмотря на доказательства
того, что важным этиологическим фактором развития пищевода Барретта является
рефлюкс содержимого двенадцатиперстной кишки, общепринятая в настоящее
время консервативная терапия пациентов с пищеводом Барретта в первую очередь
направлена на подавление секреции кислоты в желудке. Однако оказалось,
что подавление выработки кислоты не приводит к регрессии эпителия Барретта.
В действительности у многих пациентов происходит развитие эпителия Барретта
даже на фоне подавления секреции соляной кислоты в желудке. Этот факт подтверждает
точку зрения о том, что основную роль в развитии пищевода Барретта играет
рефлюкс щелочного содержимого двенадцатиперстной кишки. Возможно, лучшим
методом лечения пациентов с пищеводом Барретта являются антиреф-люксные
операции.
9. Каковы факторы риска развития рака пищевода? Рак пищевода наиболее часто
встречается у жителей Ирана, Китая и Южной Африки. В США у пожилых чернокожих
мужчин на юго-востоке страны риск развития рака пищевода более высокий,
чем у белокожих людей такого же возраста. Плоскоклеточный рак более часто
встречается у мужчин с темным цветом кожи, в то время как аденокарцинома
пищевода чаще развивается у мужчин со светлым цветом кожи.
10. Какова классификация рака пищевода в зависимости от гистологического строения и анатомической локализации? Из всех злокачественных опухолей пищевода почти в 50 % случаев выявляется аденокарцинома в области пищеводно-желудочного перехода. Далее по частоте встречаемости следует плоскоклеточный рак (почти 50 %), который поражает среднюю треть пищевода в 50 % случаев, нижнюю треть — в 35 % случаев и верхнюю треть — в 15 % случаев. Небольшой процент приходится на рак шейного отдела пищевода. Лечение рака кардиального отдела желудка осуществляется таким же образом, как и рака дистального отдела пищевода, и имеет похожие результаты. В последнее время частота развития рака пищевода увеличивается. 11. Какие дооперационные исследования необходимо проводить пациентам с раком пищевода? Какие признаки могут свидетельствовать о том, что опухоль пищевода радикально неоперабельна? • Рентгеноскопия верхних
отделов желудочно-кишечного тракта с бариевой взвесью является неинвазивным
и высокоинформативным исследованием. Она позволяет уточнить локализацию
опухоли и планировать соответствующий операционный доступ.
12. Какие существуют неоперативные паллиативные методы лечения рака пищевода? • Лучевая терапия, если
применяется самостоятельно, без сочетания с какими-либо другими методами
лечения, обеспечивает временное облегчение дисфа-гии у значительного числа
пациентов. Однако такой эффект лучевой терапии, к сожалению, очень непродолжителен.
Пятилетняя выживаемость у пациентов, получающих только лучевую терапию,
составляет от 1 до 8 %.
13. Какие операции применяются как для радикального, так и для паллиативного лечения пациентов с раком пищевода? Термин радикальная резекция
применяется
в тех случаях, когда хирург удаляет полностью все необходимые ткани и при
этом отсутствуют макроскопические признаки оставленной (неудаленной) опухолевой
ткани. Паллиативная резекция подразумевает, что хирург удалил не
всю опухоль. При наличии инкурабельных опухолей саму опухоль хирург, как
правило, не трогает и обычно либо накладывает обходной анастомоз, либо
пациенту назначается консервативное лечение.
14. Каков прогноз у пациентов с раком пищевода? Целью резекции пищевода при раке является достижение уровня операционной летальности менее 5 %, годичной выживаемости 50-75 % и 5-летней выживаемости — 15-20 %. Кроме того, после операции пациенты должны хорошо глотать любую пищу. 15. Какова роль адъювантной (дополнительной) терапии у пациентов с раком пищевода? Лучевая терапия обычно применяется у пациентов с неоперабельными опухолями или у пациентов с рецидивом опухоли после операции. Лучевая терапия, используемая в сочетании с химиотерапией, у некоторых пациентов может давать хороший эффект. 16. Каким образом следует проводить обследование пациентов с ахалазией пищевода? Ахалазия пищевода одинаково
часто встречается у мужчин и у женщин, чаще всего в возрасте от 25 до 60
лет. У пациентов с ахалазией пищевода развивается дисфагия, причем по пищеводу
не проходит не только твердая, но, нередко, и жидкая пища. Также у пациентов
с ахалазией возникают чувство переполнения в грудной клетке, регургитация
и снижается масса тела. Для того чтобы пища прошла в желудок, некоторым
пациентам необходимо изменять положение тела (так называемый постуральный
эффект). В стрессовых ситуациях дисфагия может усиливаться. Изредка пациенты
с ахалазией жалуются на боли в груди и изжогу, иногда могут возникать эпизоды
аспирационной пневмонии.
17. Перечислите методы лечения пациентов с ахалазией пищевода. 1. Лекарственная терапия
с использованием препаратов, расслабляющих гладкую мускулатуру (изосорбид,
динитрат, нифедипин).
18. Каковы особенности выполнения эзофагомиотомии? Протяженность эзофагомиотомии,
как правило, составляет от 5 до 15 см. Разрез начинается непосредственно
от пищеводно-желудочного перехода. Большинство авторов считают, что эзофаготомия
протяженностью 5-6 см является вполне достаточной. Для выявления уровня
расположения и протяженности сфинктера и, соответственно, расчета длины
эзофагомиотомического разреза можно применять дооперационную манометрию.
Протяженность миотомии в стенке желудка составляет от 0 до 4 см дистальнее
пищеводно-желудочного перехода, однако большинство авторов считают, что
0,5-1 см вполне достаточно. Излишняя протяженность миотомии в стенке желудка
приводит к повышенной частоте возникновения послеоперационного желудочно-пищеводного
рефлюкса.
19. Каковы наиболее часто встречающиеся причины возникновения перфорации пищевода? Перфорация шейного отдела пищевода (25 %) чаще всего возникает в результате проникающего ранения шеи, при выполнении эндоскопии или других манипуляций, а также при попадании инородных тел. При этом у пациентов возникают боли, лихорадка, дисфагия и крепитация на шее. Перфорация грудного отдела пищевода чаще всего возникает во время выполнения эндоскопии, дилатации пищевода и в результате травмы. Кроме того, может возникать спонтанная перфорация грудного отдела пищевода, так называемый синдром Бурхаве. У пациентов с перфорацией грудного отдела пищевода появляются лихорадка и боли, дисфагия при этом развивается редко. Перфорация внутрибрюшного отдела пищевода может быть спонтанной или возникать при повреждении пищевода во время операции. В 60 % случаев перфорации пищевода являются ятрогенными (во время эндоскопии и т. д.), в 25 % — возникают в результате ранений и в 15 % случаев бывают спонтанными. 20. Как можно поставить диагноз перфорации пищевода? Ключом к постановке правильного диагноза является клиническая картина, которая позволяет заподозрить перфорацию пищевода. Перфорация шейного отдела пищевода часто сопровождается развитием подкожной эмфиземы, которую можно выявить на обзорных рентгенограммах. При обзорной рентгенографии груди можно обнаружить выпот в плевральной полости с пневмотораксом или без него. Иногда выявляют признаки пневмоперикарда. При перфорации внутрибрюшного отдела пищевода часто в поддиафрагмальном пространстве обнаруживается свободный газ. Рентгеноскопия верхних отделов желудочно-кишечного тракта с водорастворимыми рентгеноконтрастными препаратами (гастрографином, меглюмина диатризоатом) позволяет установить точное место перфорации пищевода. Если при этом не удалось выявить место перфорации, следует выполнить рентгеноскопию с небольшим количеством жидкой (сильно разведенной) бариевой взвеси. 21. Перечислите некоторые варианты хирургического лечения перфорации пищевода. 1. При ранних оперативных
вмешательствах, если прошло менее 24 ч от момента перфорации, лучше всего
выполнять первичный шов дефекта стенки пищевода с укреплением линии швов
соседними тканями (плеврой, перикардом, сальником, диафрагмой, межреберными
мышцами, стенкой желудка). Некоторые хирурги дополнительно линию швов не
укрепляют.
22. В каких отделах пищевода возникают дивертикулы? Какова их этиология? Дивертикулы пищевода классифицируются
в зависимости от их локализации:
23. Каковы основные принципы оперативного лечения дивертикулов пищевода? Основным компонентом лечения
глоточно-пищеводных дивертикулов является кри-кофарингеальная (перстневидно-глоточная)
миотомия. Наиболее крупные дивертикулы могут быть резецированы с простым
ушиванием стенки пищевода. При этом в пищеводе должен находиться дилататор
размера 50F, с тем чтобы предотвратить развитие стеноза пищевода.
24. Какова классификация
грыж пищеводного отверстия диафрагмы? Тип I. Скользящая грыжа пищеводного
отверстия диафрагмы. Пищевод свободно в любое время перемещается через
пищеводное отверстие диафрагмы то в грудную клетку, то в брюшную полость,
вместе с пигцеводно-желудочным переходом. Тип II. Параэзофагеальная
грыжа. Пищеводно-желудочный переход расположен в брюшной полости, но
дно или большая кривизна желудка как бы выпячивается вдоль пищевода, образуя
своеобразную грыжу.
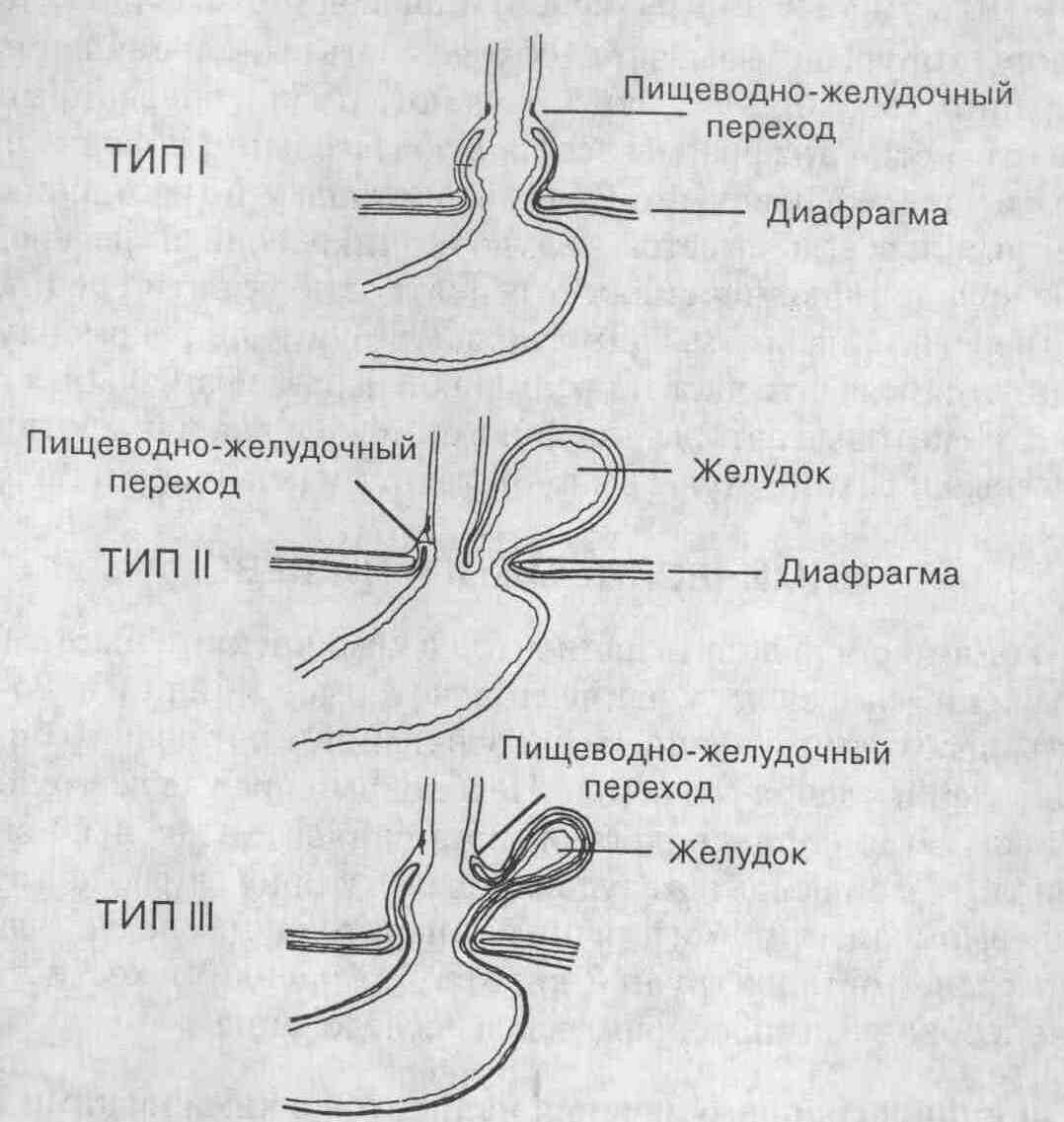
Схематическое изображение различных типов грыж пищеводного отверстия диафрагмы 25. В каких случаях пациентам с грыжей пищеводного отверстия диафрагмы показано оперативное лечение? Экстренное хирургическое вмешательство показано пациентам с осложненными грыжами пищеводного отверстия диафрагмы, например при возникновении заворота желудка, который может приводить к развитию кровотечения, некроза или перфорации стенки желудка. При отсутствии осложнений клинические симптомы у пациентов с грыжами пищеводного отверстия диафрагмы выражены незначительно. Самые большие разногласия вызывает вопрос о показаниях к оперативному лечению у пациентов, у которых грыжи пищеводного отверстия диафрагмы протекают бессимптомно или со слабо выраженными симптомами. Преобладает точка зрения, что пациенты с клиническими симптомами заболевания подлежат плановому оперативному лечению. 26. Перечислите основные принципы оперативного лечения грыж пищеводного отверстия диафрагмы. К основным принципам хирургического
лечения параэзофагеальных хиатальных грыж относятся:
27. Как необходимо обследовать пациентов с химическими ожогами пищевода? Тяжесть поражения пищевода у пациентов, которые выпили какую-либо агрессивную жидкость, необходимо оценивать на основании тщательного опроса самого пациента, свидетелей и членов его семьи. Необходимо прежде всего получить информацию о том, какую именно жидкость выпил пациент, насколько она агрессивна и как много попало ее в пищевод и желудок. Для выявления признаков аспирации, пневмоторакса, пневмомедиастинума или пневмоперитонеума следует выполнить обзорную рентгенографию органов груди и живота. Для оценки тяжести и протяженности повреждений необходимо эндоскопическое исследование. 28. Каковы принципы раннего лечения пациентов с химическими ожогами пищевода? Начинать лечение пациентов, которые выпили агрессивную жидкость, надо с оценки состояния дыхательных путей. При поражении верхних дыхательных путей или каких-либо нарушений дыхания следует выполнить интубацию трахеи. Далее необходимо произвести санацию трахеобронхиального дерева. Пациентам, которые сами не в состоянии проглатывать слюну, необходимо отсасывать содержимое из ротоглотки. Далее следует наладить активную инфузионную терапию для поддержания хорошей гидратации организма, поскольку тяжелые химические ожоги пищевода и желудка могут приводить к накоплению в тканях большого объема жидкости, что, в свою очередь, приводит к развитию гиповолемии. Пациентов с тяжелыми повреждениями сразу необходимо переводить на полное парентеральное питание. Для лечения специфических гнойных осложнений показана антибиотикотерапия. У пациентов с легкими повреждениями, которые могут нормально питаться, через 2-4 нед после получения ожога необходимо выполнить рентгеноскопию верхних отделов желудочно-кишечного тракта. 29. Каковы осложнения химических ожогов пищевода? К ранним осложнениям химических ожогов пищевода относятся некроз стенки пищевода или желудка, развитие стриктуры. Из поздних осложнений отметим рефлюкс-эзофагит и рак пищевода. 30. Как следует лечить ранние осложнения химических ожогов пищевода? Развитие некроза стенки
пищевода или желудка является крайне тяжелым осложнением. У детей чаще
всего наблюдаются легкие ожоги пищевода, тогда как у взрослых преобладают
умеренные и тяжелые. Зловещими симптомами считаются развитие септического
шока, пневмомедиастинума или пневмоперитонеума. В таких случаях необходимо
выполнять экстренную срединную лапаротомию и резекцию (или полное удаление)
пищевода, желудка или двух этих органов вместе. Для того чтобы избежать
дополнительной торакотомии, можно произвести трансхиатальную резекцию пищевода.
В некоторых случаях можно сразу выполнить и реконструктивный этап операции.
Однако чаще всего в таких случаях следует накладывать эзофагостому и гастростому,
а реконструктивный этап операции выполнять в более поздние сроки.
31. Как лечат поздние осложнения химических ожогов пищевода? В отдаленные сроки после химического ожога пищевода могут развиваться симптомы желудочно-пищеводного рефлюкса. В таких случаях пациентам можно назначить прокинетики, блокаторы Н2-рецепторов гистамина или омепразол. Роль оперативного лечения (например, фундопликации) в таких случаях сомнительная. Химические ожоги пищевода у детей могут приводить к развитию в дальнейшем короткого пищевода, требующего оперативного лечения. Наиболее тяжелым поздним осложнением химических ожогов пищевода является развитие плоскоклеточного рака или, реже, аденокарциномы на фоне стеноза или рефлюкс-эзофагита. 32. Каким образом необходимо проводить обследование пациентов с подозрением на наличие у них в пищеводе инородных тел? Большую часть (80 %) пациентов
с инородными телами верхних отделов желудочно-кишечного тракта составляют
дети. Более чем у 90 % из них инородные тела попадают в пищевод и желудок
и у приблизительно 8 % — в трахеобронхиальное дерево. В большинстве случаев
(80-90 %) инородные тела выходят из желудочно-кишечного тракта самостоятельно,
в 10-20 % случаев их удается удалить с помощью эндоскопической техники,
и только совсем небольшой части из них требуется оперативное лечение.
33. В каких случаях для удаления инородных тел показана операция? Эндоскопическое удаление инородных тел у детей необходимо производить в условиях общей анестезии. Для восстановления проходимости дыхательных путей у детей в первую очередь следует удалять инородные тела, вколоченные в области перстневидно-глоточной мышцы (т. cricopharyngeus). При проведении эндоскопического удаления инородных тел у взрослых достаточно умеренной медикаментозной седации. Операция показана у пациентов с большими или длинными инородными телами, которые остаются в желудке более 5 сут, а также при перфорации, кровотечении или кишечной непроходимости. 34. Какие существуют основные виды расстройств двигательной активности пищевода? 1. Нарушения функций мышц ротоглотки
и верхнего пищеводного сфинктера могут развиваться вследствие
неврологических или нервно-мышечных заболеваний или быть идиопатическими.
Орофарингеальная (ротоглоточная) дисфагия может также возникать после различных
операций (например, после трахеостомии, ларинг-эктомии или обширного удаления
шейных лимфатических узлов).
35. Какие существуют методы лечения при расстройствах двигательной активности пищевода? • Пациентам с крикофарингеальной
дисфагией и повышением тонуса верхнего пищеводного сфинктера необходимо
выполнять крикофарингеальную миотомию.
|