|
ГЛАВА 75. РАДИОИЗОТОПНЫЕ ИССЛЕДОВАНИЯ 1. Перечислите основные преимущества радиоизотопных диагностических методов по сравнению с другими методами визуализации. Почти в каждом случае радиоизотопные
методы исследования имеют одно или несколько преимуществ по сравнению с
другими методами:
2. Назовите основные недостатки радиоизотопных исследований по сравнению с другими радиологическими исследованиями. 1. Разрешающая способность метода (1-2
см)
ниже, чем разрешающая способность других методов визуализации.
3. Какие радиоизотопные исследования наиболее информативны при обследовании пациентов с заболеваниями желудочно-кишечного тракта? Радиоизотопные исследования можно использовать для обследования пациентов с практически любыми заболеваниями желудочно-кишечного тракта. Однако усовершенствование и все более широкое распространение эндоскопии, манометрии, рН-мониторирования, а также других инструментальных методов исследования несколько ограничивают область применения радиоизотопных исследований, которые используются только в некоторых специфических клинических ситуациях. Использование радиоизотопных исследований для диагностики заболеваний желудочно-кишечного тракта
Примечание. MIBG - т-йодобензилгуанидин; НМ-РАО - гексаметилпропиленаминоксим. 4. Как выполняется холесцинтиграфия (визуализация желчевыводящей системы)? Какова сцинтиграфическая картина в норме? Методика проведения стандартного
холесцинтиграфического исследования практически одна и та же независимо
от клинических показаний (см. вопрос 3). Пациенту парентерально вводят
препараты имидодиацетиловой кислоты, меченной технеци-ем-99т. В настоящее
время наиболее часто применяют такие радиофармакологические препараты,
как DISHIDA, меброфенин и HIDA (гепато-IDA), причем последнее название
является обобщающим для всех перечисленных препаратов. Несмотря на то,
что эти препараты метаболизируются так же, как и билирубин, их можно использовать
с диагностической целью даже при очень высокой концентрации билирубина
в крови (более 200 мг/л).
5. Как следует готовить к исследованию пациента с острым холециститом? Какие меры необходимо принимать для укорочения времени проведения исследования и повышения его достоверности? Традиционно острый холецистит
диагностируется на основании выявляемого при проведении функциональной
холесцинтиграфии недостаточного наполнения желчного пузыря (что обычно
связано с наличием камня в пузырном протоке) при первичном 60-минутном
исследовании и при дальнейшей 4-часовой визуализации (позитивное исследование).
Все подготовительные процедуры выполняются для того, чтобы не было сомнений
в том, что плохая визуализация желчного пузыря является истинно-положительным
результатом, а также для укорочения времени проведения исследования, иногда
крайне утомительного для пациентов. Так как пища является потенциальным
длительно действующим стимулятором выброса эндогенного холе-цистокинина
и последующего сокращения желчного пузыря, пациенты должны воздерживаться
от приема пищи в течение 4 ч до начала исследования; в противном случае
исследование может дать ложноположительный результат. Длительное голодание
способствует повышению вязкости желчи в неизмененном желчном пузыре, что
может затруднять его наполнение радиофармакологическим препаратом и быть
причиной получения ложноположительных результатов. Большинство клиницистов
в настоящее время используют быстродействующие аналоги холецистокинина,
такие как синкалид. Синкалид вводят в дозе 0,01-0,04 мкг/кг внутривенно
в течение более чем 3 мин за 30 мин перед холесцинтиграфией, при голодании
пациента более 24 ч, при переедании или при тяжелом течении заболевания.
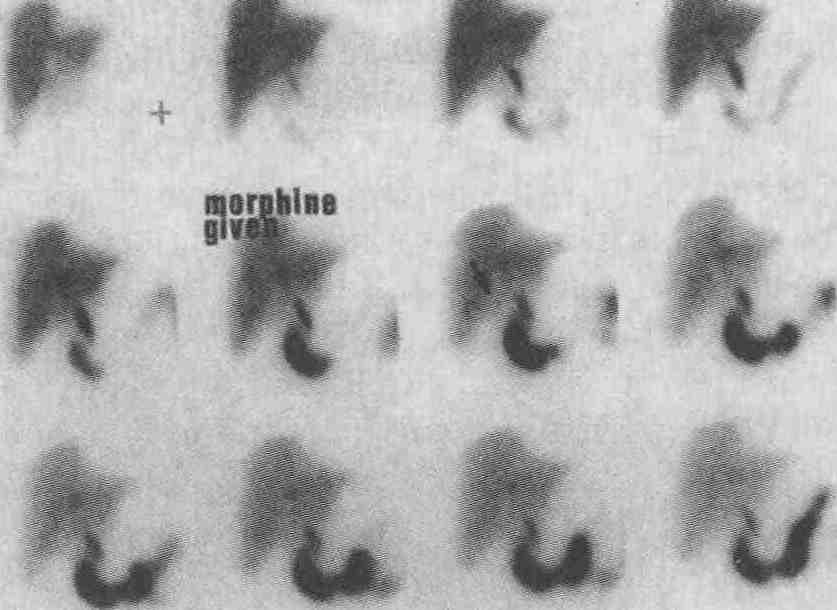
Острый холецистит. Исследование печени и желчевыводящей системы, начатое через 5 мин после инъекции 99тТс-меброфенина, отражает быстрый захват препарата печенью и быструю экскрецию его в общий желчный проток и тонкую кишку. Обратите внимание на отсутствие желчного пузыря (стрелкой показано место обычного расположения желчного пузыря). После внутривенного введения 1 мг морфина не выявлено наполнение желчного пузыря при дополнительной 30-минутной визуализации. Вместо применения описанной методики с введением морфина можно выполнять 4-часовое отсроченное исследование, но это только затягивает исследование, в чем нет необходимости 6. Следует ли выполнять сцинтиграфию печени и желчевыводящих путей у пациентов с подозрением на наличие острого холецистита? Сцинтиграфия печени и желчевыводящих путей является наиболее точным методом диагностики острого холецистита. Чувствительность и специфичность данного метода составляют 95 %. Однако не следует использовать этот метод при обследовании всех пациентов, у которых подозревается острый холецистит. Если, например, вероятность наличия острого холецистита невелика (менее 10 %), то положительный результат в группах с низкой степенью риска (по данным скринингового обследования), скорее всего, является ложноположительным. Если вероятность наличия острого холецистита высока (более 90 %), то отрицательный результат исследования в группах с высокой степенью риска, по-видимому, является ложноотрицательным. При обследовании некоторых пациентов, например пациентов с бескаменным холециститом или ожирением, а также с крайне тяжелой клинической формой заболевания, врачи часто получают ложноположительные результаты, в связи с чем результаты сцинтиграфии необходимо оценивать только в совокупности с данными ультразвукового исследования или компьютерной томографии. 7. Каким образом холесцинтиграфия применяется для диагностики и лечения пациентов с подтеканием желчи в брюшную полость? Холесцинтиграфический метод характеризуется высокой чувствительностью и специфичностью при выявлении подтекания желчи в брюшную полость (см. рисунок). Так как скопления жидкости вне желчных путей часто возникают после проведения хирургических операций, специфичность различных анатомических исследований невысока. Холесцинтиграфия имеет невысокую разрешающую способность и поэтому не позволяет точно установить локализацию зоны истечения желчи; для точного выявления локализации зоны истечения желчи может потребоваться выполнение эндоскопической ретроградной холангиопанкреатографии (ЭРХПГ). Холесцинтиграфия также может применяться для подтверждения того, что подтекание желчи устранено. 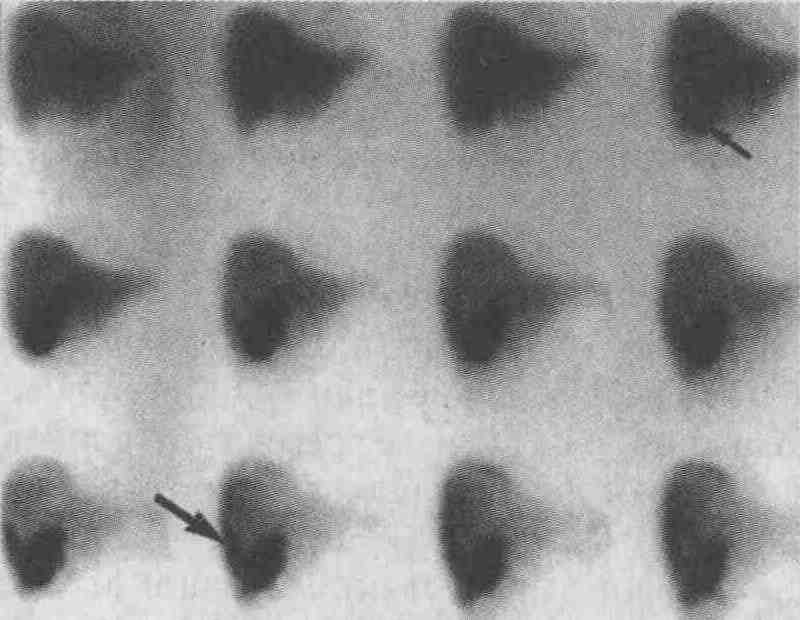
Подтекание желчи в брюшную полость. У пациента после произведения чрескожной биопсии печени возникли сильные боли в правом верхнем квадранте живота. Ультразвуковое сканирование не позволило установить причину этих болей. При радиоизотопном сканировании с введением 99mТс-меброфенина выявлен тонкий ободок желчи вдоль нижнего и латерального краев печени (большая стрелка). При этом было отмечено раннее заполнение желчного пузыря (маленькая стрелка) и отсутствие желчи в тонкой кишке 8. На основании каких признаков при проведении холесцинтиграфии диагностируется обструкция общего желчного протока? Расширение желчных протоков, выявляемое при ультразвуковом сканировании, может быть неспецифической находкой у пациентов, перенесших хирургическую операцию на желчевыводящих путях, и, наоборот, острая закупорка желчных протоков (произошедшая менее чем за 24-48 ч до УЗИ) может не сопровождаться их расширением. При закупорке общего желчного протока при проведении холесцинтиграфии не визуализиру-ются желчный пузырь и тонкая кишка, желчные протоки часто не визуализируются даже при проведении отсроченного 4-часового исследования. Чувствительность и специфичность данного метода при выявлении обструкции общего желчного протока очень высоки (см. рисунок). Результаты холесцинтиграфии являются достоверными даже при высокой концентрации билирубина. Этот метод может использоваться для дифференциальной диагностики между механической и немеханической желтухой. 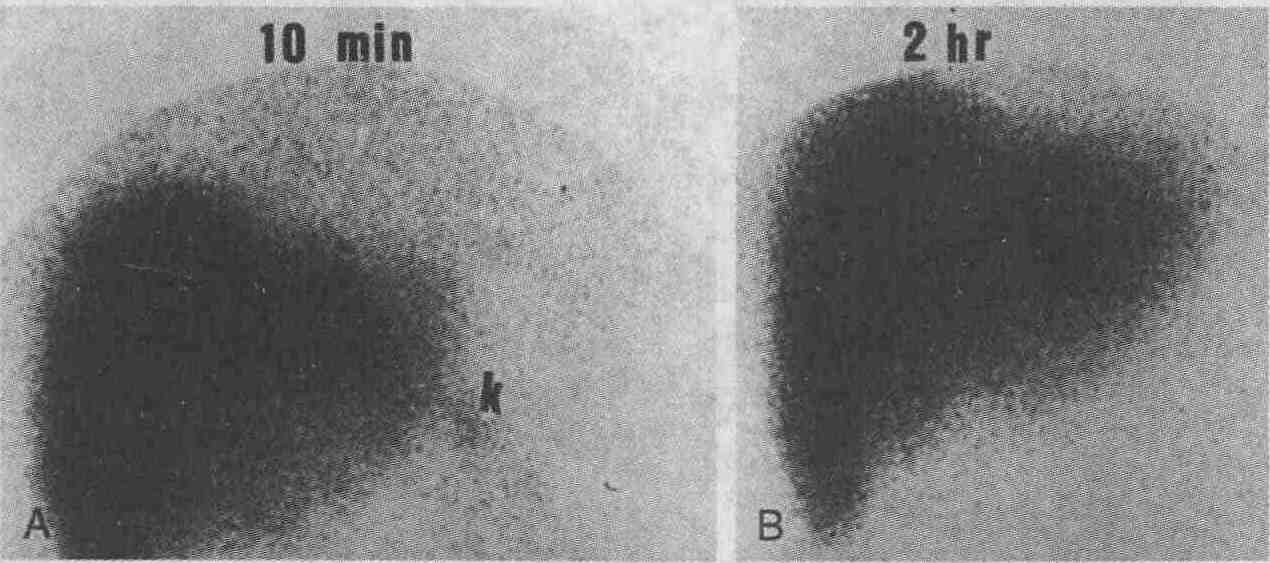
Закупорка общего желчного протока. После инъекции препарата, накапливающегося в печени и желчевыводящей системе, внутрипеченочные желчные протоки и тонкая кишка не визуализируются при проведении 10-минутного (А) и 2-часового (В) исследований. При ультразвуковом сканировании не выявлено расширения желчных протоков и камней в общем желчном протоке, наиболее частой причины его закупорки. Появление "горячей зоны", визуализирующейся слева от печени, обусловлено выделением препарата с мочой (это альтернативный путь выведения препарата из организма) 9. Как с помощью холесцинтиграфии можно выявить дисфункцию сфинктера Одди? Значительное число пациентов жалуются на боли в животе после проведения холесцинтиграфии; причиной таких болей нередко является дисфункция сфинктера Одди. Выполнения манометрии во время проведения ЭРХПГ вполне достаточно для постановки диагноза, однако это исследование является инвазивным и нередко влечет за собой различные осложнения. В настоящее время часто используется эмпирическая сцинтиграфическая шкала, которая позволяет количественно оценивать движение желчи и функцию печени. Доказано, что существует тесная корреляция между результатами холесцинтиграфии и результатами манометрического исследования сфинктера Одди. 10. Какова роль холесцинтиграфии в диагностике атрезии желчных протоков? Холесцинтиграфия является достаточно чувствительным и высокоспецифичным методом, который при соответствующей подготовке пациента позволяет диагностировать атрезию желчных протоков. Основным признаком атрезии желчных протоков является наличие у новорожденных тяжелой формы гепатита. Ультразвуковое сканирование в данном случае является неинформативным: оно позволяет выявлять расширение желчных протоков, но при атрезии расширение протоков, как правило, отсутствует. Основным недостатком сцинтиграфии является большая вероятность получения ложноположительных результатов вследствие недостаточной секреции желчи при тяжелых формах гепатита. Для устранения этого недостатка производится премедикация: внутрь в дозе 5 мгДкгхдень) в течение 5 дней вводится фенобарбитал, что стимулирует выделение желчи. При этом нельзя недооценивать важность определения концентрации фенобарбитала в сыворотке крови. Если при проведении отсроченной холесцинтиграфии визуализируется тонкая кишка, атрезия желчных путей может быть исключена (см. рисунок). 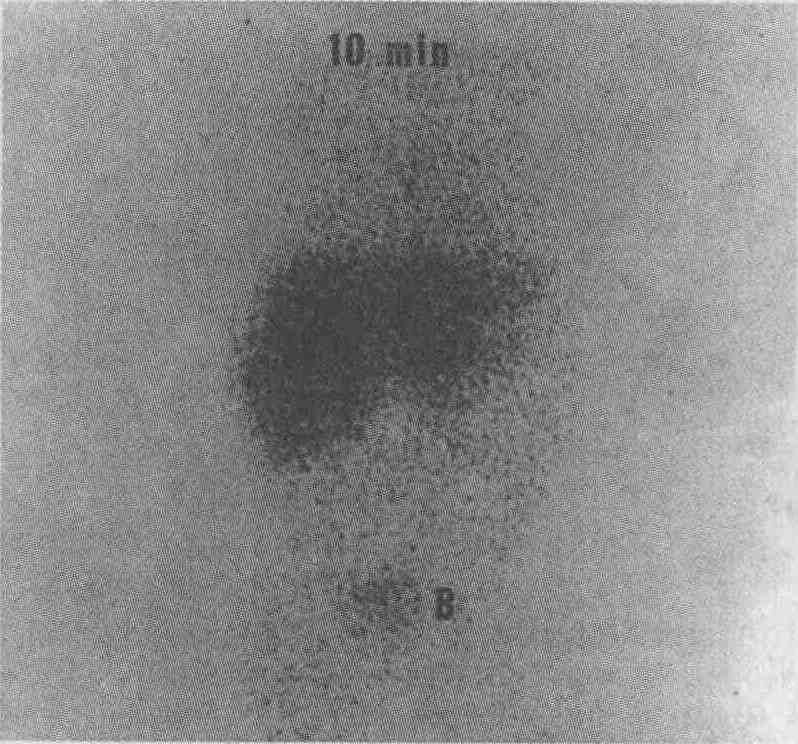
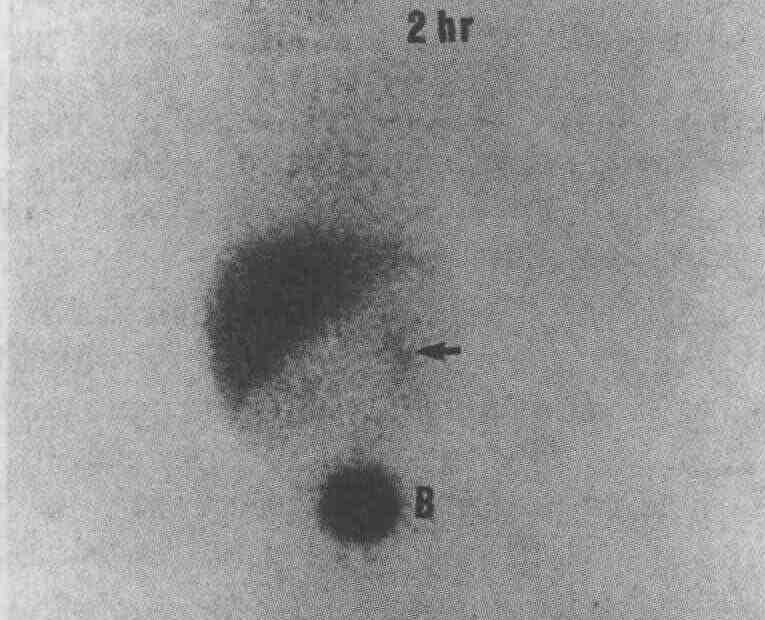 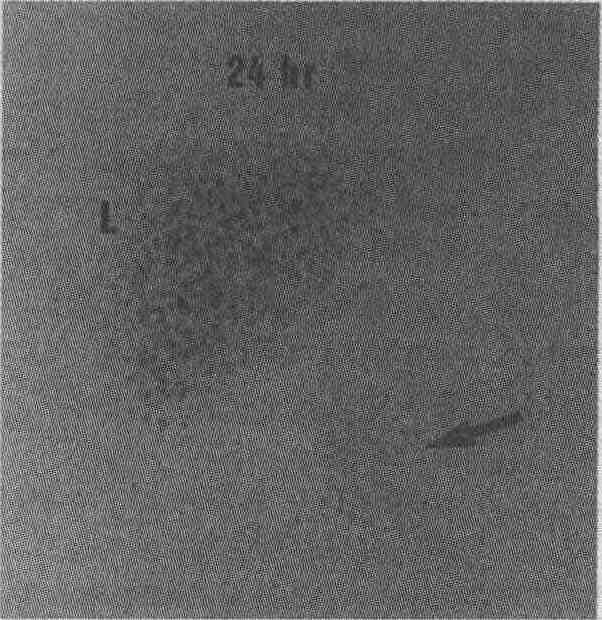
Гепатит у новорожденного с предполагаемой атрезией желчных протоков. Для того чтобы подтвердить этот сложный диагноз, пациенту вводят препарат, который поступает в печень и желчевыводящую систему. В данном случае пациенту после 5-дневного курса фенобарбитала парентерально ввели 99тТс-меброфенин. Обратите внимание на то, что через 2 ч после введения изотопа определяются активность кровяного пула в сердце и признаки экскреции препарата в желчный пузырь (В), что позволяет предположить наличие печеночно-клеточной недостаточности и нарушения экскреции препарата, который в основном выделяется с мочой. В ходе 4-часового исследования определяются очаги незначительной активности препарата (стрелки) в брюшной полости, что может быть обусловлено попаданием препарата в кишку или выделением его с мочой. При проведении 24-часового исследования с катетеризацией мочевого пузыря определяется аномально низкая активность препарата в нижнем левом квадранте брюшной полости (стрелка), ниже и латеральнее печени (L), что свидетельствует о попадании препарата в кишку и позволяет исключить атрезию желчных протоков 11. В каких случаях целесообразно применять холесцинтиграфию при обследовании пациентов с нарушением проходимости желудочно-кишечного анастомоза? Приводящую (афферентную) петлю кишки очень сложно исследовать с помощью рентгеноскопии, поскольку ее (приводящую петлю) приходится заполнять бариевой взвесью антеградно. Холесцинтиграфия позволяет с высокой степенью точности исключить нарушение проходимости приводящей петли кишки в том случае, когда активность препарата и в приводящей, и в отводящей петле кишки определяется через 1 ч после парентерального введения радиофармакологического препарата. Нарушение проходимости гастроэнтероанастомоза диагностируется в том случае, когда обнаруживается накопление радиофармакологического препарата в приводящей петле кишки в сочетании с поступлением этого препарата в отводящую петлю через 2 ч. 12. Что такое дискинезия желчного пузыря? Каким образом проводится холесцин-тиграфическое исследование эвакуаторной функции желчного пузыря? Значительное число пациентов, у которых
при проведении клинических и инструментальных исследований изменения в
желчном пузыре не выявляются, страдают от болей, связанных с нарушением
функции желчного пузыря. Выраженность симптомов у таких пациентов уменьшается
после холецистэктомии. В основе возникновения этих болей могут лежать несколько
пока недостаточно изученных патологических состояний, которые принято объединять
под общим названием "дискинезия жел-чевыводящих путей". Считается, что
в основе дискинезии желчевыводящих путей лежит нарушение координации сокращений
желчного пузыря и пузырного протока. В результате этого нарушения и возникают
боли. Установлено, что при дискинезии желчевыводящих путей выделяется аномально
малое количество желчи при стимуляции холецистокинином (синкалидом).
13. Какой радиоизотопный метод применяется для определения скорости опорожнения желудка? Определить скорость эвакуации из желудка как жидкого, так и твердого содержимого можно с помощью радиоизотопных исследований. Скорость эвакуации из желудка жидкости обычно определяют у детей. Раствор коллоидной серы, меченной технецием-99т, дают ребенку с молоком или во время обычного приема пищи. Сканирование производят каждые 15 мин в течение 1 ч, затем рассчитывают время полувыведения препарата. У взрослых скорость эвакуации из желудка твердой пищи определяют обычно после ночного голодания. Пациент съедает яичницу-болтунью с серой, меченной технецием-99т, вместе с обычной пищей, затем в передней и задней проекциях производится сканирование каждые 15 мин в течение 1,5 ч с последующим подсчетом процентного содержания выведенного препарата. Не существует стандартных рационов, результаты исследования зависят от состава завтрака. Обычно пациенту предлагают завтрак, энергетическая ценность которого составляет 300 калорий. В состав завтрака входят яичница-болтунья, хлеб и масло; при этом опорожнение желудка составляет 63 % в 1 ч (± 11 %). 14. В каких клинических ситуациях целесообразно определять скорость опорожнения желудка с помощью радиоизотопных методов? Симптомы, связанные с нарушением моторики желудка, достаточно неспецифичны, а рентгенологическое исследование с использованием бариевой взвеси не позволяет дать количественную оценку скорости опорожнения желудка; кроме того, данное исследование нефизиологично. Методики определения скорости опорожнения желудка являются полуколичественными, что в значительной степени затрудняет трактовку результатов. Кроме того, эти методики не стандартизированы. Тем не менее определение скорости опорожнения желудка у определенных групп пациентов (например, у пациентов с сахарным диабетом и у пациентов, перенесших резекцию желудка) может быть весьма полезным, так как данный метод позволяет выяснить происхождение неспецифических клинических симптомов (см. рисунок).
Картина нормального опорожнения желудка. А. Начальное изображение в передней (А) и задней (Р) проекциях после приема пациентом коллоидной серы, меченной "Тс, с яичницей-болтуньей и бифштексом. Выявляется накопление препарата в дне желудка (F) в задней проекции с последующим поступлением его в антральный отдел желудка (an). В. Через 90 мин в дне желудка остается небольшое количество препарата, значительное количество его скапливается в антральном отделе желудка (an); кроме того, выявляется скопление препарата в тонкой кишке (S). С. Через 84,5 мин 50 % пищи покидает желудок (норма — 35-60 % для этой пищи) 15. Какие радиоизотопные методы исследования пищевода существуют и когда их следует применять? В клинической практике используется
три радиоизотопных метода исследования пищевода: исследование моторики
пищевода, исследование желудочно-пищеводного рефлюкса и выявление легочной
аспирации.
16. Какую роль играют радиоизотопные диагностические методы при обследовании пациентов с объемными образованиями печени? Традиционное сканирование печени и селезенки, при выполнении которого внутривенно вводится препарат, который захватывается купферовскими клетками, или коллоидный раствор серы или альбумина, меченных 99mТс, можно заменить ультразвуковым сканированием или компьютерной томографией, так как эти методы исследования имеют большую разрешающую способность и позволяют оценивать состояние близлежащих органов и тканей. Однако при невозможности постановки точного диагноза, например пациентам с жировой инфильтрацией печени (см. рисунок), целесообразно производить радиоизотопное функциональное сканирование. 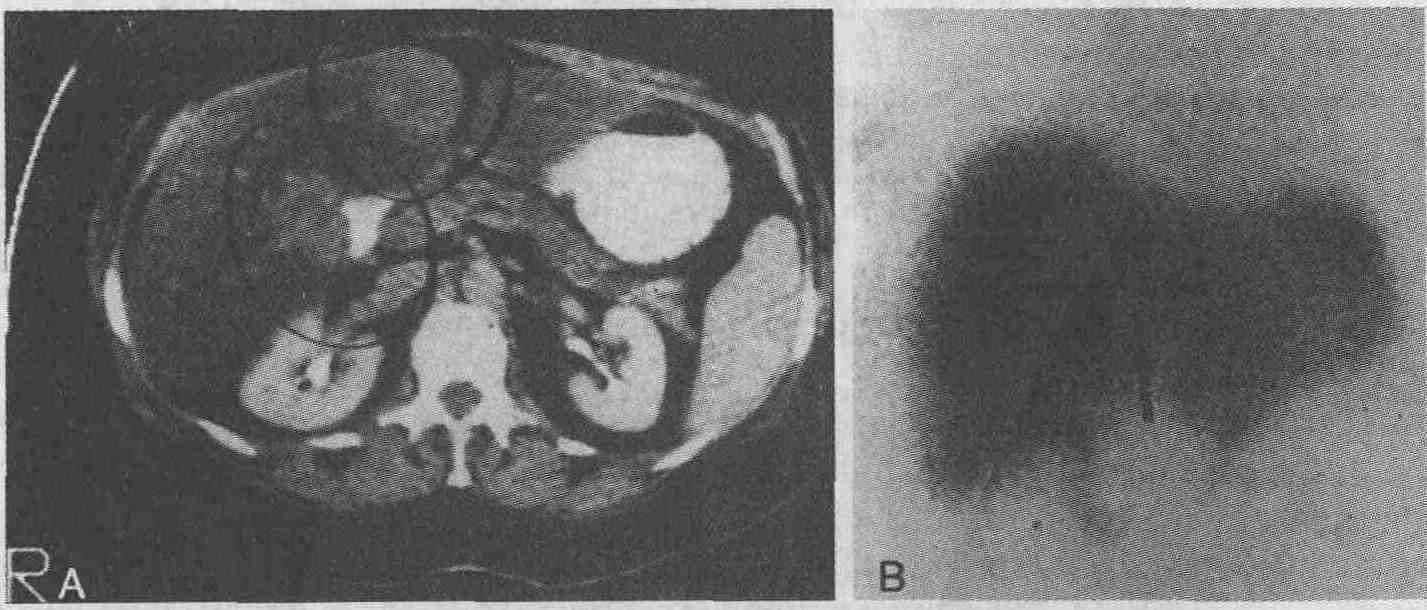
Исследование объемного образования в печени. А. При проведении компьютерной томографии печени с использованием рентгеноконтрастного вещества выявлены диффузная жировая инфильтрация печени и два участка, имеющие относительно нормальный вид (обведены кругами), у пациента с раком ободочной кишки после лечения 5-фторурацилом. Дифференциальную диагностику следует проводить между узловой регенерацией и метастатическим поражением печени. В. При визуализации этих патологических очагов крупным планом в передней проекции во время выполнения холесцинтиграфии метастазы выглядят как светлые дефекты наполнения (стрелка). Если же такие дефекты не выявлены, то обнаруженные объемные образования являются узлами регенерации Дифференциальная диагностика объемных образований печени, выявляемых при проведении радиоизотопных исследований
* Исключением являются метастазы в печени, обладающие сродством к галлию. 17. Какие методики радиоизотопного сканирования позволяют диагностировать ге-мангиомы печени? С помощью компьютерной томографии, магнитно-резонансной томографии и ультразвукового сканирования не всегда можно диагностировать гемангиомы печени. Отсроченная однофотонная эмиссионная компьютерная томография (ОЭКТ, трехмерная сцинтиграфическая визуализация, во многом сходная с КТ), при проведении которой происходит заполнение гемангиом эритроцитами, меченными "Тс, является наиболее чувствительным и специфичным методом диагностики гемангиом, размер которых превышает 2,5 см (см. рисунок). Вероятность выявления при проведении ОЭКТ мелких гемангиом (менее 1см) также весьма велика. Это связано с очень высокой избирательностью накопления препарата в гемангиомах. Отсроченная ОЭКТ является методом выбора при диагностике гемангиом печени. Однако, если гемангиомы располагаются вблизи кровеносных сосудов, бывает сложно отличить гемангиомы от сосудов, и в этом случае нужно использовать другие методы визуализации. Достаточно редко встречающиеся тромбированные гемангиомы и гемангиомы, претерпевающие фиброзное перерождение, с помощью ОЭКТ выявить также очень сложно. 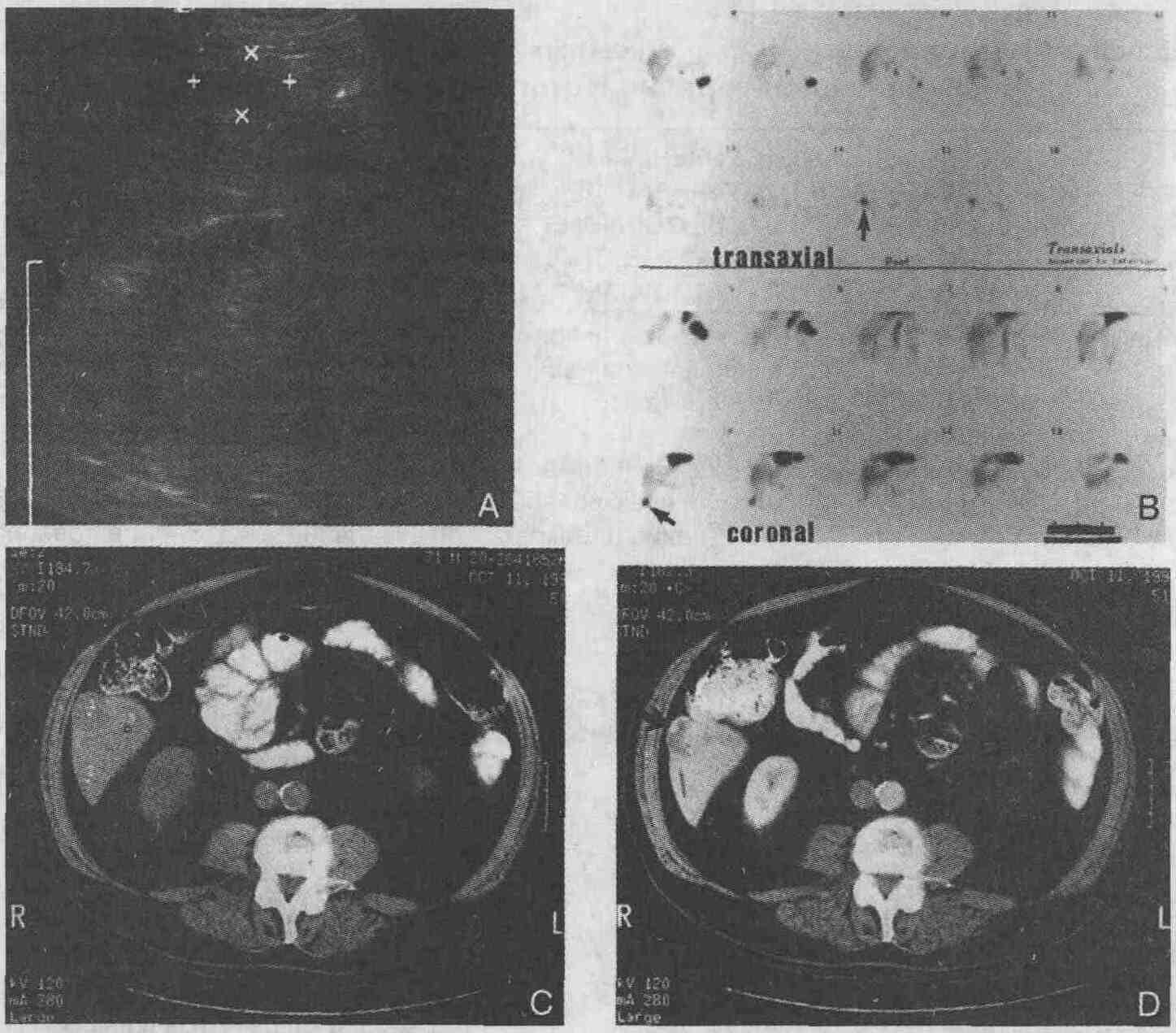
Гемангиома печени. А. При ультразвуковом сканировании выявляется 3-сантиметровое гипоэхо-генное образование, вид которого характерен для гемангиомы, но недостаточно специфичен. В. Через 2 ч при проведении ОЭКТ с введением эритроцитов, меченных 99mТс, определяется очаг повышенного накопления радиоизотопа в нижних отделах правой доли печени при реконструкции срезов в аксиальной и коронарной плоскостях (стрелки). С. При проведении контрастной компьютерной томографии выявляется центрипетальное (афферентное) заполнение узлов (стрелка), что позволяет подтвердить диагноз, установленный при проведении исследования с введением эритроцитов меченных 99mТс 18. Можно ли с помощью методов радиоизотопного сканирования выявлять эктопированную слизистую оболочку желудка? Являющийся основным источником желудочно-кишечных кровотечений у детей дивертикул Меккеля почти всегда содержит слизистую оболочку желудка. Так как 99mТс-пертехнетат избирательно накапливается в слизистой оболочке желудка, этот препарат является идеальным для определения локализации таких источников кровотечения, которые очень сложно выявить с помощью традиционных рентгенологических контрастных исследований с введением контрастных препаратов. Исследование включает в себя внутривенное введение пациенту пертехнетата и сканирование брюшной полости через 45 мин. Обычно эктопированная слизистая оболочка желудка визуализируется одновременно с желудком и не смещается во время исследования. Чувствительность метода при обнаружении кровоточащего дивертикула Меккеля составляет 85 %. Для увеличения чувствительности метода можно предварительно ввести пациенту циметидин (чтобы блокировать выведение пертехнетата в просвет кишки) и/или глюкагон (чтобы подавить моторику желудочно-кишечного тракта и предотвратить вымывание препарата). Такую же методику сканирования можно применять для выявления неудаленной слизистой оболочки антрально-го отдела желудка после хирургического вмешательства по поводу хронической язвы желудка; в этом случае чувствительность метода составляет 73 %, а специфичность — 100%. 19. Как проводится тест на всасывание витамина B12 (тест Шиллинга) и в каких случаях он применяется? Тест Шиллинга позволяет исследовать способность организма к всасыванию и выделению витамина В42. Поскольку существует много причин нарушения всасывания витамина В12исследование проводится поэтапно, на каждом этапе выявляются (или исключаются) наиболее вероятные причины недостаточности витамина В12. Хотя некоторые клиницисты при лечении пациентов с недостаточностью витамина В12 не устанавливают причины ее развития, определение этиологии заболевания очень важно для многих пациентов, так как могут быть обнаружены сопутствующие заболевания или нарушения, которые не предполагались. Нет никакой необходимости
(и даже нежелательно) назначать пациенту с выраженным дефицитом витамина
В12 его препараты до проведения теста Шиллинга. На первой и
всех последующих стадиях исследования пациенту вводят обычный (не меченный
радиоизотопом) витамин В12, 1 мг внутримышечно, чтобы "связать"
соответствующие рецепторы, а через 2 ч после этого пациент вместе с пищей
принимает витамин В12, меченный радиоактивным кобальтом. Необходимыми
условиями успешного проведения исследования являются воздержание пациента
от приема пищи в течение 3 ч до и после приема радиоактивного препарата
витамина В12 (чтобы избежать связывания меченого витамина В12
с пищей) и сбор всей выделяемой мочи в течение 24-48 ч после введения препарата.
Определяются концентрация креатинина в моче и суточный диурез. Пониженное
содержание креатинина в суточном объеме мочи может свидетельствовать о
неправильном сборе мочи для проведения анализа, что искусственно снижает
количество витамина В12, выделяемого с мочой. В собранной моче
выявляют радиоактивный кобальт. В норме менее 10 % дозы радиоактивного
кобальта, принятого внутрь, выделяется за 24 ч. Если выделение витамина
В12
за 24 ч находится в пределах нормы, это свидетельствует о его нормальном
всасывании в желудочно-кишечном тракте.
Алгоритм определения этиологии дефицита
витамина В12
20. Можно ли выявить добавочную селезенку с помощью методов радиоизотопного сканирования? Неэффективность спленэктомии,
выполненной в связи с идиопатической тромбоци-топенией, может быть связана
с тем, что у пациента осталась добавочная селезенка.
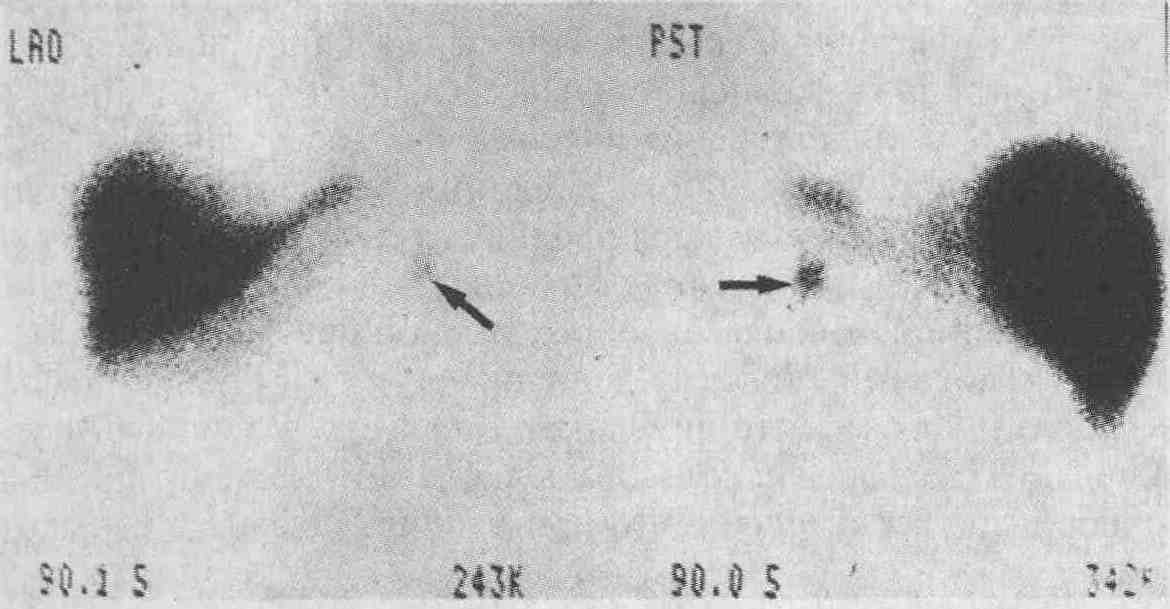
Добавочная селезенка у пациента, которому была произведена спленэктомия по поводу идиопати-ческой тромбоцитопенической пурпуры. Чрезвычайно высокая степень контрастирования, достигаемая при введении коллоидной серы, меченной 99mТс, позволяет визуализировать даже небольшие участки ткани селезенки (стрелка) и удалять их в дальнейшем. Показаны изображения, полученные при сканировании в левой передней косой (LAO) и задней (PST) проекциях. Если при проведении исследования с введением меченной радиоактивным технецием коллоидной серы получен отрицательный результат, целесообразно провести высококонтрастное специальное исследование, например сканирование с введением меченных эритроцитов, подвергнутых термической обработке, которые избирательно накапливаются преимущественно в селезенке, что позволяет в большинстве случаев установить наличие добавочной селезенки 21. Какие радиоизотопные методы сканирования можно применять для обследования пациентов с воспалительными заболеваниями кишки и абсцессами брюшной полости? Для обнаружения инфекционно-гнойных
очагов в брюшной полости применяется сканирование с введением галлия-67,
лейкоцитов, меченных 99mТс-НМРАО, и лейкоцитов, меченных индием-111.
22. Целесообразно ли применение радиоизотопных методов сканирования при постановке катетеров для артериальной перфузии? При установке артериальных катетеров, обеспечивающих перфузию печени, часто возникают сложности вследствие случайного обнаружения недиагностированных системных шунтов, смещения катетера и неизбежной сопутствующей перфузии областей, в которых нежелательно создавать высокую концентрацию высокотоксичных хи-миотерапевтических препаратов. Введение в катетер макроагрегированного альбумина (МАА), меченного 99mТс, вызывает микроэмболизацию на уровне артериол и позволяет получить изображение, по которому можно судить о площади участка перфузии, особенно при применении ОЭКТ. С помощью данной методики невозможно получить достоверные результаты при использовании рентгеноконтрастного вещества, так как оно быстро разводится на уровне артериол. 23. Целесообразно ли использовать радиоизотопные методы сканирования при установлении локализации источника желудочно-кишечного кровотечения или же в данном случае достаточно применения более простых методов? Сканирование с введением эритроцитов, меченных 99mТс, при выявлении транзиторных кровотечений является в большинстве случаев более чувствительным методом, чем ангиография (см. рисунок). Ранее существовало правило, согласно которому выявление источника желудочно-кишечного кровотечения с помощью радиоизотопных методов сканирования должно было всегда проводиться в качестве скринингового метода и предшествовать выполнению ангиографии. В настоящее время данное правило не всегда соблюдается. Однако при установлении локализации источника кровотечения радиоизотопное сканирование может оказаться полезным во многих случаях. Зная преимущества и недостатки всех методов, специалист может выбрать наиболее адекватное исследование в каждом конкретном случае. 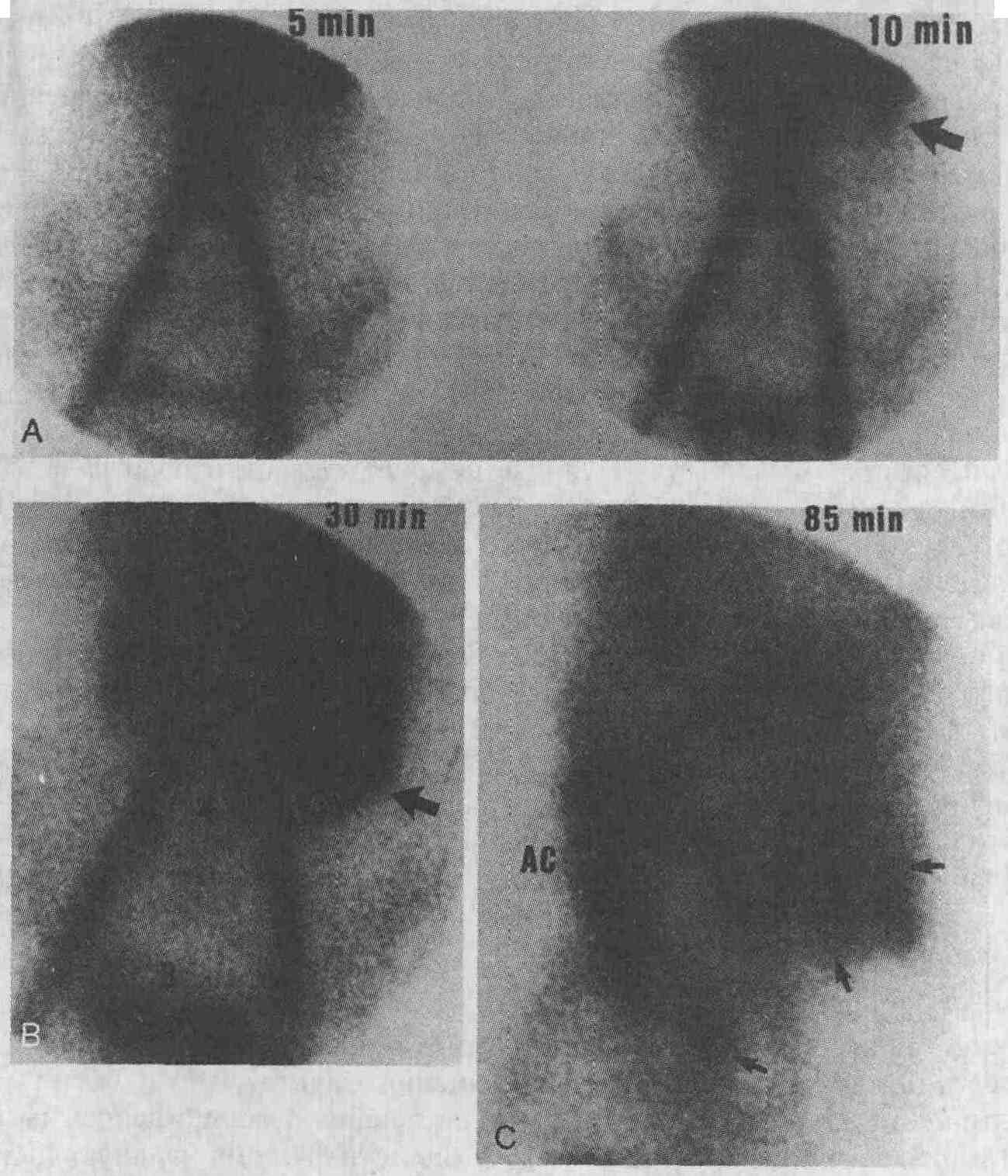
Кровотечение из тонкой кишки. После безрезультатного эндоскопического исследования на фоне продолжающегося кровотечения пациенту было выполнено радиоизотопное сканирование с введением меченных "Тс эритроцитов, в результате чего удалось обнаружить источник кровотечения, визуализирующийся вблизи селезенки (большая стрелка). При повторном сканировании, проведенном через 85 мин, было определено продвижение изотопа по тонкой кишке (маленькие стрелки) по направлению к нижнему правому квадранту брюшной полости. Эти данные подтвердили, что источник кровотечения находится в тонкой кишке. Во время операции было обнаружено, что источником кровотечения является низкая язва двенадцатиперстной кишки. (В — мочевой пузырь; АС — восходящая ободочная кишка) 24. Какие радиоизотопные методы сканирования целесообразно применять для выявления источника кровотечения из нижних отделов желудочно-кишечного тракта? Хорошо известно, что установление
локализации источника острого кровотечения из нижних отделов желудочно-кишечного
тракта сопряжено со значительными трудностями. Точное определение причины
кровотечения часто не имеет значения для выработки лечебной тактики, так
как лечение в любом случае подразумевает резекцию участка толстой кишки.
Даже остро возникающие и интенсивные кровотечения нередко являются преходящими
и поэтому часто не выявляются при выполнении ангиографии; в таких случаях
кровотечение диагностируют по наличию в просвете кишки крови, обнаруженной
при проведении эндоскопического исследования. Достаточно сложно выявить
источник кровотечения, локализующийся в дистальных отделах тонкой кишки,
недосягаемых для эндоскопа.
25. Как с помощью радиоизотопных методов сканирования оценить функциональную состоятельность перитонеально-венозного шунта? При увеличении объема живота у пациентов с перитонеально-венозным шунтом (LeVeen или Denver) прежде всего следует оценить функциональную состоятельность шунта, поскольку количество жидкости в брюшной полости может увеличиваться в результате нарушения проходимости шунта. Если шунт изготовлен из рентгенонегативного материала, рентгенографические исследования применять нельзя, и в любом случае для проведения таких исследований необходимо выполнять катетеризацию шунта. Поскольку жидкость по шунту протекает только в одном направлении, то очень сложно оценить функциональную состоятельность шунта при ретроградном введении контрастного вещества. Состоятельность шунта можно оценивать при внутриперитонеальном введении 99mTc-МАА и при последующем сканировании грудной клетки через 30 мин. При этом сам шунт может не визуализироваться, но определяется проникновение 99mTc-МАА в артериолы легких, что свидетельствует о проходимости шунта. Сравнительная характеристика методов, позволяющих установить локализацию источника желудочно-кишечных кровотечений
26. Можно ли обнаружить злокачественные новообразования в брюшной полости с помощью радиоизотопных методов сканирования? Традиционно неспецифическим
маркером новообразований и инфекционных очагов считается галлий-67. Этот
изотоп применяется при подозрении на наличие злокачественной опухоли. Данный
метод не позволяет определить стадию развития опухоли, но он полезен в
тех случаях, когда необходимо выяснить, не возникли ли рецидивы гепатомы,
ходжкинских и неходжкинских лимфом, поскольку при проведении анатомических
исследований достаточно сложно отличить некроз и рубцовые изменения от
рецидива опухоли. Трудности при использовании этого метода обусловлены
различной степенью поглощения препарата опухолями и выделением препарата
в просвет толстой кишки. Основная сложность заключается в том, чтобы отдифференци-ровать
проявления функциональной активности неизмененной кишки от проявлений функциональной
активности опухолевых клеток. Для этого применяется ОЭКТ, причем исследования
проводятся в течение недели (за это время галлий-67 выводится из просвета
кишки).
|