|
ГАСТРОЭНТЕРОЛОГИЯ
ГЛАВА 17. АУТОИММУННЫЙ ГЕПАТИТ 1. Что такое аутоиммунный гепатит? Аутоиммунный гепатит — это прогрессирующее воспаление печеночной ткани неизвестной этиологии, характеризующееся наличием антител в сыворотке крови и гипергаммаглобулинемией. При гистологическом исследовании ткани печени выявляется, по меньшей мере, перипортальный гепатит (ступенчатые (частичные) некрозы или пограничный гепатит). Заболевание быстро прогрессирует и может привести к развитию цирроза печени, портальной гипертензии, печеночной недостаточности и смерти. Поскольку патогномоничные симптомы заболевания отсутствуют, для постановки диагноза аутоиммунного гепатита необходимо исключить хронический вирусный гепатит, болезнь Вильсона, недостаточность альфа1-антитрипсина, гемохроматоз, лекарственный гепатит, алкогольный гепатит и неалкогольную жировую дистрофию печени, а также другие иммунные заболевания, такие как аутоиммунный холангит, первичный билиарный цирроз печени и первичный склерозирующий холангит. Тщательный сбор анамнеза, выполнение отдельных лабораторных тестов и квалифицированное исследование гистологических препаратов позволяют поставить правильный диагноз в большинстве случаев. Дифференциальная диагностика аутоиммунного гепатита
2. Каковы характерные признаки аутоиммунного гепатита? Заболевают преимущественно женщины (71 %). Аутоиммунный гепатит развивается в любом возрасте (от 9 месяцев до 77 лет), но обычно выявляется у пациентов моложе 40 лет. Возможно острое, даже молниеносное течение; при этом иногда ставится ошибочный диагноз острого вирусного или токсического гепатита. У 38 % больных имеются сопутствующие иммунные заболевания. Наиболее часто встречаются: аутоиммунный тиреоидит, неспецифический язвенный колит, болезнь Грейвса (Graves) (диффузный тиреотоксический зоб) и синовит. К сожалению, у 25 % больных аутоиммунный гепатит диагностируется уже на стадии цирроза печени, что указывает на его бессимптомное, субклиническое течение. Обычными иммуносерологическими маркерами аутоиммунного гепатита являются антигладкомышечные (ASMA) и антиядерные (ANA) антитела. У 64 % пациентов обнаруживаются оба типа антител, в то время как у 22 % — только SMA антитела, а у 14 % — только ANA антитела. Титр антител может колебаться; иногда они вообще исчезают, особенно во время лечения кортикостероидными гормонами. Минимального титра антител, на основании которого полученный результат относят к сероположительным, не существует, однако у взрослых пациентов титры должны быть > 1:40. Сывороточные титры > 1: 80 подтверждают правильность диагноза. Без гипергаммаглобулинемии (особенно повышении уровня IgG) — отличительного признака заболевания — диагноз считается недостоверным. Аутоиммунный гепатит не сопровождается выраженным холестазом. Поэтому преобладание таких изменений, как повышение уровня щелочной фосфатазы в крови, зуд, гиперпигментация и повреждение желчных протоков, выявляемое при гистологическом исследовании, предполагает наличие другого заболевания (например первичного билиарного цирроза, первичного склерозирующего холангита или аутоиммунного холангита). Серологические признаки острого инфекционного процесса — гепатита А, В или С, поражения печени вирусом Эпштейна-Барра или цитомегаловирусом — также свидетельствуют не в пользу диагноза аутоиммунного гепатита. Иммунные заболевания, сопутствующие
аутоиммунному гепатиту
3. Каковы морфологические изменения при аутоиммунном гепатите? Перипортальный гепатит (ступенчатые (частичные) некрозы или пограничный гепатит), характеризующийся разрушением пограничной пластинки в области ворот печени воспалительной инфильтрацией,— обязательный, но не патогномоничный признак аутоиммунного гепатита (рис. 1). Ступенчатые некрозы развиваются при многих типах острого и хронического гепатита, включая вирусный, лекарственный, алкогольный или токсический гепатит. Другая частая, но не имеющая диагностического значения патоморфологическая находка при аутоиммунном гепатите (особенно в случаях рецидива заболевания после отмены кортикостероидных гормонов) — дольковый (лобулярный) гепатит. Ему свойственна выраженная клеточная инфильтрация вдоль синусоидов в сочетании с дегенеративными или регенеративными изменениями (рис. 2). Для аутоиммунного гепатита также характерна инфильтрация портальных долек плазматическими клетками (рис. 3). Напротив, большие скопления лимфоцитов в области ворот печени и жировая дистрофия позволяют предположить наличие хронического гепатита С (рис. 4); крупные гепатоциты с матовостекловидной цитоплазмой присущи хроническому гепатиту В, а распространенные поражения или облитерация желчных протоков — холангиопатии. 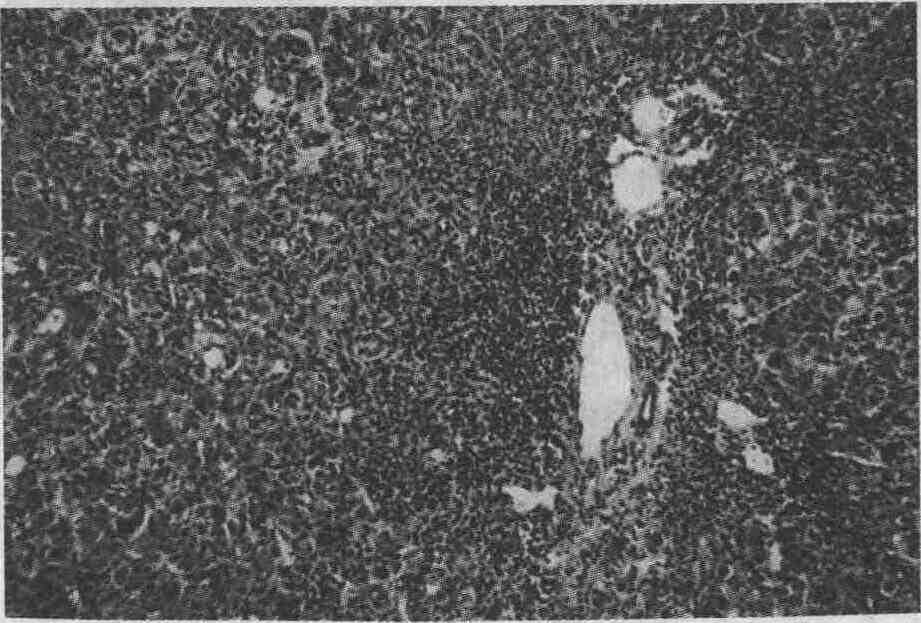
Рис. 1. Ступенчатый некроз. Пограничная
пластинка портальной дольки разрушена воспалительным инфильтратом (увеличение
х 100)
Рис. 2. Лобулярный гепатит. Воспалительная
клеточная инфильтрация вдоль синусоидов в сочетании с регенеративными или
дегенеративными изменениями гепатоцитов (увеличение х 200)
" Рис. 3. Плазмацитарная инфильтрация перипортальной области (увеличение х 400)
Рис. 4. Хронический гепатит С. Скопление лимфоцитов малых размеров в области портальной дольки, в цитоплазме гепатоцитов видны капли жира (увеличение х 200) 4. Назовите различные типы аутоиммунного гепатита. Классификация аутоиммунного
гепатита осуществляется в зависимости от типа антител, обнаруживаемых у
больных. Пациенты с SMА и/или ANA антителами страдают наиболее распространенным
в США и Западной Европе 1 типом аутоиммунного гепатита. Антитела
к актину, выявляемые в высоких титрах, также свидетельствуют о наличии
аутоиммунного гепатита 1 типа.
Подтипы аутоиммунного гепатита
5. Каковы диагностические критерии аутоиммунного гепатита? Диагностический критерий
аутоиммунного гепатита установлен согласно международному соглашению. Окончательный
диагноз предполагает обязательное обнаружение при гистологическом исследовании
ступенчатых некрозов с лобулярным гепатитом (или без такового) или мостовидными
некрозами (или без таковых). Недопустимо присутствие патологии, свидетельствующей
о возможном наличии другого заболевания (например повреждение желчных протоков,
гранулемы, отложения меди и т. д.). Любые изменения уровня аминотрансфераз
в сыворотке крови, если они являются доминирующими, считаются совместимыми
с диагнозом. Уровни общего глобулина, у-глобулина или иммуноглобулина G
должны превышать нормальные значения не менее чем в 1,5 раза; сывороточные
титры антигладкомышечных, антиядерных антител и антител к микросомам 1
типа печени и почек должны быть выше 1 :80. В анамнезе не должно быть фактов
переливания крови и ее компонентов, недавнего приема гепатотоксических
препаратов или злоупотребления алкоголем (< 35 г/сут для мужчин и 25
г/сут для женщин).
Шкала оценки, предложенная для диагностики
аутоиммунного гепатита
6. Являются ли антигладкомышечные, антиядерные антитела и антитела к микросомам 1 типа печени и почек патогенными? Хотя наличие SMA, ANA и LKM-1
антител положено в основу классификации аутоиммунного гепатита, сами антитела
не являются патогенными. Антиядерные антитела дают гомогенное или пятнистое
свечение в непрямой реакции иммунофлюоресценции на клеточных линиях НЕр-2.
Однако возможно также диффузно-гранулярное, центрометрическое, ядрышковое
или смешанные виды свечения. Анализ результатов исследования показал, что
пациенты с пятнистым свечением, как правило, моложе и имеют более высокий
уровень аспартатаминотрансферазы, чем больные с другими видами свечения.
Прогноз заболевания тем не менее никоим образом не зависел от вида свечения.
До сих пор не ясно, является ли пятнистое свечение результатом высвобождения
компонентов ядра при разрушении гепатоцита или иммунной реакции против
ядерного антигена, тормозящей функции клетки в критической ситуации. Антигладкомышечные
антитела свидетельствуют о наличии антител к актину или неактиновым компонентам
(тубулину, виментину, десмину и скелетину). AT к актиновым нитям, выявленные
в непрямой реакции иммунофлюоресценции на культуре фибробластов, высокоспецифичны
для аутоиммунного гепатита. Мишенью при этом является полимеризированный
F-актин, связанный с мембраной гепатоцитов. Хотя антитела к актину могут
содействовать развитию антителзависимых клеточно-опосредованных цитотоксических
реакций, прямых доказательств того, что они вызывают повреждение клеток
печени, нет.
Аутоантитела, связанные с аутоиммунным гепатитом
7. Какие еще антитела имеют значение при аутоиммунном гепатите? При аутоиммунном гепатите
выявляется множество других аутоантител, однако ни для одного их них не
доказана патогенность или клиническая значимость. Целью исследования является
идентификация и характеристика этих аутоантител, с тем чтобы иметь представление
об их возможных "мишенях" (аутоантигенах). Антитела к растворимому печеночному
антигену (анти-SLA) связываются с печеночными цитокератинами 8 и 18.
Они обнаруживаются только при аутоиммунном гепатите, но не образуют отдельную
клиническую подгруппу. Их наибольшее клиническое значение, по-видимому,
заключается в том, что у некоторых больных диагноз меняется с криптогенного
хронического гепатита на аутоиммунный. Антитела к ткани печени/поджелудочной
железы (анти-LP) обнаруживаются лишь у 17 % больных с аутоиммунным
гепатитом 1 типа, у 8 % больных с аутоиммунным гепатитом 2 типа и у 3 %
больных с хроническим гепатитом В или С. Напротив, их определяют в сыворотке
крови у 33 % больных, которые являются серонегативными, по всем обычным
антителам, выявляемым при заболеваниях печени. Поэтому анти-LP способны
указывать на наличие другого подтипа аутоиммунного гепатита. Анализ на
присутствие данных антител в сыворотке крови может оказаться полезным при
классификации больных с криптогенным хроническим гепатитом. Антитела
к асиалогликопротеиновым рецепторам (анти-ASGPR) являются специфичными
для аутоиммунного гепатита и связываются с предполагаемым аутоантигеном.
Антитела к анти-ASGPR человека обнаруживаются при всех типах аутоиммунного
гепатита, в т. ч. у 82 % больных с антигладкомышечными и/или антиядерными
антителами, 67 % больных с анти-LKM-1 и 67 % больных с анти-SLA. Аутоантитела
направлены против трансмембранного гликопротеина гепатоцитов. Они могут
захватывать и выделять потенциальные антигены, способствовать проникновению
в цитоплазму гепатоцитов, индуцировать пролиферацию Т-лимфоцитов и активизировать
Т-киллеры. Поскольку человеческие анти-ASGPR выявляются у 88 % больных
с аутоиммунным гепатитом и лишь у 7 % больных с хроническим гепатитом,
у 8 % больных с алкогольным гепатитом и алкогольным циррозом и 14 % больных
с первичным билиарным циррозом, это позволяет говорить об их специфичности
в диагностическом плане и использовать для наблюдения за активностью заболевания.
Реакционная способность аутоантител коррелирует с активностью воспалительного
процесса; в случае успешного лечения анти-ASGPR исчезают. Их отсутствие
позволяет выделить тех больных, у которых развитие рецидива после окончания
лечения менее вероятно.
8. Каково значение антимитохондриальных антител при аутоиммунном гепатите? Антимитохондриальные антитела (АМА) выявляются в непрямой реакции иммунофлюоресценции у 20 % пациентов с аутоиммунным гепатитом, однако их сывороточные титры низкие (< 1 : 160 в 88 % случаев). Патоморфологическая картина у этих пациентов не отличается от таковой у пациентов без АМА, а отложения меди, для окрашивания которых используется роданиновый краситель, отсутствуют или незначительны. Важно отметить, что такие пациенты, как правило, хорошо реагируют на терапию кортикостероидными гормонами. Больные с высокими титрами АМА могут страдать первичным билиарным циррозом печени и ошибочно расцениваться как анти-LКМ-1-отрицательные. В непрямой реакции иммунофлюоресценции аутоантитела распознаются следующим образом: АМА связываются с антигенами дисталь-ных канальцев почек мыши и париетальных клеток желудка мыши, а анти-LKM-l — с антигенами проксимальных канальцев почек мыши и паренхиматозных клеток мышиной печени. Тесное взаимодействие аутоантител с антигенами почечных канальцев может стирать имеющиеся в норме различия; при этом некоторые анти-LKM-l-положительные больные иногда ошибочно описываются как АМА-положительные. Антимитохондриальные антитела, специфичные для первичного билиарного цирроза печени (к субъединице Е2 пируватдегидрогеназы и/или разветвленной кетокислотной дегидрогеназе), выявляются только у 8 % больных с аутоиммунным гепатитом. Данные аутоантитела могут свидетельствовать о неправильно поставленном диагнозе, о наличии заболевания со смешанными признаками или о ложноположительном результате (в редких случаях). 9. Возможно ли наличие аутоиммунного гепатита при отсутствии традиционных аутоантител? У 13 % больных с тяжелым хроническим гепатитом этиология заболевания точно не известна. Такой гепатит называют криптогенным. Однако многие из этих больных несомненно страдают аутоиммунным гепатитом, который не удалось подтвердить при выполнении традиционных серологических тестов. У больных с криптогенным хроническим гепатитом возрастные показатели, половая принадлежность, HLA-фенотип, результаты лабораторных исследований и патоморфологические изменения аналогичны таковым у больных с аутоиммунным гепатитом 1 типа. Они хорошо реагируют на терапию кортикостероидными гормонами; ремиссия наступает у 83 % больных (при наличии традиционных маркеров аутоиммунного гепатита — у 78 %), а отсутствие эффекта от лечения отмечается у 9 % больных (при наличии традиционных маркеров аутоиммунного гепатита — у 11 %). Синонимом криптогенного хронического гепатита является серо-негативный аутоиммунный гепатит. Его следует отличать от криптогенной хронической болезни печени, под которой обычно подразумевается конечная стадия неактивного цирроза, и все характерные признаки заболевания отсутствуют. У серонегативных пациентов в последующем могут появиться антигладкомышечные и/или антиядерные антитела, а также менее традиционные аутоантитела (анти-SLA, анти-LP или анти-LC1). Балльная система оценки — лучший способ подтверждения диагноза (см. вопрос 5 данной главы). Серонегативных пациентов лечат так же, как и серопозитивных. 10. Каковы патогенетические механизмы развития аутоиммунного гепатита? Патогенетические механизмы развития аутоиммунного гепатита неизвестны, однако в настоящее время наиболее распространены две теории. По одной теории, в основе заболевания лежат антителозависимые клеточно-опосредованные цитотоксические реакции, по другой — клеточные цитотоксические реакции. Согласно первой теории, нарушение функции Т-лимфоцитов приводит к неконтролируемой продукции IgG В-лимфоцитами. Действие данных аутоантител направлено против неизмененных белков, входящих в состав мембраны гепатоцитов. Образующийся на поверхности гепатоцита комплекс антиген-антитело является мишенью для лимфоцитов, имеющих Fc-рецепторы к Ig (естественных киллеров). Для активации этих лимфоцитов не требуется предварительного взаимодействия с антигеном-мишенью. Таким образом, антигены гепатоцитов при присоединении к ним аутоантител приобретают специфичность, а лимфоциты завершают разрушение клеток. Согласно другой теории, на поверхности гепатоцитов имеются аутоантигены, специфические для данного заболевания и связанные с HLA-антигенами. При этом происходит сенсибилизация HLA-ограниченных иммуноцитов с последующим увеличением клона сенсибилизированных эффекторных клеток. Активированные иммуноциты (цитотоксические Т-лимфоциты) инфильтрируют ткань печени и разрушают гепатоциты, на поверхности которых представлены аутоантигены-мишени. Лимфокины облегчают клеточные взаимодействия, способствуют новой экспрессии антигенов HLA 2 класса, увеличивают количество аутоантигенов, расположенных на поверхности гепатоцитов, активируют иммуноциты и принимают непосредственное участие в разрушении клеток. Одновременно происходит внутриклеточная молекулярная адгезия, вызванная провоспалительными цитокинами, что способствует прикреплению эффекторных клеток к клеткам-мишеням и облегчает их разрушение. Общим для обеих теорий является генетически обусловленная повышенная иммуноре-активность больного и отсутствие четкой информации, касающейся природы и необходимости присутствия "пусковых" (триггерных) факторов. В качестве триггерного механизма, запускающего заключительную патогенетическую реакцию, могут выступать вирусные инфекции, лекарственные препараты и факторы окружающей среды. Тем не менее, согласно теории развития аутоиммунных заболеваний, "триггер" для них не требуется, зато свойственно появление (или постоянное присутствие) "запретных клонов". 11. Назовите возможные аутоантигены, способствующие развитию аутоиммунного гепатита. Аутоантигены-мишени, играющие роль в развитии аутоиммунного гепатита, неизвестны, однако для этого прекрасно подходят цитохром Р450 IID6 и асиалогликопротеиновые рецепторы. Они располагаются на поверхности гепатоцитов и являются мишенями для лимфоцитов, инфильтрирующих ткань печени в случае развития заболевания. При исследовании тканей обнаружены скопления лимфоцитов-хелперов в портальных дольках и рубцовой ткани, преобладание сенсибилизированных супрессорных/цитотоксических лимфоцитов в паренхиме печени вблизи очагов ступенчатого некроза, а также редкие В-лимфоциты и естественные киллеры. Такие находки в большей степени свидетельствуют в пользу клеточных иммунных реакций, нежели антителозависимых клеточно-опосредованных цитотоксических реакций, и делают Т-лимфоциты наиболее вероятными эффекторными клетками. Р450IID6 является 50-kDa микросомальным ферментом, который метаболизирует по меньшей мере 25 лекарственных препаратов, включая антигипертензивные средства (дебризоквин), бета-блокаторы, антиаритмические препараты и антидепрессанты. Он характеризуется генетическим полиморфизмом и отсутствует у 10 % людей. Асиалогликопротеиновый рецептор представляет собой трансмембранный гликопротеин, который способен образовывать и представлять многочисленные внутренние и наружные антигены. 12. Могут ли вирусы стать причиной развития аутоиммунного гепатита? Сообщается о возникновении аутоиммунного гепатита у пациентов, перенесших острый гепатит А или В, а также у больных, инфицированных вирусом иммунодефицита человека. Геном вируса кори более часто обнаруживается в клетках периферической крови у больных с аутоиммунным гепатитом, чем у здоровых исследуемых. А при проведении серологических исследований в странах, эндемичных по гепатиту С, у 44-86 % больных с аутоиммунным гепатитом были выявлены антитела к вирусу гепатита С (анти-HCV). Результаты первых иммунных исследований, направленных на обнаружение анти-HCV, искажались гипергаммаглобулинемией, сопровождающей аутоиммунный гепатит, и поэтому нередко оказывались ложноположительными. В более поздних исследованиях с использованием иммунных анализов второй и третьей генерации, а также полимеразной цепной реакции для выявления вирусной РНК в сыворотке крови такие находки стали более редкими, однако вероятность вирусной этиологии заболевания не исключалась. По последним оценкам, антитела к вирусу гепатита С и/или вирусная РНК имеются у 11 % больных с аутоиммунным гепатитом 1 типа и у 50—86 % больных со 2 типом заболевания. К сожалению, определить, являются ли вирусные инфекции причинами болезни или сопутствующими процессами, не представляется возможным, т. к. экспериментальные модели отсутствуют, а количество наблюдений перехода вирусного заболевания в аутоиммунный гепатит очень невелико. В настоящее время окончательный диагноз аутоиммунного гепатита ставится после исключения вирусной инфекции, а у больных с истинно инфекционным заболеванием и низкими титрами аутоантител диагностируется вирусный гепатит с неспецифическими признаками аутоиммунного. Важно отметить, что антиген Р450 IID6 обладает чертами, гомологичными с геномом вируса гепатита С и вируса простого герпеса 1 типа. В результате такой "молекулярной мимикрии" у больных с аутоиммунным гепатитом 2 типа и больных с хроническим гепатитом С не исключено образование перекрестнореагирующих антител. В дополнение следует сказать, что у больных с хроническим вирусным гепатитом редко обнаруживаются анти-LKM-l, хотя больные с анти-LKM-l часто поражены вирусом гепатита С. Доказательств того, что у этих больных имеются разные штаммы вируса, нет, а выработка анти-LKM-l, по-видимому, в большей степени связана с характерными особенностями самого больного, нежели с присутствием в его организме вируса. 13. Существует ли генетическая предрасположенность к аутоиммунному гепатиту? Факторами риска для аутоиммунного гепатита 1 типа в США и Западной Европе являются человеческие лейкоцитарные антигены (HLA) DR3 и DR4. В Японии заболевание связано с HLA DR4. В Америке 52 % больных с аутоиммунным гепатитом 1 типа являются HLA ВКЗ-положительными и 42 % — HLA ВК4-положительными (в т. ч. у 11 % обнаруживаются оба антигена). Для HLA B8 характерна прочная связь с HLA DR3 (в 94 % случаев); при этом он выявляется у 47 % больных. HLA фенотип А1-В8-DR3 встречается у 37 % пациентов с аутоиммунным гепатитом 1 типа и является классическим для данного заболевания. В противоположность ему, HLA B14, DR3 и С4А-QO присущи больным с аутоиммунным гепатитом 2 типа. Частота аллелей HLA B14 у больных с аутоиммунным гепатитом 2 типа составляет 26 % по сравнению с 4 % у здоровых исследуемых. У анти-НСУ-отрицательных больных HLA DR3 обнаруживается в 70 % случаев, a C4A-QO — в 90 % случаев. Таким образом, HLA фенотип позволяет выявить пациентов, предрасположенных к развитию аутоиммунного гепатита, однако сам по себе не определяет возникновение заболевания. Аутоиммунный гепатит не обладает выраженной семейной предрасположенностью, поэтому случаи семейного заболевания редки. Поскольку "причинный" ген не был описан, полагают, что возникновение заболевания не связано с каким-либо одним геном. Связь HLA фенотипа с развитием и течением заболевания
14. Влияет ли HLA фенотип на проявление и исход заболевания? У больных с аутоиммунным
гепатитом 1 типа фенотипы HLA DR3 и HLA DR4 характеризуются различными
клиническими проявлениями и ответными реакциями организма. HLA DR3 встречается
у более молодых пациентов с более активным течением заболевания (что оценивается
по уровням трансаминаз в сыворотке и выраженности патоморфологических изменений
— наличию сливающихся некротических очагов и цирроза), нежели у тех, у
кого HLA DR3 отсутствует. У больных с HLA DR3 рецидивирование гепатита
после окончания лечения также происходит чаще, чем у больных с другими
фенотипами. У них реже отмечаются ремиссии и чаще — ухудшения состояния
во время лечения кортикостероидными гормонами. Кроме того, им чаще требуется
пересадка печени.
15. Какие факторы определяют прогноз заболевания? Непосредственный прогноз заболевания зависит главным образом от активности воспалительного процесса, которая определяется с помощью традиционных биохимических и гистологических исследований. Активность аспартатаминотрансферазы в сыворотке крови в 10 раз выше нормальной. При пятикратном превышении уровня ACT в сочетании с гипергаммаглобулинемией (концентрация у-глобулинов должна быть по меньшей мере в 2 раза больше нормальных показателей) предполагает 3-летнюю выживаемость у 50 % больных и 10-летнюю выживаемость — у 10 % больных. У пациентов с более низкими показателями биохимической активности прогноз более благоприятный: 15-летняя выживаемость достигает у них 80 %, а возможность развития цирроза печени в течение этого периода времени составляет менее 50 %. Патоморфологические изменения также отражают тяжесть заболевания и определяют ближайший прогноз. При распространении воспалительного процесса между портальными дольками или между портальными дольками и центральными венами (мостовидные некрозы) 5-летний уровень смертности составляет 45 %, а частота развития цирроза печени — 82 %. Аналогичные результаты отмечаются у больных с полным разрушением печеночных долек (мультилобулярными некрозами). Сочетание цирроза с острым воспалительным процессом также имеет неблагоприятный прогноз: 58 % таких больных умирают в течение 5 лет, а 20 % — в течение 2 лет от кровотечения из варикозно расширенных вен. В отличие от них, для больных с перипортальным гепатитом (ступенчатыми некрозами) характерна довольно высокая (5-летняя) выживаемость; частота развития цирроза печени в течение этого времени составляет у них 17 %. Важно отметить, что при отсутствии таких осложнений, как печеночная энцефалопатия и асцит, снижающих эффективность терапии кортикостероидными гормонами, воспалительный процесс может самопроизвольно разрешиться у 13-20 % пациентов, невзирая на активность заболевания. 16. Какое лечение эффективно при аутоиммунном гепатите? Результаты многочисленных контролируемых клинических исследований свидетельствуют об эффективности лечения больных с тяжелой формой аутоиммунного гепатита преднизоном в сочетании с азатиоприном или только преднизоном в более высоких дозах. Обе схемы лечения одинаково эффективны; при этом возникает клиническая, биохимическая и гистологическая ремиссия заболевания, а также увеличивается выживаемость. Комбинированная терапия характеризуется меньшей частотой возникновения побочных эффектов по сравнению с монотерапией высокими дозами преднизона (10 % и 44 % соответственно), поэтому предпочтительна у тех больных, которые хорошо переносят азатиоприн. Она особенно показана женщинам в постменопаузе, больным с лабильной гипертензией, лабильным диабетом в легкой форме, эмоциональной неуравновешенностью, экзогенным ожирением, угрями или остеопорозом. Рекомендуемые схемы лечения
Показания к терапии кортикостероидами и критерии выбора схемы лечения
Монотерапия преднизоном показана беременным или планирующим беременность женщинам, больным, у которых имеются новообразования, а также тяжелая форма цитопении, связанная с гиперспленизмом. При монотерапии стероидными гормонами выраженные побочные эффекты не развиваются, если курс лечения составляет менее 18 месяцев, а доза преднизона не превышает 10 мг/сут. Поэтому данную схему можно использовать у больных, которым преполагается провести короткий (6 месяцев или менее) курс лечения. 17. Каковы показания к лечению кортикостероидами? Эффективность терапии кортикостероидными гормонами доказана только у пациентов с высокоактивным воспалительным процессом. Соотношение "польза-риск" у больных с менее выраженным воспалением неизвестно. Абсолютным показанием к лечению являются потеря трудоспособности, обнаружение при гистологическом исследовании мостовидных или мультилобулярных некрозов и сохраняющиеся выраженные биохимические изменения. Во всех других случаях решение о необходимости проведения стероидной терапии принимается в индивидуальном порядке, а лечение часто носит эмпирический характер. Терапия кортикостероидами не показана больным с неактивной или минимально активной формой цирроза, с декомпенсированным заболеванием печени и незначительной или минимальной активностью воспалительного процесса, а также пациентам, клиническая симптоматика у которых отсутствует и при гистологическом исследовании обнаруживается перипортальный гепатит. 18. Существуют ли факторы, позволяющие прогнозировать эффективность лечения? Таковых факторов, к сожалению, до сих пор не выявлено. Поэтому при наличии абсолютных показаний не следует a priori отказываться от лечения даже тех больных, у которых имеются цирроз печени, асцит или печеночная энцефалопатия. Основные показатели эффективности проводимой терапии — уровни аспартатаминотрансферазы, билирубина и у-глобулина в сыворотке крови. В течение 2-недельного курса лечения по меньшей мере у 90 % больных происходит улучшение хотя бы одного из перечисленных параметров, что позволяет прогнозировать выживаемость на ближайшее время с 98 % точностью. Напротив, отсутствие снижения уровня билирубина после 2-недельной терапии у больных с мультилобулярными некрозами неизбежно предвещает смерть в течение 6 месяцев. Таким больным показана пересадка печени. Декомпенсированная печеночная недостаточность развивается у 43 % больных, ремиссия у которых не наступила в течение 2 лет лечения, и у 69 % больных, не достигших ремиссии за 4 года. Обычно первым признаком декомпенсации является асцит, его наличие служит показанием к пересадке печени. Отдаленный прогноз заболевания зависит от достижения ремиссии и предотвращения развития печеночной недостаточности. 19. Каковы результаты терапии кортикостероидными гормонами? После 3-летнего курса лечения клиническая, биохимическая и гистологическая ремиссия наблюдается у 65 % больных. Средняя продолжительность курса лечения, необходимая для достижения ремиссии, составляет 22 месяца. Вероятность наступления ремиссии возрастает с каждым годом в течение первых трех лет лечения; улучшение состояния большинства больных (87 %) происходит именно в этот период. 5- и 10-летняя выживаемость больных при отсутствии цирроза печени превышает 90 %, в то время как 5-летняя выживаемость больных с циррозом печени составляет 80 %, а 10-летняя — 65 %. У 13 % больных развиваются побочные эффекты, что заставляет преждевременно прекратить проводимую терапию. К наиболее частым серьезным осложнениям относятся чрезмерное ожирение и различные косметические изменения (47 %). Реже причиной ограничения или прекращения лечения становятся остеопороз с компрессионными переломами позвонков (27 %), лабильный диабет (20 %) и образование хронических язв желудка и двенадцатиперстной кишки (6 %). Выраженные побочные эффекты у больных с циррозом развиваются чаще, чем у других пациентов. Возможно, это является следствием более высокой концентрации несвязанного преднизолона в сыворотке крови, образующегося в результате длительно существующей гипербилирубинемии и/или гипоальбуминемии, которые часто выявляются у больных с циррозом печени. Важно отметить, что факторов, позволяющих прогнозировать развитие побочных эффектов, не обнаружено. Поэтому всех нелеченных ранее больных, имеющих абсолютные показания к проведению стероидной терапии (включая женщин в постменопаузе), необходимо интенсивно лечить. Лечение оказывается неэффективным (несмотря на готовность выполнять все указания) у 9 % больных; у 13 % пациентов отмечается неполная ответная реакция. В течение 6 лет цирроз развивается у 36 % больных; у 50-86 % больных, достигших ремиссии, после окончания лечения развивается рецидив заболевания; и лишь у 14 % больных наступает стойкая ремиссия. Риск возникновения злокачественных новообразований других органов у больных, получающих иммуносупрессивные препараты в течение длительного времени, выше в 1,4 раза, чем у здоровых исследуемых того же пола и возраста (95 % доверительный интервал составляет от 0,6 до 2,9). Очевидно, терапия кортикостероидными гормонами не приводит к одинаковым результатам у всех больных и не является абсолютно безопасной. Это подчеркивает необходимость придерживаться жестких критериев отбора кандидатов для лечения. 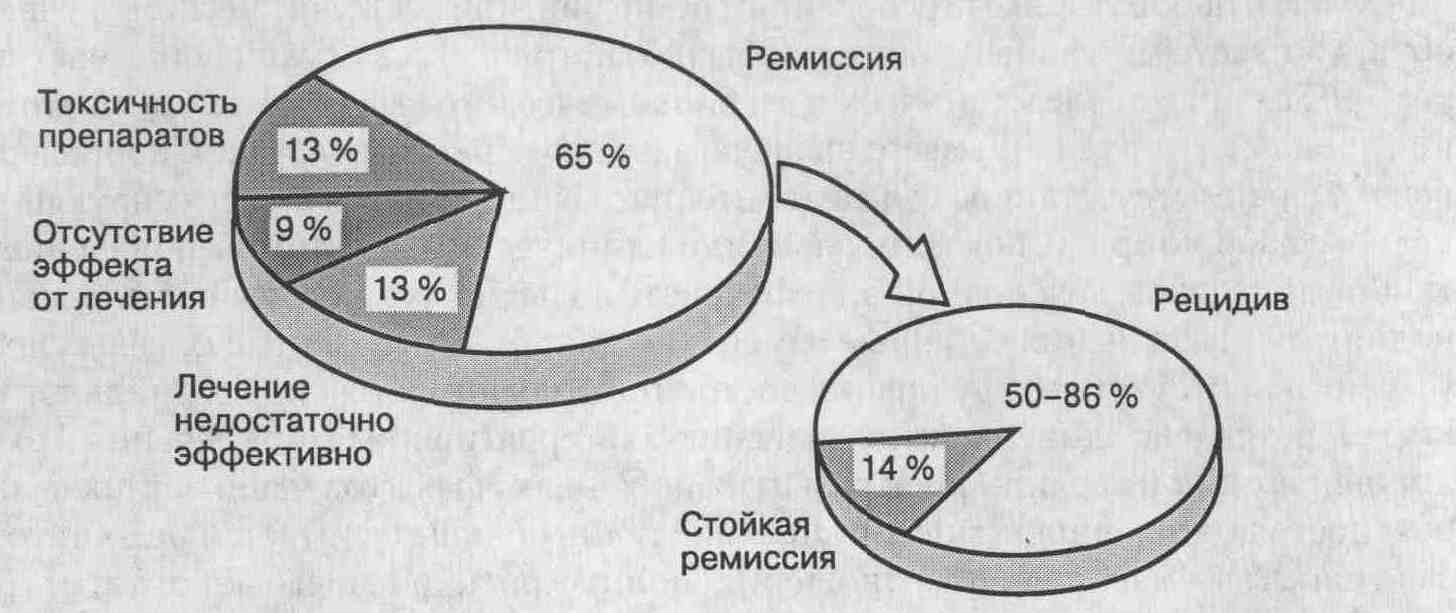
Варианты ответной реакции пациентов
на начальную терапию кортикостероидными гормонами
Частота развития и исходы субоптимальных ответных реакций при лечении кортикостероидными гормонами 20. Когда следует прекращать лечение? Лечение традиционными методами продолжают до наступления ремиссии, развития побочных эффектов, клинического ухудшения состояния (срыва компенсаторных реакций) или подтверждения факта недостаточной эффективности. Под ремиссией подразумевается отсутствие клинических симптомов, исчезновение лабораторных показателей, указывающих на активный воспалительный процесс, и улучшение гистологической картины (обнаружение нормальной ткани печени, неактивного цирроза или портального гепатита). Снижение уровня аспартатаминотрансферазы в сыворотке крови до уровня, в 2 раза превышающего норму, также свидетельствует в пользу ремиссии (при наличии других критериев). Для подтверждения ремиссии перед окончанием лечения следует выполнить биопсию печени, т. к. у 55 % больных, удовлетворяющих клиническим и лабораторным требованиям ремиссии, при гистологическом исследовании обнаруживается активный процесс. Обычно гистологическое улучшение наступает через 3-6 месяцев после клинического и биохимического выздоровления, поэтому лечение продолжают в течение всего вышеуказанного периода, после чего производят биопсию печени. Отсутствие эффекта от лечения характеризуется прогрессирующим ухудшением лабораторных показателей и/или клинических симптомов, появлением асцита или признаков печеночной энцефалопатии (несмотря на готовность больных выполнять все назначения). Данные изменения, так же как и развитие тяжелых побочных эффектов и отсутствие улучшения состояния больного в течение длительного времени, являются показанием к использованию альтернативной схемы лечения. После трех лет непрерывной терапии риск развития побочных эффектов начинает превышать вероятность достижения ремиссии. Лечение таких больных считается недостаточно эффективным, а уменьшение соотношения "польза-риск" оправдывает отказ от традиционной терапии в пользу альтернативной. 21. Предотвращает ли терапия кортикостероидными гормонами развитие цирроза печени? В течение 6 лет цирроз печени развивается у 36 % пациентов, хотя им проводится кортикостероидная терапия. Обычно он диагностируется на ранних, наиболее активных стадиях заболевания и редко — после наступления ремиссии. Цирроз печени ежегодно обнаруживается у 11 % больных в течение первых трех лет болезни, и у 1 % — в последующем (несмотря на рецидивирование гепатита или повторное лечение). Важно отметить, что возникновение цирроза печени во время и после лечения не увеличивает смертность. 5-летняя выживаемость таких больных составляет 93 %; вероятность развития у них варикозного расширения вен пищевода наблюдается в 13 % случаев, а кровотечения из верхних отделов желудочно-кишечного тракта — в 6 % случаев. Прогрессирование гепатита в цирроз печени, без сомнения, свидетельствует о трудностях на пути быстрого достижения полной и стойкой ремиссии. 22. Может ли на фоне аутоиммунного гепатита развиться гепатоцеллюлярный рак? У больных с аутоиммунным гепатитом и циррозом печени может развиться гепатоцеллюлярный рак. Если цирроз печени существует не менее 5 лет, то рак возникает в 7 % случаев; при наличии цирроза более 13 лет вероятность развития опухоли печени достигает 29 %; при этом риск появления злокачественного новообразования в 311 раз выше, чем у здоровых обследуемых. Эффективность динамического наблюдения за пациентами с аутоиммунным гепатитом и циррозом для выявления опухолей на ранних стадиях (когда лечение еще возможно), точно не известна. Следует отметить, что у 35 % всех пациентов с тяжелой формой аутоиммунного гепатита имеются отклонения от нормального уровня а-фетопротеина в сыворотке крови. Эти изменения обычно незначительно выражены (от 19,6 до 262 нг/мл) и нормализуются во время лечения кортикостероидными гормонами. Поздний подъем уровня а-фетопротеина позволяет предположить наличие злокачественного новообразования, однако и нормальное его значение не исключает диагноза опухоли. 23. В чем основная сложность лечения больных с аутоиммунным гепатитом? Основная проблема лечения больных с аутоиммунным гепатитом — рецидивирование заболевания после прекращения стероидной терапии. Рецидив заболевания после отмены препаратов у 50 % больных, достигших ремиссии, возникает в течение 6 месяцев и у 70 % — в течение 3 лет. Частота рецидивирования иногда достигает 86 % и возрастает после каждого повторного курса лечения. Риск рецидива заболевания уменьшается при увеличении продолжительности достигнутой ремиссии; так, у больных, находящихся в ремиссии не менее 6 месяцев, частота рецидивирования составляет всего 8 %. Некоторый риск тем не менее существует всегда, и рецидив аутоиммунного гепатита может возникнуть спустя несколько лет после лечения. Основной фактор, способствующий развитию рецидива заболевания,— преждевременная отмена лекарственных препаратов из-за боязни появления побочных эффектов или при исчезновении клинических симптомов и нормализации лабораторных показателей. У больных, на момент окончания лечения имевших перипортальный гепатит или цирроз печени, обязательно разовьется рецидив заболевания после прекращения лекарственной терапии. У больных с портальным гепатитом вероятность рецидива заболевания составляет 50 %, в то время как у больных с нормальной тканью печени — 20 %. Невозможность предотвратить рецидивы, по-видимому, отражает неспособность кортикостероидной терапии полностью и навсегда разорвать патогенетический механизм, лежащий в основе заболевания. У больных с HLA Al -B8-DR3 и больных с не исчезающими во время лечения аутоантителами к асиалогликопротеиновым рецепторам рецидивы заболевания отмечаются чаще, чем у тех, у кого данные находки отсутствуют. 24. Как лечить рецидив заболевания? Главным осложнением при повторном
курсе лечения в случае рецидива заболевания является развитие побочных
эффектов, что уменьшает эффективность (соотношение "польза-риск") традиционной
терапии. Частота возникновения побочных эффектов после первоначальной терапии
аналогична таковой при повторном назначении той же схемы лечения (29 и
33 % соответственно). Однако она увеличивается до 70 % при возникновении
второго рецидива и проведении третьего курса терапии. У больных с часто
рецидивирующим гепатитом рекомендуется использовать альтернативную схему
лекарственной терапии.
25. Что следует предпринять при неэффективности лечения? Терапия высокими дозами преднизона (60 мг/сут) или преднизоном (30 мг/сут) в сочетании с азатиоприном (150 мг/сут) в течение 2 лет вызывает клиническую и биохимическую ремиссию у 75 % пациентов. Ежемесячно дозы препаратов уменьшают, пока не достигнут стандартной поддерживающей дозы. К сожалению, гистологическая ремиссия наблюдается менее чем у 20 % пациентов, поэтому большинство больных, лечение которых оказалось неэффективным, становятся стероидозависимыми; у них сохраняется риск прогрессирования заболевания и развития побочных эффектов. У таких пациентов нередко возникает необходимость в пересадке печени, которая является прекрасным методом лечения при декомпенсированной форме заболевания. Пятилетняя выживаемость после трансплантации печени составляет 92 %; аутоантитела исчезают в течение 2 лет. Случаи рецидива аутоиммунного гепатита после пересадки печени описаны у больных, принимавших избыточные дозы иммунодепрессантов, и у HLA DRS-положительных больных, которые получили HLA DR3-отрицательные трансплантаты. 26. Какова наилучшая тактика ведения больных, у которых возникли побочные эффекты или лечение недостаточно эффективно? К сожалению, четкие рекомендации на сей счет отсутствуют, и подход к лечению в данном случае — чисто эмпирический. Дозы препаратов снижаются до минимальных или препараты отменяются вовсе (если это позволяет выраженность симптомов и биохимические показатели активности процесса). У таких больных может развиться декомпенсированная печеночная недостаточность и возникнуть необходимость в пересадке печени. Были предприняты отдельные попытки использования новых лекарственных средств, таких как циклоспорин (5-6 мг/кг/сут); после года наблюдений получены обнадеживающие результаты. Важно отметить, что больные постепенно приобретают зависимость от циклоспорина; у них также повышается риск развития отдаленных тяжелых осложнений. Поэтому циклоспорин до сих пор назначается эмпирически, а целесообразность его применения научно не доказана. 27. Какое лечение рекомендовано пациентам с признаками аутоиммунного и вирусного гепатита? К счастью, сочетание признаков аутоиммунного и вирусного гепатита встречается достаточно редко. При наличии абсолютных показаний к лечению выбор метода определяется преобладающими симптомами. Применение кортикостероидных препаратов у пациентов с хроническим вирусным гепатитом может усилить репликацию вируса, а лечение интерфероном больных с аутоиммунным гепатитом — вызвать обострение заболевания. Пациентов с аутоиммунным гепатитом и ложноположительными вирусными маркерами или серологически неопределенными признаками вирусной инфекции следует лечить кортикостероидными гормонами, так же как и больных с серологическими признаками перенесенного ранее вирусного заболевания (в настоящее время неактивного). Такие пациенты реагируют на терапию стероидными гормонами так же хорошо, как и те, у кого вирусные маркеры отсутствуют; ложноположительные результаты серологических реакций при этом могут быть отрицательными. У больных с истинным вирусным гепатитом и низкими титрами антиядерных и антигладкомышечных антител (титры < 1 : 320) отмечается преобладание вирусного заболевания с неспецифическими аутоиммунными признаками. Таким пациентам показано лечение рекомбинантным интерфероном. Больные с истинным вирусным гепатитом и высокими титрами антигладкомышечных и/или антиядерных антител (титры > 1 : 320), по-видимому, страдают обоими заболеваниями одновременно. Им рекомендован прием кортикостероидных гормонов под непрерывным врачебным контролем, т. к. интерферон способен привести к обострению процесса. У 53 % больных, леченных по этой схеме, наступает клиническая, биохимическая и гистологическая ремиссия, несмотря на сопутствующую вирусную инфекцию. Больные, не реагирующие на проводимую терапию, тем не менее переносят лечение вполне удовлетворительно. У пациентов с истинным вирусным гепатитом и анти-LKM-1 вероятно как сосуществование обоих заболеваний, так и вирусная инфекция, течение которой сопровождается аутоиммунной реактивностью. Эффективность применения интерферона или кортикостероидных гормонов у таких пациентов точно не доказана. В качестве начальной терапии им можно назначить интерферон, а в последующем — заменить его на кортикостероидные гормоны (в зависимости от полученных результатов). 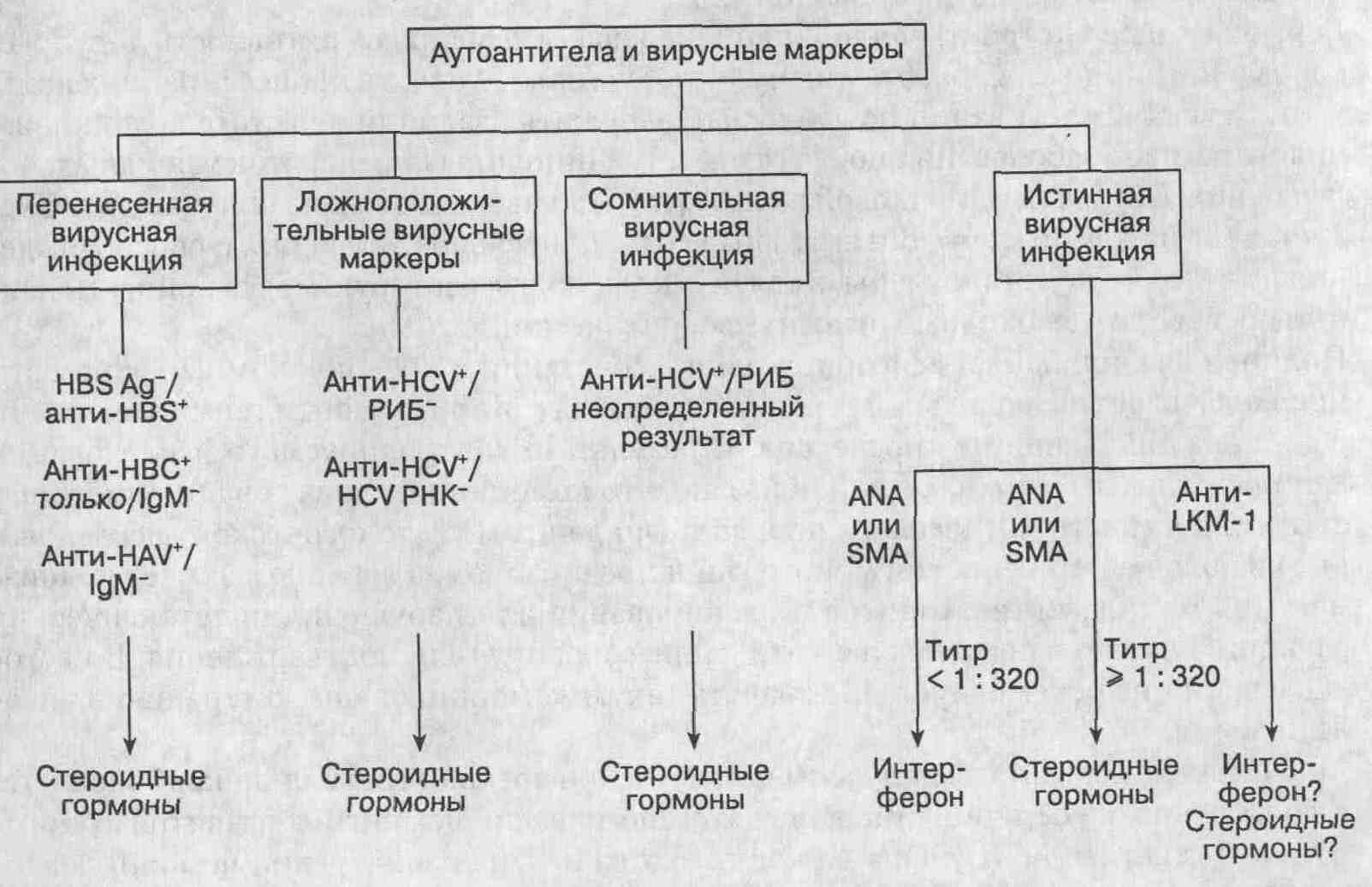
Тактика лечения пациентов, у которых обнаруживаются и аутоантитела, и вирусные маркеры (РИБ — рекомбинантный иммуноблоттинг) 28. Какие новые препараты оказывают хороший терапевтический эффект у пациентов с аутоиммунным гепатитом? Проводилось изучение нескольких
новых иммунодепрессивных и цитопротективных препаратов, но ни один из них
не обладает большим эффектом в лечении аутоиммунного гепатита, чем стандартная
терапия кортикостероидными гормонами. Циклоспорин обычно эмпирически
назначают пациентам, у которых терапия стероидными гормонами оказалась
неэффективной. Однако соотношение "польза-риск" и четкие показания к его
применению до сих пор не установлены. Предварительные немногочисленные
клинические исследования без использования слепого контроля показали, что
FK-506 снижает сывороточный уровень аминотрансфераз и билирубина на 50
% от исходного, однако такая терапия сопровождается повышением концентрации
креатинина на 150 %. В дополнение следует отметить, что четких доказательств
того, что применение FK-506 вызывает клиническую, биохимическую и гистологическую
ремиссию, нет, а исследования на животных позволяют предположить, что препарат
даже способствует развитию фиброзных изменений в печени. Урсодезоксихолевая
кислота способна изменять влияние HLA-антигенов I класса на мембрану
гепатоцитов и уменьшать образование лимфокинов. Это служит теоретическим
обоснованием ее назначения у пациентов с аутоиммунным гепатитом. Возможно,
улучшение биохимических показателей, отмечающееся у больных с хроническим
гепатитом, является результатом подобного иммуномодулирующего действия.
(Данные получены при проведении предварительных клинических исследований.)
Бреквинар
и рапамицин — это новые иммунодепрессивные препараты, которые используются
в транспланталогии, и теоретически должны быть эффективны при лечении больных
с аутоиммунным гепатитом. Тем не менее клинические исследования данных
препаратов еще не проводились.
|