ПРИМЕНЕНИЕ АНАЛЬГЕТИКА ЦЕНТРАЛЬНОГО ДЕЙСТВИЯ НЕФОПАМА ДЛЯ ПОСЛЕОПЕРАЦИОННОГО ОБЕЗБОЛИВАНИЯ У КАРДИОХИРУРГИЧЕСКИХ БОЛЬНЫХ
А. А. Еременко, Л. С. Сорокина, М. В. Павлов
ФГБУ Российский научный центр хирургии им. акад. Б. В. Петровского РАМН; Отделение кардиореанимации и интенсивной терапии, МоскваВ рандомизированном проспективном сравнительном исследовании использовали 3 схемы анальгезии: 1) контролируемую пациентом анальгезию (КПА) тримеперидином в сочетании с постоянной инфузией нефопама; 2) КПА тримеперидином в сочетании с болюсным дробным введением нефопама; 3) изолированную КПА тримеперидином в раннем послеоперационном периоде у кардиохирургических больных.
В исследование включены 60 пациентов в возрасте от 40 до 65лет по 20 человек в каждой группе. Эффективность обезболивания оценивали по 5-балльной вербальной шкале интенсивности боли и максимальной инспираторной емкости легких, измеренной методом побудительной спирометрии. Показана безопасность использования нефопама в раннем послеоперационном периоде у кардиохирургических пациентов. Сочетание КПА тримеперидином с нефопамом приводило к наиболее выраженному анальгетическому эффекту. Расход тримеперидина в группах с использованием нефопама был достоверно ниже, чем в группе изолированной КПА. В целом нежелательные эффекты были связаны с тримеперидином и зависели от его дозы. В группе изолированной КПА частота тошноты, рвоты, головокружения, слабости, пареза кишечника была достоверно выше, чем в двух других группах.
Ключевые слова: послеоперационная боль у кардиохирургических больных, контролируемая пациентом анальгезия, нефопам, тримеперидинTHE USE OF CENTRAL ACTING ANALGESIC NEFOPAM IN POSTOPERATIVE ANALGESIA IN CARDIAC SURGERY PATIENTS
Yeremenko A.A., Sorokina L.S., Pavlov М. V.
Federal State Budgetary Institution Petrovsky National Research Centre of Surgery under the Russian Academy of Medical Sciences, MoscowA prospective, randomized, comparative study was conducted. 3 analgesia protocols were used: 1) patient controlled analgesia (PCA) with trimeperidine in combination with a nefopam constant infusion; 2) PCA with trimeperidine in combination with a nefopam bolus; 3) PCA with trimeperidine separately during early postoperative period in cardiac surgery patients. The study included 60 patients aged from 40 to 65 years of age (20 patients in each group). The analgesia efficacy was evaluated with a 5-point verbal rating scale (VRS) for pain intensity and inspiratory lung capacity (ILC), measured with incentive spirometer. The safety of nefopam during early postoperative period in cardiac surgery patients was shown. The combination of nefopam and trimeperidine led to a more pronounced analgetic effect. Trimeperidine consumption was significantly lower in nefopam groups than in the group of isolated PCA. Wholly adverse effects were associated with trimeperidine and were dose-related. The incidence of nausea, vomiting, dizziness, weakness, bowel paresis was significantly higher in isolated PCA group than in the other two groups.
Key words: postoperative pain in cardiac surgery patients, patient controlled analgesia, nefopam, trimeperidineПроблема послеоперационного обезболивания не теряет своей актуальности. В последние годы принята концепция мультимодальной анальгезии, задачей которой является применение комбинации различных неопиоидных анальгетиков с целью улучшения качества обезболивания, снижения доз сильных опиоидов (обеспечение его опиоидсберегающего эффекта) и ограничения нежелательных осложнений всех компонентов анальгезии [1, 13—15]. В мультимодальных схемах применяются различные ненаркотические анальгетики (парацетамол, нестероидные противовоспалительные препараты) [2]. Среди анальгетиков особое место занимает препарат нефопам, представляющий собой рацемическую смесь двух энантиомеров и относящийся к ненаркотическим анальгетикам центрального действия [3]. Являясь ингибитором моноаминов, как, например, трамадол, нефопам отличается от него отсутствием морфиноподобного эффекта. Нефопам оказывает мультимодальное воздействие благодаря своему влиянию на многие мишени нейропластики, в отличие от трамадола его действие не нарушается антагонистами серотониновых 5НТЗ-рецепторов (например, ондансетроном) [4, 5]. К преимуществам относят также отсутствие влияния нефопама на агрегацию тромбоцитов и угнетающего воздействия на центральную нервную систему [6, 7].
Существуют многочисленные исследования по применению нефопама в абдоминальной хирургии, ортопедии и травматологии [8—10]. В то же время его эффективность для послеоперационного обезболивания у кардиохирургических больных не изучена.
Цель работы — оценка обезболивающего, опиоидсберегающего и нежелательных побочных эффектов нефопама в раннем послеоперационном периоде у кардиохирургических больных.
Материал и методы.
В исследование включены 60 больных, перенесших различные операции на сердце. Средний возраст пациентов 50,8 ± 10,8 года (от 40 до 65 лет). Дизайн исследования — рандомизированное проспективное сравнительное исследование. Все больные методом случайных чисел были распределены на 3 группы.
1-я группа: контролируемая пациентами анальгезия (КПА) тримеперидином в комбинации с нефопамом. Первую инъекцию нефопама (20 мг в течение 30 мин) вводили внутривенно за 30 мин до экстубации, далее осуществляли постоянную инфузию в дозе до 120 мг в сутки.
2-я группа: КПА тримеперидином в комбинации с дробным внутривенным введением 20 мг нефопама длительностью 30 мин каждые 4 ч. Первую инфузию нефопама в дозе 20 мг проводили за 30 мин до экстубации в течение 30 мин.
3-я группа: КПА тримеперидином в виде монотерапии. Использовали акупан (нефопам) фирмы "Биокодекс" (Франция) и промедол (тримеперидин) фирмы "Сотекс" (Россия).
КПА тримеперидином начинали через 2 ч после экстубации. Введение тримеперидина осуществляли в режиме "по требованию" на фоне постоянной инфузии (комбинированный режим). При этом концентрация этого препарата составила 2 мг/мл, начальная или насыщающая доза — 5 мг, болюсная доза — 3 мг, локаут-интервал — 6 мин, 4-часовая максимальная доза — 20 мг, скорость постоянной инфузии — 0,1 мг/ч.
По возрасту, полу, антропометрическим данным, видам оперативного вмешательства, особенностям интраоперационной общей анестезии, длительности ИК, ишемии миокарда и операции, продолжительности послеоперационной ИВЛ больные трех групп не отличались (табл. 1).
Таблица 1
Характеристика пациентов, включенных в исследование
Характеристика 1-я группа 2-я группа 3-я группа Мужчины/женщины 11/9 12/8 18/8 Средний возраст, годы 63,8 ± 10,2 57,6 ± 9,8 53,8 ± 10,8 Средний рост, см 169 ±8 172 ± 11 168 ±9 Средняя масса тела, кг 78 ±14 71 ±21 77 ±13 Протезирование клапанов 9 (45%) 4 (20%) 11 (55%) Аортокоронарное шунтирование 11 (55%) 14 (70%) 8 (40%) Операция на грудном отделе аорты 0 2 (10%) 1 (5%) Фентанил, мг/кг (интраоперационно) 0,018 ±0,001 0,02 ± 0,001 0,019 ± 0,001 Кетамин, мг/кг (интраопераци онно) 1,18 ±0,24 1,13 ±0,1 1,04 ±0,2 Время ИК, мин 96,7 ± 5,8 96,8 ± 5,1 96,1 ± 5,6 Время пережатия аорты, мин 69,6 ± 4,1 67,5 ±4,8 69,2 ±4,1 Длительность послеоперационной ИВЛ, ч 7,9 ± 1,34 7,8 ± 1,4 7,9 ± 1,34 Примечание. Различия между сравниваемыми группами статистически недостоверны.Операции производили под общей анестезией с использованием ИК и без него. Пациенты получали сбалансированную общую анестезию с применением севофлурана, пропофола, кетамина и фентанила при 40—60% содержании кислорода во вдыхаемой смеси. По дозам кетамина и фентанила пациенты сравниваемых групп не различались.
В ОРИТ всем больным проводили стандартные мероприятия интенсивной терапии и мониторинга. Длительность ИВЛ после операции составила от 5 до 10 ч и не различалась в сравниваемых группах. Время нахождения дренажей в полости средостения, перикарда и плевральных полостях составило в среднем 20,2 ±2,1 ч. Согласно стандартному протоколу, все пациенты перед операцией и в послеоперационном периоде получали Н2-блокаторы.
Критерии включения пациентов в исследование: срединная стернотомия, ранний послеоперационный период, уровень сознания — ясное или легкое оглушение, 14—15 баллов по шкале комы Глазго, возраст старше 12 лет.
Критерии исключения: наличие в анамнезе психических заболеваний и противопоказаний к назначению нефопама и индивидуальная непереносимость препаратов этой группы, печеночно-почечная недостаточность, периоперационные поражения головного мозга (ОНМК, постгипоксическая или метаболическая энцефалопатия), послеоперационное кровотечение более 1,4 мл/кг/ч, выраженная сердечно-сосудистая и/или дыхательная недостаточность, требующая проведения длительной ИВЛ (более 2 сут).
Интенсивность боли оценивали по 5-балльной вербальной шкале в покое и при глубоком вдохе и кашле.
В качестве дополнительного объективного критерия эффективности анальгезии использовали метод побудительной спирометрии. Максимальную инспираторную емкость легких (МИЕЛ) измеряли с помощью объемного спирометра Coach 2® (Intersurgical).
Первую оценку интенсивности боли и МИЕЛ проводили сразу после экстубации, затем каждые 2 ч в течение первых послеоперационных суток. Одновременно фиксировали показатели гемодинамики (АД и ЧСС).
Статистическую обработку проводили с помощью стандартного пакета Статистика 7, данные представлены в виде среднего значения со стандартным отклонением. Сравнение количественных показателей в двух группах проводили методом дисперсионного анализа. Для сравнения долей использовался критерий z с поправкой Йетса на непрерывность. Для определения зависимости использовали коэффициент корреляции Пирсона. Значение р < 0,05 считалось статистически значимым.
Результаты исследования и их обсуждение.
У больных 1-й и 2-й групп экстубацию трахеи выполняли на фоне терапевтических доз нефопама. Пациентам всех 3 групп введение тримеперидина во избежание депрессии дыхания на фоне остаточного действия общей анестезии начинали через 2 ч после экстубации.
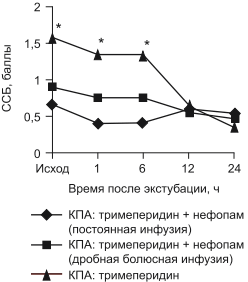
Сравнение динамики выраженности болевого синдрома (рис. 1) показало, что непосредственно после экстубации и через 1 ч интенсивность боли в 3-й группе была значительно выше, так как пациенты этой группы не получали дополнительного обезболивания в отличие от двух других групп, в которых за 30 мин до экстубации внутривенно вводили нефопам. Различия в 3-й группе по сравнению с двумя другими были статистически достоверны на первых трех этапах исследования, достоверных различий между 1-й и 2-й группой не отмечено. Вместе с тем уже после 6 ч отмечалось снижение интенсивности боли в 3-й группе, достоверно не отличающееся от двух других групп уже к 12-му часу. К концу 1-х суток интенсивность боли снижалась во всех 3 группах.
Рис. 1. Динамика среднего показателя степени боли в 1-е сутки после экстубации в исследуемых группах.
 Здесь и на рис. 2, 3: * —р < 0,05 по сравнению с другими группами.
Здесь и на рис. 2, 3: * —р < 0,05 по сравнению с другими группами.В проведенных нами ранее исследованиях было обнаружено, что если перед экстубацией трахеи пациентам не вводили анальгетических препаратов, они испытывали выраженную боль, степень которой достигала 3—4 баллов. В 1-й и 2-й группах активизации больных предшествовало введение нефопама, в результате чего выраженность болевого синдрома была значительно меньшей, чем в 3-й группе, где нефопам перед экстубацией не вводили. Это подтверждает и оценка эффективности обезболивания пациентами. Таким образом, полученные данные демонстрируют важность обезболивания перед началом активизации пациентов и возможность использования в этих целях внутривенную инфузию нефопама.
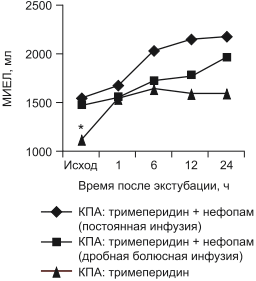
Поскольку боль при стернотомии и дренировании плевральных полостей приводит к ограничению экскурсии грудной клетки, анальгетический эффект нефопама оказывал положительное влияние на функцию внешнего дыхания, что отражает динамика максимальной инспираторной емкости легких, представленная на рис. 2. После экстубации трахеи в 1-й группе МИЕЛ составила в среднем 1555 ± 238 мл, к концу 2-го часа возросла до 1670 ± 245 мл, к концу 12-го часа — до 2150 ± 258 мл и к концу 1-х суток — до 2175±216 мл. Во 2-й группе МИЕЛ составила в среднем 1475 ± 216 мл, через 1ч — 1550 ± 229 мл, к концу 12-го часа — 1770 ± 211 мл и к концу 1-х суток — 1968 ±211 мл. В 3-й группе средняя МИЕЛ после экстубации трахеи составила 1110 ± 620 мл, к концу суток — 1600 ± 592 мл. Таким образом, средние значения МИЕЛ в 3-й группе достоверно отличались от полученных в двух других группах на первом этапе исследования, в дальнейшем различия были незначительными.
Рис. 2. Динамика максимальной инспираторной емкости легких в течение 1-х послеоперационных суток.
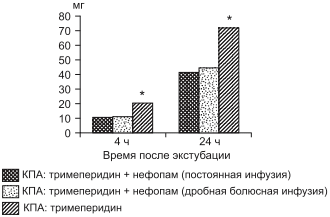
Наше исследование показывает, что нефопам обеспечивает достоверный опиоидсберегающий эффект, при этом побочные эффекты, связанные с нефопамом, отсутствуют. По данным различных исследований [11], общий морфинсберегающий эффект нефопама варьирует от 20 до 50% в зависимости от вида хирургического вмешательства и методологии применения и соответствует таковому для других ненаркотических анальгетиков, таких как нестероидные противовоспалительные препараты [12]. В нашем исследовании опиоидсберегающий эффект нефопама в 1-й и 2-й группах составил 42 и 38% соответственно. Расход тримеперидина на одного больного в сутки в 1-й группе в среднем составил 41,85 мг, во 2-й группе — 44,7 мг и в 3-й группе — 72,3 мг (рис. 3). Таким образом, обнаружено, что применение схем с использованием анальгетика центрального действия нефопама вызывает выраженный опиоидсберегающий эффект. Расход тримеперидина в 1-й группе был в 1,7 раза меньше (р < 0,05), а во 2-й группе — в 1,6 раза (р < 0,05) меньше, чем в 3-й.
Рис. 3. Средний показатель расхода тримеперидина (в мг) на одного больного в 1-е послеоперационные сутки.
Известно, что побочные эффекты различных обезболивающих препаратов могут приводить к осложнениям, увеличивающим продолжительность госпитализации, что может превосходить положительный эффект от обезболивания на хирургический стрессовый ответ [9].
Ранее с применением нефопама связывали 15—30% частоту возникновения побочных эффектов, особенно тошноты и головокружения [12]. Несмотря на то что данные побочные явления были связаны с быстрым введением препарата, эти явления, даже будучи незначительными, привели к некоторой настороженности при использовании этого препарата, когда он появился в 1970-х годах во Франции. Наши данные не подтверждают высокую частоту возникновения данных побочных явлений, поскольку частота тошноты, рвоты и головокружения в группах, где применялся нефопам, достоверно ниже, чем в группе изолированной КПА тримеперидином.
Результаты оценки побочных эффектов в трех исследуемых группах представлены в табл. 2. В 1-й группе у 1 (5%) больного, во 2-й группе у 3 (15%) была отмечена тошнота, у 1 (5%) и 1 (5%) больного соответственно — рвота. Причиной указанных побочных эффектов могло быть последействие общей анестезии и других препаратов, применявшихся во время операции и в раннем послеоперационном периоде. Эти же побочные эффекты наблюдали и в 3-й группе, в которой тошнота была отмечена у 7 (35%) пациентов, рвота — у 5 (25%), т. е. частота тошноты и рвоты в 3-й группе достоверно отличалась от двух других.
Таблица 2
Нежелательные эффекты анальгетической терапии
Побочный эффект КПА: тримеперидин + нефопам (постинфузия) КПА: тримеперидин + нефопам (дробная болюсная инфузия) КПА: тримеперидин Тошнота 1(5) 3(15) 7 (35)* Рвота 1(5) 1(5) 5 (25)* Сонливость 8(40) 10 (50) 12 (60) Слабость 8(40) 12 (60) 15 (75) Головная боль 3(15) 1(5) 3(15) Головокружение 3(15) 4(20) 8(40)* Парез кишечника 1(5) 1(5) 5 (25)* Примечание: В скобках—процент; * — р < 0,05 по сравнению с другими группами.Такие побочные эффекты, как слабость и сонливость, наблюдались в равной степени у больных всех трех групп. Они отмечались у 8 (40%) больных 1-й группы, у 10 (50%) 2-й группы и у 12 (60%) больных 3-й группы. Парез кишечника в 1-й группе и во 2-й отмечен соответственно у 1 (5%) и 1 (5%) пациента, а в 3-й группе данный симптом наблюдался у 5 (25%) больных, что, с нашей точки зрения, также объясняется побочным эффектом тримеперидина, поскольку его количество у больных, получавших нефопам, было минимальным. В 3-й группе головокружение встречалось в 2,6 раза чаще, чем в 1-й группе, и в 2 раза чаще, чем во 2-й, что также обусловлено побочным эффектом высоких доз тримеперидина.
Динамика ЧСС в 1-е послеоперационные сутки представлена на рис. 4. Динамика изменения ЧСС в 1-й группе имеет плавный характер, отмечается незначительный ее подъем после 1-го болюсного введения нефопама. При дробном болюсном режиме у 20 (50%) больных 1-й и 2-й групп на каждое введение отмечалось повышение ЧСС (на 7—25 в минуту, в среднем с 71 ± 1,4 до 81 ± 1,3, причем этот прирост был статистически значимым; р < 0,001). У остальных пациентов ЧСС при дробном введении либо не менялась, либо незначительно снижалась.
Рис. 4. Средний показатель ЧСС в 1-е послеоперационные сутки.
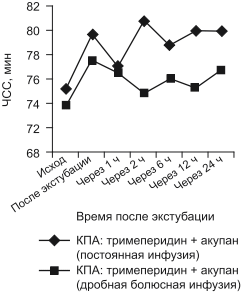
Однако следует отметить, что изменение средних значений частоты пульса в ответ на введение препарата в сравниваемых группах было недостоверно. При опросе среднего медицинского персонала было выяснено, что медсестры считают более удобной постоянную инфузию нефопама. Это связано со сниженной нагрузкой на персонал (отсутствие необходимости организации и проведения 40-минутных инфузий каждые 4 ч). Не было обнаружено статистически значимых различий в динамике артериального давления, а также в анализах свертывающей системы крови и объеме послеоперационной кровопотери в течение всего периода наблюдения.
Выводы
1. Проведенное исследование продемонстрировало безопасность использования анальгетика центрального действия нефопама в раннем послеоперационном периоде у кардиохирургических пациентов.
2. Сочетание КПА тримеперидином с нефопамом приводило к наиболее выраженному анальгетическому эффекту. Расход тримеперидина в группах с использованием нефопама был достоверно ниже, чем в группе изолированной КПА.
3. Введение нефопама перед экстубацией больных приводит к снижению выраженности болевого синдрома в среднем на 90% и делает возможной раннюю активизацию пациентов.
4. В целом нежелательные эффекты были связаны с тримеперидином и зависели от его дозы. В группе изолированной КПА частота тошноты (на 30 и 20%), рвоты (на 20%), пареза кишечника (на 20%) была достоверно выше, чем в 1-й и 2-й группах соответственно.
5. Учитывая тот факт, что у 50% пациентов дробное внутривенное введение нефопама сопровождалось возрастанием ЧСС в среднем на 10 в минуту, а также результаты опроса среднего медицинского персонала, у кардиохирургических больных предпочтительна постоянная инфузия нефопама.ЛИТЕРАТУРА
1. Kehlet Н, Dahl J. В. The value of "multimodal" or "balanced analgesia" in postoperative pain treatment. Anesth. Analg. 1993; 77: 1048—56.
2. Marret E., Kurdi O., Zufferey P. et al. Effects of non-steroidal antiinfammatory drugs on PCA morphine side-effects: meta-analysis of randomized controlled trials. Anesthesiology 2005; 102: 1249—60.
3. Elia et al. Does multimodal analgesia with acetaminophen, nonsteroidal antiinflammatory drugs, or selective cyclooxygenase-2 inhibitors and patient-controlled analgesia morphine offer advantages over morphine alone? Anesthesiology 2005; 103: 1296—304.
4. Stamer U. M. et al. Impact of CYP2D6 genotype on posroperative tramadol analgesia. Pain 2003; 105: 231—8.
5. Arcioni R. et al. Ondansetron inhibits the analgesic effects of tramadol: a possible 5-HT(3) spinal receptor involvement in acute pain in humans. Anesth. Analg. 2002; 94: 1553—7.
6. BhattA. М., Pleuvry B. J., Maddison S. E. Respiratory and metabolic effects of oral nefopam in human volunteers. Br. J. Clin. Pharmacol. 1981; 11:209—11.
7. Dordoni P. L., Della Ventura М., Stefanelli A. et al. Effect of ketorolac, ketoprofen and nefopam on platelet function. Anaesthesia 1994; 49: 1046—9.
8. Tirault M. et al. The effect of nefopam on morphin overconsumption induced by large-dose remifentanil during propofol anaesthesia for major abdominal surgery. Anesth. Analg. 2006; 102: 110—7.
9. Du Manoir B. et al. Randomized prospective study of the analgesic effect of nefopam after orthopaedic surgery. Br. J. Anaesth. 2003; 91: 836—41.
10. McLintock Т. Т., Kenny G. N., Howie J. C. et al. Assessment of the analgesic efficacy of nefopam hydrochloride after upper abdominal surgery: a study using patient controlled analgesia. Br. J. Surg. 1988; 75: 779—81.
11. Heel R. C., Brogden R. N., Pakes G. E., Speight Т. М., Avery G. S. Nefopam: a review of its pharmacological properties and therapeutic efficacy. Drugs 1980; 19: 249—67.
12. Hyllested М., Jones S., Pedersen J. L., Kehlen H. Comparative effect of paracetamol, NSAIDs or their combination in postoperative pain management: a qualitative review. Br. J. Anaesth. 2002; 88:199—214.
13. Еременко А. А., Аветисян М. И. Применение комбинированных анальгетиков в ранние сроки после кардиохирургических операций. Consilium Medicum. 2005; 2: 28—32.
14. Еременко А. А., Урбанов А. В., Аветисян М. И. Обезболивание при помощи трансдермальной терапевтической системы бупренорфина после кардиохирургических операций. Здравоохранение и медицинская техника. 2006; 4 (28): 4—7.
15. Лебедева Р. Н., Никода В. В. Фармакотерапия острой боли. М.: Аир-Apт; 1998.
16. Еременко А. А., Сорокина Л. С. Исследование контролируемой пациентом анальгезии тримеперидином в сочетании с кетопрофеном в послеоперационном периоде у кардиохирургических больных. Анестезиология и реаниматология. 2011; 6: 43—6.
| Апрель 2014 г. |