Опубликовано в журнале:
«BIOCODEX»; стр. 1-56.ЛЕЧЕНИЕ ИНФЕКЦИИ HELICOBACTER PYLORI У ДЕТЕЙ
Методическое пособие для врачей
Корниенко Е.А.Открытие H.pylori. и доказательство его ведущей роли в развитии боль- шинства гастродуоденальных заболеваний кардинальным образом изменило подход к их лечению. Хронический гастрит, язвенная болезнь, лимфома же- лудка, ассоциированные с Н.pylori (НР)-инфекцией, требуют проведения тера- пии, направленной на уничтожение микроба.
Показания к проведению эрадикационной терапии
Необходимость установления единого подхода к диагностике и терапии НР-инфекции, основанного на опыте лучших европейских исследователей, привела к созыву в г. Маастрихт (Нидерланды) в феврале 1996 г. конференции, организованной Европейской группой по изучению HР. На конференции был обсужден и принят документ под названием «Current European Concepts in the Management of Helicobacter pylori Infection - The Maastricht Consensus Report» (Маастрихт-1). В этом первом соглашении были установлены основные показания к эрадикации и рекомендованы оптимальные схемы лечения. Второй Консенсус (Маастрихт-2) был принят в 2000 г., показания были подразделены на обязательные и целесообразные.ОБЯЗАТЕЛЬНЫЕ ПОКАЗАНИЯ
Язвенная болезнь желудка и ДПК (в стадии обострения или ремиссии, включая осложнения) МALТома Атрофический гастрит Состояние после резекции по поводу рака желудка Пациенты, имеющие первую степень родства по отношению к больным раком желудка Желание пациентов (после полной консультации с лечащим врачом) ЦЕЛЕСООБРАЗНЫЕ ПОКАЗАНИЯ
Функциональная диспепсия Эрадикация НР является соответственным выбором Это приводит к длительному облегчению симптомов у части пациентов
ГЭРБ Эрадикация HP: Не связана с развитием ГЭРБ в большинстве случаев Не усугубляет уже имеющуюся ГЭРБ Эрадикация HP должна проводиться, однако у пациентов, требующих длительного, глубокого подавления кислотообразования
НПВС Эрадикация HP: Уменьшает случаи язв при последующем назначении НПВС Сама по себе не достаточна для предотвращения рецидива язвенного кровотечения у больных высокого риска, принимающих НПВС. Не ускоряет заживление язв желудка или ДПК у пациентов, получающих антисекреторную терапию на фоне приема НПВС Н. pylori и НПВС/аспирин - независимые факторы риска язвообразования. В 2005 г во Флоренции был принят последний, третий Консенсус (Маастрихт-3) по ведению инфекции Н.pylori. Целью его была выработка глобального подхода и анализ ключевых вопросов, в частности, показаний к эрадикации, стратегии и тактики ведения пациентов. Учитывая высокий уровень доказательности необходимости эрадикации HP в первой группе показаний (обязательных), принятых Консенсусом Маастрихт-2, они не подвергались повторному пересмотру. При выработке последнего Консенсуса Маастрихт-3 участники вернулись к обсуждению и принятию только тех показаний, которые значились, как целесообразные (ГЭРБ, функциональная диспепсия, прием НПВС). На основании анализа последних научных данных, была признана необходимость проведения эрадикации HP при функциональной диспепсии, поскольку морфологически при наличии HP-инфекции практически в 100% обнаруживается хронический гастрит, который является прогрессирующим заболеванием с определенным риском последующего язвообразования и малигнизации. Проведенные рандомизированные исследования показали, что после эрадикации HP улучшение состояния больных наблюдается в 50%, а полное исчезновение симптомов - у 30%. В то же время, при персистировании инфекции улучшение отмечается лишь у 38%, а исчезновение - у 18% [1]. Показания к эрадикации HP при ГЭРБ были обоснованы тем, что инфекция HP сопровождается гиперхлоргидрией у большинства пациентов, а после эрадикации секреторная функция нормализуется. Эрадикация HP не повышает риск развития ГЭРБ в сравнении с терапией ингибиторами протонной помпы (ИПП). Напротив, монотерапия ИПП, снижая желудочную секрецию, способствует распространению HP и заселению им тела желудка, что сопровождается развитием фундального гастрита с более высоким риском атрофии. Целесообазность эрадикации HP при необходимости приема нестероидных противовоспалительных препаратов (НПВС) была аргументирована повышением риска язвообразования при сочетании двух ульцерогенных факторов ( H.pylori. и НПВС). Так, по данным C.O'Morein [2], эрозивно-язвенное поражение гастродуоденальной зоны при наличии этих двух факторов выявляются у 55% больных, при отмене НПВС уменьшаются в 2 раза, а при эрадикации HP - в 5 раз. Таким образом, повторный пересмотр целесообразных рекомендаций подтвердил необходимость проведения эрадикации HP при функциональной диспепсии, ГЭРБ и приеме НПВС.
Консенсус Маастрихт-3 впервые включил показания к эрадикации HP при двух внежелудочных состояниях: железодефицитной анемии (ЖДА) и идиопатической тромбоцитопенической пурпуре (ИТП). Роль HP в развитии ЖДА была доказана на основании выявления дефицита железа вследствие потребления его микроорганизмом, а также восстановлением показателей после эрадикации HP. Целесообразность эрадикационной терапии при ИТП была доказана снижением уровня антитромбоцитарных антител у больных после эрадикации HP.
Таким образом, в соответствии с рекомендациями Консенсуса Маастрихта, показаниями к эрадикации HP являются:
1. Язвенная болезнь желудка и (или) двенадцатиперстной кишки (независимо от стадии)
2. MALT-ома желудка
3. Атрофический гастрит
4. Состояния после резекции по поводу рака желудка
5. Близкие родственники больных раком желудка
6. Функциональная диспепсия
7. Гастроэзофагеальная рефлюксная болезнь
8. Длительный прием нестероидных противовоспалительных препаратов
9. Железодефицитная анемия неясного генеза
10. Идиопатическая тромбоцитопеническая пурпураПедиатрические аспекты инфекции H.pylori. впервые обсуждались в 1997 году в г. Эшторил (Португалия) по инициативе Европейской Группы по изучению H.pylori. затем обсуждение было продолжено на состоявшихся в Будапеште второй (1998 г.) и в Хельсинки третьей (1999 г.) встречах педиатров-экспертов [3, 4]. Итогом работы явилось формирование рабочего алгоритма обследования и лечения детей, включающего следующие этапы:
1. Выявление H.pylori. с помощью неинвазивного метода (желательно, дыхательного теста) у ребенка с жалобами на боли в животе (в сочетании с другими жалобами или без них) в течение более 2 недель.
2. Проведение эрадикационной терапии.
3. При отсутствии эффекта - проведение обследования H.pylori.позитивных больных с применением эзофагогастродуоденоскопии.
4. Проведение повторной эрадикации H.pylori. при обнаружении язвенного дефекта (по другой схеме в соответствии с чувствительностью).
5. Проведение лечения при обнаружении гастродуоденита (тактику терапии определяет врач в соответствии с чувствительностью).
6. Проведение исследования на присутствие H.pylori. с помощью неинвазивного метода (желательно, дыхательного теста) через 2 недели и 6 месяцев после окончания терапии.Принятые в Риме в 1999 г рекомендации ESPGHAN по ведению инфекции H.pylori. предусматривают простой алгоритм показаний к эрадикации:
1. Дети должны обследоваться на HP, когда симптоматика наводит на мысль об органическом заболевании, а выраженность симптомов оправдывает риск терапии.
2. Если HP обнаружен при эндоскопии, лечение должно быть назначено.Педиатрические аспекты инфекции HP обсуждались и при принятии Консенсуса Маастрихт-3, в частности, были подчеркнуты следующие положения:
- У детей нельзя ограничиваться только язвенной болезнью как показанием к эрадикации.
- При несвоевременном лечении HP у детей высок риск развития атрофии слизистой оболочки желудка, что повышает потенциальный риск развития рака.
- Железодефицитная анемия у детей, не связанная с язвой, после полного обследования может быть показанием к эрадикации HP.
Важные требования к эрадикационной терапии HP-инфекции были опубликованы в «Рекомендациях по диагностике и лечению инфекции HP у взрослых при язвенной болезни желудка и двенадцатиперстной кишки» Российской Гастроэнтерологической Ассоциации и Российской группы по изучению HP [5]:
- Достигать в контролируемых исследованиях уничтожения HP, как минимум, в 80% случаев при продолжительности курса не более 7-14 дней;
- Вызывать не более 5% побочных эффектов, требующих вынужденной отмены терапии врачом или прекращения пациентом приема лекарств по схеме, рекомендованной врачом;
Компоненты эрадикационной терапии
Антибиотики
В отличие от многих микроорганизмов, HP in vitro чувствителен к большинству антимикробных препаратов. Еще в 1988 г. в исследованиях McNulty С.A.M. и Dent J.С. [6] показали его чувствительность к 21 антибактериальному агенту. Сводные данные результатов исследований разных авторов представлены в таблице:
Препарат МПК-90(мг/л) Крайние значения МПК-90 Пенициллин 0.03 0.002-0.06 Ампициллин 0.03 0.008-0.12 Цефуроксим 0.12 0.12-0.25 Цефокситин 0.12 0.15-0.5 Цефалексин 0.5 0.25-2 Цефсулодин 16 8-16 Эритромицин 0.25 0.008-0.25 Ципрофлоксацин 0.5 0.06-0.5 Офлоксацин 0.25 0.12-0.25 Фуразолидон 0.25 0.03-0.5 Гентамицин 0.25 0.06-0.5 Тетрациклин 0.25 0.12-1 Рифампицин 1 0.12-2 Метронидазол 4 0.5-4 Тинидазол 4 0.5-32 Циметидин 3200 400-3200 Ранитидин 1280 320-1280 Фамотидин 1024 128-1024 Омепразол 1000 1000 Сукральфат 3200 400-3200 Де-нол 16 2-32 Висмута субсалицилат 25 25-64 Рокситромицин 0.25 0.25-0.64 Ранитидин-висмут-цитрат 16 - Висмута субгаллат 32 - Висмута субнитрат >128 - Как видно из таблицы, HP чувствителен к подавляющему большинству антибиотиков пенициллинового ряда и большинству цефалоспоринов (цефуроксиму, цефокситину, цефалексину), причем их минимальная подавляющая концентрация для 90% бактерий (МПК-90) не превышает 0,5 мг/л. Макролиды и фторхинолоны in vitro также проявляют достаточно высокую активность в отношении HP, их МПК-90 ниже 0,5 мг/л. Весьма эффективны и антибиотики других групп (нитрофураны, гентамицин, тетрациклин, рифампицин). Метронидазол обладает активностью средней степени. HP устойчив к ванкомицину, цефсулодину, триметоприму и сульфаниламидам, поэтому эти антибактериальные используют при его культивировании для подавления конкурентной флоры. Среди противоязвенных средств ни одно не обладает существенной активностью против HP in vitro, кроме солей висмута: трикалия дицитрата (Де-нола), субсалицилата, субгаллата.
Несмотря на активность in vitro при назначении in vivo вышеперечисленные антибактериальные препараты отнюдь не отличаются столь же высокой эффективностью. Одной из причин этого является снижение их активности в кислой среде желудка. Исследования, проведенные McNulty С.A.M. [7], показали, что активность пенициллина и ампициллина в условиях кислой среды снижается более, чем в 10 раз, цефалексина - в 16 раз, ципрофлоксацина - в 10 раз, а эритромицина - более, чем в 100 раз. Макролиды последнего поколения (кларитромицин, вильпрафен), в отличие от эритромицина, гораздо более устойчивы в кислой среде [8]. Незначительное изменение активности наблюдается у тетрациклина и фуразолидона. Активность же метронидазола и Де-нола не изменяется при кислых значениях рН [9], поэтому они успешно применяются в лечении НР-инфекции.
Другой причиной снижения эффективности антибактериальных препаратов in vivo является неспособность некоторых их них накапливаться в слизи, покрывающей желудочный эпителий. Неионизированные молекулы эритромицина и ципрофлоксацина из слизистой оболочки быстро диффундируют в просвет желудка. При меньших значениях рН возможен их переход в ионизированную форму и задержка в слизистом слое, но снижение рН само по себе приводит к их почти полному разрушению. Поэтому эритромицин практически не эффективен при лечении НР-инфекции. В отличие от эритромицина, кларитромицин и рокситромицин отличаются хорошим проникновением в ткани и слизистый слой [10]. Ципрофлоксацин и другие фторхинолоны применяются в стартовой терапии хеликобактериоза еще и потому, что при их назначении очень быстро формируются резистентные штаммы ко всей группе хиноловых препаратов [11].
Амоксициллин - один из наиболее эффективных антибиотиков, применяемых при лечении HP ассоциированных заболеваний. Препарат относится к группе бета-лактамных антибиотиков, подгруппе аминопенициллинов. При низких значениях рН амоксициллин сохраняет высокую активность. Максимальную активность проявляет при нейтральных значениях рН [12]. Является амфотерным соединением и при рН 3-6 проникает в ткани несколько хуже, тогда как в слизь, которая на 90% состоит из воды - способен проникать в большей степени [13], что позволяет добиться высокой его концентрации в слизистой желудка (вплоть до собственной пластинки слизистой оболочки) и в желудочном содержимом. Механизм воздействия амоксициллина на HP заключается в ингибировании процессов синтеза в мембране бактериальной клетки пенициллин-связывающих белков (ПСБ) - ферментов, осуществляющих завершающие стадии биосинтеза основного компонента клеточной стенки микроорганизма - пептидогликана [14]. Это приводит к нарушению синтеза клеточных оболочек и лишает микробную клетку способности противостоять осмотическому градиенту, что приводит к набуханию и разрушению ее стенок. То есть, он оказывает бактерицидное действие, тогда как подавляющее большинство других бета-лактамов являются бактериостатическими. Данное обстоятельство объясняет нецелесообразность применения для лечения HP других антибиотиков данной группы (в том числе и родственного ампициллина).
Побочными эффектами, свойственными амоксициллину, являются: диарея, аллергические реакции и псевдомембранозный колит. При проведении антихеликобактерной терапии детям рекомендуется суточная доза 50 мг/кг в 2 приема до или после еды. При приеме амоксициллина до еды его местное антибактериальное действие усиливается.
При лечении HP инфекции широко применяется производное нитроимидазола - метронидазол. Его действие не зависит от рН среды. Под действием бактериальных нитропродуктаз происходит внутриклеточное восстановление нитрогруппы нитроимидазолов. Активные производные оказывают цитотоксическое действие: образуют комплексы с ДНК, вызывая ее дегидратацию, нарушая процессы синтеза в делящихся и покоящихся клетках, что приводит к бактерицидному эффекту.
Побочные эффекты метронидазола включают гастроинтестинальные симптомы, гепатотоксическое действие. При проведении антихеликобактерной терапии метронидазол рекомендуют назначать по 15-20 мг/кг в сутки в два приема после еды.
HP весьма чувствителен к тетрациклину, который ингибирует бактериальный синтез белка и, подобно амоксициллину, проявляет интралюминальную активность, причем даже при низких значениях рН [15]. В литературе нет сообщений о резистентности HP к тетрациклину, но этот препарат дает довольно большое количество побочных реакций: оказывает гепатотоксическое действие, вызывает тошноту, а также стойкое повреждение растущих зубов, вследствие чего не рекомендуется для использования у детей до 12 лет.
Эффективность другой группы антибиотиков - макролидов, в отношении HP была доказана во многих исследованиях [16]. Основу химической структуры макролидов составляет макроциклическое лактонное кольцо. Все они обладают противовоспалительным и иммуномодулирующим действием, накапливаясь в клетках организма (в том числе и в полиморфно-ядерных лейкоцитах) и влияя на миграцию нейтрофилов, окислительные реакции в фагоцитах и продукцию многих цитокинов. Механизм действия макролидов состоит в торможении синтеза белка в микробных клетках при их размножении путем связывания с каталитическим пептидилтрансферазным центром рибосомальной 50S-субъединицы. Это приводит к торможению реакции транслокации и транспептидации и нарушению процесса формирования и наращивания (элонгации) пептидной цепи. Обладают преимущественно бактериостатическим действием. Поскольку макролиды являются слабыми основаниями, их активность возрастает при рН 5,5-8,5.
Полусинтетические макролиды (кларитромицин, рокситромицин, азитромицин) характеризуются высокой кислотоустойчивостью, однако при приеме внутрь частично разрушаются под действием желудочного сока. Главным достоинством препаратов данной группы является их способность создавать очень высокие и стабильные концентрации в тканях, превышающие содержание препаратов в сыворотке крови. Важной особенностью кларитромицина является его конкурентное взаимодействие с ингибиторами протонной помпы, что увеличивает концентрацию в крови обоих препаратов.
Наиболее активным в отношении HP является кларитромицин. В отличие от других макролидов, которые в кислой среде подвергаются усиленному гидролизу, кларитромицин устойчив в кислоте желудочного сока. По данным I.Miki и соавторов (2003) [17], монотерапия кларитромицином приводит к уничтожению HP в 54% случаев, а согласно исследованиям Gisbert - в 15% случаев, что, тем не менее, является впечатляющим результатом. Кларитромицин способен вызывать нарушение вкусовой чувствительности, реже - диспептические явления и аллергические реакции.
Азитромицин и рокситромицин мало уступают кларитромицину в клинической эффективности, но в меньшей степени вступают во взаимодействие с другими лекарственными препаратами, реже вызывают побочные эффекты и поэтому могут являться альтернативой кларитромицину [18].
Джозамицин относится к группе макролидных антибиотиков, но, в отличие от других препаратов этой группы, он содержит 16-членное лактонное кольцо и длинную боковую цепь. Эта особенность химической структуры имеет большое значение, поскольку к джозамицину не развивается резистентность [19].
Джозамицин устойчив к кислой среде желудка, а благодаря высокой степени связывания с белками очень хорошо проникает в различные ткани [20], оказывая бактериостатическое действие путем соединения с S50- и S70-фракциями рибосом бактерий и блокирования синтеза белка.
Среди побочных эффектов джозамицина отмечены анорексия, тошнота, изжога, рвота, метеоризм, диарея, аллергические реакции (крапивница), транзиторное повышение активности печеночных трансаминаз, псевдо-мембранозный колит. Препарат обладает гепатотоксическим, миелотоксическим и нефротоксическим действием, оказывает неблагоприятное влияние на биоценоз толстой кишки. Все возникшие диспепсические и астеновегетативные побочные эффекты носят слабовыраженный характер, проходят самостоятельно до окончания курса противоязвенной терапии и не требуют отмены антихеликобактерных препаратов, а также проведения корригирующей терапии.
Антибактериальная активность антибиотиков может быть усилена за счет одновременного назначения антисекреторных средств. Повышение интрагастральной рН с 3,5 до 5,5 усиливает активность ампициллина и макролидов более чем в 10 раз [21]. Этот факт объясняет высокую эффективность схем антихеликобактерной терапии при включении мощных ингибиторов желудочной секреции.
Препараты висмута
Одним из основных препаратов, входящих в схемы антихеликобактерной терапии, является трикалия дицитрат висмута (ТДВ, Де-нол). При рН менее 5 ТДВ образует преципитаты в виде двух солей висмута - оксихлорида и цитрата, оптимум рН составляет 3,5 [22]. В области дна язвы препарат создает защитную пленку, образуя агрегаты с белками плазмы [23]. Он также способен образовывать кристаллы различной формы в зависимости от рН среды, которые, в частности, могут адгезироваться в местах некроза эпителиальных клеток [24].
ТДВ оказывает влияние на плотность и проницаемость слоя желудочной слизи, образуя комплекс висмут-протеогликан и замедляя диффузию Н+, но не влияя на диффузию других ионов [25]. ТДВ обладает также антипепсиновой активностью - вероятно, за счет связывания пепсина [26], а при кислых значениях рН способен связывать желчные кислоты [27]. ТДВ достоверно увеличивает секрецию простагландинов [28] и бикарбонатов [29] в желудке и двенадцатиперстной кишке.
Одним из основных свойств ТДВ является его бактерицидное действие на HP. Оно незначительно превосходит аналогичное действие других солей висмута in vitro но многократно - in vivo. Это объясняется наибольшей растворимостью ТДВ в желудочном соке и слизи в самом широком диапазоне рН, что позволяет препарату легко проникать в слизистый слой и желудочные ямки. ТДВ препятствует адгезии HP к желудочному эпителию, приводит к повреждению и фрагментации мембраны бактериальной клетки, вакуолизации ее [30]. Он ингибирует ферменты HP: уреазу, каталазу, фосфолипазу и его протеолитическую активность [31]. В результате всего комплекса воздействий ТДВ наступает лизис бактериальной клетки в непосредственной близости от эпителия желудка. Очень важно, что препарат способен воздействовать как на вегетативные, так и на кокковые формы HP. Несмотря на различные механизмы действия, он обладает синергизмом с антибиотиками, поэтому может быть эффективно использован в сочетании с ними. К препарату не развивается резистентность. Более того, согласно данным Williamson R., Pipkin G.A.[32], ТДВ предотвращает развитие первичной и вторичной резистентности к антибиотикам.
Многочисленные исследования по оценке эффективности терапии Де-нолом HP-инфекции показали, что после курса монотерапии у большинства больных удается добиться подавления инфекции и стойкого клинического улучшения [33], однако в дальнейшем восстанавливается прежняя степень обсемененности слизистой оболочки. То есть, Де-нол в качестве монотерапии не в состоянии стойко подавить HP, поэтому используется комбинированная терапия. ТДВ, а также некоторые другие соли висмута: субсалицилат и, реже, субгаллат, в сочетании с антибиотиками широко используются в комплексной терапии НР-инфекции [34].
Хотя действие этих препаратов реализуется местно, все же незначительные концентрации висмута обнаруживаются в крови и моче в процессе лечения и достигают стабильных значений спустя 4 недели от его начала [35]. В экспериментах на животных было показано, что высокие дозы висмута могут вызвать побочные реакции со стороны ЦНС (т.н. «висмутовая энцефалопатия»), Пороговыми концентрациями висмута в крови у человека считаются 50-100 мг/л, однако в реальных условиях при назначении обычных доз Де-нола (8 мг/кг у детей, 480 мг/сут у взрослых) такие концентрации никогда не регистрируются и никаких побочных реакций со стороны ЦНС не возникает [36]. Исследование П.Л. Щербакова и А.А. Нижевича [37], проведенное у детей, показало, что на фоне стандартной антихеликобактерной терапией схемой, включавшей обычные дозы Де-нола, концентрация висмута в крови не превышала 55 мг/л, что соответствует нижней границе нормы пороговых значений и 10-кратно ниже концентраций, наблюдаемых при висмутовой энцефалопатии. То есть, Де-нол является безопасным и эффективным антихеликобактерным препаратом и может быть назначен детям. Однако, поскольку висмут медленно выводится из организма, его не рекомендуют назначать пациентам с почечной недостаточностью [35]. Кроме вышеописанных, из побочных действий препаратов висмута обычно наблюдается почернение стула вследствие образования в кишечнике сульфида висмута, в литературе имеется несколько сообщений о возникновении диареи, описаны редкие случаи аллергии на препарат в виде кожных сыпей [38]. В желудке препарат может связываться с пищей и антацидами, терапевтическое его действие в этом случае становится невозможным. Поэтому препарат рекомендуют принимать за 30 мин. до еды и на ночь, не ранее, чем через 2 часа после последнего приема пищи, и не сочетают с приемом антацидов. В детской практике рекомендуется назначать Де-нол детям старше 5 лет в дозе 8 мг/кг/с в 3 приема за 30 мин. до еды.
Ингибиторы протонной помпы
С начала XX века, когда Шварцем была предложена кислотозависимая теория ульцерогенеза, в лечении больных язвенной болезнью используют антисекреторные препараты, которые оказались эффективными и в современных схемах антихеликобактерной терапии.
В эволюции развития антисекреторной терапии, прошедшей этапы широкого применения холинолитиков и блокаторов Н2-гистаминорецепторов, ингибиторы протонной помпы (ИПП) оказались наиболее мощными препаратами, максимального подавляющими секрецию соляной кислоты. Фармакологический механизм ИПП обусловлен их селективным антагонизмом к Н+К+-АТФазе париетальных клеток желудка, которая вступает в необратимую связь с активным метаболитом ИПП сульфенамидом. Благодаря высокой эффективности и безопасности этих препаратов, им отдается предпочтение при лечении всех кислотозависимых заболеваний. Опыт применения ИПП насчитывает уже более 20 лет, первым препаратом этой группы был омепразол, синтезированный в 1979 г., позднее появились пантопразол, лансопразол, рабепразол. Эти препараты представляют собой смесь R-и S-изомеров, в 2000 г. синтезирован и первый S-изомер - эзомепразол.
Среди большой группы ИПП наиболее часто используются препараты омепразола. Многочисленные исследования доказали его высокую эффективность и безопасность. Побочные действия омепразола выражены слабо и включают в себя желудочно-кишечные нарушения, такие как диарея, метеоризм, боли в животе, запор. Со стороны ЦНС изредка отмечаются головная боль и головокружение. Встречаются побочные реакции исключительно редко (менее 2,5%) [39]. В подавляющем большинстве случаев жалобы купируются самостоятельно и не требуют отмены или снижения дозы препарата. Значительно реже встречаются сыпь, крапивница и зуд, которые обычно исчезают после отмены препарата.
Лансопразол отличается от омепразола структурой радикалов на пиримидиновом и имидазольном кольцах, что обуславливает более быстрое наступление антисекреторного эффекта и обратимость его связывания с Н+К+-АТФазой [40]. Переносимость и безопасность лансопразола также хорошо изучены [41, 42, 43]. Наиболее частыми нежелательными явлениями при терапии лансопразолом являются диарея, головная боль и тошнота, а также кожные реакции, головокружение [44]. При применении пантопразола чаще всего отмечается диарея, головокружение, боли в эпигастрии, метеоризм, кожный зуд [45, 46].
Рабепразол отличается от омепразола структурой радикалов на пиримидиновом и имидазольном кольцах. Особенность его химического строения обеспечивает более быстрое ингибирование протонной помпы, благодаря способности активироваться в достаточно широком диапазоне рН. Основными нежелательными явлениями при приеме рабепразола являются головная боль и диарея [47, 48]. Частота нежелательных реакций, которые можно связать с приемом препарата, составляет менее 5% [47], то есть, по спектру и частоте побочных эффектов он сопоставим с другими ИПП.
Первым представителем нового левовращающего поколения ИПП является эзомепразол (Нексиум). Препарат имеет лучший фармакокинетический профиль и обеспечивает большее подавление кислотной продукции, чем омепразол [49, 50]. Нексиум в наименьшей степени подвергается гидроксилированию с участием цитохрома Р450 (CYP2C19) в печени и имеет меньший клиренс, чем R-изомеры [51]. Это свойство принципиально отличает эзомепразол от всех других ИПП. Существует полиморфизм гена CYP2C19, и только у 2-5% представителей европеоидной расы структура гена и, соответственно, цитохрома Р450 «благоприятна» для метаболизма ИПП. Большинство людей довольно быстро и в разной степени их метаболизируют, что не позволяет с большой точностью предсказывать эффективность блокаторов протонного насоса. Это относится ко всем ИПП, включая рабепразол. И только создание эзомепразола позволило преодолеть данный недостаток. Среди нежелательных реакций при применении эзомепразола чаще всего встречаются головная боль, боль в животе, диарея, тошнота и инфекции дыхательных путей [52], синусит, метеоризм и диарея [53].
Минуя желудок, ИПП быстро всасываются в кишечнике и перераспределяются между органами и тканями. Являясь слабыми основаниями, они лучше накапливаются там, где значения рН наиболее низкие [54]. В канальцах париетальных клеток рН может достигать 1,0-0,8. Это обеспечивает селективное накопление препаратов, поскольку оптимальным для всех видов ИПП является уровень рН от 1,0 до 2,0 [55]. ИПП избирательно накапливаются в кислой среде секреторных канальцев париетальной клетки, где их концентрация в 1000000 раз превосходит концентрацию в крови [56]. В секреторных канальцах эти лекарственные средства претерпевают ряд изменений, в результате которых переходят в активную форму. Затем они образуют прочные ковалентные связи с SH-группами Н+К+-АТФ-азы, создавая необратимую ковалентную связь и исключая возможность конформационных переходов молекулы фермента, блокируя тем самым его работу. Секреция кислоты восстанавливается только тогда, когда синтезируются новые молекулы Н+К+-АТФазы [56]. Важно отметить, что после отмены ИПП восстановление продукции HCI происходит на 4-5-й день в результате ресинтеза помп, то есть при применении ИПП отсутствует феномен «рикошета», свойственный Н2-гистаминоблокаторам. Антисекреторная активность ИПП в 2-10 раз превышает таковую у блокаторов Н2-рецепторов гистамина. ИПП превосходят антагонисты Н2-рецепторов гистамина и по скорости купирования симптомов язвенной болезни, и по частоте и скорости заживления язвенного дефекта. Это объясняет лидирующее положение данной группы препаратов в лечении кислотозависимых и H.pylori.ассоциированных заболеваний [57].
ИПП взаимодействуют с Н+К+-АТФазой с различной скоростью, которая коррелирует со скоростью их превращения в сульфенамид и зависит от рН: рабепразол > омепразол (эзомепразол) = лансопразол > пантопразол. При рН, равной 5,0 ед., пантопразол химически наиболее стабилен и слабее всего активируется, тогда как рабепразол наименее стабилен и обладает наибольшей эффективностью [58]. В связи с этим при рН 5,0 ед. практически все ингибиторы протонного насоса перестают быть активными, кроме рабепразола, который продолжает оказывать антисекреторное действие [57]. При рН 4,0 ед. рабепразол активен в наибольшей степени. При рН 3,0 ед. ингибирование обеспечивается всеми лекарствами, при этом наименее эффективен пантопразол.
В педиатрической практике наиболее изучен омепразол. Исследования, проведенные у детей в возрасте от 3 мес. до 18 лет, показали, что фармакокинетика омепразола у детей, как при оральном, так и при внутривенном введении, не отличается от таковой у взрослых [59-62]. Оптимальной дозой омепразола у детей, способной поддерживать рН выше 4 на протяжении 90% времени суток при пероральном назначении, является доза 1 мг/кг/сут [63-65]. Наблюдение за детьми, получавшими омепразол по поводу ГЭРБ на протяжении 7 лет, не выявило никаких побочных реакций, лишь незначительную гиперплазию G-клеток желудка с умеренной гипергастринемией [66]. Уровень гастрина в крови повышался обычно через несколько недель лечения, а гиперплазия G-клеток появлялась лишь через несколько лет [66]. Поэтому короткие курсы омепразола с полным основанием можно считать безопасными для детей старше 6 мес. Надо учитывать, что эквивалентными дозами ИПП являются: омепразол - 20 мг, лансопразол - 30 мг, пантопразол - 40 мг, рабепразол - 20 мг, эзомепразол - 40 мг.
Для оценки реальной эффективности различных ИПП мы провели исследование внутрижелудочного рН на фоне приема ИПП у 55 детей в возрасте от 12 до 17 лет. При оценке эффективности антисекреторного препарата принимались во внимание средние значения рН на пятый день проводимой эрадикационной терапии, рассчитанные за сутки, а также суммарный процент времени, в течение которого рН был выше 4,0. Результаты представлены в таблице:
Таблица. Сравнительная эффективность оригинальных ИПП у детей
Омепразол 20 мг х 2 раза в день Эзомепразол 20 мг х 2 раза в день Эзомепразол 40 мг х 2 раза в день Рабепразол 20 мг х 2 раза в день Таким образом, все препараты ИПП в целом были эффективно и повышали среднесуточный рН в желудке выше 4,0, но наиболее сильное антисекреторное воздействие имел эзомепразол (Нексиум) в дозе 40 мг 2 раза в сутки. Побочных реакций на прием ИПП не отмечено ни у одного из детей.
В начале 90-х годов рядом авторов было показано, что монотерапия омепразолом приводит к перераспределению H.pylori. в слизистой оболочке желудка [67]: их число в антральном отделе снижается, причем часто значительно, а в теле желудка возрастает. Механизм такого регулирующего влияния ингибиторов протонного насоса связан с мощным угнетением желудочной секреции. Синтез АТФ HP осуществляется благодаря наличию электрохимического градиента ионов водорода. Уреаза HP, разлагая мочевину с выделением ионов аммония, приводит к защелачиванию микроокружения бактерии, предохраняющего ее от действия соляной кислоты желудочного сока. В этих условиях синтез АТФ продолжается. Но применение ингибиторов протонного насоса приводит к повышению рН, а эффект уреазы - к суммарному повышению рН до уровня, который несовместим с жизнедеятельностью микроорганизма. HP способен синтезировать АТФ с помощью протон-движущей силы при рН от 4,0 до 8,0 в отсутствии мочевины. При значениях рН ниже 3,5 и выше 8,4 микроорганизм теряет способность генерировать энергию и поддерживать рН-градиент [68]. Таким образом, HP является устойчивым к кислым значениям рН (благодаря уникальной уреазной активности), но неустойчивым к щелочной реакции среды. Бактерия адаптирована к рН 4,0-8,0 ед. [69]. При использовании ИПП бактериям приходится переселяться в отделы желудка с более низкими значениями рН, т. е. из антрального отдела в тело желудка [70].
ИПП не только угнетают HP в антральном отделе, но и стимулируют защитные механизмы макроорганизма в отношении бактерии. Антитела к HP, секретируемые на поверхности слизистой оболочки желудка, быстро деградируют под влиянием протеолитических ферментов желудочного сока. Сдвиг рН в щелочную сторону при использовании блокаторов Н+К+-АТФазы заметно снижает протеолитическую активность содержимого желудка и удлиняет период полужизни антител и их концентрацию [70]. Функциональная активность нейтрофилов также зависит от рН и возрастает при его сдвиге в щелочную сторону. Ингибиторы протонного насоса обладают синергизмом с антибактериальными препаратами. Активность многих антибиотиков повышается при сдвиге значений рН из кислой в щелочную сторону. Кроме того, уменьшение объема секрета повышает концентрацию антибактериальных препаратов в желудочном соке [71].
Все производные бензоимидазола: омепразол, пантопразол, лансопразол и др., приводят к одинаковому перераспределению H.pylori. в слизистой оболочке желудка и обладают сходным бактериостатическим эффектом, а также влияют на биодоступность антибиотиков, особенно кларитромицина и тетрациклина.
Сочетание ИПП и кларитромицина увеличивает время полужизни обоих компонентов, а также концентрацию макролида в слизистой оболочке антрального отдела и желудочной слизи. Основной целью применения ИПП является активизация процессов перехода кокковых форм HP из фазы покоя в фазу активной жизнедеятельности и клеточного деления, которая происходит при устойчивом повышении интрагастрального рН от 5,0 до 7,0 ед. на срок не менее 18 часов в сутки [72]. Длительное повышение рН среды выше 5,0 ед. достаточно для синергического действия ИПП и двух антибиотиков в уничтожении HP. Таким образом, ИПП обладают косвенным антихеликобактерным действием [68].
Как было указано выше, при назначении лечения для достижения высоких показателей эрадикации HP необходимо обеспечить высокую активность применяемых антибиотиков в условиях кислой среды. Действие метронидазола практически не зависит от значений рН, тетрациклин проявляет активность даже при низких значениях рН, тогда как амоксициллин максимально активен при нейтральных значениях рН, а при рН от 3 до 6 он проникает в ткани несколько хуже. Поскольку макролиды (кларитромицин, рокситромицин, азитромицин) являются слабыми основаниями, их активность возрастает при рН 5,5-8,5 за счет меньшей ионизации. Повышение интрагастральной рН с 3,5 до 5,5 усиливает активность ампициллина и макролидов более чем в 10 раз [73]. Из всех макролидов джозамицин обладает наиболее высокой устойчивостью к кислой среде желудка [74].
Построение схем эрадикационной терапии и их эффективность
В настоящее время оптимальными считают схемы, базисным препаратом в которых выступает ИПП. Являясь самыми сильными ингибиторами желудочной секреции, ИПП создают оптимальные условия для реализации эффекта антибактериальных компонентов схемы. В многочисленных исследованиях показано, что при использовании ИПП в «классической» тройной схеме эрадикации эффективность различных ИПП одинакова [75]. К аналогичному выводу о равной эффективности омепразола, лансопразола, рабепразола и эзомепразола пришли авторы мета-анализа, включавшего 40 исследований различных ИПП в эрадикационных схемах [76]. Наше исследование 55 детей, получавших омепразол (Лосек), рабепразол (Париет) и эзомепразол (Нексиум) в составе 10-дневных схем эрадикационной терапии, сходных по другим компонентам (амоксициллин + Де-нол) показало, что, независимо от выбранного ИПП, схема имеет высокую эффективность, приближающуюся к 80%. Таким образом, любой из ИПП, назначенный в оптимальной дозе, примерно в равной мере эффективен в схемах эрадикации HP.
В соответствии с рекомендациями ESPGHAN и NASPGHAN (2000 г.), оптимальными схемами для эрадикационной терапии у детей являются следующие [77]:
1 линия:
1. ИПН+амоксициллин+кларитромицин
2. ИПН+амоксициллин+метронидазол
3. ИПН+кларитромицин+метронидазол2 линия:
1. КСВ+ИПН+амоксициллин+метронидазол (тетрациклин после 12 лет)
В соответствии с рекомендациями ESPGHAN и NASPGHAN [77], оптимальными дозами препаратов, входящих в стандартные схемы, являются следующие:
В соответствии с этими рекомендациями и Консенсусом Маастрихт-2, в качестве схем эрадикации 7-дневных первой линии рекомендована схема, включающая ИПП, кларитромицин и амоксициллин (ИКА), и в меньшей степени -схема, в которой вместо амоксициллина применяется метронидазол (ИКМ) [78]. Поскольку компоненты первой схемы были наиболее удачно сбалансированы по эффективности и минимальны по побочным действиям, она получила название «стандартной тройной терапии». Уровень эрадикации при использовании этой комбинации препаратов составил 78-91% [79]. По результатам G.M. Buzas, J. Jozan (2004), [75] эффективность схемы, включающей кларитромицин и амоксициллин, составила 79,6%, кларитромицин и нитроимидазол - 84,1%, амоксициллин с нитроимидазолом - 72,5%. В аналогичном исследовании, проведенном в Южной Корее и включавшем 352 пациента с дуоденальной язвой и неязвенной диспепсией, сравнивали комбинацию омепразола (20 мг 2 раза в сутки), кларитромицина (500 мг 2 раза в сутки) и амоксициллина (1,0 г 2 раза в сутки) или тинидазола (500 мг 2 раза в сутки), эффективность оказалась одинаковой (65,7% и 64,8%) [80]. К важному выводу о целесообразности включения в режим эрадикации кларитромицина пришли исследователи, которые сравнивали комбинацию лансопразола (30 г 2 раза в сутки), амоксициллина (1,0 г 2 раза в сутки) и метронидазола (400 мг 3 раза в сутки) с режимом, включавшим лансопразол и амоксициллин в той же дозе, но с заменой метронидазола на кларитромицин (500 мг 2 раза в сутки). Эффективность последнего варианта оказалась достоверно более высокой (91% и 78%) [81].
Если в качестве компонента схемы вместо кларитромицина использовали азитромицин с аналогичным ИПП, уровень эрадикации составил 75% и 80% соответственно [81]. Не было обнаружено различий в частоте эрадикации в зависимости от токсигенности штаммов HP .
Продолжительность терапии остается предметом дискуссий, однако Консенсус Маастрихт-3 признал, что 14-дневные схемы более эффективны, чем 7-дневные, однако после проведения местных исследований в разных регионах может быть выбрана наиболее оптимальная для региона продолжительность лечения. Мета-анализ продемонстрировал, что 14-дневные схемы превосходят по эффективности 7-дневные [82]. Альтернативой может быть 10-дневная терапия.
В 2003 г. Zullo А. и Vaira D. [83] предложили оригинальную схему 10-дневной последовательной терапии, включавшей в первые 5 дней ИПП и амоксициллин, а в последующие 5 дней - ИПП, кларитромицин и тинидазол. Проспективное исследование эффективности последовательной схемы у 1049 больных показало ее преимущество (92%) перед обычной тройной терапией (74%). Мета-анализ 10 клинических исследований, включавших 2747 пациентов, опубликованный в 2008г, подтвердил более высокую эффективность последовательной схемы (93,4%) по сравнению со стандартной (76,9%) [84].
В качестве схемы второй линии Консенсусом Маастрихт-2 была предложена приведенная выше схема квадротерапии, включающая ИПП, препарат висмута (Де-нол) метронидазол и тетрациклин (с 12 лет). У детей до 12 лет вместо тетрациклина может быть назначен амоксициллин. При неэффективности терапии второй линии рекомендуется индивидуальный подбор лекарственных препаратов с учетом антибиотикорезистентности высеваемого штамма HP.
Проблема антибиотикорезистентности HP
В последние годы отмечено снижение эффективности 7-дневных тройных схем эрадикационной терапии [84, 85]. Это обусловлено растущей резистентностью HP к антибиотикам. И, хотя Консенсус Маастрихт-3 сделал попытку выработать глобальный подход к лечению инфекции Н.pylori., рекомендовать единую стандартную схему, приемлемую для всех регионов, практически невозможно из-за значительной вариабельности локальной антибиотикорезистентности HP. Более того, резистентность меняется в связи с использованием новых препаратов.
Развитие резистентности H.pylori. к антибиотикам связано с точечными мутациями различных генов:
Так, резистентность к кларитромицину связана с изменением конфигурации рибосом вследствие точечной мутации в домене V 23S rРНК [86]. Причина резистентности к метронидазолу до сих пор окончательно не установлена. Очевидно, наиболее значима альтерация rdxA-гена, но может быть вовлечение frxA-гена [87,88]. Низкая чувствительность к амоксициллину возможна вследствие мутаций pbp1-гена, определяющего способность белков H.pylori связывать пенициллины [89]. К счастью, последняя наблюдается редко, поэтому микроб обычно сохраняет чувствительность к амоксициллину. Плазмидная передача устойчивости β-лактамазы не свойственна H.pylori.
Основными методами исследования антибиотикорезистентности HP являются бактериологические (Е-тест, диффузия и дилюция агара) и ПЦР, последний более чувствителен и точен, но разработан только применительно к кларитромицину и фторхинолонам.
Ниже приведены суммарные данные о первичной резистентности HP к различным антибиотикам у взрослых, полученные в разных странах бактериологическим методом [147]:
Таблица
Страна Годы Амо Клар Метрон Тетра Ципро Левоф Италия 2004-2006 0 16,9 29,4 19,1 Англия 2000-2005 0 12,7 36,3 Франция 2004-2005 0 22,8 36,7 17,2 Болгария 2005-2007 0,9 17,8 25 4,4 7,7 Иран 2003-2005 59 16 95 5 7 Парагвай 2002-2003 2,2 2,2 33 11,5 Япония 2002-2004 0,1 2,2 2,7 Корея 2001-2005 11,8 16,7 34,7 0 Тайвань 2004-2005 36,1 13,5 51,9 В 1999-2002 г в Европе было проведено проспективное мультицентровое исследование, включавшее 16 педиатрических центров в 14 странах [90]. Всего было обследовано 1233 пациента, 41% которых были родом из Африки и Ближнего Востока. Исследовалась как первичная (до лечения), так и вторичная (при неудачном лечении) резистентность. Первичная резистентность к кларитромицину была выявлена у 20% детей, вторичная - у 42%. Первичная резистентность к кларитромицину была достоверно выше у детей до 6 лет, чем у подростков старше 12 лет и преобладала у жителей Южной Европы по сравнению с Северной. Эти различия легко объяснимы более частым назначением макролидов для лечения внежелудочных (в основном, респираторных) заболеваний у детей раннего возраста и существованием определенных ограничений в назначении препаратов этой группы в северо-европейских странах. В Восточной Европе отдельные исследования также показали высокую резистентность к кларитромицину у детей. Так, в Болгарии она составила 12,4%, а в Польше - 23,5% [91 ].
Рядом исследований была показана тенденция к росту резистентности к кларитромицину: так, в США и Канаде до 2000 г. она составляла 4%, а в 2004г-11-12% [92].
Основной причиной роста резистентности Н.pylori к кларитромицину является не столько предшествующая неэффективная эрадикационная терапия, сколько широкое использование макролидов при лечении других заболеваний. Поскольку дети чаще получают препараты этой группы, то и распространенность устойчивых штаммов Н.pylori среди них существенно выше, чем у взрослых. Так, исследование, проведенное в японских семьях, показало, что хотя члены одной семьи обычно заражены идентичными штаммами H.pylori, резистентность к кларитромицину выше у детей [93]. В целом, резистентность H.pylori. к кларитромицину возрастает пропорционально его потреблению в данном регионе [94].
Все препараты группы макролидов характеризуются развитием перекрестной резистентности штаммов in vitro, но не все макролиды в равной мере могут формировать таковую у H.pylori. in vivo, поскольку это зависит также от способности препарата накапливаться в слизистом слое. Поскольку кларитромицин быстро достигает ингибирующей концентрации на поверхности слизистой оболочки желудка, после курса лечения 2/3 не уничтоженных штаммов H.pylori становятся резистентными к нему. Этого нельзя сказать, например, об азитромицине - он имеет низкую эффективность эрадикации (62%), но вторичная резистентность HP к нему развивается только в 23% случаев [95].
Активное применение метронидазола, как для лечения паразитозов, так и урогенитальных инфекций, привело к росту числа устойчивых штаммов HP. Механизм развития резистентности к метронидазолу изучен не полностью [96, 97]. В развитых странах первичная резистентность HP к нитроимидазолам составляет 30-35% [98, 99], в развивающихся странах - 50-90%, где его применяют при амебиазе, лямблиозе, трихомониазе [100]. Так, в странах Африки, Латинской Америки, Юго-Восточной Азии от 50 до 100% штаммов HP являются первично-резистентными к нитроимидазолу [101]. В странах Восточной Европы с невысоким уровнем жизни (в том числе и в странах СНГ) первично-резистентные к нитроимидазолу штаммы HP составляют 20-40%; в России в 1998 году резистентность к метронидазолу составила почти 30%, в Москве -36% [102]. В странах Западной Европы, по данным Европейского многоцентрового исследования, средний уровень первичной резистентности HP к метронидазолу составляет 25,6% [103].
Вторичная резистентность HP к нитроимидазолам в развитых странах в 1996г составила 50% [101], а в развивающихся - 80-100%. Бесконтрольное использование метронидазола при лечении пациентов с язвенной болезнью привело к повышению вторичной резистентности в Гонконге с 22% в 1991 г. до 73,2% в 1995 г. [17]. В России вторичная резистентность к метронидазолу у больных, которым проводили антихеликобактерную терапию по поводу язвенной болезни, составила 100%.
Необходимо подчеркнуть несоответствие результатов разных методов оценки резистентности H.pylori. к метронидазолу. Если в определении резистентности к кларитромицину достоверность диагностики мутации 23S РНК с помощью ПЦР или флюоресцентной гибридизации in situ не вызывает сомнений, то методы обнаружения резистентности к метронидазолу, основанные на бактериологической диагностике (метод дисков, Е-тест), до сих пор не стандартизованы. Возможно, этим объясняется нередкое несовпадение результатов, полученных in vitro и эффективности терапии in vivo. Тем не менее, даже с учетом возможных погрешностей в определении резистентности H.pylori к метронидазолу, можно сделать вывод о высоком, среднем или низком в целом ее уровне в популяции. Российские данные указывают на довольно высокую резистентность H.pylori. к метронидазолу.
Одним из возможных способов построения схемы при высокой резистентности HP к метронидазолу является замена его на нитрофураны. В ряде работ была продемонстрирована эффективность фуразолидона [104]. Доза препарата должна составлять 200 мг 2 раза в сутки, так как более низкие дозы характеризуются значительно более низкой эффективностью [105]. Резистентность HP к фуразолидону развивается медленно и составляет 1,0-1,8% [106]. В России предпочтение отдается другому нитрофурановому препарату - нифурателю (Макмирор), который, по нашим данным, продемонстрировал высокую эффективность (82%) в эрадикационной схеме у детей в сочетании с омепразолом и амоксициллином. В 2007 г. было проведено мультицентровое исследование в нескольких городах России, которое показало возможность использования в схемах эрадикации местного антисептика нитрофуранового рядя -нифуроксазида (Энтрофурил), общая эффективность тройной терапии с включением этого препарата в сочетании с ИПП и антибиотиком составила 78%.
Как в развитых, так и в развивающихся странах отмечена довольно низкая резистентность (не более 5%) штаммов HP к препаратам группы тетрациклина [107], поэтому препарат, по-прежнему, включается в схему второй линии терапии, но он разрешен к применению только с 12 лет, поскольку может оказывать негативное влияние на рост и формирование зубов.
В 1997 г. впервые сообщалось о появлении резистентных к амоксициллину штаммов HP, составивших 1,4-7с/о в развитых странах [108]. Если за период с 1985 по 1996 год в Японии не было выявлено ни одного резистентного штамма, то в 1997 г. их доля составила 1,1%, а в 2003 г. - 1,5% [109]. Российская группа по изучению HP в 1998г сообщила о выделении 11% резистентных к амоксициллину штаммов HP [102].
В 2005 году F. Megraud [98] представил данные о резистентности HP к антибактериальным препаратам, определившие последующий выбор тех или иных схем эрадикации. Так, показатели резистентности штаммов микроорганизма к метронидазолу находятся в пределах 19-42% в странах Европы и 33-37% - в США, 9-12% - в Японии, 53% - в Бразилии и 77% - в Мексике. В отношении кларитромицина, эти показатели составляют в США и Японии около 13%. В европейских странах они колеблются в широких пределах: сравнительно низкие в странах Северной (4,4%) и Центральной (8,7%) Европы и, напротив, очень высокие (24%) - в странах Южной Европы. В нашей стране к 2003г количество штаммов HP, резистентных к метронидазолу, достигло 55,5%. Опасной можно назвать тенденцию к росту доли полирезистентных штаммов - 11,1% [98,109].
Таблица . Динамика антибиотикорезистентности штаммов HP в России с 1996 по 2001 гг.
Резистентность к метронидазолу (%) Резистентность к кларитромицину (%) Резистентность к амоксициллину (%) Полирезистентность (0%) Интересно отметить, что частота антибиотикорезистентных штаммов H.pylori выше у больных хроническим гастритом (16,7% к кларитромицину, 56,4% к метронидазолу), чем язвенной болезнью (5,6% к кларитромицину, 19,8% к метронидазолу) [111]. Возможно, это связано с более высоким уровнем потребления антибиотиков у больных хроническим гастритом в целом, но не исключено также и влияние особенностей токсигенности штаммов H.pylori. Так, при язвенной болезни почти все штаммы CagA-позитивны, в то время как при хроническом гастрите - только две трети [112]. Как известно, токсигенные штаммы характеризуются более плотной адгезией к желудочному эпителию, что, возможно, улучшает условия воздействия на них антибиотиков, повышает эффективность терапии и снижает необходимость назначения повторных курсов лечения. Нами также было показано ранее, что более низкий процент эрадикации может объясняться иммунологической недостаточностью у пациентов с нодулярным гастритом и у детей в возрасте до 7 лет [112].
Антибиотикорезистентность H.pylori. является главной причиной неэффективности терапии. Так, суммируя результаты 20 европейских исследований, в которых проведена оценка результатов стандартной тройной терапии 1 линии, включавшей ИПП, амоксициллин и кларитромицин у 2751 пациента, можно заключить, что в случае чувствительности штаммов эрадикация достигается в среднем у 87,8%, а при устойчивости к кларитромицину - только у 18,3% пациентов [98]. Это 70% снижение эффективности лечения подчеркивает клиническое значение резистентности H.pylori. к кларитромицину. Еще более интересны результаты тройной терапии, включавшей ИПП, метронидазол и кларитромицин. В случае чувствительности H.pylori. к обоим антибиотикам эрадикация достигалась у 97%, при резистентности к кларитромицину - у 50%, к метронидазолу - у 72,6%, к обоим антибиотикам - ни у одного пациента. То есть, устойчивость к кларитромицину приводит в любом сочетании к существенному снижению эффективности терапии. В то же время, устойчивость к метронидазолу в меньшей степени отражается на результатах лечения, особенно при удлинении курса лечения до 10-14 дней [113]. На основании этих данных сочетание кларитромицина и метронидазола было признано более эффективным, чем амоксициллина и кларитромицина на 1 линии терапии, а продолжительность лечения было рекомендовано удлинить до 14 дней. Это легло в основу рекомендаций Маастрихт-3, однако такое сочетание применимо лишь в популяциях с высокой чувствительностью к обоим антибиотикам [114].
Мы исследовали биоптаты антрального отдела желудка 153 детей с НР-ассоциированными гастродуоденальными заболеваниями с помощью ПЦР. Для выделения ДНК HP из исследуемого материала использовались наборы «ДНК-технология», «Проба ГС» (ЗАО НПФ, Россия). Исследование проводилось в Лаборатории молекулярной генетики ГБ № 31 (зав. лабораторией -канд. мед. наук А.А. Лыщев) и в Научно-исследовательской лаборатории «Диагностика» Института экспериментальной медицины РАМН (зав. лабораторией - докт. мед. наук А.Н. Суворов). Мутации, обусловливающие резистентность HP к кларитромицину, были выявлены у 39% детей. Эти данные почти полностью совпадают с результатами исследования резистентности HP к кларитромицину, проведенными у взрослых пациентов Санкт-Петербурга, страдающих язвенной болезнью, у которых показатель резистентности составил 40% [115].
Исследование эффективности схемы, рекомендованной в качестве стандартной Консенсусом Маастрихт-3 в Европе (эзомепразол+кларитромицин+ метронидазол) в рекомендуемых дозах продолжительностью 10 дней, проведенное нами у 20 детей с HP-ассоциированными гастродуоденальными заболеваниями, показало низкую эффективность - 14,3%. Столь низкий результат объясняется высоким уровнем резистентности HP как к кларитромицину, так и к метронидазолу. В связи с полученными неутешительными результатами, мы не можем рекомендовать эту стандартную схему к использованию в России.
С учетом локальных особенностей штаммов HP, Консенсус Маастрихт-3 внес одну очень важную поправку: если устойчивость HP к кларитромицину в популяции конкретного региона превышает 15-20%, а к метронидазолу выше 40%, эти антибактериальные препараты не должны применяться в схемах эрадикации.
Мы проанализировали зависимость эффективности эрадикационной терапии от чувствительности штамма HP к кларитромицину. Суммарно по всем группам больных, в эрадикационную схему которых были включены макролиды, кларитромицин-чувствительные штаммы HP были выделены в 56,8% случаев, а кларитромицин-резистентные - в 43,2% случаев. Эрадикационная терапия была достоверно более эффективна у детей с кларитромицин-чувствительными штаммами: в 76,2% случаев удалось добиться эрадикации HP. Напротив, процент эрадикации у детей с кларитромицин-резистентным штаммом HP был минимален и составил всего 12,5% (рис.).
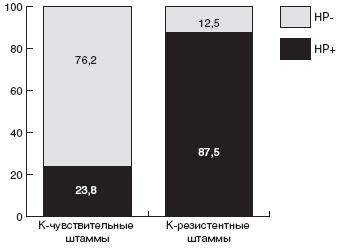
Рис. Частота эрадикации HP в группах с кларитромицин-чувствительными и кларитромицин-резистентными штаммамиКак уже указывалось выше, в качестве схемы эрадикации второй линии, рекомендуется схема квадротерапии с ИПП, тетрациклином, метронидазолом и препаратами висмута. В конце прошлого века данная схема позволяла добиться положительного результата эрадикации у 95% больных [116]. Но в 2002г J.P. Gisbert и соавторы получили 77% эрадикации при квадротерапии. Данный результат был подтвержден в испанском исследовании, проведенном в 2002г D. Bioxeda и соавторами [117]. Им удалось достичь эрадикации в 82% с неудачной стандартной тройной терапией на основе ИПП.
В материалах Консенсуса Маастрихт-3 вновь было подчеркнуто, что квадротерапия с препаратами висмута эффективна даже в случаях резистентности штаммов HP к метронидазолу. W.M.Wong с соавторами [118] показали эффективность квадротерапии у больных со штаммами, резистентными к метронидазолу и/или кларитромицину, в рандомизированном исследовании, включавшем две группы по 109 больных с пептической язвой и с функциональной диспепсией. Пациентам первой группы назначали стандартную квадротерапию, вторую лечили тройной схемой, состоящей из рабепразола, рифабутина и левофлоксацина. Частота эрадикации составила 91% в обеих группах. В другом исследовании V. Isakov с соавт. [119] разделили 70 больных язвой ДПК с метронидазол-резистентными штаммами на две группы. Больным первой группы назначали стандартную квадротерапию, второй - фуразолидон, висмут и тетрациклин в течение 7 дней. Средняя частота эрадикации составила 74% и 86% соответственно. Обе схемы были одинаково эффективны в качестве терапии второй линии, хотя в группе тройной терапии наблюдали меньшее число побочных эффектов. Treiber и соавторы [120] показали, что при наличии метронидазол-резистентных штаммов стандартная квадротерапия давала неприемлемо низкие (39%) показатели эрадикации. После повторения 7-дневного курса четверной терапии с заменой метронидазола на фуразолидон частота эрадикации достигала 82%. Данное исследование свидетельствует о том, что квадротерапия с нитрофуранами может быть предпочтительнее стандартной.
При высокой эффективности квадротерапии, не является ли целесообразным ее назначение в качестве терапии первой линии, особенно в условиях высокой антибиотикорезистентности? На этот вопрос позволяет ответить мета-анализ 102 исследований эрадикации, включающий 398 вариантов и 25644 пациента, не выявивший преимуществ квадротерапии по сравнению с тройной (эффективность 80,4% и 81,1% соответственно) [75]. Аналогичные результаты были получены в североамериканском исследовании, включавшем 275 пациентов. В данном исследовании сравнивали тройную терапию: омепразол (20 мг 2 раза в сутки) + кларитромицин (500 мг 2 раза в сутки) + амоксициллин (1,0 г 2 раза в сутки), с квадротерапией: омепразол (20 мг 2 раза в сутки) + висмута бискальцитрат (120 мг 4 раза в сутки) + метронидазол (375 мг 4 раза в сутки) + тетрациклин (375 мг 4 раза в сутки). Эффективность этих схем оказалась практически одинаковой (83,2% и 87,7% соответственно) [121]. Тройная (омепразол + амоксициллин + кларитромицин) и квадротерапия (омепразол + висмут + тетрациклин + метронидазол), используемые в качестве терапии первой линии, оказались эффективными в равной степени (87% против 86%).
Согласно нашим данным, эффективность тройной терапии с амоксициллином (омепразол+амоксициллин+метронидазол) составляет 73%, а сходной квадротерапии (омепразол+амоксициллин+метронидазол+Де-нол) - 76% [112]. Однако совсем другие результаты были получены при использовании схем с кларитромицином. Эффективность стандартной схемы, рекомендованной Консенсусом Маастрихт-3 (эзомепразол + кларитромицин + метронидазол) составила всего 14,3%, дополнение этой же схемы Де-нолом повысило эффективность до 65% [115]. Полученные нами данные согласуются с результатами европейского исследования, проведенного Williamson R., Pipkin G.A. [32], по мнению которых Де-нол способен преодолевать как первичную, так и вторичную антибиотикорезистентность HP. Это позволяет рекомендовать Де-нол в схемах эрадикации HP и делает целесообразным назначение этого препарата уже в ходе первой линии терапии.
Учитывая синергизм Де-нола с антибиотиками, мы впервые применили у детей щадящую схему с ИПП (омепразол или эзомепразол), Де-нолом и одним антибиотиком, к которому до настоящего времени почти нет резистентных штаммов HP - амоксициллином. Препараты давали в рекомендуемых дозах. Первая группа (10 больных) получала омепразол (Лосек) + Де-нол + амоксициллин (Флемоксин-солютаб) в течение 7 дней, вторая (24 больных) - те же препараты в течение 10 дней, третья (20 больных) вместо омепразола получала эзомепразол (Нексиум), продолжительность схемы также составила 10 дней. Эрадикация была достигнута в 33% в первой группе, в 75% - во второй и в 80% - в третьей (рис. ) [115]. Схемы имели минимальное количество побочных реакций - не более 2%, что, вероятно, объясняется уменьшением агрессивности антибактериальной терапии вследствие использования только одного антибиотика в схеме.
В соответствии с рекомендациями Маастрихт-3, схемы продолжительностью 14 дней более эффективны, чем 7-дневные, но в рекомендациях предусмотрена возможность использования более коротких схем в регионах при условии доказательства их эффективности. Полученные нами данные позволяют рекомендовать схемы эрадикационной терапии продолжительностью 10 дней, как наиболее оптимальные.
В случае неэффективности схем эрадикации первой и второй линии Консенсус Маастрихт-3 предлагает практическому врачу несколько приемлемых вариантов дальнейшей терапии. Поскольку к амоксициллину в процессе его применения не вырабатывается устойчивость штаммов HP, возможно назначение его высоких доз (0,75г 4 раза в сутки в течение 14 дней) в комбинации с высокими (4-кратными) дозами ИПП в виде двойной терапии, однако, по нашему мнению, мегадозы этих препаратов могут обернуться значительным увеличением числа побочных реакций. Другим вариантом может быть замена метронидазола в схеме квадротерапии на нитрофураны. Согласно последним Российским исследованиям, у детей наиболее приемлемы нитрофураны: нифуратель (Макмирор 15 мг/кг/сут) или нифуроксазид (Энтерофурил 200 мг 2 раза в день). Исследование, проведенное нами [122], показало, что включение Макмирора в состав квадросхемы (в сочетании с ИПП, Де-нолом и амоксициллином в течении 7 дней) в 82% позволяет достичь эрадикации HP у детей. Мультицентровое исследование эффективности Энтерофурила в схеме тройной терапии (с ИПП и кларитромицином или амоксициллином) у детей нескольких городов России показало общую эффективность, равную 72% [123].
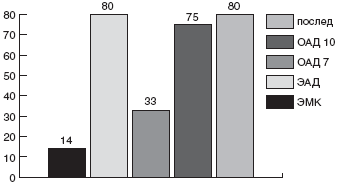
Рис. Сравнительная эффективность схем эрадикации HP у детей: ЭМК-эзомепразол, метронидазол, кларитромицин 10 дн, ЭАД - эзомепразол, амоксициллин, Де-нол 10 дн., ОАД 7 - омепразол, амоксициллин, Де-нол 7 дн., ОАД 10 - омепразол, амоксициллин, Де-нол 10 дн., послед. -эзомепразол, Де-нол 10 дн, амоксициллин первые 5 дн, джозамицин вторые 5 дн.Альтернативой нитрофуранам служит применение комбинации ИПП с амоксициллином и рифабутином (300 мг в сутки) [124] или левофлоксацином (500-1000 мг в сутки). Исследование H.C.Cheng с соавт. [125] продемонстрировало примерно равную эффективность (86% и 87,5%) доз 500 мг и 1000 мг левофлоксацина в сутки в 7-дневной схеме тройной терапии (с ИПП и амоксициллином). По данным J.P.Gisbert с соавт., левофлоксацин оказался более эффективным, по сравнению с рифабутином, в терапии упорно персистирующей НР-инфекции [126].
Попытки замены кларитромицина на другие макролидные антибиотики также предпринималась. В исследовании, проведенном в США, сравнивалась эффективность квадротерапии, включавшей ИПП (лансопразол), препараты висмута, амоксициллин и кларитромицин/азитромицин. В первом случае частота эрадикации равнялась 84,6%, во втором - 55,5% [127]. То есть, по эффективности, азитромицин уступает кларитромицину. Наше исследование с включением в тройную схему рокситромицина (10 мг/кг/сут) в сочетании с ИПП и амоксициллином также показало более низкую эффективность этого препарата по сравнению с аналогичной схемой с кларитромицином (58% против 75%).
Как уже указывалось выше, среди антибиотиков группы макролидов джозамицин обладает особыми свойствами: большей кислотоустойчивостью и меньшей вероятностью формирования перекрестной антибиотикорезистентности. Учитывая эти свойства, мы разработали новую схему последовательной терапии, когда на фоне 10-дневного курса ИПП (эзомепразола) в сочетании с Де-нолом, первые 5 дней пациент принимает амоксициллин, а последующие 5 дней - джозамицин (Вильпрафен) в дозе 10 мг/кг. Схема была применена у 20 детей с HP-ассоциированными гастродуоденальными заболеваниями, эффективность ее составила 80%, побочные реакции наблюдались у 5% детей [115]. Анализ эффективности схемы в зависимость от чувствительности штамма HP к кларитромицину показал, что схема практически в равной мере эффективна при кларитромицин-чувствительных и кларитромицин-резистентных штаммах - соответственно в 84% и 72%. Эти данные свидетельствуют об отсутствии перекрестной резистентности у кларитромицина и джозамицина и позволяют рекомендовать использование последнего в эрадикационных схемах. Последовательная терапия предусматривает одномоментный прием всего 3 препаратов, из них только один антибиотик, этим объясняется лучшая переносимость схемы.
Таким образом, у детей в России, в условиях высокой резистентности HP к кларитромицину и метронидазолу, могут быть рекомендованы следующие схемы:
- ИПП + Де-нол + амоксициллин 10 дней
- ИПП + Де-нол 10 дней + амоксициллин (первые 5 дней), джозамицин (последующие 5 дней)
- ИПП + амоксициллин + нифуратель (или нифуроксазид) 10 дней.
Контроль эффективности терапии (достижение эрадикации) следует проводить через 4-6 недель после окончания лечения. Для контроля целесообразно использовать неинвазивные методы, прежде всего, дыхательные (С13-углеродный тест или Хелик-тест). При отрицательном результате теста (эрадикации HP) дальнейшего лечения не требуется. При положительном результате повторная терапия проводится по другой схеме с использованием других антибиотиков, в частности, может быть назначена классическая схема второй линии - квадротерапия, включающая ИПП + Де-нол + тетрациклин (с 12 лет) + метронидазол. Если при проведении терапии первой линии не использовались нитрофураны, то вместо метронидазола оптимально назначение нифурателя или нифуроксазида. Альтернативой им могут быть левофлоксацин или рифабутин.
Пробиотики в лечении НР-инфекции
Одним из перспективных направлений антихеликобактерной терапии в последние годы стало использование пробиотиков. Согласно определению ВОЗ (2002г), пробиотики - это живые микроорганизмы, которые при применении в адекватных количествах вызывают улучшение здоровья организма хозяина. К пробиотикам относят многие штаммы облигатных бифидобактерий и лактобацилл, а также несвойственные человеку виды, доказавшие в клинических исследованиях свое пробиотическое действие, эффективность и безопасность (например, Saccharomyces boulardii- Энтерол®).
Действие пробиотиков не сводится к простому заселению кишечника, как это зачастую представляется. Их влияние более сложно и многопланово. Это:
- Конкуренция с патогенной микрофлорой
- Адгезия к слизистой оболочке ЖКТ и взаимодействие с эпителиоцитами
- Иммуномодулирующий эффект
При условии кислотоустойчивости штамма (а она доказана для S.boulardii, L.rhamnosus GG, L.reuteri, L.plantarum, L.acidophilus) пробиотики могут оказывать прямое антагонистическое действие в отношении HP. Они могут конкурировать с HP за питательные вещества и сайты адгезии, вырабатывать метаболиты, подавляющие его рост (летучие жирные кислоты, молочную кислоту, перекись водорода, пироглютамат). Многие штаммы вырабатывают бактериоцины - антибактериальные субстанции, которые ингибируют рост других микробов. Отдельные пробиотики - Энтерол® - способны прямо нейтрализовать токсины вирусов и бактерий. S. Roos и С. Johnson [128] показали, что некоторые штаммы лактобактерий обладают антагонизмом к HP in vitro.
Адгезия пробиотиков к кишечному эпителию обеспечивает их взаимодействие с местной иммунной системой. Некоторые микробные паттерны идентифицируются ею, в частности, липополисахариды, гликопептиды и формилпептиды, которые покрывают мембрану, могут улавливаться Toll-like рецепторами (TLR). Сигналы патогенных микробов и представителей индигенной флоры воспринимаются этими рецепторами по-разному. При реакции TLR на соответствующий структурный паттерн разрывается его комплекс с ингибитором (Tollip), и TLR передает стимулирующий импульс на белок NFkB, вследствие чего последний транспортируется в ядро клетки. Активация NFkB приводит к переключению дифференцировки ThO-лимфоцитов на Th1-путь и стимуляции выработки провоспалительных цитокинов. Микробная ДНК патогенов и комменсалов воспринимается по-разному. Олигонуклеотиды, в которых содержатся неметилированные динуклеотиды, что свойственно патогенной и условно-патогенной микрофлоре, улавливаются TLR с последующей стимуляцией воспалительного ответа. Эукариоидная ДНК и метилированные динуклеотиды, свойственные индигенной флоре, не воспринимаются TLR и не активируют иммунный ответ. Очевидно, что разные штаммы пробиотиков способны по-разному восприниматься иммунной системой ЖКТ, более того - восприятие каждого из препаратов может быть индивидуально. Тем не менее, большинство проведенных клинических и экспериментальных исследований свидетельствуют о том, что пробиотические штаммы лактобактерий ( LGG, L.acidophylus), а также S.boulardii (Энтерол®), Ent.faecium, Str.thermophylus воспринимаются TLR, но не сопровождаются активацией NFkB. Так, в работе C.Zhou с соавт. [129] было показано, что L.bulgaricum уменьшают вызванную HP экспрессию TLR4, ингибируют фосфорилирование ТАК1 и р38МАРК, предотвращая активацию NF-kB и блокируя продукцию IL-8 СОЖ. Пробиотики стимулируют фагоцитарную активность нейтрофилов и выработку SlgA, при длительном их приеме происходит преимущественное образование Th3 и, соответственно, выработка TGF-β, то есть, формирование иммунологической толерантности. Этот процесс сопровождается снижением синтеза IgE и усилением синтеза SlgA.
Исследование иммунного статуса детей с HP-ассоциированными гастродуоденальными заболеваниями, проведенное нами [130], показало, что у 68,6% из них наблюдаются те или иные признаки иммунологической неполноценности: у 34,7% имело место снижение уровня IgA, у 8,2% - IgM, у 18,4% - Т-лимфоцитов, у 20,4% - фагоцитарные дисфункции. Нами было отмечено, что разные формы HP-ассоциированных гастродуоденальных заболеваний у детей имеют свои иммунологические особенности. Самый высокий процент иммунологических дисфункций наблюдается при нодулярном гастрите, характеризующемся гиперплазией лимфоидных фолликулов в антральном отделе желудка: у 90% этих пациентов выявлено снижение уровня IgA. В сравнении с другими формами гастритов, эффективность эрадикационной терапии в этой группе была самой низкой.
Иммуномодулирующее действие пробиотиков расширяет возможности их использования и раскрывает широкие перспективы для применения. Для оценки эффективности пробиотиков в лечении НР-ассоцииированных гастродуоденальных заболеваний у детей нами было проведено открытое рандомизированное плацебо-контролируемое исследование у детей с использованием пробиотика, содержащего 2 штамма: B.longum 107 и Str.faecium 107 [130]. Под нашим наблюдением находились 24 пациента в возрасте от 11 до 16 лет с хроническими заболеваниями желудка и двенадцатиперстной кишки, ассоциированными с HP. У 11 больных эндоскопически диагностирована язвенная болезнь двенадцатиперстной кишки (ЯБДК), у 13 - хронический гастродуоденит (ХГД). Всем детям проводилось эндоскопическое исследование с биопсией из антрального отдела и тела желудка и морфологическое исследование биоптатов. Диагностика инфекции HP у всех больных была проведена 3 методами: быстрый уреазный тест, гистологическое исследование биоптатов (окраска азур-эозином) и дыхательный Хелик-тест. Исследование иммунного статуса включало определение в биоптатах слизистой оболочки желудка SlgA, в сыворотке крови -IgG, М, А, Е, а также фагоцитарной активности по тесту с нитросиним тетразолием. Исследован также уровень провоспалительных цитокинов в сыворотке крови: IL-1β и фактора некроза опухолей (TNF-α). Bceм пациентам была назначена одинаковая эрадикационная схема, включавшая эзомепразол (Нексиум) 20 мг, амоксициллин 1000мг, метронидазол 500 мг, Де-нол 240 мг, все препараты в указанных дозах принимались два раза в день, курс лечения составил 7 дней. 12 пациентов (основная группа ОГ) с первого дня приема схемы получали также пробиотик в рекомендуемой дозе в течение 3 недель. 12 пациентов (группа сравнения ГС) получали только стандартную схему без пробиотика.
Вышеописанное исследование проведено всем пациентам трижды: до начала лечения, сразу после окончания эрадикационной схемы (через неделю) и через 3 недели.
Исходный уровень сывороточных иммуноглобулинов не имел значимых отличий в основной группе и группе сравнения и составил соответственно для IgG - 11,03±0,59 г/л и 12,3±0,6 г/л, для IgM - 1,52±0,12 г/л и 1,25±0,2 г/л, для IgA - 1,78±0,17 г/л и 1,76±0,2 г/л ( р > 0,05). Уровень IgE был повышен только у больных ЯБДК, средний его уровень в основной группе составил 52,31 ±25 г/л. После проведения эрадикационной схемы уровень иммуноглобулинов всех классов остался прежним, но через 3 недели приема пробиотика у детей основной группы наблюдалось небольшая тенденция к повышению уровня IgA - 2,0±0,2 г/л и значительное снижение IgE - 10,6 г/л (р < 0,05). Изменения уровня SlgA в биоптатах слизистой оболочки после курса пробиотика были более значимы, чем IgA в сыворотке. У всех пациентов, в том числе у 5 больных с нодулярным гастритом, у которых исходный уровень SlgA был достоверно ниже, чем при других формах гастродуоденальной патологии (199±23 нг/мл против 310±29 нг/мл, р < 0,05), отмечалось повышение его выработки - в среднем с 214,2±31 нг/мл до 485±52 нг/мл, р < 0,05. Фагоцитарная активность, как спонтанная, так и стимулированная зимозаном, повышалась на фоне приема пробиотика. Уровень провоспалительных цитокинов (IL-1β и TNF-α) сразу после окончания эрадикационной схемы повысился у всех больных, но последующий прием пробиотика способствовал достоверному его снижению, причем повышения TNF-α не обнаружено при заключительном исследовании ни у одного пациента. Результаты представлены в таблицах 1-4.
Эрадикация HP была достигнута у 82% в основной группе и 72% в группе сравнения.
Таблица 1. Изменение фагоцитарной активности на фоне приема пробиотика
Фаг. спонтанный Фаг.стимулированный Таблица 2. Уровень провоспалительных цитокинов (IL-1β и TNF-α) в сыворотке крови на фоне приема пробиотика
До лечения Через 1 нед Через 3 нед IL-1 β 154,5±25 128±101 138±18,1 103±98 51,25±8 134±97 TNF-α 124,3±49,7 37,3±21 15,4±2,2 22,0±13,1 0 18,0±12,0 p<0,05 р > 0,05 Таблица 3. Уровень IgE в сыворотке крови на фоне приема пробиотика
До лечения Через 1 нед. Через 3 нед. Таблица 4. Уровень SlgA в слизистой оболочке желудка на фоне приема пробиотика
Уровень SigA (нг/л) До лечения Через 1 нед. Через 3 нед. Полученные нами данные подтвердили, что пробиотики обладают иммуномодулирующим действием, которое заключается в усилении фагоцитарной активности и выработке SlgA, основного иммунного компонента слизистого барьера пищеварительного тракта. Назначение пробиотиков на фоне эрадикационной терапии способно корректировать иммунные нарушения, вызванные HP, и нормализовать, в частности, секрецию SlgA даже у больных с заведомо дефектным иммунологическим фоном. Интересно, что уровень провоспалительных цитокинов (IL-1 β и TNF-α) прогрессивно снижался в течение всего времени приема пробиотика, что дает основание рекомендовать более продолжительные курсы пробиотиков по сравнению со стандартной схемой эрадикационной терапии (не менее 14 дней). Подавление выработки провоспалительных цитокинов, которые поддерживают альтерацию слизистой оболочки и могут играть ключевую роль в формировании наиболее тяжелых, эрозивно-язвенных поражений гастродуоденальной зоны, а также снижение уровня IgE, наблюдаемое на фоне приема пробиотиков, свидетельствуют о способности последних влиять на дифференцировку Т-хелперов, уменьшая тем самым активность воспаления. Общим результатом дополнения схемы лечения HP пробиотиком является повышение процента эрадикации. То есть, задача повышения эффективности антихеликобактерной терапии может иметь простое и безопасное решение - применение пробиотиков с доказанным действием.
Исследования, проведенные как в России, так и за рубежом, показали некоторое повышение эффективности лечения и уменьшение побочных реакций при параллельном назначении пробиотиков. В работе П.Л. Щербакова с соавт. [131] было показано повышение процента эрадикации HP с 84% при назначении стандартной тройной схемы до 92% при параллельном приеме Линекса.
Ряд работ посвящено оценке эффективности монотерапии НР-инфекции пробиотиками. В литературе имеются данные об антихеликобактерной активности Saccharomyces boulardii in vitro [132]. M.Gotteland с соавт. [133] сравнили эффективность монотерапии S.boulardii (Энтерола®), монотерапии L.acidophilus LB и стандартной 7-дневной тройной терапии у HP-инфицированных школьников. Пробиотики назначались дважды в день на протяжении 2 месяцев. Эрадикация HP была достигнута у 66% детей, получавших тройную схему, 12% - получавших монотерапию S.boulardii и 6,5% - монотерапию L.acidophilus LB. В работе В.И. Симаненкова с соавт. [134] с использованием E.faecium L-3 в качестве монотерапии у больных хроническим гастритом и язвенной болезнью было продемонстрировано не только улучшение клинической симптоматики, но и достижение эрадикации HP соответственно в 45% и 30%. То есть, некоторые пробиотики обладают антихеликобактерным действием in vivo, но недостаточным в сравнении с антибиотикотерапией. S.Kamiya с соавт. [135] обнаружили ингибирующий эффект Cl.butyricum, которая подавляет адгезию HP к эпителию, бактерицидное действие масляной кислоты превышает таковое у молочной и соляной кислот.
Большинство исследований посвящено оценке терапии пробиотиками на фоне стандартных схем. Так, в рандомизированном плацебо-контролируемом исследовании М. Cindoruk с соавт. [136] 124 пациента с НР-ассоциированными гастродуоденальными заболеваниями были разделены на 2 группы, одна из которых получала обычную эрадикационную терапию (ИПП+амоксициллин+кларитромицин в стандартных дозах), а другая на фоне ее - Энтерола® (S.boulardii) 10ОО мг/сут. Назначение Энтерола® на фоне стандартной тройной схемы улучшило ее переносимость, уменьшая выраженность диареи, метеоризма и болей. Увеличилась и результативность лечения - эрадикация была достигнута в 71% против 59% в контрольной группе. В мультицентровом исследовании, проведенном в Турции и включавшем 389 пациентов [137], было показано, что назначение Энтерола® на фоне тройной терапии снижает вероятность антибиотико-ассоциированной диареи (5,9% в основной группе против 11, 5% в контрольной).
Исследование Е. Lionetti с соавт. [138] оценило эффективность L.reuteri у детей на фоне последовательной терапии (5 дней омепразол + амоксициллин, затем 5 дней - омепразол + кларитромицин+тинидазол). Авторы отметили уменьшение симптомов диспепсии на фоне пробиотика (4,1 против 6,2 баллов).
B.S. Sheu с соавт. [139] рандомизировали 138 пациентов, половина из которых в течение 4 недель перед стандартной квадротерапией получали 400 мл йогурта, содержащего лакто- и бифидобактерии. В группе, получавшей йогурт, наблюдался более высокий процент эрадикации HP (85% против 71% в группе сравнения).
E.С. Nista с соавт. [140] провели плацебо контролируемое исследование эффективности Bacillus clausii на протяжении 14 дней в дополнение к 7-дневной тройной терапии рабепразолом + кларитромицином + амоксициллином у 120 больных с HP-инфекцией. В группе больных, получавших B.clausii, достоверно реже наблюдались боли в эпигастрии, тошнота и диарея, но уровень эрадикации HP существенно не отличался от группы плацебо.
F. Cremonini с соавт. [141] сравнили эффективность различных пробиотиков ( S.boulardii, LGG, комбинацию бифидо- и лактобактерий) и плацебо на фоне стандартной тройной терапии и 7 дней после ее окончания. У всех пациентов, получавших пробиотики, наблюдалось снижение побочных проявлений антибиотиков: тошноты, диареи, металлического вкуса во рту. При этом различий в зависимости от штамма пробиотика не отмечено, уровень эрадикации HP также не имел достоверных отличий.
В ряде работ оценивалась эффективность продуктов функционального питания, в частности йогуртов, содержащих различные штаммы лактобацилл. J. Sykora с соавт. [142] изучали эффективность кисломолочного продукта, содержащего L.casei DN-114001, у детей в дополнение к стандартной тройной терапии, было показано достоверное повышение уровня эрадикации HP. Уменьшение плотности колонизации СОЖ было продемонстрировано при назначении продуктов, содержащих L.gasseri LG21, L.acidophilus, L.brevis, B.lactis. N.Uemura с соавт. доказано также профилактическое действие некоторых штаммов лактобацилл, в частности, L.gasseri LG21, в сдерживании развития атрофического гастрита при персистировании HP [143]. Прием LG21 сопровождался снижением уровня IL-8 в СОЖ, а также тенденцией к нормализации соотношения ПГ1/ПГ2 в сыворотке крови. Мета-анализ 10 рандомизированных исследований, включавших 963 пациента, получавшего продукты функционального питания с пробиотиками на фоне стандартной терапии HP и 465 пациентов группы сравнения, показал, что пробиотики повышают уровень эрадикации HP на 5-15% и снижают выраженность побочных реакций основной терапии [144].
Постоянное употребление продуктов функционального питания с лактобациллами снижает вероятность заражения HP. На основании этого с целью профилактики хеликобактериоза можно рекомендовать йогурты с лактобациллами определенных штаммов. Профилактическое действие L.gasseri LG21 было продемонстрировано в оригинальном исследовании S.Boonyaritichaikij [145], когда дети двух параллельных классов одной из школ Таиланда получали йогурт, обогащенный LG21, либо простой йогурт. Через год на фоне приема LG21 процент инфицированных HP детей, по данным ИФА в кале, снизился с 26% до 10%, в группе сравнения он остался прежним. В проспективном исследовании японских ученых прослежено снижение антител к HP при ежедневном употреблении йогурта, обогащенного LG21 [146].
Таким образом, на сегодня можно считать доказанным адьювантное действие пробиотиков на фоне стандартной антихеликобактерной терапии, которое заключается в повышении результативности лечения и снижении побочных эффектов антибиотиков. Эффективность пробиотиков можно объяснить стабилизацией барьерных функций желудочного эпителия, уменьшением активности воспаления в сочетании с иммуномодулирующим действием, а также прямым антагонизмом по отношению к HP и снижением его способности к адгезии. По-нашему мнению, пробиотики с доказанным действием должны обязательно назначаться детям на фоне стандартных схем эрадикационной терапии. Продолжительность курса пробиотиков должна превышать продолжительность курса антибиотиков, то есть, они должны назначаться с первого дня схемы и быть продолжены на 10-14 дней после ее окончания. С профилактической целью после окончания лечения целесообразно регулярно употреблять продукты функционального питания с пробиотиками.
Применение иммуномодуляторов в лечении HP- инфекции
HP-ассоциированные гастродуоденальные заболевания сопровождаются иммунологической недостаточностью более чем у половины пациентов, что, вероятно, снижает результативность эрадикационной терапии. В связи с этим, предпринимались попытки использования различных препаратов, обладающих прямым или косвенным воздействием на иммунологическую реактивность организма. Выше обсуждалось применение пробиотиков, обладающих иммуномодулирующим действием. В 2006 г опубликована работа F. Di Mario с соавт. [147], в которой показана эффективность бычьего лактоферрина в качестве как адъювантной, так и монотерапии. Лактоферрин является железосвязывающим гликопротеином, который в норме секретируется в ЖКТ и оказывает бактерицидное действие, в частности, препятствует адгезии HP и потреблению им железа.
В качестве адьювантной терапии с целью иммуномодуляции мы использовали отечественный индуктор выработки интерферона циклоферон. Основанием для этого явились данные о его эффективности при других вялотекущих хронических инфекциях как вирусной, так и невирусной этиологии [148]. Циклоферон является индуктором выработки α- и γ-интерферонов, которые участвуют не только в осуществлении противовирусной защиты, но и оказывают стимулирующее влияние на функцию Т-хелперов, усиливая тем самым выработку иммуноглобулинов основных классов.
Мы провели сравнительную оценку эффективности эрадикационной терапии у 37 детей от 7 до 14 лет с хроническими HP-ассоциированными гастритами, проведенной у 22 детей по тройной схеме, включавшей омепразол в дозе 20мг, амоксициллин 50 мг/кг и метронидазол 20 мг/кг в сутки в течение 7 дней, и у 15 пациентов того же возраста с аналогичной патологией по схеме, дополненной циклофероном. Циклоферон назначался по 2,0 мл 12,5% раствора внутримышечно. Иньекции проводились в 1,2,4,6,8 день лечения. Остальные компоненты эрадикационной схемы назначались в вышеуказанных дозах со 2 дня лечения на 7 дней. То есть, общая продолжительность схемы: циклоферон + омепразол + метронидазол + амоксициллин, составила 8 дней. Контроль эрадикации проводился нами в сроки от 1 до 3 месяцев после окончания курса антихеликобактерной терапии. Контрольное исследование включало опрос и осмотр больного, проведение ЭГДС со взятием 3 биоптатов (1 из антрального отдела и 2 из тела желудка). Все биоптаты подвергались исследованию уреазной активности с помощью Хелпил-теста, а затем гистологическому исследованию.
Эрадикация HP при использовании стандартной тройной схемы была достигнута у 16 из 22 больных, что составило 73%. При параллельном назначении циклоферона эрадикации удалось достичь у 14 из 15 пациентов, что составило 93%. Таким образом, двойная направленность терапии: с одной стороны, на уничтожение микроба, а с другой - на повышение механизмов иммунологической защиты организма, увеличила результативность лечения на 20%. Полученные нами результаты позволяют рекомендовать использование индукторов интерферона, в частности - отечественного препарата циклоферон, для повышения эффективности антихеликобактерной терапии, дополняя им стандартные эрадикационные схемы.
Немногочисленные работы посвящены изучению фитотерапии при НР-инфекции, в частности, применению, так называемых, «фитоцевтиков», обладающих биологической активностью. К ним относятся корень женьшеня, зеленый чай, красное вино, флавоноиды, брокколи, чеснок. Эти вещества способны подавлять колонизацию HP, снижать активность воспаления СОЖ, благодаря подавлению высвобождения провоспалительных цитокинов, а также ингибировать связывание NFkB с ядерной ДНК, уменьшая тем самым риск мутагенеза. И, хотя достижение эрадикации HP при приеме фитоцевтиков не доказано, они могут быть использованы в качестве дополнительной терапии для повышения эффективности лечения и уменьшения тяжести проявлений HP-ассоциированных заболеваний [149]. Сравнительная оценка антихеликобактерной активности in vitro алоэ, чеснока и циркумина показала эффективность только последнего из них [150]. В работе M.Matsushima с соавт. [151] показано, что клюква, за счет содержащейся в ней полифенолов, подавляет рост HP, причем этот эффект дозазависим. Несколько меньшим действием обладают черника и красный виноград. В отличие от них, соки апельсина, ананаса, яблока и белого винограда не обладают антихеликобактерным действием.
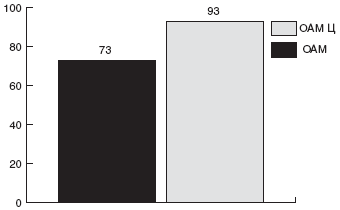
Рис. Процент эрадикации HP у детей после назначения тройной терапии, дополненной цикпофероном (ОАМ Ц) по сравнению со стандартной тройной терапией (ОАМ).Перспективы антихеликобактерной терапии
Рассматривая перспективы антихеликобактерной терапии, следует выделить несколько направлений: первое - создание новых антибиотиков специфической направленности. Расшифровка генома HP позволила выделить потенциальные мишени для их воздействия. Одной из них может быть индекапренилпирофосфатсинтетаза [152]. Другой - два фермента HP: уреаза и карбоангидраза, которые играют важную роль в адаптации HP в кислой среде желудка. Карбоангидраза может быть ингибирована некоторыми сульфаниламидами: ацетазоламидом, топираматом, сульпиридом [153]. Новые антибиотики, синтезированные в последние годы, продемонстрировали активность против HP in vitro: мурипоцин, ситафлоксацин и клинафлоксацин, а также натуральные антибиотики пилорицидины и дериваты тиенилтиазола [154].
Вторым направлением является разработка вакцины против HP. Первоначально эксперименты на животных оказались весьма успешными и обнадеживающими [155], но создание вакцины для человека столкнулось с рядом трудностей. Предполагалось, что оральная иммунизация может быть простой и эффективной, поскольку именно этот путь обеспечивает непосредственное взаимодействие с иммунной системой ЖКТ. Использование уреазы E.coli, как универсального антигена, оказалось вполне безопасным, но недостаточным для стимуляции иммунитета к HP [156]. В дальнейшем были апробированы некоторые штаммы сальмонеллы, экспрессирующие уреазу, в частности, после введения вакцинального штамма S.typhi Ту21а D.Bumann с соавт. [157] получили сероконверсию к HP у половины из 12 волонтеров. Кислая среда желудка, возможно, ограничивает активность бактерий и становится непреодолимой преградой для вакцины, поэтому интраназальный или парентеральный путь введения может оказаться более эффективным. В 2002 г немецкие ученые получили обнадеживающие результаты у 57 здоровых добровольцев, получавших вакцину, содержавшую 3 антигена HP: VacA, GagA и NAP, и введенную 3-х кратно в разных режимах. Независимо от режима, через месяц после введения третьей дозы у всех испытуемых были обнаружены антитела, как минимум, к 2 их 3 антигенов, а у 87% - ко всем трем. Местные и системные побочные реакции были легкими и сопоставимыми с плацебо [158]. Последние данные показали, что лучшим способом иммунизации может быть систематическое пероральное или интраназальное введение LT-мутанта как адьюванта, в качестве которого были использованы очищенные CagA и NAP-антигены HP [159]. Учитывая, что заражение HP нередко происходит в раннем возрасте, предлагается использовать также пассивную иммунизацию с помощью йогуртов с готовыми антителами к HP [160]. В Японии выпущен йогурт, содержащий антитела к уреазе, полученные после иммунизации цыплят, названные антителами класса IgY. Исследование 42 добровольцев показало, что уровень уреазы в желудке инфицированных HP снизился после курса лечения йогуртом с антителами по сравнению с обычным кисломолочным йогуртом. По мнению разработчиков, химика Hajime Hatta и соавторов, регулярное употребление этого продукта снизит вероятность заражения HP за счет связывания его с антителами, препятствующими адгезии возбудителя к клеткам желудочного эпителия и способствующими его элиминации.
Третьим направлением является использование последовательных схем терапии, способных достичь эрадикации HP в условиях растущей антибиотикорезистентности.
Четвертое направление - использование адьювантной терапии (с дополнением обычной схемы пробиотиками, иммуномодуляторами или биоактивными веществами).
Все эти направления требуют активного изучения, особенно для использования в детской практике.
Отдаленные результаты эрадикационной терапии
Одним из наиболее важных практических вопросов является возможность обратного развития тех изменений, которые возникают в желудке в ответ на HP-инфекцию, после проведенного лечения и эрадикации возбудителя. Для ответа на этот вопрос мы оценили динамику клинических, эндоскопических и морфологических данных у детей в течение 3 лет после проведения стандартной антихеликобактерной терапии.
Под нашим наблюдением были 100 HP-инфицированных пациентов в возрасте от 7 до 15 лет: 79 с HP-ассоциированным хроническим гастритом (ХГ) и 21 - с язвенной болезнью двенадцатиперстной кишки (ЯБДК). Все дети были обследованы до назначения антихеликобактерной терапии, через 1-2 мес. после ее окончания для подтверждения эрадикации HP и через год после лечения. У 46 пациентов эрадикация HP была достигнута после первой линии терапии (НР-), у 54 детей, несмотря на проведенное лечение, HP-инфекция персистировала (НР+). Этой группе больных через год после первой линии терапии и повторного обследования была назначена вторая линия терапии, и они были исключены из последующего наблюдения. Наблюдение было продолжено за 44 НР(-) пациентами первой группы, они были обследованы повторно спустя 3 года после эрадикации HP.
Каждый этап обследования включал оценку клинических симптомов по разработанной нами анкете, эндоскопию с взятием биоптатов из антрального отдела и тела желудка, гистологическое исследование биоптатов, уреазный тест и дыхательный Хелик-тест. Для более объективной количественной оценки морфологических изменений каждый раз оценивались воспалительный индекс (ВИ) и дистрофический индекс (ДИ). У каждого пациента было проведено сравнение клинических, эндоскопических и морфологических данных до лечения, через год и через 3 года после него.
В течение года после проведенной терапии абсолютное большинство пациентов, у которых произошла эрадикация (НР-), не предъявляли жалоб на боли в животе (43 из 46), и лишь трое (7%) детей жаловались на редкие боли в области пупка, болезненность при пальпации в эпигастрии выявлена лишь у 1 (2%) ребенка. Дети, у которых при контрольном исследовании через год после лечения HP был обнаружен (НР+), гораздо чаще предъявляли жалобы на боли в животе - в 41% (22 из 54), а болезненность при пальпации в эпигастральной области выявлена у 48% (26 из 54). В то же время следует отметить, что большинство больных с неудачной попыткой эрадикации также не предъявляли жалоб (59%) и не указывали на болезненность в эпигастрии при пальпации (52%). То есть, отсутствие жалоб и объективной болезненности еще не могут быть достаточным основанием для суждения о результативности терапии. С другой стороны, проведенная антихеликобактерная терапия, даже неудачная, может приводить к стойкому улучшению самочувствия ребенка, продолжительной ремиссии. В случае же достигнутой эрадикации стойкое исчезновение болей и болезненности наблюдается почти всегда (рис.).
Рис. Наличие эпигастральной боли и болезненности в течение года у детей после достигнутой (НР-) и не достигнутой (НР+) эрадикации.Эндоскопическая картина, спустя год после успешной эрадикации HP, характеризовалась улучшением у половины (50%) пациентов. Ни у кого не было обнаружено язв или эрозий, уменьшилась гиперемия и отек, исчезла гиперплазия лимфоидных фолликулов. Во всех случаях гастрит носил поверхностный характер. У 6 (13%) НР(-) детей наблюдалась полная нормализация эндоскопической картины. Отсутствие динамики было констатировано лишь у тех больных (37%), у которых и до лечения процесс характеризовался поверхностными изменениями слизистой оболочки. Ни у одного из детей НР(-) - группы не отмечено ухудшения эндоскопических данных.
Другая картина обнаружена у пациентов с неудавшейся эрадикацией HP. У большинства из них (59%) динамики эндоскопических данных не выявлено, причем это касается всех форм HP-ассоциированных заболеваний: у 3 пациентов с ранее диагностированной ЯБ вновь выявлена «открытая» язва, у 1 пациента с ранее установленным эрозивным дуоденитом вновь обнаружены эрозии, у всех пациентов с нодулярной формой гастрита сохранялась видимая глазом гиперплазия лимфоидных фолликулов. У 15% детей эндоскопическая картина ухудшилась: у 2 детей с ранее выявленным антральным и у 1 с распространенным поверхностным гастритом произошла трансформация в эрозивный, у 2 - в нодулярный, у 1 ребенка с нодулярным антральным гастритом были обнаружены эрозии луковицы ДПК, у 1 пациента с эрозивным дуоденитом обнаружена язва луковицы ДПК, у многих больных было отмечено распространение процесса на тело желудка, гастрит характеризовался активным воспалением, которое проявлялось яркой гиперемией и отеком. В то же время, у 26% детей этой группы эндоскопические данные улучшились, это касалось детей с эрозивно-язвенным процессом, у которых при контрольном исследовании через год язв и эрозий не было, уменьшились гиперемия и отек, но нодулярные формы ни у одного больного без эрадикации не претерпели обратного развития. Нормализации эндоскопической картины не зафиксировано ни у одного пациента с сохраняющимся HP.
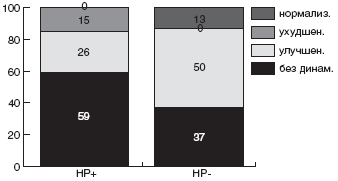
Рис. Динамика эндоскопических данных через год после антихеликобактерной терапии у детей с достигнутой эрадикацией (НР-) и без нее (НР+).Таким образом, эрадикация HP приводит у большинства пациентов к улучшению или даже нормализации эндоскопической картины и никогда -к ухудшению. Отсутствие эрадикации знаменует продолжение патологического процесса, обычно без отчетливой динамики. При этом возможно некоторое улучшение - вероятно, на фоне стойкой ремиссии. Только в случае персистирования HP наблюдается ухудшение эндоскопической картины, свидетельствующее о прогрессировании патологического процесса.
Морфологически у абсолютного большинства пациентов (95,7%) после успешной эрадикационной терапии происходит снижение воспалительных изменений СОЖ: уменьшается клеточная инфильтрация, среди клеток воспалительного инфильтрата преобладают лимфоциты, иногда с плазмоцитами, но ни у одного из больных этой группы нами не обнаружено нейтрофилов. Уменьшается глубина и плотность инфильтрата, исчезает отек стромы. У 6 пациентов (13%) морфологическая картина после проведенного лечения полностью соответствовала норме. Усиления воспалительных изменений после эрадикации HP не обнаружено ни у одного больного, лишь у 2 из 46 (4,З%) детей этой группы с исходно низким ВИ этот показатель остался без изменений. Средний ВИ после эрадикации HP составил 5,15±0,25, что достоверно ниже (р < 0,01) ВИ этих же детей до лечения, который составил 9,35±0,4. Эти данные представлены на рис.
В отличие от детей, у которых антихеликобактерная терапия привела к уничтожению HP, у пациентов с неудачной попыткой эрадикации динамика морфологических показателей была неоднозначной. У большинства детей воспалительные изменения либо усилились (33,3%), либо остались неизменными (20,4%). Однако у 25 из 54 детей этой группы (46,3%) воспалительные изменения уменьшились. Ни у одного из больных не произошло нормализации морфологической картины. Средний ВИ слизистой оболочки антрального отдела желудка через год после лечения в группе детей с сохранившимся HP составил 9,51 ±0,35, что практически не отличается от ВИ этих детей до лечения (9,96±0,3, р > 0,05), но достоверно выше ВИ больных с достигнутой эрадикацией (5,15±0,25), р < 0,01 (рис. ).
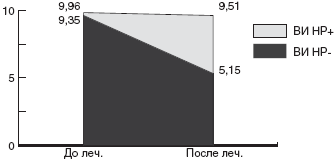
Рис. Динамика воспалительного индекса (ВИ) через год после лечения у больных с достигнутой эрадикацией (НР-) и без нее (НР+).На рис. представлено распределение больных по степени активности воспаления до и через год после антихеликобактерной терапии при успешном (НР-) и безуспешном (НР+) результате лечения.
Дистрофические изменения СОЖ после успешно проведенной антихеликобактерной терапии также претерпевали существенные изменения: из 5 детей с признаками атрофии желез через год после эрадикации HP она сохранялась лишь у одного ребенка. Ни у одного из 3 детей с признаками кишечной метаплазии ее не удалось обнаружить при контрольном исследовании. Фиброз стромы, который имел место у 20 (43%) детей, сохранялся лишь у 6 (13%). У пациентов этой группы не выявлено вакуолизации эпителия. Нарастание дистрофических изменений (дистрофии эпителия желез) было обнаружено только у одного ребенка. То есть, у большинства пациентов после эрадикации HP выявляемые до лечения признаки дистрофии и метаплазии уменьшились или полностью исчезли. Средний дистрофический индекс через год после успешного лечения составил 0,37±0,08, в то время, как до лечения он был равен 1,0±0,15, различия между ними достоверны ( р <0,01). Эти данные представлены на рис..
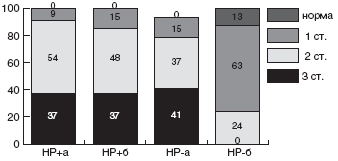
Рис. Распределение больных по активности воспаления до и через год после лечения (НР+а - до лечения больных с недостигнутой эрадикацией, НР+б -после их лечения, НР-а - до лечения больных с достигнутой эрадикацией, HP-б - после их лечения).
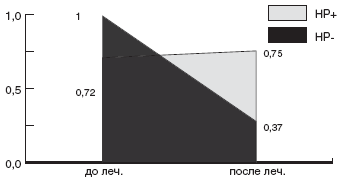
Рис. Изменение дистрофического индекса (ДИ) через год после эрадикации (НР-) и после неэффективной терапии (НР+).При гистологическом исследовании через год после неэффективного лечения у большинства больных (24%) обнаруживались прежние дистрофические изменения СОЖ, сохранялась и кишечная метаплазия (у 3 детей). У 9 (16,7%) больных наблюдалось даже некоторое нарастание дистрофических изменений, касающееся дистрофии эпителия и фиброза стромы. Лишь у 2 детей (3,7%) выявлено уменьшение признаков дистрофии. Средний ДИ через год после лечения в этой группе имел некоторую тенденцию к нарастанию (0,747±0,1) по сравнению с исходным (0,717±0,1), но эти различия недостоверны ( р > 0,05).
Таким образом, проведенное нами исследование динамики морфологических изменений после антихеликобактерной терапии показало, что эрадикация HP приводит к достоверному снижению активности воспаления, глубокой и стойкой ремиссии патологического процесса, а у части больных - к полной нормализации морфологической картины. Практически всегда исчезает гиперплазия лимфоидных фолликулов, никогда не выявляются в них светлые центры размножения. После устранения HP существенно уменьшается выраженность не только воспалительных, но и дистрофических изменений: уменьшается или полностью исчезает атрофия, исчезает даже кишечная метаплазия, не обнаруживается вакуолизация эпителия. В случае неэффективного лечения воспалительная активность остается прежней, при этом у части больных воспалительные изменения даже усиливаются. Гиперплазии лимфоидных фолликулов с признаками активного размножения при сохраняющейся персистенции HP не исчезает и даже усиливается. Дистрофические и дисрегенераторные изменения сохраняются или даже нарастают.
Через 3 года после успешной эрадикации HP у 19 (43%) из 44 HP (-) пациентов установлена реинфекция HP (рис.). Она сопровождалась возобновлением болей в животе, усилением воспалительных изменений слизистой оболочки желудка эндоскопически и морфологически, при гистологическом исследовании вновь усилилась атрофия. У всех реинфицированных пациентов гастрит носил характер распространенного, охватывая как антральный отдел, так и тело желудка. У 3 детей вновь обнаружена дуоденальная язва, еще у 1 ребенка она диагностирована впервые. ВИ увеличился с 6,2±0,4 до 9,9±0,3 ( р < 0,01), ДИ - с 0,4±0,08 до 2,2±0,12 ( р < 0,01). Воспалительная активность была близка первоначальной, а атрофические изменения превосходили таковые при первичном обследовании.
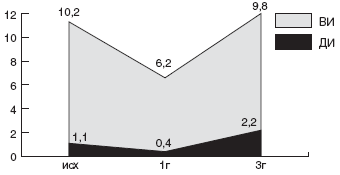
Рис. Динамика воспалительного индекса (ВИ) и дистрофического индекса (ДИ) у детей через год после успешной эрадикации и последующей реинфекцией HP.
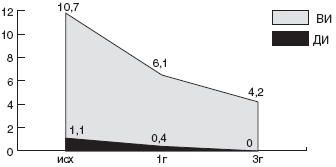
Рис. Динамика воспалительного индекса (ВИ) и дистрофического индекса (ДИ) у детей через год и 3 года после успешной эрадикации.Остальные 25 НР(-) пациентов, оставшихся неинфицированными, демонстрировали через 3 года после эрадикации HP дальнейшее снижение воспалительной активности: ВИ снизился у них с 6,1 ±0,3 до 4,2±0,28 ( р < 0,05). Атрофии и метаплазии не было обнаружено ни в одном случае, ДИ стал равен 0. Полная нормализация гистологической картины наблюдалась у 6 (28%) детей.
Полученные данные еще раз доказывают ведущую роль инфекции HP в развитии хронических заболеваний желудка и двенадцатиперстной кишки. Только полное уничтожение HP является условием возможного выздоровления. Устранение HP позволяет достичь существенного снижения воспалительной активности патологического процесса и даже полной нормализации морфологических данных. Полученные результаты свидетельствуют о возможности обратного развития атрофических и дисрегенераторных нарушений у детей с хронической гастродуоденальной патологией при условии полного уничтожения HP. В то же время, следует отметить высокий процент реинфекции, который составляет у детей, по нашим данным, примерно 20 % в год. Это требует разработки мер вторичной профилактики, которые могут сводиться к просветительской работе с ребенком и его родителями, а также обследования и лечения его ближайшего окружения.
Литература:
1. Malferthiener P. Prevention of gastric cancer by Helicobacter pylori eradication // Maastricht-3 Guidelines for Helicobacter pylori infection. - 13 United European Gastroenterology Week. - Copenhagen, 2005.
2. Perri F., Qasim A., Marras L., O'Morain C. Treatment of Helicobacter pylori infection // Helicobacter. - 2003. - Vol. 8, Suppl. 1. - P. 53-60.
3. Корсунский А.А.. Инфекция Helicobacter pylori в педиатрической практике. // В сб. «Helicobacter pylori: революция в гастроэнтерологии». Ред. акад. РАМН В.Т. Ивашкина, проф. Ф. Мегро, Т.Л.Лапиной. М., 1999,- С. 224-243.
4. Drumm В., Koletzko S., Oderda G. Helicobacter pylori infection in children: a consensus statement. European Paediatric Task Force on Helicobacter pylori. - J. Pediatr. Gastroenterol Nutr.- 2000.-V.30.-N 2.-P.207-213
5. Рекомендации по диагностике и лечению инфекции Helicobacter pylori у взрослых при язвенной болезни желудка и двенадцатиперстной кишки // Рос. журн. гастроэнтерол. гепатол. колопроктол. - 1998. - № 1. - С. 105-107.
6. McNulty С.А.М., Dent J.С. Susceptibility of Campylobacter pylori to twenty-one antimicrobal agents.// Eur.J.Clin.Microbiol.Infect.Dis., 1988, v.7, p.566-569.
7. McNulty C.A.M. Bacteriological and pharmacological basis for the treatment of Campylobacter pylori infection.- In: Rathbone B.J., Heatley R.V.eds. Campylobacter pylori and gastroduodenal disease.- Blackwell, Oxford, 1989,p.209-216.
8. Tejada M., Malizia Т., Marchetti F. et al. The Third International Conference of the Macrolides, Azalides and Streptograminis.- Lisbon,1996, Abs.p.50.
9. Григорьев П.Я., Яковенко Э.П. Современные представления о пилорическом геликобактериозе.-Практикующий врач,1998, №2 (13), с.14-17.
10. Megraund F., Brugmann D., Darmillac V. The Third International Conference of the Macrolides, Azalides and Streptograminis.-Lisbon,1996, Abs.p.47.
11. Glupczynski Y., Burette A. Drug therapy of Helicobacter pylori infection: Problems and pitfalls.- Amer.J.Gastroent.,1990,v.85,p.1545-1550.
12. Guggenbichler J. Josamycin, ein Macrolid-Antibioticum mit bemerkenswerten Eigenschaften // Arzneimitterpraxis. - 1997. - Bd. 27, № 4/5. - S. 1061-1064.
13. Корниенко E.A., Дмитриенко M.A., Ломакина E.A. Аммиачный дыхательный тест в диагностике инфекции Helicobacter pylori // Клиническая лабораторная диагностика. - 2000. - № 1. - С. 41-43.
14. Watanabe К., Tanaka A., Imase К. et al. Amoxicillin resistance in Helicobacter pylori: studies from Tokyo, Japan from 1985 to 2003 // Helicobacter - 2005. - Vol. 10, № 1.-P. 4-11.
15. Isakov V., Domareva I., Koudryavtseva L., Maev I., Ganskaya Z. Furazolidone-based triple "rescue therapy" vs. quadruple "rescue therapy" for the eradication of Helicobacter pylori resistant to metronidazole // Aliment. Pharmacol. Ther. - 2002. -Vol. 16, № 7.-P. 1277-1282.
16. Kawabata H., Habu Y., Tomioka H. et al. Effect of different proton pump inhibitors, differences in CYP2C19 genotype and antibiotic resistance on the eradication rate of Helicobacter pylori infection by a 1 -week regimen of proton pump inhibitor,
amoxicillin and clarithromycin//Aliment. Pharmacol. Ther. -2003. - Vol. 17, № 2. - P. 259-264.
17. Miki I., Aoyama N., Sakai T. et al. Impact of clarithromycin resistance and CYP2C19 genetic polymorphism on treatment efficacy of Helicobacter pylori infection with lansoprazole- or rabeprazole-based triple therapy in Japan // Eur. J. Gastroenterol. Hepatol. - 2003. - Vol. 15, № 1. - P. 27-33.
18. Щербаков П.Л., Вартапетова E.E., Филин В.А., Салмова B.C. Алгоритм современной диагностики и лечения хеликобактерной инфекции у детей с заболеваниями верхних отделов пищеварительного тракта // Педиатрия. - 2003. -№ 6. - С. 86-91.
19. Неер М., Kist М., Strobel S. et al. Secondary resistance among 554 isolates of Helicobacter pylori after failure of therapy // Eur. J. Clin. Microbiol. Infect. Dis. - 2000. -Vol. 19, № 7.-P. 538-541.
20. Моисеев С.В. Джозамицин: отличительные особенности и перспективы применения // Клин, фармакол. и терапия. - 2005. - № 14 (4). - С. 1-4.
21. Grayson M.L., Eliopoulos G.M., Ferraro M.J., Moellering R.C. Jr. Effect of varying pH on the susceptibility of Campylobacter pylori to antimicrobial agents // Eur. J. Clin. Microbiol. Infect. Dis. - 1989. - Vol. 8, № 10. - P. 888-889.
22. Lee S.P. A potential mechanism of action of colloidal bismuth subcitrate: diffusion barrier to hydrochloric acid.- Scand. J.Gastroenterol.,1982,v.17,s.80,p.17-21.
23. Soutar R.L., Coghill S.B. Interaction of tripotassum dicitrato bismuthate with macrophages in the rat and in vitro.-Gastroenterology, 1986, v.91,p.84-93.
24. Coghill S.B. Experimental studies using colloidal bismuth subcitrate; possible models of action.- ln:Proceedings of an international symposium organised under the auspices of the university of Cairo. Pathogenesis and treatment of peptic ulcer disease.- Excerpta Medica, Cairo, 1985,p.7-12.
25. Tasman-Jones C., Maher C., Thomsen L. et al. Mucosal defences and gastroduodenal disease.- Digestion,1987,v.37,s.2,p.1-7.
26. Roberts N.B., Taylor W.H. The effect of tripotassum dicitrato bismuthate (De-nol) upon the individual human pepsins.- Scand.J.Gastroenterol.,1982,v.17,s.78,p.114.
27. Stiel D., Peters T.J. Tripotassum dicitrato bismuthate (De-nol) binds conjugated bile acids in vitro - a possible mechanism in gastric ulcer healing.- Proc.Aust.Soc.Med. Res.,1983,v.16,p.18.
28. Hall D.W.R., van der Hoven W.E. Gastric mucosa protective effects of colloidal bismuth subcitrate (De-nol).- Inter.J.Tissue Reaction,1987,v.9,p.427-432.
29. Konturek S.J., Bilski J., Kwiecien N. et al. De-nol stimulates gastric and duodenal alcaline secretion through prostaglsndin dependent mechanism.-Gut,1987,v.28,p. 1557-1563.
30. Van Caekenberghe D.L., Breyssens J. In vitro synergistic activity between bismuth subcitrate and various antimicrobial agents against Campylobacter pyloridis.- Anti-microb.Agents Chemother., 1987,v.31 ,p. 1429-1430.
31. Gorbach S.L. Bismuth therapy in gastrointestinal diseases.- Gastroenterology, 1990, v.99,p.863-875.
32. Williamson R., Pipkin G.A. Does bismuth prevent antimicrobial resistance of Helicobacter pylori? // Helicobacter Pylori. Basic Mechanisms to Clinical Cure 1998 /
Ed. by R.H. Hunt, G.N.J. Tytgat. - Dordrecht; Boston; London: Kluwer Acad. Publ., 1998.-P. 416-425.
33. Marshall B.J., Armstrong J.A., Francis G.J. et al. Antibacterial action of bismuth in relation to Campylobacter pyloridis colonisation and gstritis.- Digestion, 1987,v.37, s.2, p. 16-30.
34. Graham D.Y., Lew G.M., Evans D.G. et al. Effect of triple therapy (antibiotics plus bismuth) on duodenal ulcer healing: a randomized controlled trial.-Ann.Intern. Med.,1991,v.115,p.266-269.
35. Lee S.P. Studies on the absorbtion and excretion of tripotassum dicitrato-bismuthate in man.- Res.Com.Chem.Pathol.Pharmacol.,1981 ,v.34,p.359-364.
36. Dekker W., Dal Monte P.R., Bianchi Porro G. et al. An international multi-clinic study comparing the therapeutic efficacy of colloidal bismuth subcitrate coated tablets with chewing tablets in the treatment of duodenal ulceration.- Scand.J.Gastroentero l.,1986,v.21 ,s.122,p.46-50.
37. Щербаков П.Л., Вартапетова E.E., Нижевич A.A., Салмова B.C. и др. Эффективность и безопасность применения висмута трикалия дицитрата (Де-Нол) у детей - Клиническая фармакология и терапия. - 2005,т. 14, № 1,с. 41-44.
38. Bader J.P. The safety profile of De-nol.- Digestion,1987,v.37,s.2,p.53-59.
39. Wilde M.I., McTavish D. Omeprazole. An update of its pharmacology and therapeutic use in acid-related disorders// Drugs. - 1994. - Vol. 48, № 1. - P. 91-132.
40. Freston J.W., Rose P.A., Heller C.A. et al. Safety profile of Lansoprazole: the US clinical trial experience// Drug Saf. - 1999. - Vol. 20, № 2. - P. 195-205.
41. Gerson L., Hatton В., Ryono R. et al. Clinical and fiscal impact of lansoprazole intolerance in veterans with gastro-oesophageal reflux disease // Aliment. Pharmacol. Ther. - 2000. - Vol. 14, № 4. - P. 397-406.
42. Gisbert J.P., Pajares J.M. Review article: Helicobacter pylori "rescue" regiment when proton pump inhibitor-based triple therapies fail // Aliment. Pharmacol. Ther -2002.-Vol. 16, № 6. - P. 1047-1057.
43. Grayson M.L., Eliopoulos G.M., Ferraro M.J., Moellering R.C. Jr. Effect of varying pH on the susceptibility of Campylobacter pylori to antimicrobial agents // Eur. J. Clin. Microbiol. Infect. Dis. - 1989. - Vol. 8, № 10. - P. 888-889.
44. Eisele R., Brunner G., Simon В., Solcia E., Arnold E. Gastric mucosa during treatment with lantoprazole: Helicobacter pylori is a risk factor for argyrophil cell hyperplasia//Gastroenterology. - 1997. - Vol. 112, № 3. - P. 707-717.
45. Dibildox M., Almaguer L., Di Silvio M. et al. [Safety and tolerance of pantoprazole in peptic disease] // Invest. Med. Int. - 1997. - Vol. 24. - P. 40-50. [исп.]
46. Hahn E., Bossekert H., Dammann G. et al. Tolerability and safety profile of pantoprazole, based on 71906 patients//Am. J. Gastroenterol. - 1997. - Vol. 91. - P. 1910.
47. Хомерики H.M., Хомерики С.Г. Некоторые механизмы развития побочных эффектов антихеликобактерной терапии и пути их коррекции // Consilium medicum. - 2005. - Приложение. Гастроэнтерология. - Вып. 2. - С. 22-25.
48. Johnson D.A., Benjamin S.B., Vakil N.B. et al. Esomeprazole once daily for 6 months is effective therapy for maintaining healed erosive esophagitis and for controlling gastroesophageal reflux disease symptoms: a randomized, double-blind, placebo-controlled study of efficacy and safety//Am. J. Gastroenterol.-2001.-Vol. 96, № 3. - P. 27-34.
49. Lind T., Rydberg L., Kyleback A. et al. Esomeprazole provides improved acid control vs. omeprazole in patients with symptoms of gastro-oesophageal reflux disease // Aliment. Pharmacol. Ther. - 2000. - Vol. 14, № 7. - P. 861-867.
50. Tulassay Z., Kryszewski A., Ditc P. 7-day treatment with esomeprazole-based triple therapy eradicates H. pylori (Hp) and heals patients with DU disease // Gastroenterology. - 2000. - Vol. 118. - P. A502.
51. Hassan-Alin M., Andersson Т., Bredberg E. Rohss K. Pharmacokinetics of esomeprazole after oral and intravenous administration of single and repeated doses to healthy subjects//Eur. J. Clin. Pharmacol. -2000. - Vol. 56, № 9-10.-P. 665-670.
52. Kahrilas P.J., Falk G.W., Johnson D.A. et al. Esomeprazole improves healing and symptom resolution as compared with omeprazole in reflux oesophagitis patients: a randomized controlled trial. The Esomeprazole Study Investigators// Aliment. Pharmacol. Ther. - 2000. - Vol. 14, № 10. - P. 1249-1258.
53. Vakil N.B., Shaker R., Johnson D.A. et al. The new proton pump inhibitor esomeprazole is effective as a maintenance therapy in GERD patients with healed erosive oesophagitis: a 6-month, randomized, double-blind, placebo-controlled study of efficacy and safety//Aliment. Pharmacol. Ther.-2001.-Vol. 15, № 7. - P. 927-935.
54. Хавкин А.И., Рачкова H.C., Жихарева H.C., Ханакаева З.К. Перспективы применения ингибиторов протонной помпы в педиатрии // Medicus Amicus. -2004.- № 1.- С. 7-10.
55. Самсонов А.А. Ингибиторы протонной помпы - препараты выбора в лечении кислотозависимых заболеваний // Фарматека. - 2007. - № 6. - С. 10-15.
56. Лопина О.Д. Механизм действия ингибиторов протонного насоса // Рос. журн. гастроэнтерол. гепатол. колопроктол. - 2002. - № 2. - репринт С. 3 -7.
57. Лапина Т.Л. Рекомендации по лечению инфекции Helicobacter pylori // Medicus Amicus. - 2005. - № 6. - С. 12-15.
58. Williams M.P., Sercombe J., Hamilton M.I., Pounder R.E. A placebo-controlled trial to assess the effects of 8 days of dosing with rabeprazole versus omeprazole on 24-h intragastric acidity and plasma gastrin concentrations in young healthy male subjects//Aliment. Pharmacol. Ther. - 1998. - Vol. 12, № 11. - P. 1079-1089.
59. DeGiacomo, Fiocca R., Villani L., et al. Omeprazole treatment of severe peptic disease associated with antral G cell hyperfunction and hyperpepcinogenemia 1 in an infant. - J.Pediatr., 1990,117,989-993.
60. Frits Nelis G., Westerveld BD. Tratment of resistant reflux oesophagitis in children with omeprazole. - Eur.J.Gastroent.Hepatol, 1990,2,215-217.
61. Andersson Т., Hassall E, Lundborg P.,et al. Pharmacokinetics of orally administered omeprazole in children. -Am.J.Gastroent.,2000,95,3101-3106.
62. Jacqz-Aigrain E., Bellaiche M., Faure C.,et al. Pharmacokinetics of intravenous omeprazole in children. - Eur.J.Clin.Pharmac.,1994,47,181-185.
63. Faure C., Michaud L., Khan Stghaghi E., et al. Intravenous omeprazole in children: pharmacokinetics and effect of 24-hour intragastric pH. - J.Pediatr.Gasroenterol. Nutr.,2001,33(2),144-148.
64. Kato S., Shibuyu H., Hayashi Y. et al. Effectiveness and pharmacokinetics of omeprasole in children. -J.Pediatr.Gastroent.Nutr., 1996,128,415-421.
65. Gunasekaran TS, Hassal E. Efficacy and safety of omeprazole for severe gastroesophageal reflux in children. J.Pediatr.Gastroent.Nutr., 1993,123, 148-154.
66. Pashankar DS, Israel DM, Jevon GP, et al. Effect of long-term omeprazole treatment on antral G and D cells in children. - J.Pediatr.Gastroent.Nutr., 2001,33(5),537-542.
67. Ивашкин В.Т., Лапина Т.Л., Лечение язвенной болезни: новый век - новые достижения - новые вопросы // Клин. фармакол. и терапия. - 2001. - Т. 10, № 5. - С. 15-17.
68. Лунделл Л., Швеция. Все ли ингибиторы протонной помпы одинаковы? // Клин. экспер. гастроэнтерол. - 2004. - № 5. - С. 7-8.
69. Melchers К., Haas R., Weitzenegger Т. Analysis of two single subunit mP type ATPase loci in Helicobacter pylori: Knockout mutation of ATPase - 439 abolishes urease activity // Digestive Disease Week (San Francisco, 1996). - San Francisco, 1996.-P. 215-217.
70. Лапина Т.Л. Ингибиторы протонного насоса в схемах антигеликобактерной терапии //Рос. журн. гастрол. гепатол. колопроктол. - 1997. - Т. 7, № 5. - С. 97-99.
71. Hunt R.H. The role of acid suppression in the treatment of H. pylori infection // Helicobacter Pylori. Basic Mechanisms to Clinical Cure / Ed. by R.H. Hunt, G.N.J. Tytgat. - Dordrecht, Boston, London: Kluwer Acad. Publ., 1995. - P. 584-593.
72. Ценева Г.Я., Рухляда H.B., Назаров B.E., Попов Е.А., Жербун А.Б. Патогенез, диагностика и лечение инфекции, обусловленной Helicobacter pylori. Санкт-Петербург, 2003. - С. 96.
73. Grayson M.L., Eliopoulos G.M., Ferraro M.J., Moellering R.C. Jr. Effect of varying pH on the susceptibility of Campylobacter pylori to antimicrobial agents // Eur. J. Clin. Microbiol. Infect. Dis. - 1989. - Vol. 8, № 10. - P. 888-889.
74. Guggenbichler J. Josamycin, ein Macrolid-Antibioticum mit bemerkenswerten Eigenschaften // Arzneimitterpraxis. - 1997. - Bd. 27, № 4/5. - S. 1061-1064.
75. Buzas G.M., Jozan J. [Eradication of Helicobacter pylori infection in Europe: a metaanalysis based on congress abstracts, 1997-2002] // Orv. Hetil. - 2004.- Vol. 145, № 40,- P. 2035-2041. [венг.]
76. Vergara M., Vallve M., Gisbert J.P., Calvet X. Meta-analysis: comparative efficacy of different proton-pump inhibitors in triple therapy for Helicobacter pylori eradication // Aliment. Pharmacol. Ther.-2003.-Vol. 18, № 6.- P. 647-654.
77. Gold B.D., Colletti R.B., Abbott M., et al. Helicobacter pylori infection in children: Recommendations for diagnosis and treatment. - J.Pediatric Gasroenterol.Nutr., 2000,v.31, N5, p.490-497.
78. Current concepts in the management of Helicobacter pylori infection The Maastricht 2-2000 Consensus, Report, September (2000).
79. Perri F., Qasim A., Marras L., O'Morain C. Treatment of Helicobacter pylori infection // Helicobacter. - 2003. - Vol. 8, Suppl. 1. - P. 53-60.
80. Choi I.J., Jung H.C., Choi K.W. et al. Efficacy of low-dose clarithromycin triple therapy and trinidazole-containing triple therapy for Helicobacter pylori eradication // Aliment. Pharmacol. Ther. - 2002. - Vol. 16, № 1.-P. 145-151.
81. Koivisto T.T., Rautelin H.I., Voutilainen M.E. et al. First-line eradication therapy for Helicobacter pylori in primary health care based on antibiotic resistance: results of three eradication regimens//Aliment. Pharmacol. Ther-2005.-Vol. 21, № 6.-P. 773-782.
82. Calvet X., Garcia N., Lopez Т., et al. A meta-analysis of short versus long therapy with a proton pump inhibitor, clarithromycin and either methronidazole or amoxicillin for treating Helicobacter pylori infection. - Aliment. Pharmacol. Ther., 2000,v.14, p.603-609.
83. Zullo A., Vaira D., Vakil N., et al. High eradication rates of Helicobacter pylori with a new sequential treatment. - Aliment. Pharmacol. Ther., 2003, v.17, p.719-726.
84. Jafri N.S., Hornung C.A., Howden C.W. Meta-analysis sequential therapy appears superior to standard therapy for Helicobacter pylori infection in patients naive to treatment. - Ann. Intern. Med., 2008, v. 19
85. McLoughlin R., Racz I., O'Morain C. Therapy of Helicobacter pylori. - Helicobacter, 2003, v.9,s.1,p.42-48.
86. Megraud F. Helicobacter pylori and macrolides. ln:Schonfeld W., Kirst H.A. macrolide antibiotics. - Berlin, Berkhauser Verlag, 2002, p.243-260.
87. Mendz G.L., Megraud F. Is the molecular basis of metronidazole resistance in microaerophilic organisms understood? - Trends Microbiol.,2002, v.10, p.370.
88. Marais A., Bilardi C., Cantet F. et al. Characterization of the genes rdxA and frxA involved in metronidazole resistance in Helicobacter pylori. - Res. Microbiol., 2003,v.154, p. 137-144.
89. Pelerito A., Oleastro M., Labigne A. et al. Analysis of Helicobacter pylori's penicillin-binding proteins natural polymorphism, therapeutical targets of the family of β-lactam antibiotics. - Helicobacter, 2003, v.8, p.394.
90. Koletzko S., Antos D., Richy F. et al. Antibiotic resistance of Helicobacter pylori strains obtained from children living in Europe: results of a prospective multicenter study from 1999-2002.- J.Ped.Gastroentrol.Nutr., 2004, v.39,s.1 ,p.s252.
91. Megraud F. H.pylori. antibiotic resistance: prevalence, impotance and advances in testing. - Gut, 2004, v.53,N 9, p.1374-84.
92. Fallone C.A. Epidemiology of the antibiotic resistance of Helicobacter pylori -Can.J.Gastroenterol., 2004,v.14,p.879-82.
93. Taneike I., Goshi S., Tamura Y. et al. Emergence of claritromycin-resistant Helicobacter pylori with a high prevalence in children compared with their parents. - Helicobacter, 2002, V.7, p.297-305.
94. Glupczynski Y., Megroud F., Lopez-Brea M. et al. European multicenter survey of in vitro antimicrobial resistance in Helicobacter pylori. - Eur.J.Clin.Microbiol.Infect. Dis., 2000, v.11, p.820-823.
95. Heep M., Kist M., Strobel S., et al. Secondary resistance among 554 isolates of Helicobacter pylori after failure of therapy. - Eur.J.Clin.Microbiol.Infect.Dis., 2000, v. 19, p.538-541.
96. Marais A., Bilardi C., Cantet F. et al. Characterization of the genes rdxA and frxA involved in metronidazole resistance in Helicobacter pylori // Res. Microbiol. - 2003. -Vol. 154, № 2.-P. 137-144.
97. Mendz G.L., Megraud F. Is the molecular basis of metronidazole resistance in microaerofilic organisms understood? // Trends Microbiol. - 2002. - Vol. 10, № 8. -P. 370-375.
98. Megraud F. Helicobacter pylori antibiotic resistance: prevalence, importance and advances in testing // Gut. - 2004. - Vol. 53, № 9. - P. 1374-1384.
99. Meyer J.M., Silliman N.P., Wang W. et al. Risk factors for Helicobacter pylori resistance in the United States: the surveillance of H. pylori antimicrobial resistance partnership (SHARP) study, 1993-1999//Ann. Intern. Med. -2002. -Vol. 136, № 1.-P. 13-24.
100. Фадеенко Г.Д. Лечение инфекции Н. pylori: настоящее и будущее // Medicus Amicus. - 2004. - № 1. - С. 6-9.
101. Megraud F. Epidemiology of antimicrobial resistance implications for treatment failure // H. pylori resistance and management strategies. - World Congress of Gastroenterology. — Montreal, 2005. - P. 121-124.
102. Кудрявцева Л.В. Состояние антибиотикорезистентности Helicobacter pylori в России // Эксперим. и клин, гастроэнтерол. - 2003. - № 3. - С. 7.
103. Versalovic J., Kibler К., Smell S., Graham D.Y., Go M.F. Mutation in 23 S ribosomal RNA confer clarithromycin resistance in Helicobacter pylori//Gut. - 1995. - Vol. 37, № 1.-P. A67.
104. Qasim A., Sebastian S., Thornton O. et al. Rifabutin- and furazolidone-based Helicobacter pylori eradication therapies after failure of standard first- and second-line eradication attempts in dyspepsia patients // Aliment. Pharmacol. Ther. - 2005.-Vol. 21, № 1.-P. 91-96.
105. Fakheri H., Merat S., Hosseini V., Malekzadeh R. Low-dose furazolidone in triple and quadruple regimens for Helicobacter pylori eradication // Aliment. Pharmacol. Ther. - 2004. - Vol. 19, № 1. - P. 89-93.
106. Иваников И.О. Проблема преодоления резистентности штаммов Helicobacter pylori // Материалы 7-ой сессии Российской группы по изучению Helicobacter pylori (Нижний Новгород, 1999). - Н.-Новгород, 1999. - С. 34-36.
107. Неер М., Kist М., Strobel S. et al. Secondary resistance among 554 isolates of Helicobacter pylori after failure of therapy // Eur. J. Clin. Microbiol. Infect. Dis. - 2000. -Vol. 19, № 7.-P. 538-541.
108. Meyer J.M., Silliman N.P., Wang W. et al. Risk factors for Helicobacter pylori resistance in the United States: the surveillance of H. pylori antimicrobial resistance partnership (SHARP) study, 1993-1999//Ann. Intern. Med. -2002. -Vol. 136, № 1.-P. 13-24.
109. Watanabe K, Tanaka A., Imase K. et al. Amoxicillin resistance in Helicobacter pylori: studies from Tokyo, Japan from 1985 to 2003 // Helicobacter - 2005. - Vol. 10, № 1.-P. 4-11.
110. Лапина Т.Л. Выбор антибиотика для эрадикации инфекции Helicobacter pylori: доказательная медицина // Consilium medicum. - 2005. - Приложение. Гастроэнтерология. - Вып. 2. - С. 19-22.
111. Kist М., Glocker Е., Wolf В. et al. ResiNet-A nationwide German sentinel study on development and risk factors of antimicrobial resistance in Helicobacter pylori. -Helicobacter, 2003, v.8, p.465.
112. Корниенко E.A. Клиника, диагностика и лечение Helicobacter pylori-асоциированных гастродуоденальных заболеваний у детей. - Автореф. дисс. докт., 1999, 32с.
113. Lerand F., Moum В., Ragnhildstveit Е. et al.Simplified 10-day bismuth triple therapy for cure of Helicobacter pylori infection: experience from clinical practice in a population with a high frequency of metronidazole resistance. - Am.J.Gastroenterol., 1998, v.93,p.212-216
114. Исаков В.А., Домарадский И.В. Хеликобактериоз. - М., Медпрактика-М, 2003, 412с.
115. Паролова Н.И. Сравнительная оценка эффективности эрадикационной терапии инфекции Helicobacter pylori у детей// Автореф.дисс. канд., СПб, 2008, 22с.
116. Vaira D., Zullo A., Vakil N., Gatta L., Ricci C., Perna F. et al. Sequential therapy versus standard triple-drug therapy for Helicobacter pylori eradication: a randomized trial // Ann. Intern. Med. - 2007. - Vol. 146, № 8. - P. 556-563.
117. Bioxeda D., Bermejo F., Martin-De-Argila C. et al. Efficacy of quadruple therapy with pantoprazole, bismuth, tetracycline and metronidazole as rescue treatment for Helicobacter pylori infection // Aliment. Pharmacol. Ther. - 2002. - Vol. 16, № 8. - P. 1457-1460.
118. Wong W.M., Gu Q., Lam S.K. et al. Randomized controlled study of rabeprazole, levofloxacin and rifabutin triple therapy vs. quadruple therapy as second-line treatment for Helicobacter pylori infection // Aliment. Pharmacol. Ther. - 2003. - Vol. 17, № 4. - P. 553-560.
119. Isakov V., Domareva I., Koudryavtseva L., Maev I., Ganskaya Z. Furazolidone-based triple "rescue therapy" vs. quadruple "rescue therapy" for the eradication of Helicobacter pylori resistant to metronidazole // Aliment. Pharmacol. Ther. - 2002. -Vol. 16, № 7.-P. 1277-1282.
120. Treiber G., Ammon S., Malfertheiner P., Klotz U. Impact of furazolidone-based quadruple therapy for eradication of Helicobacter pylori after previous treatment failures // Helicobacter. - 2002. - Vol. 7, № 4. - P. 225-231.
121. Laine L., Hunt R., El-Zimaity H. et al. Bismuth-based quadruple therapy using a single capsule of bismuth biskalcitrate, metronidazole, and tetracycline given with omeprazole versus omeprazole, amoxicillin, and clarithromycin for eradication of Helicobacter pylori in duodenal ulcer patients: a prospective, randomized, multicenter, North American trial // Am. J. Gastroenterol. - 2003.- Vol. 98, № 3.- P. 562-567.
122. Корниенко E.A., Паролова Н.И. Пути повышения эффективности эрадикационной терапии у детей - Материалы симпозиума "Объединение усилий в лечении язвенной болезни", Москва, РАГС, 2004, с.3-4.
123. Щербаков П.Л., Эрдес С.И., Щербакова М.Ю., Корниенко Е.А. и др. Применение нифуроксазида в эрадикационной терапии хеликобактер-ассоциированных заболеваний у детей. - Инф.болезни, 2008, T.6,№3, с.98-101.
124. Qasim A., Sebastian S., Thornton О. et al. Rifabutin- and furazolidone-based Helicobacter pylori eradication therapies after failure of standard first- and second-line eradication attempts in dyspepsia patients // Aliment. Pharmacol. Ther. - 2005.-Vol. 21, № 1.-P. 91-96.
125. Cheng H.C., Chang W.L., Chen W.Y., Yang H.B., et al. Levofloxacin-containing triple therapy to eradicate the persistent H.pylori. after a failed conventional triple therapy - Helicobacter 2007, v. 12, p.359-363.
126. Gisbert J.P., Gisbert J.L., Marcos S., Moreno-Otero R., Pajares J.M. Third-line rescue therapy with levofloxacin is more effective than rifabutin rescue regimen after two Helicobater pylori treatment failure. - Aliment. Pharmacol. Ther., 2006, v.24, p. 1469-1474.
127. Marko D., Calvet X., Ducons J. et al. Comparison of two management strategies for Helicobacter pylori treatment: clinical study and cost-effectiveness analysis // Helicobacter. - 2005.v. 10, № 1. P. 22-32.
128. Дроздова C.H., Корниенко E.A., Серебряная Н.Б. Пробиотики как способ повышения эффективности эрадикации Helicobacter pylori у детей. - Росс.мед. журн., 2005, т.13, №3, с.168-170.
129. Zhou С., Ma F.Z., Deng X.J., Yuan Н., Ma H.S. Lactobacilli inhibit interleukin-8 production induced by Helicobacter pylori lipopolysaccharide-activated Toll-like receptor 4. - World J. Gastroenterol., 2008, v. 28;14(32), p.5090-5095.
130. Корниенко E.A., Дроздова C.H., Серебряная Н.Б. Пробиотики как способ повышения эффективности эрадикационной терапии. - Материалы ассамблеи "Врач-провизор-пациент", Санкт-Петербург, 2004, с.45-47.
131. Щербаков П.Л., Корсунский А.А. Хеликобактериоз и гастродуоденальные заболевания у детей - М., Практика М., 2003.
132. Gut microflora. Digestive physiology and pathology/ Ed.:J.C.Rambaud, J.P.Buts,
G.Corthier, B.FIorie-John Libbey Eurotext, Paris, 2006, 248p.
133. Gotteland M., Poliak L., Cruchet S., Brunser O. Effect of regular ingestion of Saccharomyces boulardii plus inulin or Lactobacillus acidophilus in children colonised by Helicobacter pylori - Acta Paediatr., 2005, s.94, p.1747-1751.
134. Симаненков В.И., Суворов А.Н. Роль пробиотиков в проблеме эрадикации
H.pylori. - В кн: Дисбиоз кишечника под ред. Е.И.Ткаченко, А.Н.Суворова, СПб, 2007, с.108-114.
135. Kamiya S. Probiotics, prebiotics, synbiotics in Helicobacter pylori infection. - Клиническое питание, 2007, №1-2, c.A5.
136. Cindoruk M., Erkan G., Karakan Т., Dursun A., et al. Efficacy and safety of Saccharomyces boulardii in the 14-day triple anti-Helicobacter pylori therapy: a prospective randomized placebo-controlled double blind stude. - Helicobacter, 2007, v.12, N4, p.309-316.
137. Duman D.G., Bor S., Ozutemiz 0., et al. Efficacy and safety of Saccharomyces boulardii in prevention of antibiotic-associated Diarrhoea due to Helicobacter pylori eradication. - Eur. J. Gastroenterol. Hepatol., 2005, v.17, p.1357-1361.
138. Lionetti E., Miniello V.L., Castellaneta S.P., Magista A.M., et al. Lactobacillus reuteri therapy to reduce side-effects during anti-Helicobacter pylori treatment in children: a randomized placebo controlled trial. - Aliment.Pharmacol.Ther., 2006, v.24, p.1461-1468.
139. Sheu B.S., Cheng H.C., Kao A.W., Wang S.T., et al. Pretreatment with Lactobacillus- and Bifidobacterium-containing yogurt can improve the efficacy of quadruple therapy in eradicating residual Helicobacter pylori infection after failed triple therapy. -Am. J. Clin. Nutr., 2006, v.83, p.864-869.
140. Nista E.C., Candelli M., Cremonini F., Cazzato I.A., Zocco M.A. Bacillus clausii therapy to reduce side effects of anti-Helicobacter pylori treatment: randomized, double-blind, placebo controlled trial. - Aliment. Pharmacol. Ther., 2004, v.20, p. 1181 -1188.
141. Cremonini F., Di Caro S., Covino M., Armuzzi A., et al. Effect of different probiotic preparations on anti-Helicobacter pylori therapy-related side effects: a parallel
group < triple blind < placebo-controlled study. - Am.J.Gastroenterol., 2002, v.97, p.2744-2749.
142. Sykora J., Valeckova K., Amlerova J., Siala K., et al. Effect of specially designed fermented milk product containing probiotic Lactobacillus casei DN-114001 and the eradication of H.pylori. in children - J.Clin.Gastroenterol., 2005, v.39, p.692-698.
143. Uemura N. H.pylori. infection and high risk of gastric cancer - Is improvement of atrophic gastritis by probiotics LG21 possible? - Abstracts of the 6 Western Pacific Helicobacter congress, 2006, Bangkok, p.73.
144. Sachdeva A., Nagpal J. Effect of fermented milk-based probiotic preparations on Helicobacter pylori eradication: a systematic review and meta-analysis of randomized-controlled trials.- Eur. J. Gastroenterol. Hepatol., 2009, v.21(1), p.45-53.
145. Boonyaritichaikij S. A trial for prophylaxis of H.pylori. infection in school children using probiotics. - Abstracts of 6th Western Pacific Helicobacter Congress, Bangkok, 2006, p.9.
146. Kawai Т., Takagi A., Uemura N., Inoue K., et al. Randomized double blind trial of the efficacy of Lactobacillus gasseri OLL2716(LG21) for suppression of Helicobacter pylori. - Helicobacter, 2006, v.11, s.2, p.40.
147. Di Mario F., Aragona G., Dal Bo N.,et al. Bovine lactoferrin for Helicobacter pylori eradication: an open, randomized, multicenter study. - Aliment. Pharmacol. Ther., 2006, v.23, p.1077-1086.
148. Ершов Ф.И., Тазулахова Э.Б. Индукторы интерферона - новое поколение иммуномодуляторов. - Terra medica, 1998, № 2, с.2-39.
149. Egan B.J., Marzio L., O'Conner H., O'Morain C. Treatment of Helicobacter pylori infection. - Helicobacter, 2008, v.13,s.1, p.35-40.
150. Thong-Ngam D., Chatsuwan T. Antibacterial activity of Aloe vera, circumin, garlic and plaunotol against Helicobacter pylori - Helicobacter, 2006, v.11, s.2, p.44.
151. Matsushima M., Takagi A., Masui A., Suzuki Т., et al. Growth ingibiting action of cranberry on Helicobacter pylori. - Helicobacter, 2006, v.11, s.2, p.43.
152. Kuo C.J., Guo R.T., Lu I.L., Liu H.G., et al. Structure-based inhibitors exhibit differential activities against Helicobacter pylori and Esherichia coli undecarpenyl pyrophosphate synthases. - J.Biomed. Biotechnol., 2008, 2008:841312.
153. Nishimori I., Onishi S., Takeuchi H.,Supuran C.T. The alpha and beta classes carbonic anhydrases from Helicobacter pylori as novel drug targets. - Curr. Pharm.,2008, v.14, p.622-630.
154. Campo S.M.A., Zullo A., Hassan C., Morini S. Antibiotic treatment strategies for Helicobacter pylori infection. - Recent Patents Anti-infect. Drug.Dis., 2007, v.2, p.11-17.
155. Arora S., Czinn S.J. Vaccination as a method of preventing Helicobacter pylori-associated gastric cancer. - Cancer Epidemiol.Biomarkers Prev., 2005, v.14, p.1890-1891.
156. Michetti P., Kreiss C., Kotloff K.L., et al. Oral immunization with urease and Escherichia coli heat-labile enterotoxin is safe and immunogenic in Helicobacter pylori-infected adults. - Gastroenterology, 1999, v.116, p.804-812.
157. Bumann D., Metzger W.G., Mansouri E., et al. Safety and immunogenicity of live recombinant Salmonella enterica serovar Typhi Ty21a expressing urese A and В from Helicobacter pylori in human volunteers. - Vaccine, 2001, v.20, p.845-852.
158. Malfertheiner P., Schultze V., Del Guidice G., et al. Phase 1 safety and immunogenicity of a three-component H.pylori. vaccine. - Gastroenterology, 2002, v.122, A585.
159. Vajdy M., Singh M., Ugozzoli M., et al. Enhanced mucosal and systemicimmune responses to Helicobacter pylori antigens through mucosal priming followed by systemic boosting immunizations. - Immunology, 2003, v.110, p.86-94.
160. Eisenberg J.C., Czinn S.J., Garhart C.A., et al.Protective efficacy of anti-Helicobacter pylori immunity following systematic immunization of neonatal mice. - Infect. Immun, 2003, v.71, p.1820-1827.
| Май 2010 г. |