Опубликовано в журнале:
«ФАРМАТЕКА»; Клинический опыт; № 7; 2009; стр. 54-58.Хроническая ишемия мозга: возможности использования препарата Вазобрал
Е.И. Чуканова
Кафедра неврологии и нейрохирургии лечебного факультета РГМУ, МоскваУвеличение численности пациентов с острыми и хроническими ишемическими цереброваскулярными нарушениями определяет актуальность проблемы их эффективного лечения. В последнее время особое внимание уделяется комбинированным лекарственным средствам, обладающим нейропротективным, антигипоксическим и вазоактивным действиями. В статье обсуждаются основные патогенетические аспекты действия препарата Вазобрал (дигидроэргокриптин + кофеин) при недостаточности мозгового кровообращения, приводятся результаты клинических исследований данного лекарственного средства при лечении пациентов с цереброваскулярными заболеваниями.
Ключевые слова: ишемия мозга, цереброваскулярная недостаточность, апоптоз, ВазобралИшемия мозга остается одной из самых острых проблем современного здравоохранения, что связано со значительной частотой развития данной патологии и значимых последствий для пациентов и общества (высокий уровень инвалидизации и высокая смертность). В Москве и других крупных промышленных городах России эпидемиология инсульта продолжает настораживать медиков и организаторов здравоохранения. В настоящее время отмечается тенденция к увеличению частоты церебрального инсульта по сравнению с острым инфарктом миокарда: на один вызов к пациенту с инфарктом приходятся 2,6 вызова по поводу инсульта. Ожидаемый к 2020 г. уровень смертности от мозгового инсульта, по прогнозам ВОЗ, составит 7,6 млн человек [1—3].
К настоящему времени в целом сформировано представление о многофакторном механизме развития сосудистой мозговой недостаточности. Однако ни один из факторов риска не может целиком объяснить ни выраженность неврологических нарушений, ни характер течения заболевания, что подтверждает сложность механизмов возникновения и прогрессирования острой и хронической сосудистой мозговой недостаточности. Развитие цереброваскулярной недостаточности (ЦВН) является сложным многоступенчатым процессом, обусловленным преимущественно артериальной гипертензией (АГ) и атеросклеротическим поражением сосудов головного мозга на фоне декомпенсированной соматической патологии. Определенная роль придается сахарному диабету, нарушениям ритма сердца, сердечной недостаточности [4].
Не будет преувеличением сказать, что в настоящее время здоровью населения угрожает эпидемия АГ. Данное заболевание приводит к ряду морфофункциональных изменений в сердечно-сосудистой системе в виде ремоделирования артерий, гипертрофии левого желудочка сердца, концентрическому ремоделированию миокарда и в результате - к формированию сердечной недостаточности [5, 6].
Другой причиной развития цереброваскулярной патологии является атеросклероз, являющийся единственной болезнью, генетически предназначенной каждому. В настоящее время благодаря атрибутам цивилизованной жизни течение атеросклероза существенно изменилось, сам атеросклероз стал более “вирулентным”, ход его развития значительно ускорился. За период второй половины XX в. в худшую сторону изменился не только темп последовательного развития этапов атеросклероза (от липидных пятен до окклюзирующей бляшки), но и хронопатология поражения органов-мишеней. Развитие атеросклероза начинается с увеличения проницаемости эндотелия, которое может возникать вследствие механического повреждения турбулентными потоками крови, метаболических нарушений, воздействия инфекций, иммунных комплексов и химических субстанций [7].
В настоящее время отмечается тенденция к увеличению частоты церебрального инсульта по сравнению с острым инфарктом миокарда.
Патогенез ЦВН
Под воздействием факторов риска формируются следующие патогенетические механизмы развития различных форм ЦВН:расстройства ауторегуляции церебральных артериальных сосудов с невозможностью поддержания в перспективе адекватного уровня перфузии с последующими вторичными изменениями центральной гемодинамики (повышением периферического сопротивления, уменьшением минутного объема кровотока); стенозирование церебральных сосудов, изменения морфологии сосудистой стенки и хода артерий; возникновение гемодинамических нарушений в местах стенозирования и патологической извитости артерий головы; изменения физико-химических свойств крови, отражающие степень их декомпенсации. Помимо основных патогенетических звеньев формирования ЦВН существуют и дополнительные ее причины:
формирование синдрома обкрадывания интракраниальных сосудов с перераспределением кровоснабжения в пользу ишемизированного участка мозга и последующими вторичными дисциркуляторными расстройствами в зоне анатомически измененной васкуляризации; развитие недостаточности кровоснабжения при движениях, изменяющих вазотопику магистральных артерий головы (особенно при вертеброгенной патологии) с увеличением выраженности сужения просвета сосуда; возникновение неполноценности перфузии соответствующего бассейна при колебаниях системного артериального давления (АД) с рефлекторной вазоконстрикцией; аналогичные изменения наблюдаются при разнообразных соматогенных воздействиях на рефлексогенные зоны, вегетативных сдвигах на фоне гормонального дисбаланса, интоксикаций различного генеза; вторичные расстройства церебральной гемодинамики на отдалении от пораженного бассейна вследствие ишемизации ангиотонических вегетативных центров, дисфункция которых приводит к нарушению центральных воздействий как на системную, так и на церебральную гемодинамику. Изучение патоморфологических и биохимических изменений, формирующихся в центральной нервной системе в результате недостаточности мозгового кровообращения, в последние годы получило дальнейшее развитие. В настоящее время показано, что одной из составляющих патогенеза повреждения мозговой ткани является трофическая дисрегуляция, приводящая к биохимической и функциональной дифференциации нейронов с инициированием каскада патобиохимических реакций, которые приводят нейроны к гибели посредством некроза и апоптоза.
Еще в конце 1970-х гг. были сделаны первые попытки раскрыть механизмы последовательного изменения функционального состояния и морфологии ткани мозга на фоне ишемии. В последние годы обсуждается проблема апоптоза как одного из механизмов развития многих патологических состояний, в т. ч. ишемического повреждения мозга, нейродегенерации, демиелинизирующих заболеваний. Формирование и поддержание структурно-функционального постоянства тканей и органов биологических систем определяются сбалансированностью процессов размножения и гибели клеток. Изучение сложного процесса гибели клеток позволит разработать методы его регулирования, что несомненно будет иметь огромное общемедицинское значение.
По данным Ворлоу Ч.П. (1998), “зоной критической”, или “нищей”, перфузии, является участок мозга, в котором нейрональная функция снижается, но клетки все еще остаются жизнеспособными с сохраненным ионным гомеостазом. Вследствие того что резерв локальной перфузии исчерпан, нейроны в зоне критической перфузии становятся чувствительными к любому дальнейшему падению перфузионного давления, вызванному различными причинами. Ишемическая “полутень” представляет собой не только топографический локус, но и в большей степени динамический процесс, развивающуюся зону биоэнергетического сдвига [8, 9].
Предполагают, что процесс программированной гибели нейронов играет ключевую роль и в регуляции клеточного гомеостаза зрелой мозговой ткани. Имеется еще больше оснований предполагать наличие нейронального апоптоза в случаях безинсультного течения церебрального сосудистого заболевания, кратковременной ишемии при ангиоспазме или тромбоэмболии, проявляющихся обратимым или ремиттирующим неврологическим дефицитом. У пожилых больных, как правило, отмечается сочетание нескольких факторов риска, отдельный вклад каждого из которых довольно сложно оценить.
Варианты клинических проявлений ишемии мозга
Клинически дисциркуляторная энцефалопатия у больных пожилого возраста характеризуется феноменологическим многообразием, обусловленным как патогенетическими особенностями сосудистого процесса, так и преимущественным поражением тех или иных структур головного мозга. Определенное значение имеет и большая уязвимость головного мозга к ишемии в силу инволюционных изменений. Кроме того, диагностика ЦВН осложняется вследствие нередкого сочетания собственно сосудистых изменений с патологическими изменениями первично-дегенеративного характера [4].Хроническая недостаточность мозгового кровообращения — один из наиболее частых клинических синдромов в неврологии. По данным профилактических осмотров населения, эти заболевания выявляются в 20—30 % случаев даже у лиц трудоспособного возраста. Клинические проявления хронической недостаточности мозгового кровообращения отличаются многообразием, возможны обострения заболевания в виде церебральнососудистых кризов, транзиторных ишемических атак (ТИА) и инсультов. В нашей стране с 1957 г. используется термин “дисциркуляторная энцефалопатия”, предложенный Шмидтом Е.В. и Максудовым Г.А. [10].
Хроническая недостаточность мозгового кровообращения - один из наиболее частых клинических синдромов в неврологии. По данным профилактических осмотров населения, эти заболевания выявляются в 20-30 % случаев даже у лиц трудоспособного возраста.
В настоящее время подтверждено отсутствие прямого тождества между острой фокальной церебральной ишемией (ТИА, медленно развивающейся дисциркуляторной энцефалопатией), подразумевающей обратимость метаболических изменений в ткани мозга, и инфарктом мозга — стойким морфологическим дефектом. Эти состояния отличаются не только количественными и временными аспектами ишемии: разница между ними заключается в комплексе гемодинамических и метаболических нарушений, происходящих на определенной стадии недостаточности кровообращения мозга и генетической запрограммированности метаболизма мозга.
Хроническая ишемия мозга — это процесс, течение которого может быть ремиттирующим, перманентным, прогредиентным. У одного и того же пациента возможно повторение эпизодов декомпенсации кровообращения, проявляющихся колебаниями выраженности клинической симптоматики или углублением неврологических расстройств, которые сменяются периодами восстановления нарушенного кровообращения, что клинически проявляется в улучшении состояния и частичном восстановлении неврологической симптоматики. Таким образом, развитие как острой, так и хронической недостаточности мозгового кровообращения отличается большой гетерогенностью патогенетических механизмов, что необходимо учитывать при диагностике и определении тактики лечения. Все это диктует необходимость внимательного отношения клиницистов к вопросам ранней диагностики и комплексного лечения хронической ЦВН у пациентов с наличием факторов риска развития данной патологии.
Лечение ишемических поражений мозга
Проблема современной патогенетической терапии ишемических поражений мозга является важнейшей в клинической неврологии. Благодаря исследованиям последних десятилетий коренным образом изменились подходы к терапии ишемии мозга. Сформировались представления о предуготованности вещества мозга к формированию очагового повреждения и отсроченности необратимых изменений как от момента острого нарушения мозгового кровообращения, так и от снижения мозгового кровотока при хронической ишемии мозга. Это определяет раннюю профилактическую стратегию при ведении пациентов с выявленными факторами риска развития сердечно-сосудистых заболеваний.Весь комплекс лечебных мероприятий при хронической ЦВН условно можно разделить на два следующих блока:
базисная терапия, направленная на полную, индивидуально подобранную коррекцию имеющихся факторов риска; патогенетическая терапия, предполагающая восстановление нарушенного кровообращения мозга, прерывание механизмов формирования апоптоза и подавление явлений локального воспаления. Основными направлениями нейропротекции в лечении пациентов с хронической ЦВН являются: антиоксидантная терапия, торможение местной воспалительной реакции (применение антагонистов провоспалительных цитокинов и молекул клеточной адгезии), улучшение трофического обеспечения мозга, нейроиммуномодуляция, регуляция рецепторных структур [11]. Указанный многосторонний комплексный подход к лечению определяет целесообразность применения препаратов комбинированного действия.
Одним из таких препаратов, обладающих комплексным действием, является комбинированный препарат Вазобрал, который представляет собой комбинацию α-дигидроэргокриптина (алкалоида спорыньи) и кофеина. Дигидроэргокриптин обладает блокирующим действием в отношении α1- и α2-адренорецепторов, а также стимулирующим действием на дофаминовые и серотониновые рецепторы головного мозга, оказывает нейропротективный, антигипоксический и вазоактивный эффекты. Кофеин прежде всего повышает биодоступность дигидроэргокриптина, а также оказывает легкий стимулирующий эффект.
Вазобрал показан пациентам с нарушенной ауторегуляцией сосудов мозга, выраженными микроциркуляторными нарушениями и декомпенсацией системы регуляции агрегатного состояния крови, поскольку данный препарат воздействует на микроциркуляторное русло, снижает агрегацию эритроцитов и тромбоцитов. Вазобрал увеличивает число действующих капилляров, снижает проницаемость их стенок, улучшает венозный отток, устраняет вазоспазм, не оказывая четкого воздействия на системное АД. Данный препарат влияет на обменные процессы в мозге: повышает утилизацию глюкозы и кислорода, увеличивает концентрации АТФ и АДФ, тем самым повышая устойчивость ткани мозга к гипоксии. Воздействуя на аминергические нейротрансмиттеры, принимающие участие в двигательных, когнитивных и эмоциональных процессах, Вазобрал повышает умственную активность, улучшает память, ориентацию в пространстве, стимулирует мотивацию и внимание.
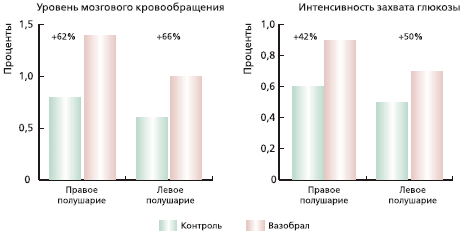
В работе Cahn R. и соавт. (1989) показано, что Вазобрал увеличивает число функционирующих капилляров на 180 %, а также подтверждено его влияние на агрегационную способность эритроцитов и тромбоцитов. При применении Вазобрала интенсивность захвата глюкозы увеличивается на 40-50 %, а уровень мозгового кровообращения по сравнению с контролем повышается в среднем на 64 % (рис. 1) [12].
Рис 1. Влияние Вазобрала на уровень мозгового кровотока и захват глюкозы [12]
В клинических исследованиях доказано, что у пациентов, получавших Вазобрал, достоверно улучшились такие показатели, как память на текущие события, ориентировка во времени и пространстве, регрессировали головокружение и головная боль (рис. 2) [13].
Рис. 2. Динамика балльной оценки по шкале EACG у больных, получавших Вазобрал, по сравнению с группой контроля [13]

В работе Аведисовой А.С. [14], проводившей исследование Вазобрала в течение 6 недель, показано статистически достоверное позитивное влияние препарата на самочувствие больных, их активность и настроение (по балльной оценке шкалы САН).
В исследовании, проведенном Батышевой Т.Т. и соавт. (2007), у пациентов, перенесших инсульт, доказана эффективность Вазобрала как нейропротективного, антигипоксического и вазоактивного средства. При лечении Вазобралом отмечена его высокая эффективность в отношении таких синдромов, как головокружение, атактические расстройства, головная боль, шум в ушах. Препарат оказывал положительное влияние на память и другие интеллектуальные функции больных, а также способствовал коррекции эмоциональных нарушений. Было показано улучшение балльной оценки по шкалам мобильности, способности к самообслуживанию и бытовой активности, отмечена нормализация сна. В данном исследовании подтверждены хорошая переносимость Вазобрала и отсутствие серьезных побочных реакций при его применении [15].
В работе по ранней реабилитации больных с инсультом, выполненной Гудковой В.В. и соавт. (2007), показано, что Вазобрал эффективен в остром периоде ишемического инсульта, при этом препарат хорошо переносится. При его применении не выявлено осложнений, в т. ч. и у лиц с геморрагической трансформацией инфаркта мозга (два случая), под его воздействием улучшаются вегетативнотрофические нарушения в паретичных конечностях. В работе определены показания к назначению Вазобрала в постинсультном периоде при наличии вегетативно-трофических нарушений в паретичных конечностях, сопутствующих нарушениях периферического кровообращения (артериальных и венозных), астено-депрессивных расстройствах [16].
Вазобрал назначают в дозе 4 мг (1 таблетка) 2 раза в день - утром и днем (во время еды) или по 4-8 мл раствора в сутки на протяжении 3-6 недель. Противопоказанием к назначению Вазобрала является только индивидуальная чувствительность к компонентам препарата. Возникающие побочные эффекты при его применении редки: менее чем в 3 % случаев возникают побочные эффекты со стороны желудочно-кишечного тракта (тошнота, диспепсия), в 1 % случаев - головокружение, головная боль и в 0,1 % случаев — аллергические реакции.
Таким образом, комбинированный препарат Вазобрал, обладающий нейропротективным, антигипоксическим, вазоактивным механизмами действия, а также стимулирующим влиянием на дофаминовые и серотониновые рецепторы головного мозга, эффективен при ЦВН, последствиях нарушения мозгового кровообращения, профилактике мигрени, синдроме Рейно, ретинопатии, нарушениях артериального и венозного периферического кровообращения, при эмоциональных и когнитивных нарушениях.
ЛИТЕРАТУРА
1. Тимофеева Т.Н. и др. Распространенность факторов, влияющих на прогноз больных артериальной гипертонией, оценка общего сердечнососудистого риска // Кардиоваскулярная терапия и профилактика. 2004. № 3. С. 15-24.
2. Фритас Г.Р., Богуславский Дж. Первичная профилактика инсульта // Журнал неврологии и психиатрии им. С.С. Корсакова. Приложение "Инсульт". 2001. Вып. 1. С. 7-21.
3. Dahlolof B, Devereux R, Kjeldsen S, et al. Cardiovascular morbidity and mortality in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): a randomised study against atenolol. Lancet 2002;359:1003.
4. Дамулин И.В. Дисциркуляторная энцефалопатия в пожилом и старческом возрасте. Дисс. докт. мед. наук. М., 1997.
5. Goldstein LB, Adams R, Becker K, et al. Primary prevention of ischemic stroke: a statement for healthcare professionals from the Stroke Council of the American Heart Association. Stroke 2001;32:280-99.
6. Hollander M, Bots ML, Witteman JC, et al. Intima-media thickness at different location of the carotid artery and risk of ischemic stroke and its subtypes: the Rotterdam Study (Abstract). Stroke 2000;31:280.
7. Аронов Д.М. Лечение и профилактика атеросклероза. М., 2000. 410 с.
8. Ворлоу Ч.П. и др. Инсульт. Практическое руководство для ведения больных. СПб., 1998. С. 298-318.
9. Гомазков О.А. Апоптоз нейрональных структур и роль нейротрофических ростовых факторов. Биохимические механизмы эффективности пептидных препаратов мозга //Журнал неврологии и психиатрии им. С.С. Корсакова. Приложение "Инсульт". 2002. Вып. 7. С. 17-22.
10. Шмидт Е.В. Классификация сосудистых поражений головного и спинного мозга // Журнал невропатологии и психиатрии. 1985. № 9. С. 1281-88.
11. Скворцова В.И., Чазова И.Е., Стаховская Л.В. и др. Первичная профилактика инсульта. М., 2006.
12. Cahn R, Borzeix MG, Legeai J. The effects of dihydroergocryptine on the neurological and enzyme disorders induced by cerebral ischemia in rats. Resuscitation 1989;18(1):37-48.
13. Babeau P, Seizet A. and Cooperating Medical Group. Double-blind randomized trial of a dihydroergocryptine mesylate-caffeine combination (Vasobral) in mental and behavioral disorders in elderly out-patients. Sem Hop Paris 1986;62:1137-42.
14.Аведисова А.С., Файзуллоев А.А., Бугаева Т.П. Динамика когнитивных функций у больных с эмоционально-лабильными расстройствами сосудистого генеза при лечении Вазобралом // Клиническая фармакология и терапия. 2004. Т. 13. № 2. С. 42-47.
15. Батышева Т.Т., Костенко Е.В., Ганжула П.А. и др. Комплексная программа вторичной профилактики инсульта: место комбинированного препарата Вазобрал // Consilium medicum. 2007. Т. 2. № 2. С. 93-96.
16. Гудкова В.В., Стаховская Л.В., Кирильченко Т.Д. и др. Ранняя реабилитация после перенесенного инсульта // Consilium medicum. 2007. Т. 8. № 8. С. 692-696.
| Апрель 2012 г. |