Опубликовано в:
«Гастродуоденальные кровотечения язвенной этиологии», руководство для врачейВОЗМОЖНОСТИ АНТИСЕКРЕТОРНОЙ ТЕРАПИИ ПРИ ОСТРЫХ ГАСТРОДУОДЕНАЛЬНЫХ ЯЗВЕННЫХ КРОВОТЕЧЕНИЯХ
В.К. Гостищев, М.А. ЕвсеевПри проспективных рандомизированных исследованиях Hwan-Jeng Lin и P. Netzer (1998–1999) показали, что частота рецидивов ОГДЯК после первичного эндогемостаза и терапии омепразолом и фамотидином составила 1 и 16% соответственно в течение первых 3 сут, 2 и 24% соответственно в течение последующих 14 сут. Однако те же авторы указывают, что для подавления желудочной секреции применялись дозы омепразола и фамотидина, превышающие среднетерапевтические в 4–6 раз. M. Khuroo и соавт. (1999) M. Bustamante и соавт. (2000) указали на снижение частоты повторного эндоскопического гемостаза, уменьшение кровопотери, а также на снижение частоты неотложных оперативных вмешательств при ОГДЯК на фоне внутривенного применения омепразола.
Для оценки клинической эффективности антисекреторных препаратов при ОГДЯК мы рассмотрели стабильность эндогемостаза у 962 пациентов на фоне применения этих лекарственных средств. Критерием клинической эффективности препаратов считали отсутствие рецидива кровотечения и его угрозы как показания к срочному оперативному вмешательству. Применяли следующие лекарственные препараты.
Препарат/ Группа Режим дозирования Кол-во наблюдений Пирензепин M1-блокатор 40 мг в/в болюсно + непрерывная внутривенная инфузия 2 мг/ч + прием внутрь в дозе 40 мг/сут (после 4 сут инфузии) n=223 Фамотидин Н2-блокатор 40 мг в/в болюсно + непрерывная внутривенная инфузия 4 мг/ч + прием внутрь в дозе 40 мг/сут (после 4 сут инфузии) n=479 Омепразол ИПП 80 мг внутривенно болюсно + непрерывная внутривенная инфузия 4 мг/ч + прием внутрь в дозе 40 мг/сут (после 4 сут инфузии) n=260 Внутривенную инфузию начинали непосредственно после установления диагноза ОГДЯК. Внутривенную инфузию препаратов продолжали 96 ч или до неотложного оперативного вмешательства в связи с нестабильностью гемостаза. После завершения парентерального введения назначали прием антисекреторных препаратов внутрь в течение 10 сут и более. Выбор препарата не зависел от морфологического субстрата геморрагии, ее интенсивности по J. Forrest, объема кровопотери, возраста и пола. Антисекреторные препараты применяли с одинаковой частотой при эндогемостазе разными методами (инфильтрационный, электрокоагуляционный, комбинированный), т.е. частота применения препарата соответствовала частоте использования данного метода эндогемостаза вообще.
Эффективность подавления желудочной секреции при внутривенной терапии омепразолом или фамотидином определяли по данным рН-метрии в теле желудка при ЭГДС через 12, 48 и 72 ч от начала терапии. Для оценки влияния антисекреторных препаратов на кислородный режим и активность свободнорадикального окисления в патологическом очаге при ЭГДС синхронно исследовали рО2тк и окислительно-восстановительный потенциал (редокс-потенциал, Eh) ткани периульцерозной зоны. рО2тк исследовали методом полярографии. Eh изучали по оригинальной методике (патент РФ № 2241997). Для этого измеряли потенциал, возникающий между активным электродом, проводимым через биопсийный канал фиброскопа и имплантируемым в ткань язвенного кратера, и хлорсеребряным электродом сравнения, установленным в подмышечной впадине.
На фоне антисекреторной терапии рецидив ОГДЯК произошел у 7,2% пациентов. Он развился в первые 12 ч у 30,4% всех пациентов с повторной геморрагией, в 12–72 ч — у 49,3% и, позднее 72 ч — у 20,3% пациентов. У 14,8% пациентов выявлена угроза рецидива кровотечения III степени (максимальная), что стало причиной неотложного оперативного вмешательства. Таким образом, оказался нестабильным гемостаз (рецидив + угроза рецидива ОГДЯК) на фоне антисекреторной терапии у 21,9% всех пациентов. Выявлена обратная зависимость между интенсивностью язвенного кровотечения и эффективностью антисекреторной терапии. Так, если при кровотечении Forrest IIb пациенты с нестабильным гемостазом составили 14,5%, то при кровотечении Forrest IIa, Ib и Ia доля пациентов с нестабильным гемостазом возрастала в 2–4 раза. При интенсивности кровотечения Forrest IIc ни одного случая нестабильного гемостаза не было. Клиническая эффективность антисекреторных средств различалась у пациентов с различной интенсивностью кровотечения (табл. 1).
Таблица 1. Нестабильный гемостаз на фоне антисекреторной терапии при кровотечениях различной интенсивности у 962 пациентов (в процентах)
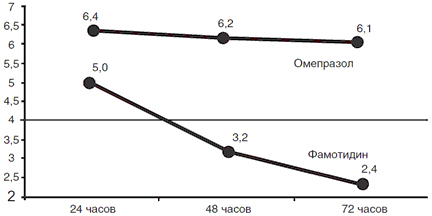
Лекарственный препарат Forrest Ia Forrest Ib Forrest IIa Forrest IIb Всего Пирензепин 100 41,6 67, 9 31,9 28,4 Фамотидин 87,5 37,0 50,9 15,6 22,0 Омепразол 50,0 20,8 32,7 4,1 13,9 В достижении стабильного гемостаза при ОГДЯК различной интенсивности наиболее эффективна терапия омепразолом. Эффективность антисекреторной терапии также различалась у пациентов с неодинаковым морфологическим субстратом ОГДЯК. Применение антисекреторных препаратов обеспечило стабильный гемостаз у 92,5% пациентов с НПВП-индуцированными язвами, у 89,3% с острыми язвами, у 81,2 и 81,1% пациентов с впервые выявленными и хроническими язвами и лишь у 45,0% пациентов с каллезными язвами; при кровотечениях из острых язв эффективность всех препаратов была сходной. При НПВП-индуцированных язвах случаи нестабильного гемостаза отмечены только на фоне терапии пирензепином и фамотидином. Наиболее эффективна при ОГДЯК различной этиологии и интенсивности продленная внутривенная инфузия омепразола. Наименьшая эффективность при ОГДЯК различной этиологии отмечена у пирензепина и фамотидина. В течение 72-часовой терапии омепразолом и фамотидином (рис. 1) под влиянием омепразола рН в теле желудка все время наблюдения превышал 6,0, а при использовании фамотидина прогрессивно снизился до 3,2 через 48 ч от начала терапии и до 2,4 через 72 ч от начала терапии, что подтверждает существование феномена «усталости» H2-рецепторов (тахифилаксии).
Рис. 1. Интрагастральный показатель рН (М) при терапии омепразолом в/в и фамотидином в/в (72-часовое наблюдение)
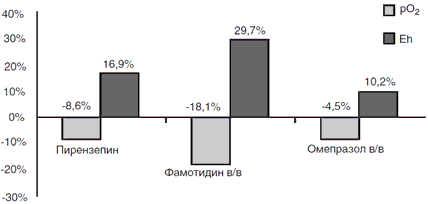
Влияние препаратов на кислородный режим и окислительно-восстановительный потенциал исследуемой зоны было неодинаковым (рис. 2). Изменения кислородного режима ткани язвы оценивали методом полярографии по динамике парциального давления кислорода (∆рО2тк), активность свободнорадикального окисления — по возрастанию редокс-потенциала ткани (∆ Eh). Максимально выраженные нарушения кислородного режима и окислительно-восстановительного потенциала в ткани язвы отмечены при терапии фамотидином: среднее значение ∆рО2тк составило —18,1%; ∆Eh +29,7%. Минимальные изменения рО2тк и Eh произошли на фоне внутривенной терапии омепразолом: среднее значение ∆рО2тк составило -4,5%, среднее значение ∆Eh +10,2%. Таким образом, максимальное прогрессирование ишемии ткани язвы с активацией свободнорадикального окисления происходит при инфузии фамотидина. Наименее выраженные явления ишемии и активации оксидаз в ткани язвы сопутствуют внутривенному введению омепразола (рис. 2).
Рис. 2. Влияние антисекреторных препаратов на кислородный режим и свобод-норадикальное окисление в ткани язвы (* ∆ – изменение значения при исследовании через 12 ч по сравнению с исходным значением (%))
Главными критериями клинической эффективности антисекреторных препаратов при ОГДЯК являются отсутствие рецидива кровотечения и состояние стабильного гемостаза. Нестабильный гемостаз на фоне терапии ингибиторами желудочной секреции был у 21,9% пациентов. При этом наблюдалась обратная зависимость между интенсивностью кровотечения и эффективностью антисекреторной терапии в целом. Кроме того, эффективность антисекреторных препаратов различалась у пациентов с различным морфологическим субстратом ОГДЯК. Эти факты отражают зависимость стабильности гемостаза после антисекреторной терапии от интенсивности первичного кровотечения и его морфологического субстрата. Вместе с тем изолированное применение антисекреторных препаратов не может гарантировать окончательного, стабильного гемостаза, особенно при максимальной (III степени) угрозе повторного кровотечения, поскольку в этих условиях антисекреторная терапия проводится при критическом для рецидива геморрагии нарушении кислородного режима и активации свободнорадикального окисления в ткани язвы. В этой ситуации даже самое эффективное подавление желудочной секреции на фоне прогрессирующей локальной ишемии и окислительного стресса с формированием очагов ишемического некроза в ткани язвы не может гарантировать надежный гемостаз.
Принципиально иными возможностями обладает антисекреторная терапия при умеренной (II степень) угрозе рецидива кровотечения, когда ишемическое повреждение ткани язвы в виде некробиоза обратимо, или при минимальной (I степень) угрозе рецидива, когда ишемическое повреждение в ткани язвы вообще не выражено. Именно в предотвращении перехода некробиотических изменений в некроз заключается, на наш взгляд, основная функция антисекреторных препаратов при ОГДЯК. Эффективное подавление секреции должно рассматриваться как самодостаточное лечебное мероприятие при минимальной (I степень) угрозе рецидива ОГДЯК. Оно позволяет избежать неотложного вмешательства при угрозе рецидива ОГДЯК II степени и становится обязательной частью предоперационной подготовки перед неотложной операцией при максимальной (III степень) угрозе рецидива язвенного кровотечения.
Антисекреторная терапия должна по меньшей мере не усугублять предшествующую локальную гипоксию. Исключение кислотно-пептического фактора, инициирующего ОГДЯК, гарантирует повышение рН желудочного сока выше 6,0 в течение наиболее вероятного периода развития рецидива ОГДЯК — 24–72 ч от начала терапии. Гарантированное состояние желудочной гипосекреции в указанный период отмечено только при инфузии омепразола: через 72 ч от начала терапии рН в теле желудка был выше 6,0. В то же время на фоне терапии фамотидином уже через 48 ч значение рН в теле желудка приближалось к 3,0, а через 72 ч от начала терапии рН в теле желудка был ниже 2,5. Феномен тахифилаксии, резко снижающий эффективность Н2-блокаторов, отмечен многими исследователями. В течение первых 12 ч терапии, когда происходит 30,4% всех рецидивов ОГДЯК, рН в теле желудка при применении как внутривенной формы омепразола, так и фамотидина был выше 5,0. В связи с этим совершенно по-новому представляется причина различия клинической эффективности антисекреторных средств — неодинаковое влияние препаратов на кислородный режим и процессы свободнорадикального окисления в ткани язвы. При кровопотере различной тяжести, при разных морфологических субстратах ОГДЯК максимальные нарушения кислородного режима и окислительно-восстановительного потенциала в ткани язвы отмечены при введении фамотидина, а минимальные изменения — на фоне внутривенной терапии омепразолом. Таким образом, максимальное прогрессирование ишемии ткани язвы с активацией процессов свободнорадикального окисления происходит при изолированном использовании фамотидина. Явления ишемии и активации оксидаз в ткани язвы минимальные при внутривенном введении омепразола изолированно или в комбинации с октреотидом. Различное влияние фамотидина и омепразола на кислородный режим и активность оксидаз в ткани можно объяснить особенностями их фармакодинамики (рис. 3).
Рис. 3. Механизм влияния антисекреторных препаратов на кислородный режим и свободнорадикальное окисление в ткани язвы
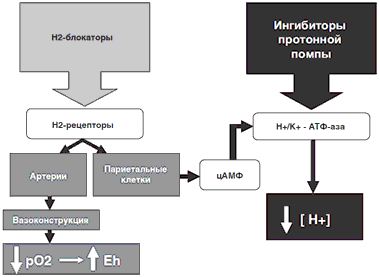
Известно, что антисекреторное действие препаратов обоих классов объясняется в конечном счете блокированием Н+/К+-АТФазы. Однако если ИПП действуют непосредственно на этот фермент, то ингибирование активности Н+/К+-АТФазы Н2-блокаторами осуществляется опосредованно, через активацию Н2-рецепторов, аденилатциклазного каскада, приводящего к образованию цАМФ, ингибирующей протонную помпу. Возможно, развитие толерантности к Н2-блокаторам с постепенным снижением их антисекреторного эффекта в течение 24–72 ч при постоянном парентеральном введении обусловлено именно опосредованным действием препаратов этого класса и истощением резерва мессенджеров (цАМФ) для Н+/К+-АТФазы. Помимо мембраны париетальных клеток, Н2-рецепторы присутствуют на мембране гладкомышечных клеток артерий подслизистого и мышечного слоев стенки желудка и ДПК. Активация Н2-рецепторов гистамином приводит к выраженной дилатации этих артерий и усилению гемоперфузии желудочной и дуоденальной стенки (Коморовский Д.И., Ковальчук Л.А., 1984). Соответственно возникающие при блокированных Н2-рецепторах снижение артериального притока в стенку гастродуоденальной зоны [Tsukamoto Y. et al.,1987], гипоксия и активация связанных с ней процессов свободнорадикального окисления — закономерное действие Н2-блокаторов. Это объясняет снижение рО2тк и повышение Eh в ткани язвы при применении фамотидина, а следовательно, объясняет и его меньшую эффективность по сравнению с внутривенной инфузией омепразола для достижения стабильного гемостаза при ОГДЯК.
Еще одним подтверждением принципиально большей эффективности ИПП при ОГДЯК стало резкое (в 2–3 раза) снижение в нашей клинике числа экстренных оперативных вмешательств в последнее пятилетие, когда применяли внутривенное введение омепразола, по сравнению с периодом, когда для подавления желудочной секреции вводили внутривенно фамотидин.
В «Международных клинических рекомендациях по ведению пациентов с неварикозными кровотечениями из верхних отделов желудочно-кишечного тракта» [«Consensus Recommendations for Managing Patients with Nonvariceal Upper Gastrointestinal Bleeding» (Barkun A., Bardou M., Marshall J.K. et al., 2003)] приводятся следующие принципы антисекреторной терапии при ОГДЯК.
Рекомендация 15. При желудочно-кишечных кровотечениях из верхних отделов желудочно-кишечного тракта не рекомендуется применение блокаторов H2-гистаминовых рецепторов (Н2-блокаторов).
Рекомендация 16. При острых неварикозных кровотечениях из верхних отделов желудочно-кишечного тракта не рекомендуется применение соматостатина и октреотида.
Рекомендация 17. Внутривенный болюс с последующей постоянной инфузией ИПП после эндоскопического гемостаза с высокой вероятностью позволяет предотвратить рецидив кровотечения.
Рекомендация 18. У пациентов, ожидающих эндоскопического исследования, необходимо рассмотреть возможность эмпирической терапии высокими дозами ИПП.
Рекомендация 20. Все пациенты с кровотечениями из верхних отделов желудочно-кишечного тракта должны быть обследованы на НР и при положительном результате получить эрадикационную терапию.
| Май 2014 г. |