Опубликовано в журнале:
«Вопросы гинекологии, акушерства и перинатологии» 2006, т. 5, № 1, С. 96-100Ферлатум - инновационная технология для безопасного лечения железодефицитной анемии
О.И. Карпов, А.М. Тайпурова
Санкт–Петербургский государственный медицинский университет им. академика И.П. ПавловаЖелезо-протеиновый комплекс (Ферлатум) представляет собой неионное соединение железа, обладающее высокой эффективностью и улучшенной переносимостью по сравнению с традиционными ионными соединениями железа, содержащего его в двухвалентной форме. Эффективность Ферлатума в лечении железодефицитной анемии, в том числе у беременных женщин, подтверждена в многочисленных исследованиях. Впервые проведено фармакоэкономи-ческое сопоставление Ферлатума и препарата двухвалентного железа Сорбифера дурулес у беременных с анемией. Установлена одинаковая эффективность дозировки Ферлатума в 80 мг в сут и Сорбифера дурулес в 100 мг в сут. Однако переносимость Ферлатума достоверно лучше, что предупреждает дополнительные затраты на коррекцию побочных эффектов Сорбифера дурулес. Ферлатум имеет высокие клинико-экономические показатели и преимущества при лечении железодефицитной анемии при беременности. Ключевые слова: железодефицитная анемия, лечение, Ферлатум
Ferlatum: innovation technology for safe treatment of iron-deficiency anemia
O.I.Karpov, A.M.Taipurova
I.P.Pavlov Saint-Petersburg State Medical UniversityIron-protein complex Ferlatum is nonionic bivalent iron compound with high effectiveness and improved tolerance in comparison with traditional ionic iron compounds. Ferlatum effectiveness for treatment of iron-deficiency anemia, including therapy of pregnant women, is confirmed in numerous of studies. There were conducted first comparison study with Ferlatum and bivalent iron medicine Sorbifer durules in pregnant women with anemia. It was established, that Ferlatum in dosage of 80 mg/day had the same effectiveness as Sorbifer durules in dosage of 100 mg/day. However, Ferlatum had shown reliable better tolerance that has allowed preventing additional expenses for reducing adverse effects of Sorbifer durules. Thus, Ferlatum has high clinical and economic rates, as well as benefits for the treatment of iron-deficiency anemia in pregnant women. Key words: iron-deficiency anemia, treatment, Ferlatum
Железодефицитные анемии (ЖДА) представляют важную проблему женского здоровья, поскольку являются наиболее распространенным видом патологии в любом возрасте, в том числе и при беременности. Дефицит железа приводит к нарушению синтеза гема и таких важных белков, как миоглобин и ферменты тканевого дыхания. Распространенность ЖДА у женщин составляет 12–18%, а у беременных она может достигать 30–70%.
Выделяют следующие группы риска по ЖДА во время беременности [1]:
- перенесенные инфекционные заболевания во время беременности;
- экстрагенитальная фоновая патология (ревматизм, пороки сердца, сахарный диабет, заболевания системы органов пищеварения);
- меноррагии;
- частые беременности;
- наступление беременности при лактации;
- беременность в подростковом возрасте;
- анемия в анамнезе;
- уровень гемоглобина (Hb) в I триместре менее 120 г/л;
- многоплодная беременность;
- многоводие;
- осложнения беременности.
Анемии беременных нередко сопутствуют:
- гипотрофия плода (25%);
- гипоксия плода (35%);
- гестоз (40%);
- невынашивание беременности (15–42%);
- гипоплазия и отслойка нормально расположенной плаценты с кровотечением (10%);
- слабость родовой деятельности (10–15%);
- гнойно-септические осложнения в послеродовом периоде (10–12%);
- гипогалактия (30–40%) [2].
Развитие анемии вне беременности также чревато различными осложнениями, среди которых следует выделить [3]:
- изменение состояния слизистых оболочек (полости рта, пищевода, желудка, влагалища);
- нарушения менструального цикла, дистрофические изменения миометрия;
- патологические изменения в печени (нарушение белко-восинтетической функции, гликогенобразующей, детоксици-рующей, изменение метаболизма ряда лекарственных препаратов);
- снижение антиинфекционной резистентности организма, увеличение частоты различных бактериальных и вирусных инфекций;
- изменение кожи и ее придатков (бледность, сухость, трещины, изменения ногтей, выпадение волос);
- общая слабость, невозможность выполнять повышенную и обычную физическую работу, снижение качества жизни;
- гипотония.
Клиническая симптоматика может отставать от лабораторной диагностики. Вот почему важным представляется своевременное выявление ЖДА, что имеет особое значение для беременных.
Уровень гемоглобина должен быть более 110 г/л (I и III триместры) и более 105 г/л (II триместр).
Эритроциты – не менее 3,25 × 1012/л.
Цветовой показатель – 0,86–1,05.
Гематокрит – 36–42%.
Ретикулоциты – 0,2–1,2%.
Сывороточное железо – 12,5–30,4 мкмоль/л.
Общая железосвязывающая способность сыворотки – 45–75 мкмоль/л.По степени тяжести анемии у беременных выделяют легкую ЖДА – уровень Hb крови 110–90 г/л, средней тяжести – 89–70 г/л и тяжелую анемию – менее 70 г/л.
Следует помнить, что дефицит железа не может быть ликвидирован с помощью диеты или железосодержащих поливитаминных комплексов, в которых этот элемент присутствует только в суточной, недостаточной для лечения дозировке [4]. Лечение ЖДА может проводиться только при условии фармакодинамической нагрузки организма железом, что возможно только при применении железосодержащих (антианемических) лекарственных препаратов [5]. «Идеальный препарат» должен содержать железо в трехвалентной форме, в фармакодинамической дозировке, иметь дополнительные факторы всасывания железа, обладать прогнозируемым и пролонгируемым действием, не иметь значимых нежелательных эффектов, прежде всего, на органы пищеварения (не вызывать желудочную и кишечную диспепсию, не иметь гепатотоксичности), обязательным условием должно быть отсутствие тератогенного, эмбрио- и фетотоксического действия (возможность безопасного применения у беременных). Кроме того, необходимо, чтобы у него были оптимальные фармакоэкономические параметры [6].
Ферлатум – полусинтетический железо-протеиновый комплекс, в котором атомы трехвалентного железа окружены белковым носителем, вырабатываемым из казеина. Основное назначение препарата – лечение железодефицитной анемии, в первую очередь у беременных. Ферлатум содержит железо в трехвалентной форме (Fe(III)), чем отличается от имеющихся на рынке препаратов Fe(II). Железо из неионных соединений переносится на трансферрин и ферритин непосредственно из лекарственного средства (ЛС) путем активного транспорта с участием специального белка-переносчика. При такой фармакокинетике передозировка, в отличие от ионных ЛС, практически исключена, также минимизировано его действие на слизистую оболочку желудка [7]. Поскольку при применении неионных соединений отсутствует процесс восстановления железа, не отмечается свободно-радикального повреждения ферментов и мембран – снижение потенциальной опасности повреждающего действия препаратов железа. Для Ферлатума свойственна и своя, присущая только ему, фармакокинетика, тесно связанная с его физико-химическими свойствами. Вследствие преципитации входящего в его состав белка в кислой среде желудка образуется защитная белковая оболочка, предотвращающая контакт железа со слизистой и исключающая потому раздражающее действие. В этом принципиальное отличие Ферлатума от других неионных соединений Fe(III) (таблица). Доказательствами прочности белковой защиты являются результаты экспериментов, в которых Ферлатум подвергался воздействию хлористоводородной кислоты физиологических концентраций (т.е. моделировались реальные условия). В течение 24-часового воздействия разрушалось только 0,005% от общего количества железа в лекарственном средстве, что подчеркивает стабильность образующегося комплекса [8]. Итак, используемый белковый носитель не позволяет железу осуществлять непосредственный контакт со слизистой оболочкой желудка, поэтому раздражающее действие металла на желудок практически сведено к минимуму.
Таблица. Сравнительная характеристика Ферлатума и ионных препаратов железа
Ферлатум Ионные соединения Эффективность Высокая Высокая Переносимость Отличная Частые побочные эффекты Безопасность Высокая Возможна передозировка Взаимодействие с пищей Нет Есть Оксидативный стресс Не вызывает Вызывает Режим дозирования Удобный Менее удобный Вкус Нет привкуса Металлический вкус Окрашивание зубов Практически не бывает Бывает, иногда необратимо Комплаенс Высокий Часты отказы от лечения В нейтральной или слабощелочной среде верхних отделов тонкой кишки белковая оболочка подвергается ферментативному разрушению с выходом из-под нее Fе(III), подвергающегося активному всасыванию в кишечнике. Быстрое всасывание обусловлено как оптимальными для прохождения в энтероциты размерами частиц (до 10 нм) железа, так и массивным перевариванием белковой оболочки трипсином сока поджелудочной железы. Таким образом, происходит равномерное, стабильное и безопасное поступление железа, содержащегося в Ферлатуме, в организм, без пиков концентраций и связанных с этим процессов патологического депонирования железа с развитием гемосидероза.
Как и из других неионных соединений, Fe(III) на уровне ворсинчатого края слизистой кишечника поглощается энтероцитами, связывается с внутриклеточным трансферрином и переносится в кровеносное русло, транспортируясь непосредственно в органы гемопоэза и частично в депо, представленное ферритином. Подобная фармакокинетика, характеризующаяся высокой и не зависящей от приема пищи абсорбцией и стабильной биодоступностью, обеспечивает полноценное восполнение дефицита железа.
Отличительной особенностью Ферлатума также следует считать отсутствие влияния различных патологических состояний в желудке на фармакокинетику [9]. В отличие от ионных соединений Fe(II), Ферлатум, например, не хуже всасывается при гастрэктомии, чем при сохраненном желудке [10]. Ионные соединения при этом состоянии поступают в организм в среднем на 20% меньше, чем в обычных условиях, к тому же приходится искусственно воссоздавать кислотность с помощью аскорбината или заместительных препаратов, содержащих желудочный сок.
В условиях хронической гемической гипоксии при анемии всасывание железа, как известно, повышается. Это своеобразный приспособительный механизм восстановления гомеостаза, что справедливо для всех препаратов железа. Хотя в эксперименте и установлено повышение всасывания ионных соединений, однако количество остаточного Fe(II) в органах пищеварения остается значительным. Степень абсорбции Ферлатума, и без того стабильно высокая, еще больше возрастает, увеличивается и скорость этого процесса. Данное обстоятельство подчеркивает дополнительное преимущество Ферлатума перед другими железосодержащими препаратами – отсутствие возрастания токсичности.
Ферлатум качественно отличается от препаратов, содержащих Fe(II), по потребительским свойствам, обеспечивая лучшую исполнительность больных (комплаентность), что важно для качественного длительного (в течение нескольких месяцев) противоанемического лечения. Наличие Ферлатума в жидкой форме в виде стабильного раствора для приема внутрь удовлетворяет потребностям пациентов разного возраста.
В обобщенном виде ключевые положения, характеризующие базовые клинико-фармакологические свойства Ферлатума, можно сформулировать следующим образом:
- низкий токсикологический потенциал и отсутствие риска отравления (важно для использования препарата в детском и подростковом возрасте);
- нет взаимодействия с пищей, возможность применения вне связи с едой;
- постоянное стабильное всасывание вследствие уникальности механизмов абсорбции при отсутствии альтерации тканей органов пищеварения;
- меньшее накопление в ткани печени и селезенки, чем при применении ионных соединений железа;
- отсутствие клинически значимых взаимодействий с лекарственными препаратами, применяющимися для лечения различных заболеваний;
- отсутствие тератогенного эффекта даже при условии использования заведомо высоких доз, в десятки раз превы шающих фармакотерапевтические (наблюдение за репродуктивной функцией животных в доклинических исследованиях) и среднетерапевтических дозировок (результаты применения Ферлатума у беременных женщин);
- высокая клиническая эффективность при железодефи-цитных анемиях, возникающих вследствие различных причин потери железа: при беременности, в послеоперационном периоде, при дисфункциональных и ювенильных маточных кровотечениях.
В наших исследованиях Ферлатум применялся по стандартной методике при подтверждении диагноза ЖДА у беременных со сроком гестации не менее 12 нед (по 1 флакону 2 раза в сут) – 30 человек. В группе сравнения пациентки получали Сорбифер дурулес (ионный препарат Fe(II)) по 1 таблетке в сут – 30 человек.
Критериями включения были следующие: беременные, у которых содержание гемоглобина (Hb) было в пределах > 80 и < 109 г/л, цветовой показатель (ЦП) < 0,85; сывороточное железо (СЖ) < 12 мкм/л, снижение уровня трансферрина более чем на 15%. В исследование не включались беременные с любыми заболеваниями органов пищеварения и селезенки, гемосидерозом, острыми и обострением хронических инфекционных заболеваний. Лечение у пациенток, давших письменное согласие, продолжалось в течение 8 нед.
Группы статистически не различались по степени выраженности клинических и лабораторных признаков ЖДА. Среди клинических признаков преобладали общая слабость, головокружение, одышка при нагрузке, тахикардия, бледность кожных покровов. Лабораторные данные, свидетельствовавшие о наличии анемии, также по группам не различались.
По окончании лечения отмечено повышение уровня эритроцитов и гемоглобина на 28 и 27,9%, соответственно, в группе принимавших Ферлатум, и на 18 и 23% – у принимавших Сорбифер дурулес (p < 0,001 по сравнению с исходными показателями в группах, отсутствие достоверных различий между группами). Достигнуты целевые значения по гемоглобину, сывороточному железу сыворотки и общей железосвязывающей способности сыворотки, что можно считать излечением от анемии (рис. 1). Позитивные сдвиги в лабораторных данных сопровождались редукцией клинической симптоматики – головокружения, одышки, слабости, восстановлением нормальной окраски кожных покровов. Наиболее длительно сохранялись слабость и головокружение, которые уменьшались в течение первого месяца лечения и исчезли у всех пациенток к началу второго месяца (рис. 2).
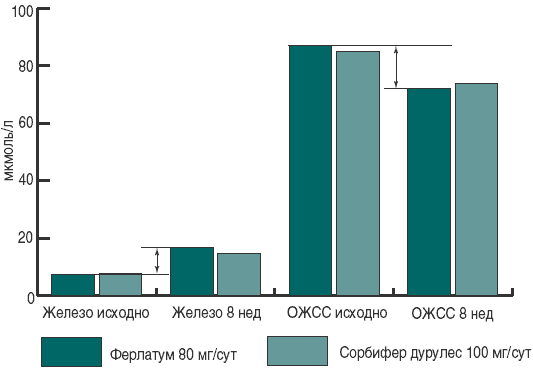
Рис. 1. Изменение лабораторных показателей в процессе лечения ЖДА у беременных. Стрелками показаны изменения при приеме Ферлатума по сравнению с исходным уровнем.
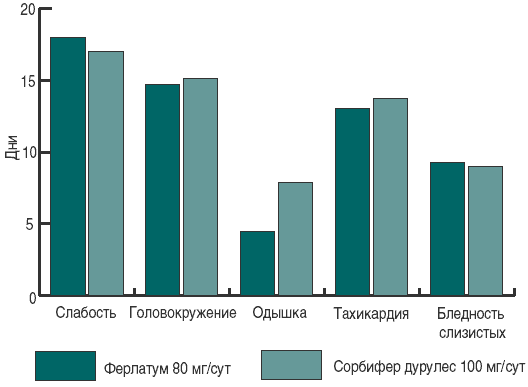
Рис. 2. Средняя длительность симптомов при лечении ЖДА у беременных.
Переносимость лечения была лучше в группе беременных, получавших Ферлатум. При применении Сорбифера дурулес у 6 пациенток отмечались проявления гастрита (рвота, тошнота, боли в животе, металлический привкус во рту). В группе Ферлатума такие эффекты не наблюдались (p < 0,05 по критерию χ2).
Таким образом, при равной клинико-лабораторной эффективности сравниваемых препаратов и режимов лечения Ферлатум отличается от ионных препаратов Fe(II) лучшей переносимостью. Наше исследование подтвердило быструю редукцию анемического синдрома у беременных при идеальной переносимости и безопасности лечения. Ферлатум полностью удовлетворяет требованиям к лекарственному средству по критериям эффективности:
- субъективное улучшение в течение 48 ч после начала лечения;
- максимальный ретикулоцитоз через 9–12 дней;
- нормализация уровня гемоглобина через 6–8 нед с высокими темпами прироста по мере терапии;
- нормализация показателей железа сыворотки крови через 3–6 мес.
Позитивные результаты лечения ЖДА беременных Ферлатумом получены и в других исследованиях. Так, в МОНИАГ при применении препарата у беременных с ЖДА средней тяжести в течение 30 дней повышение уровня гемоглобина произошло на 22%, а сывороточного железа – в 2 раза. Более длительный прием лекарственного средства приводит к прогрессивному повышению гемоглобина до 31,5% и сывороточного железа – более чем в 2 раза (данные НЦ акушерства, гинекологии и перинатологии). Особую значимость для клиники имеет эффективность Ферлатума у беременных с ЖДА и тромбофилией.
Согласно данным проведенного мирового мета-анализа исследований с применением Ферлатума, количество нежелательных реакций при его приеме меньше в 2,1 раза по сравнению с препаратами Fе(II) – относительный риск составляет 0,34. При анемии беременных целесообразно принимать Ферлатум до ее окончания. Для профилактики ЖДА Ферлатум назначают во II и III триместрах беременности в дозе 1 флакон в сутки.
Ферлатум изучался в сравнительном исследовании у 1800 пациенток [11]. Установлено, что восстановление содержания гемоглобина и сывороточного железа в течение 60 дней происходит быстрее, чем при применении препаратов Fe(II). Также показана достоверная разница в частоте гастро-интестинальных побочных эффектов, которых было значительно меньше при его применении. Лекарственное средство может быть использовано при ЖДА любой этиологии, в том числе и в результате кровопотери при гинекологических операциях и циклических кровотечениях [12].
Подтверждена эффективность и безопасность применения Ферлатума у детей и подростков. При ювенильных маточных кровотечениях ЖДА является частым синдромом, ухудшающим качество жизни пациенток. На фоне антианемической диеты, специально разработанного режима физической активности включение в схему лечебных мероприятий Ферлатума является крайне эффективным. Длительность терапии препаратом составляет 10 дней во время каждого цикла, что позволяет повышать уровень гемоглобина не менее, чем в 1,5 раза без развития нежелательных лекарственных реакций. За это время темпы прироста гемоглобина являются оптимальными для предупреждения постгипоксических осложнений анемии [13].
Поскольку эффективность Ферлатума и Сорбифера дурулес одинакова, расчет экономической эффективности проводится на основании анализа минимизации стоимости с учетом стоимости лечения возможных осложнений. Согласно нашим данным, которые совпадают с результатами других исследований, частота гастрита при применении ионных Fe(II) препаратов, составляет 25–26% [14]. Таким образом, из 100 принимающих Сорбифер дурулес ожидается, что у 25 будет гастрит, требующий фармакологической коррекции. Расчеты, проведенные нами, показали, что с учетом возможного лечения заболеваний желудочно-кишечного тракта у Сорбифера отсутствуют фармакоэкономические преимущества. Более того, при использовании Сорбифера затраты могут быть реально выше, поскольку у небеременных женщин при развитии побочных эффектов должны также применяться омепразол, мотилиум и висмутсодержащие препараты.
Заключение
Ферлатум обладает высокой клинической эффективностью и безопасностью при лечении железодефицитной анемии, в том числе при беременности.
Прогнозные фармакоэкономические расчеты показывают, что Ферлатум относится к противоанемическим средствам с оптимальными показателями стоимость/эффективность/безопасность.
ЛИТЕРАТУРА
1. Краснопольский В.И. и др. Лечение железодефицитных анемий у беременных женщин. Информационно-методическое письмо. М.: МОНИИАГ, 2004; 22.
2. Scholl T.O. Iron status during pregnancy: setting the stage for mother and infant. Am J Clin Nutr 2005; 81(5): 1218S–1222S.
3. Dubois R.W., Goodnough L.T., Ershler W.B., et al. Identification, diagnosis, and management of anemia in adult ambulatory patients treated by primary care physicians: evidence-based and consensus recommendations. Curr Med Res Opin 2006; 22(2): 385–95.
4. Gambling L., McArdle H.J. Iron, copper and fetal development. Proc Nutr Soc 2004; 63(40): 553–62.
5. Kontoghiorghes G.J., Eracleous E., Economides C., Kolnagou A. Advances in iron overload therapies. Prospects for effective use of deferiprone (L1), deferoxamine, the new experimental chelators ICL670, GT56-252, L1NA11 and their combinations. Curr Med Chem 2005; 12(23): 2663–81.
6. Bozhinova S. Treatment of iron deficiency anaemia in pregnant, puerperal and gynaecological patients-different drugs, different approaches. Akush Ginekol 2005; 44(4): 46–50.
7. Franchini M. Recent acquisitions in the management of iron overload. Ann Hematol 2005; 84(10): 640–5.
8. Gioia M.G., Di Pietra A.M., Gatti R. Validation of a spectrophotometric method for the determination of iron (III) impurities in dosage forms. J Pharm Biomed Anal 2002; 29(6): 1159–64.
9. Cremonesi P., Acebron A., Raja K.B., Simpson R.J. Iron absorption: biochemical and molecular insights into the importance of iron species for intestinal uptake. Pharmacol Toxicol 2002; 91(3): 97–102.
10. Cogo R., De Luca P., Mastrantoni M. Evaluation of the siderohaemic curve after loading administration of iron–protein–succinylate to gastrectomized subjects: a controlled study. J Int Med Res 1990; 18(3): 225–7.
11. Kopcke W., Sauerland M.C. Meta-analysis of efficacy and tolerability data on iron protein-succinylate in patients with iron deficiency anemia of different severity. Arzneimittelforschung 1995; 45(11): 1211–6.
12. Sallusto A., Eandi M., De Bartolo G., et al. Ferroprotein succinylate: treatment of iron deficiency in obstetrics and gynecology. Minerva Ginecol 1990; 42(5): 191–5.
13. Краснопольский В.И. и др. Лечение ювенильных маточных кровотечений. Информационно-методическое письмо. М.: МЗ Московской области, 2003: 21.
14. Gore R.M., Levine M.S., Ghahremani G.G. Drug-induced disorders of the stomach and duodenum. Abdom Imaging 1999; 24(1): 9–16.
15. http://www.pharmindex .
| Февраль 2010 г. |