Опубликовано в журнале:
«Arzneimittel-Forschung/Drug Research» 1995, № 45 (II), 11,, С. 1211-1216Мета-анализ данных эффективности и переносимости железа протеинсукцинилата при лечении пациентов с железодефицитной анемией разной степени тяжести
W. Kopcke and M. С Sauerland
Institutfur Medizmiscke Informatik und Binmalhematik. Westfalische Wilheims-Univeniiai Mtinster, MunslerlWeslf. (Germany)Резюме
Железа протеинсукцинилат (ITF 282, CAS 93615-44-2) является железосодержащим препаратом, предназначенным для лечения железодефицитной анемии при приеме внутрь. Его эффективность и переносимость была доказана на 1800 пациентах, изученных в ходе 3 многоцентровых клинических исследований.
Основной целью настоящего мета-анализа является оценка увеличения уровня гемоглобина (Hb) у этих пациентов (891 из них получали препарат ITF 282, 644 - сульфат железа и 236 - железосодержащий полистирол сульфонат). В ходе 3 исследований было показано гомогенное повышение уровня Hb. Оказалось, что в период с 0 дня по 30 день лечения препарат ITF 282 оказывал похожее или незначительно менее выраженное влияние на повышение уровня Hb по сравнению с другими препаратами, в то время как с 30 дня по 60 день это влияние было выше, чем у других медикаментов.
В дальнейшем анализ данных проводился путем разделения пациентов на три группы в зависимости от выраженности анемии: исходный Hb < 9 г/дл, > 9 < 11 г/дл, > 11 г/дл. В течение 60 дней лечения и препарат ITF 282, и другие анализируемые препараты оказывали наиболее выраженное повышение уровня Hb у пациентов с тяжелой формой анемии. Мета-аналитическая оценка результатов 3 исследований была расширена до анализа данных о переносимости. Из побочных эффектов наиболее часто отмечалось поражение желудочно-кишечного тракта. На фоне приема препарата ITF 282 частота встречаемости побочных эффектов была значительно ниже, чем на фоне приема других медикаментов (9.4 % против 20.4 %, p < 0.01). Сравнительный анализ распределения побочных эффектов в популяции показал, что переносимость препарата ITF 282 у беременных женщин была явно лучше (относительный риск 0.321, p< 0.01).
Анализ периода повышения уровня Hb и переносимости препарата позволяют предположить, что механизм действия препарата ITF 282 и других анализируемых препаратов различен. Так как основная разница между ITF 282 и другими препаратами заключается в форме содержащегося в них железа, которое поступает в ЖКТ, можно предположить, что медикаменты, содержащие свободное двухвалентное железо, могут оказывать раздражающее действие на слизистую желудочно-кишечного тракта, что приводит к нарушению процесса абсорбции и к повышению частоты встречаемости гастро-интестинальных побочных реакций.
Белково-связанное железо, содержащееся в препарате ITF 282, не обладает свойствами, присущими свободному двухвалентному железу. Таким образом, препарат ITF 282 не нарушает процессы абсорбции (что способствует восстановлению уровня гемоглобина) и обладает лучшей переносимостью.
Ключевые слова: CAS 93615-44-2, дефицит железа, железа протеинсукцинилат, железа сульфат, ITF 282, мета-анализ
1. Введение
Традиционно дефицит железа (сопровождающийся или нет признаками анемии) лечится препаратами железа или солями железа. Степень абсорбции двухвалентных солей выше, чем трехвалентных; совместное назначение этих солей внутрь обычно сопровождается повышением частоты встречаемости побочных эффектов [1].
Железа протеинсукцинилат (ITF 282 (Производитель: Italfarmaco S.p.A., Милан (Италия)), CAS 93615-44-2) является препаратом железа, обладающим наилучшим соотношением между клинической эффективностью и переносимостью при назначении внутрь для лечения железодефицитной анемии.
В препарате железо связано с молочно-сукцинилированными протеинами, образуя железо-протеиновый комплекс, хорошо растворимый в воде. В кислой среде pH (< 4) комплекс выпадает в осадок и становится растворимым при более высоких цифрах pH. Кроме того, железа протеинсукцинилат не расщепляется ферментами желудочного сока, а гидролизируется в двенадцатиперстной кишке под действием ферментов поджелудочной железы [2-4]. Эти специфические свойства растворимости определяют переносимость и всасывание активного вещества. Фактически, в желудке железо препарата ITF 282 остается внутри протеиновой капсулы. Таким образом, исключается любое прямое (потенциально опасное) воздействие на слизистую оболочку желудка; с другой стороны, железо хорошо всасывается в просвете двенадцатиперстной кишки после растворения белкового носителя.
2. Материалы и методы
Клиническая эффективность и переносимость железа протеинсукцинилата при суточной дозе железа 120 мг была доказана в ходе трех больших двойных слепых многоцентровых клинических исследований (Таблица 1, [5-7]).
Таблица 1. Синопсис исследований препарата ITF 282.
Номер исследования 1а) 2 3 Выборка взрослые взрослые дети Количество пациентов 1095 174 502 Заболевание железодефицитная анемия Муж/жен 119/976 4/70 272/230 Средний возраст, годы (диапазон) 40.6 (15-88) 33.4 (18:64) 5.2 (1-14) Тип исследования Контролируемое двойное-слепое (двойное-маскированное) Период лечения 60 дней Исследуемый препарат ITF 282 – железа протеинсукцинилат Суточная доза (мг железа )120 120 60-120 Кол-во пролеченных пациентов 549 86 256 Сравниваемые препараты железа сульфат железа сульфат железа полистерен сульфат Суточная доза (мг железа)
105 105 52.5-105 Кол-во пролеченных пациентов 546 88 246 Оценка эффективности
(гематология, общая симптоматика)День 0, 30 и 60 Оценка переносимости
(побочные реакции)День 0, 30 и 60
а) Для пациентов группы препарата ITF 282 данное исследование состояло из двойного слепого 60ти дневного периода лечения и «открытого» 30ти дневного периода лечения. В настоящий мета-анализ включены данные, полученные только в течение двойного слепого периода лечения.Цель проведенных исследований состояла в демонстрации терапевтической эффективности, клинической переносимости и безопасности препарата ITF 282 в сравнении с известными, использующимися в повседневной практике препаратами железа для лечения железодефицитных состояний.
Для обеспечения объективности оценки эффективности препарата производилось наблюдение за показаниями крови - гемоглобин, гематокрит, железо крови, ферритин, трансферрин – в начале исследования, спустя 30 дней и при окончании исследования (60 дней).
Субъективная оценка переносимости достигалась путем наблюдения за потенциальными побочными реакциями пациентов в течение периода лечения и проведения опросов пациентов. Объективная оценка системной безопасности проводилась путем выполнения ряда биохимических анализов крови.
Возраст, пол пациентов, участвующих в исследованиях, а также размер популяций были различными. С другой стороны, диагноз, продолжительность лечения и применяемые дозировки были одинаковыми в течение всех исследований. Более того, ниже указанные параметры были одинаковыми для всех клинических исследований: рандомизация, методика «ослепления» данных, оценка соответствия, критерии включения/исключения, исходные параметры групп лечения, определение результатов лечения. Результаты проведенных исследований, в ходе которых было изучено около 1800 пациентов, являются целью настоящего мета-анализа.
Мета-анализ представляет собой совместную оценку различных исследований по одной тематике. В дополнение к обычному сравнению результатов мета-анализ суммирует и резюмирует результаты различных исследований.
Методика мета-анализа часто используется для слияния данных различных клинических исследований, в ходе которых применялся один и тот же препарат по единым показаниям. Применение этой методики предполагает сходный план анализируемых исследований, в данном случае – исследований препарата ITF 282.
Результаты разных исследований, проводимых в сходных условиях с применением одного и того же препарата, представляются в виде значений «p» или доверительного интервала для иллюстрации разницы между исследованиями. В ходе выполнения мета-анализа применяются различные статистические приемы:
- Слияние всех значений «p» и проверка нулевой гипотезы, говорящей об отсутствии разницы между схемами лечения в каждом отдельном исследовании.
- Подсчет количества «значимых» результатов.
- Слияние данных результатов лечения отдельных исследований и вычисление доверительного интервала.
Если присутствует статистическая оценка параметров эффективности, для выполнения мета-анализа лучше всего использовать последнюю методику. Если присутствуют количественные параметры эффективности схем лечения A и В со средним значением μ, принято стандартизировать разницу лечения с целью получения сопоставимых параметров. Если присутствуют качественные параметры эффективности или переносимости (успешное лечение или наличие побочных реакций) с вероятностью π1 для основного препарата и с вероятностью π2 для сравниваемых препаратов, тогда наиболее подходящим средством оценки эффективности (или переносимости) δ являются логарифмические вероятности. Допущение идентичных параметров эффективности может быть статистически проверено с применением χ2 теста и K-l степенью свободы [8].
3. Результаты
3.1. Эффективность препарата
Основной целью настоящего мета-анализа является оценка степени повышения уровня гемоглобина на фоне проводимого лечения.
Концентрация гемоглобина в крови рассматривалась как наиболее значимый параметр оценки эффективности лечения железодефицитной анемии [1]. Показатели повышения уровня гемоглобина в ходе лечения препаратами железа (ITF 282 и другими медикаментами) в ходе 3 клинических исследований показаны в Таблице 2. Согласно результатам проведенного анализа в ходе 3 исследований наблюдалось равномерное повышение уровня Hb в 30 день (χ2 = 0.35, p > 0.05) и в 60 день (χ2 = 4.21, p > 0.05) (Таблица 3).
Таблица 2: Динамика уровня Hb в ходе 3 исследований (г/дл, среднее ± S.D.*).
№ исслед. Лечение День 0 День 30 День 60 Увеличение уровня Hb
день 0
день 30Увеличение уровня Hb
день 0
день 601 ITF 282 11.0±1.4 11.8±1.3 13.0±1.0 0.8±0.7 2.0±1.0 Другой препарат 11.0±1.4 11.8±1.3 12.8±1.0 0.8±0.7 1.8±1.0 2 ITF 282 9.9±1.1 11.4±1.2 12.2±1.2 1.5±1.5 2.2±1.7 Другой препарат 10.0±0.9 11.8±1.1 12.1±1.3 1.7±1.3 2.1±1.5 3 ITF 282 10.7±1.4 11.4±1.3 12.3±0.8 0.7±1.0 1.6±1.4 Другой препарат 10.8±1.4 11.8±1.2 12.2±0.9 1.0±1.1 1.4±1.4
* S.D. – среднеквадратическое отклонениеТаблица 3: Мета-анализ повышения уровня Hb.
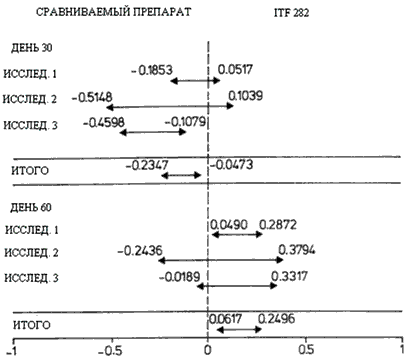
№ исследования Оценка действия Стандартное отклонение 95% доверительный интервал День 30
1 -0,06675 0.06047 -0.1853 + 0.0517 2 -0.2055 0.1578 -0,5148 + 0.1039 3 -0.2839 0.08978 -0.4598 + 0.1079 Совместная оценка -0.141 0.0478 -0.2347 + 0.0473 День 60
1 -0,1681 0.06076 -0.0490 + 0.2872 2 -0.06788 0.1589 -0.2436 + 0.3794 3 -0.1564 0.08946 -0.0189 + 0.3317 Совместная оценка -0.1556 0.04792 -0.0617 + 0.2496 Критерий гомогенности День 30 χ2 = 4.20653 (p = 0.1220)
День 60 χ2 = 0.347179 (p = 0,8406)По состоянию на 30 день степень повышения Hb на фоне приема препарата ITF 282 была ниже, чем на фоне приема других препаратов (95 % ДИ, -0,2347 ÷ -0.0473), однако на 60 день повышение было более выражено (95 % ДИ. 0.0617 ÷ 0.2496) (Рис. 1).
Рис. 1: Мета-анализ повышения уровня Hb
На втором этапе, данные по уровню Hb анализировались путем объединения пациентов трех исследований с последующим их разделением на три подгруппы, в зависимости от степени тяжести анемии: исходные значения гемоглобина < 9 г/дл, > 9 < 11 г/дл, > 11 г/дл. В течение 60ти дневного периода лечения пациентов с тяжелой формой анемии наибольшее повышение уровня гемоглобина наблюдалось как на фоне приема ITF 282, так и других препаратов: + 4 г/дл в группе ITF 282 и + 3.5 г/дл в группе других препаратов (Таблица 4).
Таблица 4: Повышение уровня гемоглобина (г/дл, среднее + S.D.) в зависимости от степени выраженности анемии
Исходный Hb < 9 г/дл Исходный Hb 9-11 г/дл Исходный Hb > 11 г/дл IFT282
(n = 82)Др. препарат
(n = 79)ITF 282
(N = 406)Др. препарат
(N = 406)ITF 282
(n = 397)Др. препарат
(n = 378)Исходный Hb 8.1 ± 0.8 8.2 ± 0.8 10.3 ± 0.5 10.3 ± 0.5 12.0 ± 0.9 12.0 ± 0.9 Hb после 30 дней лечения 10.0 ± 1.3 10.1 ± 1.2 11.2 ± 0.9 11.4 ± 0.9 12.5 ± 1.0 12.6 ± 1.0 Hb после 60 дней лечения 12.1 ± 0.9 11.7 ± 0.9 12.4 ± 0.8 12.3 ± 0.9 13.2 ± 1.1 13.0 ± 11.0 Суточное повышение Hb в 1 месяц 0.063 0.063 0.030 0.037 0.017 0.020 Суточное повышение Hb во 2 месяц 0.070 0.053 0.040 0.030 0.023 0.013 Статистическая оценка между группами препаратов день 0 - день 60,
день 30 - день 60,
p<0,01день 0 - день 30,
день 30 - день 60,
p<0,01день 0 - день 60,
день 30 - день 60
p<0,01Статистическая оценка внутри группы препаратов день 0 - день 30, день 0 - день 60, р<0.01 Оказалось, что во всех подгруппах в зависимости от степени тяжести анемии, на фоне приема препарата ITF 282 наблюдалось сходное (в течение периода с 0 по 30 день) или меньшее увеличение уровня Hb по сравнению с другими препаратами. В то время как с 31 дня по 60 день его воздействие было всегда сильнее (Таблица 4, Рис. 2).
Рис. 2: Суточное повышение Hb (г/дл) в течение первого и второго месяца лечения пациентов с анемией разной степени тяжести. ▒ - ITF 282, □ др. препарат.

3.2. Переносимость препарата
Мета-аналитическая оценка результатов 3 клинических исследований была расширена до анализа переносимости терапии железосодержащими препаратами. И в группе препарата ITF 282 и в группах других медикаментов наиболее часто пациенты предъявляли жалобы, касающиеся желудочно-кишечного тракта: тошнота/рвота, изжога/пекущие боли за грудиной, боли в эпигастрии или в животе, запор, диарея.
Была проанализирована частота встречаемости побочных реакций, о которых сообщали участники исследования. Результаты всех 3 исследований также были гомогенными (χ2 = 4.34, p > 0.05) (Таблица 5).
Таблица 5. Мета-анализ побочных реакций.
№ исследования Побочные реакции Эффект S.D. Доверительный интервал 95% ITF 282 Др. препараты Нет Да Нет Да 1а 486 63 419 127 0.8494 0.1679 0.5203 ÷ 1.1785 2 77 8 75 9 0.1441 0.5123 -0.8600 ÷ 1.1482 3 243 13 203 43 1.3761 0.3305 0.7283 ÷ 2.0239 Total 806 84
(9.4 %)697 179
(20.4 %)0.8935 0.1437 0.6118 ÷ 1.1751 Критерий гомогенности χ2 = 4.3415 (р > 0.05)
aВ настоящий мета-анализ включены данные, полученные только в ходе двойного слепого периода исследования.Положительный доверительный интервал (95% ДИ 0.6118 ÷ 1.1751) для объединенных результатов исследований подтверждает, что частота встречаемости побочных реакций на фоне приема препарата ITF 282 значительно ниже, чем на фоне других препаратов (Рис. 3).
Рис. 3: Мета-анализ побочных реакций

В целом, только 9.4 % пациентов, получавших железа протеинсукцинилат, сообщали о побочных реакциях, а лечение препаратами с двухвалентным железом вызывало побочные реакции в 20.4 % случаев (p < 0.01). Такая частота встречаемости побочных реакций на фоне сульфата железа соответствует описанным в литературе данным по применению солей железа (20-30% леченых пациентов) [9].
Следующий шаг мета-аналитической оценки переносимости препарата ITF 282 заключался в анализе распределения побочных реакций внутри выборки пациентов, получавших железа протеинсукцинилат и сравниваемые препараты. Взрослые пациенты (Исследование 1 и 2) были объединены вместе. Дети (Исследование 3) анализировались отдельно.
Внутри каждой выборки пациенты анализировались по определенным критериям. Степень переносимости лечения анализировалась в каждой группе путем оценки относительной величины частоты встречаемости побочных реакций, относительного риска и 95 % доверительного интервала.
У взрослых пациентов (Таблица 6) частота встречаемости побочных реакций распределилась поровну между пациентами, принимавшими ITF 282 и соли железа (R.R. 0.519, 95% ДИ 0.398 ÷ 0.676, p < 0.01). Это терапевтическое преимущество препарата ITF 282 над другими исследуемыми медикаментами особенно четко проявилось у женщин (R.R. 0.483, 95% ДИ 0.364 x ÷ 0.640, p<0.01), особенно у беременных женщин (R.R. 0.321, 95 % ДИ 0.194 ÷ 0.530, p < 0.01).
Таблица 6. Распределение побочных реакций у 1264 взрослых пациентов, проходивших анализ переносимости препарата (Исследования 1 и 2).
ITF 282 Железа сульфат Относительный риск 95% доверительный интервал P (n = 634) (n = 630) Кол-во % Кол-во % Пациенты с побочными реакциями Всего 71 11.2 136 21.6 0.519 0.398 ÷ 0.676 <0.0l Мужчины 10 15.4 9 15.5 0.991 0.433 ÷ 2.269 n.s. Женщины 61 10.7 127 22.7 0.483 0.364 ÷ 0.640 <0.01 Диагноз Дефицит железа 3 7.0 8 18.6 0.375 0.107÷ 1.319 n.s. Выраженная анемия 68 11.5 128 2i!s 0.528 0.402 ÷ 0.692 Беременность Да 18 8.2 51 25.6 0.321 0.194 ÷ 0.530 < 0.01 Нет 53 12.8 85 19.7 0.648 0.472 ÷ 0.888 < 0.01 Лактация Да 6 10.3 15 21.4 0.483 0.200÷ 1.164 n.s. Нет 65 11.3 121 21.6 0.522 0.395 ÷ 0.690 < 0.01 Хирургическое вмешательство Да 43 14.1 63 21.1 0 667 0.468 ÷ 0.950 < 0.05 Нет 28 8.5 73 22.1 0.387 0.257 ÷ 0.582 < 0.01 Госпитализация Да 39 10.4 83 23.1 0.449 0.316 ÷ 0.638 < 0.01 Нет 32 12.4 53 19.6 0.634 0.423 ÷ 0.950 < 0.05 Сопутствующие заболевания Да 12 14.1 19 17.6 0.802 0.413 ÷ 1.560 n.s. Нет 29 10.7 117 22.4 0.479 0.359 ÷ 0.640 <0.01 Сопутствующее лечение Да 15 13.4 24 17.3 0.776 0.428 ÷ 1.407 n.s. Нет 56 10.7 112 22.8 0.470 0.350 ÷ 0.632 <0.01 У детей (Таблица 7) сравнение частоты встречаемости побочных реакций в двух терапевтических группах говорит в пользу препарата ITF 282 (R.R. 0.291, 95% ДИ 0.160 ÷ 0.527, p < 0.01). Анализ переносимости в каждой подгруппе пациентов выявил данные по частоте встречаемости побочных реакций, говорящих о преимуществе препарата ITF 282. Тем не менее, полученные данные не настолько значимы с клинической точки зрения, так как количество пациентов в подгруппах было недостаточным для того, чтобы провести достоверную клиническую оценку или сделать окончательное заключение.
Таблица 7: Распределение побочных реакций у 502 проходивших анализ переносимости препарата (Исследование 3).
ITF 282 Железа сульфат Относительный риск 95% доверительный интервал P (n = 256) (n = 246) Кол-во % Кол-во % Пациенты с побочными реакциями Всего 13 5.1 43 17.5 0.291 0.160 ÷ 0.527 <0.01 Мальчики 5 3.2 25 17.4 0.225 0.089 ÷ 0.570 <0.01 Девочки 8 6.2 18 17.6 0.354 0.161 ÷0.781 <0.01 Диагноз Дефицит железа 3 20 16 18.2 0.174 0.052 ÷ 0 576 <0.01 Выраженная анемия 10 4.1 27 17.1 0.363 0.182 ÷ 0.726 <0.01 Госпитализация Да 3 6.8 5 29.4 0.680 0.194 ÷ 2.377 n.s. Нет 10 4.6 38 16.6 0.250 0.128 ÷ 0.490 <0.01 Сопутствующие заболевания Да 4 18.8 9 14.5 0.467 0.152 ÷ 1.435 n.s. Нет 9 4.5 34 18.5 0.247 0.122 ÷ 0.501 <0.01 Сопутствующее лечение Да 3 4.7 3 8.3 1.059 0.229 ÷ 4.891 n.s. Нет 10 7.1 40 19.0 0.236 0.121 ÷0.461 <0.01 Режим приема препарата Один раз в стуки 10 3.9 37 18.3 0.255 0.130 ÷ 0.499 <0.01 Два раза в сутки 3 6.2 6 13.6 0.524 0.140÷ 1.961 <0.01
В ходе 3 исследований эффективность и переносимость двух схем лечения оценивались в конце лечебного периода исследователями, которые давали свою субъективную оценку результатов лечения.
Когда эти оценки производятся исследователями в «слепых» условиях, тогда их можно рассматривать как данные, достоверно показывающие клиническую эффективность и переносимость двух схем лечения железосодержащими препаратами. Был показан положительный терапевтический эффект в плане эффективности и переносимости препарата ITF 282, с полностью положительным доверительным интервалом для объединенных исследований (Таблица 8 и Рис. 4; Таблица 9 и Рис. 5) (Таблицы 8 и 9).
Таблица 8. Мета-анализ окончательной оценки эффективности исследователем.
Исследование Эффективность Эффект S.D. 95% доверительный интервал ITF 282 Др. препарат Хор Неуд Хор Неуд 1 449 100 388 151 0.5581 0.1464 0.2712 ÷ 0.845 2 79 2 70 11 1.826 0.786 0.2851 ÷ 3.366 3 210 46 187 59 0.3649 0.2209 -0.680 ÷ 0.7979 Итого 738
(83 %)148 645
(78 %)221 0.543 0.126 0.2961 ÷ 0.79 Критерий гомогенности χ2 = 3.343872 (р > 0.05)м Рис. 4: Мета-анализ окончательной оценки эффективности
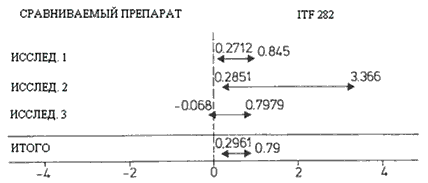
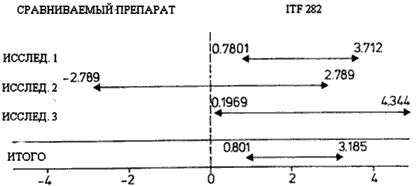
Таблица 9. Мета-анализ окончательной оценки переносимости исследователем.
Исследование Эффективность Эффект S.D. 95% доверительный интервал ITF 282 Др. препарат Хор Неуд Хор Неуд 1 547 2 521 18 2.246 0.7479 0.78021 ÷ 3.712 2 80 1 80 1 0 1.423 -2.789 ÷ 2.789 3 225 1 237 9 2.27 1.058 0.1969 ÷ 4.344 Итого 882
(99 %)4 838
(97 %)28 1.993 0.6082 0.801 ÷ 3.185 Критерий гомогенности χ2 = 2.14466 (р > 0.05) Рис. 5: Мета-анализ окончательной оценки переносимости
4. ОБСУЖДЕНИЕ
Анализ динамики повышения уровня Hb в течение первого и, соответственно, второго месяца лечения предполагает различие в механизмах действий препарата ITF 282 и других железосодержащих медикаментов.
Так как основная разница препарата ITF 282 от других медикаментов заключается в форме, в какой железо поступает в желудочно-кишечный тракт, можно предположить, что медикаменты, содержащие ионы двухвалентного железа, могут оказывать раздражающее действие на слизистую желудочно-кишечного тракта, что приводит к снижению абсорбции и повышению частоты побочных реакций.
На сегодняшний день нет данных, способных подтвердить эту гипотезу у человека; тем не менее, доклинические данные (полученные в ходе исследованиях на крысах, [4]), показывающие значительное цитотоксическое действие сульфата железа на слизистую ЖКТ (и отсутствие цитотоксичности связанного с белком железа), должны быть пересмотрены для адекватного планирования клинических исследований.
Препарат ITF 282, содержащий связанное с белком железо, не оказывает повреждающего действия на слизистую ЖКТ, что наблюдается в случае препаратов двухвалентного железа. Таким образом, это препарат не нарушает абсорбцию (что способствует повышению уровня гемоглобина) и обладает лучшей переносимостью. Проведенный мета-анализ побочных реакций показал, что препарат ITF 282 переносится больными лучше, нежели другие железосодержащие медикаменты.
Субанализ распределения побочных реакций во взрослой популяции показал, что препарат ITF 282 определенно лучше переносится беременными женщинами.
ЛИТЕРАТУРА
[1] Hillman, R. S., Hematopoietic agents: growth factors, minerals and vitamins, in: Goodman & Gilman's - The pharmacological basis of therapeutics, 8th ed., pp. 1277-1310, Pergamon Press, New York (1990)
[2] Cremonesi, P., Strada, D., Galimberti, G. et al, Arzneim.-Forsch./Drug Res. 34 (II), 948 (1984)
[3] Pagella, P. G., Bellavite, D., Agozzino, S. et al., Arzneim.-Forsch./Drug Res. 34 (II), 952 (1984)
[4] Cremonesi. P.. Cara-mazza, I., Int. J. Clin. Pharmacol. Ther. Toxicol. 31,40 (1993)
[5] Liguori, L., Int. J. Clin. Pharmacol. Ther. Toxicol. 31, 105 (1993).
[6] Najean, Y., Acuto, G., Scotti, A., Clin. Drug Inv., in press (1995)
[7] Careddu, P., Scotti, A., Int. J. Clin. Pharmacol. Ther. Toxicol. 31, 157 (1993)
[8] Armitage, P., Berry, G (cds.). Statistical Methods in Medical Research, 2nd ed., Blackwell Scientific Publication, Oxford (1987)
[9] Solvell, L., Oral iron therapy - Side Effects, in: Iron Deficiency - Patho-genesis, clinical aspects and therapy, pp. 573-583, London (1970)
| Февраль 2010 г. |