ОТКРЫТОЕ, СРАВНИТЕЛЬНОЕ, РАНДОМИЗИРОВАННОЕ ИССЛЕДОВАНИЕ ЭФФЕКТИВНОСТИ И БЕЗОПАСНОСТИ ПРЕПАРАТА «ВИТАПРОСТ®», ТАБЛЕТКИ (ОАО «НИЖФАРМ», РОССИЯ) В КОМПЛЕКСНОМ ЛЕЧЕНИИ ПАЦИЕНТОВ С ХРОНИЧЕСКИМ АБАКТЕРИАЛЬНЫМ ПРОСТАТИТОМ
МОСКВА
СПИСОК ИСПОЛНИТЕЛЕЙ
Лопаткин Н.А.
Камалов А.А.
Дорофеев С.Д.
Ефремов Е.А.Введение
Хроническим простатитом, по разным данным, страдают от 40 до 70% мужчин репродуктивного возраста. Это самое частое урологическое заболевание у мужчин до 50 лет и третье по частоте (после доброкачественной гиперплазии предстательной железы и рака простаты) у лиц старше 50 лет. У многих пожилых пациентов он отягощает течение доброкачественной гиперплазии предстательной железы, приводя к ошибкам при выборе тактики лечения. В общей популяции частота ХП составляет 5-8% (Nickel J.C., 1999). По мнению T.A.Stamey, каждый второй мужчина в определённый период жизни страдает этим заболеванием. У 7-36% пациентов ХП осложняется воспалительными заболеваниями других органов мужской половой системы, расстройствами мочеиспускания, репродуктивной и половой функций. Кроме того, ХП негативно влияет на качество жизни пациентов, которое сопоставимо с таковым при стенокардии, болезни Крона и сахарном диабете (Wenninger K. et al. 1996). Заболевание может вызывать психосоматические расстройства, часто сопровождаясь тревогой, беспокойством, неврозом и депрессией (de la Rosette J.J., 1993). Распространенность, значительные затраты на лечение ХП, а также выраженное его влияние на качество жизни пациентов свидетельствует не только о медицинской, но и социально-экономической значимости заболевания.
По определению Национального Института Здоровья США понятие «хронический простатит» включает в себя присутствие боли в области малого таза/промежности, органах мочеполовой системы в течение, по крайней мере, 3 месяцев; наличие (или отсутствие) обструктивных или ирритативных симптомов нарушения мочеиспускания; положительный (или отрицательный) результат бактериологического исследования. Согласно современным представлениям, хронический абактериальный простатит встречается в 8 - 10 раз чаще, чем инфекционный, составляющий около 10% всех случаев заболевания простатитом (Roberts R.O. et al., 1997).
Проблема диагностики и лечения ХП остаётся нерешённой до сих пор. А выбор лекарственного препарата для лечения пациентов хроническим абактериальным простатитом (воспалительным синдромом хронической тазовой боли), относящегося по классификации NIH к IIIA категории, тем более представляет значительную сложность. Это связано с неопределенностью самого понятия "хронический абактериальный простатит", проистекающей из неясности этиологии и патогенеза этого заболевания.
Для лечения хронического абактериального простатита и ВСХТБ предложено большое число препаратов разных групп. Наилучший результат при лечении ХП достигается при соблюдении принципа комплексного подхода. Он подразумевает одновременное использование несколько лекарственных препаратов и методов, действующих на разные звенья патогенеза и позволяющих добиться устранения спастических реакций мышечных элементов железы, нормализации кровообращения в органах малого таза (в т.ч. улучшения микроциркуляции в простате), адекватного дренажа простатических ацинусов, особенно в периферических зонах и нормализации иммунных реакций.
При лечении ХП применяются разнообразные лекарственные препараты растительного и животного происхождения. Один из них – «Витапрост®», производства ОАО «Нижфарм», Россия, активным веществом которого является эндогенная субстанция Сампрост - комплекс водорастворимых биологически активных пептидов, выделенных из предстательной железы ткани простаты крупного рогатого скота (Аль-Шукри, Горбачев и др., 1996).
Экстракт простаты обладает органотропным действием в отношении предстательной железы. Один из механизмов его действия основан на способности ингибировать преобразование тестостерона в дегидротестостерон в простате. Благодаря этому, происходит снижение пролиферативной активности клеток, приводящее к развитию доброкачественной гиперплазии простаты. Простаты экстракт способен также повышать содержание тестостерона в крови и чувствительность тканей к этому гормону. Как все пептидные биорегуляторы, простаты экстракт обладает антиагрегантными и антикоагулянтными свойствами, усиливает синтез антигистаминовых и антисеротониновых антител, улучшает микроциркуляцию в пораженном органе. На этом основана его способность уменьшать отек и активность воспалительных процессов при заболеваниях предстательной железы. Существенным является также наличие у простаты экстракта иммуномодулирующих свойств (Аль-Шукри, Горбачев и др., 1996).
В 2001 году в НИИ Урологии МЗ РФ по поручению Государственного Фармакологического комитета проведено открытое несравнительное исследование по изучению эффективности и безопасности препарата «Витапрост» в форме суппозиториев ректальных (доза по сампросту 50 мг) при ХП. Исследование продемонстрировало хорошую эффективность препарата при немногочисленных нежелательных явлениях. По окончании терапии у пациентов было зарегистрировано: уменьшение боли и дискомфорта, улучшение копулятивной функции, в лучшую сторону изменились показатели мочеиспускания, нормализовались параметры секрета простаты и эякулята, улучшилось качество жизни пациентов.
На основании полученных данных сделаны выводы о том, что «Витапрост» может быть применён в комплексной терапии хронического бактериального и абактериального простатита у пациентов всех возрастных групп, в том числе в сочетании с доброкачественной гиперплазией простаты, а также для реабилитации пациентов, перенесших острое воспаление предстательной железы.
На сегодняшний день компанией «Нижфарм» разработана таблетированная форма препарата «Витапрост®». Препарат «Витапрост®», таблетки кишечнорастворимые, позволяет врачу и пациенту варьировать режим дозирования препарата, осуществляя патогенетическую терапию заболеваний предстательной железы и функционально связанных с ней органов. Препарат «Витапрост®», таблетки, показан при различных заболеваниях и патологических состояниях мужской урогенитальной сферы.
Вид исследования
В ФГУ «НИИ Урологии Росздрава» по поручению Государственного Фармакологического комитета в 2005 году проведено открытое сравнительное рандомизированное исследование эффективности и безопасности препарата «Витапрост®», таблетки (ОАО «Нижфарм», Россия) в комплексном лечении пациентов с хроническим абактериальным простатитом.
Препарат «Витапрост®» представляет собой таблетки, покрытые кишечнорастворимой оболочкой. Одна таблетка содержит: в качестве активного вещества простаты экстракт (Сампрост субстанция) – 0,1 г и вспомогательные вещества (сахар (сахарозу), сахар молочный (лактозу), кальция стеарат, кросповидон, целлюлозу микрокристаллическую) – до получения ядра массой 0,25 г. Кишечнорастворимая оболочка - не более 10 % от средней массы ядра.
Для проведения исследования приказом директора «НИИ Урологии Росздрава» Н.А. Лопаткина назначены следующие лица:
1. Лопаткин Н.А.- директор института – научный координатор исследования;
2. Камалов А.А.- заведующий отделом андрологии – ответственный исполнитель;
3. Дорофеев С.Д.- старший научный сотрудник отдела андрологии – исполнитель;
4. Ефремов Е.А.- научный сотрудник отдела андрологии – исполнитель;
Целями данного исследования являлись: оценка эффективности и безопасности лекарственного препарата «Витапрост®», таблетки, в комплексной терапии пациентов с хроническим абактериальным простатитом.
Эффективность оценивалась на основании уменьшения степени выраженности болевого синдрома (измеряемого в соответствии с унифицированной шкалой индекса симптомов ХП [NIH-CPSI]) и воспалительного процесса на фоне комбинированной терапии («Витапрост®» + Кетонал) по сравнению с монотерапией препаратом Кетонал.
Оценка безопасности препарата «Витапрост®», таблетки, проводилась на основе анализа зарегистрированных нежелательных явлений и изменений лабораторных показателей клинического и биохимического анализа крови, и клинического анализа мочи.
Материалы и методы исследования
Критерии включения:
В исследование было включено 60 пациентов в возрасте от 21 до 57 лет (средний возраст 39,85 года), соответствовавших следующим критериям включения:
мужчины в возрасте 20-60 лет, находящиеся на амбулаторном лечении; пациенты с диагностированным хроническим абактериальным простатитом (невоспалительным синдромом хронической тазовой боли), у которых имеются: наличие боли в области малого таза/промежности, органах мочеполовой системы в течение 3 месяцев (и более) и признаки воспаления при микроскопическом исследовании секрета предстательной железы (число лейкоцитов более 10 в поле зрения); пациенты, подписавшие информированное согласие на участие в исследовании. Критерии исключения:
В исследование не включались пациенты, которые на момент визита 1:
нуждались в оперативном вмешательстве или применении любого другого вида лечения ХП (помимо оговоренного ниже) с целью предотвращения прогрессирования заболевания и нанесения вреда здоровью пациента; пациенты, у которых было зарегистрировано 10-и и более кратное увеличение количества патогенных бактерий и/или грибов в постмассажной порции мочи в сравнении с предмассажной и/или выявлены патогенные бактерии в постмассажной моче при стерильной предмассажной. имели диагностированные заболевания МПС (почек, мочевого пузыря, простаты, уретры и другие), которые могут быть причиной наличия болевого синдрома и симптомов воспаления, характерных для ХП: хламидиоз, уреаплазмоз, микоплазмоз, манифестные проявления генитального герпеса, камни мочевого пузыря и выраженные кальцинаты ПЖ, воспалительные заболевания мочевыводящих путей, доброкачественные и злокачественные опухоли мочевого пузыря, простаты и соседних органов (в том числе ДГПЖ), склероз шейки мочевого пузыря, стриктуру уретры, нейрогенный мочевой пузырь и другие; имели выраженные нарушения функции печени и/или почек; не были способны адекватно отвечать на вопросы исследователя, заполнять необходимые документы и принимать исследуемый препарат; участвовали в каком-либо другом исследовании. Также в исследование не включались пациенты, получавшие, менее чем за неделю до начала исследования следующие лекарственные препараты и процедуры: альфа-адреноблокаторы, спазмолитические препараты, антибиотики и уросептики, холинергические и антихолинегрические препараты, ингибиторы 5-альфа редуктазы, экстракты растительного происхождения для лечения заболеваний простаты, массаж простаты, инстилляции в уретру, эндоуретральные манипуляции (уретроскопию, цистоскопию) и физиотерапевтическое воздействие на простату, включая термальные методы.
1. Основная группа в качестве терапии ХП получала препараты: «Витапрост®», таблетки по 100 мг 2 раза в сутки и Кетонал (кетопрофен), суппозитории ректальные по 100 мг 1 раз в сутки;
2. Контрольная группа в качестве терапии ХП получала препарат Кетонал (кетопрофен), суппозитории ректальные по 100 мг 1 раз в сутки.
Основные демографические данные пациентов, включенных в исследование, представлены в таблице 1.
Таблица 1. Данные пациентов обеих групп
Основная группа
Контрольная группа
Возраст
21 - 59 лет
(в среднем 40,67)
21 - 57 лет
(в среднем 39,03)
Давность заболевания
3 мес. - 15 лет
(в среднем 3 года 4 мес.)
3 мес. - 11 лет
(в среднем 2 года 9 мес.)
Из первой группы 13 человек имели сопутствующие заболевания, в том числе язвенную болезнь двенадцатиперстной кишки, мочекаменную болезнь, бронхиальную астму, хронический гепатит, хронический пиелонефрит. 8 пациентов из второй группы имели сопутствующие заболевания: язвенную болезнь двенадцатиперстной кишки, ишемическую болезнь сердца, недостаточность кровообращения, гипертоническую болезнь 2 степени.
Большинство пациентов обеих групп ранее уже прибегали к лечению ХП. В первой группе лекарственная терапия проводилась 18 пациентам, другие виды лечения – 12 (в т.ч. массаж простаты – 11 человек, лазеротерапия – 3, СВЧ-гипертермия – 1, трансректальная микроволновая гипертермия – 1). Во 2 группе у 16 человек в анамнезе – медикаментозная терапия, у 16 – немедикаментозная (массаж простаты – 13, лазеротерапия – 4, магнитотерапия – 1, трансректальная микроволновая гипертермия – 1).
Во время визита «1» исследователь получал письменное согласие на участие пациента в исследовании, проводился сбор анамнеза и физикальный осмотр пациента, проводилась регистрация: сопутствующих заболеваний и применяемых пациентом лекарственных препаратов, предшествующего медикаментозного и немедикаментозного лечения хронического простатита, регистрация исходной симптоматики хронического простатита с использованием шкалы симптомов NIH-CPSI, проводилось пальцевое ректальное и трансректальное ультразвуковое исследование предстательной железы, после чего оценивалось соответствие пациента критериям включения/исключения. Также производился забор анализов:
клинический анализ крови; биохимический анализ крови; общий анализ мочи; исследование мазка из уретры на наличие ИППП методом ПЦР; микроскопическое исследование секрета предстательной железы; микроскопическое и бактериологическое исследования пред- и постмассажных порций мочи и секрета простаты. Полученные данные заносились в ИРК (страницы визита 1).
Визит «2» проводился на 8-й день от начала исследования, допустимое отклонение составляло ±3 дня. В ходе визита проводился физикальный осмотр пациента, на основании полученных лабораторных данных повторно проверялись критерии включения/исключения пациента и регистрировались нежелательные явления, возникшие во время проведения исследования. После этого пациент включался в исследование с присвоением пациенту рандомизационного кода и ему выдавался препарат(ы) в соответствии с группой рандомизации и с указанием схемы применения. Данные, касающиеся визита «2», заносились в соответствующие страницы ИРК.
Визит «3» проводился на 13-й день от начала исследования, с допустимым отклонением ±1 день. В ходе визита исследователь проводил физикальный осмотр пациента, регистрировал нежелательные явления, возникшие во время проведения исследования и заполнял ИРК (страницы визита «3»).
В ходе визита «4», сразу после окончания приема препарата, соответствующего группе рандомизации (18-й день от начала исследования, допустимое отклонение ±1 день), исследователь проводил физикальный осмотр пациента, регистрацию симптоматики хронического простатита с использованием шкалы симптомов NIH-CPSI, регистрацию нежелательных явлений, возникших во время проведения исследования, пальцевое ректальное и трансректальное ультразвуковое исследование предстательной железы. Также производился забор анализов:
клинический анализ крови; биохимический анализ крови; общий анализ мочи; микроскопическое исследование секрета предстательной железы.
В заключение визита проводилась оценка эффективности терапии пациентом и врачом. Полученные данные заносились в ИРК (страницы визита «4»).Визит «5», проводился на 25-й день от начала исследования (допустимое отклонение составляло ±1 день) (через 7 дней после окончания терапии). Исследователь проводил физикальный осмотр пациента, регистрацию симптоматики хронического простатита с использованием шкалы симптомов NIH-CPSI, регистрацию нежелательных явлений, возникших во время проведения исследования, пальцевое ректальное и трансректальное ультразвуковое исследование предстательной железы. Проводилось лабораторное исследование:
клинический анализ крови; биохимический анализ крови; общий анализ мочи; микроскопическое исследование секрета предстательной железы.
В заключение визита проводилась оценка эффективности терапии пациентом и врачом. Полученные данные заносились в соответствующие страницы ИРК.В ходе исследования у пациента оценивались следующие показатели (параметры эффективности):
I. Степень выраженности воспалительного процесса - на основании данных, полученных:
1. В результате трансректального УЗИ простаты;
2. Пальцевого ректального исследования;
3. Микроскопического исследования СПЖII. Степень выраженности симптомов хронического простатита - на основании регистрации симптомов хронического простатита по баллам с использованием шкалы симптомов хронического простатита NIH-CPSI.
Критериями оценки эффективности являлись: выраженный эффект, хороший эффект, удовлетворительный эффект и неудовлетворительный эффект.
1. Под выраженным эффектом понималось уменьшение количества баллов по шкале NIH-CPSI на 50 и более % и/или уменьшение количества лейкоцитов при микроскопическом исследовании СПЖ на 50% и более.
2. Хороший эффект подразумевал уменьшение количества баллов по шкале NIH-CPSI от 25 до 49% и/или уменьшение количества лейкоцитов при микроскопическом исследовании СПЖ от 25 до 49%.
3. Эффект оценивался как удовлетворительный при уменьшении количества баллов по шкале NIH-CPSI менее чем на 25% и/или уменьшении количества лейкоцитов при микроскопическом исследовании СПЖ.
4. Эффект оценивался как неудовлетворительный – в случае отсутствия положительной динамики состояния пациента или ухудшения состояния пациента.Для оценки безопасности препарата «Витапрост®», таблетки, пациентам проводили общий и биохимический анализ крови, общий анализ мочи, регистрировали нежелательные явления в ходе исследования.
Негативные изменения в общем состоянии пациента, возникновение новых жалоб, патологические отклонения лабораторных показателей (клинического и биохимического исследования крови и клинического исследования мочи) в ходе исследования фиксировались как нежелательные явления. Выявлялась взаимосвязь между нежелательными явлениями и терапией препаратом «Витапрост®», определялась степень тяжести нежелательных явлений (слабая, умеренная, тяжелая), их продолжительность и серьезность.
Критерии прерывания исследования
Пациент мог быть досрочно исключён из исследования по следующим причинам:
возникновение серьезных побочных эффектов (потребовавших госпитализации или приведших к временной потере трудоспособности); нарушение протокола пациентом или исследователем; по усмотрению исследователя, если тот считает, что продолжение исследования наносит вред здоровью пациента; по желанию самого пациента. Результаты исследования
Результаты лабораторных методов обследования:
Секрет предстательной железы.
Наиболее информативным показателем степени выраженности воспалительного процесса является количество лейкоцитов в поле зрения при микроскопическом исследовании секрета предстательной железы. Согласно протоколу в исследование были включены пациенты с уровнем лейкоцитов более 10 в поле зрения. Динамика количества лейкоцитов в исследуемых группах представлена в таблицах 2,3.
Таблица 2. Динамика количества лейкоцитов в секрете простаты
Количество пациентов
Количество лейкоцитов в секрете простаты
(в поле зрения)
Основная группа
(количество пациентов (N*))
Контрольная группа
(количество пациентов (N*))
До лечения
Визит 4
Визит 5
До лечения
Визит 4
Визит 5
0 - 5
0
3
(10%)
5
(16,67%)
0
1
(3,33%)
3
(10%)
6 – 10
0
14
(46,67%)
12
(40%)
0
12
(40%)
6
(20%)
11 – 20
25
(83,33%)
10
(33,33%)
10
(33,33%)
22
(73,33%)
12
(40%)
16
(53,33%)
21 – 30
3
(10%)
2
(6,67%)
2
(6,67%)
4
(13,33%)
2
(6,67%)
3
(10%)
Больше 30
2
(6,67%)
1
(3,33%)
1
(3,33%)
4
(13,33%)
3
(10%)
2
(6,67%)
N* – количество пациентовЕсли до начала лечения обе группы были сравнимы по содержанию лейкоцитов в секрете простаты, то по окончании терапии (на 4 визите) в основной группе у 3 (10%) пациентов отмечалось уменьшение количества лейкоцитов в поле зрения до единичных, что расценивается как норма, в то время, как в группе сравнения по окончании лечения единичные лейкоциты в поле зрения отмечены только у 1 (3,33%) пациента.
Итого, в основной группе по окончании исследования (на 5 визите) у 17 (56,67%) пациентов отмечалось снижение лейкоцитов в секрете простаты до показателя менее 10 в поле зрения, что свидетельствует о значительном уменьшении воспалительного процесса, в то время, как в контрольной группе по окончании исследования только у 9 (30%) пациентов отмечалось снижение лейкоцитов в секрете простаты до показателя менее 10 в поле зрения.
Таблица 3. Динамика средних значений количества лейкоцитов в секрете простаты
Основная группа
Контрольная группа
До лечения
Визит 4
Визит 5
До лечения
Визит 4
Визит 5
Минимальное и максимальные значения
11 - 45
3 - 40
5 - 60
11-50
3-55
3-60
Среднее арифметическое со стандартным отклонением
17,1 ±
8,00
12,67 ±
7,54
12,7 ±
10,30
18,13 ±
9,43
15,73 ±
11,41
16,07 ±
12,1
p
р=0,019
р=0,854*
р=0,378
р=0,911*
* - недостоверные измененияАнализируя таблицу 3, можно отметить, что сразу по окончании терапии (4 визит) в группе «Витапрост®, таблетки + Кетонал, суппозитории ректальные» произошло снижение средних значений количества лейкоцитов на 4,43, причем на 5 визите среднее значение количества лейкоцитов осталось неизменным, что может свидетельствовать о стабильности результата противовоспалительной терапии, в то время как в группе «Кетонал, суппозитории ректальные» по окончании лечения, уменьшение среднего значения количества лейкоцитов составило 2,4, причем через 10 дней после окончания терапии зарегистрировано некоторое увеличение лейкоцитов в секрете простаты, что может свидетельствовать о наличии тенденции к увеличению количества лейкоцитов в секрете предстательной железы.
Несмотря на то, что, согласно протоколу, в исследование не включались пациенты, имеющие 10-и и более кратное увеличение количества патогенных микроорганизмов в постмассажной порции мочи в сравнении с предмассажной и/или у которых были выявлены патогенные бактерии в постмассажной моче при стерильной предмассажной, у большинства пациентов обеих групп при исследовании секрета простаты всё же обнаруживались микроорганизмы в клинически незначимом количестве (таблица 4).
Таблица 4. Динамика выявления непатогенной микрофлоры в секрете простаты.
Основная группа
Контрольная группа
До лечения
Визит 4
Визит 5
До лечения
Визит 4
Визит 5
Количество пациентов с выявленной непатогенной микрофлорой
22
(73,33%)
14
(46,67%)
11
(36,67%)
25
(83,33%)
16
(53,33%)
16
(53,33%)
В результате лечения по окончании исследования (на 5 визите) в группе «Витапрост® + Кетонал» количество пациентов с выявленной микрофлорой в СПЖ уменьшилось на 11 человек (36,67%), в то время, как в контрольной группе – количество пациентов с выявленной микрофлорой уменьшилось на 9 (30%) человек. Лучшие показатели группы «Витапрост® + Кетонал» свидетельствуют о наличии противовоспалительного действия препарата Витапрост®, таблетки и улучшении им местного иммунитета.
Таблица 5. Динамика количества липоидных телец в секрете простаты
Количество пациентов
Количество липоидных телец в секрете простаты
Основная группа
(N)
Контрольная группа
(N)
До лечения
Визит 4
Визит 5
До лечения
Визит 4
Визит 5
Мало
(в поле зрения)
16
(53,33%)
2
(6,67%)
1
(3,33%)
12
(40%)
2
(6,67%)
12
(40%)
Умеренно
(в поле зрения)
12
(40%)
19
(63,33%)
16
(53,33%)
17
(56,67%)
21
(70%)
17
(56,67%)
Много
(в поле зрения)
2
(6,67%)
9
(30%)
13
(43,33%)
1
(3,33%)
7
(23,33%)
1
(3,33%)
Липоидные тельца (лецитиновые зерна) – это продукт жизнедеятельности железистых структур простаты. При нормальном состоянии предстательной железы лецитиновые зерна густо покрывают все поле зрения: в 1 мл секрета здоровых мужчин в возрасте до 40 лет содержится 5-10 млн. зерен и более. Продукция и содержание липоидных телец в секрете предстательной железы свидетельствуют о ее нормальном функционировании, а их уменьшение - об ингибиции нормальных функций простаты. Липоидные тельца являются индикатором функционального состояния предстательной железы, также имеют важное значение как фактор противомикробной защиты.
В ходе исследования выявлено закономерное повышение количества липоидных телец в секрете простаты на фоне проведенного лечения. При этом количество пациентов с умеренным (6-10 в поле зрения) и большим содержанием (>10 в поле зрения) липоидных телец последовательно увеличивается от 1 визита к 4 и 5. В основной группе 13 (43,33%) пациентов к 5 визиту имели большое содержание (>10 в поле зрения) липоидных телец, тогда как на 1 визите данный показатель был только у 2 (6,67%) пациентов. В группе сравнения количество пациентов, которые имели большое содержание (>10 в поле зрения) липоидных телец не изменилось от 1 к 5 визиту и составило 1 (3,33%) пациент. Полученные данные свидетельствуют об улучшении секреторной функции предстательной железы, более выраженной в основной группе (что связано с приемом препарата Витапрост®, таблетки) по сравнению с контрольной (таблица 5).
Общий анализ мочи.
Выявлено достоверное снижение выраженности лейкоцитурии. Так, в ходе исследования средние значения в основной группе уменьшились с 5,3 до 3,97 (разность составляет 1,57) лейкоцитов в поле зрения, в контрольной группе соответственно с 4,6 до 3,5 (разность составляет 0,6). Таким образом, в основной группе (Витапрост®, таблетки + Кетонал, суппозитории ректальные) произошло выраженное достоверное снижение количества лейкоцитов в моче по сравнению с контрольной группой (Кетонал, суппозитории ректальные), что свидетельствует о большей выраженности противовоспалительного эффекта комбинированной терапии с применением препарата Витапрост®, таблетки.
Проведенное исследование выявило отсутствие достоверного влияния на концентрацию белка в моче и на показатель кислотности (рН) у пациентов в обеих группах. При микроскопии осадка мочи выявлена тенденция к снижению количества бактерий: в основной группе средние показатели снизились с 0,31 до 0, в контрольной группе с 0,2 до 0 (бактерии в поле зрения).
Показатели клинических анализов крови (содержание гемоглобина, эритроцитов, лейкоцитов, тромбоцитов, Скорости Оседания Эритроцитов), биохимического анализа крови (АСТ, АЛТ, мочевины, креатинина, глюкозы, общего белка и билирубина) у пациентов обеих сравниваемых групп в данном исследовании не выходили за границы физиологической нормы, поэтому статистически достоверные колебания данных параметров клинического значения не имеют.
Результаты трансректального ультразвукового исследования простаты и семенных пузырьков:
При анализе данных трансректального ультразвукового исследования предстательной железы выявлено отсутствие статистически достоверных изменений объёма простаты и поперечного размера семенных пузырьков в обеих группах (таблица 6).
Таблица 6. Динамика объёма простаты и поперечных размеров семенных пузырьков по данным ТРУЗИ
Основная группа
Контрольная группа
До лечения
Визит 4
Визит 5
До лечения
Визит 4
Визит 5
Средний объём простаты (см3)
18,73
18,41
p=0,721*
18,08
p=0,704*
20,94
20,91
p=0,98*
20,10
p=0,607*
Средний
поперечный
размер
семенных
пузырьков
правого
(мм)
11,19
11,09
p=0,778*
10,81
p=0,353
11,17
11,13
p=0,936*
11,06
p=0,875*
левого
(мм)
11,43
11,23
p=0,698*
11,11
p=0,786*
11,12
11,16
p=0,948*
11,05
p=0,833*
* - недостоверное значение.Результаты анкетирования пациентов по шкале NIH-CPSI:
Одним из первичных переменных при статистическом анализе данных исследования являлась субъективная оценка степени выраженности симптомов хронического простатита. Результаты проведенного анкетирования приведены в таблицах 7,8.
Таблица 7. Динамика суммарного балла по шкале NIH-CPSI
Количество пациентов
Количество баллов
Основная группа
(N)
Контрольная группа
(N)
До лечения
Визит 4
Визит 5
До лечения
Визит 4
Визит 5
0 – 10
2
(6,67%)
10
(33,33%)
14
(46,67%)
1
(3,33%)
4
(13,33%)
4
(13,33%)
11 – 20
23
(76,67%)
18
(60%)
15
(50%)
24
(80%)
24
(80%)
23
(76,67%)
21 - 30
3
(10%)
1
(3,33%)
1
(3,33%)
4
(13,33%)
2
(6,67%)
3
(10%)
31 - 43
2
(6,67%)
1
(3,33%)
0
1
(3,33%)
0
0
Если до лечения 2 сравниваемые группы были сопоставимы по шкале NIH-CPSI, то по окончании исследования (на 5 визите) в группе «Витапрост®, таблетки + Кетонал, суппозитории ректальные» у 14 (46,67%) пациентов – выраженность симптомов составила от 0-10 баллов, в то время как в контрольной группе только у 4 (13,33%) пациентов выраженность симптомов составила от 0-10 баллов.
Таблица 8. Динамика средних значений суммарного балла по шкале NIH-CPSI
Основная группа
Контрольная группа
До лечения
Визит 4
Визит 5
До лечения
Визит 4
Визит 5
Минимальное и максимальные значения
10-41
8-32
1-29
10-32
10-25
10-28
Среднее арифметическое со стандартным отклонением
17,13 ±
6,25
13,1 ±
5,05
11,17 ±
4,78
16,5 ±
4,79
14,57 ±
3,96
13,97 ±
4,12
p
p=0,08
p=0,134
p=0,094
p=0,567*
* - недостоверное значение.Таким образом, одним из основных параметров эффективности проводимой терапии явилась оценка снижения суммарного балла по шкале NIH-CPSI. Приведенные данные свидетельствуют о достоверном уменьшении выраженности симптомов хронического простатита в основной и контрольной группах сразу после 10-дневного курса лечения. При этом наиболее выраженное снижение интенсивности симптомов ХП зарегистрировано в группе, получавшей комплексное лечение (Витапрост® + Кетонал), причем, по окончании терапии в группе (Витапрост® + Кетонал) зарегистрировано дальнейшее достоверное снижение суммарного балла, которое составило в итоге 13,1±5,05 на 4-ом визите и 11,17±4,78 на 5-ом визите. Подобной достоверной зависимости в контрольной группе не получено (р=0,567). Это может свидетельствовать о терапевтическом последействии препарата Витапрост®, таблетки (терапевтическое действие которого продолжается с прекращением курса лечения некоторое время), позволяющем наблюдать стойкое снижение выраженности симптомов хронического простатита в сроки последующего наблюдения, сравнимом с продолжительностью курса лечения.
Выраженность болевого синдрома по шкале NIH-CPSI представлена в таблицах 9, 10.
Таблица 9. Динамика выраженности болевого синдрома по шкале NIH-CPSI
Количество пациентов
Количество баллов
Основная группа
(N)
Контрольная группа
(N)
До лечения
Визит 4
Визит 5
До лечения
Визит 4
Визит 5
0 – 5
4
(13,33%)
20
(66,67%)
26
(86,67%)
7
(23,33%)
11
(36,66%)
17
(56,66%)
6 – 10
23
(76,67%)
8
(26,67%)
2
(6,67%)
21
(70%)
19
(63,33%)
13
(43,33%)
11 – 21
3
(10%)
2
(6,67%)
2
(6,67%)
2
(6,67%)
0
0
Сразу по окончании лечения (к 4 визиту) выраженность болевого синдрома в группе (Витапрост® + Кетонал) от 0-5 баллов по шкале NIH-CPSI была зарегистрирована у 20 (66,67%) человек, к 5 визиту (через 1 неделю после окончания лечения) количество пациентов с выраженностью болевого синдрома от 0 до 5 баллов составило 26 пациентов (86,67%), таблица 9, диаграмма 7. Среди пациентов группы сравнения, по окончании лечения (к 4 визиту) выраженность болевого синдрома составила от 0-5 баллов по шкале NIH-CPSI только у 11 (36,66%) человек, по окончании наблюдения (5 визит) количество пациентов с выраженность болевого синдрома от 0-5 баллов увеличилась еще на 6 человек, и составило 17 (56,66%) пациентов, таблица 9. Лучшие показатели группы «Витапрост®, таблетки + Кетонал, суппозитории ректальные» свидетельствуют о значительном уменьшении выраженности воспаления в этой группе, что привело к значительному уменьшению степени выраженности болевого синдрома у пациентов основной группы по сравнению с контрольной.
Таблица 10. Динамика средних значений выраженности болевого синдрома по шкале NIH-CPSI
Основная группа
Контрольная группа
До лечения
Визит 4
Визит 5
До лечения
Визит 4
Визит 5
Минимальное и максимальные значения
5-19
0-15
0-13
4-11
3-9
1-8
Среднее арифметическое со стандартным отклонением
7,9 ±
3,0
5,27 ±
2,92
4,43 ±
2,73
7,0 ±
1,97
5,77 ±
1,55
5,27 ±
1,55
p
р= 0,001
р= 0,254
р= 0,009
р= 0,217
Данные проведенного анкетирования свидетельствуют о достоверном снижении выраженности болевого синдрома, характерного для хронического простатита в обеих исследуемых группах. При этом отмечается большее уменьшение выраженности боли в основной группе, причем данная закономерность прослеживается и к завершению исследования (5 визит). Динамика (разница) среднего значения степени выраженности болевого синдрома по шкале NIH-CPSI до и после наблюдения в основной группе составила 3,47 балла, в то время как в контрольной группе – 1,73.
Выраженность ирритативных расстройств мочеиспускания представлены ниже (таблицы 11, 12).
Таблица 11. Динамика выраженности нарушений мочеиспускания по шкале NIH-CPSI
Количество пациентов
Количество баллов
Основная группа
(N)
Контрольная группа
(N)
До лечения
Визит 4
Визит 5
До лечения
Визит 4
Визит 5
0 – 5
28
(93,33%)
27
(90%)
29
(96,66%)
25
(83,33%)
28
(93,33%)
29
(96,66%)
6 – 10
2
(6,67%)
3
(10%)
1
(3,33%)
5
(16,66%)
2
(6,67%)
1
(3,33%)
Анализ полученных данных позволил отметить отсутствие достоверного влияния проведенного лечения на качество мочеиспускания у пациентов как основной, так и контрольной группы, так как превалирующими жалобами у данного контингента пациентов были: наличие боли в области таза и наружных половых органов, чувство дискомфорта в вышеуказанных областях, а также снижение качества жизни пациентов. Жалобы на затруднение или учащение мочеиспускания в описываемых группах были вторичными и встречались относительно редко.
Таблица 12. Динамика средних значений выраженности нарушений мочеиспускания по шкале NIH-CPSI
Основная группа
Контрольная группа
До лечения
Визит 4
Визит 5
До лечения
Визит 4
Визит 5
Минимальное и максимальные значения
0-10
0-7
0-6
0-9
0-8
0-8
Среднее арифметическое со стандартным отклонением
1,47±
2,43
1,23 ±
1,98
0,97±
1,54
2,07 ±
2,73
1,8±
2,22
1,67±
2,02
p
р= 0,676*
р= 0,572*
р= 0,676*
р= 0,813*
* - недостоверное значение.При анализе данных средних значений выраженности нарушений мочеиспускания по шкале NIH-CPSI выявлено отсутствие статистически достоверных изменений в обеих группах (таблица 12).
Оценка пациентом своего состояния по шкале NIH-CPSI представлена в таблицах 13,14.
Таблица 13. Динамика оценки пациентом своего состояния по шкале NIH-CPSI
Количество пациентов
Количество баллов
Основная группа
(N)
Контрольная группа
(N)
До лечения
Визит 4
Визит 5
До лечения
Визит 4
Визит 5
0 – 6
9
(30%)
15
(50%)
19
(63,33%)
8
(26,66%)
12
(40%)
13
(43,33%)
7 - 12
21
(70%)
15
(50%)
11
(36,67%)
22
(73,33%)
18
(60%)
17
(56,66%)
По окончании лечения (4 визит) в группе«Витапрост®, таблетки + Кетонал, суппозитории ректальные» 15 (50%) пациентов оценили свое состояния по шкале NIH-CPSI от 0-6 баллов, к окончанию наблюдения (5 визит), количество пациентов, оценивающих свое состояние от 0-6 баллов, увеличился на 4 человека, и составило 19 (63,33%) пациентов, таблица 13. У пациентов улучшилось качество жизни: стали реже встречаться нервно-психические расстройства, уменьшилась общая утомляемость, улучшился сон. Среди пациентов группы сравнения, к 4 визиту только 12 (40%) пациентов оценили свое состояния по шкале NIH-CPSI от 0-6 баллов, к 5 визиту данная группа пациентов увеличилась только на 1 пациента и составила 13 пациентов (43,33%), таблица 13. Лучшая оценка комбинированной терапии пациентами основной группы подтверждает наличие выраженного противовоспалительного эффекта препарата Витапост®, таблетки, что выражается в значительном уменьшении степени выраженности боли, улучшении функции ПЖ, и в итоге качества жизни пациентов.
Таблица 14. Динамика средних значений оценки пациентом своего состояния по шкале NIH-CPSI
Основная группа
Контрольная группа
До лечения
Визит 4
Визит 5
До лечения
Визит 4
Визит 5
Минимальное и максимальные значения
4-12
4-11
1-10
5-11
4-11
4-12
Среднее арифметическое со стандартным отклонением
7,63±
1,92
6,77±
1,48
5,8±
1,81
7,4±
1,71
7,0±
1,68
7,03±
1,97
p
р= 0,057
р= 0,027
р= 0,365
р= 0,950*
* - недостоверное значение.Сумма баллов, полученная при ответе на вопросы анкеты NIH-CPSI № 7,8,9, отражает оценку пациентом своего состояния и характеризует качество жизни. Выявлена достоверная закономерность улучшения параметров качества жизни у наблюдаемых пациентов основной группы, как на фоне лечения, так и после окончания терапии (в период наблюдения до 28 дня). Так средние значения этой суммы баллов (7,63±1,92 на первом визите) уменьшались до 6,77±1,48 к 4 визиту и до 5,8±1,81 к 5 визиту. В контрольной группе зарегистрировано достоверное снижение суммы баллов только во время проведения терапии (Таблица 14).
Оценка эффективности терапии со стороны пациента и врача представлена в таблице 15.
Таблица 15. Оценка эффективности терапии пациентом и врачом
Количество пациентов
Оценка эффективности
терапии
Основная группа
Контрольная группа
Визит 4
Визит 5
Визит 4
Визит 5
Врач
Паци-ент
Врач
Пациент
Врач
Пациент
Врач
Пациент
Выраженный эффект
7
(23,33%)
1
(3,33%)
11
(36,67%)
3
(10%)
3
(10%)
0
4
(13,33%)
0
Хороший эффект
14
(46,66%)
18
(60%)
15
(50%)
22
(73,33%)
7
(23,33%)
8
(26,66%)
7
(23,33%)
6
(20%)
Удовлетворительный эффект
9
(30%)
7
(23,33%)
4
(13,33%)
3
(10%)
17
(56,67%)
17
(56,66%)
15
(50%)
18
(60%)
Неудовлетворительный эффект
0
4
(13,33%)
0
2
(6,67%)
3
(10%)
5
(16,66%)
4
(13,33%)
6
(20%)
Оценка эффективности терапии врачом производилась на 4 и 5 визитах:
Сразу после лечения (4 визит), эффект от проводимой терапии был оценен врачом в основной группе
«Витапрост®, таблетки + Кетонал, суппозитории ректальные», как:выраженный – у 7 (23,33%) пациентов; хороший - у 14 (46,66%) пациентов; удовлетворительный – у 9 (30%) пациентов; неудовлетворительный – не отмечался. В контрольной группе «Кетонал, суппозитории ректальные», эффект от проводимой терапии был оценен врачом, как:
выраженный – у 3 (10%) пациентов; хороший - у 7 (23,33%) пациентов; удовлетворительный – у 17 (56,67%) пациентов; неудовлетворительный – у 3 (10%) пациентов. Через 1 неделю после окончания терапии (5 визит), эффект от проводимой терапии был оценен врачом в основной группе
«Витапрост®, таблетки + Кетонал, суппозитории ректальные», как:выраженный – у 11 (36,67%) пациентов; хороший - у 15 (30%) пациентов; удовлетворительный – у 4 (13,33%) пациентов; неудовлетворительный – не отмечался. В контрольной группе «Кетонал, суппозитории ректальные», эффект от проводимой терапии был оценен врачом, как:
выраженный – у 4 (13,33%) пациентов; хороший - у 7 (23,33%) пациентов; удовлетворительный – у 15 (50%) пациентов; неудовлетворительный – у 4 (13,33%) пациентов. Оценка эффективности терапии пациентом также производилась на 4 и 5 визитах:
Сразу после лечения (4 визит) количество пациентов в группе
«Витапрост®, таблетки + Кетонал, суппозитории ректальные», оценивших эффект от терапии как:Выраженный – составило 1 (3,33%); Хороший - составило 18 (60%); Удовлетворительный – составило 7 (23,33%); Неудовлетворительный – составило 4 (13,33%). В контрольной группе
«Кетонал, суппозитории ректальные», количество пациентов, оценивших эффект от терапии, как:Выраженный – не отмечено; Хороший - составило 8 (26,66%); Удовлетворительный – составило 17 (56,66%); Неудовлетворительный – составило 5 (16,66%). Через 1 неделю после окончания терапии (5 визит), эффект от проводимой терапии был оценен пациентами в основной группе
«Витапрост®, таблетки + Кетонал, суппозитории ректальные» , как:Выраженный – у 3 (10%) пациентов; Хороший - у 22 (73,33%) пациентов; Удовлетворительный – у 3 (10%) пациентов; Неудовлетворительный – у 2 (6,67%) пациентов. В контрольной группе
«Кетонал, суппозитории ректальные» , эффект от проводимой терапии был оценен пациентами как:Выраженный – не отмечался; Хороший - у 6 (20%) пациентов; Удовлетворительный – у 18 (60%) пациентов; Неудовлетворительный – у 6 (20%) пациентов. Оценка эффективности терапии пациентом и врачом
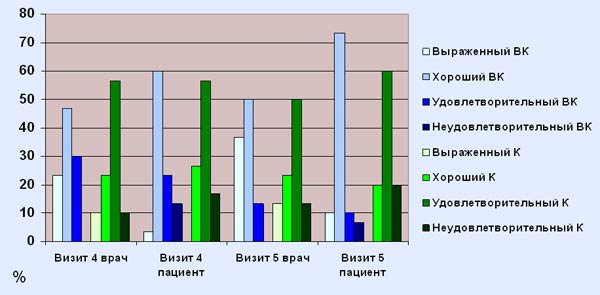
Оценка переносимости препарата
В ходе исследования нежелательных явлений у пациентов обеих групп не отмечено.
Полученные данные анализов крови и мочи свидетельствуют о безопасности препарата Витапрост®, таблетки.
Таким образом, проведённое клиническое исследование показало, что применение препарата «Витапрост®», таблетки в комплексной терапии хронического абактериального простатита (в сочетании с нестероидными противовоспалительными средствами) вызывает значительное уменьшение выраженности воспалительного процесса в предстательной железе, что проявляется уменьшением количества лейкоцитов в анализе секрета простаты, значительной редукцией суммарного балла выраженности болевого синдрома и оценки пациентом своего состояния по шкале симптомов хронического простатита NIH-CPSI, а также в оценке эффективности терапии как самим пациентом, так и исследователем. При этом, анализ данных большинства критериев клинической эффективности (средние значения количества лейкоцитов в секрете простаты, суммарного балла, выраженности болевого синдрома и оценки пациентом своего состояния по шкале симптомов хронического простатита NIH-CPSI) показывает, что сочетанная терапия ХП, включающая «Витапрост® таблетки и Кетонал, суппозитории ректальные приводит к более выраженному и стабильному эффекту, нежели монотерапия препаратом Кетонал, суппозитории ректальные.
Отсутствие нежелательных явлений и статистически достоверных изменений клинических и биохимических параметров крови и мочи у пациентов обеих групп за время наблюдения (за исключением снижения количества лейкоцитов в моче в поле зрения) свидетельствует о хорошей переносимости и безопасности препарата.
Всё вышеизложенное позволяет рекомендовать препарат «Витапрост®», таблетки к применению в комплексной терапии хронического абактериального простатита для повышения эффективности лечения у пациентов разных возрастов и с различными сопутствующими заболеваниями.
| Март 2008 г. |