А.А. Камалов, Е.А. Ефремов, С.Д. Дорофеев, Я.И. Мельник, Д.А. Охоботов
ВИТАПРОСТ® ФОРТЕ В ЛЕЧЕНИИ БОЛЬНЫХ С АДЕНОМОЙ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
ФГУ НИИ урологии (дир. - академик РАМН Н.А. Лопаткин) Росздрава, Москва
Введение.По данным международной статистики, аденома предстательной железы (АПЖ) наблюдается в среднем у 80% мужчин в возрасте 60 лет и старше. По данным ООН, численность населения в возрасте старше 60 лет к концу ХХ века возросла более чем в 3 раза. Учитывая тенденцию старения населения планеты, можно предположить возрастание актуальности данной проблемы [1].
АПЖ является одним из наиболее распространенных заболеваний мужчин пожилого возраста и определяется гистологически наличием доброкачественной ткани, расположенной в окружности проксимального сегмента мочеиспускательного канала [2].
J.Isaacs и D.Coffey (1987) [3] на основании аутопсийных исследований заключают, что при профилактическом обследовании мужчин старше 50 лет АПЖ обнаруживается в 10 – 15% случаев, однако клинические проявления болезни наблюдаются далеко не у всех [4]. У 80 – 85% мужчин 60 лет и старше имеет место в той или иной степени увеличение предстательной железы [5].
В.Е. Родоманом с соавт. [6] при обследовании 648 мужчин в возрасте от 50 до 86 лет (средний возраст 66,2 года) АПЖ была диагностирована у 242 (37,34%), среди них лиц от 50 до 59 лет было 11,3% , от 60 до 69 лет – 36,5%, от 70 до 79 лет – 42,8%, 80 лет и старше – 94%[7]. Заболевание проявляется жалобами на прогрессирующее ухудшение качества самостоятельного мочеиспускания: затрудненное мочеиспускание тонкой вялой струей, чувство неполного опорожнения мочевого пузыря, вынужденное ночное мочеиспускание от 1 раза и чаще.
Таким образом, лечение пациентов с АПЖ является важной задачей современной урологии в связи с распространенностью данного заболевания. Медикаментозная терапия АПЖ – одна из наиболее динамично развивающихся областей урологии. Вместе с тем механизмы действия некоторых препаратов изучены недостаточно, отсутствуют четкие показания к применению большинства лекарственных средств. Основные группы лекарственных средств, применяющихся для лечения АПЖ: гормональные препараты (аналоги гонадотропных рилизинг-гормонов, антиандрогены, гестагены, антиэстрогены, ингибиторы ароматазы, антагонисты пролактина), ингибиторы 5-α редуктазы, α-адреноблокаторы, растительные препараты, прочие (полиеновые антибиотики, аминокислотные комплексы и экстракты органов животных).
При лечении АПЖ применяются разнообразные лекарственные препараты растительного и животного происхождения. Один из них – Витапрост®, активным веществом которого является эндогенная субстанция сампрост (экстракт простаты) - комплекс водорастворимых биологически активных пептидов, выделенных из предстательной железы ткани простаты быков и бычков, достигших половой зрелости путем жесткого кислотного гидролиза, глубоко разрушающего клеточные структуры. Особенности выделения этих пептидов нивелируют их молекулярную видоспецифичность, в результате чего полученные препараты лишаются антигенных свойств и ассоциированных с ними побочных эффектов [8].
Экстракт простаты оказывает органотропное действие в отношении предстательной железы. Как все пептидные биорегуляторы, экстракт простаты обладает антиагрегантными и антикоагулянтными свойствами, усиливает синтез антигистаминовых и антисеротониновых антител, улучшает микроциркуляцию в пораженном органе. На этом основана его способность уменьшать отек и активность воспалительных процессов при заболеваниях предстательной железы. Существенным является также наличие у экстракта простаты иммуномодулирующих свойств [8].
В 2001 году в НИИ урологии Минздрава РФ проведено открытое несравнительное исследование по изучению эффективности и безопасности препарата Витапроста® в форме суппозиториев (доза по экстракту простаты - 50 мг) при хроническом простатите (ХП). Исследование продемонстрировало хорошую эффективность препарата при немногочисленных нежелательных явлениях. На основании полученных данных сделаны выводы о том, что Витапрост® может быть применён в комплексной терапии бактериального и абактериального ХП у пациентов всех возрастных групп, в том числе в сочетании с АПЖ [9].
Сегодня компанией «Нижфарм» разработана новая форма препарата - Витапрост® форте суппозитории ректальные 100 мг, что позволяет врачу и пациенту варьировать режим дозирования препарата, осуществляя патогенетическую терапию заболеваний предстательной железы и функционально связанных с ней органов. Витапрост® форте показан при различных заболеваниях и патологических состояниях мужской урогенитальной сферы, в том числе и при АПЖ.
В ФГУ «НИИ Урологии Росздрава» (Москва) в 2006 г. в соответствии с разрешением Федеральной службы по надзору в сфере здравоохранения и социального развития № 133 от 2 мая 2006 г. проведено сравнительное рандомизированное плацебо контролируемое клиническое исследование эффективности и безопасности препарата Витапроста® форте, суппозитории ректальные 100 мг, производства ОАО «Нижфарм» (Россия) у пациентов с АПЖ.
Препарат Витапрост® форте суппозитории ректальные 100 мг представляет собой суппозитории от белого с желтоватым до кремового с сероватым оттенком цвета, торпедообразной формы. Один суппозиторий содержит: в качестве активного вещества: сампроста субстанцию (экстракт простаты) 0,1 г (в пересчёте на водорастворимые пептиды – 0,02 г) и вспомогательные вещества - витепсол в количестве достаточном для получения суппозитория массой 1,25 г.
При планировании исследования были поставлены основная, первичные и вторичная цели.
Основной целью данного исследования явилась оценка эффективности и безопасности лекарственного препарата Витапроста® форте суппозитории ректальные 100 мг в лечении пациентов с АПЖ.
Первичными целями исследования были:
оценка динамики симптомов АПЖ по шкале Международной системы суммарной оценки заболеваний простаты (IPSS-Q); определение степени выраженности инфравезикальной обструкции, обусловленной АПЖ по данным ультразвукового (ТРУЗИ), урофлоуметрии, определения объема остаточной мочи; оценка степени уменьшения выраженности воспалительного процесса в предстательной железе, способствующего нарушению самостоятельного мочеиспускания (по показателям ТРУЗИ простаты). Вторичная цель – оценка переносимости препарата Витапроста® форте на основе анализа зарегистрированных побочных действий и изменений лабораторных показателей (клинического, биохимического анализов крови и клинического анализа мочи).
Материалы и методы. В исследование было включено 120 пациентов, соответствовавших следующим критериям включения:
мужчины с диагнозом АПЖ, находящиеся на амбулаторном лечении и наблюдении; пациенты, имеющие умеренно выраженную инфравезикальную обструкцию (максимальная объёмная скорость мочеиспускания Qmax 8,0 – 14,0 мл/с); пациенты, подписавшие информированное согласие на участие в исследовании. В исследование не включались пациенты, которые на момент 1-го визита:
нуждались в оперативном вмешательстве или применении любого другого вида лечения АПЖ; имели диагностированные заболевания мочеполовой системы (кроме АПЖ и простатита); имели выраженные нарушения функции печени и/или почек, и/или других жизненно важных органов, сопровождающиеся декомпенсацией их функций; не были способны адекватно отвечать на вопросы исследователя, заполнять необходимые документы и применять исследуемый препарат; участвовали в исследовании какого-либо другого лекарственного препарата. Все пациенты, соответствующие критериям включения и включенные в исследование, были рандомизированы на три группы по 40 человек в каждой:
пациенты основной группы получали препарат Витапрост® форте суппозитории ректальные 100 мг по 1 суппозиторию 1 раз в сутки; пациенты первой контрольной группы - препарат тамсулозин (омник) производства фирмы «Яманучи Юроп Б.В.» (Нидерланды) из группы α-адреноблокаторов по 1 таблетке 1 раз в сутки; пациенты второй контрольной группы - плацебо по 1 суппозиторию 1 раз в сутки. Длительность лечения во всех трех группах составляла 30 дней.
11 пациентов основной группы (Витапрост® форте), 11 пациентов первой контрольной (омник), 21 пациент второй контрольной (плацебо) группы имели сопутствующие заболевания, в том числе: язвенную болезнь желудка и двенадцатиперстной кишки, гипертоническую болезнь I-II стадии, ишемическую болезнь сердца, сахарный диабет 2-го типа и др. 2 (5%) пациента из основной группы и 1 (2,5%) пациент из группы плацебо перенесли инфаркт миокарда, 1 (2,5%) пациент из основной группы – острое нарушение мозгового кровообращения. Кроме этого, некоторые пациенты были подвергнуты в анамнезе оперативным вмешательствам (аппендэктомии, холецистэктомии, герниотомии и др.), а также биопсии простаты.
Исследование включало 5 визитов, в ходе которых проводились сбор анамнеза и физикальный осмотр пациента, регистрация симптоматики АПЖ с использованием шкалы Международной системы суммарной оценки заболеваний простаты (IPSS-Q), пальцевое ректальное исследование и ТРУЗИ с допплерографией сосудов предстательной железы, клинические и биохимические лабораторные исследования крови и мочи, простатспецифический антиген (ПСА), определение объема остаточной мочи, урофлоуметрия.
План обследования
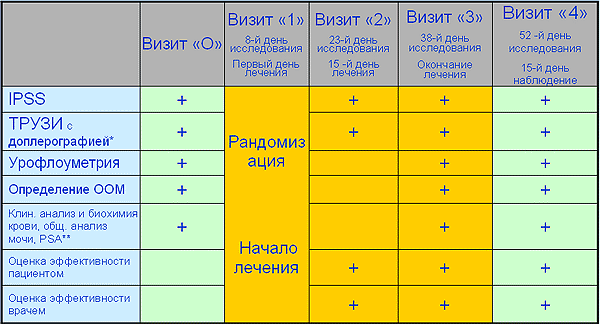
* Доплерография проводилась только на визитах 0 и 3 ** PSA определяли на визите «О» период лечения Результаты.
По данным проведенного динамического исследования клинических, а также биохимических анализов крови достоверные параметры для всех рассматриваемых групп колебались в пределах физиологических нормативов либо не имели клинического значения. Общий анализ мочи: сравнение таких параметров, как уровень белка, удельная плотность, содержание бактерий в поле зрения, pH, не выявило достоверных различий во всех группах. При этом колебания значений этих показателей определялись в пределах нормы.Данные ТРУЗИ простаты являлись одними из критериев эффективности, используемых для оценки терапевтического эффекта терапии и степени выраженности воспалительного процесса в предстательной железе.
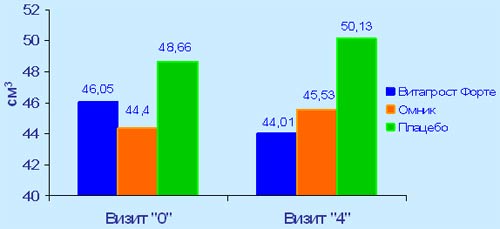
В основной группе на фоне приема препарата Витапроста® форте было достигнуто незначительное, но статистически достоверное снижение среднего значения объёма предстательной железы (с 46,05 см3 на 0-м визите до 44,01 см3 на 4-м визите). Среди пациентов, принимавших омник, было выявлено статистически достоверное умеренное увеличение объёма простаты с 44,4 до 45,33 см3 к концу исследования. В группе плацебо также зафиксировано последовательное увеличение объема простаты от 0-го визита к 3-му и 4-му визитам, но статистически недостоверное.
Динамика значений объема простаты по данным ТРУЗИ
Одними из основных параметров, используемых для оценки терапевтического эффекта применения препарата Витапроста® форте, были показатели урофлоуметрии и величины объёма остаточной мочи, характеризующие степень нарушения мочеиспускания на фоне развития АПЖ и функциональное состояние детрузора (таб. 1).
Таблица 1
Значения основных параметров мочеиспускания у пациентов трёх групп
Показатель
Основная группа
Омник
Плацебо
Визит
0-й
3-й
4-й
0-й
3-й
4-й
0-й
3-й
4-й
Qmax (мл/с)
минимальное и максимальное значения
8-14
9-16
8-18
8-14
8-16
7-14
8-14
7-16
8-16
среднее арифметическое ± стандартное отклонение
10,48
±1,8
11,48
±2,05
11,7 ±2,29
10,13±1,43
11,34 ±2,21
10,18±1,66
10,55±2,11
10,23±2,04
10,15±2,25
p
<10-5
<10-5
<10-5
0,83*
0,04
0,003
Qave (мл/с)
минимальное и максимальное значения
3-8
3-9
3-9
2-8
2,8-8
3-8
3-9
3-8
3-10
среднее арифметическое ± стандартное отклонение
5,05
±1,1
5,7
±1,38
5,88
±1,38
4,76 ±1,18
5,45 ±1,33
4,88 ±1,16
5,16 ±1,27
5,06 ±1,15
5,23 ±1,41
p
<10-5
<10-5
<10-5
0,002
0,47*
0,18*
Примечание. Здесь и в табл. 2, 4* - недостоверное значение.
В основной группе (Витапрост® форте) достигнуто увеличение среднего значения Qmax с 10,48 мл/с на 0-м визите до 11,48 мл/с к 3-му и 11,71 мл/с к 4-му визиту. Эти изменения были статистически достоверны. При этом максимальные значения этого параметра среди пациентов, принимавших Витапрост® форте, возросли до 16 и 18 мл/с к 3-му и 4-му визитам соответственно, достигнув нормальных значений. На фоне приема омника также увеличилась Qmax от 0-го визита к 3-му визиту (с 10,13 до 11,34 мл/с), но дальнейшее изменение этого показателя было недостоверно. Среди пациентов, принимавших плацебо, отмечено последовательное уменьшение Qmax от 0-го визита к 3-му и 4-му.
В группе получавшей Витапрост® форте, от 0-го к 4-му визиту происходит достоверное снижение среднего значения объема остаточной мочи, несмотря на прекращение приема препарата на 3-м визите, что может свидетельствовать о терапевтическом последействии препарата Витапроста® форте (терапевтическое действие которого продолжается с прекращением курса лечения) (табл. 2).
Таблица 2
Величины объема остаточной мочи у пациентов трех групп
Объём остаточной мочи, мл
Основная группа
Омник
Плацебо
Визит
0-й
3-й
4-й
0-й
3-й
4-й
0-й
3-й
4-й
минимальное и максимальное значения
0-139
0-98
0-85
0-100
0-74
0-95
0-95
0-89
0-142
среднее арифметическое ± стандартное отклонение
51,95
±31,3
30,42
±25,61
28,62
±24,39
49,7±25,11
31,35±24,22
48,38±25,2
45,85±25,19
49,53±25,07
54,95±29,59
р
<10-5
<10-5
<10-5
<10-5
0,208*
0,09*
* - недостоверное значение
У пациентов, принимавших омник, отмечается достоверное сниженное среднего значения объема остаточной мочи от 0-го к 3-му визиту, а далее от 3-го к 4-му визиту (после отмены препарата) объём остаточной мочи увеличивается. Данное увеличение указывает на симптоматическое действие препарата омника, после прекращения приема которого первоначальные показатели объема остаточной мочи возвращаются к исходным.
В группе плацебо, напротив, объём остаточной мочи увеличивался от визита к визиту, хотя увеличение это и не было статистически достоверно.
Одним из параметров эффективности терапии, используемом при статистическом анализе данных исследования для оценки степени выраженности обструктивной и ирритативной симптоматики АПЖ, являлась сумма баллов по шкале IPSS. Результаты проведенного анкетирования приведены в табл. 3.
Таблица 3
Динамика суммарного балла по шкале IPSS
Количество баллов
Количество пациентов
Основная группа
Омник
Плацебо
Визит
0-й
3-й
4-й
0-й
3-й
4-й
0-й
3-й
4-й
0 – 7 (незначительная)
2
(5)
9
(22,5)
12
(30)
4
(10)
14
(35)
8
(20)
3
(7,5)
3
(7,5)
3
(7,5)
8 – 19 (умеренная)
35
(87,5)
29
(72,5)
26
(65)
33
(82,5)
24
(60)
30
(75)
33
(82,5)
34
(85)
34
(85)
20 – 35 (выраженная)
3
(7,5)
2
(5)
2
(5)
3
(7,5)
2
(5)
2
(5)
4
(10)
3
(7,5)
3
(7,5)
Примечание. Здесь, а также в табл. 5, 6 в скобках указано процентное значение.
При анализе результатов исследования отдельно оценивалось количество пациентов с незначительной симптоматикой АПЖ (сумма баллов 0-7), умеренной (сумма баллов 8-19) и выраженной (сумма баллов 20-35). В основной группе на 0-м визите прослеживается преимущественное преобладание пациентов с умеренным количеством баллов по шкале IPSS – 35 (87,5%) пациентов, далее к 4-му визиту этот показатель снижается до 26 (65%). Это связано с тем, что препарат влияет на субъективную симптоматику и достоверно уменьшает симптоматику исходного заболевания, в результате чего количество пациентов с незначительными симптомами последовательно увеличилось от 0-го визита к 4-му с 2 (5%) до 12 (30%).
В группе пациентов, принимающих омник, данная тенденция прослеживается от 0-го визита к 3-му, однако снижение субъективной симптоматики требует проведения постоянной терапии, и поэтому после отмены омника субъективная симптоматика постепенно возвращается к 4-му визиту, что является дополнительной иллюстрацией к различиям в механизме действия препаратов и подтверждением симптоматического действия омника.
Среднее значение суммарного показателя по шкале IPSS снизилось в основной группе с 13,39 на 0-м визите до 10,73 и 10,32 балла на 3-м и 4-м визитах. Снижение значения этого показателя также достигнуто среди пациентов группы омника: с 13,18 на 0-м визите до 9,625 балла к 3-му визиту. Однако затем зафиксировано его увеличение до 11,77 балла на 4-м визите. Изменение среднего значения суммарного балла в группе плацебо статистически недостоверны (см. рисунок).
В оценке степени выраженности симптомов АПЖ немаловажную роль играет и оценка пациентом качества жизни (Q). Динамика средних значений оценки пациентом качества жизни при анкетировании по шкале IPSS приведена в табл. 4.
Таблица 4
Динамика средних значений оценки пациентом качества жизни
|
Количество баллов |
Основная группа |
Омник |
Плацебо |
||||||
|
Визит |
|||||||||
|
0-й |
3-й |
4-й |
0-й |
3-й |
4-й |
0-й |
3-й |
4-й |
|
|
Минимальное и максимальное значения |
2-5 |
1-5 |
0-5 |
2-5 |
0-5 |
2-4 |
2-6 |
2-6 |
2-6 |
|
Среднее арифметическое ± стандартное отклонение |
3,25 ±0,7 |
2,68 ±1,02 |
2,55 ±1,13 |
3,03 ±0,76 |
2,68 ±1,1 |
2,88 ±0,85 |
2,93 ±0,86 |
2,9 ±0,87 |
2,9 ±0,87 |
|
р |
<10-5 |
<10-5 |
0,003 |
0,16* |
0,897* |
1,0* |
|||
* - недостоверное значение
У пациентов основной группы выявлено достоверное снижение среднего значения оценки качества жизни от 0-го визита 0 к 3-му и 4-му визиту с 3,25 до 2,68 и 2,55 балла соответственно. Среди пациентов, принимавших омник, также отмечено уменьшение этого показателя с 3,025 на 0-м визите до 2,675 на 3-м визите, однако дальнейшие изменения недостоверны. В группе плацебо все изменения показателя качества жизни статистически недостоверны. Отсутствие достоверной динамики в группе плацебо может свидетельствовать об отсутствии какого-либо клинического эффекта, что является определяющими факторами для плацебо.
Оценка эффективности терапии пациентом и врачом представлена в таблице 5 и 6.
Таблица 5
Оценка эффективности терапии пациентом и врачом в основной группе (Витапрост® форте)
|
Оценка эффекта |
Количество пациентов n (%) |
|||||
|
2-й визит |
3-й визит |
4-й визит |
||||
|
пациент |
врач |
пациент |
врач |
пациент |
врач |
|
|
Выраженный |
0 |
0 |
1 (2,5) |
10 (25) |
1 (2,5) |
13 (32,5) |
|
Хороший |
6 (15) |
4 (10) |
12 (30) |
19 (47,5) |
14 (35) |
12 (30) |
|
Удовлетворительный |
33 (82,5) |
35 (87,5) |
25 (62,5) |
11 (27,5) |
23 (57,5) |
14 (35) |
|
Неудовлетворительный |
1 (2,5) |
1 (2,5) |
2 (5) |
0 |
2 (5) |
1 (2,5) |
Таблица 6
Оценка эффективности терапии пациентом и врачом в контрольных группах
|
Оценка эффекта |
Количество пациентов n (%) |
|||||||||||
|
Омник |
Плацебо |
|||||||||||
|
2-й визит |
3-й визит |
4-й визит |
2-й визит |
3-й визит |
4-й визит |
|||||||
|
пациент |
врач |
пациент |
врач |
пациент |
врач |
пациент |
врач |
пациент |
врач |
пациент |
врач |
|
|
Выраженный |
0 |
0 |
0 |
9 (22,5) |
0 |
2 (5) |
0 |
0 |
0 |
1 (2,5) |
0 |
1 (2,5) |
|
Хороший |
7 (17,5) |
5 (12,5) |
12 (30) |
11 (27,5) |
1 (2,5) |
5 (12,5) |
0 |
0 |
0 |
1 (2,5) |
0 |
1 (2,5) |
|
Удовлетворительный |
31 (77,5) |
35 (87,5) |
27 (67,5) |
20 (50) |
21 (52,5) |
17 (42,5) |
17 (42,5) |
17 (42,5) |
7 (17,5) |
7 (17,5) |
4 (10) |
4 (10) |
|
Неудовлетворительный |
2 (5) |
0 |
1 (2,5) |
0 |
18 (45) |
16 (40) |
23 (57,5) |
23 (57,5) |
33 (82,5) |
31 (77,5) |
36 (90) |
34 (85) |
Как видно из приведенных данных, во время 3-го визита пациенты всех трех групп оценивали эффективность всего проведенного курса терапии. При этом в основной группе и группе, получавшей в качестве лечения омник, преобладали пациенты с удовлетворительным эффектом (62,5% (25 пациентов) и 67,5% (27 пациентов)). Количество пациентов в этих группах было одинаковым – с хорошим эффектом (по 30% (12 пациентов)). Выраженный эффект отмечен у 1 (2,5%) пациента основной группы, в группе омника выраженного эффекта не отмечено ни в одном случае. Неудовлетворительный эффект выявлен у 2 (5%) пациентов основной группы и у 1 (2,5%) пациента в группе омника. В группе плацебо не зарегистрировано ни одного случая выраженного и хорошего эффекта. Пациенты, получавшие плацебо в основном представлены неудовлетворительным (82,5% - 33 пациента), а также удовлетворительным (17,5% - 7 пациентов) результатами.
Оценивая эффективность лечения на 3-м визите, врач констатировал у 47,5% (19) пациентов основной группы хороший эффект, в группе омника этот показатель значительно ниже - 27,5% (11 пациентов).
В основной группе удовлетворительный эффект зафиксирован в 27,5% (11 пациентов) случаев, а в группе омника – в 50% (20 пациентов), частота встречаемости выраженного эффекта в основной группе увеличилась от 0 до 25% (10 пациентов).
У пациентов, получавших плацебо, к 3-му визиту, по мнению врача, были в основном неудовлетворительные результаты - 77,5% (31 пациент), а также удовлетворительные - 17,5% (7 пациентов). В 1 случае хороший, а в 1 выраженный эффект (по 2,5% в каждом наблюдении) отмечен в группе, получавшей плацебо на момент 3-го визита.
Полученные в ходе исследования данные свидетельствуют о том, что в ходе проведенного лечения исследуемым препаратом Витапростом® форте, а также омником по сравнению с плацебо как пациентом, так и врачом отмечена высокая сопоставимая эффективность терапии. За период лечения от 2-го к 3-му визиту констатирована положительная динамика в оценке эффективности как в основной группе, так и в группе пациентов, получавших омник. При этом в основной группе обращает на себя внимание трансформация представления о преобладании пациентов. Так, на 2-м визите у преобладающего большинства пациентов эффект расценен как удовлетворительный (87,5% - 35 пациентов), к 3-му визиту преобладают пациенты с хорошим эффектом (47,5% - 19 пациентов).
После прекращения терапии к 4-му визиту в группе Витапроста® форте отмечено такое же количество пациентов с выраженным эффектом, как и на 3-м визите (1 пациент), количество пациентов с хорошим эффектом увеличилось с 3-го визита к 4-му с 12 до 14, что свидетельствует о терапевтическом последействии препарата Витапроста® форте после прекращения курса лечения.
После прекращения терапии к 4-му визиту в группе омника отмечается увеличение числа пациентов с неудовлетворительным эффектом - на 3-м визите это был 1 пациент, а к 4-му визиту их стало 18, что указывает на прекращение действия препарата омника сразу после завершения терапии.
В группе плацебо, по мнению пациентов, неудовлетворительный эффект зафиксирован в 90% (36 пациентов) случаев, удовлетворительный – в 10% (4 пациента). Хорошего, а также выраженного эффекта не выявлено ни в одном из случаев.
По оценке врача ко времени 4-го визита у пациентов основной группы удовлетворительный, выраженный, а также хороший эффекты распределились практически в равных долевых пропорциях: удовлетворительный - 35% (14 пациентов), хороший - 30% (12 пациентов), выраженный - 32,5% (13 пациентов) при 1 неудовлетворительном результате.
После прекращения терапии к 4-му визиту в группе Витапроста® форте отмечается увеличение числа пациентов с выраженным эффектом - на 3-м визите их было 10, а к 4-му визиту стало 13, что также свидетельствует о терапевтическом последействии исследуемого препарата.
В группе омника частота встречаемости эффектов от проведенного лечения иная: удовлетворительный и неудовлетворительный эффекты преобладают - 17 и 16 пациентов соответственно (42,5 и 40%). Хороший эффект отмечен в 12,5% (5 пациентов) случаев, выраженный эффект был у 2 (5%) пациентов.
В группе плацебо: неудовлетворительный эффект отмечен в 85% (34 пациента) случаев, удовлетворительный – в 10% (4 пациента), хороший и выраженный эффекты – по 1 наблюдению (по 2,5%).
Таким образом, через 15 дней после окончания лечения в группе омника наблюдается тенденция к снижению эффективности проведенной терапии на фоне завершения использования препарата по сравнению с плацебо, низкая эффективность которого была заведомо ожидаемой и подтверждена документально в данном исследовании. Выраженное и резкое снижение оценки эффективности лечения после прекращения приема препарата в группе омника объяснимо с позиции рассмотрения принципов проведения симптоматического лечения, механизма действия и периода полувыведения препарата.
Более высокую оценку эффективности в основной группе после прекращения лечения можно объяснить специфическим органотропным действием исследуемого препарата, этиопатогенетическим механизмом его действия, а также терапевтическим последействием препарата Витапроста® форте после прекращения курса лечения.
За всё время проведения исследования зафиксированы два нежелательных эффекта. В 1 случае между 3-м и 4-м визитом (уже после прекращения приема препарата) пациент из основной группы отметил усиление дизурии (в том числе ночной поллакиурии). Это было расценено как нежелательный эффект лёгкой степени тяжести, несерьезное и не требовало дополнительной терапии, взаимосвязи между данным нежелательным эффектом и терапией препаратом Витапростом® форте не было.
У другого пациента, получавшего плацебо, между 3-м и 4-м визитом выявлено ухудшение параметров мочеиспускания и увеличение объема простаты. Это также было расценено как нежелательный эффект лёгкой степени, несерьезное, не требовало дополнительной терапии, взаимосвязи между данным нежелательным эффектом и применением плацебо не было.
Аллергических реакций у пациентов трех групп не отмечено.
Обсуждение. Проведённое клиническое исследование показало, что применение препарата Витапроста® форте, суппозитории ректальные в качестве монотерапии АПЖ вызывает умеренное статистически достоверное уменьшение объема предстательной железы. Положительный эффект может быть объяснен специфическим прямым и непрямым органотропным действием основного действующего вещества препарата (экстракта простаты) на простату, что приводит к снижению пролиферативной активности клеток предстательной железы и торможению развития АПЖ, усилению синтеза антигистаминовых и антисеротониновых антител, что в конечном счете, способствует уменьшению отека органа и снижению активности сопутствующих воспалительных процессов.
Немалую роль играет и способность экстракта простаты уменьшать отек и активность воспалительных процессов в органе за счет улучшения в нем микроциркуляции. С антиагрегантными и антикоагулянтными свойствами экстракта простаты связано и умеренное улучшение кровообращения в органе, проявившееся статистически достоверным увеличением максимальной линейной скорости кровотока после первых 15 дней терапии.
При анализе результатов исследования на фоне терапии препаратом Витапростом® форте отмечено и уменьшение инфравезикальной обструкции, что выразилось в увеличении максимальной и средней объемных скоростей мочеиспускания и уменьшении объема остаточной мочи. При этом положительные изменения сохранялись в течение 15 дней после окончания приёма препарата. Уменьшение выраженности обструктивной, а также ирритативной симптоматики при приеме исследуемого препарата подтверждается и анкетированием пациентов с помощью Международной шкалы простатических симптомов IPSS, при анализе данных которой выявлено уменьшение суммарного балла и балла оценки пациентом качества жизни. Данные изменения объясняются этиопатогенетическим механизмом действия препарата на АПЖ и свидетельствуют о терапевтическом последействии препарата Витапроста® форте, терапевтическое действие которого продолжается с прекращением курса лечения.
За время наблюдения у пациентов, применявших Витапрост® форте, суппозитории ректальные, отмечен только один нежелательный эффект легкой степени тяжести, взаимосвязи между ним и терапией препаратом Витапростом® форте не выявлено. Нежелательных эффектов средней и тяжёлой степеней тяжести не выявлено, что наряду с отсутствием статистически достоверных отрицательных изменений клинических и биохимических параметров крови и мочи у пациентов обеих групп за время наблюдения свидетельствует о хорошей переносимости и безопасности препарата.
Заключение. Всё вышеизложенное позволяет рекомендовать препарат Витапрост® форте, суппозитории ректальные, к применению в монотерапии АПЖ у пациентов с умеренно выраженной инфравезикальной обструкцией независимо от возраста и наличия сопутствующих заболеваний.
ЛИТЕРАТУРА
1.
Emberton M, Andriole GL, de
2. Barry M.J.,
3. Isaacs J., Coffey D.S. Etiology and disease process
of benign prostatic hyper plasia. Prostate 1987: 2 (Suppl.): 33-50.
4.
«Об осложнениях адэномэктомии простаты и способах их
лечения», под ред. Аккад. Н.А. Лопаткина, М.: Медицина; 1982.
5.
Шабад А.Л.,
Осипов В.П. Аденома предстательной железы. – М.; 1987.
6.
Родоман В.Е.,
Авдошин В.П., Першин С.В. В кН.: Аденома предстательной железы. М.: Изд-во
Рос. Ун-та дружбы народов; 1993.
7. Материалы Симпозиума Правления Общества Урологов
России, Саратов; 1998; 167, 215-216.
8.
Горбачев А.Г.,
Бобков Ю.А., Аль-Шукри С.Х. Роль простатилена в патогенетическом лечении
хронического простатита. В кн.: Материалы Международного симпозиума
«Геронтологические аспекты пептидной регуляции функций организма». СПб.; 1996; 36.
9.
Камалов А.А.,
Дорофеев С.Д. Современные взгляды на проблему хронического простатита. Рус.
мед. журн. 2003; 11, (№4): 229-233.
Резюме. Статья посвящена исследованию эффективности и безопасности препарата Витапрост® форте суппозитории ректальные в терапии пациентов с доброкачественной гиперплазией предстательной железы.
Представлены сведения об эпидемиологии и принципах лечения доброкачественной гиперплазии предстательной железы, а также о механизмах действия и клинической эффективности и безопасности препарата Витапрост® форте.
Активным веществом препарата Витапрост® форте является комплекс водорастворимых биологически активных пептидов, выделенных из предстательной железы бычков и быков. Экстракт простаты обладает органотропным действием в отношении предстательной железы. Он снижает пролиферативную активность клеток, приводя к торможению развития доброкачественной гиперплазии простаты; уменьшает отек и активность воспалительных процессов при заболеваниях предстательной железы.
Потенцированные антитела к эндогенному регулятору, в отличие от естественных, не подавляют его активность, а специфически её модифицируют.
Настоящее клиническое исследование показало, что применение препарата Витапрост® форте», суппозитории ректальные, в качестве монотерапии ДГПЖ вызывает умеренное статистически достоверное уменьшение объёма предстательной железы. При анализе результатов исследования на фоне терапии препаратом Витапрост® форте отмечено и уменьшение инфравезикальной обструкции, что выразилось в увеличении максимальной и средней объёмных скоростей мочеиспускания и уменьшении объёма остаточной мочи. Уменьшение выраженности обструктивной, а также ирритативной симптоматики при приёме исследуемого препарата подтверждается и анкетированием пациентов с помощью Международной шкалы простатических симптомов IPSS, при анализе данных которой выявлено уменьшение суммарного балла и балла оценки пациентом качества жизни.
Препарат
Витапрост® форте, суппозитории ректальные, может быть использован в
монотерапии доброкачественной гиперплазии предстательной железы у пациентов с
умеренно выраженной инфравезикальной обструкцией вне зависимости от возраста и
наличия сопутствующих заболеваний.
Март 2008 г.