Функциональные нарушения моторики желудочно-кишечного тракта и кишечная микрофлора
А.В. Малкоч, С.В. Бельмер, М.Д. Ардатская
Российский государственный медицинский университет,
Учебно-Научный центр Медицинского центра Управления делами Президента РФ.
Ключевые слова: желудочно-кишечный тракт, моторика, функциональные нарушения, микрофлора, короткоцепочечные жирные кислоты, пребиотики, лактулоза.Резюме.
Функциональные нарушения моторики являются одним из наиболее частых проявлений патологии желудочно-кишечного тракта (ЖКТ). Регуляция моторики ЖКТ имеет многоуровневый характер и осуществляется на уровне центральной и периферической нервной системы, вегетативной нервной системы, на местном уровне непосредственно в кишечнике. Значительный вклад в местную регуляцию моторики вносит микрофлора ЖКТ, как за счет формирования каловых масс, так и путем выработки различных метаболитов, в том числе, короткоцепочечных жирных кислот (КЦЖК). Состав и количество КЦЖК зависит от факторов питания микрофлоры. Для нормального функционирования и метаболизма сапрофитная микрофлора нуждается в значительном количестве неперевариваемых углеводов, т.е. пребиотиках. Пребиотики являются неотъемлемым компонентом комплексной терапии функциональных нарушений ЖКТ.
Назначение детям с функциональными нарушениями ЖКТ и дисбактериозом препарата лактулозы Дюфалак приводило к выраженному и стойкому улучшению состава и метаболической активности микрофлоры, курировало проявления дискинезии ЖКТ.
Нарушения моторики являются одним из наиболее встречаемых симптомов патологии желудочно-кишечного тракта (ЖКТ). С некоторой долей условности их можно разделить на первичные, связанные с органической патологией (аномалии развития, приобретенные заболевания и др.), и вторичные (функциональные), связанные с нарушением нервной, гуморальной, метаболической и местной регуляции.
Функциональные нарушения моторики (дискинезии) могут быть единственным проявлением патологии, но чаще сопровождаются нарушением других функций ЖКТ: нарушениями секреции, переваривания (мальдигестия), всасывания (мальабсорбция), состояния микрофлоры (дисбактериоз), активности иммунной системы. Прогрессирование одного функционального расстройства неизбежно приводит к нарушению всех остальных функций ЖКТ.
Регуляция моторики ЖКТ.
Нервная регуляция моторики ЖКТ носит многоуровневый характер. Психоэмоциональные реакции, общий психоэмоциональный фон, органические поражения ЦНС оказывают эфферентные влияния на состояние вегетативной нервной системы (симпатической и парасимпатической), которая через внекишечные и внутрикишечные ганглии, собственную нервную систему кишечника регулирует работу гладких миоцитов и желез.Гуморальная регуляция осуществляется как на системном уровне, так и за счет выработки разнообразных интестинальных гормонов, которые обеспечивают согласованную работу различных отделов и желез ЖКТ, превращая их в единый «технологический конвейер». Именно благодаря локально вырабатываемым интестинальным пептидам и взаимосвязи нервной регуляции на местном и сегментарном уровне страдание одного отдела или органа ЖКТ приводит к вовлечению в процесс и других.
Местная регуляция моторики ЖКТ осуществляется благодаря наличию клеток-водителей ритма в гладкой мускулатуре, причем такими водителями ритма в случае необходимости могут становиться отдельные миоциты. Помимо этого, регуляцию моторики осуществляют различные медиаторы (простагландины, кинины, оксид азота, гистамин и др.).
В гладких миоцитах кишечника содержатся различные рецепторы: холинергические, дофаминовые, опиатные, 5-НТ4-рецепторы и др. Посредством влияния на них достигается согласованность в работе кишечника и осуществляется кишечный транзит. Также большую роль в местной регуляции играют барорецепторы, активность которых регулируется давлением каловых масс, и желчные кислоты.
Значительное местное влияние на состояние моторики ЖКТ оказывает микрофлора. Деятельность микроорганизмов, населяющих кишечник, приводит к увеличению объема каловых масс, газообразованию, снижению порога чувствительности миоцитов, стимуляции выработки холецистокинина и др. Помимо этого, бактерии вырабатывают огромное количество различных веществ, так или иначе воздействующих на моторику. Это такие медиаторы как гистамин, серотонин, ГАМК; циклические АМФ и ГМФ; токсины и пептиды; бактериальные метаболиты желчных кислот; короткоцепочечные жирные кислоты и др. [1].
Короткоцепочечные жирные кислоты (КЦЖК) являются одними из важнейших метаболитов кишечной микрофлоры, которые оказывают как местное, так и системное влияние. Количество и спектр КЦЖК зависит как от типа метаболической активности микроорганизмов, так и обеспеченности их теми или иными субстратами, т.е. питания микрофлоры [1, 2].
Питание микрофлоры и короткоцепочечные жирные кислоты.
Питание микроорганизмов, населяющих желудочно-кишечный тракт человека, обеспечивается за счет нутриентов, которые не перевариваются собственными ферментативными системами желудочно-кишечного тракта и не всасываются в тонкой кишки. Ранее эти компоненты пищи называли «балластными», предполагая, что они не имеют какого-либо существенного значения для макроорганизма, однако по мере изучения микробного метаболизма, стало очевидным их значение не только для роста кишечной микрофлоры, но для здоровья человека в целом. Они получили название «пребиотики», под которым, согласно современному определению, понимаю частично или полностью неперевариваемые компоненты пищи, которые избирательно стимулируют рост и/или метаболизм одной или нескольких групп микроорганизмов, обитающих в толстой кишке, обеспечивая нормальный состав кишечного микробиоценоза [3].С биохимической точки зрения под пребиотиками понимают обычно углеводные компоненты питания, особо необходимые для жизнедеятельности нормальной кишечной микрофлоры. Свои энергетические потребности микроорганизмы толстой кишки обеспечивают за счет анаэробного субстратного фосфорилирования, ключевым метаболитом которого является пировиноградная кислота (ПВК). ПВК образуется из глюкозы через процесс гликолиза и далее, восстановление ПВК, дает образование от 1 до 4 молекул АТФ. Последний этап приведенных выше процессов обозначается как брожение, которое может идти различными путями с образованием различных метаболитов.
Гомоферментативное молочное брожение характеризуется преимущественным образование молочной кислоты (до 90%) и характерно для лактобактерий и стрептококков толстой кишки. Гетероферментативное молочное брожение при котором образуются и другие метаболиты (в т.ч. уксусная кислота), присуще бифидобактериям. Спиртовое брожение, ведущее к образованию углекислого газа и этанола, является побочным метаболическим путем у некоторых представителей Lactobacillus и Clostridium. Отдельные виды энтеробактерий (E.coli) и клостридий получают энергию в результате муравьинокислого, пропионового, маслянокислого, ацетонобутилового или гомоацетатного видов брожения.
Таким образом, в результате микробного метаболизма в толстой кишке образуются молочная кислота, короткоцепочечные жирные кислоты, углекислый газ, водород, вода. Углекислый газ в большой степени преобразуется в ацетат, водород всасывается и выводится через легкие, а органические кислоты утилизируются макроорганизмом, причем значение их для человека трудно переоценить.
Говоря о жирных кислотах, наибольшее значение имеют уксусная (обозначается как С2, т.е. содержит 2 углеродных атома), пропионовая (С3), масляная / изомасляная (С4), валериановая / изовалериановая (С5), капроновая / изокапроновая (С6). Перечисленные жирные кислоты в медицинской литературе обозначаются как короткоцепочечные, хотя, строго говоря, с биохимической точки зрения таковыми являются только три первых (т.е. С2-С4). Нормальная микрофлора толстой кишки перерабатывая непереваренные в тонкой кишке углеводы производит перечисленные кислоты с минимальным количеством их изоформ. В то же время, при нарушении микробиоценоза и увеличении доли протеолитической микрофлоры указанные жирные кислоты начинают синтезироваться из белков преимущественно в виде изоформ, что отрицательным образом сказывается на состоянии толстой кишки, с одной стороны, и может быть диагностическим маркером, с другой. Концентрация короткоцепочечных жирных кислот (КЦЖК) в толстой кишке максимальная в проксимальных отделах, т.е. там где идет наиболее интенсивный их синтез, и снижается к дистальным отделам. В среднем концентрация КЦЖК в толстой кишке взрослого человека составляет 70-140 ммоль/л в проксимальных отделах толстой кишки и 20-70 ммоль/л – в дистальных [4]. У новорожденного ребенка КЦЖК в толстой кишке в виду отсутствия микрофлоры практически отсутствуют. Их количество у здорового ребенка резко нарастает к 20-30 дню жизни до 70-80 ммоль/л, что совпадает с периодом нормального становления кишечной микрофлоры и далее достигает «взрослых» значений к 2-м годам жизни [5].
Соотношение концентраций С2:С3:С4 в толстой кишке взрослого человека составляет примерно 57:21:22%. Остальные КЦЖК присутствуют в незначительных количествах. Ацетат является преобладающим во всех возрастных группах, однако у детей первых месяцев жизни, находящихся на естественном вскармливании, концентрация бутирата и пропионата очень невелики, а основную часть метаболитов микробной микрофлоры составляют ацетат и лактат. При искусственном вскармливании доля лактата уменьшается, а бутирата и пропионата увеличивается, что объясняется изменением состава микрофлоры и может иметь отрицательные последствия для состояния кишечника [6].
КЦЖК, образованные в результате микробного метаболизма, имеют важное значение как для толстой кишки, так и для макроорганизма в целом. Синтез КЦЖК является важным фактором колонизационной резистентности, обеспечивающим стабильность состава кишечной микрофлоры, одним, но не единственным, механизмом обеспечения которой является поддержание оптимальных значений рН в просвете толстой кишки. Повышение концентрации КЦЖК сочетается со снижением осмотического давления в толстой кишке в связи с расщеплением полисахаридов [4].
Регуляция кишечного транзита органическими кислотами связана не только с изменением осмотического давления в результате их синтеза. В проксимальных отделах толстой кишки КЦЖК стимулируют рецепторы L-клеток, которые вырабатывают регуляторный пептид PYY, который, в свою очередь, замедляет моторику как толстой так и тонкой кишки. Ранее было установлено, что выработка PYY лежит в основе «илеоцекального тормоза», замедляющего кишечную моторику при попадании в толстую кишку недопереваренных жиров [7]. В дистальных отделах толстой кишки эффект КЦЖК противоположный. Они стимулируют рецепторы Ecl-клеток, вырабатывающих гистамин, который действуя на 5-HT4-рецепторы афферентных волокон блуждающего нерва инициирует рефлекторное ускорение моторики [8].
Большая часть КЦЖК, образовавшихся в толстой кишке, всасывается. Обычно, с калом выводится не более 5% от их общего количества. Всасывание КЦЖК происходит при участии активных транспортных систем колоноцитов и наиболее хорошо изучено в отношении бутирата. Установлено, что бутират поступает в колоноцит в обмен на гидрокарбонатные ионы. Часть всосавшегося бутирата поступает опять в просвет кишки в обмен на ионы хлора, однако значительная часть его остается в колоноците и утилизируется им. Кроме того, всасывание бутирата тесно связано с всасыванием натрия: блокирование всасывание бутирата блокирует всасывание натрия и наоборот. Это взаимодействие имеет особое значение, т.к. поступление натрия в колоноцит определяет всасывание воды. Кроме того, КЦЖК определяют всасывание кальция и магния. Таким образом, эффективность всасывания КЦЖК имеет значение не только для поддержания водно-электролитного равновесия и минерального обмена в организме, но также для регуляции моторики толстой кишки, проявляя свой антидиарейный эффект [9].
Наконец, важнейшей функцией микрофлоры в связи с метаболизмом пребиотиков в КЦЖК является обеспечение колоноцита энергией, который для энергетических целей не менее чем на 70% потребляет бутират и значительно страдает при его недостатке. Показано, что КЦЖК являются регуляторами апоптоза и обладают антиканцерогенным эффектом, снижая пролиферацию клеток эпителия толстой кишки, но повышая ее их дифференцировку.
Поступившие в колоноцит ацетат и пропионат в основном выводятся в кровоток. При этом на уровне толстой кишки они участвуют в регуляции ее кровотока, повышая ее и тем самым обладают антиишемическим эффектом. Концентрация КЦЖК (в основном, ацетат и пропионат) в воротной вене составляет в среднем 375+70 ммоль/л, в то время как в оттекающей от печени крови она снижается до 148+42 ммоль/л, а в периферической крови - 79+22 ммоль/л. Таким образом, печень задерживает примерно половину поступивших через колоноцит КЦЖК, а периферические ткани элиминируют еще одну четверть их. Большая часть ацетата и пропионата в тканях идет на синтез глюкозы и небольшая часть (не более 10%) на энергетические нужды [4].
Пребиотики в комплексной терапии функциональных нарушений ЖКТ.
Нарушение состава кишечной микрофлоры, т.е. дисбиоз, приводит к изменению спектра продуцируемых ею метаболитов, в том числе и КЦЖК [10]. Это оказывает негативное влияние на работу кишечника, особенно, на его моторику. Однако существует и обратная связь. Нарушения моторики ЖКТ приводят к изменению внутренней среды кишки, нарушению переваривания и всасывания, что отрицательно сказывается на состоянии микрофлоры. Дисбиоз и дискинезии ЖКТ поддерживают развитие друг друга, при этом нарушения моторики ЖКТ могут быть как следствием, так и причиной развития дисбиоза.При развитии дисбиоза кишечника вследствие раздражения рецепторов и нарушения моторики усиливается поток восходящих «отрицательных» импульсов в ЦНС, что оказывает влияние на психоэмоциональный фон и поведение ребенка, функционирование ЦНС.
Тесная взаимосвязь нервной системы, кишечника и микрофлоры обуславливает комплексный подход в лечении функциональных нарушений ЖКТ, который включает в себя создание охранительного психоэмоционального и пищевого режима, назначение спазмолитиков, антидепрессантов, препаратов, улучшающих состав и функционирование кишечной микрофлоры.
Большое значение в комплексной терапии функциональных расстройств имеет обеспеченность организма пребиотиками. Достаточное поступление пребиотиков в толстую кишку приводит не только к росту сапрофитной микрофлоры, но влияет на ее метаболизм, способствует синтезу КЦЖК с минимальным количеством изоформ.
Наиболее эффективными пребиотическими свойствами обладают лактулоза, фруктозо-олигосахаридах (ФОС), галакто-олигосахаридах (ГОС), инулин, пищевые волокна. Пребиотики содержатся в кукурузных хлопьях, крупах, хлебе, луке репчатом, ци.кории полевом, чесноке, фасоли, горохе, артишоке, аспарагусе, бананах, в овощах, фруктах, листовых культурах, во многих ягодах.
Обогащение рациона питания продуктами, содержащими пребиотики, обеспечивает стабильность состава и нормальное функционирование кишечной микрофлоры [3]. Однако для коррекции дисбиоза, в том числе возникшего на фоне функциональных нарушений ЖКТ, этого, как правило, недостаточно.
На сегодняшний день существует большое количество пребиотических препаратов, пищевых добавок, продуктов, обогащенных пребиотиками. Одними из наиболее эффективных препаратов с пребиотическим эффектом, применяемых для коррекции дисбиоза, являются препараты лактулозы.
Лактулоза – дисахарид, состоящий из галактозы и фруктозы, в молоке (женском или коровьем) отсутствует, однако в небольших количествах может образовываться при нагревании молока до температуры кипения. Лактулоза не переваривается ферментами желудочно-кишечного тракта, ферментируется лакто- и бифидобактериями и служит им субстратом для энергетического и пластического обмена, за счет чего способствует их росту и нормализации состава микрофлоры, увеличению объема биомассы и каловых в масс, что определяет ее слабительный эффект. Помимо этого, показана антикандидозная активность лактулозы и ее угнетающий эффект на сальмонелл.
Наиболее известным препаратом лактулозы является Дюфалак. Дюфалак в стандартных дозах широко используется как слабительное средство. При этом возрастает объем каловых масс за счет высоких адсорбционных свойств препарата и ускоряется кишечный транзит. Пребиотический эффект при такой дозировке незначителен.
С пребиотической целью детям Дюфалак назначается в низких дозах (по 1,5-2,5 мл 2 раза в день в течение 3-6 недель). Доза Дюфалака подбирается индивидуально с тем, чтобы не вызывать слабительного эффекта.
Многочисленные исследования, в том числе, проводившиеся нами, показывают, что при лечении функциональных нарушений ЖКТ на фоне терапии препаратом Дюфалак не только улучшается состав кишечной микрофлоры и спектр вырабатываемых ею КЦЖК, но и отмечается купирование клинических симптомов (нормализуется частота и консистенция стула, снижается интенсивность абдоминального болевого синдрома вплоть до его исчезновения) [11, 12].
Мы наблюдали 24 детей в возрасте от 2 до 15 лет с дисбиозом кишечника различной степени тяжести, которым в качестве пребиотика назначался Дюфалак в дозе 4-5 мл в сутки в два приема в течение 3-4 недель. У них исследовался состав фекальной микрофлоры и спектр короткоцепочечных жирных кислот в кале до начала монотерапии Дюфалаком, сразу после ее окончания и через месяц после прекращения терапии.
На фоне терапии Дюфалаком у всех детей улучшилось общее самочувствие, у большинства пациентов купировались признаки абдоминального синдрома, а у остальных значительно снизилась их интенсивность.
В лучшую сторону изменился характер стула, причем не только для 1-го и 2-го типов по Бристольской шкале, но и для 6-го типа, характеризующегося кашицеобразным стулом. Этот эффект сохранялся и через месяц после окончания терапии Дюфалаком. Нормализовалась и частота стула у большинства пациентов. Если до начала терапии у 17 детей отмечались запоры или склонность к ним, то после применения Дюфалака у большинства детей дефекация происходила каждые 24 часа, у некоторых – каждые 36 часов. Характерным явилось то, что и у пациентов с частой дефекацией (2-3 и более раз в сутки) отмечалась нормализация частоты стула до 1-2 раз в 24 часа (рис. 1).
Рисунок 1. Динамика частоты стула на фоне терапии Дюфалаком.
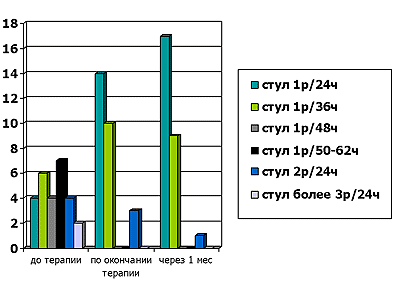
Определенная положительная динамика выявлена нами в нормализации состава фекальной микрофлоры. В начале исследования у всех детей отмечался дисбиоз различной степени: 1-й – у 6 пациентов, 2-й – у 17, 3-й – у 4 детей. На фоне терапии Дюфалаком нормализовался состав фекальной микрофлоры у 5 детей с 1-й степенью дисбиоза, а у остальных – значительно улучшился, причем 3-й степени нами не было выявлено вовсе. Позитивные изменения фекальной микрофлоры сохранились и через месяц после окончания терапии Дюфалаком. Так, нормальные показатели фекальной микрофлоры мы констатировали у 13 человек, а доля дисбиоза 2-й степени снизилась по сравнению с показателями во 2-й точке исследования сразу после курса Дюфалака (рис. 2).
Рисунок 2. Динамика состава микрофлоры на фоне терапии Дюфалаком
(степени нарушений кишечной микрофлоры – по А.В.Куваевой).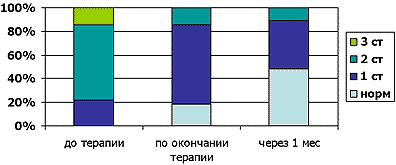
У большинства пациентов до лечения Дюфалаком отмечалось снижение абсолютного содержания отдельных короткоцепочечных жирных кислот и их суммарного количества в кале, что свидетельствовало как о нарушении утилизации данных кислот колоноцитами, вследствие измененной моторно-эвакуаторной функции кишечника, так и могло являться следствием измененной активности и численности различных популяций микроорганизмов индигенной толстокишечной микрофлоры.
После проведенного курса лечения отмечалась тенденция к нормализации абсолютного содержания уксусной, пропионовой и масляной кислот, вносящих основной вклад в общий пул КЖК (рис.3). Данный факт свидетельствовал о восстановлении функциональной активности и численности толстокишечной микрофлоры, вследствие нормализации моторно-эвакуаторной функции кишечника, что соотносится с динамикой клинических симптомов.
Рисунок 3. Динамика короткоцепочечных жирных кислот в кале на фоне лечения низкими дозами Дюфалака.
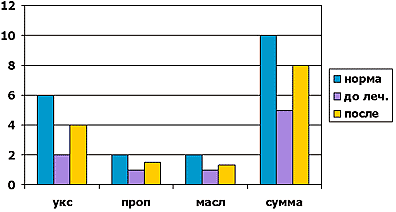
Исходно у наших пациентов отмечалось достоверное повышение относительного содержания пропионовой и масляной кислот при снижении доли уксусной кислоты, что явилось следствием повышения численности и активности анаэробного звена микрофлоры, представленного в основном популяциями микроорганизмов родов Bacteroides, Clostridium, эубактерий, фузобактерий и др. (в основном их факультативных и условно-патогенных штаммов). После курса лечения отмечено формирование нормального профиля содержания КЖК, т.е. происходило восстановление активности и численности облигатных штаммов микроорганизмов (в частности представителей молочнокислой флоры (бифидо- и лактобактерий), облигатных штаммов бактероидов и т.д.).
Таким образом, на фоне приема низких доз Дюфалака происходило не только улучшение клинических показателей, частоты и характера стула, но отмечались положительные изменения толстокишечного микробиоценоза, выражающиеся в нормализации состава фекальной микрофлоры, снижении активности условно-патогенных анаэробов (в частности протеолитических и гемолитических штаммов). В результате терапии Дюфалаком значительно изменялась внутриполостная среда толстой кишки, которая обеспечивает условия для нормальной и эффективной жизнедеятельности облигатной микрофлоры, нормализовался баланс аэробно/анаэробных популяций микроорганизмов, что подтверждалось изменением состава и спектра КЖК.
Очевидно, что лактулоза оказывает значительный пребиотический эффект и может использоваться в качестве монотерапии дисбиозов кишечника легкой степени, а при более тяжелых нарушениях кишечной микрофлоры - в сочетании с другими препаратами. Причем эти эффекты длительно сохраняются и после прекращения терапии Дюфалаком.
Таким образом, развитие функциональных нарушений моторики ЖКТ тесно связано как с нарушением нервно-гуморальной регуляции, так и состоянием микробиоценоза кишечника. Микрофлора ЖКТ, вырабатывая КЦЖК и другие метаболиты, оказывает выраженное влияние на моторику кишечника. Поэтому в комплексную терапию функциональных дискинезий ЖКТ должны включаться препараты, нормализующие состав и функционирование кишечной микрофлоры, в том числе, и пребиотики.
Литература
- Эволюционные и сравнительно-физиологические аспекты микрофлоры. В кн.: Микрофлора пищеварительного тракта (под редакцией А.И. Хавкина) – М.: Фонд социальной педиатрии, 2006, с.18-28.
- Ардатская М.Д. Клиническое значение короткоцепочечных жирных кислот при патологии желудочно-кишечного тракта.// Докт. диссер., М., 2003, 230с.
- Малкоч А.В., Бельмер С.В. Кишечная микрофлора и значение пребиотиков для ее функционирования.// Лечащий врач, 2006.-№4.-стр.60-65.
- Topping D.I., Clifton P.M. Short-Chain Fatty Acids and Human Colonic Function: Roles of Resistant Starch and Nonstarch Polysaccharides.// Physiological Reviews.- 2001.- Vol. 81.- No. 3.- P.1031-1064.
- Midtvedt AC, Midtvedt T. Production of short chain fatty acids by the intestinal microflora during the first 2 years of human life.// J Pediatr Gastroenterol Nutr.- 1992.- Vol.15.- N4.- P.395-403.
- Parrett A M, Edwards C A.In vitro fermentation of carbohydrate by breast fed and formula fed infants.// Archives of Disease in Childhood.- 1997.- N76.- P.249–253.
- Cherbut C., Ferrier L., Roze C., Anini Y., Blottiere H., Lecannu G., Galmiche J.-P. Short-chain fatty acids modify colonic motility through nerves and polypeptide YY release in the rat.// Am J Physiol Gastrointest Liver Physiol.- 1998.- Vol.275.- Issue 6.- P.G1415-G1422.
- Fukumoto S., Tatewaki M., Yamada T., Fujimiya M., Mantyh C., Voss M., Eubanks S., Harris M., Pappas T.N., Takahashi T. Short-chain fatty acids stimulate colonic transit via intraluminal 5-HT release in rats..// Am J Physiol Regul Integr Comp Physiol.- 2003.- Vol.284.- Issue 5.- P.R1269-R1276.
- Sandle G.I. Salt and water absorption in the human colon: a modern appraisal.// Gut.- 1998.- Vol.43.- P.294–299.
- Ардатская М.Д., Минушкин О.Н., Иконников Н.С. «Дисбактериоз» кишечника: понятие, диагностические подходы и пути коррекции. Возможности и преимущества биохимического исследования кала., 2004, Москва, 57с.
- Малкоч А.В., Бельмер С.В., Ардатская М.Д., Минушкин О.Н. Значение пребиотиков для функционирования кишечной микрофлоры: клинический опыт применения препарата Дюфалак (лактулоза).// Детская гастроэнтерология, 2006.-№5.-стр.35-41.
- Малкоч А.В., Бельмер С.В., Ардатская М.Д., Минушкин О.Н., Смирнова К.А. Показатели короткоцепочечных жирных кислот у детей с кишечным дисбиозом на фоне терапии лактулозой.// Вопросы детской диетологии, 2007.-т.5.-№1.-стр.72-73.
| Июнь 2010 г. |