ИНСТРУКЦИЯ
по медицинскому применению препаратаСТЕЛАРА® (STELARA®)
Регистрационный номер - ЛП-001104Торговое название - Стелара®
Международное непатентованное название (МНН) - устекинумаб
Лекарственная форма - раствор для подкожного введения
Состав
Активный компонент: Один заполненный шприц содержит 45 мг (45 мг/0,5 мл) или 90 мг (90 мг/1,0 мл) устекинумаба.
Вспомогательные вещества:
Для дозировки 45 мг/0,5 мл: сахароза - 38 мг, L-гистидин (в том числе L-гистидина гидрохлорида моногидрат) - 0,5 мг, полисорбат 80 - 0,02 мг, вода для инъекций - до 0,5 мл.
Для дозировки 90 мг/1,0 мл: сахароза - 76 мг мг, L-гистидин (в том числе L-гистидина гидрохлорида моногидрат) - 1,0 мг, полисорбат 80 - 0,04 мг, вода для инъекций - до 1,0 мл.Описание
Прозрачный или слегка опалесцирующий раствор от бесцветного до светло-желтого цвета. Раствор может содержать единичные прозрачные частицы белка.Фармакотерапевтическая группа - псориаза средство лечения.
Код АТХ: L04AC05
Фармакологические свойства
Фармакодинамика
Механизм действия
Устекинумаб представляет собой полностью человеческие моноклональные антитела класса IgGlk с молекулярным весом около 148600 дальтон, продуцируемые рекомбинантной клеточной линией и проходящие многоступенчатую очистку, включая инактивацию и удаление вирусных частиц. Устекинумаб обладает высокой специфичностью к субъединице р40 интерлейкинов (ИЛ) человека ИЛ-12 и ИЛ-23.
Препарат блокирует биологическую активность ИЛ-12 и ИЛ-23, предотвращая связывание p40 с рецептором ИЛ-12R-β1, экспрессируемым на поверхности иммунных клеток. Устекинумаб не может связываться с ИЛ-12 и ИЛ-23, уже связанными с рецептором ИЛ-12R-β1. Поэтому препарат вряд ли будет воздействовать на комплемент- или антитело-зависимую цитотоксичность клеток, репрессирующих рецепторы к ИЛ-12 и/или ИЛ-23.
ИЛ-12 и ИЛ-23 являются гетеродимерными цитокинами, которые секретируются активированными антиген-презентирующими клетками, в частности, макрофагами и дендритными клетками. ИЛ-12 активирует NK-клетки, стимулирует дифференциацию CD4+ Т-клеток до Т-хелперов 1 (Th 1), а также усиливает выработку интерферона гамма (ИФНγ). ИЛ-23 стимулирует образование Т-хелперов 17 (Тh 17) и увеличивает секрецию ИЛ-17А, ИЛ-21 и ИЛ-22. Уровни ИЛ-12 и ИЛ-23 повышены в крови и коже у пациентов с псориазом. Концентрация ИЛ 12/23р40 в сыворотке крови является фактом дифференциации пациентов с псориатическим артритом, что подтверждает участие ИЛ-12 и ИЛ-23 в патогенезе псориатических заболеваний. Полиморфизм генов, кодирующих ИЛ-23А, ИЛ-23R и ИЛ-12В, определяет предрасположенность к таким заболеваниям. Гены ИЛ-12 и ИЛ-23 имеют повышенную экспрессию в пораженной псориазом коже, и обусловленная ИЛ-12 выработка ИФНγ прямо пропорциональна выраженности псориатического заболевания. Чувствительные к ИЛ-23 Т-клетки обнаруживались в энтезисах на мышиных моделях воспалительного артрита, в которых ИЛ-23 - вызывал энтезиальное воспаление.
Препарат Стелара® проявляет клиническую эффективность при псориазе и псориатическом артрите, посредством связывания субъединицы р40 ИЛ-12 и ИЛ-23 и нарушения выработки цитокинов Тh1 и Тh17, которые являются ключевыми звеньями патогенеза данных заболеваний.
Фармакодинамика
Применение препарата Стелара® приводит к значительному ослаблению гистологических проявлений псориаза, включая гиперплазию и пролиферацию клеток эпидермиса. Эти данные согласуются с клинической эффективностью. У пациентов с псориазом и/или псориатическим артритом устекинумаб не оказывает существенного влияния на соотношение циркулирующих в крови иммунных клеток, включая клетки памяти и неактивированные Т-клетки, а также на концентрацию цитокинов в крови. Концентрация системных маркеров воспаления у пациентов, принимающих устекинумаб, находится в пределах нормы, а показатели 4 маркеров (MDC, VEGF, MCSF-1 b YKL-40) незначительно отличаются у пациентов, принимающих препарат Стелара®, по сравнению с группой плацебо.
Анализ мРНК, выделенной из биопсийных образцов кожных очагов псориаза исходно и через 2 недели лечения, показал, что применение препарата Стелара® приводило к снижению экспрессии генов, кодирующих его молекулярные мишени - ИЛ-12 и ИЛ-23, а также генов, кодирующих воспалительные цитокины и хемокины -моноцитарный хемотаксический фактор (МСР)-1, фактор некроза опухоли (TNF)-альфа, интерферон-гамма - индуцибельный белок (IP)-10 и ИЛ-8. Эти данные согласуются со значительным клиническим эффектом лечения у пациентов с псориазом.
Клинический эффект лечения псориаза и псориатического артрита, по-видимому, зависит от концентрации устекинумаба в плазме крови. У пациентов с псориазом с лучшим результатом по шкале оценки площади и тяжести псориаза PASI среднее значение концентрации устекинумаба в плазме крови было выше, чем у больных с меньшим клиническим эффектом. В целом, доля больных, у которых улучшение по шкале PASI достигало 75%, увеличивалась по мере повышения концентрации устекинумаба в плазме крови. У пациентов с псориатическим артритом, достигших оценки ACR 20, наблюдается более высокая средняя концентрация устекинумаба в плазме крови по сравнению с пациентами, не ответившими на лечение. Число пациентов с псориатическим артритом, достигших улучшения по шкале ACR 20 и ACR 50, увеличивалось по мере повышения концентрации устекинумаба в плазме крови.
Иммунизация
В долгосрочном клиническом исследовании 3 фазы у пациентов, получавших препарат Стелара® по крайней мере 3,5 года развивался иммунный ответ, схожий с таковым у контрольной группы пациентов, больных псориазом, но не проходящих систематического лечения, при введении вакцины, содержащей пневмококковый полисахарид или противостолбнячной вакцины.
У примерно одинакового количества (%) пациентов, получающих лечение препаратом Стелара®, и пациентов из контрольной группы достигалась защитная концентрация противопневмококковых и противостолбнячных антител. Титры антител также были примерно одинаковы.
Фармакокинетика
Всасывание
Среднее время достижения максимальной концентрации в плазме крови (Tmax) после однократного подкожного введения 90 мг устекинумаба здоровым добровольцам cоставляло 8,5 дня. У больных псориазом эта величина при дозах препарата 45 или 90 мг была сопоставима с таковой у здоровых добровольцев.
Абсолютная биодоступность устекинумаба после однократного подкожного введения больным псориазом составила 57,2%.
Распределение
Среднее значение объема распределения устекинумаба в терминальной фазе выведения после однократного внутривенного введения больным псориазом колебалось от 57 до 83 мл/кг.
Метаболизм
Метаболический путь устекинумаба не известен.
Выведение
Средняя величина системного клиренса устекинумаба после однократного внутривенного введения больным псориазом колебалась от 1,99 до 2,34 мл/сут/кг.
Средний период полувыведения (Т1/2) устекинумаба у больных псориазом и/или псориатическим артритом составлял примерно 3 недели, и в разных исследованиях варьировал от 15 до 32 дней.
Линейность
Системная экспозиция устекинумаба (Cmax и площадь под кривой "концентрация-время", AUC) у пациентов с псориазом увеличивалась пропорционально введенным дозам после однократного внутривенного введения доз в диапазоне от 0,09 мг/кг до 4,5 мг/кг, а также после однократного подкожного введения доз в диапазоне от 24 мг до 240 мг.
Изменение концентраций устекинумаба в плазме крови с течением времени после однократных или многократных повторных введений препарата было в основном предсказуемо. Равновесная концентрация устекинумаба в плазме крови достигается к 28-й неделе при предложенном режиме терапии (вторая инъекция 4 недели спустя после первого применения, затем каждые 12 недель). В среднем, равновесная концентрация препарата у пациентов с псориазом составляет 0,21-0,26 мкг/мл для дозы 45 мг и 0,47-0,49 мкг/мл для дозы 90 мг. Кумуляции препарата в сыворотке крови не наблюдалось на протяжении лечения при режиме дозирования 1 инъекция каждые 12 недель.
Влияние массы тела пациента на фармакокинетику препарата
Концентрация препарата в плазме крови зависит от массы тела пациента с псориазом и/или псориатическим артритом. При введении одинаковых доз (45 мг или 90 мг), у пациентов с массой тела более 100 кг средняя концентрация устекинумаба в плазме была меньше, чем у пациентов с массой тела менее 100 кг. Однако, средняя минимальная концентрация устекинумаба в плазме крови пациентов с массой тела более 100 кг, которым вводили 90 мг препарата, была сравнима с таковой в группе пациентов с массой тела менее 100 кг, которым вводили 45 мг препарата.
Популяционный фармакокинетический анализ
Кажущийся клиренс (CL/F) и объем распределения (V/F) составляли 0,465 л/сут и 15,7 л, соответственно, по данным, полученных у пациентов с псориазом. Период полувыведения (Т1/2) препарата составлял примерно 3 недели. Пол, возраст и принадлежность к той или иной расе не влияли на кажущийся клиренс устекинумаба. На кажущийся клиренс (CL/F) препарата влияла масса тела пациентов, при этом у пациентов с большей массой тела величина CL/F была больше. Средний кажущийся клиренс у пациентов с массой тела более 100 кг был примерно на 55% выше такового у пациентов с меньшей массой тела. Объем распределения (V/F) у пациентов с массой тела более 100 кг был примерно на 37% выше такового у пациентов с меньшей массой тела.
Аналогичные результаты получены при подтверждающем анализе популяционных данных среди пациентов с псориатическим артритом.
Было проанализировано влияние коморбидных состояний (сахарный диабет, артериальная гипертензия, гиперлипидемия) на фармакокинетику препарата у пациентов с псориазом. У пациентов с сахарным диабетом величина CL/F была в среднем на 29% выше, чем у здоровых пациентов.
Популяционный фармакокинетический анализ показал, что существует тендеция увеличения клиренса устекинумаба у пациентов с положительным иммунным ответом.Данные о фармакокинетике препарата у пациентов с почечной или печеночной недостаточностью отсутствуют.
Популяционный фармакокинетический анализ среди пациентов старше 65 лет не выявил влияния возраста на величины кажущегося клиренса (CL/F) и объема распределения (V/F). Применения алкоголя и табака не влияло на фармакокинетику устекинумаба.Показания
Лечение пациентов старше 18 лет со средней или тяжелой степенью бляшечного псориаза.
Лечение пациентов старше 18 лет с активным псориатическим артритом (ПсА) в качестве монотерапии или в комбинации с метотрексатом.Противопоказания
Клинически значимая повышенная чувствительность к устекинумабу или любому вспомогательному веществу препарата; Детский,возраст (до 18 лет); Беременность и лактация; Серьезные инфекционные заболевания в острой фазе, в том числе туберкулез; Злокачественные новообразования. С осторожностью
Хронические или рецидивирующие паразитарные и инфекционные заболевания вирусной, грибковой или бактериальной природы. Злокачественные опухоли в анамнезе. Пожилой возраст. Применение во время беременности и лактации
Беременность
В ходе изучения препарата животным вводили дозу в 45 раз превышающую рекомендованную клиническую дозу для человека, при этом не было выявлено явлений тератогенности, врожденных аномалий или отставании в развитии. Однако результаты исследований на животных не всегда применимы к человеку.
Неизвестно, может ли устекинумаб при применении у беременных женщин привести к неблагоприятному влиянию на плод или повлиять на репродуктивную функцию. Адекватных и строго контролируемых исследований у беременных женщин не проводилось.
Не рекомендуется применять препарат во время беременности, должны быть использованы эффективные методы контрацепции во время и 15 недель после лечения препаратом.
Лактация
Исследования на обезьянах показали, что устекинумаб выделяется с грудным молоком. Неизвестно, абсорбируется ли препарат системно после всасывания. Поскольку многие препараты и иммуноглобулины выделяются с грудным молоком, и поскольку препарат Стелара® может вызывать неблагоприятные реакции у грудных детей, следует принять решение о прекращении грудного вскармливания в период приема препарата или об отмене терапии устекинумабом.Способ применения и дозы
Препарат Стелара® предназначен для подкожных инъекций у пациентов старше 18 лет.
Бляшечный псориаз Рекомендованная доза составляет 45 мг. Вторую инъекцию делают 4 недели спустя после первого применения, затем каждые 12 недель.
У пациентов с массой тела более 100 кг препарат рекомендуется использовать в дозе 90 мг.
При неэффективности терапии в течение 28 недель рекомендуется рассмотреть целесообразность применения препарата.
Коррекция дозы
Пациентам, у которых клиническая эффективность препарата при применении каждые 12 недель выражена недостаточно, следует увеличить дозу препарата до 90 мг каждые 12 недель. В случае если такой режим дозирования не эффективен, дозу препарата 90 мг следует вводить каждые 8 недель.
Возобновление лечения
Возобновление лечения по предложенной схеме - вторая инъекция через 4 недели спустя после первого применения, а затем каждые 12 недель - было так же эффективно, как и впервые проводимая терапия.
Псориатический артрит Рекомендованная доза составляет 45 мг. Вторую инъекцию делают 4 недели спустя после первого применения, затем каждые 12 недель. У пациентов с массой тела более 100 кг препарат рекомендуется использовать в дозе 90 мг.
Применение у пожилых больных (старше 65 лет)
Из 4031 пациентов, принимавших препарат Стелара®, 248 являлись пациентами в возрасте старше 65 лет (183 пациента с псориазом и 65 - с псориатическим артритом). В ходе клинических исследований не было выявлено влияния возраста на клиренс или объем распределения препарата. Несмотря на то что в ходе исследований препарата не было выявлено различий в безопасности и эффективности препарата для пожилых пациентов старше 65 лет по сравнению с более молодыми пациентами, число пожилых пациентов недостаточно для окончательного вывода о влиянии возраста (дли об отсутствии влияния) на клиническую эффективность.
Применение у детей
Безопасность и эффективность устекинумаба у детей не изучалась.
Применение при почечной и печеночной недостаточности
Изучения препарата у пациентов с почечной или печеночной недостаточностью не проводилось.Указания по введению препарата
Препарат предназначен для подкожного введения.
Перед введением препарата внимательно осмотрите содержимое шприца. Раствор может быть прозрачным или слегка опалесцирующим от бесцветного до светло-желтого цвета, может содержать единичные прозрачные частицы белка. Такой внешний вид является нормальным для белковых растворов. При изменении цвета, помутнении или наличии твердых частиц раствор использовать нельзя. Устекинумаб не содержит консервантов, поэтому любой неиспользованный остаток препарата в шприце использовать нельзя.
Препарат не следует смешивать с другими жидкостями для инъекции. Если для введения дозы 90 мг используют 2 шприца по 45 мг препарата, следует сделать 2 последовательные инъекции. При этом вторая инъекция должна быть сделана сразу же после первой. Инъекции следует делать в разные области. Не встряхивайте препарат. Длительное энергичное встряхивание может повредить препарат. Не используйте препарат, если его встряхивали. В начале лечения инъекции препарата Стелара® должен делать только медицинский персонал, однако, в последующем, если врач сочтет это возможным, пациент может делать себе инъекции препарата Стелара® самостоятельно, соблюдая все необходимые предосторожности и пройдя предварительно обязательное обучение технике подкожных инъекций, с последующим контролем врача.
Рекомендованными местами для инъекции являются верхняя часть бедра или область живота примерно 5 см ниже пупка. Также можно использовать область плеча (см. Рис 1). Следует избегать инъекций в область, пораженную псориазом.
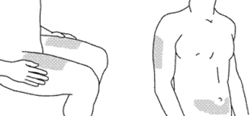 Рис. 1 Рекомендованные места для инъекции
Рис. 1 Рекомендованные места для инъекцииПеред введением препарата внимательно осмотрите содержимое флакона. Раствор должен быть опалесцирующим от бесцветного до светло-желтого цвета, может содержать единичные прозрачные частицы белка. При изменении цвета, помутнении или наличии твердых частиц раствор использовать нельзя.
Тщательно вымойте руки и обработайте место инъекции ватным тампоном, смоченным антисептиком.
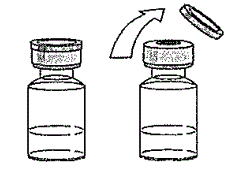 Рис. 2 Шприц с препаратом Стелара
Рис. 2 Шприц с препаратом СтелараСнимите защитный колпачок с флакона с препаратом (Рис. 2). Не снимайте резиновый колпачок. Протрите резиновый колпачок ватным тампоном, смоченным антисептиком. Снимите защитный колпачок с иголки шприца (шприц не входит в комплект упаковки препарата). Не допускайте контакта иголки с посторонними предметами и не трогайте иголку.
Поставьте флакон с препаратом на ровную поверхность и воткните иглу шприца в резиновый колпачок флакона. Переверните флакон с препаратом и воткнутым в него шприцом как это показано на рисунке 3.
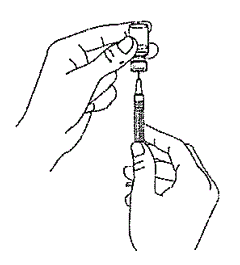 Рис. 3.
Рис. 3.Наберите содержимое флакона в шприц.
Во избежание попадания пузырьков воздуха в шприц, кончик иглы, пока вы набираете препарат в шприц, всегда должен находиться в жидкости.
Выньте шприц из флакона. Держите шприц иголкой в направлении от себя и проверьте наличие в нем пузырьков воздуха. При наличии пузырьков воздуха в шприце осторожно постучите по стенке шприца, пока пузырьки воздуха не переместятся вверх (Рис.4).
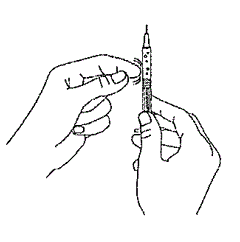 Рис. 4.
Рис. 4.Надавите на поршень шприца, чтобы выпустить пузырьки воздуха. Не кладите шприц и не допускайте контакта иглы с посторонними предметами.
Аккуратно зажмите кожу в области инъекции между большим и указательным пальцами, воткните иголку в кожу и медленно опустите поршень шприца до предела (Рис.5).
 Рис. 5.
Рис. 5.После этого отпустите кожу и осторожно выньте иглу. Из места инъекции может выделиться небольшое количество крови. Это нормально. Приложите ватный тампон, смоченный антисептиком, к месту инъекции и подержите несколько секунд. Не трите место инъекции. При необходимости заклейте пластырем.
Использованный шприц необходимо утилизировать в соответствии с местными требованиями по уничтожению такого рода отходов. Никогда не используйте иглы повторно.Побочные эффекты
Наиболее частыми неблагоприятными явлениями (>5%) в контролируемых и не контролируемых клинических исследованиях применения препарата при псориазе и псориатическом артрите были назофарингит, головная боль и инфекции верхних дыхательных путей. Большинство этих явлений были умеренно выраженными и не требовали прекращения лечения.
Побочные действия препарата систематизированы относительно каждой из систем органов в зависимости от частоты встречаемости, с использованием следующей классификации: очень часто очень часто (≥1/10), часто (≥1/100, <1/10), нечасто (≥1/1000, <1/100), редко (≥1/10000, <1/1000), очень редко (<1/10000), включая единичные случаи.
Инфекции:
Часто: одонтогенные инфекции, инфекции верхних дыхательных путей, назофарингит.
Нечасто: воспаление подкожной жировой клетчатки, опоясывающий лишай, вирусные инфекции верхних дыхательных путей.
В плацебо-контролируемых исследованиях у больных с псориазом и/или псориатическим артритом частота инфекции и серьезной инфекции при применении препарата Стелара® и плацебо была одинакова (частота инфекции - соотв. 1,27 и 1,17 случая на человеко-год лечения, частота серьезных инфекций - соотв. 0,01 (5/616) и 0,01 (4/287) случая на человеко-год лечения).
В ходе контролируемых и неконтролируемых клинических исследований у пациентов с псориазом и псориатическим артритом частота инфекций при применении препарата Стелара® составляла 0,87 случая на человеко-год лечения. Частота возникновения серьезной инфекции составляла 0,01 случая на человеко-год лечения (104/9548). Серьезные инфекции включали дивертикулит, воспаление подкожной жировой клетчатки, аппендицит, холецистит и сепсис.
Психические нарушениях
Нечасто: депрессия.
Со стороны центральной нервной системы:
Часто: головокружение, головная боль.
Со стороны дыхательной системы:
Часто: боль в горле и гортани.
Нечасто: заложенность носа.
Со стороны желудочно-кишечного тракта:
Часто: диарея, рвота.
Со сторон кожи и подкожных тканей:
Часто: зуд.
Со стороны костно-мышечной системы:
Часто: боль в спине, миалгия, артралгия.
Общие расстройства и реакции в месте введения:
Часто: усталость, эритема в месте введения, боль в месте введения.
Нечасто: реакции в месте введения (включая кровоизлияние, гемотому, уплотнение, припухлость и зуд).
Злокачественные опухоли
В 3-х клинических плацебо-контролируемых исследованиях у больных с псориазом и псориатическим артритом частота развития злокачественных опухолей (не включая немеланомную форму рака кожи) у пациентов, получавших устекинумаб и плацебо, составляла соотв. 0,16 (1/615) и 0,35 (1/287) случая на 100 человек/год. Частота развития иных, чем меланома, форм рака кожи при применении препарата Стелара® и плацебо составляла соотв. 0,65 (4/615) и 0,70 (2/287) случая на 100 человек/год. Частота развития злокачественных опухолей у больных, получавших препарат Стелара®, была сравнима с частотой возникновения опухолей среди населения в целом.
Наиболее часто, помимо немеланомного рака кожи, наблюдались злокачественные опухоли простаты, кишечника, молочных желез и меланома.
Частота развития немеланомного рака кожи у пациентов, получавших препарат Стелара®, составляла 0,61 случаев на 100 человек/год (41/6770).
Реакции гиперчувствительности
В клинических исследованиях сыпь и крапивница наблюдались менее чем у 1 % больных.
Иммуногенность
Примерно у 6% пациентов с псориазом и псориатическим артритом, получавших препарат Стелара®, формировались антитела к устекинумабу, которые обычно имели низкий титр. Явной корреляции между формированием антител и наличием реакций в месте инъекции не обнаружено. При наличии - антител к устекинумабу пациенты чаще имели более низкую эффективность препарата, хотя наличие антител не исключает достижения клинического эффекта. Большинство пациентов с псориазом, имевших антитела к устекинумабу, обладали также и нейтрализующими такие антитела антителами.
Со стороны иммунной системы:
Нечасто: реакции гиперчувствительности (включая сыпь и крапивницу);
Редко: серьезные реакции гиперчувствительности (включая анафилаксию и ангионевротический отек).
Со стороны кожи и подкожных тканей:
Нечасто: бляшечный псориаз.Передозировка
Во время проведения клинических исследований пациентам однократно внутривенно вводили дозы до 6 мг/кг без развития дозолимитирующей токсичности. В случае передозировки рекомендуется контролировать состояние больного для выявления признаков и симптомов побочных эффектов и при их развитии следует немедленно начинать соответствующую симптоматическую терапию.Взаимодействия
Исследования лекарственного взаимодействия на людях не проводились.
Эффекты ИЛ-12 и ИЛ-23 на ферменты CYP450 были изучены in vitro на гепатоцитах человека. Исследование показало, что ИЛ-12 и/или ИЛ-23 в концентрации 10 нг/мл не влияли на ферменты CYP450 (CYP1A2, 2B6, 2C9, 2C19, 2D6 или 3A4). Полученные результаты не предполагают необходимости коррекции дозы у пациентов, принимающих одновременно с препаратом Стелара® препараты, метаболизируемые ферментам CYP450.
Не следует применять вакцины, содержащие ослабленные возбудители инфекционных заболеваний, одновременно с устекинумабом.
При совместном применении препарата Стелара® и таких препаратов, как парацетамол (ацетаминофен), ибупрофен, ацетилсалициловая кислота, метформин, аторвастатин, напроксен, левотироксин и гидрохлоротиазид взаимодействия не было выявлено.
Безопасность и эффективность совместного применения препарата Стелара® с другими иммунодепрессантами (метотрексат, циклоспорин) или биологическими препаратами для лечения псориаза не была оценена.Особые указания
Инфекции
Устекинумаб является селективным иммунодепрессантом и может повышать риск развития инфекций и реактивации инфекций, находящихся в латентной фазе.
В клинических исследованиях при применении препарата Стелара® у больных наблюдались серьезные бактериальные, грибковые и вирусные инфекции. Устекинумаб не следует применять у больных с клинически значимыми, активными инфекциями.
Следует проявлять осторожность при применении препарата у больных с хроническими инфекциями или наличием рецидивирующих инфекций в анамнезе.
Перед началом применения препарата следует провести тестирование больного на наличие туберкулеза. Не следует применять устекинумаб у больных с активным туберкулезом. При наличии латентного или активного туберкулеза (в том числе в анамнезе) следует начать его лечение до начала применения препарата Стелара®. Также следует начать лечение туберкулеза у больных, у которых достаточный эффект от его предыдущего лечения не подтвержден. В период лечения устекинумабом и после этого следует тщательно наблюдать за больными для выявления признаков и симптомов активного туберкулеза.
Больных следует предупредить о необходимости обращения к врачу при появлении признаков и симптомов, позволяющих предположить инфекцию. При развитии серьезной инфекции применение препарата Стелара® необходимо отменить, пациент должен находиться под контролем медицинского персонала. Не следует применять устекинумаб до окончания лечения инфекции.
Злокачественные новообразования
Препарат Стелара® является селективным иммунодепрессантом. Иммунодепрессанты могут повышать риск развития злокачественных опухолей. У некоторых больных, получавших устекинумаб в клинических исследованиях, наблюдалось возникновение злокачественных новообразований (кожных и некожных форм).
Применение препарата Стелара® не было изучено у пациентов со злокачественными опухолями в анамнезе. Следует проявлять осторожность при назначении препарата пациентам со злокачественными опухолями в анамнезе, а также при рассмотрении продолжения лечения препаратом Стелара® пациентов с диагностированными злокачественными новообразованиями.
У всех пациентов в возрасте старше 60 лет, а также у пациентов ранее получавших длительную терапию иммунодепрессантами или УФ-излучением, необходимо проводить обследование на наличие немеланомного рака кожи.
Реакции гиперчувствительности
В пострегистрационном применении препарата Стелара® известны случаи возникновения серьезных реакций гиперчувствительности, включая ангионевротический отек и анафилаксию. При развитии анафилактических и других серьезных реакций гиперчувствительности применение устекинумаба следует немедленно прекратить, и следует назначить соответствующее лечение.
Вакцинация
Не следует проводить вакцинацию пациента живыми вакцинами в период лечения препаратом Стелара®, а также в период 15 недель до вакцинации (после приема последней дозы препарата Стелара®) и 2 недели после вакцинации.
Данные по вторичному инфицированию при применении живых вакцин у пациентов, получающих препарат Стелара®, отсутствуют. Следует соблюдать осторожность при применении живых вакцин для иммунизации членов семьи пациента, получающего лечение препаратом Стелара®, поскольку имеется риск вирусо- или бактериовыделения и передачи инфекции от этих лиц больным.
Длительное лечение препаратом Стелара® не подавляет гуморальный иммунный ответ на на вакцины, содержащие пневмококковый полисахарид и противостолбнясную вакцину.
Вместе с устекинумабом можно применять вакцины, содержащие инактивированные микроорганизмы, однако индуцированный иммунный ответ может быть недостаточным, чтобы предотвратить заболевание.
Сопутствующая иммуносупрессивная терапия
Безопасность и эффективность применения препарата Стелара® в комбинации с иммунодепрессивными препаратами и фототерапией не изучалась в исследованиях у пациентов с псориазом. В ходе исследований у пациентов с псориатическим артритом совместное применение с метотрексатом не влияло на безопасность и эффективность препарата Стелара®. Следует проявлять осторожность при рассмотрении возможности одновременного применения других иммунодепрессантов и устекинумаба, а также при переходе с терапии другим противопсориазным биологическим препаратом на терапию устекинумабом.
Иммунотерапия
Безопасность и эффективность применения препарата Стелара® у пациентов, прошедших иммунотерапию аллергических заболеваний не установлена. Следует соблюдать осторожность у пациентов, получающих в настоящее время или прошедших иммунотерапию аллергических заболеваний, особенно анафилактических состояний.
Общее
Защитный колпачок для иглы содержит в своем составе натуральную резину (производное латекса) и при наличии гиперчувствительности к латексу может вызвать аллергические реакции.Влияние на способность управлять транспортными средствами и механизмами
Исследований не проводилось.Форма выпуска
Раствор для подкожного введения 90 мг/мл.
По 0,5 мл или 1,0 мл в шприцы из боросиликатного стекла (тип I) с устройством UltraSafe Passive®.
Каждый шприц содержит 45 мг (45 мг/0,5 мл) или 90 мг (90 мг/1,0 мл) устекинумаба.
По 1 шприцу вместе с инструкцией по медицинскому применению помещают в пачку картонную.Условия хранения
Хранить в оригинальной упаковке в защищенном от света месте при температуре от 2 до 8 °С. Не замораживать.
Не встряхивать. Хранить в недоступном для детей месте.Срок годности
18 месяцев.
Не использовать после истечения срока годности.Условия отпуска
Отпускается по рецепту.Держатель регистрационного удостоверения и организация, принимающая претензии:
ООО "Джонсон & Джонсон", Россия, 121614, Москва, ул. Крылатская, 17/2;Производитель
Силаг АГ, Хохштрассе 201, Шаффхаузен СН-8205, Швейцария.
или
Бакстер Фармасьютикал Солюшнз ЛЛС, 927 С Карри Пайк Блумингтон, ИН 47403, США.Первичная и вторичная упаковка, выпускающий контроль качества
Силаг АГ, Швейцария.Стелара
Август 2013 г.