Опубликовано в :
«ПСИХИАТРИЯ И ПСИХОФАРМАКОТЕРАПИЯ » »» Том 12 №6
Терапия тяжелой рекуррентной депрессии
Е.Ю.Антохин
ГОУ ВПО Оренбургская государственная медицинская академия Росздрава
Введение
Рекуррентная депрессия (РД) является распространенным заболеванием, которое встречается у 15-25% женщин и 6-12% мужчин [1-3]. Часто у больных РД возникают повторные приступы (более трех), которые наблюдаются у 86,1% пациентов, причем у 10,5% отмечается 10 депрессивных приступов и более [1, 4]. Имеется неблагоприятная прямая зависимость между числом эпизодов заболевания (фаз) и риском развития его рецидива [5]. От 30 до 50% больных не достигают интермиссии при инициальной терапии [6] или имеют остаточные симптомы [7, 8]. Следствием этого может быть довольно выраженная социальная дезадаптация с низкой самооценкой показателей здоровья [9]. Соответственно, лечение РД нередко представляет серьезные трудности в силу развития резистентности. Как отмечает проф. А.С.Аведисова, «более чем пятидесятилетняя история развития психофармакологии позволяет многим исследователям сделать достаточно пессимистический вывод о том, что удивительная, так называемая золотая декада психофармакологии (1950-1960-е годы) не повторится» [10]. Тем не менее распространенность применения антидепрессантов, особенно широкое внедрение в практику не только психиатров генераций антидепрессантов II и III поколений, косвенно свидетельствует об их несомненной эффективности при лечении депрессий [10-18].
Опыт терапии депрессии антидепрессантами, в частности селективными ингибиторами обратного захвата серотонина (СИОЗС), норадреналина (СИОЗН), способствовал укреплению позиций моноаминовой теории аффективной патологии, а также развитию классификационных подходов к депрессии, основанных на синдромах дефицита моноаминов [6, 11-14, 19-21]. Дефицит серотонина обусловливает проявления тревоги и симптомов тревожного спектра (панику, фобии), обсессивно-компульсивные расстройства, нарушения пищевого поведения (тревожные депрессии). Дефицит норадреналина проявляется трудностями концентрации внимания, двигательной заторможенностью, утомляемостью, снижением объема рабочей памяти (астенические, адинамические депрессии). Дефицит дофамина характеризуется ангедонией, уплощенностью аффекта, аспонтанностью, затруднениями когнитивных процессов и проблемно-решающего поведения (апатические, ангедонические депрессии) [12-14, 21-23]. Соответственно, определена зависимость тяжести депрессии от широты вовлеченности дефицита моноаминов: чем тяжелее депрессия, тем больше дефицит моноаминов и более вариативны симптомы. Указанный подход, несомненно, способствует дифференцированному назначению антидепрессантов в зависимости от клинической картины прежде всего легких и умеренных депрессий, обусловленных преобладанием дефицита одного или двух моноаминов. Несмотря на большой арсенал препаратов, существует потребность в антидепрессантах для лечения астенических и адинамических депрессий (дефицит норадреналина), апатических и ангедонических депрессий (дефицит дофамина) и их сочетаний [12]. Трициклические антидепрессанты (ТЦА) также усиливают трансмиссию моноаминов, но, вследствие низкой селективности и воздействия на другие рецепторы, они вызывают много побочных эффектов, что снижает комплаенс, особенно к длительной терапии [15, 16, 22, 24-26, 34]. Опыт применения СИОЗС привел к накоплению данных и по побочным эффектам данной группы препаратов, наиболее частыми из которых являются гастроинтестинальные расстройства, связанные с непрямым стимулированием серотониновых рецепторов типа 3 и 4, расположенных в головном мозге и желудочно-кишечном тракте. Кроме того, воздействие на серотониновые рецепторы типа 2А и 2С в гиппокампе и лимбической коре может привести к кратковременному учащению панических атак, усилению тревоги, нарушениям сна, а в спинном мозге - к аноргазмии, задержке эякуляции. Немаловажными симптомами, снижающими комплаенс к приему СИОЗС, особенно отмечаемыми пациентами в период формирования ремиссии, являются апатия, ангедония, анергия, когнитивные трудности. Их появление связано с воздействием на серотониновые 2А-рецепторы, расположенные в дофаминовых нейронах, в результате чего блокируется высвобождение дофамина (симптомы дефицита дофамина). Кроме того, стимуляция 2С-рецепторов, расположенных на вставочных ГАМКергических нейронах, ведет к блокировке высвобождения дофамина и норадреналина в префронтальной коре. Вследствие указанных эффектов СИОЗС не рекомендуется назначать при лечении, основная цель которого -устранение ангедонии и усиление положительного аффекта. Подавлением и положительных, и отрицательных эмоций серотонином объясняется «уплощенность» настроения, которая наблюдается у некоторых пациентов, принимающих СИОЗС [27]. Кроме того, имеются, хотя и противоречивые, данные (тем не менее отраженные в инструкциях некоторых препаратов) о влиянии СИОЗС на суицидальность. В частности, D.Gunnel и соавт. [28] отмечают повышение частоты регистрации нефатального суицидального поведения, D.Fergusson и соавт. [29] указывают на высокий риск суицида в течение первых 2 мес лечения СИОЗС. С другой стороны, I.Anderson и соавт. [30] утверждают, что в первые 2 мес после лечения флуоксетином, флувоксамином и пароксетином показатели суицидальности низкие.
Несомненный интерес вызывают нейровизуализационные и генетические исследования, которые могут объяснить развитие устойчивости к СИОЗС. Установлено, что плотность в мозге 5НТ1А-рецепторов, которые принимают участие в ингибировании по механизму обратной связи трансмиссии серотонина, увеличивается у больных с полиморфизмом гена 5НТ1А-рецепторов G(-1019) [31, 32]. Мутация гена G(-1019) рассматривается как ведущий фактор развития резистентности депрессий к терапии антидепрессантами. Экспрессию гена предположительно вызывают нарушения баланса между количеством серотонина, выделяемого в пресинаптическую щель через пресинаптическую мембрану, и серотонина, подвергающегося обратному захвату; уровнем серотонина и норадреналина в межсинаптической щели. Можно предположить, что терапия СИОЗС сопряжена с наибольшим риском экспрессии гена G(-1019) и увеличения плотности 5НТ1А-рецепторов [23, 33]. Этим можно объяснить отсутствие ответа или неполный ответ примерно у 30% больных депрессией на СИОЗС на протяжении 6-12 нед терапии [6, 8, 34].
Длительный прием ряда антидепрессантов уменьшает уязвимость мозга к стрессу, повышает нейропластичность гиппокампально-амигдалярных мозговых структур, усиливая выработку нейротрофических мозговых факторов (BDNF, CREB). В настоящее время подобные механизмы действия описаны для ТЦА, ингибиторов обратного захвата серотонина и норадреналина (ИОЗСН), тианептина и Вальдоксана [23, 35, 36].
Появление Вальдоксана с инновационным механизмом действия является продолжением развития психофармакотерапии депрессий. Вальдоксан (агомелатин) - агонист MT1, МТ2-рецепторов мелатонина и антагонист 5НТ2С-серотониновых рецепторов. В механизме действия он объединяет нейроэндокринные и моноаминергические механизмы. За счет антагонизма к 5НТ2С-рецепторам он повышает уровень в префронтальной коре норадреналина и дофамина (лечение депрессии с синдромом дефицита норадреналина и дофамина), а стимуляция мелатонинергической передачи способствует усилению антидепрессивного эффекта, анксиолитическому действию, а также восстанавливает координированную работу нарушенных циркадных ритмов и сон. Вальдоксан не повышает внеклеточные уровни 5НТ, в связи с чем не вызывает побочных эффектов, свойственных СИОЗС (тошноту, диарею, половые дисфункции, диссомнию). Кроме того, Вальдоксан не обладает аффинитетом к гистаминергическим Н1, α1-адренергическим и мускариновым рецепторам, поэтому не вызывает побочных эффектов, характерных для ТЦА [20, 38-43]. В плацебо-контролируемых исследованиях с подбором терапевтических дозировок показано, что рекомендуемая доза Вальдоксана при терапии депрессии составляет 25 мг/сут с повышением при необходимости до 50 мг/сут [40, 44-46]. Несмотря на сравнительно недавнее появление, Вальдоксан уже подвергся довольно активным клиническим исследованиям. Так, его эффективность выявлена при лечении большого депрессивного расстройства [20, 40, 41, 43-46] и в предотвращении его рецидивов [47, 48], в том числе в сравнительных исследованиях c венлафаксином [49] и пароксетином [45], при умеренных и тяжелых непсихотических депрессиях в амбулаторной и стационарной практике [38, 39, 42], при биполярном аффективном расстройстве [40, 45, 50]. Также проведен фармакоэкономический анализ действия Вальдоксана в сравнении с препаратами СИОЗС, ИОЗСН, НаССа [51]. Результаты рандомизированных контролируемых испытаний - это «золотой стандарт» качества данных, но они имеют несколько ограничений. В частности, они не всегда предоставляют непосредственные данные о том, насколько хорошо помогает лечение на практике в отличие от идеальной результативности. Применение жестких критериев включения и исключения чаще всего означает, что пациенты, участвующие в испытаниях, вряд ли соответствуют среднестатистическим пациентам, которые встречаются в клинической практике [10, 30, 52]. В рандомизированных контролируемых испытаниях акцент делается на монотерапии Вальдоксаном, но в реальной клинической практике, особенно у больных с хронической депрессией, в силу нередкой их устойчивости к антидепрессантам, применяется тактика комбинированной фармакотерапии, которая все чаще сочетается с психотерапией (комплексная терапия). Не вдаваясь в дискуссию по поводу преимуществ и недостатков (например, полипрагмазии) данного терапевтического подхода, отметим, что большинство специалистов в области психофармакотерапии и практические врачи при лечении тяжелой депрессии указывают на комбинированную терапию с сочетанием антидепрессантов, разных по механизмам действия, антидепрессантов и антипсихотиков, антидепрессантов и транквилизаторов, антидепрессантов и препаратов ноотропного ряда и др. И это также обусловлено отсутствием в настоящее время (и, видимо, в ближайшем будущем) «идеальных» препаратов (мультитаргетных) с высокими эффективностью и переносимостью [3, 9, 10, 19, 22, 23, 25, 34, 36, 41, 52-60].
В условиях стационара Оренбургской областной клинической больницы №1 (ОКПБ №1; главный врач -Г.Б.Прусс) проведено исследование, целью которого явилось определение эффективности комплексной терапии тяжелого рекуррентного депрессивного расстройства, включающей Вальдоксан.
Таблица 1. Динамика показателей опросника SCL-90-R у обследуемых больных в процессе комплексной терапии, включающей Вальдоксан (7-недельное наблюдение)
Примечание. Статистически значимые различия по показателям отражены в тексте и на рисунках.
терапии Показатели шкал SCL-90-R som o-c sen dep anx hos phob par psy gsi 0 2,07 1,85 1,52 1,93 2,04 1,33 1,38 1,22 0,99 1,64 3 1,81 1,65 1,35 1,72 1,78 1,09 1,18 1,16 0,84 1,46 7 1,76 1,58 1,33 1,60 1,72 1,00 1,24 1,13 0,83 1,43 14 1,62 1,54 1,24 1,51 1,48 0,93 1,14 0,92 0,72 1,27 21 1,51 1,43 1,12 1,31 1,45 0,82 1,27 0,84 0,77 1,19 28 1,42 1,28 1,18 1,25 1,30 0,82 1,16 0,78 0,61 1,05 35 1,35 1,18 1,04 1,23 1,30 0,66 0,97 0,76 0,71 1,10 42 1,13 1,03 0,93 1,06 1,05 0,59 0,78 0,64 0,63 1,01 49 1,03 1,06 0,84 1,05 0,99 0,57 0,70 0,69 0,60 0,90 Материалы и методы исследования
В исследовании приняли участие 35 пациентов в возрасте от 21 до 60 лет (средний возраст 44,6±11,2 года; 25 женщин, 10 мужчин). Были включены пациенты с диагнозом (соответствующим критериям МКБ-10 «тяжелое рекуррентное депрессивное расстройство» [61]. Преобладали больные с тяжелым эпизодом без психотических симптомов (F332) - 32 (91,4%) человека. Исключались пациенты в период беременности и лактации, с коморбидностью с шизофренией и расстройствами шизофренического спектра, алкоголизмом, наркоманией, деменцией, тяжелыми соматическими заболеваниями в фазе декомпенсации (почечная, печеночная, сердечная недостаточность, неконтролируемая гипергликемия), принимающие флувоксамин, ципрофлоксацин (сильные ингибиторы CYP1A2) в течение 2 нед, предшествующих включению в исследование. Состояние пациентов оценивали клинико-психопатологическим методом с применением синдромального опросника SCL-90-R [62] на 3, 7, 14, 21, 28, 35, 42, 49-е сутки терапии. Все включенные пациенты закончили исследование к 49-му дню. У всех пациентов наблюдалось в анамнезе более трех тяжелых депрессивных эпизодов (среднее число 5,6±2,3). Все пациенты имели опыт приема ТЦА, 80% - антидепрессантов новых поколений (СИОЗС, селективных ингибиторов обратного захвата серотонина и норадреналина - СИОЗСН). Статистическую оценку сдвига показателей проводили с помощью непараметрического W-критерия согласованных пар для зависимых выборок Вилкоксона на основе программной системы «Statistica 7.0». В качестве значимых принимались результаты со степенью достоверности не ниже 95% (p<0,05).
Результаты и обсуждение
Тяжесть депрессии исследуемого контингента больных определялась выраженной полиморфной депрессивной симптоматикой, а также нередко затяжным характером фаз. Кроме того, в состоянии ремиссии более 90% пациентов, несмотря на прием антидепрессантов, отмечали периодические симптомы тревоги, ощущение быстрой утомляемости даже от повседневной деятельности, угнетающее чувство недостаточности положительных эмоций со снижением способности радоваться «как до болезни», а также ряд симптомов, связанных с часто встречаемыми побочными эффектами от приема антидепрессантов (ТЦА, СИОЗС), в основном гастроинтестинального спектра, а у мужчин с указаниями на снижение сексуальной функции. Нередко при этом не соблюдались рекомендуемые дозировки поддерживающего лечения, нарушалась регулярность приема препарата. У 12 (34,3%) пациентов прекращение приема препарата перед развитием эпизода было непосредственно связано с депрессией (усиление тревоги, тоски, самоиндукция), что указывало на снижение ответа на поддерживающую дозировку антидепрессанта. Угрожаемыми по формированию бензодиазепиновой зависимости [53, 54, 59] явились указания ряда пациентов (более 50%) на частый, с тенденцией к систематическому, прием транквилизаторов (чаще феназепама и алпразолама) без назначения врача. К приему бензодиазепинов пациенты прибегали даже при легкой тревоге, связанной с ситуацией перемещения. Несомненно, указанные явления были следствием недостаточной психотерапии пациентов во время предыдущих госпитализаций, низкой комплаентности в отношении препарата, связанной, в том числе, и с побочными действиями (особенно ТЦА). Эти пациенты также были отнесены к группе риска по формированию резистентности к последующей терапии.
Полиморфность симптоматики текущего депрессивного эпизода (рис. 1) заключалась в наличии как выраженной тревоги, нередко доходящей до умеренной ажитации в утренние часы, так и в выраженных соматовегетативных симптомах с астенизацией, более тяжелых в вечернее время. У 80% пациентов имелась коморбидная органическая патология, чаще сосудистая (начальные проявления атеросклероза сосудов головного мозга, гипертония), реже отдаленные последствия черепно-мозговой травмы.
Тяжесть депрессии выражалась в замедлении когнитивных и двигательных процессов с трудностями сосредоточения и осмысления прочитанного (в частности, при первичной работе с диагностическим опросником: в этом случае требовалась помощь врача). Все пациенты отмечали выраженную бессонницу. Наличие кратковременного ночного сна сопровождалось трудностями засыпания и частыми тревожными пробуждениями с окончательным пробуждением в ранние утренние часы, что усиливало субъективную негативную оценку качества сна. У пациентов с психотическими симптомами [F32.3 - 3 (8,6%) пациента] депрессия была представлена преобладающей тревожно-тоскливой симптоматикой с отдельными бредовыми идеями самообвинения и сниженной самооценкой, пессимистической составляющей взгляда на прошлое, настоящее и будущее, суицидальными мыслями (у всех пациентов отмечены суицидальные попытки в анамнезе). Двигательная заторможенность также была достаточно выраженной, но не достигала ступора.
С учетом прогнозируемой устойчивости к вновь назначаемым препаратам, а также высокого уровня тревожного спектра в структуре депрессии с 1-го дня терапии была применена комбинированная стратегия лечения антидепрессантами, разными по механизму действия: амитриптилин (внутривенно капельно) в дозе 50 мг в первой половине дня и Вальдоксан в дозе 25 мг на ночь. Данная стратегия была выбрана и в связи с угрозой формирования бензодиазепиновой зависимости у исследуемого контингента пациентов, вследствие чего не назначались бензодиазепиновые транквилизаторы [53, 54]. Кроме того, с учетом наличия коморбидной органической патологии с 1-го по 10-й день применялась стратегия аугментации: проводилась внутривенная терапия глиатилином, который также обладает нейропротекторной и анксиолитической активностью. Аугментация предполагает добавление лекарственного вещества, которое не является специфическим для лечения депрессий и не входит в класс антидепрессантов, но способно усилить ответ на принимаемый антидепрессант [3, 34-36, 41, 52, 55, 56]. Коморбидная органическая патология, с одной стороны, усиливала тревожно-астеническую составляющую депрессии (по данным опросника SCL, ведущие шкалы - соматизации, тревоги и депрессии - см. рис. 1), а с другой, - способствовала формированию устойчивости к предшествовавшей терапии [56-60, 63]. Сочетание амитриптилина с Вальдоксаном, с нашей точки зрения, потребовало меньшей дозировки амитриптилина, что позволило избежать или минимизировать побочные эффекты, свойственные ТЦА. Указанная комбинация оказалась эффективной с первых дней терапии, что подтвердилось достоверным снижением показателей к большинству шкал опросника SCL-90-R к 3-м суткам (рис. 2-5; см. таблицу 1): «соматизация» (som; с 2,07 до 1,81;p=0,00), «тревога» (anx; c 2,04 до 1,78;р=0,02), «депрессия» (dep; с 1,93 до 1,72; р=0,01), «враждебность» (hos; c 1,33 до 1,09;р=0,00), «межличностная сенситивность» (int; с 1,52 до 1,35; р=0,04), «фобическая тревога» (phob; с 1,38 до 1,18; р=0,04), «индекс наличного симптоматического дистресса» (psdi; c 2,13 до 1,99; р=0,01), «индекс выраженности симптомов» (gsi; с 1,64 до 1,46; р=0,00).
Рис. 1. Синдромальный профиль больных до начала терапии: по данным опросника SCL-90-R.
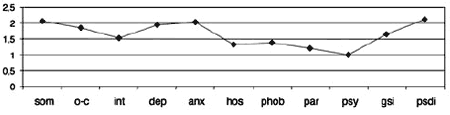
Примечание. Здесь и далее: som – «соматизация», o-c – «обсессивность-компульсивность», int – «межличностная сенситивность»,dep – «депрессия», anx – «тревожность», hos – «враждебность», phob – «фобическая тревожность», par – «паранойяльные симптомы», psy – «психотизм», gsi – «индекс выраженности симптомов», psdi – «индекс наличного симптоматического дистресса».Рис. 2. Динамика показателей по шкале «соматизация».
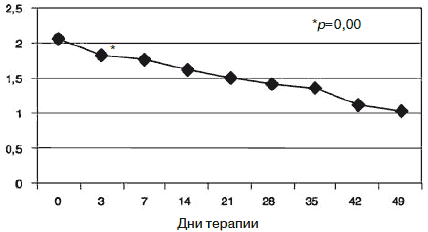
Рис. 3. Динамика показателей шкалы «тревога».
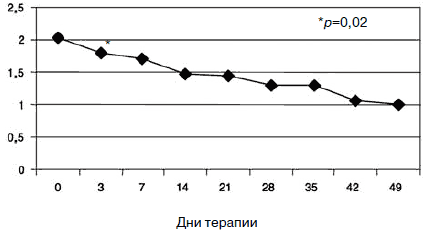
Рис. 4. Динамика показателей по шкале «депрессия».
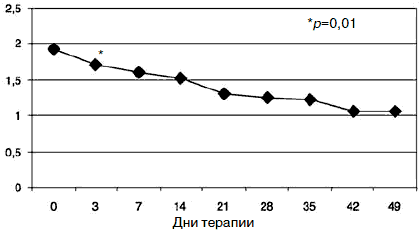
Рис. 5. Динамика показателей по шкале «враждебность».
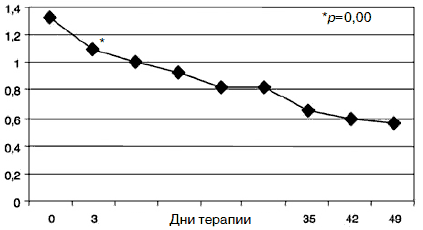
Рис. 6. Динамика показателей по шкале «межличностная сенситивность».
Клинически это выражалось в снижении тревоги в течение дня, относительной стабилизации соматовегетативных и суточных колебаний, подъеме настроения с улучшением гедонистической составляющей восприятия событий. Все пациенты отмечали улучшение функции сна с быстрым засыпанием, единичными непродолжительными пробуждениями среди ночи, а также субъективную удовлетворенность качеством сна.
Общая активность пациентов, видимо вследствие седации амитриптилином и сохраняющейся астении, оставалась довольно низкой. Помимо сухости во рту, что затрудняло речевую функцию, головокружения, усиливающегося при смене положения тела, пациенты отмечали наплывы сновидений, а также ощущение давления в области надбровных дуг, отсутствие аппетита и быстрое истощение желания общаться со склонностью к проведению времени в одиночестве. У больных с психотическими симптомами сохранялись отдельные идеи самообвинения, которые оценивались с относительной критикой, появилась заметная активность в плане раскрытия своих переживаний депрессивного содержания, снизилось чувство бесконтрольности тревоги и тоски, появилась большая способность к изменению настроения в зависимости от окружающих событий и собственного поведения и мыслей.
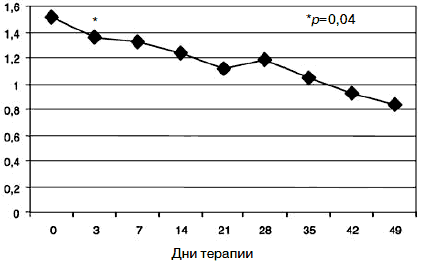
Рис. 7. Динамика показателей по шкале «фобическая тревога».
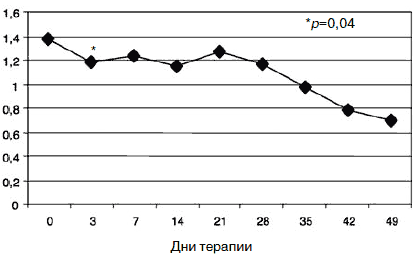
Рис. 8. Динамика показателей по шкалам «индекс наличного симптоматического дистресса» (1) и «индекс выраженности симптомов» (2).
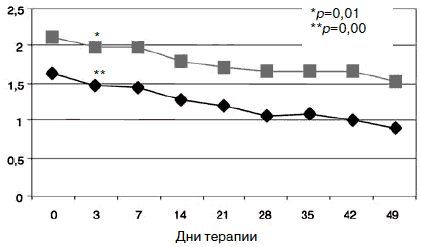
Рис. 9. Динамика показателей по шкалам «обсессивность- компульсивность» (1) и «психотизм» (2).
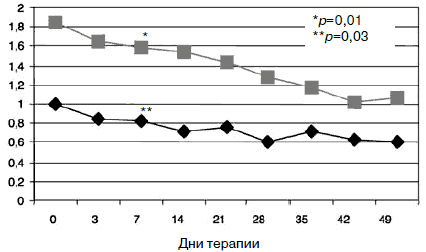
Парентеральное введение амитриптилина продолжалось в течение 5 дней с последующей его отменой. К 7-му дню терапии по сравнению с началом лечения у пациентов сохранялась тревожно-депрессивная симптоматика с астенизацией, хотя и менее выраженная. Ожидаемым было относительное усиление тревоги после отмены амитриптилина, но с учетом указаний на появление статистически значимого влияния Вальдоксана на симптомы депрессии к концу первой 1-й недели [39, 49], а также продолжающейся парентеральной терапии глиатилином дозировка антидепрессанта не повышалась. Статистически значимых различий показателей по шкалам опросника SCL-90-R между 3 и 7-м днем терапии не отмечено, по шкале «фобическая тревога» получено незначительное повышение (с 1,18 до 1,24; р=0,94). Тем не менее статистически значимое улучшение показателей (рис. 9) по сравнению с началом терапии к указанным изменениям по остальным шкалам опросника определено по шкалам «обсессивность-компульсивность» (с 1,85 до 1,58; р=0,01) и «психотизм» (с 0,99 до 0,83; р=0,03).
С 7-го дня терапии все пациенты были включены в тренинговую психотерапевтическую группу. Раннему началу активной психотерапевтической работы способствовали, помимо заметного клинического улучшения статуса пациентов, минимальные (у части пациентов отсутствовали) побочные действия получаемой фармакотерапии. На 1-м этапе групповых тренингов - информационно-обучающем - больных направляли в открытую группу, где широко использовали информационно-образовательную работу с интерактивным разбором причин ухудшения состояния. В доступной форме разбирали анатомо-физиологические и биохимические механизмы развития депрессий, роль современных препаратов с разбором причин их побочных действий, последствия бессистемного приема транквилизаторов. На 2-м этапе больных включали в закрытую группу специализированных тренингов, в частности в тренинг анализа ситуации (ТАС). Более подробная информация по общим принципам групповой психотерапии больных депрессией в ОКПБ №1 отражена в наших предыдущих публикациях [64, 65]. В структуру ТАС именно для больных рекуррентной депрессией и биполярным аффективным расстройством II типа, при которых нередко нарушены циркадианные и социальные ритмы [66-70], были интегрированы занятия, направленные на выработку поведенческих стратегий, регулирующих социальные ритмы с преодолением ситуаций возникновения межличностных проблем, вызывающих аффективную дестабилизацию (аналог межличностной и социально-ритмической терапии [71]).
Ригидная структура аффекта с нередким недоверием к терапии, ее эффективности, отчасти дисфорическим содержанием статуса, который выходил на первый план по мере снижения тревоги, нашел отражение в показателях опросника SCL-90-R. Согласно полученным данным, именно показатель «паранойяльные симптомы» оказался наименее динамичным в процессе терапии. Статистически значимое снижение показателя (с 1,22 по 1,13; р=0,02) по данной шкале получено к 14-му дню лечения (рис. 10).
С 14-го дня терапии повышение дозы до 50 мг/сут понадобилось 7 (20%) пациентам, причем чем выше были показатели депрессии у пациентов до начала терапии, тем лучше была динамика состояния. Так, все 3 пациента с психотическими симптомами до начала комплексной терапии в дальнейшем остались на дозировке 25 мг.
Данные, полученные при анализе показателей опросника по лечению с 14-го по 35-й день наблюдения (фармакотерапия только Вальдоксаном), представлены на рис. 11 и в таблице 1).
Произошло снижение всех показателей, но статистически достоверное отмечено по шкалам «соматизация» (с 1,62 до 1,35; p=0,02), «обсессивность-компульсивность» (с 1,54 до 1,18; р=0,01), «межличностная сенситивность» (с 1,24 до 1,04; р=0,03). Динамика показателя по шкале «депрессия» свидетельствовала о статистически значимом снижении уже в течение 1-й недели после монофармакотерапии Вальдоксаном (с 1,24 до 1,12; р=0,02) с дальнейшим снижением к 35-му дню (1,04; р=0,00). Кроме того, дополнительный индекс опросника pst, отражающий общее число утвердительных ответов по выбору симптомов [62], также достоверно уменьшился с 14-го по 35-й день терапии (с 57,5 до 52,4; р=0,02). По показателям шкал «тревога» (с 1,48 до 0,99; р=0,04) и «индекс выраженности симптомов» (с 1,27 до 0,90; р=0,03) достоверное снижение отмечено с 14-го к 49-му дню терапии. Именно изменение показателей тревожного спектра имели наименьшую динамику (особенно по шкалам «фобическая тревога» - см. рис. 7 и табицу, содержательная часть которой близка к дефиниции агорафобической симптоматики [62]). По-видимому, при терапии Вальдоксаном анксиолитическое действие препарата связано с эффектами нейропластичности [23, 35, 36, 38], в частности с повышением клеточной пролиферации и нейрогенеза в зубчатой извилине головного мозга, - участка, который участвует в обработке эмоций [45], что требует более продолжительной антидепрессивной терапии, особенно при рекуррентной депрессии с признаками резистентности. Тем не менее, ведущий синдромальный спектр исследуемых пациентов к 49-му дню терапии показал практически 50% снижение по шкалам опросника SCL-90-R, что также объективно отмечалось в статусе пациентов. Прежде всего практически нормализовались настроение, сон, улучшилась социальная активность (лечебные отпуска и перевод на дневной стационар уже с 3-й недели терапии). Повысилась приверженность пациентов дальнейшей амбулаторной терапии Вальдоксаном.
Рис. 10. Динамика показателей по шкале «паранойяльные симптомы».
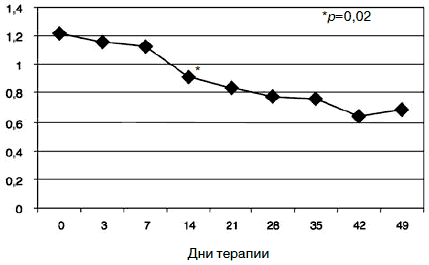
Рис. 11. Синдромальный профиль больных к 14-му (1) и 35-му (2) дням терапии: по данным опросника SCL-90-R.

Рис. 12. Синдромальный профиль больных через 6 мес терапии Вальдоксаном у катамнестической группы (12 человек): по данным опросника SCL-90-R.
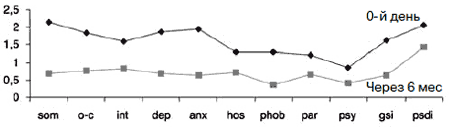
У 12 (34,3%) пациентов проведена 6-месячная катамнестическая оценка поддерживающего лечения Вальдоксаном в дозе 25 мг/сут (рис. 12). Сведения об остальных пациентах собрать не удалось в силу их проживания в отдаленных районах области или за ее пределами.
Средние показатели катамнестической группы не имели статистически достоверных различий с общей группой пациентов до начала терапии. В результате в катамнезе получены достоверно более низкие показатели по всем шкалам, которые приближаются к варианту нормы. Пациенты сохраняли приверженность терапии на протяжении 6 мес, регулярно принимая препарат. Госпитализаций за указанный период не отмечено. Пациенты периодически посещали врача для контроля состояния, а также психотерапевтической поддержки. В течение 6 мес коррекция дозы с повышением до 50 мг/сут на срок до 2 нед потребовалась 2 (16,7%) пациентам, что предотвратило обострение и, соответственно, госпитализацию.
Таким образом, была подтверждена эффективность комплексной терапии больных тяжелым рекуррентным расстройством, включающей Вальдоксан. Отмечена хорошая переносимость лечения Вальдоксаном в комбинированной модели с амитриптилином и глиатилином. Показана возможность купировать тревожный спектр тяжелой депрессии указанной комбинацией в первые 2 нед лечения, что формирует раннее включение в групповую психотерапию, способствуя повышению комплаенса. Для достижения более качественной интермиссии при рекуррентной депрессии необходима длительная поддерживающая терапия Вальдоксаном, что связано, по-видимому, с долгосрочным эффектом антидепрессанта (формирование нейро-пластичности).
Важно помнить, что данное исследование описывает лишь рабочую модель и в некоторых случаях может быть полезно назначение, например, атипичных антипсихотиков с антидепрессивными свойствами (кветиапина, арипипразола) или применение других способов преодоления устойчивости к терапии [3, 34, 41, 52, 55, 57].
Список использованной литературы
- Мосолов С.Н., Вертоградова ОП., Пантелеева ГП. и др. Профилактическая эффективность тианептина при рекуррентной депрессии с частыми обострениями. Журн. неврол. и психиатр. им. С.СКорсакова. 2004; 104 (9): 32-8.
- KesslerRC,AngermeyerM,AnthonyJC. World psychiat2007; 6 (3): 168-76.
- Shelton RC, Tollefson GD, Tohen M et al. A novel augmentation strategy for treating resistant major depression. AmJ Psychiat 2001; 158:131-34.
- Altamura AC, PercudaniM. The use of antidepressants for long-term treatment of recurrent depression: rationale, current methodologies, and future directions.J Clin Psychiat 1993; 54 (8): 29-37.
- Кессинг ЛВ, Хансен МГ, Андерсен П.К., Ангст Дж. Число эпизодов как прогностический фактор риска развития рецидива при депрессивном и биполярномрасстройствах: пожизненный прогноз (расширенный реферат). Психиатр. и психофармакотер. 2008; 5.
- Qaseem A, Snow V, Denberg TD et al. Using Second-Generation Antidepressants to Treat Depressive Disorders: A Clinical Practice Guideline from American College of Physicians.AnnIntMed2008; 149 (18): 725-33
- Fava CA, Ruini C, Belaise C. The concept of recovery in major depression. Psychol Med 2007; 48:103-11.
- Menza M, Marin H, Opper RS. Residual symptoms in depression: Can treatment be symptom specific? J Clin Psychiatry 2003; 64:516-23.
- Serretti A, CavalliniMC, Macciardi F et al. Social adjustment and self esteem in remitted with mood disorders. Eur Psychiatry 1999; 14:137-42.
- Аведисова А.С. От рандомизированных обсервационных исследований к пониманию эффективности психофармакотерапии. Психиатр. и психофармакотер. 2009; 1:15-8.
- Амон М., Буае П.-Т., Моке Е. Перспективы в изучении патогенеза и терапии аффективных расстройств:рольмелатонина и серотонина. Журн. неврол. и психиат. им. С.СКорсакова. 2007; 11: 77-82.
- Дробижев М.Ю., Кикта СВ. Как выбирать антидепрессант для лечения депрессии? Соц. и клин. психиатр. 2008; 18 (4): 82-93.
- Дробижев М.Ю., Кикта С.В. Пароксетин: высокая частота назначений. Соц. и клин. психиатр. 2009; 19 (3): 55-9.
- ДробижевМ.Ю., Кикта СВ. Как использоватьмиртазапин в клинической практике? Соц. и клин. психиатр. 2009; 19 (3): 60-5.
- Иванов МВ., Мазо Г.Э., Чомский АН. К проблеме антидепрессантов «первого выбора» при терапии депрессивного расстройства. Психиатр. и психофармакотер. 2009; 5: 6-9.
- Крижановский АС., Иванов М.В., Мазо Г.Э. Новые возможности решения проблемы комплаенса. Обозр. психиатр. и мед. психол. им. ВМБехтерева. 2010; 1:48-51
- Gartlehner G, Hansen RA, Thieda P et al. Comparative Effectiveness of Second-Generation Antidepressants in the Pharmacologic Treatment ofAdult Depression. Comparative Effectiveness Review №7-EHC007-EF. Rockville, MD: Agency for Healthcare Research and Quality, 2007.
- Gartlehner G, Gaynes BN, Hansen RA et al. Comparative benefits and harms of second-generation antidepressants: background paper for the American College of Physicians. Ann Intern Med 2008; 149: 734-50.
- Балашов АМ. Фармакологическая активность селективных ингибиторов обратного захвата серотонина при лечении коморбидных депрессивных расстройств. Психиатр. и психофармакотер. 2009; 2: 4-5.
- Hamon M. Рецепторные профили антидепрессантов. Обозр. психиатр. и мед. психол. им. ВМБехтерева. 2009; 2:67-72.
- Stahl SM. Stahl's essentialpsychopharmacology: neuroscientific basis and practical application. 3-d ed. Cambridge, 2008.
- Дробижев М.Ю. Антидепрессанты первых поколений в современной терапии депрессии. Журн. неврол. и психиатр. им. С.СКорсакова. 2008; 108 (12): 32-8.
- Марценковский И.А. Терапия депрессий через призму современных нейробиологических исследований. НейроNews психоневрология и нейропсихиатрия. 2008; 4:9. http://neuro.health-ua.com/article/124.php
- Петрова Н.Н., Кучер Е.О. Комплаенс больных с депрессивными расстройствами. Обозр. психиатр. и мед. психол. им. ВМБехтерева. 2009; 4:21-4.
- Пучков И.И. Типология и распространенность отказов от психофармакотерапии у больных с депрессивными расстройствами. Рос. психиатрич. журн. 2005; 5:45-8.
- Sartorius N, Baghai T, Baldwin D, Brand U. The use and usefulness of antidepressants a technical review of avidance by a tesk forse of the ECNP. 2006.
- Zaid DH, Depue RA Serotonergic functioning correlates with positive and negative affect in psychiatrically healthy males. Personality and individual Differences2001;30: 71-86.
- Gunnell D, Saperia J, Ashby D. Selective serotonin reuptake inhibitors (SS-Rls) and suicide in adults: meta-analysis of drug company data from placebo controlled, randomized controlled trials submitted to the MHRA's safety review. BMJ2005; 7:330-85
- Fergusson D, Doucette S, Glass KC et al. Association between suicide attempts and selective serotonin reuptake inhibitors: systematic review of randomized controlled trials. BMJ2005; 6:330-96.
- Anderson IM, Edwards JG. Guidelines For choice of selective serotonin reuptake inhibitor in depressive illness. Advances in Psychiatric treatment. 2001; 7: 170-80.
- Балашов А.М. Фармакогенетика в психофармакологии. Соц. и клин. психиатр. 2008; 18 (1): 89-98.
- Lemonde S, Du L, Bakish D et al. Association of the C (-1019) G 5-HT1A functional promoter polymorphism with antidepressant response. Int J Neuropsychopharmacol 2004; 7 (4): 501-6.
- NacamuraM, Ueno S, Sano A, Tanahe H. The human serotonin transporter gene linked polymorphism (5HTTLPR) shows ten novel allelic variants. Molec Psychiat 2000; 5:35-8.
- Иванов М.В., Мазо Г.Э. Полифармакотерапевтический подход к лечению резистентных депрессивных состояний. Усовершенствованная медицинская технология. СПб., 2007.
- Погосова Г.В., Колтунова И.Е., Гудкова О.А. Стресс, депрессия и их влияние на нейропластичность: возможно ли обратное развитие? Обозр. психиатр. и мед. психол. им. ВМБехтерева. 2008; 3:49-52.
- Millan MJ. Препараты с двойным и тройным механизмом действия для лечения ядерных и коморбидных проявлений большой депрессии: новые концепции, новые препараты (расширенныйреферат). Психиатр. и психофармакотер. 2009; 3:4-20.
- Хартер С., Ксиминг Ван, Вейгман Х. и др. Избирательное влияние флувоксамина и других антидепрессантов на биотрансформацию мелатонина (реферат). Обозр. психиатр. и мед. психол. им. В.М.Бехтерева. 2010; 1: 60-3.
- Злоказова МБ. Опыт применения Вальдоксана при лечении умеренных и тяжелых депрессивных расстройств непсихотического уровня у амбулаторных пациентов. Психиатр. и психофармакотер. 2009; 4:39-41.
- Иванов СВ. Вальдоксан (агомелатин) при терапии умеренных и тяжелых депРессий непсихОтического уровНя в амбулатОрной и гоСпитальной практике (результаты Российского мультицентрового исследования «ХРОНОС»). Психиатр. и психофармакотер. 2009; 6:14-7.
- Олье Ж.-П., Каспер З. Эффективность Вальдоксана (агомелатина), агониста МТ1/МТ2-рецепторов и антагониста 5-НТ2с-рецепторов при большом депрессивном расстройстве. Рос. психиатр. журн. 2009; 2: 85-95.
- Терапия антидепрессантами и другие методы лечения депрессивных расстройств. Доклад Рабочей группы CINP на основе обзора доказательных данных. Под ред. ВНКраснова. М., 2008.
- Bourin M, Prica C. Агонист мелатониновыхрецепторов Вальдоксан (агомелатин): новый препарат для терапии монополярной депрессии (реферат). Обозр. психиатр. и мед. психол. им. ВМБехтерева. 2009; 4: 74-82.
- Montgomery SA, Olie J-P, Kennedy SH. Antidepressants efficacy of agomelatine in major depressive disorder: meta-analysis of three pivotal studies. Eur Neuropsychopharmacol 2006; 16 (4): 321.
- Kennedy SH, Emsley R. Placebo-controlled trial of Valdoxan in the treatment of major depressive disorder. Eur Neuropsychopharmacol 2006; 16: 93-100.
- LЩo H, Hale A, D'haenen H. Determination of the dose of agomelatine, a melatoninergic agonist and selective 5-HT antagonist, in the treatment of mayor depressive disorder: a placebo-controlled dose range study. Int Clin Psychopharmacol 2002; 17:239-47.
- Olie J-P, Emsley R. Confirmed clinical efficacy of agomelatine (25-50 mg) in major depression: two randomized double-blind,placebo-controlled studies. Eur Neuropsychopharmacol 2005; 15 (3): 416.
- Goodwin GM, Emsley R, Rembry S, Rouillon F. Вальдоксан (агомелатин) предотвращаетрецидивыу пациентов с большим депрессивным расстройством без признаков синдрома отмены: 24-недельное рандомизированное двойное слепое плацебо-контролируемое исследование. Психиатр. и психофармакотер. 2010; 2:46-51.
- Munoz C. Better quality remission in depression: Valdoxan, the first melatonergic antidepressant.Medicographia 2009; 31 (2): 175-81.
- Lemoine P, Guilleminault Ch, Alvarez E. Улучшение субъективных показателей сна при большом депрессивном расстройстве на фоне терапии новейшим антидепрессантом Вальдоксаном: рандомизированное двойное слепое сравнение с венлафаксином (реферат). Обозр. психиатр. и мед. психол. им. ВМБехтерева. 2009; 3:54-63.
- Счастный Е.Д., Зражевская И.А. Применение инновационного антидепрессанта Вальдоксана (агомелатин) при лечении пациента с быстроциклическим течением биполярного аффективного расстройства (клинический случай). Психиатр. и психофармакотер. 2009; 5: 22-5.
- Гурович ИЯ., Любов ЕБ., Чапурин СА, Чурилин Ю.Ю. Лечение Вальдоксаном, венлафаксином, дулоксетином, эсциталопрамом, миртазапином, пароксетином, сертралином, флуоксетином депрессивных расстройств: фармакоэкономический анализ. Психиатр. и психофармакотер. 2010; 1: 25-31.
- КозловскийВЛ., НезнановНГ. Комбинированная терапия антипсихотиками и антидепрессантами:рациональность, стратегия, тактика (сообщение 1). Обозр. психиатр. и мед. психол. им. В.М.Бехтерева. 2008; 3:4-8.
- Аведисова АС., Ястребов ДБ. Длительное применение бензодиазепиновых транквилизаторов: распространенность и связь с лекарственной зависимостью. Психиатр. и психофармакотер. 2010; 1: 17-25.
- Дашкина Г.К. Заместительная терапия антидепрессантами больных с пограничными психическими расстройствами, длительно принимающих бензодиазепиновые транквилизаторы. Рос. психиатрич. журн. 2010; 3:53-8.
- Мазо Г.Э. Терапевтически резистентные депрессии: подходы к терапии. Соц. и клин. психиатр. 2004; 14 (4): 59-64.
- Марута Н.А., Бачериков А.Н. Актовегин и геримакс в лечении резистентных рекуррентных депрессивных расстройств. Укратьский вiсник психоневрологи. 2007; 1 (50): 119-20.
- Мосолов СН. Тревожные и депрессивные расстройства: коморбидность и терапия.М., 2007.
- Tyrer P. General neurotic syndrome and mixed anxiety-depression disorder. Classification of Neurosis. TyrerP. (ed.) New York, Wiley, 1989; 132-64.
- Woods JH, Kutz JI, Winger J. Use and abuse of benzodiazepins. Issues relevant to prescribing. JAMA 1988; 260 (23): 3476-80.
- ZajeckaJM, Ross JS. A systematized approach to the management of the depressed and anxious patient. Int J ClinPract 1998; 2:27-30.
- Чуркин АА, Мартюшов АН. Практическое руководство по применению МКБ-10 в психиатрии и наркологии.М, 2010.
- Тарабрина Н.В. Практикум по психологии посттравматического стресса. СПб., 2001; 146-81.
- Маляров СА Пациент с депрессией и симптомами тревоги: вопросы дифференциальной диагностики и терапии. НейроNews психоневрология и нейропсихиатрия. 2010; 2:21.
- Антохин Е.Ю., Авеличев В.К., Байдавлетова Э.Т. Протекторные психологические механизмы при дистимии и их динамика в процессе комплексной терапии в стационаре. Соц. и клин. психиатр. 2009; 2: 57-63.
- Антохин Е.Ю. Гендерные аспекты психогенных депрессий: особенности клиники, подходы к терапии. Соц. и клин. психиатр. 2010; 2: 52-66.
- Бескова Д.А. Влияние социальных факторов на циркадианныеритмы (от нормального функционирования до психических расстройств). Обозр. психиатр. и мед. психол. им. ВМБехтерева. 2010; 1: 52-60.
- Germain A. Психоповеденческий подход к нарушениям циркадианных ритмов у пациентов с депрессией. Обозр. психиатр. и мед. психол. им.ВМБехтерева. 2008; 2:37-41.
- Смулевич А.Б., Иванов С.В. Депрессия и биологические ритмы: анкетное исследование ЦИРЩДИДН-I. Психиатр. и психофармакотер. 2008; 6: 4-8.
- Hirschfeld RM, Montgomery SA, Keller MB et al. Social functioning in depression: a review. J Clin Psychiatry 2000; 61:268-75.
- Monteleone P, Maj M. Circadian rhythm disturbances in depression: implications for treatment and quality of remission. Medicographia 2009; 31 (2): 132-9.
- Frank E, Kupfer DJ, Thase ME et al. Two-year outcomes for interpersonal and social rhythm in individuals with bipolar I disorder. Arch Gen Psychiatry 2005; 62:996-1004.
| Ноябрь 2012 г. |