Опубликовано в :
«ПСИХИАТРИЯ И ПСИХОФАРМАКОТЕРАПИЯ » »» Том 12 № 4
Терапия непсихотических депрессий антидепрессантом агомелатином (Вальдоксан): результаты наблюдательного многоцентрового исследования «РИТМ»
А.Б.Смулевич1, А.В.Андрющенко2, Д.А.Бескова1
1 Научный центр психического здоровья РАМН, Москва;
2 Первый МГМУ им. И.М.Сеченова
Введение
В рамках поисков новых подходов к изучению и терапии аффективных расстройств в настоящее время можно выделить процесс интеграции хронобиологии и психиатрии/психофармакотерапии. Среди базисных проблем нарушений ритмов, наиболее частых и определяющих патогенез аффективных расстройств, выделяются хронобиологические девиации в виде циркадианных нарушений. Анализ публикаций клинических исследований за многие годы подтверждает, что депрессии с циркадианными нарушениями не являются гомогенной группой: такого рода нарушения не только характерны для циркулярной меланхолии, но и определяют симптоматику депрессий, относящихся к широкому спектру эндоформных, эндореактивных и соматореактивных аффективных расстройств. Высокая распространенность и клинико-эпидемиологическая значимость хронобиологических аномалий при депрессиях требуют разработки новых, регулирующих циркадианные функции антидепрессивных средств, которые могут быть введены в широкую клиническую практику наряду с существующими немедикаментозными средствами [3, 8, 19, 39].
В настоящее время в соответствии с разрабатываемыми направлениями в нейробиологии изучение аффективных расстройств проводится с позиций ритмологической (молекулярно-генетическая) модели депрессий, концептуализирующей нарушения механизма цикличности на уровне главного водителя ритма (супрахиазматическое ядро гипоталамуса) и многочисленных локальных циркадианных часов [2, 24] 1. В рамках поиска биологических маркеров различных депрессий и предикторов терапевтической эффективности изучается целый ряд патофизиологических показателей при депрессиях, отражающих нарушения циркадианного ритма, а также их значимость для дифференциации депрессивных подтипов [14]. В частности, обнаружено, что нарушения составляющих цикла сон-бодрствование взаимосвязано с целым рядом биохимических нарушений (снижение ночной концентрации мелатонина в плазме крови и аномальные фазы его секреции, нарушение периодичности колебаний концентраций пролактина, кортизола, кортикотропин-рилизинг-гормона, тиреостимулирующего гормона, интерлейкина 2 и 6 и пр.). Выявлены связанные с патологическими циклами температурные дисфункции (уплощение суточных колебаний температуры) [16]. В последние годы на основании клинических данных построена модель, отражающая психопатологические аспекты проблемы хронобиологических нарушений при депрессиях [4]. С высокой долей вероятности можно предположить, что программы, которые будут проводиться на основе взаимодействия (взаимодополнения) клинических и нейробиологических ритмологических моделей депрессий, смогут уточнить роль патофизиологических нарушений с учетом особенностей симптоматики.
В соответствии с предложенной циркадианной моделью к числу первостепенных терапевтических задач следует отнести редукцию коррелирующих с выраженностью других депрессивных симптомов суточных колебаний и расстройств сна, которые не только субъективно тяжело переносятся, но снижают уровень трудоспособности и нарушают комплаенс [33]. При выборе метода лечения депрессий и конкретного тимолептика, помимо общего антидепрессивного эффекта, оценивают его способность быстро восстанавливать нормальный сон и дневную активность, редуцировать колебания гипотимической симптоматики в течение суток - другими словами, потенциал препарата в отношении циркадианных аномалий, выявляемых в рамках актуального расстройства [37]. Выбор препарата осуществляется с учетом новых мишеней и выраженности его хронобиотической активности - свойства (которое изучается как в отношении психотропных препаратов, так и немедикаментозных средств 2), определяющего силу лечебного воздействия на ежедневную вариабельность симптомов депрессий в связи с циркадианными нарушениями3. Таким образом, оптимизация алгоритмов лечения в настоящее время позволяет использовать контролируемую (патогенетически обоснованную) фармакокоррекцию патологического циркадианного ритма [1, 20]. При этом терапевтическая тактика, позволяющая с первых дней купировать депрессивные аномалии суточного ритма, в частности инсомнии, может способствовать предотвращению обострения суицидальных тенденций и прочих тяжелых проявлений.
Проверка возможности нового построения алгоритма терапии депрессий стала реальной после появления антидепрессанта Вальдоксана (агомелатин) - препарата, способствующего редукции проявлений депрессии, при этом основные фармакологические эффекты препарата связаны с повышением активности синхронизаторов функций цикла день-ночь, восстанавливающих и стабилизирующих циркадианные ритмы [5, 7, 21]. Данные «Лаборатории Сервье» и результаты серии доклинических/клинических исследований свидетельствуют об оригинальном фармакологическом профиле препарата. Основные фармакологические эффекты Вальдоксана определяются тем, что препарат является мощным лигандом мелатониновых рецепторов со свойством агониста к МТ1/МТ2-рецепторам (в первую очередь в супрахиазматическом ядре), поэтому их дисфункция коррелирует с нарушениями основного водителя циркадианного ритма [36]. Фармакологические свойства Вальдоксана, усиливающие антидепрессивный эффект, обусловлены также антагонизмом препарата с серотонинергическими 5-НТ2С-рецепторами, при этом определено отсутствие значимого аффинитета к другим центральным рецепторам или переносчикам моноаминов, отсутствие других механизмов, влияющих на уровни серотонина в синаптической щели. Благодаря синергизму действия на МТ1-, МТ2- и 5НТ2С-рецепторы Вальдоксан обладает достаточным антидепрессивным действием [29]. Фармакологические свойства Вальдоксана, определяющие благоприятный профиль безопасности и переносимости, определяются отсутствием сродства к α-, ß-адренорецепторам, гистаминовым рецепторам, холинорецепторам, допаминовым и бензодиазепиновым рецепторам, что на клиническом уровне связано с отсутствием характерных для других антидепрессантов побочных эффектов в сфере желудочно-кишечного тракта, сексуальных функций, сердечно-сосудистой системы, эндокринно-обменных функций и др.
1 Современные нейробиологические модели, направленные на изучение патогенеза аффективных расстройств, подтверждают соучастие различных механизмов. Предполагается, что ключевые нарушения связаны не только с дисфункциями моноаминергических и нейроэндокринных систем, но и с нарушениями циркадианной системы, характеризующейся дезорганизацией эндогенных (внутренних) ритмов [12].
2 Патогенетически обоснованная немедикаментозная терапия (частичная или полная депривация сна, светотерапия, социально-ритмическая психотерапия, Social Rhythm Therapy), связанная с манипуляциями такими синхронизаторами, как сон, свет, социальная активность, демонстрирует в целом низкую терапевтическую активность при психопатологически выраженных депрессиях и редко применяется как самостоятельный метод. Как правило, в клинической практике немедикаментозные методы используются избирательно при легких нарушениях в рамках так называемых сезонных депрессий или для профилактики аффективной дестабилизации в период ремиссии. Наиболее эффективный из этих методов - тотальная депривация сна - редко используется из-за трудностей реализации в амбулаторных и даже стационарных условиях. При этом поиск способов оптимизации терапевтической активности этих средств затруднен, так как отсутствуют четкие критерии эффективности и рекомендации в плане терапевтических курсов ориентированы в большей мере на эмпирический результат, полученный у единичных больных или на выборках, трудно сопоставимых друг с другом.Переходя к анализу данных, относящихся к клинической активности Вальдоксана, следует дать оценку результатам завершенных рандомизированных клинических исследований (РКИ), которые обеспечивают научное обоснование широкого внедрения препарата в практику медицинских учреждений и определяют спектр психических расстройств, в отношении которых препарат демонстрирует высокую эффективность [10, 26-28]. Обзор РКИ подтверждает тимолептическую активность Вальдоксана при непсихотических депрессиях с нарушениями цикла сон-бодрствование в стандартных дозах 25-50 мг/сут. При этом установлено, что по уровню антидепрессивного эффекта Вальдоксан достоверно превосходит плацебо [13, 17]. Сравнение с активным контролем показывает, что препарат сопоставим (или превосходит) по выраженности и быстроте достижения терапевтического ответа с другими современными средствами, включая селективные ингибиторы обратного захвата серотонина (пароксетин, флуоксетин и сертралин) и препарат двойного действия -ингибитор обратного захвата серотонина и норадреналина (венлафаксин): антидепрессивный эффект Вальдоксана проявляется в первые 2 нед [13, 31]. Согласно целому ряду исследований, проведенных на больших выборках, выявлено его отличие от антидепрессантов, применяемых в группах контроля: Вальдоксан одновременно воздействует на ряд показателей инсомнии таким образом, что происходит восстановление ключевых нарушений, определяющих последовательность структурных элементов цикла сон-бодствование: стадий и циклов сна и дневной активности с самого утра. Данные ряда исследований свидетельствуют о безопасности и хорошей переносимости Вальдоксана. Препарат не повышает риск самоубийства, не влияет на клинические/биохимические показатели крови, массу тела и сексуальные функции. После прекращения терапии Вальдоксаном синдрома отмены не выявляется. Среди побочных эффектов препарата (их частота не зависит от пола и возраста) отмечены единичные жалобы на головокружение, парестезии, тошноту, боли в эпигастрии, зуд. Улучшение состояния - редукция побочных эффектов/возврат к нормальным показателям - в большинстве случаев происходит без отмены назначенного лекарственного средства.
Важной исследовательской составляющей в период интеграции препарата в повседневную психиатрическую практику являются обсервационные наблюдения, которые могут предоставить полную информацию для врачей с различным уровнем подготовки. Проведение многоцентровых обсервационных исследований новых препаратов с помощью группы опытных в отношении такого рода работы психиатров позволяет получить согласованную экспертную оценку о терапевтическом потенциале, спектре клинических эффектов, переносимости и безопасности нового препарата у разных (по географическим, социодемографическим и клиническим параметрам) групп больных с опорой на данные, открытые для всестороннего обсуждения. Натуралистические наблюдательные исследования, сопровождающие весь «жизненный цикл» антидепрессанта, помогают решать вопросы, касающиеся прогноза эффективности у отдельных групп пациентов с учетом уровня индивидуальной чувствительности/резистентности.
Одно их первых обсервационных исследований Вальдоксана в России, «РИТМ», с целью приближения к реальной ситуации проведено на достаточно большой выборке, сформированной без жестких критериев исключения. Для обеспечения надежности результата запланирована оценка, включающая как непосредственное клиническое впечатление (которое можно сравнить с предыдущим опытом), так и результаты многопеременного анализа формализованных данных, собранных с помощью адаптированного к задачам исследования стандартного инструмента.
Целью обсервационной программы «РИТМ» является открытое несравнительное наблюдательное исследование эффективности и переносимости агомелатина (Вальдоксан), применяемого в стандартных гибких дозах при 6-недельной терапии в соответствии с рекомендованной инструкцией в амбулаторных или стационарных условиях психиатрической сети (ЛСР-000540/08 от 11.02.2008). Основная задача - оценка антидепрессивного и нормализующих сон/циркадианный ритм эффектов, а также переносимости и безопасности препарата. Среди дополнительных задач - уточнение оптимальной дозы с учетом депрессий разной степени тяжести, в том числе выраженности инсомнии, а также анализ согласованности оценок пациента и врача в отношении динамики депрессивных нарушений на фоне терапии агомелатином.
Общая выборка была сформирована на основании следующих критериев включения/исключения.
Таблица 1. Объем сформированных по длительности терапии выборок
Включены в анализ Всего исключены из анализа - 67 (19,1%) Всего набрано ППТ ПНТ ИИП ЗИП 283 (80,9%) 12 (3,4%) 55 (15,7%) 350 (100%) Таблица 2. Причины исключения из исследования до завершения 4 нед терапии
*Причиной прекращения исследования были острые проявления, включая лабораторные данные, сахарного диабета, гипертонической болезни, клещевого энцефалита, сифилиса.
Причина исключения Число пациентов Неэффективность лечения 13 НЯ на фоне лечения 12 По критерию включения по возрасту 3 По критерию исключения HDRS-17<17, CGI-S<3 7 По критерию исключения острого/тяжелого
соматического заболевания*4 Улучшение 3 Инверсия фазы
(биполярное аффективное расстройство)1 Отзыв информированного
согласия/неуточненные причины12 Всего... 55 Критерии включения
- Мужчины и женщины в возрасте 18-65 лет, находящиеся в психиатрическом стационаре или на амбулаторном лечении.
- Диагноз депрессивного расстройства по МКБ-10 в соответствии со следующими рубриками:
- депрессивный эпизод, умеренный (F32.1) или тяжелый, без психотических симптомов (F32.2);
- рекуррентное депрессивное расстройство, умеренный или тяжелый депрессивный эпизод (F33.1, F33.2);
- биполярное аффективное расстройство (F31), умеренный или тяжелый депрессивный эпизод (F31.3, F31.4).
- Выраженность депрессивного расстройства в соответствии со стандартными шкалами исключала легкие формы: не менее 17 баллов по шкале HAMD-17 и не менее 3 баллов по шкале CGI-тяжесть заболевания.
- Показания для назначения Вальдоксана были стандартными для терапии антидепрессантами в клинической практике: в качестве первого антидепрессанта (показания) или в качестве замены предыдущего антидепрессанта в случае его плохой переносимости и/или недостаточной эффективности.
- Письменное информированное согласие пациента на участие в исследовании.
Критерии исключения
- Острые и хронические соматические заболевания в стадии декомпенсации.
- Выраженная неврологическая патология, включая эпилепсию, паркинсонизм, органическую патологию мозга.
- Шизофрения.
- Беременность и период лактации.
- Повышенный риск самоубийства (более 2 баллов по пункту 3 шкалы HAMD-17).
- Алкоголизм или наркомания.
- Прием ингибиторов моноаминоксидазы в течение 2 нед до начала исследования.
- Прием депо-нейролептиков в течение 4 нед до начала исследования.
- Гиперчувствительность к агомелатину
- Пациенты, не желающие или не способные соблюдать требования данного протокола.
4 Стандартная методика, используемая для оценки динамики расстройств сна на фоне антидепрессивной терапии в других странах [30].
5 Все данные по экспериментальным шкалам соответствуют критериям нормального распределения (критерий Колмогорова-Смирнова), что позволяет использовать для основной выборки параметрические статистические модели.Дизайн исследования
Исследование проведено в соответствии с единым протоколом программы «РИТМ» в 10 исследовательских центрах различных регионов РФ: НЦПЗ РАМН (Москва), ГНЦССП им. В.П.Сербского (Москва), ПКБ-1 (Москва), ГУ СПбНИПНИ им. В.М.Бехтерева (Санкт-Петербург), ГУ СПбНИПНИ им. В.М.Бехтерева (Санкт-Петербург), ГОУ ДПО ИГИУВ (Иркутск), ГОУ ВПО ИГМУ (Иркутск), КГМУ (Казань), НГМА (Нижний Новгород), НИИ ПЗ СО РАМН (Томск). Работа выполнена с привлечением более 20 опытных исследователей-экспертов, проводивших отбор, регулярное обследование и курсовое лечение больных Вальдоксаном.
В рамках исследования после скрининга (и в случае смены терапии - фазы «отмывания») проводилось изучение эффективности и переносимости Вальдоксана во время фазы активной терапии (6 нед). После периода «отмывания» пациенты вступали в фазу активной терапии (визит 1). На фоне терапии состояние пациентов оценивалось на 7-й день терапии (визит 2), 14-й день терапии (визит 3), 21-й день терапии (визит 4), 28-й день терапии (визит 5) и 42-й день терапии (визит 6). На всех промежуточных и заключительном визитах для верификации антидепрессивного и хронобиотического эффектов (в частности, купирующего расстройства сна и восстанавливающего дневную активность) проводили объективную и субъективную оценку депрессивного состояния пациента по стандартным шкалам HAMD-17, CGI-S, CGI-I, HADS. Для оценки сна использовали 10 визуальных аналоговых шкал вопросника для оценки сна Lееds (Leeds Sleep Evaluation Questionnaire, LSEQ4). С целью оценки безопасности на всех визитах регистрировали показатели жизненно важных функций (артериальное давление - АД, частота сердечных сокращений - ЧСС) и нежелательные явления (НЯ).
Вальдоксан назначали пациентам в суточной дозе 25 мг однократно на ночь. При недостаточной эффективности исследуемого препарата на 2-м визите (после 7 дней активной терапии) доза по усмотрению исследователя могла быть увеличена до 50 мг/сут однократно на ночь (максимально допустимая доза). Комплаентность на всем протяжении исследования оценивали на основании капсул, возвращенных пациентами (приемлемый диапазон от 80 до 120%).
Выборка была сформирована из 350 больных, страдающих депрессивными расстройствами, которые прошли процедуру скрининга. Из них 283 пациента полностью завершили исследование (6 нед активной терапии, 6-й визит), еще 12 больных завершили 4 нед активной терапии (визит 5) и 55 пациентов исключены до 5-го визита на разных этапах исследования.
Статистический анализ осуществляли с помощью лицензионных статистических пакетов SPSS 13.0 for Windows, Statistfca 7.0 for Windows5. Для всех применяемых критериев уровень значимости устанавливали равным 5%. Применяли двусторонние статистические критерии.
Проанализированы следующие показатели эффективности и переносимости:
- число больных с положительным эффектом терапии -терапевтическим ответом: сокращение суммарного балла по HDRS-17>50%, по шкале CGI не более 2 баллов;
- число больных, достигших ремиссии: суммарный балл HDRS-17<7;
- положительная динамика различных показателей депрессии, в том числе инсомнии, по данным оценочных шкал (HDRS-17, CGI-I, CGI-S, HADS, LSEQ);
- частота, тяжесть, длительность НЯ с учетом вероятности связи с используемым препаратом и необходимости фармакологической коррекции.
Результаты проанализированы с учетом исследуемых популяций (табл. 1):
ЗИП - зарегистрированные в исследовании пациенты (все включенные в исследование пациенты).
ППТ - пациенты, полностью прошедшие 6-недельную терапию Вальдоксаном (завершившие визит 6).
ПНТ - пациенты, прошедшие в соответствии с протоколом неполную терапию Вальдоксаном, но не менее 4 нед терапии (завершившие визит 5).
ИИП - исключенные из исследования пациенты. РЕСП - пациенты-респондеры. РЕМ - пациенты, достигшие ремиссии. Н-РЕСП - пациенты, у которых не зарегистрирован терапевтический ответ (популяция нонреспондеров).
Причины исключения из исследования до завершения 4-недельного курса терапии распределялись, как показано в табл. 2, следующим образом.
Таблица 3. Структура депрессивных расстройств в изучаемых выборках по диагнозу МКБ-10 (включая депрессивный эпизод - ДЭ, рекуррентный депрессивный эпизод - РДЭ, биполярную депрессию - БАР)
Таблица 4. Исходная оценка тяжести заболевания по шкале CGI-S в изучаемых выборках
Диагноз ППТ ПНТ ИИП ЗИП абс. % абс. % абс. % абс. % РДЭ (умеренный) 140 49,5 5 41,7 30 54,5 175 50,0 РДЭ (тяжелый) 49 17,3 0 0 6 10,9 55 15,7 ДЭ (умеренный) 61 21,6 4 33,3 15 27,3 80 22,9 ДЭ (тяжелый) 11 3,9 0 0 0 0,0 11 3,1 БАР (умеренный) 21 7,4 3 25,0 3 5,5 27 7,7 БАР (тяжелый) 1 0,4 0 0 1 1,8 2 0,6 Всего... 283 100,0 12 100,0 55 100,0 350 100,0
Тяжесть заболевания Балл ППТ ПНТ ИИП ЗИП абс. % абс. % абс. % абс. % Легкое расстройство 2 - - - - 2 3,6 2 0,6 Умеренное расстройство 3 199 70,3 11 91,7 40 72,7 249 71,1 Значительно болен 4 83 29,3 1 8,3 13 23,7 98 28,0 Тяжелое расстройство 5 1 0,4 - - - - 1 0,3 Всего... 283 100 12 100 55 100 350 100 Таблица 5. Шкала LSEQ - исходная оценка тяжести диссомнии в изучаемых выборках (m±sd)
Показатель ППТ ПНТ ИИП ЗИП Засыпание 40,6±12,0 35,6±16,4 42,9±14,4 40,7±12,6 Качество сна 41,5±11,6 43,8±13,6 40,9±15,1 41,5±12,2 Пробуждение 40,6±11,4 39,5±19,8 45,7±12,8 41,2±12,0 Цельность поведения 46,4±12,3 48,7±10,4 46,5±13,2 46,5±12,3 Исходные социодемографические и клинические параметры изучаемых выборок.
Результаты сравнительной оценки данных общей выборки пациентов, включенных в исследование, - ЗИП, выборок ППТ и ПНТ, которые прицельно анализировали с точки зрения эффективности применения Вальдоксана при депрессиях, по показателям половозрастного распределения, сопутствующим соматическим заболеваниям, клиническим (диагностическим) характеристикам депрессии, числу и длительности эпизодов патологии, средней длительности заболевания свидетельствуют о сопоставимости и репрезентативности последних (табл. 3). По формализованным исходным данным трудно прогнозировать неэффективность Вальдоксана, так как показатели пациентов выборки ИИП (исключенных из исследования) по основным параметрам сопоставимы с данными пациентов, завершивших исследование и включенных в окончательный анализ.
Исходные данные психометрических шкал также свидетельствовали о сопоставимости и репрезентативности выборок, включенных в анализ, и отсутствии значимых различий с выборкой пациентов, исключенных из исследования, в том числе по данным оценки общего состояния (шкала CGI-S) и нарушений сна (инсомнии/гиперсомнии) по вопроснику LSEQ (табл. 4, 5).
Результаты
Показатели эффективности.
В качестве основной выборки для общей оценки терапевтической активности, а также эффектов антидепрессивной направленности и связанных с улучшением нарушенного сна, анализировали данные динамики состояния пациентов, полностью завершивших 6-недельный курс терапии Вальдоксаном (ППТ). Социодемографические и основные клинические характеристики выборки, как уже отмечено, сопоставимы с показателями других групп и представлены в табл. 6.
Выявлено, что среднее значение общего балла по шкале HDRS-17 в ходе терапии статистически значимо снижается с очень большой степенью достоверности (р<0,0001) уже на 1-й неделе терапии (рис. 1). Улучшение общего показателя на фоне терапии с 23,6±4,5 до 8,2±5,4, происходящее позитивно, свидетельствует о значительной редукции симптоматики уже в первые 14 дней и отчетливой тенденции к ремиссии в группе респондеров.
Таблица 6. Социодемографические и клинические характеристики выборки ППТ (пациенты, полностью прошедшие 6-недельную терапию Вальдоксаном, - завершившие визит 6)
Показатель n Мужчины (n=65), % 23 Женщины (n=218), % 77 Возраст (M±Sd), лет 44,4±12,2 Сопутствующие заболевания, % 52,3 Работают, % 58,3 На инвалидности, % 8,1 Длительность заболевания (M±Sd), годы 6,3±7,3 Длительность обострения, (M±Sd), мес 3,8±4,6 Частота депрессий в анамнезе в выборках РДЭ и БАР, % 97,2 Частота зарегистрированных маний в анамнезе в выборке БАР, % 86,4 Оценка динамики гипотимической составляющей депрессии - суммарного индекса депрессии («депрессивное настроение», «чувство вины», «суицидальные намерения, «снижение работоспособности», «заторможенность») и отдельного показателя «депрессивное настроение» шкалы HDRS-17 - подтвердила статистически значимое улучшение (с очень большой степенью достоверности р<0,00001) уже на 1-й неделе терапии, визит 2 (рис. 2). Эти данные подтверждают быстроту проявления собственно антидепрессивого эффекта. Достоверность улучшения суммарного индекса депрессии была выше, т.е. динамика с учетом ряда ключевых симптомов депрессии была более быстрой, чем изменение изолированного показателя «депрессивное настроение».
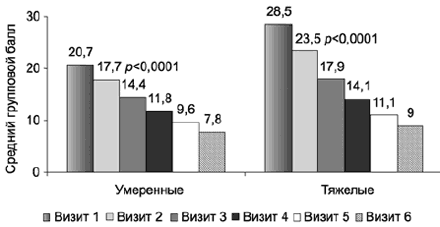
С учетом широкого спектра депрессий, варьирующих по клиническим характеристикам и степени тяжести, динамика общего балла, а также индекса депрессии по шкале HDRS-17 была проанализирована с выделением двух различающихся по степени тяжести патологии подгрупп: умеренной (n=179) и тяжелой (n=104) депрессий. Основной терапевтической дозой в обеих группах были 25 мг/сут, у 27,4% дозу повысили на 7, 14 или 28-й дни терапии. Несмотря на существенную разницу исходного балла, динамика улучшения не имела достоверных различий в обеих подгруппах - статистически значимое улучшение (p<0,0001) зарегистрировано уже на 1-й неделе в отношении как суммарного показателя, так и индекса депрессии. При этом снижение суммарного балла, зарегистрированное в подгруппе с тяжелыми нарушениями, оказывается достаточно показательным: уже после 3 нед терапии у большинства больных отмечены лишь расстройства легкой степени (<17 баллов): средний балл с 28,5±2,8 уменьшился до 14,1±6,2. На заключительном визите (после 6 нед терапии) средний общий балл уменьшился до 9,0±6,4, при этом половина больных из этой подгруппы достигли ремиссии («пограничное состояние» или «выздоровление» по CGI-S; рис. 3). В подгруппе депрессии с умеренной степенью тяжести отмечено улучшение общего балла с 20,7±2,3 до 7,8±4,7. В результате дополнительного анализа, проведенного в обеих подгруппах, выявлено более выраженное улучшение у тех пациентов, у которых обнаружены достоверные различия по среднему общему баллу HDRS-17 уже на 1-й неделе.
Рис. 1. Выборка ППТ: влияние терапии на сумму баллов по шкале HDRS-17.
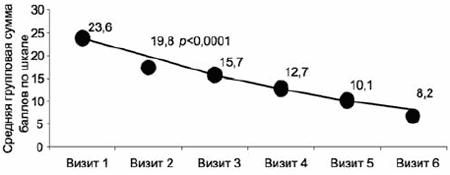
Рис. 2. Выборка ППТ: влияние терапии на индекс депрессии по шкале HDRS-17.
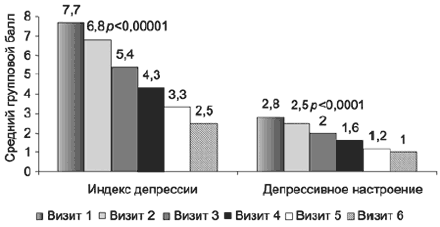
Рис. 3. Выборка ППТ: сравнение динамики состояния по показателям суммарного балла HDRS-17 в группах тяжелой и умеренной депрессий.
Сравнительная динамика индекса депрессии (рис. 4) также не демонстрирует достоверных различий, причем следует отметить, что при исходно значимо более высоких баллах в группе «тяжелые депрессии» уже на 3-й неделе терапии показатели в обеих группах выравниваются, а итоговый средний балл в группе с тяжелыми депрессиями оказывается даже более низким.
Согласно исходным данным особенностью данной выборки является значительная выраженность депрессивных проявлений, причем гипотимическая составляющая (депрессивный индекс HDRS-17) коррелирует не только с проявлениями нарушений сна, но и с тревожными расстройствами (тревожный индекс HDRS-17); аналогичная ситуация выявлена при анализе симптоматики с учетом общих баллов субшкал «тревоги» и «депрессии» HADS. Показатели динамики средних баллов по этим субшкалам HADS в ходе терапии статистически значимо снижаются с очень большой степенью достоверности (р<0,0001), уже на 1-й неделе терапии (рис. 5), причем как в общей выборке, так и в группах с умеренными и выраженными депрессивными расстройствами (рис. 6, 7).
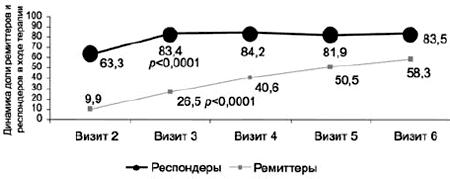
Сопоставление динамики общего балла по шкале HDRS-17 и субшкалам CGI показало, что статистически значимое (p<0,0001) увеличение доли респондеров и ремиттеров достигается уже в первые 2 нед терапии. По данным HDRS-17, статистически значимый прирост (p<0,001) доли респондеров отмечен уже на 1-й неделе терапии (визит 2), ремиттеров (р<0,001) - на 2-й (визит 3). Кроме того, по обоим показателям обнаружено значимое (р<0,001) увеличение процента больных на каждом последующем визите по сравнению с предыдущим (рис. 8).
По данным субшкалы CGI-I (менее чувствительной, чем HDRS-17, для оценки динамики депрессии), значимое улучшение отмечено на 2-й неделе терапии Вальдоксаном (рис. 9).
Сравнительный анализ (табл. 7) групп респондеров и нонреспондеров, разделенных по наличию терапевтического ответа по результатам 6-недельной терапии, выявил некоторые социодемографические и клинические особенности группы больных, у которых не зарегистрирован терапевтический ответ (в первую очередь большие значения средней длительности аффективного расстройства, а также большая частота лиц мужского пола, более высокий средний возраст). Сравнение динамики респондеров и нонреспондеров по шкале HDRS-17 показало, что в группе нонреспондеров хотя и отмечено улучшение в течение 6 нед терапии (с 22,5±4,3 до 15,3±5,0 балла), оно не соответствует критерию терапевтического ответа - 50% редукции симптоматики (рис. 10). Уже на 2-й неделе терапии (визит 3) выявлены значимые (р<0,0001) межгрупповые различия в интенсивности динамики между выборками Н-РЕСП и РЕСП/РЕМ, значимость и величина различий нарастает на последующих визитах. В то же время значимые различия в динамике между группами РЕСП и РЕМ появляются только на 5-м визите (р<0,001) и сохраняются до конца терапии.
Рис. 4. Терапевтическая динамика индекса депрессии по шкале HDRS-17 в группах с умеренными и тяжелыми депрессивными расстройствами.
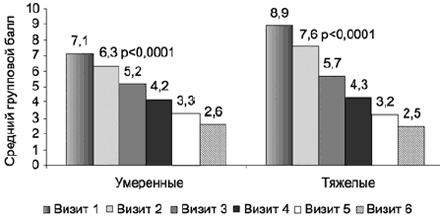
Рис. 5. Выборка ППТ: динамика среднего балла по субшкалам тревоги и депрессии по HADS.
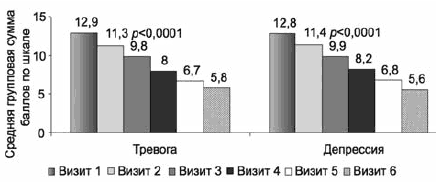
Рис. 6. Терапевтическая динамика по субшкале тревоги по HADS в группах с умеренными и тяжелыми депрессивными расстройствами.
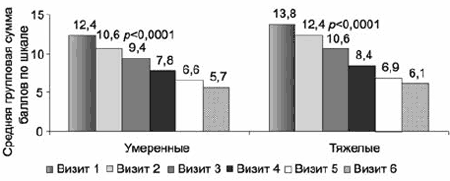
Рис. 7. Терапевтическая динамика по субшкале депрессии по HADS в группах с умеренными и тяжелыми депрессивными расстройствами.
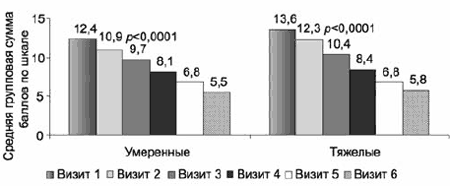
Рис. 8. Выборка ППТ: динамика доли (в %) респондеров и ремиттеров в ходе терапии по данным HDRS-17.
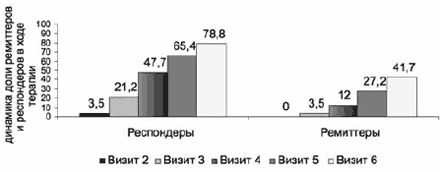
Рис. 9. Выборка ППТ: динамика доли респондеров и ремиттеров (в %) в ходе терапии по данным CGI-I.
Оценка динамики индекса депрессии («депрессивное настроение», «чувство вины», «суицидальные намерения», «снижение работоспособности», «заторможенность») шкалы HDRS-17 подтвердила статистически значимое различие в группах респондеров и нонреспондеров (рис. 11). Хотя общее значение по суммарному индексу депрессии в ходе терапии статистически значимо снижается с большой степенью достоверности (р<0,001) на 1-й неделе терапии во всех группах, на 2-й неделе выявляется значимость внутригрупповых различий, которая увеличивается в процессе терапии.
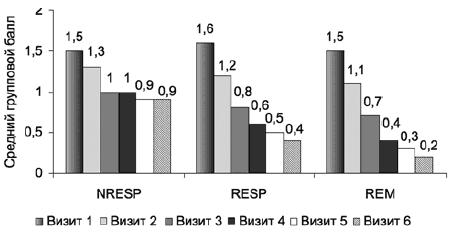
При сравнении динамики объективных критериев расстройств сна (ранняя и средняя инсомния) в группах нонреспондеров, респондеров и ремиттеров обнаружены межгрупповые различия на 2-й неделе терапии: группа Н-РЕСП по сравнению с группой РЕМ (р<0,0001) и группой РЕСП (р<0,01), с увеличением различий при сравнении с окончанием терапии (рис. 12, 13). При сравнение групп РЕСП и РЕМ выявлены различия по показателю «средняя инсомния» на 4-м визите (р<0,05), которые нарастают к концу терапии.
Таблица 7. Сравнение групп респондеров и нонреспондеров
Показатель Респондеры Нонреспондеры Мужчины, % 20,6 26,2 Женщины, % 79,4 73,8 Возраст (медиана), лет 44,5 49,0 Длительность заболевания (медиана), годы 3,2 5,3 Рис. 10. Сравнение динамики в группах респондеров/ремиттеров и нонреспондеров по шкале HDRS-17.
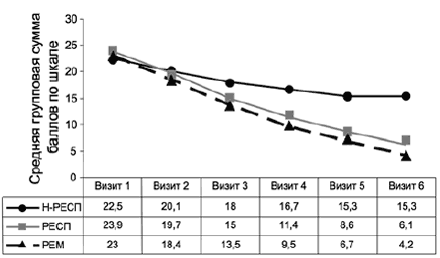
Рис. 11. Динамика индекса депрессии по шкале HDRS-17 в группах нонреспондеров, респондеров и ремиттеров.
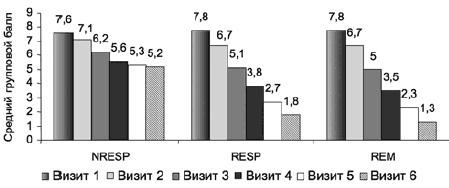
Рис. 12. Динамика показателя «ранняя инсомния» по HDRS-17 в группах нонреспондеров, респондеров и ремиттеров.
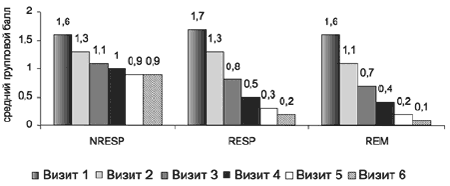
Рис. 13. Динамика показателя «средняя инсомния» по HDRS-17 в группах нонреспондеров, респондеров и ремиттеров.
В течение фазы активной терапии НЯ были отмечены у 20% пациентов - 68 наблюдений из 340 (табл. 8). В 12 (3,5%) случаях пациенты были исключены из исследования по причине выраженности НЯ или отказа больного от продолжения терапии Вальдоксаном (табл. 9). Среди всех наблюдений при экспертной оценке выявлено, что 24 из 96 НЯ имеют маловероятный характер связи наблюдаемого явления и приема Вальдоксана. Среди наиболее частых отмечены нарушения сна - 13 (3,8%) наблюдений и тошнота - 10 (3,4%), но ни один из выявленных побочных эффектов не достигал 5% барьера. В ходе 6-недельной терапии не выявлены серотониновый синдром, повышение массы тела, обострение суицидальных мыслей - побочные эффекты, отмечаемые при терапии некоторыми антидепрессантами других клинических групп.
НЯ, отмеченные у 68 больных, возникали преимущественно в начале терапии Вальдоксаном - на 1-й неделе (зарегистрированы на визите 2 у 42 пациентов), в ходе последующей терапии НЯ зарегистрированы у 19 больных на 14-й день (из них 8 больных, ранее не испытывавших НЯ), у 15 больных на 21-й день терапии (из них 8 больных, ранее не отмечавших НЯ), у 16 больных на 28-й день терапии (из них 10 больных, ранее не отмечавших НЯ), также 1 продолжающееся НЯ зарегистрировано на заключительном визите (42-й день терапии). Значительная часть НЯ носила эпизодический или краткосрочный характер и регистрировалась на одном визите. Только у 4 больных НЯ отмечены в течение 4 нед, у 6 больных длительность НЯ составила 3 нед, у 14 больных продолжительность НЯ составила 2 нед.
Оценка переносимости позволила определить в сочетании с эффективностью по CGI терапевтический индекс и, соответственно, рассмотреть долю респондеров с этой позиции. Полученные данные подтверждают важность включения оценки переносимости в итоговый результат (рис. 14).
Обсуждение
Комбинация антидепрессивного и хронобиотического, с улучшением качества сна, эффектов остается актуальной задачей на всех этапах терапии депрессии и определяет актуальность разработки препаратов с новым механизмом действия. К таким полифункциональным средствам относится Вальдоксан, обеспечивающий лечение депрессивных расстройств, а также быстрое стабильное восстановление цикла сон-бодрствование. Данные о механизме действия Вальдоксана соотносятся с современными концепциями патогенеза депрессий, при этом высокая безопасность и оптимальная переносимость свидетельствуют о перспективности использования препарата в клинической практике при депрессиях непсихотического уровня. Результаты натуралистического исследования «РИТМ» подтверждают целый ряд значимых эффектов и тенденций, выявленных в рамках РКИ. В частности, полученные данные совпадают с результатами международного многоцентрового сравнительного с венлафаксином РКИ, направленного на изучение особенностей терапевтической активности Вальдоксана при большой депрессии [15]. Как и в исследовании P.Lemoine и соавт., в исследовании «РИТМ» согласно оценке эффективности с помощью выделенного (путем факторного анализа) депрессивного индекса по HDRS-17, не включающего симптомы инсомнии, получены свидетельства, что реализация антидепрессивного эффекта Вальдоксана происходит независимо от влияния на пункты нарушений сна.
Рис. 14. Анализ эффективности Вальдоксана при депрессиях, по данным оценочных шкал.
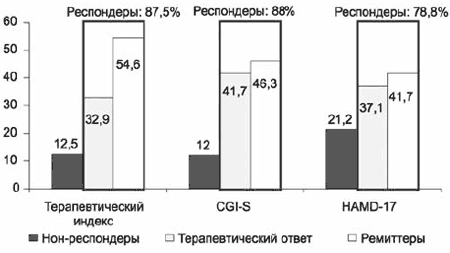
Таблица 8. НЯ (фаза активной терапии)*
* Характер связи между приемом Вальдоксана и НЯ оценивали эксперты по следующим рангам: маловероятный - МВ, вероятный - В, очень вероятный - ОВ.
НЯ Количество НЯ
(n=96)Выраженность легкая средняя тяжелая Нарушения сна, кошмарные сновидения 13 В-2, МВ-1 МВ-3, В-5 ОВ-2 Тошнота 10 МВ-1, В-5, ОВ-3 ОВ-1 Нарушение координации движений 7 МВ-2, ОВ-1 В-2, ОВ-2 Тревога 7 МВ-3, В-2 МВ-1, ОВ-1 Сонливость 7 В-2 В-1, ОВ-4 Сухость во рту 6 В-2, ОВ-4 Головокружение 6 В-1 В-3, ОВ-2 Головные боли 6 В-1 МВ-2, В-1, ОВ-1 МВ-1 Слабость 3 МВ-1 МВ-1, ОВ-1 Повышение АД 3 В-1 МВ-2 Раздражительность 3 В-1 МВ-1 ОВ-1 Тахикардия 3 В-2 МВ-1 Боли в теле 3 МВ-1, В-1 ОВ-1 Нарушение четкости зрения 2 В-1 В-1 Рвота 2 В-1 ОВ-1 Боль в сердце 2 В-1, ОВ-1 Трудности концентрации внимания 2 МВ-1 В-1 Потливость 2 В-1 В-1 Запоры 1 В-1 Гипергидроз, приливы 1 В-1 Зуд 1 МВ-1 Затрудненное мочеиспускание 1 В-1 Снижение слуха 1 В-1 Менструальноподобное кровотечение 1 В-1 Нарушение менструального цикла 1 МВ-1 Парестезии 1 ОВ-1 Аллергическая крапивница, отек Квинке 1 В-1 Таблица 9. Побочные эффекты, являющиеся причиной исключения из исследования «РИТМ»
НЯ Выраженность Связь с приемом Длительность Визит
исключенияЧисло
больных (n=12)Тревога, боли, диссомния Тяжелая Очень вероятная До 2 нед 3 1 Сонливость, нарушения внимания Умеренная Вероятная или маловероятная Менее 1 нед 3 1 Сухость во рту, дрожь, головокружение, головная боль Умеренная Вероятная или маловероятная До 2 нед 3 1 Головокружение, менструальноподобное кровотечение Умеренная Вероятная или маловероятная До 2 нед 5 1 Тревога, депрессия Умеренная Вероятная или маловероятная До 2 нед 4 Нарушения сна Умеренная Вероятная Менее 1 недели 5 1 Головокружение Умеренная Вероятная или маловероятная До 2 нед 3 1 Кошмарные сновидения Умеренная Вероятная Менее 1 нед 5 2 Тревога, диссомния Умеренная Вероятная или маловероятная До 2 нед 4 1 Нарушения концентрации внимания Умеренная Вероятная До 2 нед 5 1 Слабость, сонливость Умеренная Вероятная Менее 1 нед 5 1 Результаты терапии выборки больных, включенных в анализ (доли респондеров и ремиттеров, показатели темпа и значимости улучшения, определенные с помощью валидных психометрических шкал) свидетельствуют о том, что антидепрессант нового поколения Вальдоксан в целом сопоставим по уровню антидепрессивного эффекта с целым рядом антидепрессантов нового поколения и может применяться при лечении непсихотических депрессий.
Список использованной литературы
- Доклад Рабочей группы CINP на основе обзора доказательных данных. Терапия антидепрессантами и другие методы лечения депрессивных расстройств.М., 2008; с. 43-135.
- Левин ЯИ. Современная сомнология. Психические расстройства в общей медицине. М, 2007; 4: 61-72.
- Мосолов СН. Сравнительные полисомнографические характеристики больных биполярными фазно протекающими психозами с частыми («быстрые циклы») и редкими обострениями. Соц. и клин. психиат. 1992; 3:20-9
- Смулевич АБ., Дубницкая Э.Б. К построению дименсиональной ритмологической модели депрессий. Журн. неврол. и психиат. им. С.С.Корсакова. 2010; 1:4-10.
- Armstrong SM, McNulty OM, Guardiola-Lemaitre B et al. Successful use of S20098 and melatonin in an animal model of delayed sleep-phase syndrome (DSPS). Pharmacol Biochem Behav 1993; 46:45-9
- Boivin DB. Influence of sleep-wake and circadian rhythm disturbances in psychiatric disorders.] Psychiat Neurosci 2000; 25:446-58.
- Bourin M, Mocaer E, Porsolt R. Antidepressant-like activity of S 20098 (agomelatine) in the forced swimming test in rodents: involvement of melatonin and serotonin receptors.] Psychiatry Neurosci 2004; 29:126-33.
- Fahndrich E, Haug HJ. Diurnal variation of mood in psychiatric patients of different nosological groups. Neuropsychobiol 1998; 2 0:141-4.
- Ford DE, Kamerow DB. Epidemiological study of sleep disturbances and psychiatric disorders: an opportunity for prevention? JAMA 1989; 262: 1479-84
- Goodwin G, Rouillon F, Emsley R. Eur Neuropsychopharmacol. 2008; 18 (suppl. 4): S338. Abstract P2c025.
- Jindal RD, Thase ME. Treatment of insomnia associated with clinical depression Sleep Med Rev 2004; 8:19-30.
- Kasper S, Laigle L, BaylO F. Eur Neuropsychopharmacol 2008; 18 (suppl. 4): S336. Abstract P2c022.
- Kennedy SH, Emsley R. Placebo-controlled trial of agomelatine in the treatment of major depressive disorder. Eur Neuropsychopharmacol 2006; 16: 93-100
- KoenigsbergHW, TeicherMH,Mitropoulou Vet al. 24-h monitoring of plasma norepinephrine, MHPG, cortisol, growth hormone and prolactin in depression.J Psychiat Res 2004; 38:503-11.
- Lemoine P, Guilleminault C, Alvarez E. Improvement in subjective sleep in major depressive disorder with a novel antidepressant, agomelatine: randomized, double-blind comparison with venlafaxine.] Clin Psychiat 2007; 68: 1723-32.
- LeproultR, Van OnderbergenA,L'hermite-BaleriauxMet al.Phase-shifts of 24-h rhythms of hormonal release and body temperature following early evening administration of the melatonin agonist agomelatine in healthy older men. Clin Endocrinol (Oxf) 2005; 63: 298-304.
- Loo H, Hale A, D'haenen H. Determination of the dose of agomelatine, a melatonergic agonist and selective 5-НТ2С antagonist, in the treatment of major depressive disorder: a placebocontrolled dose range study. Int] Clin Psychopharmacol 2002; 17: 239-47
- LustbergL, Reynolds CF. Depression and insomnia: questions of cause and effect. Sleep Med Rev 2000; 4:253-62.
- Mannjj. The medical management of depression. N Engl] Med 2005; 353: 1819-34
- Mayers AG, Baldwin DS. Antidepressants and their effect on sleep. Hum Psychopharmacol 2005; 20:533-59
- MillanM], Gobert A, Lejeune F et al. The novel melatonin agonist agomelatine (S20098) is an antagonist at 5-hydroxytryptamine2c receptors, blockade of which enhances the activity of frontocortical dopaminergic and adrenergic pathways.J Pharmacol Exp Ther 2003; 306:954-64
- Montgomery SA, Kennedy SH, Burrows GD et al. Absence of discontinuation symptoms with agomelatine and occurrence of discontinuation symptoms with paroxetine: a randomized, doudle-blind, placebo-controlled discontinuation study. Int Clin Psychopharmacol 2004; 19:271-80.
- Mouret J, Lemoine P,MinuitMP et al. Effects of trazodone on the sleep of depressed subjects: a polygraphic study. Psychopharmacology (Berl) 1988; 95 (suppl): S37-43
- Nutt D, Paterson L. Sleep disorders as core symptoms of depression. Dialogs ClinNeuroscience 2008,10:329-36.
- Ohayon MM, Roth T. Place of chronic insomnia in the course of depressive and anxiety disorders.] Psychiat Res 2003; 37:9-15
- OliOjP, Emsley R. Confirmed clinical efficacy of agomelatine (25-50mg) in major depression: two randomized, double-blind, placebo-controlled studies. Eur Neuropsychopharmacol 15:416.
- Olie]Р, Kasper S. Efficacy of agomelatine, а МТ1/МТ2 receptor agonist with 5-HT2C antagonistic properties, in major depressive disorder [published online ahead of print May 4, 2007]. Int]Neuropsychopharmacol 2007; 10 (5): 661-73- doi:10.1017/S1461145707007766.
- Quera-SalvaMA, VanierB, Laredo] et al. Major depressive disorder, sleep EEG and agomelatine: an open-label study. Int ] Neuropsychopharmacol 2007; 10: 691-6.
- Papp M, Gruca P, BoyerP-A et al. Effect of agomelatine in the chronic mild stress model of depression in the rat. Neuropsychopharmacology 2003; 28: 694-703.
- Parrott AC, Hindmarch I. Factor analysis of a sleep evaluation questionnaire. Psychol Med 1978; 8:325-9
- Rascati K. Drug utilization review of concomitant use of specific serotonin reuptake inhibitors or clomipramine with antianxiety/sleep medications. Clin Ther 1995; 17: 786-90.
- Reynolds CF 3rd. Sleep and affective disorders: a minireview. Psychiatr Clin North Am 1987; 10:583-91
- Rosenberg RP. Sleep maintenance insomnia: strengths and weakness of current pharmacologic therapies. Ann Clin Psychiat 2006; 18:49-56.
- Spoormaker VI, van den Boutj. Depression and anxiety complaints: relations with sleep disturbances. Eur Psychiat 2005; 20:243-5
- Staner L, Cornette F, Maurice D et al. Sleep microstructure around sleep onset differentiates major depressive insomnia from primary insomnia. ] Sleep Res 2003; 12:319-30.
- Van Reeth O, Weibel L, Olivares E et al. Melatonin or a melatonin agonist corrects age-related changes in circadian response to environmental stimulus. Am] PhysiolRegulIntegr Comp Physiol 2001; 280: R1582-91
- Wilson S, Argyropoulos S. Antidepressants and sleep: a qualitative review of the literature. Drugs 2005; 65:927-47
- Winokur A Gary KA, Rodner S et al. Depression, sleep physiology, and antidepressant drugs. Depress Anxiety 2001; 14:19-28.
- Wirz-]ustice A. Diurnal variation of depressive symptoms. Dialogs Clin Neuroscience 2008; 10:337-44
| Ноябрь 2012 г. |