Тяжелая депрессия и антидепрессанты: результаты анализа объединенных данных плацебо-контролируемых исследований агомелатина
Severe depression and antidepressants: focus on a pooled analysis of placebo-controlled studies on agomelatineStuart A. Montgomerya, Siegfried Kasperb
International ClinicalPsychopharmacology 2007, 22:283-291 a Imperial College School of Medicine, University of London, London, UK; bDepartment of General Psychiatry, Medical University of Vienna, Vienna, Austria
Эффективность агомелатина при тяжелой депрессии оценивалась в трех плацебо-контролируемых исследованиях и анализе объединенных данных всех трех исследований у пациентов, получавших 25-50 мг агомелатина (n = 357) и плацебо (n = 360). Агомелатин достоверно превосходил по эффективности плацебо в подгруппе пациентов с тяжелой депрессией по критерию суммарного балла > 25 по 17-пунктовой Шкале депрессии Гамильтона, как в каждом исследовании отдельно (P<0.05), так и по результатам анализа объединенных данных (P<0.001). Результаты анализа объединенных данных свидетельствуют об увеличении различий между агомелатином и плацебо по мере нарастания исходной тяжести депрессии по критерию стартового балла Шкалы депрессии Гамильтона. После разделения всей выборки на подгруппы по разным граничным критериям тяжести с увеличением стартовых суммарных баллов Шкалы депрессии Гамильтона достоверное превосходство агомелатина над плацебо выявлено во всех подгруппах, даже несмотря на уменьшение числа пациентов при увеличении тяжести. Нарастание исходной тяжести депрессии сопровождалось увеличением различий между агомелатином и плацебо от 2.06 до 4.45 баллов по Шкале депрессии Гамильтона. Таким образом агомелатин является эффективным средством терапии тяжелой депрессии.
Ключевые слова: агомелатин, плацебо, тяжелая депрессия, терапевтический эффект
Введение
Большое депрессивное расстройство (БДР) является серьезным расстройством, распространенность которого на протяжении жизни оценивается в 16-17% в Европе и в США (Lepine et al., 1997; Kessler et al., 2003). Депрессия связана со значительной профессиональной и социальной дезадаптацией и занимает лидирующее положение среди всех заболеваний по показателям дезадаптации в развитых странах (Murray и Lopez, 1997). Поэтому терапия депрессии имеет большое значение для здравоохранения, как с позиции индивида, так и общества в целом.
Накоплено множество доказательств усугубления дезадаптации и повышения суицидального риска в связи с нарастанием тяжести депрессии (Nierenberg, 1994). Соответственно терапия тяжелой депрессии приобретает статус особенно важной задачи. Антидепрессанты обычно изучаются без учета уровней тяжести депрессии, однако для клинициста будет полезным знать препараты, эффективность которых дополнительно подтверждена в терапии тяжелой депрессии.
Определение тяжелой депрессии
Легкой, умеренное и тяжелое БДР рассматриваются как градации тяжести одного и того же расстройства, поскольку до сих пор не было получено данных, подтверждающих, что тяжелая депрессия представляет собой самостоятельное расстройство (Montgomery и Lecrubier, 1999). Все накопленные на сегодня данные свидетельствуют о существовании континуума между умеренной и тяжелой депрессией, в связи с чем все критерии их разграничения в той или иной мере условны. Тем не менее дифференцированная оценка эффективности антидепрессанта на разных уровнях тяжести депрессии требует использования критериев разграничения между умеренной и тяжелой депрессией. К сожалению, универсальных критериев тяжести не существует, а каждый и использующихся критериев имеет свои ограничения. В современных исследованиях широко используются критерии, основанные на суммарных баллах рейтинговых шкал, таких как Шкала депрессии Гамильтона (HAMD) (Hamilton, 1960) и Шкала депрессии Монтгомери-Асберг (MADRS) (Montgomery, Asberg, 1979), однако граничные баллы тяжести значительно варьируют, что затрудняет сопоставление результатов разных исследований. Чаще всего в качестве критерия тяжелой депрессии используется суммарный балл > 25 по шкале HAMD и суммарный балл > 30 по шкале MADRS. Показатель необходимости госпитализации, который используется в некоторых исследованиях в качестве критерия тяжелой депрессии, нельзя признать удовлетворительным в связи с значительными отличиями в стандартной практике ведения пациентов в разных странах, различиями в количестве коек между стационарами и в зависимости от уровня амбулаторной помощи. Шкала общего клинического впечатления - тяжесть заболевания (CGI-S), которая также используется для определения тяжести депрессии, имеет определенное преимущество, поскольку основана на клинической оценке исследователя, однако оценки по этой шкале варьируют в широких пределах.
Диагностические критерии, которые неизбежно основаны на наличии или отсутствии диагностических признаков или симптомов, направлены на квалификацию определенного состояния, т.е. БДР и мало приемлемы для выделения подгрупп пациентов с разной тяжестью депрессии. В МКБ-10, в которой отмечается повышение суицидального риска при тяжелой депрессии, указывается на «некоторые» симптомы, которые могут быть особенно выраженными или субъективно тягостными, среди которых без достаточных на то оснований выделяются нарушения сна, изменения аппетита и потеря в весе. В Диагностическом и статистическом руководстве по психическим расстройствам-IV (DSM-IV) TR (American Psychiatric Association, 2000) тяжелая депрессия без признаков психоза определяется либо по количеству симптомов, либо на основании выраженного снижения трудоспособности, привычной социальной активности или межличностных отношений. Соответственно диагноз БДР, для постановки которого требуется нарушение этих функций, во многом зависит от смысла, который вкладывается в термин «выраженное». Ни в DSM-IV TR, ни в МКБ-10 (ВОЗ, 1992) не содержится дефиниции тяжести депрессии, которая была бы достаточно точной для оценки эффективности терапии при разных уровнях тяжести депрессии.
Доказательство эффективности при тяжелой депрессии
Несмотря на методологические проблемы дефиниции тяжелой депрессии данные научных публикаций со всей очевидностью свидетельствуют о возможности доказательства не только эффективности антидепрессантов при депрессии, но и превосходства одних препаратов над другими по этому показателю. Наиболее известными из сравнительных исследований эффективности разных антидепрессантов при тяжелой депрессии, определяемой по критерию необходимости госпитализации, является серия работ Группы по исследованию антидепрессантов Датского Университета (Danish University Antidepressant Group). На основании данных ряда отдельных сравнительных исследований авторы сообщают, что трициклический антидепрессант (ТЦА) кломипрамин превосходит по эффективности селективные ингибиторы обратного захвата (СИОЗС) циталопрам и пароксетин, а также обратимый ингибитор моноаминоксидазы моклобемид (Danish University Antidepressant Group, 1986, 1990, 1993). Однако наряду со спорным критерием тяжелой депрессии (необходимость госпитализации) эти исследования имеют много других методологических недостатков. Например, в этих исследованиях не использовались стандартные диагностические инструменты, не предусматривались группы плацебо, пациенты имели сравнительно низкий стартовый суммарный балл HAMD (> 18). Авторы последующих обзорных публикаций по проблеме эффективности СИОЗС при тяжелой депрессии (Pande, Sayler, 1993; Hirschfeld, 1999) приходят к выводу, что СИОЗС не уступают ТЦА по уровню антидепрессивного эффекта в терапии тяжелой депрессии или меланхолической депрессии. Тем не менее, исследования датской группы инициировали распространенное теперь представление о том, что ТЦА более эффективны, чем антидепрессанты новых поколений, при тяжелой депрессии. Соответственно сохраняется недовольство уровнем эффективности антидепрессантов новых поколений.
Эффективность при тяжелой депрессии подтверждена для некоторых других антидепрессантов. В исследовании с участием госпитализированных пациентов показано, что венлафаксин в высоких дозах эффективен в терапии меланхолической депрессии у пациентов со стартовым суммарным баллом Шкалы депрессии Монтгомери-Асберг (MADRS), причем проявляет значимый эффект начиная с 4-го дня терапии (Guelfi et al., 1995). В другом исследовании показано, что венлафаксин превосходит по эффективности флуоксетина в терапии пациентов с меланхолической депрессией в рамках БДР (Clerc et al, 1996). Эти данные подтверждают, что двойной механизм действия с подавлением обратного захвата серотонина и норадреналина более эффективен при тяжелой депрессии. В нескольких обзорных публикациях по эффективности венлафаксина содержатся данные, подтверждающие такую точку зрения, однако следует подчеркнуть, что столь высокий эффект венлафаксина проявляется только при назначении высоких доз свыше 150 мг (Hirschfeld, 1999; Thase, 2000; Sonawalla, Fava, 2001). Необходимы дальнейшие исследования для доказательства сопоставимости антидепрессантов этого класса. Например, до сих пор не получено никаких подтверждений того, что лицензированный позднее двойной блокатор обратного захвата серотонина и норадреналина, дулоксетин, эффективен при тяжелой депрессии, поскольку пациенты с тяжелой депрессией исключались из основных плацебо-контролируемых исследований этого антидепрессанта. В относительно небольшом 8-недельном исследовании с участием 157 пациентов с меланхолическими депрессиями в рамках БДР и стартовым суммарным баллом HAMD > 25 показано, что миртазапин в средней суточной дозе 50 мг сопоставим по эффективности с венлафаксином в средней дозе 250 мг/сут (Guelfi et al, 2001), что позволяет прогнозировать эффективность миртазапина при тяжелой депрессии. Данные анализа результатов исследований миртазапина подтверждают такое предположение (Kasper, 1997).
В исследования эффективности отдельных антидепрессантов обычно включается небольшое число пациентов, которого недостаточно для адекватного анализа эффективности в подгруппах больных с разной тяжестью депрессии. Широко используемый метод решения проблемы малых выборок предполагает мета-анализ объединенных данных нескольких одинаковых исследований для оценки эффективности в подгруппе пациентов с тяжелой депрессией. В результате мета-анализа, выполненного Anderson и Tomenson (1994), показано, что у пациентов с наибольшими стартовыми баллами HAMD стандартные ТЦА не отличаются по эффективности от флувоксамина, пароксетина или циталопрама, но превосходят по эффективности флуоксетин. В ходе анализа объединенных данных девяти плацебо-контролируемых исследований (Montgomery et al, 1994) установлена эффективность циталопрама при тяжелой депрессии по критериям баллов HAMD, но только при назначении этого антидепрессанта в дозах не менее 40 мг/сут. Сходные данные получены и по пароксетину, который оказался эффективнее плацебо у пациентов с тяжелой депрессией (21-пунктовая HAMD, суммарный балл > 28) (Montgomery, 1992). Эффективность циталопрама также подтверждена в анализе объединенных данных подгруппы пациентов с меланхолической депрессией в рамках БДР (Tignol et al, 1992). Недавно был опубликованы результаты мета-анализа исследований эсциталопрама, подтверждающие, что эсциталопрам эффективен при тяжелой депрессии (Lepola et al, 2004), а по данным проспективного очного сравнения у пациентов со стартовым суммарным баллом MADRS > 30 превосходит по эффективности циталопрам (Moore et al, 2005) и пароксетин (Boulenger et al, 2006).
В нашем анализе использовалось несколько критериев тяжелой депрессии для оценки эффективности агомелатина, нового антидепрессанта, действующего как агонист мелатонинергических MT1 и MT2 рецепторов и антагонист серотонинергических 5HT2C рецепторов, в терапии тяжелой депрессии. Антидепрессивный эффект агомелатина подтвержден в трех двойных-слепых рандомизированных плацебо-контролируемых исследованиях (Loo et al., 2002; Kennedy, Emsley, 2006; Olie, Kasper [в печати]) (Таблица 1). В исследовании Loo et al. (2002) три дозы агомелатина (1, 5 и 25 мг) сравнивались с плацебо и пароксетином, который использовался как активный препарат сравнения, при 8-недельной терапии 711 пациентов с депрессией. Две меньшие дозы не отличались от плацебо, тогда как доза 25 мг достоверно превосходила плацебо, как по главному (баллы шкалы HAMD), так и дополнительным (другие шкалы) параметрам эффективности. Пароксетин 20 мг также был эффективным. В этом исследовании идентифицирована минимальная эффективная доза агомелатина - 25 мг однократно в сутки вечером. В двух других исследованиях предусматривался гибкий режим дозирования: у пациентов без признаков улучшения по завершении 2 недель терапии агомелатином в стартовой дозе 25 мг проводилось двойное-слепое двукратное повышение дозы до 50 мг/сут, которая сохранялась на протяжении оставшихся 6 недель терапии. Ни исследователи, ни пациенты не знали критериев повышения дозы. Активные препараты сравнения в этих исследованиях не использовались.
Показатели преждевременной отмены терапии были одинаково низкими во всех трех исследованиях: 15.8% в группе агомелатина и 18.1% в группе плацебо. Частота преждевременной отмены из-за нежелательных явлений также была одинаковой для агомелатина и плацебо (4.4% и 6.6% соответственно). Агомелатин в эффективных суточных дозах 25-50 мг хорошо переносился пациентами и обнаруживал благоприятный профиль нежелательных явлений (НЯ). Наиболее частыми НЯ в группах агомелатина и плацебо были головная боль (7.7% против 13.7%), тошнота (5% против 6.3%) и головокружение (5% против 3.6%). Каждое исследование имело достаточно мощности для выявления различий между активной терапией и плацебо. В нашем исследовании был предпринят анализ объединенных данных указанных трех исследований с целью повышения мощности для оценки эффективности агомелатина в подгруппе пациентов с тяжелой депрессией.
Методы
В трех исследованиях, включенных в анализ объединенных данных, использовались одинаковые методы: в них включались пациенты с сопоставимыми уровнями тяжести депрессии в соответствии с баллами HAMD (17-пунктовая версия) (Hamilton, 1967) (основная шкала) и баллами CGI (дополнительная шкала). Исследования несколько различались по длительности терапии, которая составила 8 недель в исследовании Loo et al. (2002) и 6 недель в двух других исследованиях.
После объединения данных всех трех исследований был предпринят анализ общей выборки терапии (ITT), в которую включались все рандомизированные пациенты, получившие минимум одну дозу препарата и завершившие минимум одну оценку по главной шкале после стартовых измерений. Для заполнения пробелов в данных использовался консервативный метод замещения недостающего значения предыдущим (LOCF).
В подгруппу тяжелой депрессии включались пациенты со стартовым баллом 17-пунктовой шкалы HAMD > 25. Дополнительные анализы чувствительности оценки различий между активным препаратом и плацебо проводились в подгруппах пациентов со стартовыми баллами HAMD > 24, > 25, > 26, > 27, > 28, > 29 и > 30 и стартовыми баллами Шкалы общего клинического впечатления - Тяжесть заболевания (CGI-S) > 4 или > 5.
Еще один анализ проводился в подгруппе тяжелой депрессии, сформированной по комбинированному критерию: балл CGI-S > 5 (выраженная депрессия) в сочетании с суммарным баллом HAMD > 25; такой анализ был запланирован в двух исследованиях (Kennedy, Emsley, 2006; Olie, Kasper [в печати]), но не предусматривался в третьем исследовании (Loo et al, 2002).
В дальнейшем влияние тяжести депрессии на терапевтический эффект агомелатина в сравнении с плацебо изучалось в ходе анализа объединенных данных с разделением пациентов на отдельные подгруппы по принципу нарастания стартовых показателей тяжести депрессии.
Таблица 1. Суммарный балл HAMD17 (среднее±SD): результаты оценки общей выборки терапии в трех плацебо-контролируемых исследованиях агомелатина, включенных в анализ объединенных данных
E (SE), расчетное (стандартная ошибка) различие между группами; HAMD, Шкала депрессии Гамильтона; SD, стандартное отклонение.
Исследование N пациенты Стартовый балл Финальный балл E(SE) P Loo et al. (2002) Агомелатин 25 мг 135 27.4 + 2.7 12.8 ±8.2 2.57 (1.03) 0.034a Плацебо 136 27.4 ±3.1 15.3 ±8.9 Пароксетин 20 мг 144 27.3 ±3.4 13.1 ±8.4 0.030b Kennedy, Emsley (2006) Агомелатин 25-50 мг 106 26.5 ±2.8 14.1 ±7.7 2.30 (1.02) 0.026c Плацебо 105 26.7 ±3.0 16.5 ±7.4 Olie, Kasper [в печати] Агомелатин 25-50 мг 116 27.4 ±2.7 13.9 ±7.7 3.44 (0.91) 0.001c Плацебо 119 27.2 ±2.7 17.0 ±7.9
a Парное сравнение с плацебо с помощью теста Dunnett.
b Двусторонний тест Student для независимых выборок.
c Ковариационный анализ с поправкой на центр и стартовые показатели.С целью оценки эффективности агомелатина у пациентов пожилого возраста проводился отдельный анализ в подгруппе больных депрессией в возрасте > 60 лет.
В анализе также использовались еще не опубликованные данные специального исследования с участием пациентов с тяжелой депрессией в пожилом возрасте. В этом исследовании основным показателем эффективности был суммарный балл шкалы MADRS (Montgomery, Asberg, 1979), а в качестве дополнительных показателей использовались баллы шкалы HAMD. Использовались два критерия тяжести депрессии: стартовый суммарный балл MADRS > 30, который указывается в качестве критерия тяжелой депрессии в рекомендациях CPMP (CPMP/EWP/518/ 97); комбинированный критерий - стартовый суммарный балл MADRS > 30 в сочетании со стартовым баллом CGI-S > 5.
Статистические методы
В ходе мета-анализа рассчитывался средний суммарный эффект на основании показателей терапевтического эффекта в сравнении с плацебо, полученных в каждом из трех исследований. Анализ проводился в три этапа.
Терапевтический эффект в каждом исследовании рассчитывался по суммарным финальным баллам HAMD (последнее измерение после инициальной оценки) методом LOCF за 8-недельный период в исследовании Loo et al. (2002) и 6-недельный период в двух других исследованиях.
Различие между агомелатином и плацебо оценивалось в каждом исследовании методом ковариационного анализа с учетом в качестве ковариант таких факторов, как стартовые баллы, метод терапии и центр исследования. Гомогенность показателей терапевтического эффекта в трех исследованиях оценивалась методами дескриптивной статистики для терапии и расчетов различий между агомелатином и плацебо в каждом исследовании. Также проводился тест гетерогенности терапевтического эффекта в трех исследованиях (Whitehead, Whitehead, 1991).
В каждом анализе общий терапевтический эффект в сравнении с плацебо оценивался с помощью модели случайных эффектов, которая адекватна в случае гомогенности показателей терапевтического эффекта в трех исследованиях и в случае гетерогенности показателей выраженности терапевтического эффекта. Суммарный терапевтический эффект рассчитывался как взвешенное среднее трех показателей терапевтического эффекта с учетом варианты расчетного терапевтического эффекта и источника вариаций этого показателя между тремя исследованиями.
Дополнительный анализ связи между инициальным уровнем тяжести депрессии и терапевтическим эффектом был предпринят для оценки четырех отдельных подгрупп пациентов, выделенных по принципу увеличения стартового суммарного балла HAMD: 22-25, 26-27, 2830 и более 30 баллов. Три подгруппы со стартовыми баллами HAMD от 22 до 30 были примерно одинаковыми по объему, четвертая подгруппа с баллом HAMD более 30 была меньше. Различие в финальных суммарных баллах HAMD (LOCF) между агомелатином и плацебо рассчитывались к каждой подгруппе методом ковариационного анализа. Проводился взвешенный регрессионный анализ с включением различий в терапии в качестве зависимых переменных и средних стартовых баллов HAMD в пределах каждого интервала в качестве независимых переменных. Нагрузки представляли собой инверсию расчетных вариант (квадраты SE) терапевтического эффекта.
В ходе анализа данных специального исследования с участием пожилых пациентов различие между агомелатином и плацебо оценивалось с помощью двустороннего t-теста Student для независимых выборок. Различия в суммарных баллах HAMD и MADRS оценивались на каждом визите с помощью вариационного анализа с повторными измерениями с учетом следующих факторов: терапия, время и взаимодействие терапия x время. Для всех анализов ошибка I типа была установлена на двустороннем уровне 5%.
Результаты
В каждом из трех исследований, включенных в анализ, была показана более высокая эффективность агомелатина в сравнении с плацебо в подгруппах пациентов с тяжелой депрессией по критерию стартового суммарного балла HAMD > 25 (Таблица 1).
В результате анализа объединенных данных в этой тяжелой подгруппе (суммарный балл HAMD > 25) значение общего эффекта после внесения поправки свидетельствовало о том, что агомелатин превосходит по эффективности плацебо (P<0.001) (Таблица 2). Сопоставимые анализы с применением модели смешанных эффектов или поправками на гетерогенность привели к сходным результатам.
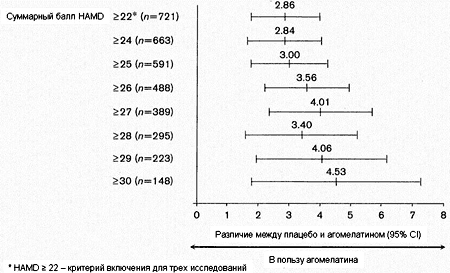
Результаты анализа при разных критериях тяжести по HAMD с поправкой на стартовые показатели и центры исследования также свидетельствуют о превосходстве агомелатина в сравнении с плацебо в терапии тяжелой депрессии при использовании любого критерия тяжести (P<0.001) (Таблица 3). Различие между агомелатином и плацебо на момент финальной оценки возрастало по мере увеличения тяжести депрессии по стартовым баллам HAMD (Таблица 3, Рисунок 1). Разница в финальных показателях HAMD между агомелатином и плацебо составила 3 балла при использовании критерия инициальной тяжести депрессии > 25 баллов по HAMD и увеличивалась до 4.53 баллов у пациентов со стартовым баллом HAMD > 30.
Как показано в Таблице 4 агомелатин достоверно превосходил по эффективности плацебо во всех четырех подгруппах пациентов с тяжелой депрессией, различающихся по критериям тяжести депрессивного состояния. Разница между агомелатином и плацебо неуклонно увеличивалась при нарастании стартовой тяжести депрессии (Рисунок 2) с 2.06 до 4.45 баллов HAMD.
В результате регрессионного анализа также выявлена тенденция (P = 0.052) к увеличению размера терапевтического эффекта агомелатина при нарастании исходной тяжести депрессии.
Таблица 2. Агомелатин в сравнении с плацебо в подгруппе пациентов со стартовым баллом HAMD > 25 (анализ LOCF с поправкой) по результатам отдельных исследований (среднее±SD) и анализа объединенных данных
CI, доверительный интервал; E, расчетное различие между методами терапии; HAMD, Шкала депрессии Гамильтона; LOCF, замещение недостающего значения предыдущим; SD, стандартное отклонение; SE, стандартная ошибка.
Число пациентов агомелатин/плацебо Финальный балл HAMD агомелатин Финальный балл HAMD плацебо E (SE) 95% CI P Loo et al. (2002) 121/117 13.3 ±8.4 16.3 ±9.7 2.73 (1.13) 0.52-4.95 0.016a Kennedy, Emsley (2006) 76/75 14.4 ±7.9 17.3 ±7.2 2.72 (1.19) 0.37-5.08 0.024a Olie, Kasper [в печати] 99/103 14.6 ±7.7 17.6 ±8.1 3.41 (1.02) 1.40-5.41 <0.001a Анализ объединенных данных 295/296 14.0 ±8.0 17.2 ±8.5 3.00 (0.64) 1.75-4.24 <0.001b
a Ковариационный анализ с поправкой на центр и стартовые показатели.
b Результаты мета-анализа.Таблица 3. Эффективность агомелатина в сравнении с плацебо при разных уровнях тяжести депрессии (стартовый суммарный балл HAMD >24–30) по результатам анализа финальных суммарных баллов HAMD в объединенных данных (LOCF) с поправкой на стартовые показатели и центр исследования.
A, Агомелатин; CI, доверительный интервал; E (SE), расчетное (стандартная ошибка) различие между группами; HAMD, Шкала депрессии Гамильтона; LOCF, замещение недостающего значения предыдущим; П, плацебо; А, агомелатин.
Стартовый балл HAMD > 24 25 26 27 28 29 30 Число пациентов П
AП
AП
AП
AП
AП
AП
A333
330295
296244
244189
200142
153118
10576
72E (SE) 2.84 (0.60) 3.00 (0.64) 3.56 (0.70) 4.01 (0.85) 3.40 (0.93) 4.06 (1.07) 4.53 (1.40) 95% CI 1.66-4.02 1.75-4.24 2.2-4.93 2.34-5.68 1.58-5.22 1.95-6.17 1.80-7.27 Значенине Pa <0.001 <0.001 <0.001 <0.001 <0.001 <0.001 <0.001
a Результаты мета-анализа.Рисунок 1. Эффективность агомелатина 25-50 мг в сутки в сравнении с плацебо при разных уровнях тяжести депрессии по критерию стартового балла HAMD: анализ объединенных данных трех позитивных кратковременных плацебо-контролируемых исследований; P<0.001 на всех уровнях тяжести.
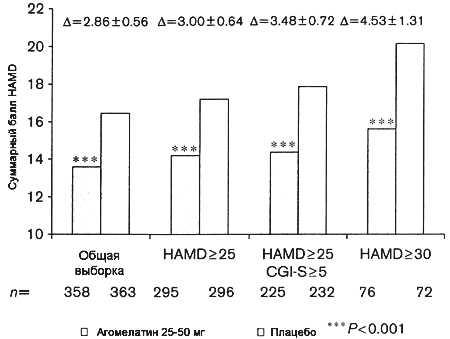
Агомелатин также достоверно превосходил по эффективности плацебо (различие: 3.48 CI = 2.08-4.89, P<0.001) по результатам анализа объединенных данных в подгруппе пациентов с тяжелой депрессией, определяемой на основании комбинированного критерия тяжести: стартовый балл CGI-S > 5 (выраженная депрессия) в сочетании со стартовым баллом HAMD > 25 (Рисунок 3). В группе агомелатина 357 пациентов имели стартовый балл CGI-S > 4 и 240 пациентов - балл CGI-S > 5. В группе плацебо 362 пациента имели стартовый балл CGI-S > 4 и 255 пациентов - балл CGI-S > 5. Лишь у единичных пациентов зафиксирован стартовый CGI-S > 6. В результате анализа эффективности в подгруппах тяжелой депрессии по критерию стартового балла CGI выявлено сходное увеличение размера эффекта агомелатина в сравнении с плацебо по мере нарастания исходной тяжести депрессии. По завершении терапии различие в финальных баллах HAMD составило 2.90 балла (SE: 0.56) (P<0.001) при сравнении групп пациентов со стартовым баллом CGI-S > 4 и 3.22 балла (SE: 0.69) при сравнении групп пациентов со стартовым баллом CGI-S > 5 (P<0.001) (анализ LOCF с поправкой на стартовые показатели и центр исследования).
Таблица 4. Эффективность агомелатина в сравнении с плацебо при разных уровнях тяжести депрессии по стартовым баллам HAMD: результаты анализа объединенных данных трех позитивных кратковременных плацебо-контролируемых исследований: анализ финальных суммарных баллов HAMD - агомелатин 25-50 мг - 6/8 недель; поправка на стартовые показатели и центр исследования.
CI, доверительный интервал; E, расчетное различие между группами; HAMD, Шкала депрессии Гамильтона.
Балл HAMD N E 95% CI Значение P 22-25 233 2.06 0.31;3.81 0.021 26-27 193 3.31 1.10;5.52 0.003 28-30 215 3.46 1.34;5.59 0.001 >30 80 4.45 0.57;8.33 0.025 Рисунок 2. Эффективность агомелатина в сравнении с плацебо в отдельных подгруппах с разными стартовыми баллами HAMD: результаты анализа объединенных данных трех позитивных кратковременных плацебо-контролируемых исследований: анализ финальных суммарных баллов HAMD – агомелатин 25-50 мг – 6/8 недель; поправка на стартовые показатели и центр исследования.
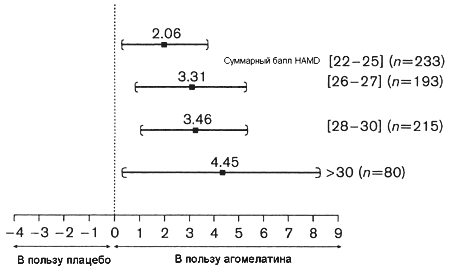
Рисунок 3. Редукция суммарных баллов HAMD у пациентов с тяжелой депрессией, получавших 25-50 мг/сут в течение 6-8 недель (мета-анализ данных 3-х позитивных исследований) в зависимости от критерия тяжести депрессии (HAMD > 25, HAMD > 25 и CGI-S > 5, HAMD > 30).
Пожилые пациенты с тяжелой депрессией
В выборке анализа объединенных данных трех позитивных плацебо-контролируемых исследований 29 пациентов в группе агомелатина и 24 в группе плацебо были в возрасте 60 лет или старше. В этой подгруппе различие между агомелатином и плацебо в финальных суммарных баллах HAMD (LOCF) составило 4.50 балла (SE 2.11) (P = 0.033). Однако число пациентов указанного возраста с тяжелой депрессией было недостаточным для адекватного тестирования эффективности терапии.
В еще не опубликованном специальном исследовании агомелатина у пожилых пациентов с депрессией, в котором не было получено достоверных различий между агомелатином и плацебо, 48.1% выборки исследования имели стартовый балл MADRS > 30. По результатам анализа в этой подгруппе различие между агомелатином и плацебо составило 3.97балла (SE: 2.14) по шкале MADRS (P = 0.066).
Пациенты, соответствующие комбинированному критерию тяжелой депрессии, стартовый суммарный балл MADRS > 30 в сочетании со стартовым баллом CGI-S > 5, составили 40.6% от общей выборки исследования. В соответствии с результатами анализа финальных баллов MADRS (LOCF) различие между агомелатином 25 мг и плацебо равнялось 5.58 балла (SE: 2.32) (P= 0.018).
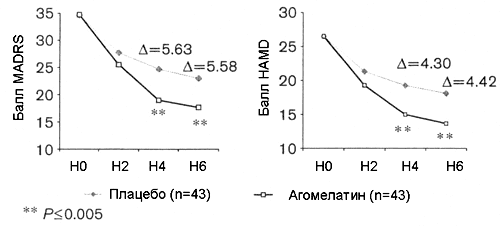
Различия между плацебо и агомелатином 25 мг в финальных суммарных баллах MADRS и HAMD в подгруппе пациентов со стартовым суммарным баллом MADRS > 30 в сочетании со стартовым баллом CGI-S > 5 были достоверными на 4 и 6 неделях терапии (Рисунок 4).
Рисунок 4. Подгруппа пожилых пациентов с тяжелой депрессией (возраст > 60 лет, стартовый балл MADRS > 30 и стартовый балл CGI > 5) в специальном плацебо-контролируемом исследовании. Агомелатин отличается от плацебо на 5.58 баллов (P= 0.002) MADRS и 4.42 баллов (P= 0.004) HAMD через 6 недель терапии. Вариационный анализ с повторными измерениями (метод замещения недостающего значения предыдущим, LOCF).
ОбсуждениеРезультаты анализа объединенных данных трех исследований свидетельствуют о высокой эффективности агомелатина в терапии пациенты, страдающих тяжелой депрессией. Эффективность при тяжелой депрессии, определяемой по одному из критериев, использованных в настоящем анализе, также показана в каждом из трех плацебо-контролируемых исследований агомелатина (Loo et al, 2002; Kennedy, Emsley, 2006; Olie, Kasper [в печати]). Увеличение числа пациентов за счет объединения данных трех исследований позволило нам оценить не только эффективность агомелатина при тяжелой депрессии в целом, но и выполнить дифференцированную оценку при разных уровнях тяжести депрессивных расстройств. В результате такого инновационного подхода к изучению связи эффекта с уровнем тяжести подтверждена тенденция к увеличению различий между агомелатином и плацебо по мере нарастания тяжести деперссивного состояния. Увеличение эффекта показано с использованием двух независимых методов формирования подгрупп пациентов с тяжелой депрессией на основании стартовых баллов шкал HAMD и CGI-S. На основании полученных результатов, свидетельствующих об увеличении отличий от плацебо, можно предположить, что агомелатин обладает особенно высокой эффективностью в терапии тяжелая депрессия. Полученные нами данные приводят к вопросу о том, являются ли установленные тенденции к увеличению эффекта при нарастании тяжести депрессии специфичными только для агомелатина, и определяют актульаность сходных анализов эффективности других антидепрессантов для уточнения уровня их эффекта при тяжелой депрессии.
Относительно СИОЗС на сегодня опубликованы только данные сравнительного анализа эффективности циталопрама и эсциталопрама (Lam и Andersen, 2006). В соответствии с этими данными терапевтический эффект циталопрама не увеличивается при нарастании инициальной тяжести депрессии в отличие от эсциталопрама и, как было показано в нашем анализе, агомелатина. На основании результатов этих двух анализов можно предположить, что размер терапевтического эффекта агомелатина и эсциталопрама увеличивается по мере нарастания тяжести депрессии.
Среди методов оценки тяжести депрессии наиболее широкое применение и признание находят рейтинговые шкалы HAMD и MADRS. В ранних исследованиях в качестве критерия тяжелой депрессии чаще всего использовался стартовый суммарный балл 17-пунктовой шкалы HAMD > 25, однако в ряде современных работ применялся более строгий критерий с повышением требуемого стартового балла HAMD до > 27. В данных последних исследований обращает на себя внимание тот факт, что при повышении пограничных стартовых баллов HAMD стартовые баллы шкалы CGI-S у тех же пациентов остаются без изменений, т.е. такое увеличение баллов HAMD не сопровождается значимым нарастанием тяжести депрессии по оценке клиницистов. В связи с этим можно предположить, что баллы шкалы HAMD либо недооценивались в ранних исследованиях, либо переоцениваются в современных работах. Учитывая повышенное внимание к предварительному обучению исследователей работе со шкалами перед началом исследования более адекватным представляется второе предположение, хотя доказать это достаточно трудно. Следует отметить и значительную вариабельность в оценках исследователей по шкале HAMD, которая не предусматривает четких инструкций для определения тяжести по каждому пункту. Наиболее распространенным критерием тяжелой депрессии по шкале MADRS является стартовый суммарный балл > 30, хотя используются и другие пограничные баллы. Несмотря на определенную условность любых критериев тяжести депрессии, основанных на пограничных баллах, тем не менее такой подход обеспечивает возможность отграничения более тяжелого расстройства от менее тяжелого в пределах одной группы пациентов, состояние которых квалифицируется как БДР умеренной-тяжелой степени.
Отдельные исследования эффективности агомелатина в сравнении с плацебо имели достаточно мощности для подтверждения различий между активным препаратом и плацебо в общих выборках больных депрессии, однако эти выборки были недостаточно большими для проведения адекватного анализа в подгруппах больных с тяжелой депрессией. Метод мета-анализа объединенных данных трех позитивных исследований обеспечивает достаточно большую группу пациентов с тяжелой депрессии, адекватную для такого анализа. Однако мета-анализ также имеет целый ряд методологических недостатков, наиболее важный из которых связан с потенциальными различиями между объединяемыми исследованиями. Наш анализ можно признать адекватным, поскольку во все три исследования включались пациенты с сопоставимым инициальным уровнем тяжести депрессии и использовались одинаковые инструменты - 17-пунктовая шкала HAMD как главный инструмент и шкала CGI как дополнительный инструмент оценки. Единственное существенно различие касается длительности исследований, одно из которых продолжалось 8 недель, а два других - по 6 недель. Во всех трех исследованиях, данные которых были включены в наш анализ, эффективность агомелатина была подтверждена на общих выборках и отдельно в подгруппе пожилых пациентов (60 лет и старше). Однако в целом число пожилых пациентов было недостаточным для отдельной оценки эффективности при тяжелой депрессии в этом возрасте. В специальном исследовании с участием пожилых пациентов не удалось обнаружить достоверных отличий агомелатина от плацебо - результат, зафиксирован во многих неопубликованных исследованиях других антидепрессантов, в которых также не наблюдалось статистически достоверного превосходства активных препаратов над плацебо. В исследовании, в котором сертралин достоверно отличался от плацебо (Schneider et al, 2003), разница между этим антидепрессантом и плацебо составила всего лишь 1 балл по шкале HAMD, что оказалось достаточным для подтверждения статистической достоверности в связи с большим объемом выборки. Тем не менее, в результате нашего анализа получено подтверждение эффективности агомелатина у пациентов, соответствующих post-hoc критерию тяжелой депрессии.
Рost-hoc анализы данных указанного специального исследования агомелатина в терапии пожилых пациентов свидетельствуют об эффективности агомелатина в подгруппе пациентов с наиболее тяжелыми депрессивными состояниями с достаточно большим количественным отличием от плацебо. Также показано, при лечении пожилых пациентов с тяжелой депрессией размер терапевтического эффекта агомелатина 25 мг в сравнении с плацебо увеличивается по мере нарастания инициальной тяжести депрессивного расстройства. Эти данные согласуются с результатами оценки общих выборок больных депрессией, в которых показана сходная тенденция к увеличению эффекта при нарастании инициальной тяжести депрессии. Наше исследование имеет определенные недостатки. Анализ основан на данных всего лишь трех исследований, выборки которых ограничены. Очевидно, что при наличии более крупной выборки будет значительно легче выявить связь между эффективностью и уровнем тяжести депрессии. Малое число пациентов, располагающихся на крайних точках континуума тяжести затрудняет экстраполяцию полученных результатов на случаи депрессии с суммарным баллом HAMD выше 30 или ниже 24. Те же ограничения касаются и шкалы CGI-S -числа пациентов с > 6 баллов было недостаточно для адекватного анализа. Разные уровни тяжести депрессии определялись по двум шкалам, HAMD и CGI. Было бы интересно уточнить, повышается ли эффективность параллельно нарастанию тяжести при разных депрессивных синдромах. Для этого можно было бы использовать другие шкалы для оценки тяжести депрессии, измеряющие разные симптомы.
Однако, несмотря на указанные недостатки, результаты нашего исследования имеют существенное значение. Известно, что тяжелая депрессия приносит больше страдания пациенту, а также сопряжена с более выраженным нарушением социальной и профессиональной адаптации в сравнении с более легкими депрессивными состояниями. Больные тяжелой депрессией чаще госпитализируются, а их лечение связано с большими затратами ресурсов здравоохранения. Соответственно эффективная терапия тяжелой депрессии является важной и приоритетной задачей. Агомелатин обнаруживает отчетливую эффективность в терапии тяжелой депрессии. Первые доказательства такой эффективности были получены в небольших подгруппах тяжелых пациентов в отдельных исследованиях и получили подтверждение в результате анализа объединенных данных этих исследований. Агомелатин может рассматриваться как важная и ценная альтернатива в фармакотерапии тяжелой депрессии.
Декларация интересов
S.A. Montgomery и S. Kasper являются консультантами многих фармацевтических компаний, включая Servier.
Список использованной литературы
- American Psychiatric Association (2000). Diagnostic criteria from DSM-IV-TR. American Psychiatric Association: Washington.
- Anderson IM, Tomenson BM (1994). The efficacy of selective serotonin re-uptake inhibitors in depression: a meta-analysis of studies against tricyclic antidepressants. JPsychopharmacol 8:238-249.
- Boulenger JP, Huusom AK, Florea I, Baekdal T, Sarchiapone M (2006). A comparative study of the efficacy of long-term treatment with escitalopram and paroxetine in severely depressed patients. Curr Med Res Opin 22: 1331-1341.
- Clerc GE, Ruimy P, Verdeau Pailles J (1996). A double-blind comparison of venlafaxine and fluoxetine in patients hospitalized for major depression and melancholia. Int Clin Psychopharmacol 9:139-143.
- Committee for Proprietary Medicinal Products (CPMP) (2002). Note for guidance on clinical investigation of medicinal products in the treatment of depression. CPMP/EWP/518/97, Rev. 1. Danish University Antidepressant Group (1986). Citalopram: clinical effect profiles in comparison with clomipramine. A controlled multicentre study. Psychopharmacol 90:131-138.
- Danish University Antidepressant Group (1990). Paroxetine: a selective serotonin reuptake inhibitor showing better tolerance, but weaker antidepressant effect than clomipramine in a controlled multicenter study. J Affect Dis 18:289-299.
- Danish University Antidepressant Group (1993). Moclobemide: a reversible MAO-A-inhibitor showing weaker antidepressant effect than clomipramine in a controlled multicenter study. J Affect Dis 28:105-11 6.
- Guelfi JD, White AC, Hackett D, Guichoux JV (1995). Effectiveness of venlafaxine in hospitalized patients with major depression and melancholia. J Clin Psychiat 56:450-458.
- Guelfi JD, Ansseau M, Timmerman L, Korsgaard S, Mirtazapine-venlafaxine study group (2001). Mirtazapine versus venlafaxine in hospitalized severely depressed patients with melancholic features. J Clin Psychopharmacol 21:425-431.
- Hamilton M (1960). A rating scale for depression. J Neurol Neurosurg Psychiatry 23:56-62.
- Hamilton M (1967). Development of rating scale for primary depressive illness.Br J Soc Clin Psychol 6:278-296.
- Hirschfeld RM (1 999). Efficacy of SSRIs and newer antidepressants in severe depression: comparison with TCAs. J Clin Psychiatry 60:326-335.
- Kasper S (1997). Efficacy of antidepressants in the treatment of severe depression: the place of mirtazapine. J Clin Psychopharmacol 17 (Suppl 1):19S-28S.
- Kennedy SH, Emsley R (2006). Efficacy and safety of agomelatine in the treatment of major depressive disorder. Eur Neuropsychopharmacol 16:93-100.
- Kessler RC, Berglund P, Dernier O, Jin R, Koretz D, Merinkangas K, et al. (2003). The epidemiology of major depressive disorder: results from the National Comorbidity Survey replication (NCS-R). JAMA 289:3095-3105.
- Lam RW, Andersen HF (2006). The influence of baseline severity on efficacy of escitalopram and citalopram in the treatment of major depressive disorder: an extended analysis. Pharmacopsychiatry 39:180-184.
- Lepine J-P, Gastpar M, Mendlewicz J, Tylee A (1997). Depression in the community: the first pan-European study DEPRES (Depression Research in European Society). Int Clin Psychopharmacol 12:19-29.
- Lepola U, Wade AG, Andersen HF (2004). Do equivalent doses of escitalopram and citalopram have similar efficacy? A pooled analysis of two positive placebo-controlled studies in major depressive disorder. Int Clin Psycho-Pharmacol 19:1 49-155.
- Loo H, Hale A, D'Haenen H (2002). Determination of the dose of agomelatine, a melatoninergic agonist and selective 5-HT (2C) antagonist, in the treatment of major depressive disorder: a placebo-controlled dose range study. Int Clin Psychopharmacol 17:239-247.
- Montgomery SA (1992). The advantages of paroxetine in different subgroups of depression. Int Clin Psychopharmacol 6 (Suppl 4):91-100.
- Montgomery SA, Asberg M (1979). A new depression scale designed to be sensitive to change. Br J Psychiatry 134:382-389.
- Montgomery SA, Lecrubier Y (1 999). Is severe depression a separate indication? Eur Neuropsychopharmacol 9:259-264.
- Montgomery SA, Pedersen V, Tanghoj P, Rasmussen JGC, Rioux P (1994). The optimal dosing regimen for citaloprama meta-analysis of nine placebo-controlled studies. Int Clin Psychopharmacol 9 (Suppl 1):35-40.
- Moore N, Verdoux H, Fantino B (2005). Prospective, multicentre, randomized, double-blind study of the efficacy of escitalopram versus citalopram in outpatient treatment of major depressive disorder. Int Clin Psychopharmacol 20:131-137.
- Murray CJL, Lopez AD (1997). Global mortality, disability, and the contribution of risk factors: Global Burden of Disease Study. Lancet 349:1436-1442.
- Nierenberg AA (1994). The treatment of severe depression: is there an efficacy gap between SSRI and TCA antidepressant generations? J Clin Psychiatry 55:55-59.
- Olie and Kasper [in press]. Efficacy of agomelatine, an MT1/MT2 receptor antagonist with 5-HT2c antagonistic properties, in major depressive disorder. International Journal of Neuropsychopharmacology.
- Pande AC, Sayler ME (1993). Severity of depression and response to fluoxetine. Int Clin Psychopharmacol 8:243-245.
- Schneider LS, Nelson JC, Clary CM, Newhouse P, Krishnan KR, Shiovitz T, Weihs K (2003). An 8-week multicenter, parallel-group, double-blind, placebo-controlled study of sertraline in elderly outpatients with major depression. Am J Psychiatry 160:1277-1 285.
- Sonawalla SB, Fava M (2001). Severe depression: is there a best approach? CNS Drugs 15:765776.
- Thase ME (2000). Treatment of severe depression. J Clin Psychiatry 61:17-25.
- Tignol J, Stoker MJ, Dunbar GC (1992). Paroxetine in the treatment of melancholia and severe depression. Int Clin Psychopharmacol 7:91-94.
- Whitehead A, Whitehead J (1 991). A general parametric approach to the metaanalysis of randomized clinical trials. Stat Med 10:1665-1677.
- WHO (1992). International classification of diseases 10th revision (ICD-10). Geneva: World Health Organization.
| Ноябрь 2012 г. |