Улучшение субъективных показателей сна при большом депрессивном расстройстве при терапии новейшим антидепрессантом агомелатином: рандомизированное двойное-слепое сравнение с венлафаксином
Improvement in Subjective Sleep in Major Depressive Disorder With a Novel Antidepressant, Agomelatine: Randomized, Double-Blind Comparison With VenlafaxinePatrick Lemoine, M.D., Ph.D.; Christian Guilleminault, M.D., Biol.D.; и Enric Alvarez, M.D.
J Clin Psychiatry 2007;68:1723-1732
Цель: Пациенты с большим депрессивным расстройством (БДР) страдают нарушениями сна, которые могут усугубляться под влиянием некоторых антидепрессантов в начале терапии. Целью данного исследования была оценка субъективного качества сна у пациентов, получающих агомелатин, новый антидепрессант, действующий как агонист мелатонинергических MT1 и MT2 рецепторов и антагонист 5-HT2C рецепторов, в сравнении с пациентами, получающими венлафаксин, ингибитор обратного захвата серотонина и норадреналина. Метод: В данное двойное-слепое, рандомизированное исследование было включено 332 пациентов с БДР (критерии DSM-IV), у которых проводилась сравнительная оценка эффектов агомелатина 25-50 мг/сут и венлафаксина 75-150 мг/сут при 6 недельной терапии с возможностью коррекции дозы через 2 недели лечения. Субъективные показатели сна оценивались с помощью Вопросника для оценки сна Leeds (LSEQ), главным критерием эффективности служил балл «засыпание». Антидепрессивная эффективность оценивалась по 17-пунктовой Шкале депрессии Гамильтона (HAM-D) и Шкале общего клинического впечатления (CGI) -улучшение. Исследование проводилось с ноября 2002 г. по июнь 2004 г.
Результаты: Через 6 недель агомелатин был сопоставим по антидепрессивной эффективности с венлафаксином. Балл LSEQ «засыпание» был достоверно лучше в группе агомелатина (70.5 ± 16.8 мм), чем в группе венлафаксина (64.1 ± 18.2 мм); различия между терапевтическими группами по этому показателю на последнем визите составили 6.36 мм (p = 0.001), причем разница между антидепрессантами была достоверной уже на 1 -й неделе. Дополнительные показатели сна, включая такие пункты LSEQ, как качество сна (p = 0.021), пробуждения во время сна (p = 0.040), целостность поведения (p = 0.024), а также суммарный балл по пунктам 4, 5 и 6 (балл инсомнии) шкалы HAM-D (p = 0.044) и балл шкалы CGI-улучшение (p = 0.016) также улучшались в достоверно большей степени при терапии агомелатином в сравнении с венлафаксином. Частота нежелательных явлений составила 52.1% для агомелатина и 57.1% для венлафаксина; пациенты из группы венлафаксина чаще преждевременно исключались из исследования из-за нежелательных явлений в сравнении с агомелатином (13.2% против 4.2%).
Заключение: Агомелатин сопоставим с венлафаксином по выраженности антидепрессивного эффекта, но превосходит венлафаксин по эффективности улучшения субъективных показателей сна при терапии пациентов с БДР.
Распространенность большого депрессивного расстройства на протяжении жизни в населении США старше 18 лет оценивается в 16% [1], сходные показатели получены в Европе [2]. Из числа лиц, перенесших депрессивный эпизод в последние 12 месяцев, 87.4% оценивают нарушения ролевого статуса как минимум умеренное, а 59.3% указывают, что такие нарушения достигают тяжелой или очень тяжелой степени.1 В последние годы доля пациентов с депрессией, получающих терапию, значительно увеличилась, что частично связано с внедрением новых препаратов с улучшенной переносимостью, таких как селективные ингибиторы обратного захвата серотонина (СИОЗС). Однако, в соответствии с данными выполненного недавно опроса, только 57.3% пациентов с депрессией получают какой-либо метод терапии, а адекватная терапия проводится менее, чем в половине этих случаев.[1] Следовательно, сохраняется потребность в создании новых антидепрессантов с более высокими показателями эффективности и переносимости, а также более удобных в применении.
Почти все пациенты с большим депрессивным расстройством обнаруживают количественные или качественные нарушения сна. Результаты многих исследований свидетельствуют о тесной связи между регуляцией сна и регуляцией настроения, как у больных аффективными расстройствами, так и в не клинической популяции.[5] Пациенты с депрессией характеризуются аномальными изменениями циркадианных ритмов [6] и отчетливыми нарушениями структуры сна. [7] Инсомния часто предшествует появлению первых симптомов аффективного расстройства [8] и может сохраняться в периоде клинической ремиссии.[4] Стойкая инсомния является фактором риска манифестации депрессивного расстройства в будущем, а также обострения и рецидива депрессии.[9-11] Более того, в сочетании с хроническим заболеванием, таким как депрессия, нарушения сна могут оказывать значительное влияние на связанное со здоровьем качество жизни, не меньше, чем собственно хроническое заболевание. [12] Нарушения сна обычно редуцируются при эффективной терапии антидепрессантами, однако некоторые антидепрессанты, включая СИОЗС и ингибиторы обратного захвата серотонина и норадреналина (ИОЗСН), могут усугублять расстройства сна, особенно в начале терапии, [13,15] в связи с чем при назначении таких препаратов часто требуется сопутствующее назначение седативных средств/гипнотиков, как правило, бензодиазепинов. [16,17] Тем не менее, сочетание позитивного эффекта на настроение со способностью улучшать сон, особенно в начале терапии, остается важной терапевтической задачей, которую не всегда удается решить современными средствами,[13,15] в связи с чем сохраняется потребность в разработке новых антидепрессантов, способных решить эту задачу. Следовательно, оценка субъективных показателей сна, т.е. впечатления пациентов относительно своего сна, с применением валидизированных инструментов является важной составной частью клинической терапии депрессии. Объективные и субъективные измерения сна указаны в Европейских рекомендациях как компонент подтверждения терапевтического эффекта в отншении расстройств сна (Clinical Investigation of Hypnotic Medicinal Products, Directive 75/318/EEC, с поправкой [18]).
Агомелатин - новейший антидепрессант оригинальным механизмом действия. Агомелатин является мощным агонистом мелатонинергических MT1 и MT2 рецепторов и антагонистом серотонинергических 5-HT2C рецепторов. В исследованиях на животных показано, что анти-деперссивный эффект агомелатина связан с взаимодействием с рецепторами обоих типов.[19-21] Более того, агомелатин способен has been shown ресинхронизировать нарушенные циркадианные ритмы как на моделях депрессии у животных [22], так и у пациентов с депрессией. [23,24] Клинически агомелатин в дозе 25-50 мг/сут обладает достоверным антидепрессивным эффектом относительно плацебо у пациентов с большим депрессивным расстройством. [25,26] На основании фармакологического профиля предполагается, что дополнительно к антидепрессивному эффекту агомелатин может купировать нарушения сна у пациентов с депрессией. В недавно выполненном исследовании с участием пациентов с депрессией получено полисомнографическое подтверждение способности агомелатина 25 мг/сут корректировать циркадианные нарушения. [27] В этом исследовании агомелатин способствовал увеличению медленноволнового сна и нормализации его распределения в течение ночи.[27,28] Главной целью данного исследования была оценка эффектов агомелатина на субъективные показатели сна в сравнении с хорошо известным антидепрессантом класса ИОЗСН венлафаксином у пациентов с большим депрессивным расстройством.
МЕТОД
Дизайн исследования
Данное рандомизированное, двойное-слепое, с параллельными группами исследование проводилось во Франции (41 центр) и Испании (15 центров) с ноября 2002 по июнь 2004 г.г. В исследовании участвовали амбулаторные пациенты с большим депрессивным расстройством. После короткого (< 7 дней) периода отмывки без терапии пациенты подвергались рандомизации для назначения агомелатина 25 мг/сут или венлафаксина 75 мг/сут курсом на 6 недель. Пациенты получали 2 каспулы в сутки, 1 утром и 1 вечером. В группе агомелатина пациенты принимали 1 капсулу плацебо утром и 1 капсулу агомелатина 25 мг вечером, в группе венлафаксина - по 1 капсуле венлафаксина 37.5 мг утром и вечером. У пациентов с неудовлетворительным эффектом через 2 недели лечения в соответствии с критерием суммарного балла 17-пунктовой Шкалы депрессии Гамильтона (HAM-D) [29] и баллом Шкалы общего клинического впечатления - улучшение (CGI)[30] предусматривалось повышение дозы до 1 кпсулы агомелатина 50 мг вечером и 1 капсулы плацебо утром, или до суточной дозы венлафаксина 150 мг (по 75 мг 2 раза в сутки). Все капсулы имели идентичный внешний вид. Рандомизация была централизованной, некорректируемой, сбалансированной и стратифицировалась в соответствии с центрами исследования; для рандомизации использовались перестановочные блоки фиксированных размеров. После включения пациента интерактивная голосовая система ответов (IVRS) назначала номер терапевтического комплекта. Коррекция дозы, если требовалось в соответствии с критериями, проводилась централизованно, слепым методом. Критерии повышения дозы были установлены до начала исследования и не были известны ни исследователям, ни пациентам. Через 2 недели терапии каждому пациенту назначался терапевтический комплект с новым номером с учетом того, повышалась ли доза препарата, или оставалась неизменной, при этом ни исследователи, ни пациенты не получали информации об изменении терапии.
Пациенты
В исследовании участвовали амбулаторные пациенты мужского и женского пола в возрасте 18 - 65 лет с диагнозом умеренного или тяжелого большого депрессивного расстройства по критериям DSM-IV [31] со стартовым баллом шкалы HAM-D > 20, без психотических или кататонических симптомов и без связи манифестации с послеродовым периодом. Из исследования исключались пациенты с высоким суицидальным риском или суицидальными попытками в течение предыдущих 6 месяцев, с биполярным расстройством, тревожной симптоматикой, в том числе паническим атаками, обсессивно-компульсивным расстройством, посттравматическим стрессовым расстройством, наркотическим злоупотреблением или зависимостью, резистентной к антидепрессантам депрессией в анамнезе, электросудорожной терапией в течение предыдущих 3 месяцев или формальной психотерапией в течение предыдущего 1 месяца. Также исключались пациенты, у которых при скрининговом клиническом обследовании выявлялись признаки расстройств сна, в том числе обструктивное апноэ во сне и синдром беспокойных ног, как и пациенты, недавно осуществившие или планирующие в ближайшее время воздушное путешествие с пересечением часовых поясов (смена > 3 часовых поясов) или фототерапию в пределах 2 недель. Пациенты с неврологическими расстройствами (деменция, судорожные припадки, инсульт), ожирением с функциональными нарушениями, серьезным или нестабильным соматическим заболеванием (неоплазия, сердечнососудистая или легочная патология, неконтролируемый диабет 1 или 2 типа) не допускались для участия в исследовании. Назначение других антидепрессантов, а также гипнотиков, анксиолитиков и нейролептиков запрещалось в течение всего периода исследования в разные сроки до включения в исследование в зависимости от периода полужизни каждого препарата. Перед включением проводился скрининг мочи на содержание бензодиазепинов. Исследование проводилось в соответствии с этическими принципами, заложенными в Хельсинской Декларации 1964 г. (с Эдинбургской поправкой от 2000 г.). Протокол исследования и все поправки к протоколу были одобрены независимыми этическими комитетами обеих стран. От всех пациентов получено письменное информированное согласие.
Измерения эффективности
Эффекты препаратов исследования на субъективные показатели сна измерялись с помощью следующих инструментов самооценки, которые заполнялись пациентами на визитах исследования.
Вопросник для оценки сна Leeds (Leeds Sleep Оценка Questionnaire; LSEQ). Основная оценка изменений субъективных показателей сна на фоне терапии осуществлялась с помощью Вопросника для оценки сна Leeds (LSEQ),[32] стандартного инструмента, разработанного для измерения a standardized instrument designed to quantify subjective оценка эффектов препаратов на сон и раннее утреннее поведение. Вопросник состоит из 10 пунктов, каждый из которых количественно оценивается по 100-мм визуальной аналоговой шкале (VAS) с последующей группировкой оценок по 4 показателям, оцениваемым в баллах: легкость засыпания (3 пункта VAS), субъективное качество сна (2 пункта VAS), легкость пробуждения (2 пункта VAS) и целостность поведения после пробуждения (3 пункта VAS, оценивающие, насколько пациент чувствует себя в большей степени внимательным и менее неуклюжим). Баллы по четырем указанным категориям анализировались отдельно.
Вопросы LSEQ предназначены для оценки изменений во время терапии относительно состояния пациента перед началом терапии; соответственно, стартовых оценок не предусматривается. Для большей ясности баллы по каждому пункту определялись путем вычитания из 100 мм, т.е. чем выше балл, тем больше улучшается сон на фоне терапии. Балл по пункту LSEQ «засыпание» был принят за главный критерий эффективности в данном исследовании.
Визуальные аналоговые шкалы по пунктам «сонливость в дневное время» и «хорошее самочувствие». Эти 2 шкалы заполнялись на каждом визите после включения вплоть до 6 недели исследования.
Вопросник по Питтсбургскому индексу качества сна (Pittsburgh Sleep Quality Index questionnaire). Вопросник по Питтсбургскому индексу качества сна [33] заполнялся пациентами при включении для подтверждения сопоставимости терапевтических групп по статусу сна.
Дневник сна. Пациенты заполняли дневник сна ежедневно утром, начиная от включения до визита на неделе 3, регистрируя время выключения света, латентность начала сна и количество ночных пробуждений, а также время пробуждения и время покидания постели.
Эффективность в отношении депрессивных симптомов. Эффективность препаратов исследования в отношении депрессии оценивалась исследователем во время визитов пациентов с помощью 17-пунктовой шкалы HAM-D и балла общего улучшения по шкале CGI. Респондерами считали пациентов с редукцией стартового суммарного балла HAM-D на > 50%.
Оценка безопасности
На каждом визите регистрировались все нежелательные явления, выявленные целенаправленно или сообщенные пациентами самостоятельно, а также любые аномальные показатели, оцениваемые исследователем как клинически значимые. Частота сердечных сокращений и артериальное давление регистрировались при отборе, а также на каждом визите исследования. Образцы крови брали при отборе и в интервале между 4 и 6 неделями исследования. Индекс массы тела (ИМТ) рассчитывался на основании массы тела и регистрировался на неделе 0 и неделе 6. Запись электрокардиограммы в 12-ти отведениях проводилась при отборе и на последнем визите.
Статистический анализ
Главным критерием эффективности был балл по пункту «засыпание» вопросника LSEQ. Балл по этому пункту по завершении периода терапии (финальное значение) анализировался в общей выборке терапии (intention-to-treat; ITT) с применением метода замещения недостающего значения предыдущим для восполнения пропущенных данных. Различия между группами терапии по последним значениям анализировались с помощью 2-стороннего t теста Стьюдента для независимых выборок в приложении к исходным данным. Для анализа динамики изменений балла «засыпание» использовалась смешанная модель, включавшая терапию, время, а также взаимодействия время x терапия и время2 x терапия в качестве факторов с последующей оценкой различий между терапевтическими группами на каждом визите исследования с помощью 2-стороннего t теста Стьюдента в приложении к исходным данным (без поправки на риск ошибки I типа). Все другие показатели эффективности анализировались как вторичные критерии. В результате первого анализа, который предусматривал сравнение баллов HAM-D, полученных на последнем визите после стартового измерения (через 6 недель терапии), не было обнаружено достоверных различий между двумя терапевтическими группами. Сравнение между агомелатином и венлафаксином по субъективным показателям сна проводилось только при отсутствии достоверных различий в антидепрессивной эффективности. Все критерии эффективности анализировались на материале всех данных для анализа (full analysis set; FAS), определяемых, в соответствии с принципом ITT, как данные всех пациентов, рандомизированных через IVRS, которые приняли минимум 1 дозу препарата исследования. Показатели HAM-D, CGI и LSEQ также анализировались в подгруппе пациентов с тяжелой депрессией (по критерию стартового суммарного балла HAM-D > 25). Количество пациентов было достаточным для утверждения отсутствия различий в показателях антидепрессивного эффекта.
РЕЗУЛЬТАТЫ
Пациенты
Из 394 скрининрованных пациентов 332 пациента (выборка исследования) методом рандомизации распределялись для терапии агомелатином (165) или венлафаксином (167). Средний возраст а выборке исследования (236 женщин: 75.2% в группе агомелатина, 67.1% в группе венлафаксина) составил 40.1 лет (от 18 до 60 лет). Все рандомизированные пациенты соответствовали критериям DSM-IV для большого депрессивного расстройства. У 56.0% установлено рекуррентное депрессивное расстройство со средним числом депрессивных эпизодов (включая текущий эпизод) 2.2 ± 1.9. Медиана продолжительности текущего эпизода составила 2.8 месяцев.
208 пациентов (62.7%) получали психофармакотерапию в пределах 1 года до включения в исследование. Психолептики принимали 47.6% пациентов (включая анксиолитики [41%], гипнотики и седативные средства [16.9%]), психоаналептики назначались 39.2% пациентам, преимущественно СИОЗС - в 31.6%, в остальных случаях (9%) - другие антидепрессанты. Терапевтические группы не обнаруживали достоверных различий по стартовым показателям. Распределение пациентов в исследовании показано на Рисунке 1, стартовые демографические и клинические характеристики представлены в Таблице 1. Преждевременно выбыл из исследования 51 пациент (агомелатин 15, венлафаксин 36), еще 1 пациент (получал агомелатин) был исключен в связи с утратой контакта для катамнестической оценки. Через 2 недели терапии повышение дозы проводилось 40 (12.0%) пациентам (агомелатин 23 [13.9%], венлафаксин 17 [10.2%]). 7 пациентам дополнительно назначались бензодиазепины (агомелатин 3, венлафаксин 4). В подгруппу тяжелой депрессии (стартовый балл HAM-D > 25) вошло 213 пациентов (64% выборки исследования: агомелатин 103 [62.4%], венлафаксин 110 [65.9%]).
Комплаентность за 6 недель терапии, которая оценивалась по количеству таблеток, возвращенных пациентом, составила 98.3 ± 6.9% в группе агомелатина и 91.9 ± 18.6% в группе венлафаксина.
Рисунок 1. Распределение пациентов в исследовании.
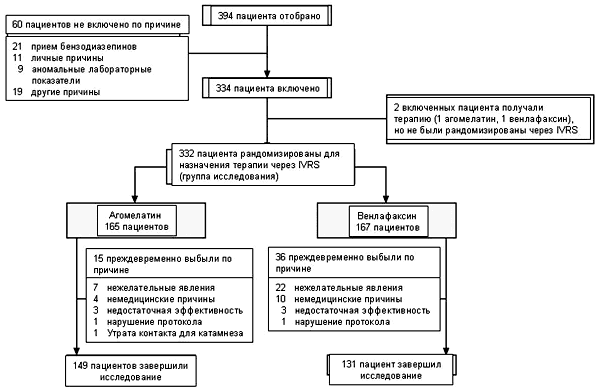
Сокращения: IVRS = интерактивная голосовая система ответов (interactive voice response system).Эффективность в отношении депрессивных симптомов
Выборка исследования. За период с недели 0 до последней оценки в выборке FAS средний суммарный балл шкалы HAM-D снизился с 25.9 ± 3.2 до 9.9 ± 6.6 в группе агомелатина и с 26.0 ± 3.3 до 11.0 ± 7.4 в группе венлафаксина. Динамика улучшения стартовых баллов HAM-D была одинаковой в обеих терапевтических группах, без достоверных различий между группами на всех визитах исследования (Рисунок 2). Доли респондеров на момент финальной оценки (редукция стартового суммарного балла шкалы HAM-D на > 50%) были одинаковыми в обеих группах: 76.4% в группе агомелатина и 70.6% в группе венлафаксина (95% доверительный интервал [CI] = с -15.35 до 3.73). Изменения стартовых баллов HAM-D на момент последнего измерения, за исключением пунктов, связанных со сном (пункты 4, 5 и 6) также были одинаковыми в группах агомелатина (с 21.3 ± 3.0 до 8.5 ± 5.6) и венлафаксина (с 21.4 ± 2.9 до 9.2 ± 6.3).
За период с 1 по 6 неделю средний балл общего улучшения по шкале CGI снизился с 3.2 ± 0.8 до 1.6 ± 0.7 в группе агомелатина и с 3.6 ± 0.9 до 1.6 ± 0.8 в группе венлафаксина. В результате поискового анализа выявлено превосходство агомелатина по выраженности улучшения, достигавшее уровня статистически достоверного на 1-й неделе (различие 0.39, 95% CI = 0.20 - 0.58, p < 0.0001) и на момент финальной оценки (различие 0.32, 95% CI = 0.06 -0.58, p = 0.016).
Таблица 1. Стартовые демографические и клинические характеристики пациентов, рандомизированных для терапии агомелатином или венлафаксином.
a Оценка при отборе.
Характеристика Агомелатин
(N = 165)Венлафаксин
(N = 167)Возраст, лет Среднее ± SD 40.7 ± 10.7 39.6 ± 10.3 Разброс 18-59 18-60 Пол, N (%) Мужской 41 (24.8) 55 (32.9) Женский 124 (75.2) 112(67.1) Число предыдущих депрессивных эпизодов (включая текущий эпизод), среднее ± SD 2.3 ± 1.9 2.2 ± 1.8 Предыдущая психофармакотерапия в пределах 1 года, N (%) 106 (64.2) 102 (61.1) Текущий депрессивный эпизод, N (%) Единичный эпизод 70 (42.4) 76 (45.5) Рекуррентный эпизод 95 (57.6) 91 (54.5) HAM-D суммарный балл, среднее ± SD 25.9 ± 3.2 26.0 ± 3.3 Питсбургский Индекс Качества Сна,a среднее ± SD 12.0 ± 3.3 12.5 ± 3.2 VAS сонливость в дневное время (мм), среднее ± SD 53.1 ± 29.5 46.9 ± 28.2 VAS хорошее самочувствие (мм), среднее ± SD 24.4 ± 20.1 24.6 ± 17.3 HAM-D балл по пунктам инсомнии (пункты 4 + 5 + 6), среднее ± SD 4.6 ± 1.2 4.6 ± 1.4
Сокращения: HAM-D = Шкала депрессии Гамильтона, VAS=визуальная аналоговая шкала.Подгруппа тяжелой депрессии. За период с недели 0 до недели 6 в подгруппе пациентов с тяжелой депрессией средний суммарный балл HAM-D снизился с 28.0 ± 2.2 до 11.2 ± 7.0 в группе агомелатина и с 27.8 ± 2.5 до 11.2 ± 6.9 в группе венлафаксина. Достоверных различий между группами не выявлено ни на одном из визитов. За период с недели 1 до недели 6 динамика среднего балла улучшения по CGI также была одинаковой в группе агомелатина (с 3.3 ± 0.8 до 1.5 ± 0.7) и в группе венлафаксина (с 3.6 ± 0.9 до 1.6 ± 0.8).
Эффективность по субъективным показателям сна
Выборка исследования. В анализе ITT балл LSEQ «засыпание» (главный критерий эффективности) на момент финальной оценки был достоверно выше (т.е. отражал более выраженное улучшение сна) для агомелатина (70.5 ± 16.8 мм) в сравнении с венлафаксином (64.1 ± 18.2 мм; различие между группами 6.36 мм, p = 0.001) (Рисунок 3). По результатам применения смешанной модели анализа эффект терапии был достоверно выше в группе агомелатина (p = 0.013). В анализе данных по каждому визиту исследования установлено достоверное различие в баллах LSEQ «засыпание» в пользу агомелатина, начиная с 1-й недели терапии и далее, вплоть до 6 недели исследования (Рисунок 3).
Рисунок 2. Суммарные баллы Шкалы депрессии Гамильтона (HAM-D) по визитам исследования у пациентов выборки исследования с доступными для анализа данными.
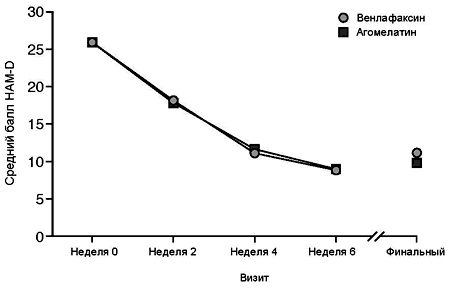
Рисунок 3. Динамика баллов Вопросника для оценки сна Leeds (LSEQ) «засыпание» в выборке исследованияa
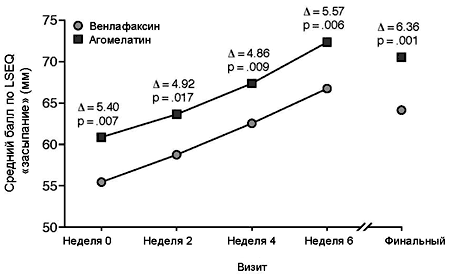
a Баллы LSEQ отражают различия в сне в периоде фармакотерапии в сравнении с состоянием сна до начала терапии; чем выше балл, тем больше улучшение сна. Значения p по результатам 2-стороннего t теста Стьюдента.В результате отдельного анализа 3 компонентных пунктов балла LSEQ «засыпание» установлено, что агомелатин обеспечивал достоверно более выраженное улучшение по пунктам засыпания «легче/труднее» и «быстрее/медленнее», начиная с 1-й недели и вплоть до 6-й недели периода терапии (Таблица 2). При этом достоверных различий между группами по пункту «ощущение более/менее выраженной сонливости» не обнаружено. По всем другим баллам LSEQ (качество сна, легкость пробуждения и целостность поведения) в выборке ITT также выявлено достоверно более выраженное улучшение по завершении терапии в группе агомелатина в сравнении с венлафаксином (Таблица 3).
На момент последнего измерения в выборке ITT стартовый балл инсомнии по HAM-D (сумма баллов по пунктам 4, 5 и 6) снизился с 4.6 ± 1.2 до 1.4 ± 1.6 в группе агомелатина и с 4.6 ± 1.4 до 1.8 ± 1.7 в группе венлафаксина с достоверным превосходством агомелатина в 0.37 (95% CI = 0.01 - 0.72, p = 0.044). В результате отдельного анализа каждого из пунктов нарушений сна по HAM-D выявлены различия в пользу агомелатина по пунктам 4 (ранняя инсомния) и 5 (средняя инсомния) со статистически достоверными различиями в финальных значениях между терапевтическими группами (0.18 [p < 0.05] и 0.17 [p < 0.05], соответственно). Улучшение по пункту 6 (ранние пробуждения) было одинаковым в группах агомелатина и венлафаксина (различие между терапевтическими группами по финальным значениями = 0.02, 95% CI = -0.13 - 0.16).
За 6-недельный период терапии средний балл по шкале VAS «сонливость в дневное время» снизился в обеих терапевтических группах, т.е пациенты испытывали меньше сонливости в течение дня (Рисунок 4A). На 1-й неделе балл «сонливость в дневное время» был достоверно ниже в группе агомелатина (40.6 ± 24.8 мм), чем в группе венлафаксина (49.3 ± 25.6 мм); после внесения поправки на центр и стартовые значения различие между группами составило 10.37 (p < 0.001). На следующих визитах различия между терапевтическими группами не достигали уровня статистически достоверных.
Таблица 2. Отдельные компонентные пункты Вопросника для оценки сна Leeds (LSEQ) по категории «засыпание» на 6-й неделе терапии в терапевтических группах исследования (полный комплект данных для анализа [full analysis set])a
a Баллы LSEQ отражают различия в сне в периоде фармакотерапии в сравнении с состоянием сна до начала терапии; более высокие баллы по каждому из 3-х пунктов означают, что засыпание происходит легче, засыпание происходит быстрее и пациент испытывает меньше сонливости, соответственно.
Балл на 6-й неделе (мм),
среднее ± SDРасчетное различие
между группами
(агомелатин - венлафаксин)Пункт LSEQ Агомелатин
(N = 165)Венлафаксин
(N = 167Среднее (SE) 95% CI P Засыпание «легче/труднее» 78.7 ± 19.8 73.3 ± 20.3 5.40 (2.34) 0.79 - 10.00 0.022 Засыпание «быстрее/медленнее» 77.9 ± 17.4 72.3 ± 20.3 5.58 (2.35) 0.94 - 10.21 0.019 Засыпание «ощущение более/менее выраженной сонливости» 60.2 ± 25.7 54.3 ± 24.5 5.91 (3.14) 0.28 - 12.09 0.061 Таблица 3. Баллы по пунктам Вопросника для оценки сна Leeds (LSEQ) качество сна, пробуждения в периоде сна и целостность поведения по визитам в терапевтических группах исследованияa
a Баллы LSEQ отражают различия в сне в периоде фармакотерапии в сравнении с состоянием сна до начала терапии; чем выше балл, тем больше улучшение сна.
Агомелатин,
среднее ± SD
Score (N)Венлафаксин,
среднее ± SD
Score (N)Расчетное различие
между группами
(агомелатин - венлафаксин)Визит Среднее (SE) 95% CI P Балл LSEQ качество сна (мм) Неделя 1 61.2 ± 19.6 (154) 55.7 ± 19.8 (150) 5.51 (2.26) 1.06 - 9.96 .015 Неделя 2 62.2 ± 20.1 (158) 61.3 ± 21.4 (144) 0.89 (2.39) -3.82 to 5.60 .710 Неделя 3 67.0 ± 20.7 (153) 64.9 ± 18.3 (137) 2.19 (2.31) -2.35 to 6.73 .343 Неделя 6 76.3 ± 18.1 (132) 71.4 ± 19.8 (124) 4.85 (2.37) 0.19 to 9.51 .041 Последняя 72.5 ± 21.4 (164) 66.9 ± 22.3 (160) 5.63 (2.43) 0.85 to 10.41 .021 Балл LSEQ пробуждения в периоде сна (мм) Неделя 1 57.4 ± 18.9 (153) 53.8 ± 18.2 (150) 3.69 (2.13) -0.50 to 7.88 .084 Неделя 2 61.1 ± 18.0 (156) 55.5 ± 18.1 (143) 5.57 (2.09) 1.45 to 9.69 .008 Неделя 3 63.1 ± 20.5 (153) 57.5 ± 19.5 (136) 5.54 (2.36) 0.89 to 10.19 .020 Неделя 6 69.4 ± 19.4 (132) 64.3 ± 21.4 (125) 5.13 (2.54) 0.12to 10.14 .045 Последняя 66.9 ± 20.5 (163) 62.0 ± 21.8 (160) 4.86 (2.35) 0.23 to 9.49 .040 Балл LSEQ целостность поведения (мм) Неделя 1 58.6 ± 17.8 (157) 48.4 ± 18.5 (155) 10.25 (2.05) 6.21 to 14.29 < 0.0001 Неделя 2 57.8 ± 18.4 (159) 55.2 ± 19.2 (146) 2.60 (2.15) -1.63 to 6.83 .227 Неделя 3 61.0 ± 19.2 (154) 59.5 ± 18.5 (137) 1.49 (2.21) -2.87 to 5.85 .501 Неделя 6 68.8 ± 18.1 (135) 65.2 ± 18.9 (124) 3.61 (2.30) -0.93 to 8.15 .118 Последняя 66.2 ± 20.1 (164) 61.0 ± 20.9 (160) 5.16(2.28) 0.68 to 9.65 .024 Повышение балла «хорошее самочувствие» на 1 -й неделе терапии было достоверно более выраженным в группе агомелатина (с 24.4 ± 20.1 мм исходно до 44.7 ± 22.2 мм) в сравнении с венлафаксином (с 24.6 ± 17.3 мм исходно до 36.8 ± 21.6 мм, p = 0.001) (Рисунок 4B); различия оставались достоверными на неделе 2 (p = 0.044), но утрачивали достоверность на следующих визитах.
Данные, зарегистрированные пациентами в дневнике сна, отражают улучшение латентности сна и сокращение числа ночных пробуждений в обеих терапевтических группах в выборке FAS, без статистически достоверных различий между терапевтическими группами. Подгруппа тяжелой депрессии. В подгруппе тяжелой депрессии выявлены достоверные различия между группами по средним баллам LSEQ «засыпание»: финальные значения составили 71.1 ± 17.9 мм в группе агомелатина и 64.1 ± 19.6 мм в группе венлафаксина (различие между группами 6.94 мм, p = 0.008), анализ в выборке ITT.
В результате отдельных анализов каждого из 3 компонентных пунктов балла LSEQ «засыпание» установлены достоверные различия между группами по средним баллам пунктов LSEQ засыпание «легче/труднее» на неделе 1, 2 и 6, а также в финальных значениях (77.9 ± 19.6 мм в группе агомелатина и 69.4 ± 22.7 мм в группе венлафаксина; различие между терапевтическими группами 8.47 мм, p = 0.004). Также установлены достоверные различия в средних баллах пункта засыпание «быстрее/медленнее» на неделе 1 и неделе 6, а также в финальных значениях (75.5 ± 21.8 мм в группе агомелатина и 68.2 ± 23.0 мм в группе венлафаксина; различие между терапевтическими группами 7.25 мм, p = 0.020). В то же время баллы по пункту «ощущение более/менее выраженной сонливости» не обнаруживали отчетливого улучшения в периоде и не обеспечивали достоверных различий между терапевтическими группами (финальные значения: 60.0 ± 27.6 мм в группе агомелатина и 54.8 ± 24.5 мм в группе венлафаксина).
Относительно других пунктов LSEQ установлены достоверные различия в баллах «качество сна» между группами агомелатина и венлафаксина на неделе 6 (различие между терапевтическими группами 6.57 мм, p = 0.036). Балл «легкость пробуждения» также был достоверно лучше в группе агомелатина в сравнении с группой венлафаксина на неделе 2 (различие 7.03 мм, p = 0.007) и неделе 6 (различие 8.14 мм, p = 0.012), а также на момент финальной оценки (различие 6.81 мм, p = 0.027). Балл по пункту «целостность поведения» был достоверно лучше в группе агомелатина в сравнении с группой венлафаксина на неделе 1 (различие 8.98 мм, p < 0.001) и на неделе 6 (различие 6.36 мм, p = 0.027).
Рисунок 4. Баллы Аналоговых визуальных шкал «сонливость в дневное время (A) и «хорошее самочувствие» (B) по визитам исследования в выборке исследованияa
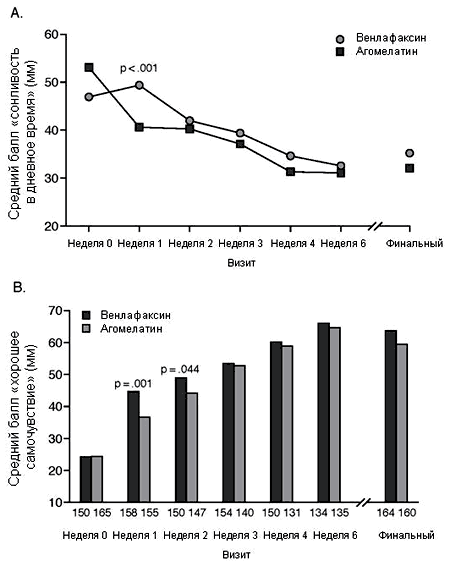
a Более высокий балл «сонливость в дневное время» отражает более выраженную сонливость в дневное время; более высокий балл «хорошее самочувствие» отражает более хорошее самочувствие. Значения р получены с помощью 2-стороннего t теста Стьюдента. Число пациентов на каждом визите показано ниже горизонтальной оси в части B.Таблица 4. Связанные с терапией нежелательные явления (СТНЯ) за 6-недельный период терапииa
a Возникавшие у > 2% пациентов каждой группы; перечислены в порядке убывания частоты в группе агомелатина.
Агомелатин (N = 166) Венлафаксин (N = 168) Число
явленийЧисло пациентов Число
явленийЧисло пациентов Нежелательное явление N % N 5 Все 178 85 51.2 232 96 57.1 Головная боль 16 9.6 25 20 11.9 Тошнота 11 10 6.0 39 38 22.6 Диарея 8 8 4.8 3 3 1.8 Сонливость 7 6 3.6 8 8 4.8 Запоры 6 6 3.6 7 7 4.2 Назофарингит 6 6 3.6 6 6 3.6 Верхняя абдоминальная боль 5 5 3.0 7 7 4.2 Сердцебиение 5 5 3.0 5 5 3.0 Потливость 5 5 3.0 3 3 1.8 Диспепсия 4 4 2.4 4 4 2.4 Гриппоподобные явления 4 4 2.4 0 0 0 Головокружение 4 3 1.8 16 16 9.5 Сухость во рту 3 3 1.8 6 6 3.6 Рвота 2 2 1.2 8 8 4.8 Инсомния 1 1 0.6 4 4 2.4 Тремор 0 0 0 7 7 4.2 Серотониновый синдром 0 0 0 5 5 3.0 Безопасность
Частота связанных с терапией нежелательных явлений (СТНЯ) составила 52.1% для агомелатина и 57.1% для венлафаксина. Преждевременное исключение из-за нежелательных явлений происходило в 3 раза чаще при терапии венлафаксином (22 пациента [13.2%]) в сравнении с агомелатином (7 пациентов [4.2%]).
Наиболее частые СТНЯ в периоде терапии приведены в Таблице 4. Суммарное число СТНЯ составило 178 в группе агомелатина и 232 в группе венлафаксина. Следующие СТНЯ существенно чаще регистрировались в группе венлафаксина в сравнении с группой агомелатина: тошнота (22.6% против 6.0%), головокружение (9.5% против 1.8%) и рвота (4.8% против 1.2%). Тремор отмечался у 4.2% пациентов в группе венлафаксина, но ни одного из пациентов в группе агомелатина; сходным образом серотониновый синдром зафиксирован у 3.0% пациентов в группе венлафаксина и ни у одного из пациентов в группе агомелатина. Диарея чаще возникала при терапии агомелатином (4.8%) в сравнении с венлафаксином (1.8%). Значимых изменений ИМТ не отмечалось ни в одной из терапевтических групп; большинство пациентов оставались в пределах исходного ИМТ класса (норма, избыточный вес и пр.) вплоть до последнего измерения (агомелатин 94.2%, венлафаксин 94.7%). За период исследования не было ни одного случая смерти и зафиксировано 2 суицидальные попытки (по 1 пациенту в каждой группе).
ОБСУЖДЕНИЕ
В данном исследовании агомелатин был сопоставим с ИОЗСН венлафаксином по уровню антидепрессивного эффекта при 6-недельной терапии пациентов с большим депрессивным расстройством. В соответствии с показателями LSEQ агомелатин достоверно превосходил венлафаксин по главному критерию эффективности - баллу «засыпание» в выборке ITT (в FAS), начиная с недели 1 и далее на всех визитах исследования. По завершении 6-недельного периода терапии улучшение других показателей LSEQ (качество сна и легкость пробуждения) было достоверно более выраженным в группе агомелатина в сравнении с венлафаксином. По показателям «качество сна» и «целостность поведения после пробуждения» достоверные различия между терапевтическими группами в пользу агомелатина фиксировались начиная с 1-й недели лечения. Достоверно более выраженное улучшение показателей бодрствования и самочувствия в дневное время также отмечалось в группе агомелатина в сравнении с венлафаксином, уже на первых этапах терапии (на неделе 1 и на неделях 1 и 2, соответственно). Быстрое улучшение сна при терапии антидепрессантами очень желательно, поскольку редукция большинства депрессивных симптомов при использовании современных антидепрессантов происходит сравнительно медленно, обычно становится достоверной не ранее, чем через 2 недели, и не достигает максимального уровня даже через 6 недель лечения. Более выраженное улучшение субъективных показателей сна в группе агомелатина в соответствии с показателями LSEQ дополняется положительными результатами анализа финальных баллов шкалы HAM-D с достоверно более выраженным улучшением баллов по пунктам 4 (ранняя инсомния) и 5 (средняя инсомния) в сравнении с венлафаксином. Интересно отметить, что динамика баллов по пункту 6 «ранние пробуждения», которые в большей степени связаны с депрессией, была одинаковой в группах агомелатина и венлафаксина, что согласуется с данными о сопоставимости этих препаратов по выраженности антидепрессивного эффекта. Значимая редукция балла улучшения по шкале CGI уже на 1-й неделе терапии может объясняться быстрым улучшением качество сна и состояния в дневное время. В данных дневника сна не обнаружено статистически достоверных различий между терапевтическими группами, однако установлено более выраженное улучшение показателей латентности сна и числа ночных пробуждений (начиная с 1-й недели для латентности сна) в группе агомелатина в сравнении с венлафаксином, что согласуется с достоверным ранним улучшением баллов «засыпание» по вопроснику LSEQ. Тем не менее, интерпретация данных дневника затруднена в связи с большим количеством пропущенных измерений и частыми искажениями самооценок вследствие когнитивных нарушений, сопутствующих депрессии. Более того, ночные пробуждения, фиксировавшиеся пациентами в дневниках, не включали микропробуждений, которые характеризуются высокой частотой у пациентов с депрессией и определяют снижение качества сна.
Улучшение субъективных показателей сна в группе агомелатина сопровождалось параллельным улучшением показателей состояния бодрствования в дневное время. Баллы шкал VAS «сонливость в дневное время» и «хорошее» значительно и в достоверно более выраженной степени улучшались в группе агомелатина, начиная с 1 -й недели терапии. Улучшение сна без последующей сонливости в дневное время представляет собой важную клиническую задачу, которую не всегда удается решить с помощью доступных антидепрессантов. Некоторые антидепрессанты, включая большинство трицикликов, миртазапин и тразодон, оказывают седативное действие, которое способствует улучшению сна, но ценой сонливости в дневное время.[17,34,35] Другие антидепрессанты, включая СИОЗС и ИОЗСН, способны ухудшать сон, особенно в начале терапии, что является дополнительным фактором усугубления сонливости в дневное время.[14,15,17]
Терапия агомелатином обеспечивает достоверное и прогрессирующее улучшение по 2 из 3 компонентных пунктов балла LSEQ «засыпание» - более легкое и быстрое засыпание. При этом не выявлено существенных изменений и достоверных различий между терапевтическими группами по компоненту, связанному с увеличением/ослаблением чувства сонливости при засыпании. В связи с этим можно предположить, что агомелатин улучшает засыпание без гипнотического эффекта.
Агомелатин оказался сопоставим по антидепрессивной эффективности с венлафаксином в соответствии с динамикой суммарных баллов HAM-D, а также суммарных баллов HAM-D с вычетом пунктов, связанных с нарушениями сна (пункты 4, 5, 6). Эти результаты свидетельствуют, что антидепрессивный эффект агомелатина реализовался независимо от динамики показателей сна. Агомелатин обеспечивал достоверно более выраженное улучшение по шкале CGI, хотя и с менее высокими баллами улучшения на момент финальной оценки в сравнении с венлафаксином - препаратом, известным своим высоким антидепрессивным эффектом.[36]
Гибкий режим дозирования в группе венлафаксина с данном исследования предусматривал применение средних рекомендуемых доз этого препарата для амбулаторных пациентов в Европейских странах и исключал возможность назначения максимальной рекомендуемой дозы 225 мг. Возможно, что у некоторых пациентов можно было получить более выраженное улучшение при использовании более высокой дозы венлафаксина. Однако, подобный прирост эффективности может быть связан со снижением переносимости и увеличением числа преждевременных исключений, которое и так было выше в группе венлафаксина в сравнении с агомелатином. У пациентов с тяжелой депрессией агомелатин также обнаруживал сопоставимый с венлафаксином антидепрессивный эффект. Положительное влияние агомелатина на субъективные показатели сна, зафиксированное в общей выборке исследования, также отмечалось и в подгруппе тяжелой депрессии. Действительно, по большинству показателей агомелатин превосходил венлафаксин по эффективности в подгруппе тяжелой депрессии в большей степени, чем в общей выборке исследования. Такие результаты, возможно, объясняются более тяжелыми нарушениями сна в этой подгруппе пациентов с депрессией и подтверждают надежность данных, полученных в общей выборке исследования. Более того, эти результаты согласуются с данными по эффективности агомелатина при более тяжелых депрессиях, полученными в предыдущих исследованиях.[25,26,37]
У пациентов с депрессией возможны расхождения между субъективными и объективными оценками сна. Так, изменения в тяжести депрессии могут влиять на оценки сна пациентами.[38] Однако, учитывая сходство изменений в баллах тяжести депрессии в группах агомелатина и венлафаксина, представляется маловероятным, что различия в динамике тяжести депрессии могут определять выявленные различия в субъективных показателях сна. Более того, применение агомелатина сопровождается значимым улучшением полисомнографических параметров сна у пациентов с большим депрессивным расстройством, о чем свидетельствуют данные открытых предварительных исследований.[27,28]
Эффективное улучшение субъективных показателей сна при терапии агомелатином, начинавшееся уже на 1-й неделе и продолжавшееся на протяжении всех 6 недель лечения, означает существенную пользу для качества жизни пациентов. Необходимы длительные исследования для уточнения способности агомелатина полностью редуцировать резидуальные симптомы инсомнии, которые, как известно, являются фактором риска обострения депрессии. Механизм действия агомелатина, несмотря на его инновационность, согласуется с общим механизмом действия антидепрессантов. Тесная связь между процессами регуляции сна и депрессии достоверно подтверждена. [39] Агомелатин является мощным агонистом мелатонинергических рецепторов и антагонистом 5-HT2C рецепторов. Взаимодействие с этими рецепторами лежит в основе эффективности агомелатина при депрессии, которая реализуется за счет ресинхронизации нарушенных циркадианных ритмов[23,24,40,41], а также повышения концентраций норадреналина и дофамина во фронтальной коре.[19,42]
Профиль безопасности агомелатина более благоприятный в сравнении с венлафаксина. В группе агомелатина было меньше случаев преждевременного исключения пациентов из-за нежелательных явлений. Особенно следует отметить, что терапия агомелатином реже сопровождается такими явлениями, как тошнота, рвота и головокружение.
Улучшение субъективных показателей сна и состояния бодрствования в дневное время, начиная уже с 1 -й недели терапии, определяет очень благоприятное клиническое свойство агомелатина, особенно с учетом сравнительно медленного развития антидепрессивного эффекта при использовании современных препаратов, а также крайне ограниченное число антидепрессантов, способных улучшать сон без сонливости в дневное время. Эти оригинальные эффекты агомелатина на сон представляют инновационный вклад в свойства антидепрессантов.
Названия препаратов: миртазапин (Ремерон и другие), венлафаксин (Эффексор и другие).
Список использованной литературы
- Kessler RC, Berglund P, Demler O, et al. The epidemiology of major depressive disorder: results from the National Comorbidity Survey Replication (NCS-R). JAMA 2003;289:3095-3105
- Alonso J, Angermeyer MC, Bernert S, et al. Prevalence of mental disorders in Europe: results from the European Study of the Epidemiology of Mental Disorders (ESEMeD) project. Acta Psychiatr Scand Suppl 2004; 420:21-27
- Olfsson M, Marcus SC, Druss B, et al. National trends in the outpatient treatment of depression. JAMA 2002;287:203-209
- Reynolds CF 3rd. Sleep and affective disorders: a minireview. Psychiatr Clin North Am 1987;10:583-591
- Spoormaker VI, van den Bout J. Depression and anxiety complaints: relations with sleep disturbances. Eur Psychiatry 2005;20:243-245
- Koenigsberg HW, Teicher MH, Mitropoulou V, et al. 24-h monitoring of plasma norepinephrine, MHPG, cortisol, growth hormone and prolactin in depression. J Psychiatr Res 2004;38:503-511
- Staner L, Cornette F, Maurice D, et al. Sleep microstructure around sleep onset differentiates major depressive insomnia from primary insomnia. J Sleep Res 2003;12:319-330
- Ohayon MM, Roth T. Place of chronic insomnia in the course of depressive and anxiety disorders. J Psychiatr Res 2003;37:9-15
- Ford DE, Kamerow DB. Epidemiological study of sleep disturbances and psychiatric disorders: an opportunity for prevention? JAMA 1989; 262:1479-1484
- Lustberg L, Reynolds CF. Depression and insomnia: questions of cause and effect. Sleep Med Rev 2000;4:253-262
- Riemann D, Voderholzer U. Primary insomnia: a risk factor to develop depression? J Affect Dis 2003;76:255-259
- Katz DA, McHorney CA. The relationship between insomnia and health-related quality of life in patients with chronic illness. J Fam Pract 2002;51:229-235
- Jindal RD, Thase ME. Treatment of insomnia associated with clinical depression. Sleep Med Rev 2004;8:19-30
- Mayers AG, Baldwin DS. Antidepressants and their effect on sleep. Hum Psychopharmacol 2005;20:533-559
- Wilson S, Argyropoulos S. Antidepressants and sleep: a qualitative review of the literature. Drugs 2005;65:927-947
- Rascati K. Drug utilization review of concomitant use of specific serotonin reuptake inhibitors or clomipramine with antianxiety/sleep medications. Clin Ther 1995;17:786-790
- Winokur A, Gary KA, Rodner S, et al. Depression, sleep physiology, and antidepressant drugs. Depress Anxiety 2001;14:19-28
- European Medicines Agency. Clinical Investigation of Hypnotic Medicinal Products, Directive 75/318/EEC as amended. September 1991. Available at: http://www.emea.europa.eu/pdfs/human/ewp/ 3cc27aen.pdf. Accessed September 27, 2007
- Millan MJ, Gobert A, Lejeune F, et al. The novel melatonin agonist agomelatine (S20098) is an antagonist at 5-hydroxytryptamine2C receptors, blockade of which enhances the activity of frontocortical dopaminergic and adrenergic pathways. J Pharmacol Exp Ther 2003; 306:954-964
- Papp M, Gruca P, Boyer P-A, et al. Effect of agomelatine in the chronic mild stress model of depression in the rat. Neuropsychopharmacology 2003;28:694-703
- Bourin M, Mocaer E, Porsolt R. Antidepressant-like activity of S 20098 (agomelatine) in the forced swimming test in rodents: involvement of melatonin and serotonin receptors. J Psychiatry Neurosci 2004;29:126-133
- Fuchs E, Schmelting B, Mocaer E. Effects of the novel antidepressant agomelatine (S 20098) and fluoxetine in chronically stressed tree shrews, an animal model of depression [abstract]. Eur Neuropsychopharmacol 2006;16(suppl 4):S338
- Krauchi K, Cajochen C, Mori D, et al. Early evening melatonin and S-20098 advance circadian phase and nocturnal regulation of core body temperature. Am J Physiol 1997;272:R1178-R1188
- Leproult R, Van Onderbergen A, L'hermite-Baleriaux M, et al. Phase-shifts of 24-h rhythms of hormonal release and body temperature following early evening administration of the melatonin agonist agomelatine in healthy older men. Clin Endocrinol (Oxf) 2005;63:298-304
- Loo H, Hale A, D'haenen H. Determination of the dose of agomelatine, a melatonergic agonist and selective 5-HT2C antagonist, in the treatment of major depressive disorder: a placebo-controlled dose range study. Int J Clin Psychopharmacol 2002;17:239-247
- Kennedy SH, Emsley R. Placebo-controlled trial of agomelatine in the treatment of major depressive disorder. Eur Neuropsychopharmacol 2006,16:93-100
- Quera-Salva MA, Vanier B, Laredo J, et al. Major depressive disorder, sleep EEG and agomelatine: an open-label study. Int J Neuropsychopharmacol 2007;10:691-696
- Lopes MC, Quera-Salva MA, Guilleminault C. Cyclic alternating pattern in the NREM sleep of patients within major depressive disorder: baseline results and change over time with a new antidepressant: agomelatine. Sleep Med 2005;6(suppl 2):87-88
- Hamilton M. A rating scale for depression. J Neurol Neurosurg Psychiatry 1960;23:56-62
- Guy W. Clinical Global Impressions (CGI). ECDEU Assessment Manual for Psychopharmacology. US Dept Health, Education, and Welfare publication (ADM) 76-338. Rockville, Md: National Institute of Mental Health; 1976:217-222
- American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders, Fourth Edition. Washington, DC: American Psychiatric Association; 2004
- Parrott AC, Hindmarch I. Factor analysis of a sleep evaluation questionnaire. Psychol Med 1978;8:325-329
- Buysse DK, Reynolds CF, Monk TH, et al. The Pittsburgh Sleep Quality Index: a new instrument for psychiatric practice and research. Psychiatry Res 1989;28:193-213
- Mouret J, Lemoine P, Minuit MP, et al. Effects of trazodone on the sleep of depressed subjects: a polygraphic study. Psychopharmacology (Berl) 1988;95(suppl):S37-S43
- Rosenberg RP. Sleep maintenance insomnia: strengths and weakness of current pharmacologic therapies. Ann Clin Psychiatry 2006;18:49-56
- Mann JJ. The medical management of depression. N Engl J Med 2005; 353:1819-1834
- Pierre Olie J, Kasper S. Efficacy of agomelatine, a MT1/MT2 receptor agonist with 5-HT2C antagonistic properties, in major depressive disorder [published online ahead of print May 4, 2007]. Int J Neuropsychopharmacol 2007;10(5):661-673. doi:10.1017/S1461145707007766
- Tsuchiyama K, Nagayama H, Kudo K, et al. Discrepancy between subjective and objective sleep in patients with depression. Psychiatry Clin Neurosci 2003;57:259-264
- Boivin DB. Influence of sleep-wake and circadian rhythm disturbances in psychiatric disorders. J Psychiatry Neurosci 2000;25:446-458
- Armstrong SM, McNulty OM, Guardiola-Lemaitre B, et al. Successful use of S20098 and melatonin in an animal model of delayed sleep-phase syndrome (DSPS). Pharmacol Biochem Behav 1993;46:45-49
- Van Reeth O, Weibel L, Olivares E, et al. Melatonin or a melatonin agonist corrects age-related changes in circadian response to environmental stimulus. Am J Physiol Regul Integr Comp Physiol 2001;280:R1582-R1591
- Millan MJ, Lejeune F, Gobert A. Reciprocal autoreceptor and heteroreceptor control of serotonergic, dopaminergic and noradrenergic transmission in the frontal cortex: relevance to the actions of antidepressant agents. J Psychopharmacol 2000;14:114-138
| Ноябрь 2012 г. |