Опубликовано в журнале:
«РАЦИОНАЛЬНАЯ ФАРМАКОТЕРАПИЯ В КАРДИОЛОГИИ»; № 9(2); 2013; стр. 188-200.Мета-анализ исследований, сообщавших об эффектах ингибиторов ангиотензинпревращающего фермента и блокаторов рецепторов ангиотензина у больных без сердечной недостаточности
G. Savarese1, P. Costanzo1,2, J.G.F. Cleland2, E. Vassallo1, D ggiero1, G. Rosano3, P. Perrone-Filardi1
1Кардиология, Университет Federico II, Неаполь, Италия
2Академическое отделение кардиологии, Медицинская школа Hull York, Университет Hull, Daisy Building, Больница Castle Hill, Коттингем, Великобритания
3Клинический и экспериментальный научно-исследовательский центр, IRCCS San Raffaele, Рим, ИталияЦель. Оценить влияние ингибиторов ангиотензинпревращающего фермента (ИАПФ) и блокаторов рецепторов ангиотензина (БРА) на объединенный исход, включающий сердечно-сосудистую смерть, инфаркт миокарда (ИМ) и инсульт, а также на смертность от всех причин, возникновение сердечной недостаточности (СН) и впервые выявленного сахарного диабета (СД) в группе высокого риска у пациентов без СН.
Введение. ИАПФ уменьшают частоту сердечно-сосудистых событий в группе больных с высоким сердечно-сосудистым риском без СН, в то время как эффект БРА является менее определенным.
Материал и методы. В мета-анализ было включено 26 рандомизированных исследований, сравнивающих БРА и ИАПФ с плацебо у 108212 пациентов без СН. Проанализирован риск объединенного исхода, смертности от всех причин, возникновения СН и впервые выявленного СД.
Результаты. ИАПФ достоверно снижали риск объединенного исхода (отношение шансов [ОШ]: 0.830 [95% доверительный интервал (ДИ) 0,744-0,927], р=0,001), ИМ (ОШ: 0,811 [95% ДИ 0,748-0,879], р<0,001), инсульта (ОШ: 0,796 [95% ДИ 0,682-0,928], р<0,004), смерти от всех причин (ОШ: 0,908 [95% ДИ 0,845-0,975], р=0,008), впервые возникшей СН (OШ: 0,789 [95% ДИ 0,686-0,908], р=0,001), и впервые выявленного СД (ОШ: 0,851 [95% ДИ 0,749-0,965], р<0,012). БРА достоверно снижали риск объединенного исхода (OШ: 0,920 [95% ДИ 0,869-0,975], р=0,005), инсульта (ОШ: 0.900 [95% ДИ 0,830-0,977], р=0,011), и впервые выявленного СД (ОШ: 0,855 [95% ДИ 0,798 -0,915], р<0,001).
Заключение. У пациентов с высоким сердечно-сосудистым риском без СН ИАПФ и БРА снижали риск объединенного исхода, включавшего смерть от сердечно-сосудистых причин, инфаркт миокарда и инсульт. ИАПФ также снижали риск смерти от всех причин, впервые возникшей СН, и впервые выявленного СД. Таким образом, БРА дают ценную возможность снижения сердечно-сосудистой заболеваемости и смертности у пациентов, у которых невозможно применение ИАПФ
Ключевые слова: ингибиторы ангиотензинпревращающего фермента, блокаторы рецепторов ангиотензина, клинические события.После исследования HOPE (Heart Outcomes Prevention Evaluation) [1] ингибиторы ангиотензин-превращающего фермента (ИАПФ) были рекомендованы для снижения сердечно-сосудистых событий у пациентов с высоким сердечно-сосудистым риском без сердечной недостаточности (СН) [2]. Результаты исследования HOPE, которое продемонстрировало существенное снижение основных сердечно-сосудистых событий (смерть от сердечно-сосудистых причин, инфаркт миокарда [ИМ] и инсульт), были подтверждены в исследованиях PROGRESS (Perindopril pROtection aGainst REcurrent Stroke Study) [3] и EUROPA (EURopean trial On reduction of cardiac events with Perindopril in stable coronary Artery disease) [4], но не нашли подтверждения в других исследованиях, сравнивавших ИАПФ с плацебо у пациентов с высоким сердечно-сосудистым риском [51 2]. Тем не менее, мета-анализ Dagenais и соавт. [13], в который были включены 3 крупных рандомизированных плацебо-контролируемых исследования ИАПФ у пациентов без СН, показал благоприятные влияния ИАПФ на сердечно-сосудистые события.
Основанием для применения ИАПФ при лечении пациентов без СН было влияние ангиотензина-II и брадикинина/простагландинов в сосудах на прогрессирование атеросклероза [14]. Однако хорошо известно, что во время терапии ИАПФ синтез ангиотензина-II может перейти на альтернативные АПФ-независимые ферментативные пути, что может снизить эффективность терапии [1 5]. Неблагоприятные эффекты ангиотензина-II на прогрессирование атеросклероза опосредуется через стимуляцию рецепторов ангиотензина-II 1 типа. Блокаторы рецепторов ангиотензина (БРА) предотвращают стимуляцию рецепторов ангиотензина-II 1 типа без прямого воздействия на брадикинин/простагландины, что улучшает профиль их побочных эффектов. Хотя БРА уменьшают риск диабетической ретинопатии и нефропатии [16-18], а также сердечнососудистой заболеваемости и смертности у пациентов с СН [19], их эффекты у пациентов без СН менее определенны, поскольку основные клинические исследования, сравнивавшие БРА с плацебо, имеют противоречивые результаты [20-29].
Цель данного исследования - оценить методом метаанализа влияние лечения ИАПФ и БРА на объединенный исход, включающий сердечно-сосудистую смерть, ИМ и инсульт, а также на смертность от всех причин, возникновение СН и впервые выявленного сахарного диабета (СД) в группе высокого риска у пациентов без СН.
Материал и методы
Источники данных и поиск. В поисковых системах MEDLINE, базе данных Cochrane, ISI Web of Sciences, и SCOPUS был проведен поиск без языковых ограничений до июня 2012 г Исследования выявляли по следующим заголовкам: блокатор рецепторов ангиотензина, антагонист рецепторов ангиотензина-II 1 типа, БРА, ангиотензин-превращающий фермент, АПФ, «случайно», «случайный», рандомизированное контролируемое исследование и клиническое испытание. Чтобы найти дополнительные соответствующие теме исследования, использовались списки литературы извлеченных статей, а также информация от коллегВыбор исследований. Мета-анализ был разработан в соответствии с заявлением PRISMA (Preferred Reporting Items for Systematic reviews and Meta-Analyses - Предпочтительные для систематических обзоров и мета-анализов сообщения о результатах исследований) [30,31]. Для включения в анализ рассматривались только рандомизированные, двойные слепые клинические испытания, сравнивающие БРА или ИАПФ с плацебо, в которые не включались больные с систолической или диастолической СН, и в которых имелись данные о клинических событиях (включая смерть от всех причин и от сердечно-сосудистых причин, ИМ, инсульт, впервые выявленную СН, и впервые выявленный СД).
Извлечение данных и оценка качества. Два автора независимо выбирали потенциально приемлемые исследования. Разногласия были урегулированы путем обсуждения и консенсуса. Два исследователя независимо читали полный текст выбранных исследований, который проверяли во избежание включения дублирующих данных, опубликованных в других источниках. Извлекались данные об основных характеристиках, наличии СД, артериальной гипертензии, ишемической болезни сердца и заранее определенных для оценки исходах, в том числе, смерти от всех причин и сердечнососудистой смерти, ИМ, инсультах, впервые возникшей СН и впервые выявленном СД. Первой задачей исследования была оценка влияния лечения на объединенный исход (сердечно-сосудистая смерть, ИМ и инсульт) и смерть от всех причин. Кроме того, были изучены эффекты влияния лечения на риск каждого из компонентов объединенного исхода, а также впервые возникшей СН и впервые выявленного СД.
Качество каждого из исследований было определено с применением оценки в баллах для каждого исследования по методу Detsky [32] (табл. 1). Из 25 661 статей, выявленных при первоначальном поиске, 43 были выбраны для более детальной оценки, и 25 (что соответствовало 26 исследованиям) было включено в мета-анализ (рис. 1). Включенные исследования и подробные данные о популяциях исследованных больных приведены в табл. 1 -3. В тринадцати исследованиях сравнивались ИАПФ с плацебо [1, 3-1 2, 33, 34], и в других 13 исследованиях проводилось сравнение БРА с плацебо [17, 18, 20-29]. Сравнение характеристик популяций больных, включенных в исследования ИАПФ и БРА, проводили с помощью t-теста Стьюдента для непарных данных или теста хи-квадрат при необходимости.
Рисунок 1. Блок-схема этапов мета-анализа
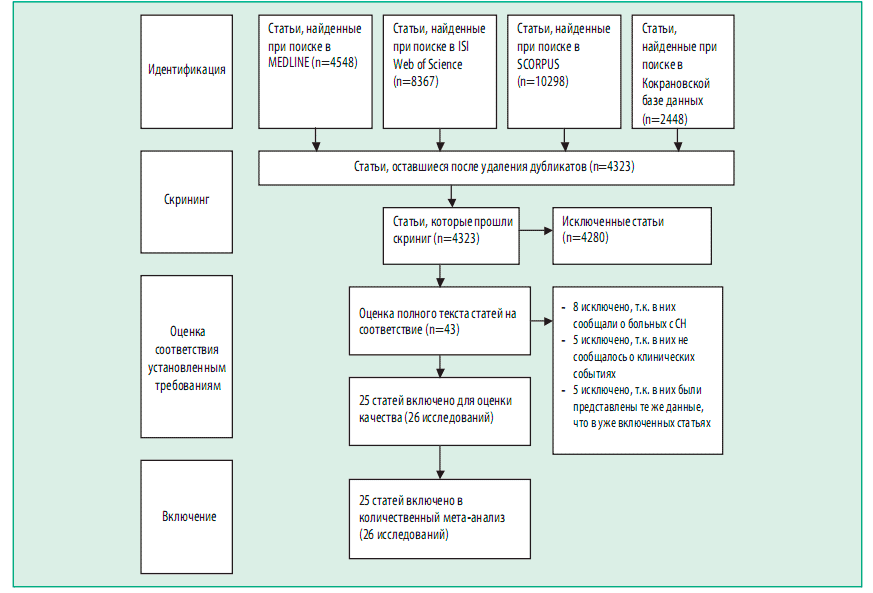
Таблица 1.
Основные характеристики влюченных исследований
Препараты
Исследование [номер в списке литературы]
Год
Лечение
Число больных, леченных активным препаратом (n)
Число больных, получавших плацебо (n)
Наблюдение (годы)
Возраст (годы)
Женщины (%)
Число больных с артериальной гипертензией (n)
Число больных с СД (n)
Шкала качества Detsky
ИБС (%)
Особенности популяции исследования
БРА IRMA-2 [20] 2001 Ирбесартан 404 207 2,00 58 31 100 100 20 8 Больные АГ, с СД 2 типа и МАУ RENAAL [21] 2001 Лозартан 751 762 3,40 60 37 94 100 19 21 Больные с инсультом или ТИА в анамнезе IDNT [22] 2003 Ирбесартан 579 567 2,60 59 32 100 100 20 28 Больные СД 2 типа с нефропатией и АГ Kondo et al. [23] 2003 Кандесартан 203 203 2,00 65 24 44 25 17 100 Больные с коронарным вмешательством в анамнезе без значимого стеноза коронарных артерий в период наблюдения SCOPE [24] 2003 Кандесартан 2477 2460 3,70 76 65 53 12 18 5 Пожилые больные с АГ и оценкой по шкале MMSE >24 DIRECT-PREVENT-1 [17] 2008 Кандесартан 711 710 4,70 30 44 0 100 19 0 Больные с нормальным АД, без повышения уровня альбуминов в моче с СД 1 типа без ретинопатии DIRECT-PROTECT-1 [17] 2008 Кандесартан 951 954 4,80 32 43 0 100 19 0 Больные с нор мальным АД, без повышения уровня альбуминов в моче с СД 1 типа с ретинопатией DIRECT-PROTECT-2 [18] 2008 Кандесартан 951 954 4,70 57 50 62 100 19 0 Больные СД 2 типа с ретинопатией с нормальным уровнем альбумина в моче, нормальным АД или получающие антигипертензивные препараты PROFESS [26] 2008 Телмисартан 10146 10186 2,50 66 36 74 28 20 NA Больные, недавно перенесшие ишемический инсульт TRANSCEND [27] 2008 Телмисартан 2954 2972 4,67 67 43 76 36 20 75 Больные с высоким риском, не переносящие ИАПФ NAVIGATOR [28] 2010 Валсартан 4631 4675 6,50 64 51 78 0 21 28 Больные с НТГ и диагностированным СС заболеванием или факторами СС риска ORIENT [25] 2011 Олмесартан 282 284 3,20 59 69 94 100 17 8 Больные СД 2 типа с явной нефропатией ROADMAP [29] 2011 Олмесартан 2232 2215 3,20 58 54 NA 100 20 31 Больные СД 2 типа ИАПФ Lewis et al. [33] 1993 Каптоприл 207 202 3,00 35 47 76 100 16 NA Больные с диабетической нефропатией AIPRI [34] 1996 Беназеприл 300 283 3,00 51 28 82 NA 16 NA Больные с почечной недостаточностью HOPE [1] 2000 Рамиприл 4645 4652 5,00 66 27 47 39 20 80 Больные с высоким риском с признаками сосудистого заболевания или СД+ одним дополнительным фактором СС риска PART-2 [5] 2000 Рамиприл 308 309 4,70 61 18 NA 9 18 100 Больные с ИБС или другим окклюзивным заболеванием артерий SCAT [6] 2000 Эналаприл 229 231 3,98 62 11 36 11 17 100 Больные с ИБС PROGRESS [3] 2001 Периндоприл 3051 3054 4,00 64 30 48 13 19 8 Больные, ранее перенесшие инсульт или ТИА QUIET [7] 2001 Квинаприл 878 872 3,00 58 18 47 16 18 100 Больные ИБС EUROPA [4] 2003 Периндоприл 6110 6108 4,20 60 15 27 12 20 100 Больные стабильной ИБС PEACE [8] 2004 Трандолаприл 4158 4132 4,80 64 18 46 17 20 100 Больные стабильной ИБС CAMELOT [9] 2004 Эналаприл 673 655 2,00 58 28 60 19 19 100 Больные с документированной ИБС DIABHYCAR [10] 2004 Рамиприл 2443 2469 4,00 65 30 56 100 18 6 Больные СД 2 типа с персистирующей МАУ или протеинурией DREAM [11] 2006 Рамиприл 2623 2646 3,00 55 59 44 0 18 NA Больные без СС заболеваний, но с нарушенным уровнем глюкозы натощак или НТГ IMAGINE [12] 2007 Квинаприл 1280 1273 2,95 61 13 47 9 21 100 Больные с низким риском вскоре после шунтирования коронарных артерий АГ - артериальная гипертензия, МАУ - микроальбуминурия, ТИА - транзиторная ишемическая атака, АД - артериальное давление, НТГ - нарушение толерантности к глюкозе, БРА - блокатор рецепторов ангиотензина; ИАПФ - ингибитор ангиотензин-превращающего фермента; ИБС - ишемическая болезнь сердца; СД - сахарный диабет; СС - сердечно-сосудистые; NA - нет данных; AIPRI - Angiotensin-converting enzyme Inhibition in Progressive Renal Insufficiency; CAMELOT - Comparison of AMlodipine vs Enalapril to Limit Occurrences of Thrombosis; DIABHYCAR - type 2 DIABetes, Hypertension, CArdiovascular Events and Ramipril; DIRECT - DIabetic REtinopathy Candesartan Trials; DREAM - Diabetes REduction Assessment with ramipril and rosiglitazone Medication; EUROPA - in the EURopean trial On reduction of cardiac events with Perindopril in stable coronary Artery disease; HOPE - Heart Outcomes Prevention Evaluation; PART-2 - Prevention of Atheroslerosis with Ramipril Trial; IDNT - Irbesartan Diabetic Nephropathy Trial; IMAGINE - Ischemia Management with Accupril post-bypass Graft via Inhibition of the coNverting Enzyme; IRMA-2 - IRbesartan MicroAlbuminuria type 2 diabetes mellitus in hypertensive patients; MMSE - Mini Mental State Examination; NAVIGATOR - Nateglinide And Valsartan in Impaired Glucose Tolerance Outcomes Research; ORIENT - Olmesartan Reducing Incidence of End stage renal disease in diabetic Nephropathy Trial; PEACE - Prevention of Events with Angiotensin Converting Enzyme inhibition; PRoFESS - Prevention Regimen For Effectively Avoiding Second Strokes; PROGRESS - Perindopril pROtection aGainst REcurrent Stroke Study; QUIET - QUinapril Ischemic Event Trial; RENAAL - Reduction in ENdpoints with the Angiotensin Antagonist Losartan; ROADMAP - Randomized Olmesartan And Diabetes MicroAlbuminuria Prevention; SCAT - Simvastatin/enalapril Coronary Atheroslerosis Trial; SCOPE - Study on Cognition and Prognosis in the Elderly; TRASCEND - Telmisartan Randomised AssessmeNT Study in ACEiNtoleran subjects with cardiovascular DiseaseТаблица 2.
Уровни артериального давления исходно и по окончании наблюдения
Препарат Исследование [Номер в списке литературы] Артериальное давление исходное, Л (мм рт.ст.) Артериальное давление исходное, К (мм рт.ст.) Артериальное давление в конце наблюдения, Л (мм рт.ст.)
Артериальное давление в конце наблюдения, К (мм рт.ст.) БРА IRMA-2 [20] 137/81 136/80 126/74 129/76 RENAAL [21] 166/90 166/90 145/80 148/82 IDNT [22] 144/84 144/84 NA NA Kondo et al. [23] 141/82 141/82 NA NA SCOPE 24 117/74 117/73 NA NA DIRECT-PREVENT-1 [17] 129/76 128/76 127/75 126/76 DIRECT-PROTECT-1 [17] 139/82 140/83 133/78 136/80 DIRECT-PROTECT-2 [18] 142/78 141/77 132/72 137/74 PROFESS [26] 152/82 153/82 140/74 142/74 TRANSCEND [27] 131/77 131/78 NA NA NAVIGATOR [28] 160/87 158/87 140/77 144/80 ORIENT [25] 153/90 153/90 142/83 144/83 ROADMAP [29] 116/72 116/72 NA NA ИАПФ Lewis et al. [33] 137/85 140/86 NA NA AIPRI [34] 137/82 137/82 128/78 133/80 HOPE [1] 142/87 144/88 NA NA PART-2 [5] 146/82 145/82 143/80 143/80 SCAT [6] 136/83 136/83 NA NA PROGRESS [3] 123/74 123/74 NA NA QUIET [7] 128/77 132/78 NA NA EUROPA [4] 122/70 121/70 125/74 129/76 PEACE [8] 133/79 133/79 127/74 132/78 CAMELOT [9] 139/79 139/79 136/76 139/77 DIABHYCAR [10] 134/78 133/78 130/74 132/76 DREAM [11] 147/86 147/86 138/82 142/84 IMAGINE [12] 129/77 129/78 124/74 130/79 К - контроль; Л - лечение; другие аббревиатуры - как в табл. 1Таблица 3.
Сопутствующая терапия
Препарат Исследование (Номер в списке литературы) Бета-блокаторы Аспирин Статины Диуретики Блокаторы кальциевых каналов ARBs IRMA-2 [20] NA NA NA NA NA RENAAL [21] NA NA 9 NA NA IDNT [22] 21 NA 47 21 24 Kondo et al. [23] 58 75 55 33 40 SCOPE [24] NA NA NA NA NA DIRECT-PREVENT-1 [17] 5 15 14 NA NA DIRECT-PROTECT-1 [17] 39 37 38 32 32 DIRECT-PROTECT-2 [18] 17 20 53 37 68 PROFESS [26] 18 NA NA 58 71 TRANSCEND [27] NA NA NA NA NA NAVIGATOR [28] 47 NA NA NA 8 ORIENT [25] 15 18 18 23 NA ROADMAP [29] NA NA NA NA NA ACE-Is Lewis et al. [33] NA NA NA NA NA AIPRI [34] 62 92 58 9 31 HOPE [1] 38 NA NA 23 48 PART-2 [5] NA 19 29 NA NA SCAT [6] 17 14 13 16 13 PROGRESS [3] 26 73 0 NA 0 QUIET [7] 48 90 NA NA 15 EUROPA [4] 63 95 83 NA 37 PEACE [8] 43 81 29 NA 25 CAMELOT [9] 40 76 29 15 47 DIABHYCAR [10] 60 91 70 13 36 DREAM [11] NA NA NA NA NA IMAGINE [12] 77 95 83 30 9 Сокращения как в табл. 1Для оценки уровня риска исходов у пациентов, включенных в исследования, рассчитывался коэффициент заболеваемости (КЗ) - число новых событий на 1000 пациенто-лет для каждого проанализированного исхода в группе лечения плацебо среди пациентов, включенных в исследования ИАПФ, и в группе лечения плацебо среди пациентов, включенных в исследования БРА. Применяли следующую формулу [35]:
КЗ = (число пациентов из группы плацебо, у которых зарегистрировано событие х 1000)
число пациентов из группы плацебо х число лет наблюдения)Синтез и анализ данных. Итоговый мета-анализ.
Отношение шансов (ОШ) влияния рандомизированного лечения на исходы было рассчитано с применением функции metan (STATA версии 11.0, StataCorp, College Station, Техас). ОШ и 95% доверительный интервал (ДИ) каждого исхода рассчитывался отдельно для каждого исследования с группировкой данных в соответствии с «намерением лечить» (intention-to-treat principle) [36, 37]. Выбор ОШ был обусловлен ретроспективным дизайном мета-анализа, проведенного на основе опубликованных исследований, которые различались по дизайну, популяции пациентов, схемам лечения, оценкам первичных исходов и качеству [38,39]. Сводные оценки влияния лечения были рассчитаны с помощью модели случайных эффектов [40]. Предположение об однородности эффектов лечения в различных исследованиях было проверено с применением Q и I2 статистик. Объединенные ОШ были логарифмически преобразованы и взвешены в обратной пропорции к дисперсии. Уровень значимости для обобщенной оценки эффекта лечения и для мета-регрессионного анализа был задан на уровне р<0,05. Только одно (первое) событие учитывалось при оценке каждого исхода.Анализ чувствительности.
Был проведен метарегрессионный анализ с помощью команды metareg [41 ] (STATA версия 11.0) для изучения воздействия на исходы потенциального влияния модифицирующих факторов - демографических характеристик исследуемой популяции, индекса массы тела, процента пациентов с ишемической болезнью сердца, процента пациентов с СД, процента пациентов с артериальной гипертензией, значения артериального давления и изменения артериального давления от начала до конца каждого исследования, текущей терапии, продолжительности наблюдения и качества исследований [32]. Для того, чтобы учесть среднее распределение эффектов в различных исследованиях, для всех мета-регрессионных анализов была использована модель случайных эффектов. Известно, что модель случайных эффектов обеспечивает более широкие ДИ для коэффициентов регрессии, чем анализ фиксированных эффектов, если существует остаточная неоднородность [42]. Чтобы соответствовать анализу случайных эффектов, для каждого исследования определялся вес, как обратная величина суммы дисперсии внутри исследования и остаточной дисперсии между исследованиями. Для оценки tau-2 - добавочного компонента дисперсии (между исследованиями) был использован метод максимального правдоподобия с ограничениями (restricted maximum likelihood method), учитывающий возникновение остаточной неоднородности, не относящейся к влиянию потенциальных модифицирующих факторов [42]. Чтобы проверить однородность результатов, были выполнены индивидуальные мета-анализы влияния одного лекарства (кандесартана, олмесартана, телмисартана, ирбесартана, периндоприла, рамиприла и эналаприла) на каждый из исходов, если препарат был использован по крайней мере в двух исследованиях.Систематическая ошибка, связанная с предпочтительной публикацией положительных результатов исследования.
Чтобы оценить потенциальные систематические ошибки, связанные с предпочтительной публикацией положительных результатов исследования, был использован метод взвешенной линейной регрессии с естественным логарифмом ОШ в качестве зависимой переменной и обратной величиной общего размера выборки в качестве независимой переменной. Это - модифицированный тест Macaskill, который дает более сбалансированный процент ошибок I типа в «хвостовых» областях вероятности по сравнению с другими тестами для выявления систематических ошибок, связанных с публикацией [43].Результаты
Характеристика пациентов, включенных в исследования.
Исходные характеристики пациентов 26 исследований, включенных в мета-анализ, показаны в табл. 1 и 3. Из 108 212 пациентов в общей сложности, 53 791 были включены в исследования ИАПФ, и 54 421 - в исследования БРА. Продолжительность наблюдения была от 2 до 6,5 лет [3,68±1,11). Средний возраст пациентов в целом был 58±11 лет, и 35% пациентов были женщинами. В исследованиях ИАПФ средний возраст составил 58,3±8,3 лет, а в исследованиях БРА —57,7±13,1 лет (р=NS); 26% пациентов, включенных в испытания ИАПФ, составляли женщины по сравнению с 44% в испытаниях БРА (р<0,05) . Продолжительность наблюдения в исследованиях ИАПФ (3,66±0,90 лет) и исследованиях БРА (3,69±1,32 лет) не различалась (р=NS). У пациентов, распределенных в группу лечения плацебо в исследованиях ИАПФ и в исследованиях БРА, не выявлено достоверных различий КЗ для объединенного исхода (27 против 25 событий на 1 000 пациенто-лет, р=0,608), а также смерти от всех причин (21 против 19 событий на 1 000 пациенто-лет, р=0,898), впервые выявленной СН (7 против 6 событий на 1 000 пациенто-лет, р=0,784) и впервые выявленного СД (15 против 24 случаев на 1 000 пациентов лет, р=0,176).Анализ исходов.
ВЛИЯНИЕ ИАПФ.
Лечение ИАПФ достоверно снижало риск объединенного исхода на 14,9% по сравнению с плацебо (ОШ: 0.830 [95% ДИ 0,744-0,927]; р сравнения=0,001, р гетерогенности=0,002) (рис. 2). Когда компоненты объединенного исхода были рассмотрены отдельно, оказалось, что снижение смертности от сердечно-сосудистых причин на 10% не достигало статистической значимости (ОШ: 0,896 [95% ДИ 0,783-1,026], р сравнения=0,112, р гетерогенности=0,087), тогда как значимо снижался риск развития ИМ на 17,7% (OШ: 0,811 [95% ДИ 0,748-0,879], р сравнения <0,001, р гетерогенности=0,438) и инсульта на 1 9,6% (OШ: 0,796 [95% ДИ 0,682-0,928], р сравнения=0,004, р гетерогенности=0,115). Кроме того, применение ИАПФ достоверно снижало риск смерти от всех причин на 8,3% (OШ: 0,908 [95% ДИ 0,845-0,975], р сравнения=0,008, р гетерогенности=0,368) (рис. 2В), впервые возникшей СН на 20,5% (OШ: 0,789 [95% ДИ 0,686-0,908], р сравнения=0,001, р гетерогенности=0,252), и впервые выявленного СД на 13,7% (ОШ: 0,851 [95% ДИ 0,749-0,965], р сравнения=0,01 2, р гетерогенности=0,069). Была выявлена значительная неоднородность исследований в отношении оценки объединенного исхода, но не для всех других исходов, изученных в процессе анализа.Рисунок 2. Отношение шансов объединенного исхода и смерти от всех причин
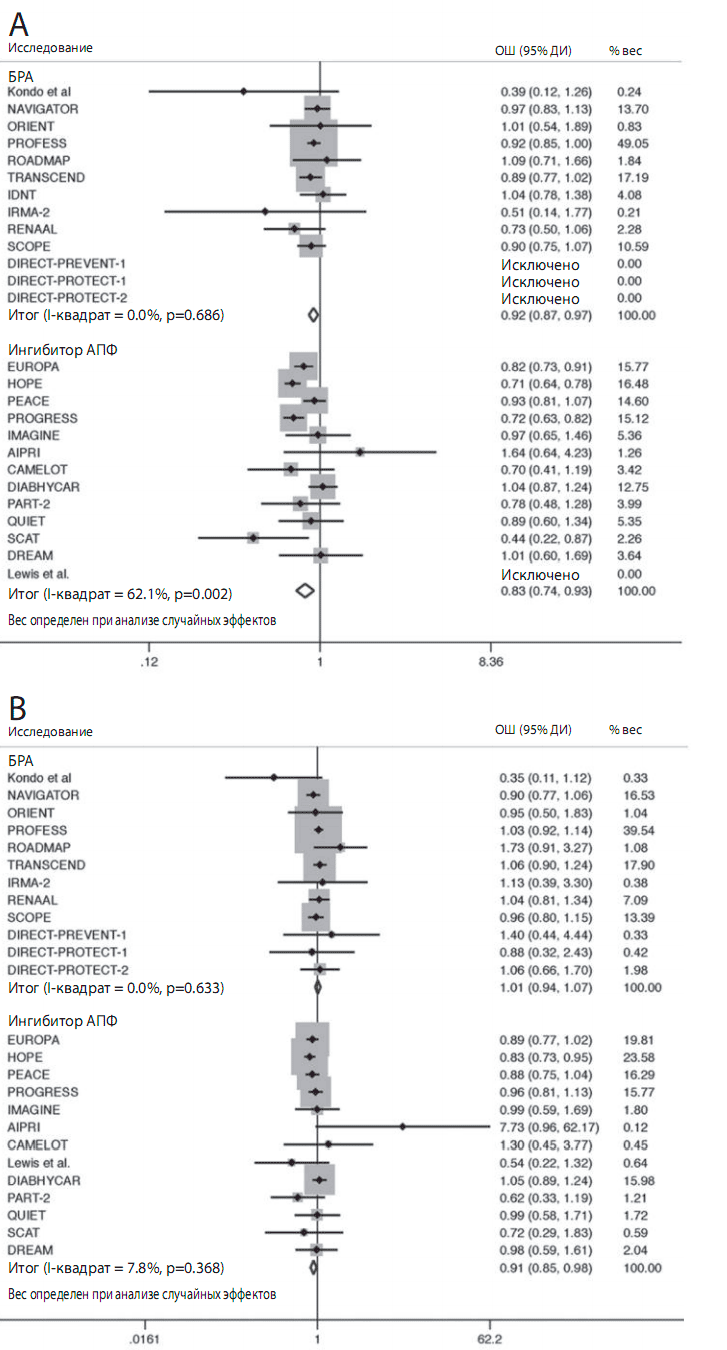 Квадраты представляют отношение шансов (ОШ) в испытаниях и имеют размер пропорциональный числу событий; 95% доверительные интервалы (ДИ) для индивидуальных испытаний обозначаются линиями; объединенные ОШ обозначены пустыми ромбами.
Квадраты представляют отношение шансов (ОШ) в испытаниях и имеют размер пропорциональный числу событий; 95% доверительные интервалы (ДИ) для индивидуальных испытаний обозначаются линиями; объединенные ОШ обозначены пустыми ромбами.
(A) Объединенный исход;
(B) смерть от всех причин.
ИАПФ — ингибитор ангиотензинпревращающего фермента;
БРА — блокатор рецепторов ангиотензинаРисунок 3. ОШ и 95% ДИ влияния ИАПФ и БРА на каждый исход в сравнении с плацебо
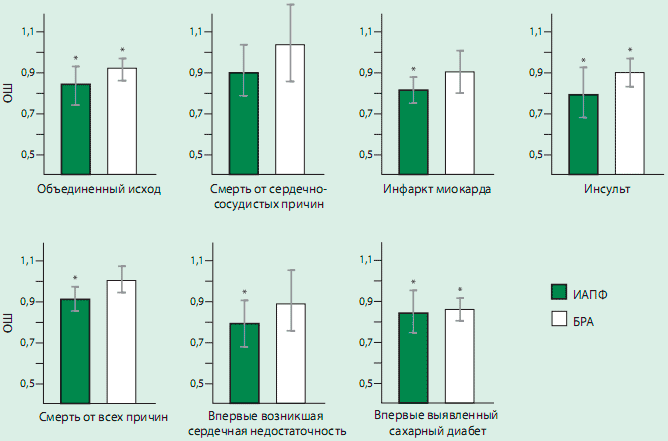 * ОШ достоверно ниже по сравнению с плацебо. Сокращения как на рис. 2
* ОШ достоверно ниже по сравнению с плацебо. Сокращения как на рис. 2ВЛИЯНИЕ БРА.
Лечение БРА достоверно на 7,0% по сравнению с плацебо снижало риск объединенного исхода (ОШ: 0,920 [95% ДИ 0,869-0,975], р сравнения=0,005, р гетерогенности=0,686) (рис. 2). При раздельном анализе компонентов объединенного исхода оказалось, что лечение БРА не снижало риск сердечнососудистой смерти (ОШ: 1,033 [95% ДИ 0,847-1,260], р сравнения=0,748, р гетерогенности=0,01 2), тогда как выявленное снижение риска ИМ на 9,5% приближалось к статистической значимости (ОШ: 0,903 [95% ДИ 0,803-1,01 5], р сравнение=0,086, р гетерогенности=0,420. БРА достоверно снижали риск инсульта на 9,1 % (ОШ: 0.900 [95% ДИ 0,830-0,977], р сравнения=0,011, р гетерогенности=0,469) . Не было отмечено существенного влияния БРА на риск смерти от всех причин (ОШ: 1,006 [ 95% ДИ 0,941-1,075], р сравнение=0,866, р гетерогенности=0,368) (рис. 2В) и впервые возникшей СН (ОШ: 0,892 [95% ДИ 0,7611,046], р сравнения=0,159, р гетерогенности=0,188). Лечение БРА статистически достоверно снижало риск развития СД на 10,6% (ОШ: 0,855 [95% ДИ 0,798-0,91 5], р сравнения <0,001, р гетерогенности=0,819). Значительная неоднородность испытаний была выявлена только в отношении смерти от сердечно-сосудистых причин. ОШ влияния ИАПФ и БРА на изученные исходы представлены на рис 3.Анализ чувствительности.
Результаты анализа были подтверждены при введении в мета-регрессионный анализ в качестве регрессоров потенциальных модификаторов эффекта. Кроме того, аналогично общим результатам, телмисартан (ОШ: 0,915 [95% ДИ 0,853-0,982], р=0,013), периндоприл (ОШ: 0,768 [95% ДИ 0,679-0,869], р<0,001) и эналаприл (ОШ: 0.580 [95% ДИ 0,370-0,908], р=0,017) достоверно снижали риск объединенного исхода, в то время как олмесартан (ОШ: 1,063 [95% ДИ 0,7481,509], р=0,733), кандесартан (ОШ: 0,728 [95% ДИ 0,357-1,482], р=0,381), ирбесартан (ОШ: 0,949 [95% ДИ 0,597-1,508], р=0,824) и рамиприл (ОШ: 0,861 [95% ДИ 0,661-1,122], р=0.268) не влияли достоверно на этот показатель. Результаты анализа других исходов представлены в табл. 4.Таблица 4
Оценки OШ для каждого исхода в каждой группе медикаментозного лечения по сравнению с плацебо
Препарат Инфаркт миокарда
Сердечно-сосудистая смерть
Инсульт
ОШ 95% ДИ р ОШ 95% ДИ р ОШ 95% ДИ p Кандесартан 1,161 0,786-1,715 0,452 0,552 0,136-2,235 0,405 NA NA Олмесартан 0,610 0,366-1,020 0,059 4,181 1,703-10,263 0,002 0,999 0,512-1,951 0,008 Телмисартан 0,893 0,707-1,128 0,343 0,930 0,771-1,121 0,447 0,925 0,845-1,012 0,091 Ирбесартан 0,873 0,851-1,312 0,514 NA NA NA Периндоприл 0,724 0,598-0,877 0,001 0,881 0,767-1,012 0,073 0,801 0,587-1,093 0,162 Рамиприл 0,807 0,716-0,910 0,000 0,840 0,604-1,169 0,302 0,856 0,580-1,265 0,436 Эналаприл 0,564 0,313-1,016 0,056 1,064 0,258-4,379 0,932 0,451 0,164-1,235 0,121 Смертность от всех причин
Сердечная недостаточность
Впервые возникший сахарный диабет
Кандесартан 0,960 0,816-1,131 0,627 NA NA NA NA NA NA Олмесартан 1,288 0,719-2,308 0,394 NA NA NA NA NA NA Телмисартан 1,036 0,949-1,130 0,434 1,043 0,873-1,246 0,643 0,884 0,777-1,006 0,061 Ирбесартан NA NA NA NA NA NA NA NA NA Периндоприл 0,915 0,821-1,020 0,110 0,686 0,564-0,834 0,000 NA NA NA Рамиприл 0,907 0,757-1,085 0,286 0,918 0,693-1,215 0,548 0,784 0,565-1,087 0,144 Эналаприл 0,933 0,463-1,879 0,846 NA NA NA NA NA NA ДИ - доверительный интервал; ОШ - отношение шансов; NA - нет данных (not available)Систематическая ошибка, связанная с предпочтительной публикацией положительных результатов исследования.
Модифицированный тест Macaskill не выявил систематической ошибки такого рода для любого из изученных исходов.Обсуждение
Мета-анализ подтвердил, что по сравнению с плацебо лечение ИАПФ существенно снижает объединенный исход, включающий смерть от сердечно-сосудистых причин, инфаркт миокарда и инсульт, а также риск смерти от всех причин, риск впервые возникшей СН и впервые выявленного СД в группе высокого сердечно-сосудистого риска у пациентов без СН, главным образом, с ишемической болезнью сердца или другими сосудистыми заболеваниями. Лечение БРА пациентов группы высокого риска, в основном с СД или нарушенной толерантностью к глюкозе без СН, снижает риск объединенного исхода и впервые выявленного СД, но, видимо, не снижает частоту смерти от всех причин или впервые появившейся СН.Сердечно-сосудистые эффекты ингибиторов АПФ у больных без СН.
Полученные результаты подтверждают и расширяют данные предыдущего мета-анализа исследований ИАПФ, проведенного Dagenais и соавт. [13], за счет добавления 10 дополнительных испытаний ИАПФ (и, соответственно, дополнительно 23 986 пациентов) [3, 5-7, 9-12, 33, 34] к исследованиям HOPE [1], EUROPA [4] и PEACE (Prevention of Events with Angiotensin Converting Enzyme inhibition) [8], включенным в ранее проведенный анализ. В частности, в соответствии с исследованием Dagenais и соавт., наш мета-анализ показывает, что по сравнению с плацебо ИАПФ значимо снижают риск смерти от всех причин на 8,3%, сердечнососудистой смерти на 10%, ИМ на 17,7% и инсульта на 19,6%, а также впервые возникшей СН на 20,5%. Кроме того, проведенный нами мета-анализ свидетельствует о значимом снижении риска развития СД на 13,7%.Сердечно-сосудистые эффекты БРА у пациентов без СН.
Воздействия БРА на основные клинические события у пациентов без СН были оценены в нескольких испытаниях, в которых были получены противоречивые результаты [17, 18, 20-29]. Исследование RENAAL (Reduction in ENdpoints with the Angiotensin Antagonist Losartan) [21] показало, что лечение лозартаном в сравнении с плацебо не привело к уменьшению вторичного объединенного сердечно-сосудистого исхода, в том числе - сердечно-сосудистой смерти, ИМ, инсульта, коронарной или периферической реваскуляризации и развитию новой СН у больных сахарным диабетом с нефропатией. Аналогично, лечение ирбесартаном в группе высокого риска у больных сахарным диабетом без [20] и с явной нефропатией [22], не снижало частоту сердечно-сосудистых событий. В исследовании SCOPE (Study on Cognition and Prognosis in the Elderly) [24] показано, что терапия артериальной гипертензии у пожилых пациентов, основанная на применении кандесартана, не смогла снизить первичный объединенный исход, включающий сердечно-сосудистую смерть, инфаркт миокарда и инсульт, но в то же время значительно снижала риск впервые выявленного СД. Напротив, в небольшом исследовании, включавшем пациентов высокого риска [23], кандесартан по сравнению с плацебо значительно снижал риск объединенного исхода, в том числе - сердечно-сосудистой смерти, инфаркта миокарда и коронарной реваскуляризации. Однако впоследствии были получены данные о том, что высокие дозы кандесартана не снижают риск сердечно-сосудистых событий у пациентов с СД 1 типа или СД 2 типа без предшествующих сердечно-сосудистых событий [17, 18]. В исследовании TRANSCEND (Telmisartan Randomised Assessme NT Study in ACEiNtoleran subjects with cardiovascular Disease) [27] пациенты, которые не переносили ИАПФ, были распределены в группы лечения телмисартаном или плацебо. Несмотря на то, что лечение телмисартаном не снижало достоверно риск первичной конечной точки, включавшей сердечнососудистую смерть, ИМ, инсульт и впервые возникшую СН, это исследование продемонстрировало снижение на 13% риска вторичной комбинированной конечной точки, включавшей сердечно-сосудистую смерть, инфаркт миокарда и инсульт (р=0,05), тогда как риск впервые выявленного СД телмисартан не уменьшал. В исследовании PROFESS (Prevention Regimen For Effectively Avoiding Second Strokes) [26], в котором приняли участие пациенты с недавно перенесенным инсультом, при лечении телмисартаном не удалось снизить риск повторения инсульта, смертность от всех причин, риск СД, или любых сердечно-сосудистых конечных точек по сравнению с плацебо. В недавно проведенном исследовании NAVIGATOR (Nateglinide And Valsartan in Impaired Glucose Tolerance Out- comes Research) [28], в котором приняли участие стабильные больные с нарушенной толерантностью к глюкозе с наличием сердечно-сосудистого заболевания или высоким сердечнососудистым риском, валсартан снижал частоту возникновения СД, но не снизил сердечно-сосудистую заболеваемость и смертность. Наконец, результаты также недавно завершившихся исследований ROADMAP (Randomized Olmesartan And Diabetes MicroAlbuminuria Prevention) [29] и ORIENT (Olmesartan Reducing Incidence of End stage renal disease in diabetic Nephropathy Trial) [25], несмотря на установленное благоприятное влияние лечения олмесартаном на риск первичной почечной конечной точки, свидетельствуют об увеличении у больных СД, получающих олмесартан, риска смертности от сердечно-сосудистых причин - вторичной конечной точки, заранее определенной в этих исследованиях.Проведенный нами мета-анализ показал, что у включенных в рандомизированные клинические исследования больных с высоким сердечно-сосудистым риском без СН, в основном, с СД или имеющих нарушенную толерантность в глюкозе БРА статистически значимо снижали риск объединенного исхода, включающего сердечно-сосудистую смерть, ИМ и инсульт на 7,0%, а также риск инсульта на 9,1% и риск впервые выявленного СД на 10,6%. Тем не менее, никакого существенного влияния БРА на риск смерти от всех причин, инфаркта миокарда и впервые возникшей СН у этих больных нами не доказано.
Насколько нам известно, ранее не проводилось мета-анализов, исследующих влияние БРА в сравнении с плацебо на фоне сопутствующей терапии у больных без СН. Так, в предыдущий мета-анализ Baker и соавт. [44], из отмеченных исследований БРА было включено только исследование TRANSCEND [27]. В мета-анализе Bangalore и соавт. [45], который был в основном сосредоточен на оценке влияния лечения блокаторами рецепторов ангиотензина-II на риск развития ИМ, сообщалось об исследованиях у пациентов с СН. Совсем недавно van Vark и соавт. [35] опубликовали мета-анализ рандомизированных клинических исследований лечения ингибиторами ренин-ангиотензин-альдостероновой системы. По сравнению с нашим исследованием в этот мета-анализ были включены только исследования у больных артериальной гипертензией [35], и анализировалось только влияние на сердечно-сосудистую смертность и смертность от всех причин. Исследование van Vark и соавт. показало значимое благоприятное влияние этой группы препаратов на смертность от всех причин и сердечно-сосудистую смертность, в значительной степени связанное со снижением АД и почти полностью обусловленное эффектом ИАПФ; оценить эффект БРА у больных с повышенным риском без артериальной гипертензии по результатам этого мета-анализа невозможно. Наконец, McAlister и соавт. [46] опубликовали мета-анализ лечения ИАПФ и БРА пациентов с атеросклерозом и нормальным артериальным давлением, который демонстрирует благоприятное влияние такого лечения на основные клинические исходы. Однако в этом мета-анализе исследования ингибиторов АПФ и БРА были объединены в одном анализе, и не делалось никакого различия между исследованиями ингибиторов АПФ и БРА. Кроме того, в этот мета-анализ вошли исследования, включавшие больных с СН. Таким образом, сердечно-сосудистые влияния БРА у пациентов с высоким риском без СН не были должным образом исследованы в предыдущих метаанализах.
Ограничения исследования.
Во-первых, мы использовали суммарные, а не индивидуальные данные о пациентах. Кроме того, характеристики популяций больных, включенных в испытания ИАПФ и БРА, были разными. Исследования ИАПФ в основном проводились у больных с ишемической болезнью сердца или другими сосудистыми атеросклеротическими заболеваниями, а исследования БРА в основном проводились у пациентов с СД или нарушенной толерантностью к глюкозе. Хотя уровень риска развития любого из оценивавшихся исходов в группах больных, получавших плацебо, в исследованиях ИАПФ и БРА достоверно не различался, и характеристики популяций включенных в исследования не влияли на результаты исследования по результатам анализа чувствительности, различия между популяциями больных в исследованиях ИАПФ и БРА призывают осторожно относиться к обобщению результатов. Кроме того, при интерпретации результатов анализа чувствительности следует учитывать ограничения, присущие мета-регрессионному анализу [47]. Таким образом, данное исследование не представляет собой прямое сравнение ИАПФ и БРА, которое может быть адекватно проведено только в специальных исследованиях (ad hoc). Так, в исследовании ONTARGET (ONgoing Telmisartan Alone and in combination with Ramipril Global End- point Trial) [48] не было отмечено никакого существенного различия между влиянием телмисартана и рамиприла на основные сердечно-сосудистые исходы, однако в этом исследовании не было группы лечения плацебо, что не дает возможности тщательной оценки суммарной пользы двух видов терапии на фоне сопутствующей сердечно-сосудистой терапии. В клинических испытаниях значительное число пациентов прекратили прием БРА, и это могло ослабить оценку эффекта терапии при анализе в соответствии с назначенным лечением (intention - to-treat analysis). Кроме того, данный анализ не позволяет исключить потенциально большую пользу от лечения БРА в отдельных подгруппах больных, в частности, у больных с повреждением органов. Наконец, в данном исследовании ИАПФ и БРА рассматривались как 2 класса препаратов, хотя они включают в себя ряд препаратов с различными фармакокинетическими и фармакодинамическими свойствами.Заключение
В группе высокого риска без СН ингибиторы АПФ как класс препаратов снижают риск смерти от всех причин и сердечно-сосудистой смерти, а также сердечно-сосудистую заболеваемость и риск впервые выявленного СД. БРА уменьшают риск объединенного исхода, включающего сердечно-сосудистую смерть, ИМ и инсульт, а также риск впервые возникшего СД. Таким образом, БРА представляют собой вариант терапии, пригодный для пациентов группы высокого риска, которые не переносят лечение ИАПФ.ЛИТЕРАТУРА
1. Yusuf S, Sleight P, Pogue J, Bosch J, Davies R, Dagenais G. Effects of an angiotensin-converting-enzyme inhibitor, ramipril, on ca rdiovascu- lar events in high-risk patients. The Heart Outcomes Prevention Evaluation Study Investigators. N Engl J Med 2000;342:1 45-53.
2. Gibbons RJ, Abrams J, Chatterjee K, et al. ACC/AHA 2002 guideline update for the management of patients with chronic stable angina- summary article: a report of the American College of Cardiology/ American Heart Association Task Force on practice guidelines. J Am Coll Cardiol 2003;41:159 -68.
3. PROGRESS Collaborative Group. Randomized trial of a perindopril- based blood-pressure-lowering regimen among 6,105 individuals with previous stroke or transient ischemic attack. Lancet 2001 ;358:1033-41.
4. Fox KM, EURopean trial On reduction of cardiac events with Perindopril in stable coronary Artery disease Investigators. Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomized, double-blind, placebo-controlled, multicentre trial (the EUROPA study). Lancet 2003;362:782- 8.
5. MacMahon S, Sharpe N, Gamble G, et al. Randomized, placebo-controlled trial of the angiotensin-converting enzyme inhibitor, ramipril, in patients with coronary or other occlusive arterial disease. PART-2 Collaborative Research Group. Prevention of Atherosclerosis with Ramipril. J Am Coll Cardiol 2000;36:438-43.
6. Teo KK, Burton JR, Buller CE, et al. Long-term effects of cholesterol lowering and angiotensin-converting enzyme inhibition on coronary atherosclerosis: the Simvastatin/Enalapril Coronary Atherosclerosis Trial (SCAT). Circulation 2000;1 02:1 748 -54.
7. Pitt B, O'Neill B, Feldman R, et al. The QUinapril Ischemic Event Trial (QUIET): evaluation of chronic ACE inhibitor therapy in patients with ischemic heart disease and preserved left ventricular function. Am . Cardiol 2001 ;87:1058 -63.
8. Braunwald E, Domanski MJ, Fowler SE, et al. Angiotensin-converting-enzyme inhibition in stable coronary artery disease. PEACE Trial Investigators. N Engl J Med 2004;351:2058 -68.
9. Nissen SE, Tuzcu EM, Libby P, et al. Effect of antihypertensive agents on cardiovascular events in patients with coronary disease and normal blood pressure: the CAMELOT study: a randomized controllec trial. JAMA 2004;292:221 7-25.
10. Marre M, Lievre M, Chatellier G, et al. Effects of low dose ramipril on cardiovascular and renal outcomes in patients with type 2 diabetes and raised excretion of urinary albumin: randomized, double blind, placebo controlled trial (the DIABHYCAR study). BMJ 2004;328: 495-500.
11. DREAM Trial Investigators, Bosch J, Yusuf S, et al. Effect of ramipril on the incidence of diabetes. N Engl J Med 2006;355:1 55-62.
12. Rouleau JL, Warnica WJ, Bail lot R, et al. Effects of angiotensin-converting enzyme inhibition in low-risk patients early after coronary artery bypass surgery. Circulation 2008;117:24-31.
13. Dagenais GR, Pogue J, Fox K, Simoons ML, Yusuf S. Angiotensin-converting enzyme inhibitors in stable vascular disease without left ventricular systolic dysfunction or heart failure: a combined analysis of three trials. Lancet 2006;368:581 - 8.
14. Cipollone F, Fazia ML, Mezzetti A. Role of angiotensin II receptor blockers in atherosclerotic plaque stability. Expert Opin Pharmacother 2006;7:277- 85.
15. Struthers AD. Aldosterone escape during ACE inhibitor therapy in chronic heart failure. Eur Heart j 1 995;16:103-6.
16. Casas JP, Chua W, Loukogeorgakis S, et al. Effect of inhibitors of the renin-angiotensin system and other antihypertensive drugs on renal outcomes: systematic review and meta-analysis. Lancet 2005;366:2026-33.
17. Chaturvedi N, Porta M, Klein R, et al. Effect of candesartan on prevention (DIRECT-Prevent 1) and progression (DIRECT- Protect 1) of retinopathy in type 1 diabetes: randomised, placebo-controlled trials. Lancet 2008;372:1394-402.
18. Sj0lie AK, Klein R, Porta M, et al. Effect of candesartan on progression and regression of retinopathy in type 2 diabetes (DIRECT-Protect 2): a randomized placebo-controlled trial. Lancet 2008;372:1 38593.
19. Demers C, McMurray JJ, Swedberg K, et al. Impact of candesartan on nonfatal myocardial infarction and cardiovascular death in patients with heart failure. JAMA 2005;294:1794-8.
20. Parving HH, Lehnert H, Brochner-Mortensen J, et al. The effect of irbesartan on the development of diabetic nephropathy in patients with type 2 diabetes. N Engl J Med 2001 ;345:870-8.
21. Brenner BM, Cooper ME, de Zeeuw D, et al. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J Med 2001 ;345:861 -9.
22. Berl T, Hunsicker LG, Lewis JB, et al. Cardiovascular outcomes in the Irbesartan Diabetic Nephropathy Trial of patients with type 2 diabetes and overt nephropathy. Collaborative Study Group. Ann Intern Med 2003;138:542-9.
23. Kondo J, Sone T, Tsuboi H, et al. Effects of low-dose angiotensin II receptor blocker candesartan on cardiovascular events in patients with coronary artery disease. Am Heart J 2003;146:E20-E25.
24. Lithell H, Hansson L, Skoog l, et al. The Study on Cognition and Prognosis in the Elderly (SCOPE): principal results of a randomized double-blind intervention trial. J Hypertens 2003;21:875-86.
25. Imai E, Ito S, Haneda M, Chan JC, Makino H, ORIENT Investigators. Olmesartan reducing incidence of end stage renal disease in diabetic nephropathy trial (ORIENT): rationale and study design. Hypertens Res 2006;29:703-9.
26. Yusuf S, Diener HC, Sacco RL, et al. Telmisartan to prevent recurrent stroke and cardiovascular events. N Engl J Med 2008; 359:1 225-37.
27. Telmisartan Randomized AssessmeNt Study in ACE iNtolerant subjects with cardiovascular Disease (TRANSCEND) Investigators, Yusuf S, Teo K, et al. Effects of the angiotensin-receptor blocker telmisartan on cardiovascular events in high-risk patients intolerant to angiotensin-converting enzyme inhibitors: a randomized controlled trial. Lancet 2008;372:1 174-83.
28. NAVIGATOR Study Group, McMurray JJ, Holman RR, et al. Effect of valsartan on the incidence of diabetes and cardiovascular events. N Engl J Med 2010;362:1477-90.
29. Haller H, Ito S, Izzo JL Jr, et al. Olmesartan for the delay or prevention of micro albuminuria in type 2 diabetes. N Engl J Med 2011;364:907-17.
30. Moher D, Liberati A, Tetzlaff J, Altman DG; PRISMA Group. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. J Clin Epidemiol 2009;62:1 006 -1 2.
31. Savarese G, Paolillo S, Costanzo P et al. Do changes of 6-minute walk distance predict clinical events in patients with pulmonary arterial hypertension? A meta-analysis of 22 randomized trials. J Am Coll Cardiol 2012;60:1 1 92-201.
32. Detsky A, Naylor C, O'Rourke K, McGeer A, L'Abbe K. Incorporating variations in the quality of individual randomized trials into meta-analysis. J Clin Epidemiol 1 992;45:255-65.
33. Lewis EJ, Hunsicker LG, Bain RP, Rohde RD. The effect of angiotensin-converting enzyme inhibition on diabetic nephropathy. The Collaborative Study Group. N Engl J Med 1993;329: 1456-62.
34. Maschio G, Alberti D, Janin G, et al. Effect of the angiotensin-converting enzyme inhibitor benazepril on the progression of chronic renal insufficiency. The Angiotensin-Converting Enzyme Inhibition in Progressive Renal Insufficiency Study Group. N Engl J Med 1 996;334:939-45.
35. van Vark LC, Bertrand M, Akkerhuis KM, et al. Angiotensin-converting enzyme inhibitors reduce mortality in hypertension: a meta-analysis of randomized clinical trials of renin-angiotensin-aldosterone system inhibitors involving 1 58,998 patients. Eur Heart J 2012;33:2088-97.
36. Sharp S 1, Sterne J. Meta-analysis. Stata Technical Bulletin Reprints 1998;7:100-8.
37. Costanzo P, Perrone-Filardi P Petretta M, et al. Calcium channel blockers and cardiovascular outcomes: a meta-analysis of 175,634 patients. J Hypertens 2009;27:1 1 36 -51.
38. Davies HT, Crombie IK, Tavakoli M. When can odds ratios mislead? BMJ 1998;316:989 -91.
39. Whitehead A. Meta-Analysis of Controlled Clinical Trials. Chichester, England: John Wiley & Sons Inc; 2002:4.
40. Raudenbush SW Analyzing effect sizes: random-effects models. In: Cooper HM, Hedges LV, Valentine JC, editors. The Handbook of Research Synthesis and Meta-Analysis. New York, NY: Russell SAGE Foundation; 2009:306 -7.
41. Sharp SJ. Meta-analysis regression. Stata Technical Bulletin 1998;42:1 6 -22.
42. Thompson SG, Sharp SJ. Explaining heterogeneity in meta-analysis: a comparison of methods. Stat Med 1999;18:2693-708.
43. Peters JL, Sutton AJ, Jones DR, Abrams KR, Rushton L. Comparison of two methods to detect publication bias in meta-analysis. JAMA 2006;295:676-80.
44. Baker WL, Coleman CI, Kluger J, et al. Systematic review: comparative effectiveness of angiotensin-converting enzyme inhibitors or angiotensin II-receptor blockers for ischemic heart disease. Ann Intern Med 2009;151:861-71.
45. Bangalore S, Kumar S, Wetterslev J, Messerli FH. Angiotensin receptor blockers and risk of myocardial infarction: meta-analyses and trial sequential analyses of 147 020 patients from randomised trials. BMJ 2011 ;3 42:d2 234-48.
46. McAlister FA, Renin Angiotensin System Modulator Meta-Analysis Investigators. Angiotensin-converting enzyme inhibitors or angiotensin receptor blockers are beneficial in normotensive atherosclerotic patients: a collaborative meta-analysis of randomized trials. Eur Heart J 2012;33:505-1 8.
47. Thompson SG, Higgins JPT. How should meta-regression analyses be undertaken and interpreted. Statist Med 2002;21:1 559 -73.
48. ONTARGET Investigators, Yusuf S, Teo KK, et al. Telmisartan, ramipril, or both in patients at high risk for vascular events. ONTARGET Investigators. N Engl J Med 2008;358:1 547-59.ИНГИБИТОРЫ АНГИОТЕНЗИНПРЕВРАЩАЮЩЕГО ФЕРМЕНТА И АНТАГОНИСТЫ РЕЦЕПТОРОВ АНГИОТЕНЗИНА: НЕ ПОРА ЛИ ПОСТАВИТЬ ТОЧКУ В ДИСКУССИИ О ПЕРВЕНСТВЕ
Комментарий к статье G. Savarese et al. Мета-анализ исследований, сообщавших об эффектах ингибиторов АПФ и блокаторов рецепторов ангиотензина у больных без сердечной недостаточности (перевод опубликован в данном номере на стр. 188-200)С.Ю. Марцевич
Государственный научно-исследовательский центр профилактической медицины. 101990, Москва, Петроверигский пер., 10Появление ингибиторов ангиотензинпреворащающего фермента (ИАПФ) в конце 70-х гг. ХХ века стало большим событием в области фармакологии. Впервые появились реальные препараты, способные воздействовать на ренин-ангиотензиновую систему, а, следовательно, потенциально способные вмешиваться в патогенез целого ряда сердечно-сосудистых заболеваний, в первую очередь, сердечной недостаточности и артериальной гипертонии. Проведенные вскоре рандомизированные контролируемые клинические исследования (РКИ) полностью подтвердили возлагавшиеся на эти препараты надежды: ИАПФ стали первыми препаратами, отчетливо продемонстрировавшими способность снижать самый важный для клинициста показатель - общую смертность больных при хронической сердечной недостаточности. Вскоре в ряде РКИ был доказан не менее важный факт: ИАПФ существенно снижали смертность больных, перенесших инфаркт миокарда, осложнившийся сердечной недостаточностью или дисфункцией левого желудочка. Наконец, в исследовании HOPE было показано, что добавление ИАПФ к терапии достаточно широкого круга больных с доказанными сердечно-сосудистыми заболеваниями или сахарным диабетом, имевшими высокий риск сердечнососудистых осложнений, приводило к существенному улучшению прогноза их жизни.
Чуть более 10 лет потребовалось для создания новой группы препаратов, также воздействовавших на ренин-ангиотензиновую систему, но делавших это более избирательно: посредством блокады ангиотензиновых рецепторов, получивших впоследствии название антагонистов рецепторов ангиотензина (АРА), или сартанов. Интересно, что разработка этих препаратов являлась примером направленного фармакологического синтеза. Первый препарат этой группы (лозартан) был одобрен для клинического применения в США в 1995 г. Особенности механизма действия АРА (более полное блокирование альдостерона) давали повод предполагать, что они будут иметь вполне конкретные преимущества перед ИАПФ и, возможно, даже заменят их. Однако действительность в виде данных РКИ практически во всех областях медицины не подтвердила наличие у них решающих преимуществ перед ИАПФ. Поскольку ИАПФ доказали свое действие раньше, чем АРА, именно первые стали стандартом лечения, вторым же приходилось постоянно доказывать если не преимущества перед ними, то хотя бы равенство с ними.
Первым разочарованием для АРА стали результаты исследования ELITE-2, не показавшие никаких преимуществ лозартана перед традиционным ИАПФ каптоприлом во влиянии на выживаемость больных хронической сердечной недостаточностью. Единственным «утешением» для АРА явилось чуть лучшая переносимость лозартана по сравнению с каптоприлом. Авторы исследования ELITE-2 сделали вывод, который представляется справедливым до настоящего времени: место АРА там, где плохо переносятся ИАПФ. Полностью опровергли надежды, возлагавшиеся на АРА, еще два крупных РКИ, проводившиеся у больных, перенесших инфаркт миокарда -OPTIMAAL и VALIANT. Они не продемонстрировали никаких преимуществ АРА перед ИАПФ во влиянии на показатели смертности. Наконец, исследование ONTARGET, построенное по аналогии с исследованием HOPE, в котором планировали продемонстрировать преимущества АРА телмисартана перед ИАПФ рамиприлом, не выявило никаких различий во влиянии этих препаратов на первичную конечную точку.
Оставались надежды, что АРА завоюют место в тех областях кардиологии, где ИАПФ по тем или иным причинам никак себя не проявили. Такие исследования дали неоднозначные результаты. Наиболее удачным было исследование LIFE, показавшее (правда, у очень специфической группы больных с артериальной гипертонией, осложненной гипертрофией левого желудочка) преимущества лозартана перед атенололом во влиянии на отдаленный результат лечения. Значительно менее впечатляющими были результаты таких исследований как I-PRESERVE, CHARM-Preserved (больные с сердечной недостаточностью и сохраненной систолической функцией левого желудочка), PROFESS (телмисартан во вторичной профилактике инсульта) и ряда других.
Учитывая значительное число исследований, накопившихся к настоящему времени, выполненных с использованием ИАПФ и АРА, представляет интерес сравнить действие этих препаратов косвенно, используя технику мета-анализа. Таких мета-анализов, сравнивавших эффективность ИАПФ и АРА, было выполнено несколько. В этом номере РФК публикуется перевод последнего мета-анализа, опубликованного в 2013 г. (Savarese et al.), цел ью которого было оценить эффективность ИАПФ и АРА у больных без сердечной недостаточности, имеющих высокий риск сердечно-сосудистых осложнений, т.е., той категории больных, у которых еще оставались шансы показать хотя бы равенство этих двух классов препаратов в отношении улучшения прогноза жизни.
В мета-анализ включались только те исследования, в которых эффект ИАФП или АРА сравнивался с плацебо. Прямого сравнения этих двух классов препаратов между собой не проводилось. Всего в него было включено 26 РКИ, сравнивавших ИАПФ или АРА с плацебо. Общее количество больных составило 108 212. Более подробно о результатах читатель узнает из самой статьи, назовем лишь основной вывод: АРА, безусловно, являются эффективными препаратами, снижющими риск возникновения сердечно-сосудистой смерти (не влияя при этом, в отличие от ИАПФ, на общую смертность), инфаркта миокарда и инсульта. ИАПФ продемонстрировали более выраженное и многообразное действие, снижая также вероятность развития сердечной недостаточности и новых случаев сахарного диабета. Абсолютно логичен и вывод, который сделали авторы мета-анализа: признавая эффективность АРА, они отводят им роль препаратов, которые могут использоваться вместо ИАПФ в тех случаях, когда последние по каким-либо причинам назначены быть не могут.
От себя отметим, что вся предыдущая цепочка исследований и мета-анализов приводили к точно такому же выводу, и вывод, сделанный авторами публикуемого мета-анализа, насколько логичен, настолько же и банален.
В заключение подчеркнем, что нисколько не сомневаясь в эффективности АРА, придется все же согласиться с тем, что в большинстве клинических ситуаций они реально не смогли доказать своих преимуществ перед ИАПФ, более того, АРА, как правило, уступали ИАПФ. Поскольку АРА - препараты не новые и изучены к настоящему времени практически так же подробно, как и ИАПФ, крайне маловероятно что они докажут свои преимущества перед ИАПФ в будущем.
Сведения об авторе:
Марцевич Сергей Юрьевич — д.м.н, профессор, руководитель отдела профилактической фармакотерапии ГНИЦ ПМ
| Сентябрь 2013 г. |