Опубликовано в журнале:
«КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ И ТЕРАПИЯ» 2012, № 21(2), с. 2-7Железа карбоксимальтозат (Феринжект®) – новый внутривенный препарат для лечения железодефицитной анемии
С.В. Моисеев
Кафедра терапии и профболезней Первого МГМУ им. И.М.Сеченова, кафедра внутренних болезней факультета фундаментальной медицины МГУ им. М.В.ЛомоносоваОбсуждается новый препарат для внутривенного введения – карбоксимальтозат железа, который быстро восстанавливает дефицит железа, не вызывает реакции гиперчувствительности, характерные для препаратов, содержащих декстран, и обеспечивает медленное высвобождение железа, что снижает риск токсических эффектов.
Ключевые слова. Железодефицитная анемия, лечение, карбоксимальтозат железа, внутривенно.
Клин. фармакол. тер., 2012, 21 (2).
Анемия относится к числу глобальных проблем современного здравоохранения. По данным экспертов ВОЗ [1], в мире анемией страдают около 1,6 млрд человек, или 24,8% от общего населения. Частота анемии оказалась высокой во всех группах и составила 25,4-47,4% у детей дошкольного и школьного возраста, 41,8% у беременных женщин, 30,2% у небеременных женщин репродуктивного возраста, 23,9% у пожилых людей и 12,7% у мужчин. Хотя среди взрослого населения анемия чаще всего развивалась во время беременности, тем не менее, в популяции основную долю пациентов с анемией составляли небеременные женщины репродуктивного возраста (468 млн человек). По крайней мере в половине случаев причиной анемии служит дефицит железа [2], который может быть следствием хронической кровопотери (менструации и другие причины), недостаточного поступления железа с пищей (например, при хроническом алкоголизме), повышенной потребности (детский и подростковый возраст, беременность, послеродовый период), нарушения всасывания. Дефицит железа бывает не только абсолютным, но и функциональным. Последний возникает в том случае, когда адекватное или даже повышенное общее содержание железа в организме оказывается недостаточным при увеличении потребности в нем костного мозга на фоне стимуляции эритропоэза. Важную роль в регуляции обмена железа играет гепсидин – гормон, который образуется в печени, взаимодействует с ферропортином (белком, осуществляющим транспорт железа) и подавляет всасывание железа в кишечнике, а также его высвобождение из депо и макрофагов [3]. Повышение уровня гепсидина, отмечающееся при воспалении, считают основной причиной анемии хронических заболеваний. Кроме того, уровень гепсидина увеличивается при хронической болезни почек и вносит вклад в развитие нефрогенной анемии и резистентности к стимуляторам эритропоэза. При усилении эритропоэза под действием эритроэпоэтина скорость мобилизации железа из депо становится недостаточной для обеспечения возросших потребностей костного мозга. Пролиферирующим эритробластам необходимо все большее количество железа, что приводит к истощению лабильного пула железа и снижению сывороточного уровня ферритина. Для мобилизации и растворения железа из гемосидерина требуется определенное время. В результате уменьшается количество поступающего в костный мозг железа, что приводит к развитию его функционального дефицита [4].
Независимо от причины железодефицитной анемии основной метод ее лечения – устранение абсолютного или функционального дефицита железа. С этой целью применяют препараты железа, которые можно назначать перорально или внутривенно. Хотя пероральные препараты удобнее парентеральных, они оказывают медленное действие, неэффективны при синдроме нарушенного всасывания и часто вызывают нежелательные реакции со стороны желудочно-кишечного тракта (10-40% пациентов), которые снижают приверженность к лечению. Соответственно, внутривенное введение препаратов железа обосновано в тех случаях, когда необходимо быстро добиться эффекта (например, при более тяжелой анемии, особенно у пациентов, страдающих сердечно-сосудистыми заболеваниями или находящихся на химиотерапии), плохой переносимости препаратов для приема внутрь или их неэффективности (синдром мальабсорбции, хроническая потеря железа, превышающая скорость его восполнения, и др.) [5,6]. Кроме того, внутривенное введение железа считают методом выбора при лечении препаратами, стимулирующими эритропоэз, у больных с хронической болезнью почек (ХБП), воспалительными заболеваниями кишечника, злокачественными опухолями [7].
Некоторые препараты железа можно вводить внутримышечно, однако внутримышечные инъекции болезненные, вызывают изменение цвета кожи и ассоциировались с развитием саркомы ягодичной мышцы [8,9]. По мнению некоторых авторов [10], от внутримышечного введения препаратов железа следует отказаться.
Железа карбоксимальтозат (Феринжект®) – это новый внутривенный препарат железа (рис. 1). Он позволяет быстро восполнить дефицит железа, крайне редко вызывает реакции гиперчувствительности, характерные для препаратов, которые содержат декстран, и обеспечивает медленное высвобождение железа, что снижает риск токсических эффектов.
Рис. 1. Строение карбоксимальтозата железа

Препараты железа для внутривенного введения
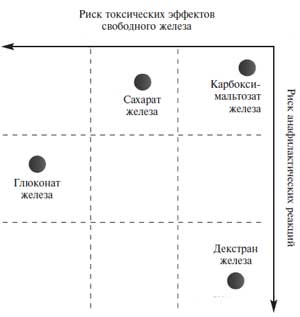
Для внутривенного введения в России применяют карбоксимальтозат железа (Феринжект®), сахарат железа (Венофер), глюконат железа (Феррлецит) и декстран железа (КосмоФер), которые представляют собой сферические железоуглеводные коллоиды. Углеводная оболочка придает комплексу стабильность, замедляет высвобождение железа и поддерживает образующиеся формы в коллоидной суспензии. Эффективность и безопасность внутривенных препаратов железа зависят от их молекулярной массы, стабильности и состава. Комплексы с низкой молекулярной массой, такие как глюконат железа, менее стабильны и быстрее высвобождают в плазму железо, которое в свободном виде может катализировать образование реактивных форм кислорода, вызывающих перекисное окисление липидов и повреждение тканей. Значительная часть дозы подобных препаратов выводится через почки в первые 4 часа после приема препарата и не используется для эритропоэза. Хотя препараты декстрана железа обладают высокими молекулярной массой и стабильностью, их недостатком является повышенный риск аллергических реакций. Карбоксимальтозат железа сочетает в себе положительные свойства высокомолекулярных комплексов железа, но не вызывает реакции гиперчувствительности, наблюдающиеся при применении препаратов, содержащих декстран (рис. 2), и, в отличие от сахарата и глюконата железа, может вводиться в более высокой дозе [11]. Применение карбоксимальтозата железа позволяет вводить за одну инфузию до 1000 мг железа (внутривенно капельно в течение 15 минут), в то время как максимальная доза железа в виде сахарата составляет 500 мг и вводится в течение 3,5 ч, а длительность инфузии декстрана железа достигает 6 ч. Причем в двух последних случаях перед началом инфузии необходимо ввести тестовую дозу препарата. Введение большой дозы железа позволяет сократить необходимое число инфузий и затраты на лечение. Помимо удобства применения важными свойствами карбоксимальтозата железа являются низкая токсичность и отсутствие оксидативного стресса, которые определяются медленным и физиологичным высвобождением железа из стабильного комплекса с углеводом, по структуре сходного с ферритином.
Рис. 2. Риск токсических эффектов и анафилактических реакций при применении внутривенных препаратов железа
Феринжект® вводят внутривенно в виде болюса (максимальная доза 4 мл, или 200 мг железа, не более трех раз в неделю) или капельно (максимальная доза 20 мл, или 1000 мг железа, не чаще одного раза в неделю). Перед началом лечения следует рассчитать оптимальную кумулятивную дозу препарата, которую не следует превышать. Кумулятивную дозу, необходимую для восстановления уровня гемоглобина в крови и восполнения запасов железа в организме, вычисляют по формуле Ганзони:
Кумулятивный дефицит железа (мг) = масса тела [кг] × (целевой Hb – фактический Hb) [г/дл] × 2,4 + содержание депонированного железа [мг], где целевой уровень гемоглобина (Hb) у человека с массой тела <35 и ≥35 кг = 13 г/дл (8,1 ммоль/л) и 15 г/дл (9,3 ммоль/л), соответственно, депо железа у человека с массой тела <35 кг и ≥35 кг = 15 мг/кг и 500 мг. Для перевода уровня гемоглобина из ммоль/л в г/дл показатель следует умножить на 1,61145.
Феррокинетику карбоксимальтозата железа изучали с помощью позитронной эмиссионной томографии с целью оценки распределения железа после введения препарата в дозе 100 мг [12]. Было показано, что препарат быстро распределяется в печень и селезенку, а затем в основном поступает в костный мозг. У всех пациентов уровень утилизации железа эритроцитами быстро увеличился в течение 6-9 дней, а затем продолжал нарастать более медленно. Через 2-3 недели степень утилизации железа составила 91-99% у пациентов с железодефицитной анемией и 61-84% у пациентов с функциональным дефицитом железа.
Клинические исследования R.Moore и соавт. [13] провели мета-анализ 14 рандомизированных клинических исследований, в которых 2348 пациентов получали карбоксимальтозат железа в дозе до 1000 мг в неделю по различным показаниям (нефрогенная анемия, анемия при акушерских и гинекологических состояниях, заболеваниях желудочно-кишечного тракта и др.). Пациентам групп сравнения назначали пероральные препараты железа (n=832), плацебо (n=762) или внутривенно сахарат железа (n=384).
Длительность лечения составляла от 1 до 24 недель. По сравнению с пероральными препаратами внутривенное введение карбоксимальтозата железа привело к более значительному увеличению средних уровней гемоглобина (средняя разница между группами 0,48 г/дл), ферритина (разница 163 мкг/л) и степени насыщения трансферрина (разница 5,3%). При применении внутривенного препарата чаще удавалось достичь предусмотренного протоколом увеличения уровня гемоглобина и целевого уровня гемоглобина. В группе карбоксимальтозата железа выявили достоверное снижение частоты желудочно-кишечных расстройств (13% и 32%, соответственно), в том числе запора (3% и 13%), тошноты/рвоты (3% и 10%) и диареи (2% и 5%). В целом результаты метаанализа подтвердили более высокую эффективность и улучшенную переносимость карбоксимальтозата железа по сравнению с пероральными препаратами железа.
Карбоксимальтозат железа может применяться при любой железодефицитной анемии, когда по тем или иным причинам обосновано внутривенное введение железа. Наиболее важными показаниями к его назначению считают анемию при воспалительных заболеваниях кишечника и хронической сердечной недостаточности, нефрогенную анемию, анемию, вызванную противоопухолевой химиотерапией, так как в подобных случаях внутривенные препараты железа имеют преимущества перед пероральными.
Анемия при воспалительных заболеваниях кишечника
Анемия часто встречается у больных с воспалительными заболеваниями кишечника (болезнью Крона и язвенным колитом) и чаще всего обусловлена дефицитом железа (до 90% случаев), хотя нередко наблюдается и анемия хронических заболеваний [14,15]. Критериями диагностики железодефицита у пациентов с воспалительными заболеваниями кишечника являются снижение сывороточного уровня ферритина <30 мкг/л (у пациентов с высокой воспалительной активностью <100 мкг/л) и степени насыщения трансферрина <16% [16].
У пациентов с уровнем ферритина >100 мкг/л и воспалительной активностью снижение гемоглобина, вероятно, связано с анемией хронических заболеваний. Причинами дефицита железа могут быть хроническая кровопотеря при изъязвлении слизистой оболочки, недостаточное всасывание железа при поражении двенадцатиперстной и тощей кишки или низкое потребление железа. У пациентов с воспалительными заболеваниями кишечника препараты железа предпочтительно вводить внутривенно, так как пероральный их прием часто не позволяет компенсировать продолжающуюся кровопотерю. Кроме того, большая часть принятого внутрь железа не всасывается и может вызывать локальный оксидативный стресс, усиление воспалительных изменений кишечника и, соответственно, нарастание симптомов заболевания [16]. Внутривенные препараты дают более быстрый и выраженный эффект, лучше переносятся и в большей степени улучшают качество жизни. Абсолютными показаниями к внутривенному введению препаратов железа считают тяжелую анемию (уровень гемоглобина <10 г/дл), плохую переносимость или неэффективность пероральных препаратов железа, высокую активность основного заболевания, лечение эритроэпоэтином или желание пациента [16].
В многоцентровом, рандомизированном, контролируемом исследовании эффективность карбоксимальтозата железа изучали у 200 пациентов с железодефицитной анемией на фоне воспалительных заболеваний кишечника [17]. Препарат вводили в дозе 1000 мг железа один раз в неделю. Пациенты группы сравнения получали железа сульфат внутрь в дозе 100 мг два раза в день. Через 12 недель средняя концентрация гемоглобина была сходной в двух группах, однако пациенты быстрее отвечали на внутривенное введение препарата железа. Так, уже через 2 недели доля больных, у которых уровень гемоглобина увеличился по крайней мере на 2 г/дл, в основной группе была достоверно выше, чем в группе сравнения (p=0,0051). Сходные результаты были получены через 4 недели (p=0,0346). Кроме того, внутривенное введение препарата железа позволяло значительно быстрее восполнить запасы железа. Уже через 2 недели средний сывороточный уровень ферритина в основной группе увеличился с 5,0 до 323,5 мкг/л. Хотя в дальнейшем он снизился, при лечении сульфатом железа было отмечено только умеренное увеличение уровня ферритина с 6,5 до 28,5 мкг/л через 12 недель. В группе карбоксимальтозата железа доля пациентов, у которых уровень ферритина увеличился до целевого значения (100-800 мкг/л), при всех визитах была выше, чем в группе сравнения.
Общая частота нежелательных явлений была сопоставимой в двух группах, однако из-за нежелательных реакций лечение карбоксимальтозатом железа прекращали реже, чем пероральным препаратом (1,5% и 7,9%, соответственно). Кроме того, в основной группе была ниже частота желудочно-кишечных расстройств (5,8% и 14,2%), хотя из исследования были исключены пациенты с известной непереносимостью пероральных препаратов железа. Таким образом, внутривенное введение карбоксимальтозата железа у больных с воспалительными заболеваниями кишечника и железодефицитной анемией вызывало быстрое увеличение уровня гемоглобина и восполнение запасов железа, а также имело преимущества перед пероральным препаратом по переносимости.
Анемия при хронической болезни почек
Анемия – это одно из основных осложнений ХБП; частота ее увеличивается по мере ухудшения функции почек. По данным эпидемиологического исследования PRESAM [18], анемия была выявлена у 69% пациентов, впервые обратившихся в диализный центр. Ключевую роль в развитии нефрогенной анемии играет недостаточность эритропоэтина, однако важный вклад в патогенез этого состояния вносит дефицит железа. В популяционном исследовании NHANES признаки дефицита железа (снижение сывороточного уровня ферритина или степени насыщения трансферрина) были выявлены у 58-59% мужчин и 70-73% женщин с ХБП [19]. Причины недостаточности железа при ХБП включают в себя кровопотерю во время диализа или из желудочно-кишечного тракта, недостаточное поступление железа с пищей, а также воспаление, которое сопровождается увеличением секреции гепсидина печенью. Последний блокирует всасывание железа в кишечнике и его выделение из макрофагов [20]. Основными критериями диагностики железодефицита у больных с ХБП считают снижение сывороточного уровня ферритина <100 нг/мл (<200 нг/мл при лечении гемодиализом) и степени насыщения трансферрина <20%. При заместительной терапии препаратами железа целевые значения этих показателей составляют 200-500 нг/мл и 30-50%, соответственно [21]. Если сывороточный уровень ферритина превышает 500 нг/мл, то введение препаратов железа не рекомендуется, хотя в исследовании DRIVE у 134 диализных пациентов с высоким уровнем ферритина (500-1200 нг/мл) и низкой степенью насыщения трансферрина (≤25%), у которых сохранялась анемия несмотря на введение высоких доз эритропоэтина, внутривенное введение препарата железа привело к значительному увеличению уровня гемоглобина по сравнению с контролем [22]. В руководстве Британского национального института здоровья (NICE) 2011 года у преддиализных пациентов с нефрогенной анемией, у которых имеются признаки абсолютного или функционального дефицита железа, рекомендуется скорректировать эти изменения перед назначением препаратов, стимулирующих эритропоэз [23]. При лечении эритроэпоэтином необходимо поддерживать показатели обмена железа на целевых уровнях. В рекомендациях Национального почечного фонда 2006 г. указано, что больным терминальной почечной недостаточностью, получающим лечение гемодиализом, препараты железа следует вводить внутривенно, в то время как у преддиализных пациентов и больных, которым проводится перитонеальный диализ, можно выбрать как внутривенный, так и пероральный путь введения препаратов железа [24].
Эксперты группы Cochrane Collaboration провели мета-анализ 28 исследований (n=2098), в которых сравнивали результаты перорального и внутривенного введения препаратов железа у пациентов с ХБП [25]. Внутривенное введение препаратов железа по сравнению с пероральным привело к значительному увеличению среднего уровня гемоглобина (средняя разница между группами 0,90 г/дл), сывороточного уровня ферритина (средняя разница 243,25 мкг/л) и степени насыщения трансферрина (средняя разница 10,20%). При внутривенном применении препаратов железа у диализных пациентов было выявлено значительное снижение доз эритроэпоэтина. Частота желудочно-кишечных побочных эффектов была выше при пероральном применении препаратов железа, в то время как артериальная гипотония и аллергические реакции чаще встречались при внутривенном их введении.
В многоцентровом исследовании эффективность карбоксимальтозата железа изучали у 163 пациентов с железодефицитной анемией, получавших лечение гемодиализом [26]. У 73,6% пациентов проводилась терапия эритропоэтином. Частота ответа на лечение (увеличение уровня гемоглобина по крайней мере на 1 г/л) составила 61,7%. Вследствие нежелательных явлений лечение прекратили всего 3,1% больных.
W.Qunibil и соавт. [27] в рандомизированном исследовании сравнивали эффективность карбоксимальтозата железа (внутривенное введение в дозе 1000 мг в течение 15 минут + при необходимости две дополнительных дозы по 500 мг с 2-недельными интервалами) и сульфата железа (325 мг три раза в день внутрь в течение 56 дней) у 255 преддиализных пациентов с ХБП и железодефицитной анемией, получавших эритроэпоэтин в стабильной дозе. Доля пациентов, у которых уровень гемоглобина увеличился ≥1 г/дл в любые сроки исследования, составила 60,4% и 34,7% в двух группах, соответственно (p<0,001). Через 42 дня у больных, которым препарат железа вводили внутривенно, выявили более значительное увеличение среднего уровня гемоглобина (р=0,005), ферритина (p<0,001) и степени насыщения трансферрина (p<0,001). При применении карбоксимальтозата железа частота нежелательных явлений была достоверно ниже, чем в группе сравнения (2,7% и 26,2%, соответственно; p<0,0001).
Таким образом, у преддиализных больных железодефицитной анемией карбоксимальтозат железа достоверно превосходил пероральный сульфат железа как по эффективности, так и переносимости.
Анемия, вызванная противоопухолевой химиотерапией
Анемия развивается у 3/4 пациентов со злокачественными опухолями, получающих химиотерапию [28]. Для лечения анемии, индуцированной химиотерапевтическими препаратами, применяют эритроэпоэтин, однако около 50% пациентов плохо отвечают на лечение [29]. Как указано выше, основной причиной недостаточной эффективности препаратов, стимулирующих эритропоэз, является функциональный дефицит железа. В руководстве Европейской организации по изучению и лечению рака (EORTC) указано, что перед назначением эритроэпоэтина необходимо устранить железодефицитную анемию [30]. Хотя результаты исследований карбоксимальтозата железа у пациентов с анемией, индуцированной химиотерапией, не опубликованы, тем не менее, в нескольких рандомизированных клинических исследованиях было показано, что внутривенное введение препаратов железа позволяло увеличить частоту ответа на лечение эритроэпоэтином с 25–70% до 68–93% [31]. В то же время пероральные препараты у таких больных были мало эффективными или вообще неэффективными. Например, в одном исследовании частота ответа на эритроэпоэтин при одновременном применении плацебо или перорального препарата железа составила 25% и 36%, соответственно [32], а в другом – 41% и 45% [33]. В тех же исследованиях внутривенное введение препарата железа привело к увеличению частоты ответа на эритроэпоэтин до 68% и 73%, соответственно. Применение внутривенных препаратов железа может привести к снижению затрат на лечение вследствие уменьшения доз препаратов, стимулирующих эритропоэз, и потребности в гемотрансфузии.
Анемия при акушерских и гинекологических состояниях
В трех рандомизированных контролируемых исследованиях эффективность карбоксимальтозата железа изучали у женщин с послеродовой железодефицитной анемией (уровень гемоглобина <10 г/дл в течение 10 дней после родов) [34-36]. При внутривенном введении препарата железа частота ответа на лечение (увеличение уровня гемоглобина >12 г/дл или более чем на 2,0 г/дл) превышала 85%. В двух исследованиях [35,36] она была выше, чем при пероральном применении препарата железа, в то время как в третьем исследовании [34] средний уровень гемоглобина через 12 недель увеличился в сопоставимой степени при применении карбоксимальтозата железа и сульфата железа. Во всех трех исследованиях внутривенное введение препарата железа привело к быстрому и стойкому увеличению уровня ферритина в сыворотке, в то время как при пероральном применении сульфата железа этот показатель изменялся незначительно. D.Van Wyck и соавт. выявили значительное снижение частоты желудочно-кишечных побочных эффектов при лечении карбоксимальтозатом железа (6,3% и 24,4% в основной и контрольной группах, соответственно; p<0,001). Кумулятивная доза железа при внутривенном введении была значительно меньше, чем при пероральном применении. Например, в исследовании C.Breymann и соавт. она в среднем составила 1,3 и 16,8 г, соответственно. Как отмечено выше, для введения указанной дозы (1,3 г) требуется всего две 15-минутных инфузии карбоксимальтозата железа с интервалом в одну неделю. Еще в одном крупном рандомизированном контролируемом исследовании эффективность карбоксимальтозата железа изучали у 454 женщин с железодефицитной анемией, развившейся на фоне маточного кровотечения [37]. Пациентки были рандомизированы на две группы и получали карбоксимальтозат железа внутривенно (дозу рассчитывали индивидуально) или сульфат железа внутрь (по 325 мг 3 раза в сутки в течение 6 недель). Доля пациенток, у которых уровень гемоглобина увеличился по крайней мере на 2 г/дл, в основной группе была достоверно выше, чем в контрольной (82% и 62%, соответственно; p<0,001). Сходные результаты были получены при анализе частоты увеличения уровня гемоглобина по крайней мере на 3,0 г/дл (53% и 36%; p<0,001) и нормализации уровня гемоглобина (≥12 г/дл; 73% и 50%; p<0,001). Кроме того, введение карбоксимальтозата железа привело к более выраженному улучшению качества жизни (p<0,05). У 86% пациенток основной группы для введения необходимой дозы железа потребовалось всего 2 инфузии препарата, в то время как в остальных случаях были выполнены 1 или 3 инфузии. Таким образом, как и в других исследованиях, внутривенное введение карбоксимальтозата железа было не только более эффективным, чем пероральное применение препарата железа, но и позволяло ввести необходимую дозу железа за короткий срок (у подавляющего большинства пациентов – две инфузии с интервалом в 1 неделю).
Анемия при сердечной недостаточности
В рекомендациях Европейского общества кардиологов анемия рассматривается как независимый фактор риска смерти и других неблагоприятных исходов у больных хронической сердечной недостаточностью [38]. Причинами анемии у таких пациентов могут быть дефицит железа, гемодилюция, почечная дисфункция, неполноценное питание, хроническое воспаление, нарушение функции костного мозга и прием некоторых препаратов. Хотя коррекцию железодефицита или железодефицитной анемии не считают обязательным компонентом лечения хронической сердечной недостаточности, тем не менее, опубликованы результаты исследований, подтверждающих пользу такого подхода.
В исследование FAIR-HF были включены 459 больных с хронической сердечной недостаточностью II-III функционального класса, сниженной фракцией выброса левого желудочка, дефицитом железа (уровень ферритина <100 мкг/л или 100-299 мкг/л при степени насыщения трансферрина <20%) и уровнем гемоглобина от 95 до 135 г/л [39]. Пациентов рандомизировали на две группы (2:1) и вводили карбоксимальтозат железа (200 мг железа) или физиологический раствор. Через 24 недели значительное или умеренное улучшение было отмечено у 50% и 28% пациентов двух групп, соответственно. Доля пациентов с I-II функциональным классом к этому сроку составила 47% в основной группе и 30% в группе плацебо. Внутривенное введение препарата железа привело к улучшению толерантности к физической нагрузке (проба с 6-минутной ходьбой) и качества жизни. Результаты лечения были сходными у пациентов, страдавших и не страдавших анемией.
Заключение
Учитывая безопасность и эффективность внутривенных препаратов железа в лечении железодефицитной анемии различного происхождения, необходимо пересмотреть роль пероральных препаратов железа при этом состоянии [10]. Внутривенное введение препаратов железа считают методом выбора коррекции железодефицита не только при тяжелой анемии или плохой переносимости пероральных препаратов, но и при лечении препаратами, стимулирующими эритропоэз, у пациентов с нефрогенной анемией или анемией, индуцированной химиотерапией. Карбоксимальтозат железа (Феринжект®) – это внутривенный препарат железа, представляющий собой высокомолекулярный и стабильный железоуглеводный комплекс. Он не содержит декстран, который может вызвать серьезные аллергические реакции. Преимуществом карбоксимальтозата железа перед другими внутривенными препаратами железа, зарегистрированными в Российской Федерации, является возможность однократного введения большой дозы железа (1000 мг за 15 минут), что позволяет быстро восполнить дефицит железа (2-3 инфузии) и избежать длительного приема пероральных препаратов, часто вызывающих желудочно-кишечные побочные реакции.
ЛИТЕРАТУРА
1. Worldwide prevalence of anaemia 1993–2005. WHO global database of anaemia. Edited by de Benoist B et al. World Health Organisation; 2008.
2. Iron deficiency anaemia: assessment, prevention, and control. A guide for programme managers. Geneva, WHO, 2001 (WHO/NHD/01.3).
3. Coyne D. Hepcidin: clinical utility as a diagnostic tool and therapeutic target. Kidney Int., 2011, 80 (3), 240-244.
4. Милованов Ю.С., Милованова Л.Ю., Козловская Л.В. Нефрогенная ане- мия: патогенез, прогностическое значение, принципы лечения. Клин. неф- рол., 2010, 6, 7-18.
5. Huch R., Schaefer R. Iron deficiency and iron deficiency anaemia. New York: Thieme Medical Publishers; 2006.
6. Crichton R. Danielson B., Geisser P. Iron therapy with special emphasis on intravenous administration. 4th edition. London, Boston: International Medical Publishers; 2008.
7. Auerbach M., Ballard H. Clinical use of intravenous iron: administration, efficacy, and safety. Hematology Am. Soc. Hematol. Educ. Program, 2010, 2010 (1), 338-347.
8. Grasso P. Sarcoma after intramuscular iron injection. Br. Med. J., 1973, 2, 667.
9. Greenberg G. Sarcoma after intramuscular iron injection. Br. Med. J., 1976, 1, 1508-1509.
10. Auerbach M., Ballard H., Glaspy J. et al. Clinical update: intravenous iron for anaemia. Lancet, 2007, 369, 1502-1504.
11. Geisser Р. The pharmacology and safety profile of ferric carboxymaltose (Ferinject®): structure/reactivity relationships of iron preparations. Port. J. Nephrol. Hypert., 2009, 23 (1), 11-16.
12. Beshara S., Sorensen J., Lubberink M. et al. Pharmacokinetics and red cell utilization of 52Fe/59Fe-labelled iron polymaltose in anaemic patients using positron emission tomography. Br. J. Haematol., 2003, 120, 853-859.
13. Moore R., Gaskell H., Rose P., Allan J. Meta-analysis of efficacy and safety of intravenous ferric carboxymaltose (Ferinject) from clinical trial reports and published trial data. BMC Blood Disord., 2011, 1, 4.
14. Gasche C. Anemia in inflammatory bowel diseases. London, Boston: International Medical Publishers; 2008.
15. Kulnigg S., Gasche C. Systematic review: managing anaemia in Crohn's disease. Aliment. Pharmacol. Ther., 2006, 24 (11–12), 1507–1523.
16. Gasche C., Berstad A., Befrits R. et al. Guidelines on the diagnosis and management of iron deficiency and anemia in inflammatory bowel diseases. Inflamm. Bowel Dis., 2007, 13 (12), 1545–1553.
17. Kulnigg S., Stoinov S., Simanenkov V. et al. A novel intravenous iron formulation for treatment of anemia in inflammatory bowel disease: the ferric carboxymaltose randomized controlled trial. Am. J. Gastroenterol., 2007, 103 (5), 1182–1192.
18. Valderrábano F., Horl W., Macdougall I. et al. Pre-dialysis survey on anaemia management. Nephrol. Dial. Transplant., 2003, 18 (1), 89-100.
19. Fishbane S., Pollack S., Feldman H., Joffe M. Iron indices in chronic kidney disease in the National Health and Nutritional Examination Survey 1988-2004. Clin. J. Am. Soc. Nephrol., 2009, 4 (1), 57-61.
20. Tsagalis G. Renal anemia: a nephrologist’s view. Hippokratia, 2011, 15 (Suppl. 1), 39-43.
21. Locatelli F., Covic A., Eckardt K. et al. Anaemia management in patients with chronic kidney disease: a position statement by the AnaemiaWorking Group of European Renal Best Practice. Nephrol. Dial. Transplant., 2009, 24, 348–354.
22. Coyne D., Kapoian T., Suki W. et al. DRIVE Study Group. Ferric gluconate is highly efficacious in anemic hemodialysis patients with high serum ferritin and low transferrin saturation: results of the Dialysis Patients’ Response to IV Iron with Elevated Ferritin (DRIVE) Study. J. Am. Soc. Nephrol., 2007, 18, 975–984.
23. NICE clinical guideline. Anaemia management in people with chronic kidney disease. February 2011.
24. National Kidney Foundation. KDOQI Clinical practice guidelines and clinical practice recommendations for anemia in chronic kidney disease. Am. J. Kidney Dis., 2006 (supp. 3), 47, S1-S146.
25. Albaramki J., Hodson E., Craig J., Webster A. Parenteral versus oral iron therapy for adults and children with chronic kidney disease. Cochrane Database Syst. Rev., 2012, Jan. 18;1:CD007857.
26. Covic A., Mircescu G. The safety and efficacy of intravenous ferric carboxymaltose in anaemic patients undergoing haemodialysis: a multi-centre, open-label, clinical study. Nephrol. Dial. Transplant., 2010, 25, 2722–2730.
27. Qunibi W., Martinez C., Smith M et al. A randomized controlled trial comparing intravenous ferric carboxymaltose with oral iron for treatment of iron deficiency anaemia of non-dialysis-dependent chronic kidney disease patients. Nephrol. Dial. Transplant., 2011, 26, 1599–1607.
28. Ludwig Hю et al. The European Cancer Anaemia Survey (ECAS): a large, multinational, prospective survey defining the prevalence, incidence, and treatment of anaemia in cancer patients. Eur. J. Cancer, 2004, 40 (15), 2293–2306.
29. Shord S. et al. Parenteral iron with erythropoiesis-stimulating agents for chemotherapy-induced anemia. J. Oncol. Pharm. Pract., 2008, 14 (1), 5–22.
30. Aapro M. et al. September 2007 update on EORTC guidelines and anemia management with erythropoiesis-stimulating agents. Oncologist, 2008, 13 (Suppl. 3), 33–36.
31. Hedenus M. et al. The role of iron supplementation during epoietin treatment for cancer-relatedanemia. Med. Oncol., 2009, 26 (1), 105–115.
32. Auerbach M. et al. Intravenous iron optimizes the response to recombinant human erythropoietinin cancer patients with chemotherapy-related anemia: a multicenter, open-label, randomized trial. J. Clin. Oncol., 2004, 22 (7), 1301–1307.
33. Henry D. et al. Intravenous ferric gluconate significantly improves response to epoetin alfa versus oral iron or no iron in anemic patients with cancer receiving chemotherapy. Oncologist, 2007, 12 (2), 231–242.
34. Breymann C. et al. Comparative efficacy and safety of intravenous ferric carboxymaltose in the treatment of postpartum iron deficiency anemia. Int. J. Gynaecol. Obstet., 2008, 101 (1), 67–73.
35. Seid M. et al. Ferric carboxymaltose injection in the treatment of postpartum iron deficiency anemia: a randomized controlled clinical trial. Am. J. Obstet. Gynecol., 2008, 199 (4), 431–437.
36. Van Wyck D. et al. Intravenous ferric carboxymaltose compared with oral iron in the treatment of postpartum anemia: a randomized controlled trial. Obstet. Gynecol., 2007, 110 (2 Pt. 1), 267–278.
37. Van Wyck D., Mangione A., Morrison J. et al. Large-dose intravenous ferric carboxymaltose injection for iron deficiency anemia in heavy uterine bleeding: A randomized, controlled trial. Transfusion, 2009, 49 (12), 2719–2728.
38. Dickstein K. et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2008: the Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2008 of the European Society of Cardiology. Eur. Heart J., 2008, 29 (19), 2388–2442.
39. Anker S., Comin Colet J., Filippatos G. et al. Ferric carboxymaltose in patients with heart failure and iron deficiency. N. Engl. J. Med., 2009, 361, 2436-2448.
| Май 2013 г. |