Изучение противоаллергической и противовоспалительной активности эбастина в суточных дозах 10 и 20 мг у больных интермиттирующим аллергическим ринитом.
Т.Ю. Петровская*, А.С. Лопатин**, Е.С. Феденко***, Сергеева Т.А.*
* Федеральное Государственное учреждение "Поликлиника №3" Управления делами Президента РФ, Москва
** ММА им. И.М. Сеченова, Москва
*** ГНЦ - Институт иммунологии ФМБА России, МоскваКлючевые слова: аллергический ринит, эбастин, антигистаминные препараты, риноманометрия, эндоскопия полости носа, эозинофилия назального секрета, эозинофильный катионный протеин.
Резюме.
Цель. Изучение противоаллергической и противовоспалительной активности Кестина в суточных дозах 10 и 20 мг у больных интермиттирующим аллергическим ринитом (ИАР) с помощью объективных и субъективных методов обследования.
Материалы и методы. Обследовано 40 больных, страдающих ИАР средней степени тяжести, получавших эбастин в дозе 10 или 20 мг/сут в течение 4 нед. Оценивали динамику показателей передней активной риноманометрии (ПАР), данных эндоскопии полости носа, уровня эозинофилии и эозинофильного катионного протеина (ЕСР) назального секрета, динамику основных симптомов ИАР и потребность в топических деконгестантах до начала курса и в период терапии.
Результаты. Назначение эбастина больным ИАР в течение 4 недель приводит к увеличению суммарного объемного потока (до 623±33,1 см3/с у пациентов, получавших эбастин 10мг/сут, и до 699,7±54 см3/с у пациентов, получавших 20мг/сут, по сравнению с исходными значениями - 352,3±18,6 см3/с, p<0,001) и уменьшению суммарного сопротивления воздушному потоку (до 0,38±0,03 Па/см3/с у пациентов, получавших эбастин 10мг/сут, и до 0,32±0,03 Па/см3/с у пациентов, получавших 20мг/сут, по сравнению с исходными значениями - 1,44±0,1 Па/см3/с, p<0,001); к снижению эозинофилии назального секрета (в 2 раза) и уровня ЕСР (в среднем до 3,15±1,9 мкг/л по сравнению с исходными значениями - 14,4±5,25 мкг/л, p<0,05); улучшению эндоскопической картины; значительно и достоверно уменьшает выраженность симптомов ИАР и снижает потребность в деконгестантах.
Заключение. Эбастин в суточных дозах 10 и 20 мг высоко эффективен в отношении всех симптомов ИАР, включая назальную обструкцию, а также обладает дополнительной противоаллергической и противовоспалительной активностью, причем, эффект эбастина в дозе 20 мг превосходил таковой в дозе 10 мг.
A study comparing the anti-allergic and anti-inflammatory activity of Ebastine (10 mg to 20 mg) once daily in patients with intermittent allergic rhinitis. T.U.Petrovskaya*, A.S.Lopatin**, E.S.Fedenko***, T. A. Sergeeva *
*Federal state institution of President Administrative office "Polyclinic №3", Moscow, Russia
**Moscow Medical Academy named after I. M. Setchenof, Moscow, Russia
***Institute of immunology, Moscow, RussiaKey words: allergic rhinitis, ebastine, antihistamines, rhinomanometria, endoscopy of nasal cavity, eosinophilia of nasal secretions, eosinophil cationic protein.
Background. Aim of our study was to compare the anti-allergic and anti-inflammatory activity of Ebastine (10 mg to 20 mg) once daily in patients with intermittent allergic rhinitis (IAR) by means of objective and subjective methods.
Methods. 40 patients with moderate-to-severe IAR who received Ebastine 10 mg or 20 mg once daily within 4 weeks were studied. During the study we estimated the rhinomanometria, endoscopy of nasal cavity changes, nasal eosinophilia, eosinophil cationic protein (ECP) level changes, the influence of treatment on clinical symptoms of allergic rhinitis.
Results. Administration of Ebastine within 4 weeks leads to increased total volumetric stream (on the average 623±33,1 sm3/s (Ebastine 10 mg) and 699,7±54 sm3/s (Ebastine 20 mg) in comparison with reference values - 352,3±18,6 sm3/s, p <0,001) and to reduction of total resistance to an air stream (on the average 0,38±0,03 Pa/sm3/s (Ebastine 10 mg) and 0,32±0,03 Pa/sm3/s (Ebastine 20 mg) in comparison with reference values - 1,44±0,1 Pa/sm3/s, p <0,001); to decreasing of nasal eosinophilia and of ECP level (on the average 3,15±1,9 mkg/l with in comparison with reference values - 14,4±5,25 mkg/l, p<0,05), to improvement of the endoscopic view, reduction of allergic rhinitis symptoms of and of the topical decongestant requirement.
Conclusion . Once daily Ebastine 10 mg and 20 mg effectively reduces all symptoms of IAR including nasal obstruction and possesses additional anti-allergic and anti-inflammatory activity (decreasing of nasal eosinophilia) in IAR patients. The most therapeutic effect showed Ebastine 20mg in comparison with Ebastine 10 mg.Введение.
H1-блокаторы, благодаря своей симптоматической активности, признаны высокоэффективным средством лечения ИАР [1]. Традиционно H1-блокаторы считались менее эффективными в отношении назальной обструкции, нежели остальных симптомов (чихание, зуд в носу и ринорея). Однако во многих, появившихся недавно исследованиях, по оценке эффективности и безопасности H1-блокаторов второго поколения наблюдалось их влияние на заложенность носа у больных ИАР [2-4]. Развитие данного симптома не опосредовано воздействием гистамина на H1-рецепторы [5], следовательно, можно предположить, что некоторые H1-блокаторы обладают дополнительной противоаллергической и противовоспалительной активностью. Как указывает F. Simons [6], противоаллергическая активность (снижение выделения медиаторов из тучных клеток и базофилов), возможно, обеспечивается за счет прямого влияния H1-блокаторов на Ca-ионные каналы, что приводит к снижению входящего тока Ca и истощению внутриклеточного депо кальция. Противовоспалительный эффект (экспрессия молекул адгезии и хемотаксиса эозинофилами и другими клетками) может быть обеспечен за счет снижения активности NF-kB (nuclear factor kappa B) - фактора транскрипции, связанного с инициирующими участками многих генов, которые отвечают за продукцию цитокинов и молекул адгезии. В результате блокирования высвобождения медиаторов воспаления базофилами и тучными клетками и уменьшения экспрессии молекул адгезии, происходит угнетение миграции клеток аллергического ответа в зону воспаления [6].
ECP входит в состав цитоплазматических гранул эозинофилов и является абсолютно специфичным для них. ECP тормозит пролиферацию Т-лимфоцитов, связывает и нейтрализует гепарин, стимулирует секрецию слизи в бронхах. Попадая в кровоток при дегрануляции, он отражает степень выраженности аллергического воспаления, являясь его маркером [7-8]. Известны положительные эффекты лоратадина и фексофенадина на изменение уровня эозинофилии и ЕСР в назальном секрете у больных ИАР [9-10]. Целью нашей работы стало изучение противоаллергической и противовоспалительной активности эбастина в суточных дозах 10 и 20 мг у больных интермиттирующим аллергическим ринитом (ИАР) с помощью объективных и субъективных методов обследования.
Материалы и методы.
Дизайн исследования. В исследование были включены 40 пациентов, обоего пола [24 мужчин (60%) и 16 женщин (40%)], страдающих ИАР, средней степени тяжести (согласно классификации ВОЗ ARIA), с сенсибилизацией к пыльцевым аллергенам в стадии обострения. Средний возраст больных составил 41,2 ± 4,5 лет (от 22 до 63 лет). Средняя продолжительность заболевания составила 13,6 ± 4,5 лет (от 2 до 43 лет).
Все пациенты были рандомизированы методом случайного отбора на две группы:
1 группа (15 человек) принимали эбастин 10мг/сут;
2 группа (25 человек) принимали эбастин 20мг/сут;Сформированные группы больных ИАР были сопоставимы по полу, возрасту и длительности заболевания.
Дополнительно при необходимости пациенты могли принимать препараты симптоматической терапии (деконгестанты и ингаляционные бронхолитики при наличии БА), ежедневную потребность в которых пациенты регистрировали в своих дневниках. Активный период наблюдения составил 4 недели.
Критериями включения пациентов в исследование были:
больные с историей ИАР; по крайней мере, 2-летний анамнез заболевания; положительные кожные пробы с пыльцевыми аллергенами; клиническая картина обострения ИАР; способность адекватно оценивать свое состояние. В исследование не были включены пациенты:
с инфекциями дыхательных путей или придаточных пазух носа; с полипами и другими анатомическими аномалиями носа, значительно нарушающими носовое дыхание; с гиперчувствительностью к любому из компонентов изучаемых препаратов; имевшие недавние хирургические вмешательства в полости носа; с наличием декомпенсированных заболеваний или острых состояний, способных существенно повлиять на результат исследования; параллельно применявшие препараты, способные оказать влияние на динамику показателей, использующихся для оценки эффективности терапии (системные ГКС, топические ГКС, топические антигистаминные, кромоны, системные деконгестанты и комбинированные препараты, в состав которых входят вышеперечисленные) меньше чем за 2 нед. до начала исследования и во время исследования. Оценка эффективности терапии: всем пациентам до начала терапии, на 8 и 29 сутки терапии проводили следующее обследование: передняя активная риноманометрия (ПАР); эндоскопия полости носа; исследование уровня эозинофилии назального секрета; клинический анализ крови. До начала терапии и на 10 сутки исследовали уровень эозинофильного катионного протеина (ЕСР) в назальном секрете.
ПАР проводилась с использованием риноманометра "РС 300" фирмы "ATMOS", Германия. Суммарный объемный поток (СОП) и суммарное сопротивление (СС) обеих половин носа изучались при давлении 150 Па. При клиническом анализе использовалась суммарная оценка обеих половин носа.
Осмотр полости носа проводили жесткими эндоскопами диаметром 4 или 2,7 мм с углами зрения 0° и 30° фирмы "KARL STORS" (Германия). Одновременно производилось фотографирование риноскопической картины в стандартном положении эндоскопа в передних отделах одной половины полости носа.
Для подсчета числа эозинофилов в мазках-отпечатках со слизистой оболочки носа использовали общепринятую методику. Стерильный ватный тампон на зонде прикладывали к слизистой оболочке нижней носовой раковины на глубине 1-1,5 см, получали мазок-отпечаток, фиксировали в эфирно-спиртовой смеси, окрашивали по Романовскому - Гимзе. Цитологический анализ назального секрета выполняли с помощью световой микроскопии.
Для определения ЕСР в назальных смывах производили забор назального секрета абсорбционным методом, описанным Klimek L. [11]. Для этого пинцетом в средний носовой ход каждой половины носа помещали кусочек поролона размером 1х1 см на 15 минут. Пинцетом выжимали тампон в пробирку с предварительно нанесенной на стенки пробирки солью этилендиаминотетрауксусной кислоты (ЭДТА), которую растворяли в 2 мл физиологического раствора (pH7,4). Полученную массу центрифугировали при 1000g в течение 20 мин для осаждения клеточных элементов и слизи. Далее методом ИФА проводилось измерение количества ЕСP в нг/мл с использованием реагентов Ala STAT Mikroplate EСP производства DPC (СА, USA).
Пациенты ежедневно оценивали динамику симптомов ИАР (заложенность носа, чихание, ринорея, зуд в полости носа, стекание слизи по задней стенке глотки), а также потребность в топических деконгестантах до начала курса терапии и в период терапии. Дополнительно пациенты отмечали выраженность других симптомов, характерных для больных, страдающих поллинозом (зуд в глазах, слезотечение, покраснение глаз, першение в горле) и симптомы, характеризующие качество жизни (КЖ) пациентов (нарушение сна, нарушение дневной активности и нарушение трудоспособности или способности к обучению). Выраженность симптомов оценивали по 4-балльной шкале: 0 - отсутствие симптомов; 1 - слабо выраженные симптомы; 2 - умеренно выраженные симптомы; 3 - интенсивные симптомы. Также пациенты ежедневно оценивали влияние болезни (ИАР) на свое самочувствие с помощью визуальной аналоговой шкалы (ВАШ), где 0% - это отсутствие жалоб и симптомов, а 100% - максимально выраженные проявления болезни. Оценка терапии врачом-исследователем проводилась во время контрольных визитов: исходно, на 8 и 29 день терапии (в подсчетах учитывались данные за последние 7 дней, предшествовавших визиту).
Оценка безопасности терапии: безопасность препаратов оценивалась на основании субъективных жалоб пациента, данных физикального и лабораторного обследования, отсутствия побочных эффектов и осложнений.
Результаты и обсуждение.
Общая характеристика пациентов. Исследование в соответствии с протоколом завершили 39 пациентов (выбыл 1 пациент из группы, получавшей эбастин 10мг/сут в связи с неявкой на контрольные визиты, обусловленные занятостью по работе).
У всех пациентов отмечалось сочетание ИАР с другими атопическими заболеваниями. Так, 32 (82%) пациента страдали аллергическим конъюнктивитом (АК), 6 больных (15,4%) - интермиттирующей бронхиальной астмой (БА) атопической формы легкого течения, 4 (10,3%) - атопическим дерматитом (АтД) локальной формы; у 5 (12,9%) пациентов отмечались реакции пищевой перекрестной аллергии с клиническими проявлениями крапивницы и/или отека Квинке.
При аллергологическом обследовании (кожном prick-тестировании) в структуре спектра сенсибилизации у 27 пациентов (69,2%) была выявлена повышенная чувствительность к аллергенам пыльцы деревьев, у 24 (61,5%) - пыльцы злаковых трав, у 2 (5,1%) - пыльцы сорных трав, у 10 (25,6%) - бытовым аллергенам (домашняя, библиотечная пыль, клещи D. pter. и D. far), у 9 (23,1%) - эпидермальным аллергенам.
Оценка эффективности терапии с помощью ПАР. Методом ПАР у больных ИАР были изучены показатели суммарного объемного потока (СОП) и суммарного сопротивления воздушному потоку (СС). Нормальные показатели СОП и СС для сравнения были выведены на основании обследования контрольной группы из 14 здоровых лиц, без каких-либо заболеваний носа и околоносовых пазух (табл. 1).
Таблица 1. Показатели ПАР у здоровых лиц
суммарный объемный поток (СОП), см3/с суммарное сопротивление (СС), Па/см3/с 682,6 ± 35,8 0,22 ± 0,03 Исходные значения СОП в обеих группах были сходными и составили в среднем 352,3±18,6 см3/с (табл. 2), что было ниже (почти в 2 раза) по сравнению с группой обследованных здоровых лиц (682,6±35,8 см3/с). На фоне терапии эбастином было отмечено достоверное (р<0,001) увеличение СОП уже ко второму визиту (на 8 день терапии) и дальнейшее увеличение к концу лечения. Так, в 1 группе пациентов, получавших эбастин 10 мг/сут, к концу лечения зарегистрированы значения СОП в среднем 623±33,1 см3/с (прирост составил Δ=272±15,0 см3/с (77,5%)). Во 2 группе пациентов (эбастин 20 мг/сут) средние значения СОП к концу лечения - 699,7±54 см3/с (прирост составил Δ=346,5±34,1 см3/с (98,1%)), т.е. показатели СОП стали сходными с показателями СОП здоровых лиц. Лучшие результаты были получены в группе пациентов, получавших эбастин в дозе 20 мг/сут (межгрупповые различия в выраженности эффекта были статистически достоверны, p<0,05).
Таблица 2. Динамика показателей суммарного объемного потока (СОП), см3/с, у больных ИАР на фоне терапии эбастином
Доза препарата 10мг 20мг исходные значения 351±28,7 353,1±27,7 8 день терапии 492±34,8 587,6±31,6 прирост показателей относительно исходных 141±9,1 (40,2%) 234,5±12,5 (66,4%) 29 день терапии 623±33,1 699,7±54 прирост показателей относительно исходных 272±15,0 (77,5%) 346,5±34,1 (98,1%) Исходные значения СС (в среднем 1,44±0,1 Па/см3/с) в обеих группах были сходными (табл. 3), что было выше (почти в 6,5 раз) по сравнению с группой обследованных здоровых лиц (0,22±0,03 Па/см3/с). На фоне терапии эбастином было отмечено достоверное (р<0,001) уменьшение СС уже ко второму визиту (на 8 день терапии) и дальнейшее снижение к концу лечения. Так, в 1 группе пациентов, получавших эбастин 10 мг/сут, к концу лечения зарегистрированы средние значения СС - 0,38±0,03 Па/см3/с [разница показателей составила Δ=-1,03±0,09 Па/см3/с (-73%)]. Во 2 группе пациентов (эбастин 20 мг/сут) средние значения СС к концу лечения - 0,32±0,03 Па/см3/с [Δ=-1,14±0,09 Па/см3/с (-78,1%)]. Более выраженное снижение СС было отмечено в группе пациентов, получавших эбастин в дозе 20 мг/сут (межгрупповые различия в выраженности эффекта были статистически достоверны, p<0,05). Таким образом, после 4-недельного курса терапии эбастином у больных ИАР были улучшены показатели CC воздушному потоку в 4 раза, однако, они так и не стали сопоставимы с показателями СС здоровых лиц.
Таблица 3. Динамика показателей суммарного сопротивления воздушному потоку (СС), Па/см3/с, у больных ИАР на фоне терапии эбастином
Доза препарата 10мг 20мг исходные значения 1,41±0,14 1,46±0,1 8 день терапии 0,92±0,06 0,81±0,7 разница показателей относительно исходных -0,49±0,04 (-34,8%) -0,65±0,03 (-44,5%) 29 день терапии 0,38±0,03 0,32±0,03 разница показателей относительно исходных -1,03±0,09 (-73%) -1,14±0,09 (-78,1%) Оценка эффективности терапии с помощью эндоскопии и фотографирования полости носа. На начальном этапе исследования эндоскопическая картина была сходной у всех пациентов и характеризовалась выраженным отеком слизистой оболочки, обуславливающим увеличение нижних носовых раковин и сужение носовых ходов, бледностью и пятнистостью слизистой, наличием серозного или серозно-слизистого отделяемого и соответствовала обострению ИАР. Динамика эндоскопической картины на фоне терапии эбастином в обеих группах была сходной и характеризовалась уменьшением отека слизистой носовых раковин, расширением носовых ходов, уменьшением количества отделяемого, нормализацией цвета (стал розовым), что свидетельствовало о восстановлении носового дыхания. Частота и степень выраженности этих изменений соответствовали динамике показателей ПАР, уменьшению эозинофилии и уровня ЕСР в назальном секрете и уменьшению интенсивности основных симптомов ИАР. Лучшие результаты были получены в группе пациентов, получавших эбастин 20 мг/сут.
Оценка эффективности терапии с помощью цитологического исследования назального секрета. При цитологическом исследовании мазков-отпечатков со слизистой оболочки носа до начала терапии эозинофилы выявлялись у 35 пациентов (89,7%), а в конце лечения - у 3 (7,7%).
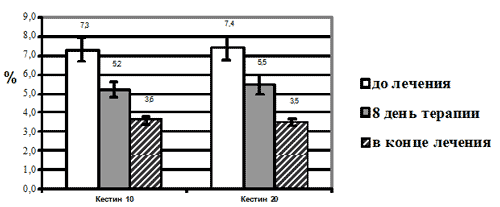
Исходные количества эозинофилов в мазках-отпечатках в обеих группах были сходными и составили в среднем 7,36% ± 0,5. На фоне терапии эбастином в дозах 10 и 20 мг/сут было отмечено достоверное (р<0,001) уменьшение эозинофилии назального секрета, в некоторых случаях - до полного исчезновения, а в среднем до 3,53± 0,3% на 29 день терапии (Рис.1). Статистически достоверных межгрупповых различий не выявлено. Таким образом, в результате проведенного исследования было показано достоверное уменьшение эозинофилии назального секрета у больных ИАР на фоне лечения эбастином, что косвенно свидетельствует о способности этого препарата снижать хемотаксис и накопление эозинофилов в слизистых оболочках при атопических заболеваниях.
Рис. 1. Изменение количества эозинофилов в мазках-отпечатках со слизистой носа на фоне терапии эбастином
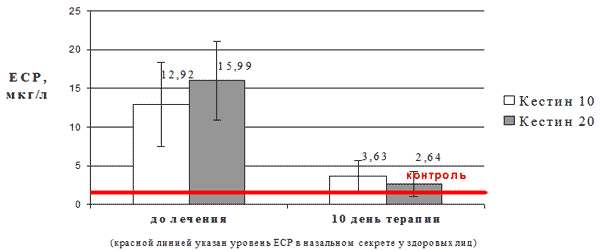
Исследование уровня ЕСР в назальном секрете у больных ИАР на фоне терапии эбастином.
До начала и на 10 день терапии эбастином всем пациентам проводилось исследование уровня эозинофильного катионного протеина (EСP) в назальном секрете. Нормальные показатели ECP для сравнения были выведены на основании обследования контрольной группы из 10 здоровых лиц, без каких-либо заболеваний носа и околоносовых пазух.
Средние значения концентрации ECP в назальном секрете у больных ИАР до начала лечения составили 14,4±5,25 мкг/л, что существенно превышало уровень ЕСР у здоровых лиц (2,0±0,5 мкг/л, р<0,001). На фоне терапии эбастином на 10 день терапии отмечено значительное и достоверное снижение концентрации ЕСР - в среднем до 3,15±1,9 мкг/л (Δ=-11,25±5,1, р=0,025). Более выраженный эффект был отмечен в группе пациентов, получавших эбастин в дозе 20 мг/сут (снижение уровня ECP в среднем до 3,6±2,0 мкг/л; Δ=-4,5±5,2) по сравнению с группой пациентов, получавших эбастин в дозе 10 мг/сут (снижение уровня ЕСР в среднем до 2,6±1,7 мкг/л; Δ=-13,8±5,1) (Рис.2), однако статистически межгрупповые различия в выраженности эффекта были недостоверны.
Рис. 2. Изменение уровня ЕСР в назальном секрете у больных САР на фоне терапии эбастином
При изучении взаимосвязи между уменьшением количества эозинофилов и снижением концентрации ECP в назальном секрете корреляции не выявлено (коэффициент корреляции Спирмена r=0,235; р<0,211), что может быть обусловлено малым количеством наблюдений.
При изучении взаимосвязи между изменениями параметров ПАР и уровня ECP в назальном секрете у больных ИАР на фоне лечения эбастином была выявлена четкая отрицательная корреляция в случае с СОП (r=-0,79; р<0,001) и положительная в случае с СС (r=0,84; р<0,001).
Полученные данные свидетельствуют о наличии у эбастина не только противогистаминного, но и собственного противовоспалительного эффекта, т.е. способности подавлять развитие поздней фазы аллергического воспаления.
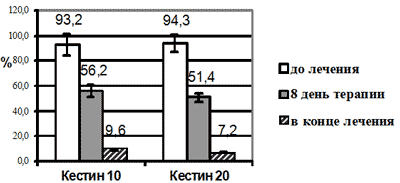
Рис.3. Динамика значений визуальной аналоговой шкалы (%) у больных ИАР на фоне терапии эбастином
Оценка влияния H1-блокаторов на симптомы ИАР. По результатам субъективной оценки исходные показатели выраженности симптомов в обеих группах были сходными и соответствовали средней тяжести течения ИАР (табл.4). В результате исследования было показано, что эбастин хорошо подавляет интенсивность ринореи, заложенности носа, чихания, стекания слизи по задней стенке глотки, першения в горле и глазных симптомов. Назначение эбастина больным ИАР приводит к нормализации сна, восстановлению дневной активности и трудовой деятельности, что свидетельствует об улучшении КЖ пациента. Положительный эффект наступал с 1 дня терапии и стойко сохранялся в течение всего 28-дневного курса лечения. Эбастин в дозе 20 мг/сут лучше контролировал симптомы ИАР по сравнению с дозой 10 мг/сут (межгрупповые различия были статистически достоверны (р<0,05)).
Таблица 4. Динамика интенсивности симптомов ИАР и конъюнктивита на фоне терапии эбастином (оценка исходного состояния, визит 1 и 2 - средний балл за предыдущие 7 дней)
Симптом эбастин 10 мг эбастин 20 мг до лечения
(М ± σ)в конце терапии
(М ± σ)до лечения
(М ± σ)в конце терапии
(М ± σ)чихание 2,13 ± 0,2 0,27 ± 0,01 *** 2,07 ± 0,2 0,22 ± 0,01 *** выделения из носа 2,07 ± 0,15 0,47 ± 0,04 *** 2,07 ± 0,18 0,38 ± 0,02 *** заложенность носа 2,47 ± 0,23 1 ± 0,05 * 2,45 ± 0,22 0,81 ± 0,07 *** стекание слизи по задней стенке глотки 1,87 ± 0,17 0,27 ± 0,02 *** 1,89 ± 0,12 0,23 ± 0,02 *** слезотечение 1,4 ± 0,1 0,27 ± 0,02 ** 1,39 ± 0,12 0,24 ± 0,02 *** зуд в глазах 1,27 ± 0,1 0,07 ± 0,01 *** 1,27 ± 0,11 0,07 ± 0,01 *** покраснение глаз 0,93 ± 0,1 0,47 ± 0,04 * 0,93 ± 0,07 0,4 ± 0,02 *** першение в горле 1,53 ± 0,1 0,33 ± 0,02 ** 1,56 ± 0,12 0,31 ± 0,02 *** нарушение сна 0,73 ± 0,06 0,2 ± 0,02 * 0,75 ± 0,07 0,16 ± 0,02 *** нарушение дневной активности 0,67 ± 0,04 0,27 ± 0,02 * 0,65 ± 0,04 0,22 ± 0,01 *** назофарингеальные симптомы (суммарн.балл) 10,07 ± 0,55 2,34 ± 0,14 *** 10,04 ± 0,6 1,95 ± 0,12 *** глазные симптомы (суммарный балл) 3,6 ± 0,34 0,81 ± 0,05 *** 3,59 ± 0,21 0,71 ± 0,05 *** симптомы, характеризую-щие КЖ (суммарн.балл) 1,4 ± 0,1 0,47 ± 0,04 ** 1,4 ± 0,08 0,38 ± 0,03 *** общий суммарный балл 15,07 ± 1,31 3,62 ± 0,28 *** 15,03 ± 1,18 3,04 ± 0,18 *** * - р<0,05 в сравнении с исходной величиной
** - р<0,01 в сравнении с исходной величиной
***- р<0,001 в сравнении с исходной величинойПри оценке выраженности симптомов ИАР с помощью ВАШ исходные значения в обеих группах были сходными и в среднем составили 93,9±5,8%. На фоне терапии эбастином отмечено достоверное (р<0,001) улучшение самочувствия, связанного с болезнью, уже ко второму визиту (на 8 день терапии) и дальнейшее улучшение к концу лечения, когда значения ВАШ составили в среднем 8,1±4,7%. Достоверных межгрупповых различий в выраженности эффекта не получено.
На фоне терапии эбастином у пациентов, исходно имевших потребность в топических деконгестантах, удалось сократить кратность их приема, вплоть до полной отмены в среднем на 6-7 сутки (индивидуально потребность в топических деконгестантах сохранялась от 1 до 21 суток).
Оценка безопасности терапии. На протяжении всего периода наблюдения нежелательные явления были отмечены у 2 пациентов (табл. 5) и характеризовались появлением головной боли или сухости во рту. Все симптомы были легкой степени выраженности, не требовали отмены препарата и регрессировали самостоятельно в ходе терапии или после окончания лечения на 29 день. Переносимость препарата у остальных пациентов была хорошей. Существенной межгрупповой разницы в развитии нежелательных явлений не выявлено. Переносимость препарата у остальных 37 пациентов (94,9%) была хорошей.
Таблица 5. Сравнительный анализ эффективности H1-блокаторов при лечении больных ИАР
эффект эбастин 10мг эбастин 20мг отличный 5 (35,7%) 11 (44%) хороший 3 (21,4%) 6 (24%) удовлетворительный 5 (35,7%) 8 (32%) незначительный или отсутствие эффекта 1 (7,1%) 0 (0%) нежелательные явления 1 (7,1%) 1 (4%) Что касается заключительной оценки эффективности эбастина в различных суточных дозировках, то при проведении сравнительного анализа были выявлены межгрупповые различия, свидетельствующие о большей эффективности эбастина в дозе 20 мг по сравнению с дозой 10 мг (табл. 5).
Заключение. В результате проведенного исследования было показано, что эбастин хорошо контролирует симптомы ИАР, способствуют уменьшению заложенности носа и восстановлению носового дыхания, что подтверждается результатами объективных методов исследования, причем эффект эбастина в дозе 20 мг превосходил таковой в дозе 10 мг. Назначение эбастина больным ИАР приводит к снижению эозинофилии назального секрета (в 2 раза) и уровня ЕСР (в среднем до 3,15±1,9 мкг/л по сравнению с исходными значениями - 14,4±5,25 мкг/л, p<0,05), что коррелирует с улучшением показателей ПАР и уменьшением выраженности симптомов и свидетельствует о наличии у препарата не только противогистаминной, но и собственной противовоспалительной активности и его способности подавлять развитие поздней фазы аллергического воспаления.
ЛИТЕРАТУРА
- Bousquet J. Requirements for medication commonly used in the treatment of allergic rhinitis. Allergy, 2003, v.58, p.192-197.
- Ciprandi G, Cirillo I, Vizzaccaro A, Tosca MA. Levocetirizine improves nasal obstruction and modulates cytokine pattern in patients with seasonal allergic rhinitis: a pilot study. Clin Exp Allergy, 2004, v.34, N6, p.958-964.
- Lipworth BJ., Wilson AM., Haggart K., Sims EJ. Differnces in vitro H1-receptor antagonist potency with fexofenadine and desloratadine do not determine effects on nasal congestion in seasonal allergic rhinitis. Allergy, 2002, v.57, s.73, p.10-15.
- Meltzer EO, Jalowayski AA, Vogt K, Iezzoni D, Harris AG. Effect of desloratadine therapy on symptom scores and measures of nasal patency in seasonal allergic rhinitis: results of a single-center, placebo-controlled trial. Ann Allergy Asthma Immunol, 2006, v.96, N 2, p.363-368.
- Riechelmann H. Oral second generation antihistamines in allergic rhinitis. Laryngorhinootologie, 2005, v.84, N1, p.30-41.
- Simons FER. Advances in H1-antihistamines. N Engl J Med, 2004, v.351, p.2203-2217.
- Moneret-Vautrin DA. Is the seric eosinophil cationic protein level a valuable tool of diagnosis in clinical practice? Rev Med Interne, 2006, vol.27, N 9, p.679-683.
- Lin X, He S, Xie H. Correlations between plasma levels of IL-18, IL-4, IFN-gamma, IgE and ECP in the patients with seasonal allergic rhinitis and their clinical implications. Lin Chuang Er Bi Yan Hou Ke Za Zhi, 2005, v.19, N5, p.195-197.
- Kaszuba SM, Baroody FM, deTineo M. Superiority of an intranasal corticosteroid compared with an oral antihistamine in the as-needed treatment of seasonal allergic rhinitis. Arch Intern Med, 2001, v.161, N21, p.2581-2587.
- Барановская Т.В. Лечение аллергических заболеваний с помощью нового антигистаминного препарата Телфаст (фексофенадин). Медицинские новости, 2002, № 6, с.45-48.
- Klimek L, Rasp G. Norm values for eosinophil cationic protein in nasal secretions: influence of specimen collection. Clin Exp Allergy, 1999. v.29, p.367-74.
| Апрель 2010 г. |