Опубликовано в журнале:
«Русский медицинский журнал», 2008, ТОМ №16, № 14, с. 1-7Глюкованс - высокоэффективная комбинация метформина и глибенкламида в одной таблетке
Профессор А.М. Мкртумян, к.м.н. Е.В. Бирюкова, Н.В. Маркина
МГМСУК большому хору специалистов и экспертов ВОЗ, выражающих тревогу по росту заболеваемости сахарным диабетом 2 типа (СД–2) среди взрослого населения планеты, присоединилась крупнейшая политическая организация мира – ООН, заявившая, что диабет представляет угрозу человечеству. В США диабет прочно занимает четвертое место по смертности, обусловленной преимущественно ишемической болезнью сердца (ИБС) [1,17,21]. СД–2 увеличивает риск кардиоваскулярных заболеваний в 4 раза, что особенно проявляется среди женщин–диабетиков [15]. В ряде исследований продемонстрировано, что у больных СД–2 риск возникновения инсульта повышен в 2–3 раза, хронической почечной недостаточности – в 15–20 раз, а слепоты – в 10–20 раз [4,8,11]. Кроме того, риск развития хронической сердечной недостаточности у больных СД–2 в 2,5 раза выше, чем у лиц без СД. СД–2 характеризуется прогрессирующим нарушением функции β–клеток поджелудочной железы на фоне развития инсулинорезистентности [4,8]. При манифестации СД–2 секреция инсулина снижается на 50%, чувствительность к инсулину – на 70% [13]. В настоящее время известно более 40 различных состояний, при которых формируется инсулинорезистентность той или иной степени. Инсулинорезистентность сопутствует стрессам, инфекциям, уменьшению физической активности, пожилому возрасту, приему алкоголя, ожирению и многим другим состояниям [13]. Вместе с тем нарушение секреции инсулина в результате секреторного дефекта β–клеток поджелудочной железы встречается исключительно при СД–2. Одним из ранних патофизиологических дефектов секреторной функции β–клеток при СД–2 является нарушение ранней фазы секреции инсулина, ограничивающей подъем гипергликемии в постпрандиальный период. Ранняя фаза прандиального ответа инсулина вызывает подавление эндогенной продукции глюкозы печенью, контролирует дальнейший рост гликемии, подавляет липолиз и секрецию глюкагона, а также повышает чувствительность периферических тканей к действию инсулина, способствуя утилизации ими глюкозы. При СД–2 секреция инсулина недостаточна по отношению к нарастающей гипергликемии. Наибольшая диспропорция между секрецией инсулина и потребностью в нем возникает после приема пищи. Другим важным патофизиологическим механизмом является инсулинорезистентность периферических тканей – печени, мышечной и жировой. Инсулинорезистентность печени сопровождается снижением синтеза гликогена, активизацией гликогенолиза и глюконеогенеза. Физиологическая реакция печени на гиперинсулинемию заключается в снижении продукции глюкозы. Длительное время инсулинорезистентность компенсируется нефизиологической гиперинсулинемией. В дальнейшем этот механизм утрачивается и печень избыточно продуцирует глюкозу, что приводит к гипергликемии натощак. При СД–2 продукция эндогенной глюкозы печенью продолжается, несмотря на пищевую нагрузку, и в сочетании с относительной недостаточностью выброса инсулина также приводит к постпрандиальной гипергликемии.
Обычный подход к лечению СД–2 включает диету и физические нагрузки, изменение поведения, фармакотерапию, обучение больных, а также профилактику и лечение осложнений [1,4,20]. Однако в декабре 2006 года Американская диабетическая ассоциация (ADA) и Европейская ассоциация по изучению СД (EASD) пришли к соглашению (консенсусу), согласно которому на этапе установления диагноза СД всем пациентам следует назначить метформин наряду с принципами модификации образа жизни. При неудаче терапии, проводимой на любом этапе прогрессирования СД–2, важно своевременно проводить ее коррекцию и выбирать наиболее оптимальный вариант. Модификация образа жизни включает соблюдение правильного питания, снижение и контроль за массой тела, увеличение физической активности, прекращение курения, ограничение или исключение употребления алкоголя, уклонение, решение социальных и сексуальных проблем.
При избыточном весе рекомендуются: низкокалорийное питание с исключением легкоусвояемых углеводов, доля жиров в суточном рационе не должна превышать 30%, а насыщенные жиры должны составлять не более 1/3 от всего потребляемого жира; снижение потребления холестерина (менее 300 мг в сутки); употребление продуктов с высоким содержанием пищевых волокон; сокращение приема алкоголя (менее 30 г в сутки). Для лучшей мотивации больных следует избегать жестких ограничений в диете. Хороший эффект оказывает регулярная физическая нагрузка (например, ходьба в течение 1 часа, интенсивность которой увеличивается постепенно во избежание нежелательных по -следствий), безопасная и эффективная с учетом индивидуальных особенностей каждого пациента. Четко установлена способность регулярных физических упражнений снижать риск осложнений СД путем повышения чувствительности к инсулину [2]. Однако нефармакологические методы лечения СД–2 обеспечивают достижение и поддержание целевых показателей гликемии в течение 1 года после установления диагноза не более чем у 5–10% пациентов [4,17]. Поэтому эксперты сочли необходимым немедленное начало фармакотерапии метформином при отсутствии противопоказаний к данному препарату. Фармакотерапия СД–2 должна воздействовать на основные патофизиологические нарушения, присущие СД–2: дисфункция β–клеток и инсулинорезистентность [8,14].
Монотерапия одним из пероральных сахароснижающих препаратов (ПССП) имеет положительные результаты непродолжительное время и обычно эффективна в первые 5–6 лет заболевания. В дальнейшем возникает необходимость комбинации из двух и более препаратов с различным механизмом действия. Так, результаты UKPDS показали, что через 3 года от начала лечения только у 50% больных на фоне терапии диетой и монотерапии ПССП достигается уровень HbA1c менее 7,0%, а спустя 9 лет только 25% достигают такой цели [9]. В дальнейшем для достижения компенсации СД появляется необходимость назначения комбинированной терапии. В клинической практике применяются комбинации из препаратов разных групп, которые дополняют друг друга по механизму действия. В сравнении с монотерапией ПССП комбинированная фармакотерапия способна снизить содержание HbA1с на 2–2,5% [4] (табл. 1).
Таблица 1. Снижение уровня HbA1с на фоне различной сахароснижающей терапии
Производные СМ*, меглитиниды Метформин Тиазолидиндионы Инсулин 1,0–2,0 1,0–2,0 0,5–1,0 1,5–2,5 *– сульфонилмочевина Одним из основополагающих принципов фармакотерапии СД–2 с учетом его прогрессирующей природы является регулярная оценка ее эффективности. В настоящее время известно, что хороший гликемический контроль снижает риск развития и прогрессирования осложнений СД–2 [3,19]. В современной клинической практике терапии СД–2 используются следующие группы лекарственных препаратов:
- Производные сульфонилмочевины
- Бигуанид
- Меглитиниды
- Миметики глюкагонподобного пептида 1 (ГПП 1)
- Ингибиторы дипептидил пептидазы IV (DPP IV)
- Тиазолидиндионы
- Ингибиторы α–глюкозидазы
- Комбинированные препараты
- Инсулин
Препараты сульфонилмочевины
Эти препараты относятся к секретогенам инсулина. Механизм действия препаратов сульфонилмочевины (ПСМ) основан на их способности стимулировать образование и секрецию эндогенного инсулина β–клетками поджелудочной железы, особенно в присутствии глюкозы [4,8,9]. Среди ПСМ второй генерации в настоящее время широко используются глибенкламид, глипизид, гликлазид, гликвидон и глимепирид. Известно, что ПСМ характеризуются различной силой стимулирующего влияния на секрецию инсулина, что обусловлено особенностями связывания с рецепторами β–клеток (АТФ–зависимыми калиевыми каналами) за счет разной химической структуры молекулы. Периферическое действие ПСМ имеет вторичную природу. Это действие обусловлено повышением инсулинемии и снижением глюкозотоксичности, что вызывает улучшение утилизации глюкозы тканями и угнетение продукции глюкозы печенью. При едином механизме действия каждый из препаратов сульфонилмочевины имеет особенности фармококинетики и фармакодинамики и ряд дополнительных фармакологических свойств, которые необходимо учитывать, проводя лечение больных с СД–2 [5,9]. ПСМ связываются со специфическими белками–рецепторами на клеточной мембране β–клеток и стимулируют секрецию инсулина путем закрытия калиевых каналов и, как следствие этого, открытия кальциевых каналов. В дальнейшем значительно увеличивается приток кальция внутрь β–клеток, в которых его накопление запускает секрецию инсулина. ПСМ связываются на клеточной мембране β–клетки с сульфонилмочевинным рецептором, молекулярная масса которого составляет 149 кДА. Исключением является глимепирид, связывающийся с субъединицей этого рецептора с меньшей молекулярной массой (65 кДА). ПСМ не оказывают клинически значимого эффекта в отношении повышенной гепатической продукции глюкозы и инсулинорезистентности. Наиболее эффективным препаратом из ПСМ является глибенкламид, который используется в клинической практике около 40 лет. Метаболизм препарата происходит в основном в печени путем превращения в два неактивных метаболита, один из которых экскретируется с мочой, а второй выделяется через желудочно–кишечный тракт. Глибенкламид обладает наиболее выраженным сахароснижающим действием среди всех ПСМ и производится в виде двух форм: немикронизированной и микронизированной. Немикронизированная форма глибенкламида является препаратом выбора в лечении больных СД–2 при неэффективности других ПСМ. Для достижения оптимального эффекта препарата необходим постепенный подбор наиболее эффективной и при этом минимальной дозировки. Длительность сахароснижающего эффекта всех форм глибенкламида составляет 24 часа. Биодоступность этой формы глибенкламида составляет всего 24–69%, максимальная концентрация в крови достигается через 4–6 ч после приема. Суточная доза составляет 2,5–20 м г, ее назначают в 2 приема за 30–40 мин. до еды. Глибенкламид обладает максимальным сродством к АТФ–зависимым K+–каналам β–клеток, поэтому оказывает выраженный сахароснижающий эффект. В ряде случаев такой эф -фект может явиться причиной гипогликемии в ночное время, в случае из–за пропуска очередного приема пищи, недостаточного количества пищи или неадекватности физических нагрузок, что наиболее опасно у лиц пожилого и старческого возраста. Более частое возникновение гипогликемических эпизодов отмечено у больных СД–2, получавших глибенкламид, в сравнении с больными, которые получали другие ПСМ (глимепирид, гликлазид) [7]. Гипогликемии, как явные, так и скрытые, могут возникать при неправильном назначении препарата (неадекватно большие дозы, использование режима приема 3 раза в сутки). В результате у больного повышается аппетит, увеличивается масса тела и нарастает инсулинорезистентность. Но состояние компенсации СД не достигается, что ошибочно оценивается врачом, как неэффективность лечения, и вновь увеличивается суточная доза препарата. Несмотря на известные факторы риска гипогликемий, ПСМ длительного действия продолжают достаточно широко использоваться, в основном из–за их высокой сахароснижающей активности. Эпизоды гипогликемии чаще встречаются у больных пожилого и старческого возраста в результате нарушения режима приема препаратов за счет ухудшения памяти. Как показывает практика, пожилые больные часто не помнят, принимали ли они лекарство от диабета в утренние или вечерние часы, в связи с чем перед ужином или завтраком принимают дозу, в 2 раза больше рекомендованной, не увеличивая при этом количество потребляемых углеводов, что часто провоцирует гипогликемию.
Микронизированные формы глибенкламида характеризуются значительно большей биодоступностью и эффективностью по сравнению с немикронизированной формой, несмотря на употребление в меньшей дозе. Микронизированная форма глибенкламида обеспечивает полное высвобождение действующего вещества в течение 5 мин. после растворения и быстрое всасывание, поэтому его рекомендуется принимать непосредственно перед приемом пищи. Максимальная концентрация микронизированных форм глибенкламида достигается через 1,7 часа (1,75 мг) и 2,5 ч (3,5 мг). Риск гипогликемических эпизодов в периоды времени между приемами пищи и ночью значительно снижен.
Бигуанид
Единственным препаратом из группы бигуанидов, разрешенным к применению, является метформин [3]. Одно из существенных преимуществ метоформина по сравнению с другими ПССП связано с препятствием увеличению массы тела (а в ряде случаев он даже способствует ее снижению).
Одним из важнейших патофизиологических механизмов развития гипергликемии при СД–2 является повышение гепатической продукции глюкозы в ночные и ранние утренние часы, что приводит к повышению уровня гликемии натощак. Основу этого патологического процесса составляют нарушенная чувствительность гепатоцитов к действию инсулина, относительная портальная гипоинсулинемия и гиперглюкагонемия [3,17]. Давно доказано, что инсулинорезистентность сопровождается повышенным риском сердечно–сосудистых заболеваний и нарушением функции сосудов [14,20]. Бигуанид метформин повышает печеночную и периферическую чувствительность к эндогенному инсулину, не влияя на его секрецию [3,9]. Не оказывая прямых эффектов на β–клетки, метформин опосредованно улучшает секрецию инсулина, снижая глюкозотоксичность и концентрацию свободных жирных кислот (липотоксичность). Первичный антигипергликемический эффект вызван снижением продукции глюкозы печенью (глюконеогенез), а также продукции свободных жирных кислот (СЖК), окисления жира и частично – усилением периферического захвата глюкозы [11].
Основным механизмом действия метформина является снижение продукции глюкозы печенью, которая в 2–3 раза повышена у больных СД–2 [3]. В одном из недавних исследований показано, что у больных СД–2 гипергликемия натощак отчасти обусловлена троекратным повышением скорости глюконеогенеза [13]. Такой механизм действия препарата связан с подавлением процессов глюконеогенеза и в меньшей степени гликогенолиза, что в итоге обеспечивает нормализацию показателей гликемии натощак. Наряду с этим повышается поглощение глюкозы скелетными мышцами и жировой тканью. Метформин способствует инсулин–индуцированному подавлению глюконеогенеза из таких предшественников глюкозы, как лактат, пируват, глицерол, некоторые аминокислоты и противодействует глюконеогенетическому действию глюкагона. В первую очередь это происходит вследствие торможения поступления перечисленных субстратов глюконеогенеза в гепатоциты и ингибирования его ключевых ферментов – пируваткарбоксилазы, фруктозо–1,6–бифосфатазы и глюкозо–6–фосфатазы [10,13,17].
Повышение чувствительности периферических тканей к действию инсулина под влиянием метформина реализуется посредством ряда клеточных механизмов. Со стороны рецепторов инсулина под влиянием метформина наблюдается повышение их числа и аффинности. Кроме того, происходит стимуляция тирозинкиназной активности рецептора инсулина, а также стимуляция экспрессии и активности транспортеров глюкозы, их транслокация из внутриклеточного пула на клеточную мембрану [17]. Вышеперечисленные процессы приводят к увеличению поглощения глюкозы органами–мишенями инсулина – печенью, мышечной и жировой тканями, усиливается синтез гликогена в печени. Метформин также оказывает влияние на всасывание углеводов в желудочно–кишечном тракте, замедляя его скорость, а также снижает аппетит, в связи с чем снижается постпрандиальная гликемия. Наряду с этим метформин имеет ряд других метаболических эффектов, включая и влияние на жировой обмен [3,4]. Лечение бигуанидом оказывает благоприятный эффект на метаболизм липидов плазмы в связи с гиполипидемическим и антиатерогенным действием (табл. 2). Повышенная концентрация СЖК определяется у большинства больных СД–2, а метформин обладает способностью снижать на 10–30% окисление СЖК. Снижая концентрацию СЖК (на 10–17%), он не только улучшает чувствительность к инсулину, но и способствует коррекции нарушенной секреции инсулина [3,9].
Таблица 2. Прямые и непрямые кардиопротективные эффекты метформина
• Снижение гипергликемии (25–30%)
• Ослабление инсулинемии
• Улучшение диастолической функции миокарда
• Снижение уровня общего холестерина, триглицеридов
(10–20%)
• Снижение уровня холестерина ЛПОНП (10%)
• Снижение уровня холестерина ЛПНП (10%)
• Повышение уровня холестерина ЛПВП (10–20%)
• Подавление окислительного стресса• Снижение пролиферации ГМК*
• Улучшение релаксации сосудов
• Усиление капиллярного кровотока
• Снижение проницаемости сосудов
• Снижение неоангиогенеза
• Подавление активности ингибитора активатора плазминогена–1
• Повышение уровня тканевого активатора плазминогена
• Снижение агрегации и адгезии тромбоцитов* – гладкомышечные клетки сосудистой стенки Важно заметить, что у больных СД–2 метформин оказывает кардиопротективное действие, которое лишь отчасти обусловлено его антигипергликемическими эффектами. Дополнительные кардиопротективные эффекты связаны с влиянием метформина на липидный об мен, эндотелиальную функцию, сосудистую реактивность, систему гемостаза и реологию крови, в том числе гиперкоагуляцию, гиперактивность тромбоцитов и др. (табл. 2).
В недавно проведенном исследовании у больных СД–2 пожилого возраста оценивалось влияние метформина и глибенкламида на дисперсию интервала QТ, который является маркером риска аритмии и внезапной сердечной смерти [8]. Было показано, что лечение метформином не оказывает влияния на дисперсию интервала QТ, в то время как прием глибенкламида достоверно увеличивал дисперсию QТ.
В последние годы появилось много интересных данных о гемодинамических эффектах метформина, которые свидетельствуют о значимой роли препарата не только в достижении контроля гликемии, но и в профилактике и замедлении прогрессирования сосудистых осложнений СД–2. Как у больных СД–2 среднего, так и у пожилого возраста, бигуанид положительно влияет на систему гемостаза и реологию крови. У больных СД–2 значительно усилены процессы тромбообразования и высок риск тромбоза. Терапия метформином в суточной дозе 1700 мг уменьшает агрегацию тромбоцитов у больных СД–2 [9]. Метформин не только обладает способностью тормозить агрегацию тромбоцитов, но и снижает риск образование тромбов [3,11]. В ряде исследований показано улучшение процессов фибринолиза под влиянием метформина [13,17]. Механизм улучшения фибринолиза обусловлен снижением уровня и активности ингибитора активатора плазминогена–1 (ИАП–1), инактивирующего тканевой активатор плазминогена. Кроме того, метформин обладает и непрямым механизмом снижения уровня ИАП–1. Адипоциты висцеральной жировой ткани продуцируют значительно больше ИАП–1, чем адипоциты подкожно–жировой клетчатки, а метформин способствует уменьшению массы висцеральной жира.
Вазопротективные эффекты метформина заключаются в нормализации цикла сокращения/расслабления артериол, уменьшении проницаемости сосудистой стенки и торможении процессов неоангиогенеза.
Окислительный стресс при СД–2, вызванный комплексным ослаблением антиоксидантной системы и повышенным синтезом свободных радикалов одна из причин поддержания инсулинорезистентности. Метформин обладает антиоксидантной активностью, обусловленной торможением клеточных окислительных реакций, в том числе и окислительного гликозилирования белков [15,17].
В сочетании с диетотерапией и физическими нагрузками метформин снижает концентрацию глюкозы натощак на 2,78–3,90 ммоль/л, что сопровождается снижением уровня HbA1c на 1,3–2,0% [3,10]. Вариабельность степени снижения гликемии связана с исходным уровнем гликемии до инициации лечения метформином. Доказано, что эффективность терапии метформином не зависит от возраста, массы тела, продолжительности СД, уровня инсулина и С–пептида крови.
При выборе препарата для лечения больного с СД–2, особенно с избыточной массой тела, всегда нужно помнить о доказанных преимуществах мет фор ми на у та кой категории больных. В отличие от производных сульфонилмочевины, инсулина и тиазолидиндионов метформин обладает уникальным действием – снижает массу тела. Метформин практически не метаболизируется в организме и полностью выводится почками в неизмененном виде (период полувыведения 1,5–4,9 ч). При почечной недостаточности, уменьшении выделительной функции почек (особенно с возрастом) скорость выведения метформина снижается пропорционально уменьшению клиренса креатинина и может возрастать риск лактацидоза. Лечение препаратом инициируют с 500–850 м г, принимаемых в ужин или на ночь. В дальнейшем доза препарата увеличивается на 500–850 мг каждую 1–2 недели. Максимальная рекомендованная доза составляет 2550–3000 мг/сут. в режиме 2–3 приемов. Окончательный антигипергликемический эффект метформина развивается постепенно, как правило, через 3–4 недели после начала лечения (табл. 2).
Часть пациентов с СД–2 не переносят метформин в связи с побочными эффектами препарата (диарея, метеоризм, абдоминальный дискомфорт). Эти дозозависимые эффекты, по–видимому, связаны с накоплением препарата в слизистой кишечника и локальным повышением выработки лактата [3,10]. Во избежание таких явлений необходима постепенная титрация дозы препарата, а в некоторых случаях временное снижение дозы до предыдущей.
Риск развития гипогликемии на фоне терапии метформином практически отсутствует, поскольку препарат не стимулирует продукцию инсулина β–клетками [13]. Идеальный пациент для инициации терапии метформином – это больной СД–2 с избыточным весом или ожирением и нормальной функцией почек (концентрация креатинина крови <133 ммоль/л у мужчин и <124 ммоль/л у женщин). Метформин следует использовать с осторожностью у пожилых пациентов со сниженной массой тела, концентрация креатинина у которых обманчиво низка и увеличение уровня которого не отражает истинного снижения скорости гломерулярной фильтрации. Отсутствие достижения целевого уровня постпрандиальной гликемии на фоне лечения метформином свидетельствует о значительном нарушении функциональной активности β–клеток, относительном дефиците инсулина и необходимости дополнительного приема препарата с другим механизмом действия. При комбинированной терапии метформин назначают с производными сульфонилмочевины, меглитинидами, тиазолидиндионами и инсулином, что повышает терапевтическую эффективность и значительно улучшает гликемический контроль. Метформин в комбинации с препаратами сульфонилмочевины является эффективной формой терапии, которая интенсивно используется клиницистами уже много лет и позволяет добиться снижения дозы препаратов сульфонилмочевины [24]. Целесообразность использования препаратов сульфонил мочевины не подлежит сомнению, ибо важнейшим звеном патогенеза СД–2 является секреторный дефект β–клетки. С другой стороны, инсулинорезистентность почти постоянный признак СД–2, что обусловливает необходимость применения метформина. По мнению исследователей [25], комбинированная терапия метформином и препаратами сульфонилмочевины также эффективна, как комбинированная терапия инсулином и препаратами сульфонилмочевины или монотерапия инсулином у пациентов с плохим эффектом от предшествовавшей терапии. Это хорошо видно на результатах перекрестного исследования 50 больных СД–2 с вторичной резистентностью к препаратам сульфонилмочевины [26], которые были разделены на 2 группы. Пациентам первой группы дополнительно был назначен метформин три раза в сутки, а больным второй группы дополнительно было назначено вечернее введение инсулина NPH. При проведении сравнительной оценки эффективности и переносимости терапии констатировано одинаковое улучшение показателей гликемии при обоих вариантах комбинации. Уровень холестерина сыворотки значительно снизился при приеме метформина (p<0,005), но не на фоне инсулинотерапии. Было замечено, что все пациенты инсулинотерапии предпочитали дополнительное назначение метформина. Подтверждение наблюдений о том, что комбинированная терапия сульфонилмочевиной и метформином имеет существенные преимущества перед монотерапией способствовали созданию официальной формы препарата, содержащего оба компонента. Подобным комбинированным препаратом является Глюкованс, обеспечивающий патогенетический подход к лечению СД–2. Глюкованс представляет собой сбалансированную комбинацию метформина 500 мг и глибенкламида 2,5 мг или 5 мг в одной таблетке (рис. 1).
Рис. 1. Уникальная технология производства Глюкованса.

В отличие от похожей комбинации в другом препарате глибенкламид в Глюковансе представлен в виде микронизированной формы, а уникальная система доставки частиц глибенкламида разного размера способствует более быстрому поступлению глибенкламида после еды. Таким образом, пик концентрации глибенкламида в плазме наступает раньше, что позволяет принимать препарат вместе с едой (рис. 2).
Рис. 2. Концентрация глибенкламида в плазме крови
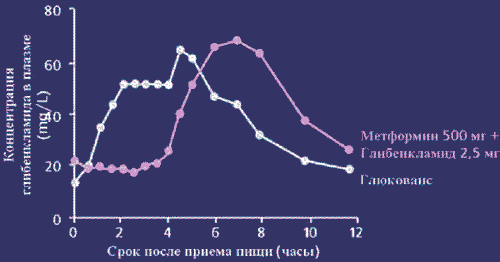
Следует отметить, что биодоступность Глюкованса идентична свободной комбинации обоих компонентов, а фармакокинетика метформина неизменна, и лишь пик концентрации глибенкламида наступает раньше, что, по сути, является преимуществом препарата. Клинические исследования демонстрируют синергическое действие компонентов, высокую эффективность по сравнению с монотерапией или любой комбинацией пероральных сахароснижающих средств (рис. 3).
Рис. 3. Показатели HbA1c на Глюковансе в сравнении с монотерапией
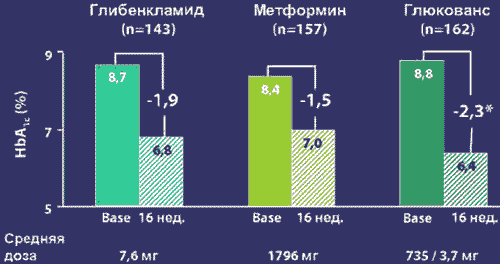
На рисунке 3 показано, что несмотря на меньшие дозы компонентов в препарате Глюкованс достигнута более высокая эффективность по достижению компенсации углеводного обмена, чем при монотерапии метформином и глибенкламидом.
Такие малые дозы позволяют обеспечить безопасность при высокой эффективности. Благодаря низкой дозе глибенкламида в Глюковансе обеспечиваются:
- меньшее воздействие на β–клетки
- низкий риск гипогликемий
- низкая частота острых и хронических осложнений терапии СД–2
Не менее важно учесть, что для пациента это удобная форма препарата, воздействующая на оба дефекта СД–2 одной таблеткой и имеющая улучшенную переносимость.
Показания для назначения Глюкованса могут быть первичными, так и вторичными.
Первичные показания к назначению Глюкованса:
- при поздней диагностике диабета
- при изначально агрессивном течении диабета
- при наличии относительных противопоказаний к ПССП
Вторичные показания для назначения Глюкованса:
- при неэффективности высших доз монотерапии
- у лиц с сохраненной секрецией инсулина при вторичной резистентности к препаратам сульфонилмочевины
- при противопоказании к высшим дозам метформина в виде монотерапии
Таким образом, раннее назначение более интенсивной терапии с применением комбинированных препаратов позволяет достичь лучшего долгосрочного контроля гликемии и снизить риск развития и прогрессирования осложнений СД–2. Комбинация метформина с производными сульфонилмочевины, с одной стороны, повышает общую терапевтическую эффективность и значительно улучшает контроль гликемии, а с другой стороны, препараты в одной таблетке присутствуют в меньшей дозе, но с более высокой эффективностью.
В клинической практике эффективной терапевтической схемой является комбинация метформина и глибенкламида, поскольку значительно улучшается чувствительность к секретируемому инсулину, без риска прибавки массы тела.
ЛИТЕРАТУРА
1. California Healthcare Foundation/ American Geriatrics Society Panel on Improving Care for Elders with Diabetes. Guidelines for Improving the care of the older person with diabetes mellitus // J Am Geriatr Soc.–2003; 51:S265–280.
2. Castaneda C., Layne J.E., Munoz–Orians L. et al. A randomized controlled trial of resistance exercise training to improve glycemic control in older adults with type 2 diabetes. // Diabetes Care.–2002; 25(12):2335–2341.
3. Davidson M.B., Peters A.L. An overview of metformin in the treatment of type 2 diabetes mellitus // Am. J Med –1997; 102: 99–110.
4. DeFronzo R.A. Pharmacologic therapy for type 2 diabetes mellitus // Ann Intern. Med. –1999; 131: 281–303.
5. Droin P. Diamicron MR once daily is effective and well tolerated in type 2 diabetes: double–blind, randomized, multinational study. // J Diabetes Complications. – 2000; 14(4): 185–191.
6. Festa A., Williams K., Tracy R.S. Progression of Plasminogen Activator Inhibitor–1 and Fibrinogen Levels in Relation to Incident in type Diabetes // Circulation .–2006; 113(14):1753–9.
7. Holstein A., Plaschke F., Egberts E.H. Lower incidence of severe hypoglycaemia in patients with type 2 diabetes treated with glimepiride versus glibenclamid. // Diabetes Metab Res Rev.–2001; 17(6): 467–473.
8. Gregori F., Ambrosi F., Manfrini S. et al. Poorly controlled elderly Type 2 diabetic patients: the effects of increasing sulphonylurea dosages or adding metformin. // Diabet Med. –1999; 16(12): 1016–1024.
9. Kimmel B., Inzucchi E.M. Oral Agents for Type 2 Diabetes: An Update // Clin. Diabetes. – 2005; 23(2): 64 – 76.
10. Kirpichnikov D., McFarlane S.I., Sowers J.R, Metformin:An Update //Ann Intern Med 2002; 137: 25 –33
11. Klip A., Leiter L.A Cellular mechanism of action of metformin // Diabetes Care 1990; 13 (6):696–704
12. Kuusisto J., Mykkanen J., Pyorala K., Laakso M. Non– insulin dependent diabetes and its metabolic control are important predictors of stroke in elderly subjects. // Stroke. – 1994; 25(6): 1157–1164
13. Matthaei S., Hamann A., Klein H.H., Benecke H. et al. Association of Metformin‘s effect to increase insulin–stimulated glucose transport with potentiation of insulin–induced translocation of glucose transporters from intracellular pool to plasma membrane in rat adipocytes // Diabetes. –1999; 40(7): 850–857
14. McFarlane S.I., Banerij M., Sowers J.R. Insulin resistance and cardiovascular disease. // J Clin Endocrinol Metab. – 2001; 86: 713–8
15. Nathan D.M.,Meigs J, Singer D.E. The epidemiology of cardiovascular disease in type 2 diabetes mellitus: how sweet it is... or is it?// Lancet. – 1997; 350 (suppl 1): 4–9.
16. Naor M., Steingruber H.J., Westhoff K. et al. Congitive function in elderly non– insulin–dependent diabetic patients before and after inpatient treatment for metabolic control. // J Diabetes Complications. – 1997; 11(1): 40–46.
17. Patane G., Piro S., Rabuazzo A.M. , Anello M. et al. Metformin restores insulin secretion altered by chronic exposure to free fatty acids or high glucose: a direct metformin effect on pancreatic beta–cells // Diabetes. –2001; 49(5): 735–740
18. Olson D.E., Norris. Diabetes in older adults. Overview of AGS guidelines for the treatment of diabetes mellitus in geriatric population/ //Geriatrics.– 2004; 59(4): 18–24.
19. Rosenstock J. Management of type 2 diabetes mellitus in the elderly: special considerations. // Drugs Aging. – 2001; 18(1): 31–44.
20. Ruigomez A., Rodrigues L.A. Presence of diabetes related complication at the time of NIDDM diagnosis: an important prognostic factor // Eur. J. Epidemiol. . – 1998; 14(15): 439 –445.
21. Ramachandran A, Snehalatha C. Epidemiology of heart disease in type 2 diabetes // Medicographia, 2007; vol.29 No.3,207–212.
22. Ubink–Veltman L.J., Bilo H.J., Groenier K.H. et al. Prevalens, incidence and mortality of type 2 diabetes mellitus revisited: a prospective populacion–based study in the Netterlands (ZODIAC–1).// Eur JEpidemiol.–2003;18(8):793–800.
23. Wolffenbuttel B.H., Sels J.P., Rondas–Colbers G.J. et al. Comparison of different insulin regimens in elderly patients with NIDDM. // Diabetes Care.–1996; 19(12):1326–1332
24. Edelman S.V, Henry R.R. Diagnosis and management of type II diabetes,1998, PCI, chapter 7: Oral agens.
25. Charles M, Clark J. Oral therapy in type 2 diabetes: Pharmacological properties and clinical use of currently available agents. Diabetes spectrum, 1998, 211–221.
26. Trischitta V, Italia S, Raimondo M, Guardabasso V. et al. Efficacy of combined treatments in NIDDM patients with secondary failure to sulphonylureas. Is it predictable? J Endocrinol Invest, 1998, 21(11), 744–747.
| Август 2011 г. |