Опубликовано в журнале:
Русский Медицинский Журнал, Том 19, No 2, 2011Метформин: в традициях Парацельса
Профессор А.А. Александров
Эндокринологический научный центр Минздравсоцразвития России, Москва«Экономика, основанная на посредничестве, порождает культуру, предпочитающую
перепродавать созданные другими образы, вместо того, чтобы создавать новые».
Виктор Пелевин, «Священная книга оборотня»
В 2007 году медицинская общественность отмечала знаменательную дату - 50-летие начала клинического применения метформина в лечении больных сахарным диабетом 2 типа. В рамках Конгресса Европейской ассоциации по изучению диабета (EASD), прошедшего в Амстердаме (Нидерланды), состоялась юбилейная конференция, посвященная научно-практическому опыту использования метформина, который был накоплен за прошедшие полвека.
Однако, строго говоря, лекарственные растения, содержащие близкие естественные аналоги метформина, постоянно упоминаются уже в средневековых медицинских травниках [1].
В Европе средневековые врачи пытались облегчить симптомы болезни, связанной с обильными и частыми мочеиспусканиями, препаратами, приготовленными из корней растения Galega officinalis. Приоритет в рекомендациях подобного использования G. officinalis принадлежит английскому врачу (Nicholas Culpeper), который впервые в XVII веке написал об этом в своем медицинском труде [2].
G. officinalis (Leguminosae) - это многолетнее растение с белыми, голубыми или пурпурными цветами, высотой более 90 см, произрастающее в большинстве стран с умеренным климатом.
Это растение использовалось тогда под многими названиями, такими как goat's rue (козлиная рута), French Liliac (французская сирень), Italian Fitch (итальянский хорек), ложное индиго и другие. Оно находило широкое применение для стимуляции потогонного эффекта при эпидемиях чумы, отравлениях, различного рода заражениях, укусах змей, пляске Св. Вита, а также выращивалось для домашнего скота с целью увеличения надоев молока [3].
В конце XIX века было установлено, что Galega officinalis содержит большое количество гуанидина, однако только в 1918 году было обнаружено, что это вещество обладает у животных довольно слабым сахароснижающим эффектом.
Для клинического использования гуанидин оказался слишком токсичным, и в 1920-х годах врачи только короткое время в клинических условиях использовали в качестве антидиабетического препарата менее токсичный экстракт из корня Galega officinalis (изоамилен-дигуанидин), получивший название галегин (рис. 1). Тогда же были синтезированы два новых дигуанида: декаметилен дигуанидин (Синталин А) и додекаметиленидигуанин (Синталин В), которые были менее токсичны, более сахароснижающе эффективны и использовались в клинике до конца 1920-х годов [4,5].
Рис. 1. Химическая структура производных гуанидина
Гуанидин Галегин (изоамилин гуанидин) Синталин А (декаметилен дигуанидин) Бигуанид (гуанил–гаунидин) Фенформин (фенитил–бигуанид) Буформин (бутилбигуанид) Метформин (диметилбигуанид) Появление инсулина резко уменьшило популярность токсичных и малоэффективных дигуанидов, что обусловило их исчезновение из клиники к началу 1930-х годов.
Параллельно в 1929 году в Германии было синтезировано несколько сахароснижающих бигуанидов, включая диметилбигуанид (известный нам теперь под названием метформин). В то время опыта применения этих препаратов у людей еще не было. В 1940-х годах производные гуанидина использовались как противолихорадочные препараты, в частности, диметилбигуанид (метформин) под названием флюмамина применялся на Филипинах, как средство против гриппа [6].
В качестве сахароснижающего препарата у больных сахарным диабетом 2 типа бигуаниды были внедрены в клиническую практику французским врачом Jean Sterne (1909-1997), который специализировался по диабетологии в одном из госпиталей Парижа. В 1956 году в соавторстве с Denise Duval он апробировал антидиабетические свойства нескольких бигуанидов, открытых в работах германских коллег 1929 года. Sterne выбрал диметилбигуанид (метформин) для клинического использования и присвоил ему имя «Глюкофаж» - «пожиратель сахара». Свои результаты он опубликовал в 1957 году [7]. Также в 1957 году Ungar опубликовал исследования по фенформину и в 1958 году Mehner доложил о буформине.
В 1960-70-е годы в США были проведены многочисленные исследования фенформина, антигипергликемический эффект которого по сравнению с буформином и метформином оказался наибольшим.
Довольно скоро после внедрения бигуанидов в практику была установлена связь между применением препаратов этой группы, особенно фенформина, и развитием лактатацидоза. Лактатацидоз, или молочно-кислый ацидоз - это тяжелая форма декомпенсации обмена веществ с высокой частотой летальных исходов. Это послужило причиной того, что с конца 70-х гг. в США наложили запрет на ввоз фенформина, а затем и в большинстве других стран фенформин был изъят из обращения. Вскоре такая же участь постигла и буформин.
Применение метформина значительно реже сопровождалось развитием лактатацидоза, и метформин продолжал оставаться на фармацевтическом рынке. Однако большинство диабетологов охладели к нему, поскольку важные различия между фенформином и метформином тогда еще не были известны. При этом многие понимали, что плейотропные эффекты бигуанидов сложны и складываются из многих компонентов.
С конца 1980-х гг. интерес к метформину возрос. Применение метформина стимулировалось растущим интересом к синдрому инсулинорезистентности, как к одному из основных компонентов патогенеза развития СД 2 типа. В то время именно метформин олицетворял собой препарат, наиболее эффективно воздействующий на инсулинорезистентность. В середине 1990-х годов, особенно после опубликования результатов UKPDS, возникает настоящий бум этого препарата.
Набор пациентов в UKPDS начался в 1977 году и продолжался до 1991 года. В Великобритании 23 исследовательских центра набрали в общей сложности 5102 пациента (возраст: 25-65 лет) с только что выявленным сахарным диабетом 2 типа (глюкоза натощак > 6 ммоль/л), из которых 4209 были рандомизированы для лечения после 3-месячной терапии диетой (UK Prospective Diabetes Study Group, 1998). Метформин (Глюкофаж®) был препаратом выбора для пациентов с избыточным весом, набранных в первых 15 UKPDS центрах. Схема исследования и включенные параметры лечения представлены на рисунке 2.
Рис. 2. Алгоритм исследования UKPDS

В течение последующего периода (в среднем 10,7 лет) пациенты с избыточным весом, которым назначалось интенсивное лечение метформином, имели значительно более низкий уровень HbA1C по сравнению с остальными пациентами, получавшими стандартное лечение (7,4% против 8,0% соответственно; р=0,001), а также:
- на 32% ниже риск развития любых связанных с диабетом исходов (р=0,002);
- на 36% ниже риск смертности по любой причине (р=0,021);
- на 42% ниже смертность, связанная с диабетом (р=0,017);
- на 39% ниже риск развития инфаркта миокарда (р=0,01);
- на 41% ниже риск развития инсульта (р=0,032);
- на 30% ниже риск развития всех макроангиопатий (инфаркт миокарда, внезапная смерть, стенокардия, инсульт и периферические сосудистые заболевания) (р=0,02);• на 29% ниже риск развития микроангиопатий, подобных осложнений у пациентов, интенсивно леченных инсулином или производными сульфонилмочевины, но не столь значительных.
Кроме того, в группе метформина по сравнению с группой, получавшей интенсивную терапию инсулином или производными сульфонилмочевины, отмечалось:
- более выраженное снижение риска развития любых связанных с диабетом исходов (р=0,003);
- более выраженное снижение смертности от любых причин (р=0,021).
В целом основные клинические результаты можно сформулировать следующим образом: метформин является единственным препаратом, обеспечивающим значительное снижение риска развития макроангиопатий у пациентов сахарным диабетом 2 типа при использовании в качестве монотерапии; риск развития микроангиопатий снижается одинаково у пациентов сахарным диабетом 2 типа, леченных метформином, производными сульфонилмочевины или инсулином [8].
В настоящее время метформин - единственный бигуанид, рекомендованный к применению Европейской Группой по разработке тактики ведения СД 2 типа (European NIDDM Policy Group,1993 год). Международная федерация диабета (IDF) в своем настольном руководстве по сахарному диабету в 1999 году называет метформин первым в списке рекомендованных к применению пероральных сахароснижающих препаратов.
2009 год - это год триумфа. Авторитетнейшая группа международных экспертов по лечению сахарного диабета публикует современный алгоритм применения сахароснижающих препаратов у больных СД 2 типа (рис. 3).
Рис. 3. Коррекция гипергликемии у больных СД 2 типа: согласованный алгоритм; Diabetes Care, 2009 год, Nathan D.M. et al. [9]
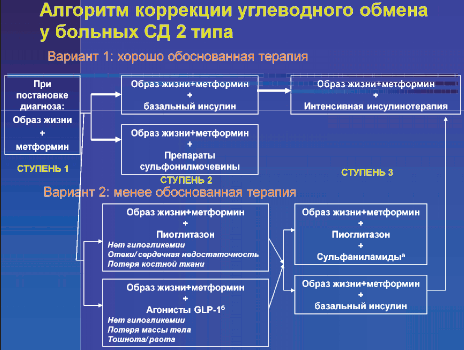
Метформин - это α и ω этих рекомендаций. Свершилось! СД 2 типа и метформин - это неразрывное целое. Это почти синонимы. Больные сахарным диабетом 2 типа наибольшую пользу от лечения получают с помощью метформина или при наличии его в других схемах лечения. Метформин же, в свою очередь, идеален для предотвращения прогрессирования сахарного диабета 2 типа и развития его сосудистых осложнений. При этом практически безопасен.
Таким образом, к концу 1990-х годов позиция метформина в лечении сахарного диабета 2 типа стабилизируется. В первую очередь она связана с его уникальным влиянием на макрососудистые осложнения СД 2 типа. При этом данное влияние часто связывают с его способностью при применении в монотерапии достигать поставленных целевых уровней глюкозы и гликированного гемоглобина у большого числа больных. Процент таких больных еще более увеличивается при использовании комбинаций метформина с другими сахароснижающими препаратами.
Однако кардиопротективный эффект при использовании метформина достигается не только у больных с нарушениями углеводного обмена. И в подобных ситуациях часто упоминаются другие, не связанные с антигипергликемическими способностями, свойства метформина. Наиболее часто их объединяют под названием плейотропных эффектов.
Встает вопрос: «Так ли уж важны его сахароснижающие свойства в реализации кардиозащитного эффекта препарата? Действительно ли именно эти сахароснижающие свойства определяют его защитный эффект в отношении сердечно-сосудистой системы, в уменьшении осложнений и общей смертности? Ведь препараты сульфонилмочевины и, тем более инсулин, не менее эффективно снижают уровень глюкозы в крови, а подобных макрососудистых эффектов при этом не отмечается».
Метформин - прекрасный антигипергликемический препарат. Это истина, зафиксированная в огромном количестве официальных международных документов и в головах абсолютного большинства практикующих врачей.
Антигипергликемический - это значит ликвидирующий подъемы глюкозы в крови и уменьшающий последствия длительно существующей гипергликемии как на метаболическом, так и на органном уровне. Однако метформин не влияет на концентрацию глюкозы в крови здорового человека. Более того, при остром (внутривенном) введении метформин не снижает уровень гликемии и у больных СД 2 типа. Клиническое действие метформина осуществляется только в присутствии определенной концентрации инсулина в плазме, причем этот инсулин может быть как эндогенным (собственная секреция), так и экзогенным (инсулинотерапия). В условиях абсолютной инсулиновой недостаточности антгипергликемический эффект метформина отсутствует.
Добавление метформина повышает связываемость инсулина с инсулиновыми рецепторами тканей, изменяя их конфигурацию, а также стимулирует рецепторные и пострецепторные пути передачи инсулинового сигнала внутри клетки. Метформин усиливает тирозинкиназную активность, восстанавливая фосфорилирование внутриклеточной β-субъединицы инсулинового рецептора, вследствие чего восстанавливается скорость синтеза фосфотидилинозитол-3 киназы, ответственной за транслокацию собственных транспортеров глюкозы на плазматическую мембрану. Последние, захватывая глюкозу, вводят ее внутрь клетки, где она подвергается дальнейшим превращениям. Этот механизм обеспечивает процесс поступления глюкозы в клетку и в значительной степени зависит от аффинитета связи «инсулин-рецептор». Данное взаимодействие усиливается за счет увеличения на рецепторе количества мест связывания с низким аффинитетом, является обратимым, не требует синтеза нового рецептора и прямо зависит от концентрации инсулина в крови [10-12].
В исследовании in vitro метформин оказывает дозозависимый эффект, увеличивая в среднем на 43% инсулиностимулированный транспорт глюкозы в адипоциты, мышечные клетки. При этом происходит увеличение мобилизации GLUT-4 из интрацеллюлярных депо на плазматические мембраны. В результате действие инсулина усиливается и поступление глюкозы в печеночные, мышечные и жировые клетки резко повышается. Этот процесс является важнейшим звеном в антигипергликемическом действии метформина. Данное обстоятельство свидетельствует о том, что главную роль в снижении глюкозы в крови под действием метформина играет восстановление нарушенных у больных СД 2 типа пострецепторных механизмов действия инсулина.
Очевидное улучшение усвоения глюкозы периферическими тканями на фоне метформина не сопровождается усилением окисления глюкозы. Метформин приводит к увеличению неокислительного метаболизма глюкозы. Последний заключается в образовании гликогена, превращении глюкозы в лактат и включении глюкозы в триглицериды [13-15]. Применение метформина способствует значительному снижению гликемии натощак. Данный эффект обусловлен повышением чувствительности печеночных клеток к инсулину под воздействием метформина, угнетением в печени процессов глюконеогенеза и гликогенолиза, а также увеличинием синтеза гликогена. При концентрациях инсулина, которые не оказывают никакого тормозящего эффекта на глюконеогенез, метформин примерно на 30% снижает продукцию глюкозы из аланина, пирувата, лактата, глютамина и глицерола. Это происходит прежде всего вследствие торможения поступления перечисленных субстратов глюконеогенеза в гепатоциты. Механизм подавления глюконеогенеза заключается, по-видимому, в том, что метформин блокирует дыхательную цепь переноса электронов в митохондриях и соответственно АТФ-синтез, что приводит к уменьшению отношения АТФ/АДФ и блокируются основные ферменты глюконеогенеза - пируваткарбоксилаза, фруктозо-1,6-бифосфатаза и глюкозо-6-фосфатаза.
Антигипергликемический эффект метформина во многом связан с особенностями его накопления и действия в кишечнике, которое существенно отличается от таковых в печени, мышечной и жировой ткани.
Вообще действие метформина в кишечнике - одно из самых загадочных его свойств. Во-первых, активность метформина в кишечнике не зависит от концентрации инсулина в крови. При этом ткань кишечника аккумулирует как при парентеральном, так и при энтеральной введении препарата намного более высокие концентрации метформина, чем печень, почки или слюнные железы. В двух последних органах обнаруживается концентрация примерно в два раза выше, чем в плазме, а в тканях кишки - почти в тысячу раз.
В кишечнике метформин способствует замедлению всасывания глюкозы (примерно на 12%) и повышает скорость ее метаболизма в кишечнике. Таким образом , действие метформина в кишечнике вносит существенный вклад в предотвращении постпрандиального подъема гликемии. В то же время оказалось, что метформин значительно повышает утилизацию глюкозы кишечником. Так, при воздействии метформина утилизация глюкозы в кишечнике повышается на 69%, что в 1,7 раза превышает активность данного процесса в мышцах в состоянии покоя. Наибольшую активность метформин проявляет в слизистой оболочке тонкого кишечника. В тканях кишечника глюкоза очень быстро подвергается аназробному гликолизу, приводя к увеличению выработки в первую очередь лактата. Однако образующийся лактат не оказывает системного воздействия, а экстрагируется печенью, где сразу же включается в глюконеогенез. Таким образом, это второй механизм предотвращения опасной постпрандиальной гликемии при сохранении возможности предотвращения истощения углеводных ресурсов печени и, следовательно, риска развития стрессовых гипогликемических состояний.
Увеличение поглощения глюкозы печеночной и мышечной тканями сопровождается накоплением в них гликогена и, по некоторым данным, изменением количества и размеров митохондрий. При этом в работе митохондрий отсутствуют выраженные признаки нарушения окислительного фосфорилирования, что свидетельствует о существовании относительного баланса между поступлением и использованием кислорода. Интересно, что подобного рода метаболические проявления повышенного использования глюкозы и накопления гликогена характерны для кардиомиоцитов, сохраняющих жизнеспособность за счет указанных специфических метаболических изменений пережить длительно существующую ишемию миокарда. Подобное состояние кардиомиоцита носит название «гибернации» [16].
В «гибернированном» миокарде отмечена массивная активизация генных программ, не свойственных клетке в обычных условиях. Это гены и белки , вовлеченные в антиапоптоз (IAP), клеточный рост (VEGF; H11 киназа), циторотекцию (HS70; HIF-1 альфа), воспалительные процессы (TNFa; iNOS) [17].
Оказалось, что миокардиальный фенотип «гибернированного» миокарда встречается не только при ишемической природе кардиальной патологии [18]. По мнению ряда исследователей фенотип «гибернированного» кардиомиоцита - это не частное проявление ИБС, а унифицированный вариант экстремальной адаптации кардиального фенотипа к стрессу различного происхождения. Правомерно предположить, что лекарственное средство (метформин), способствующее развитию особого типа обмена глюкозы в миокарде, способно стимулировать и возникновение фенотипа «выживания» кардиомиоцита. Как следствие - более выраженное снижение общей смертности и частоты развития инфаркта миокарда по сравнению с другими сахароснижающими средствами.
Обращаясь к другим, так называемым плейотропным эффектам метформина, хочется обратить внимание на его способность блокировать липолиз в жировой ткани, снижая при этом количество циркулирующих в крови свободных жирных кислот и триглицеридов. С точки зрения риска развития сердечно-сосудистых осложнений, особенно нарушений ритма и инфаркта миокарда, это, разумеется, благоприятно. Аналогично действуют β-адреноблокаторы, польза которых при ишемической болезни сердца не вызывает каких-либо сомнений. Вообще с метаболической точки зрения блокада гипергликемии, липолиза и снижение уровня циркулирующих свободных жирных кислот - это характерные проявления симпатолитического эффекта. Так что в этом смысле метформин - это функциональный симпатолитик. Особенно если учесть, что при его применении отмечается снижение артериального давления и даже отмечено снижение норадреналина в плазме крови [19].
Кроме того, метформин снижает уровень главного циркулирующего ингибитора активатора тканевого плазминогена и урокиназы (ИАП-1), под воздействием которых плазминоген переходит в плазмин и растворяет фиксированный фибрин. Таким образом, фибринолитическая активность крови в зоне тромбоза повышается. Под воздействием метформина снижение уровня ИАП-1 происходит независимо от дозы последнего как у больных СД 2 типа, так и у лиц без нарушения углеводного обмена, но с явлениями инсулинорезистентности. Это еще один «симпатолитический» эффект метформина.
Тем не менее было бы неоправданным упрощением представлять метформин только в качестве «метаболического симпатолитика». Сейчас мы уже хорошо знаем, что по глубине и многогранности воздействия на организм человека аналог метформину найти не очень просто.
Около 10 лет назад появились работы по использованию метформина при синдроме поликистозных яичников. Применение метформина усиливает овуляторный процесс в яичниках, нормализует менструальный цикл и реально снижает уровень сывороточных андрогенов. Исследователями было доказано прямое, инсулин-независимое влияние метформина на стероидогенез в яичниках, подавление базального и FSH-стимулируемой продукции прогестерона и эстрадиола [20].
Совсем недавно появились работы о способностях метформина снижать уровень тиреотропного гормона у больных с гипотиреозом, не влияя при этом на уровень свободного Т4 в крови [21]. Учитывая, что до 11% больных СД 2 типа страдают субклиническим гипотиреозом данное свойство метформина может быть существенным фактором, определяющим их сердечно-сосудистый статус.Объяснение многогранных способностей метформина было предложено в 2001 году группой исследователей (Zhou с соавторами), доказавших, что основная мишень метформина - АМФ-активируемая протеинкиназа (AMPK) [22]. AMPK является одним из важнейших членов большой серин/треонин киназной семьи, называемой AMPK/SNF1 семейство [23]. Семейство широко распространено в животном и растительном мире и представляет собой гетеротримерный энзим, состоящий из каталитической α-субъединицы и регуляторных β- и γ-субъединиц. AMPK находится во всех тканях млекопитающих, представляя различную смесь изоформ в самых разных тканях со специфическими функциями. В ряде случаев активация AMPK может приводить к нежелательным результатам, например, угнетению секреции инсулина, снижению кардиальной деятельности в период постишемической реперфузиии, преждевременному возбуждению желудочков сердца, нарушению клеточной дифференциации. Тем не менее центральная роль AMPK в регуляции углеводного и липидного обменов убедительно доказана [22].
Не вызывает сомнений, что метформин - это лекарство с огромными потенциальными возможностями. Пожалуй, это больше, чем лекарство для первых шагов в лечении сахарного диабета 2 типа. Мы о нем еще не все знаем. Но его свойства должны быть нами хорошо изучены. У него большое будущее.
Существует несколько парадоксов, связанных с метформином. В наш век открытие и разработка лекарственных средств основаны на применении высоких технологий. В то же время данное лекарство первой линии в лечении сахарного диабета 2 типа мало чем отличается от растительного средневекового снадобья. Несмотря на свою химическую простоту и детальное изучение, уровень знаний о метформине далек от совершенства. В то время как постоянно подчеркивается фармакологическая безопасность метформина, его естественный прародитель G. оfficinalis (известный в США под названием «Профессор Сорняк») относится к Классу А федеральных ядовитых сорняков в 35 штатах США и входит в список ядовитых растений [24].
В заключение хочется привести два высказывания. Швейцарский врач Теофраст Бомбаст фон Хохенхейн (1493-1541) более известный, как Парацельс: «Только правильная дозировка отделяет ядовитое вещество от полезного лекарственного средства». И высказывание современных специалистов по эндокринологии и обмену веществ: «В начале XXI века цветы Французской сирени, возможно, еще приведут к пышному расцвету новых направлений в лечении сахарного диабета» [25].
Литература
1. Mori A, Cohen BD, Lowenthal A. Guanidines – historical, biological, biochemical and clinical aspects of the naturally occurring guanidine compounds. London: Plenum Press,1985.
2. Culpeper N. The English Physitian or an astrologophysical discourse on the vulgar herbs of this nation. London: Peter Cole, 1652.
3. Bailey CJ, Day C. Metformin: its botanical background. Pract Diab Int, 2004, Vol.21, No.3, 115–117.
4. Beckman R. Biguanide (Expermen teller Teil). In Handbook of experimental pharmacology 29. Maske H (ed). Berlin: Springer Verlag, 1971;439–596.
5. Frank E, Nothmann M, Wanger A. Uber synthetisch dargestellte Korper mit insulinartiger Wirkung auf den normaken und den diabetischen Organismus. Kli Wschr 1926; 5:2100–2107.
6. Garcia E. 1949 Flumamine. Untraced publication from the Philippines. Cited by Sterne J in an interview (April 4,1996) for Merck–Lipha published in Glucophage, serving diabetology for 40 years. Pasik C (ed). Lyon: Groupe Lipha,1997; 21, 29.
7. Sterne J. Du nouveau dans les antidiabetiques. La NN dimethylamine guanyl guanidine. (N.N.D.G.). Maroc Med 1957; 36:1295–1296.
8. United Kingdom prospective diabetes study (UKPDS) 13: relative efficacy of randomly allocated diet, sulphonylurea, insulin, or metformin in patients with newly diagnosed non–insulin dependent diabetes followed for three years BMJ 1995;310:83–88.
9. Nathan D M., Buse JB, Davidson MB, Ferrannini E et al. Medical Management of Hyperglycemia in Type 2 Diabetes: A Consensus Algorithm for the Initiation and Adjustment of Therapy A consensus statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2009, Vol.32 (1),193–203.
10. Galuska D., Nolte L. A., Zierath J. R., Wallberg–Henriksson H. Effect of metformin on insulin–stimulated glucose transport in isolated skeletal muscle obtained from patients with NIDDM. Diabetologia. 37(8):826–832.
11. Y Fischer, J Thomas, P Rosen, and H Kammermeier. Action of metformin on glucose transport and glucose transporter GLUT1 and GLUT4 in heart muscle cells from healthy and diabetic rats. Endocrinology 1995 136: 412–420.
12. Nagi DK, Yudkin JS. Effects of metformin on insulin resistance, risk factors for cardiovascular disease, and plasminogen activator inhibitor in NIDDM subjects. A study of two ethnic groups. Diabetes Care April 1993 16:621–629.
13. Widen EI, Eriksson JG, Groop LC. Metformin normalizes nonoxidative glucose metabolism in insulin–resistant normoglycemic first–degree relatives of patients with NIDDM. Diabetes March 1992 41:354–358.
14. Riccio A, Del Prato S, Vigili de Kreutzenberg S, et al. Glucose and lipid metabolism in non–insulin–dependent diabetes. Effect of metformin. Diabete Metab 1991 May; 17 Suppl.1: 180–184.
15. Johnson AB, Webster JM, Sum CF, et al. The impact of metformin therapy on hepatic glucose production and skeletal muscle glycogen synthase activity in overweight type–II diabetic patients. Metabolism 1993; 42:1217–1222.
16. Borgers M, thone F, Wouters L, Ausma J et al. Structural correlates of reginal myocardial dysfunction in patients with critical coronary artery stenosis: chronic hibernation? Cardiovasc. Pathol. 2: 237–245, 1993.
17. Borgers M, Ausma J. Structural aspects of the chronic hibernating myocardium in man. Basic Res Card 90: 44–46.
18. Sack MM, Kelly DP. The energy substrate switch during development of heart failure: gene regulatory mechanisms. Int J Mol Med. 1998:1:17–24.
19. Muntzel MS, Hamidou I, Barrett S. Metformin Attenuates Salt–Induced Hypertension in Spontaneously Hypertensive Rats. Hypertension 1999;33:1135–1140.
20. Diamanti–Kandarakis E, Christakou CD, Kandaraki1 E, Economou FN. Metformin: an old medication of new fashion: evolving new molecular mechanisms and clinical implications in polycystic ovary syndrome European Journal of Endocrinology 2010;162:193–212.
21. Cappelli C, Rotondi M, Pirola I, Agosni B, Gandossi E, Valentini U, De Martino E, Cimino A, Chiovato L, Agabiti–Rosei E, Castellano M. TSH–Lowering Effect of Metformin in Type 2 Diabetic Patients. Differences between euthyroid, untreated hypothyroid, and euthyroid on L–T4 therapy patients. Diabetes Care 32:1589–1590, 2009.
22. Zhou G, et al. Role of AMP–activated protein kinase in mechanism of metformin action. J.Clin Invest. 2001, 108:1167–1174.
23. Poisonous Plant Database. U.S. Department of Health and Human Services. Food & Drug Administration, Center for Food Safety & Applied Nutrition. Office of Plant and Dairy Foods and Beverages. http://vm.cfsan.fda.gov/- djw/plantnam.php.
24. Kemp BE, et al. Dealing with energy demand: the AMP–activated protein kinase. Trends Biochem. Sci. 1999,24:22–25.
25. Witters LA. The blooming of the French lilac. J.Clin Invest. 2001;108:1105–1107.
| Март 2012 г. |