Опубликовано в журнале:
CONSILIUM MEDICUM »» ТОМ 11 / № 12
Заместительная и супрессивная терапия левотироксином в практике эндокринолога
Е.А. Трошина, Н.В.Мазурина, Е.М.Скрынник
ФГУ Эндокринологический научный центр МЗСР РФ, МоскваПрепараты тиреоидных гормонов относятся к числу наиболее часто используемых в клинической практике лекарственных средств. Их назначают с целью проведения заместительной или супрессивной терапии при ряде заболеваний щитовидной железы (ЩЖ).
Целью заместительной терапии является поддержание нормального обмена веществ у больных гипотиреозом любой этиологии.
Манифестный гипотиреоз
Левотироксин назначают из расчета 1,6–1,8 мкг на 1 кг массы тела (ориентировочная начальная доза для женщин 75–100 мкг/сут; мужчин – 100–150 мкг/сут).
Целевое значение тиреотропного гормона (ТТГ) при проведении заместительной терапии левотироксином первичного гипотиреоза составляет 0,5–1,5 мМЕ/л.
При проведении заместительной терапии центрального (вторичного) гипотиреоза необходимо добиться поддержания тироксина крови на уровне, соответствующем верхней трети нормальных значений для этого показателя.
Субклинический гипотиреоз
Тироксин назначают из расчета 1 мкг на 1 кг массы тела (ориентировочная начальная доза 50–75 мкг/сут).
Целью супрессивной терапии также является достижение концентрации ТТГ менее нижней границы нормы для предотвращения его возможного стимулирующего влияния на рост ткани ЩЖ (в том числе на рост резидуальной опухолевой ткани).
Целевое значение ТТГ составляет менее 0,1 мМЕ/л. Для этого используются дозы левотироксина от 2,2 до 2,5 мкг на 1 кг массы тела в сутки.
Принципы заместительной терапии левотироксином
Изменения секреции тиреоидных гормонов и снижение функции ЩЖ (гипотиреоз) могут происходить в результате поломки биосинтеза тиреоидных гормонов на разных его этапах: поступления йодида из крови, окисления его в элементарный йод, включения йода в состав тирозинов с образованием монойодтирозина и дийодтирозина, конденсации молекул йодтирозина с образованием Т4 и Т3. Независимо от того, на какой из стадий произошло нарушение метаболизма гормонов ЩЖ, будут изменяться те физиологические эффекты, за которые ответственны тиреоидные гормоны.
Основные физиологические эффекты тиреоидных гормонов:
• регуляция энергетического обмена
• регуляция роста и развития
• регуляция белкового, углеводного и жирового обмена
• влияние на сердечно-сосудистую систему
• влияние на костно-мышечную систему
• влияние на психикуЛечение всех форм гипотиреоза является заместительным и пожизненным. Исключение составляет только гипотиреоз, вызванный введением каких-либо медикаментов или веществ, блокирующих выработку тиреоидных гормонов.
Препараты левотироксина являются препаратами выбора для заместительной терапии гипотиреоза, и представляют собой синтетический тироксин (натриевая соль тироксина), который полностью идентичен тироксину, продуцируемому ЩЖ. Хорошо всасывается в желудочно-кишечного тракта (ЖКТ), причем при гипотиреозе его всасывание не нарушено.
Один из препаратов левотироксина – Эутирокс (фирма «Никомед»). Его отличием от других препаратов этой группы является возможность с легкостью подобрать нужную дозировку – 25, 50, 75, 100, 125 или 150 мкг, что существенно облегчает проведение как заместительной, так и супрессивной терапии.
На фоне заместительной терапии Эутироксом концентрация Т3 сохраняется постоянной. Режим дозирования препарата устанавливают индивидуально, с учетом тех возможных ситуаций, когда потребность в тироксине может изменяться (табл. 1).
Таблица 1. Ситуации, при которых может измениться потребность организма в тироксине
Повышение потребности в тироксине • Снижение абсорбции в кишечнике (заболевания слизистой оболочки тонкой кишки и после операций на тонкой кишке) • Поносы при диабете • Цирроз печени • Беременность • Прием препаратов, снижающих абсорбцию Холестирамин
Сукралфат
Окись алюминия
Сульфат железа• Препараты, увеличивающие выведение неметаболизированного Т4 Рифампицин
Карбамазепин
Возможно, фенитоин• Препараты, блокирующие конверсию Т4 в Т3 Амиодарон
Дефицит селенаСнижение потребности в тироксине • Пожилой возраст • Ожирение Поскольку основной задачей лечения гипотиреоза является восстановление нормальных физиологических функций всех органов и систем, нарушенных вследствие гипотиреоза, то и при первичном, и при вторичном (третичном) гипотиреозе основа лечения – адекватная заместительная терапия препаратами тиреоидных гормонов. Критерием адекватности лечения служит исчезновение клинических и лабораторных проявлений гипотиреоза.
Компенсация манифестного гипотиреоза – 1,6–1,8 мкг левотироксина в сутки. Средняя суточная доза 75–150 мкг
Компенсация субклинического гипотиреоза – 1 мкг левотироксина на 1 кг массы тела. Средняя суточная доза 50–75 мкг
Терапию начинают с небольшой дозы Эутирокса, причем у пожилых она может составлять 12,5 мкг/сут. Препарат принимают утром, натощак. Дозу постепенно увеличивают до поддерживающей (у молодых больных за 4 нед, у пожилых за 2 мес, а иногда, при наличии сопутствующей кардиальной патологии, за 3–4 мес).
Оценивать уровень ТТГ на фоне лечения следует не раньше чем через 2 мес от начала терапии. Далее исследовать этот показатель нужно с интервалом 1 раз в 6 мес и корректировать дозу Эутирокса в зависимости от полученных результатов.
При лечении вторичного гипотиреоза схема назначения препарата аналогичная, однако контролировать, по понятным причинам, следует не ТТГ, а свободный Т4. В табл.2 представлен начальный этап лечения гипотиреоза.
Таблица 2. Начальный этап заместительной терапии у больных гипотиреозом
Больные без кардиальной патологии моложе 65 лет Левотироксин назначают из расчета 1,6–1,8 мкг на 1 кг массы тела Ориентировочная начальная доза: • женщины – 50–75 мкг/сут • мужчины – 75–100 мкг/сут Больные с кардиальной патологией и/или старше 65 лет
Начальная доза 12,5 мкг левотироксина в день (увеличивать по 12,5 мкг с интервалом 2 мес до нормализации уровня ТТГ, при появлении или ухудшении кардиальных симптомов провести коррекцию терапии).Тяжесть и длительность гипотиреоза являются основными критериями, определяющими тактику врача в момент начала лечения.
Чем тяжелее гипотиреоз и чем дольше он был некомпенсирован, тем выше будет общая восприимчивость организма к тиреоидным гормонам, особенно это относится к кардиомиоцитам. Поэтому процесс адаптации к препарату должен быть постепенным и плавным независимо от возраста пациента.
При назначении тироксина пациенту с гипотиреозом нужно выяснить, какие еще медикаменты он получает, поскольку многие препараты могут увеличивать потребность в тироксине. Если не учитывать этот эффект, компенсация гипотиреоза может быть затруднена.
Субклинический гипотиреоз характеризуется отсутствием четких клинических проявлений заболевания. Жалобы пациента, как правило, неспецифичны и часто сводятся к повышенной слабости и утомляемости. Лабораторные параметры включают в себя незначительное повышение ТТГ при нормальных уровнях Т3 и Т4. Нередко субклинический гипотиреоз является случайной находкой при общем обследовании больного. Данный синдром чаще обнаруживается у пожилых пациентов.
Для верификации диагноза нужно провести больному повторное определение уровня ТТГ через 6 мес. В том случае, если у пациента регистрируется стойкое повышение уровня ТТГ, вопрос о лечении следует решать в индивидуальном порядке. Однозначного мнения по поводу целесообразности специфической терапии субклинического гипотиреоза в настоящее время нет. Но если такая терапия проводится, то она должна сопровождаться адекватным и своевременным наблюдением за пациентом, включающим в себя определение уровня ТТГ. Как правило, заместительную терапию при субклиническом гипотиреозе начинают тогда, когда уровень ТТГ составляет 10 мЕ/л и выше, и Эутирокс назначают в дозе 1 мкг на 1 кг массы тела (суточная доза составляет 50–75 мкг).
Рис. 1. Распространенность ДЗ в различных возрастных группах. 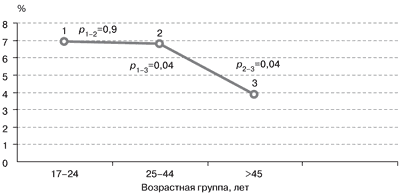
Гипотиреоз и беременность
При некомпенсированном гипотиреозе наступление беременности крайне маловероятно. Если беременность все же наступила, то лечение гипотиреоза должно быть начато немедленно. Во время беременности потребность в левотироксине в среднем возрастает на 45% от расчетной исходной дозы. Если беременность наступила у женщины с компенсированным гипотиреозом, то доза препарата должна быть увеличена в соответствии с возросшей потребностью в нем.
Принципы супрессивной терапии левотироксином
Высокодифференцированный рак ЩЖ (ВДРЩЖ)На протяжении многих лет основным способом терапии для больных, получивших радикальное лечение по поводу ВДРЩЖ, остается введение тиреоидных гормонов в дозах, превышающих физиологические (2,5 мкг на 1 кг массы тела в сутки), с целью снижения концентрации сывороточного ТТГ. Клетки рака ЩЖ, происходящие из фолликулярного эпителия, имеют рецепторы ТТГ, и в ответ на их стимуляцию происходит повышение активности аденилатциклазы. Предполагается, что эти опухоли ЩЖ могут расти под воздействием ТТГ. Многие исследователи отмечали уменьшение частоты рецидивов опухолевого роста благодаря подавлению секреции ТТГ под воздействием супрессивной терапии как при папиллярной, так и при фолликулярной тиреоидной карциноме.
Сегодня рекомендуется использовать методы анализа ТТГ III поколения, которые позволяют выявлять его присутствие в сыворотке в концентрациях порядка 0,01 мЕд/л.
До сих пор активно обсуждается вопрос о том, что более опасно для пациента: предотвращение рецидива рака при условии поддержания субклинического тиреотоксикоза или неблагоприятное влияние медикаментозного тиреотоксикоза на сердце и кости. Побочные эффекты супрессивных доз левотироксина включают нарушения контрактильности миокарда, увеличение частоты сердечных сокращений и предсердные аритмии, а также могут вызывать ускорение круговорота элементов костной ткани, остеопороз. По этой причине многие специалисты считают, что полное подавление секреции гипофизарного ТТГ на протяжении длительного периода (до 0,01–0,1 мЕд/л или ниже) целесообразно лишь у больных, входящих в группу высокого риска – в первую очередь при повышенной вероятности рецидивов или смерти у пациентов с ВДРЩЖ. В то же время большинство клиницистов полагают, что у подавляющего числа больных с папиллярной тиреоидной карциномой, относимых к группе низкого риска на основании результатов прогностической балльной оценки, хороший эффект дает относительно слабое подавление секреции ТТГ. У таких больных концентрацию сывороточного ТТГ следует поддерживать на уровне 0,1–0,4 мЕд/л. В целом при лечении ВДРЩЖ, по имеющимся на сегодняшний день данным контролируемых исследований, назначение высоких доз левотироксина с целью подавления уровня ТТГ имеет преимущества по сравнению с обычной заместительной терапией, при которой поддерживается эутиреоз, т.е. нормальный уровень ТТГ. Исключение могут составлять пожилые больные или больные с тяжелым заболеванием сердца и выраженным остеопорозом.
- У пациентов низкого риска без признаков заболевания через год терапии доза Эутирокса может быть снижена для поддержания уровня ТТГ в сыворотке крови на уровне нижней границы диапазона нормальных значений (0,5–1,0 мЕд/л).
Узловой коллоидный зоб
В настоящее время в соответствии с Консенсусом РАЭ решение вопроса о целесообразности супрессивной терапии левотироксином при узловом коллоидном зобе определяется в индивидуальном порядке. Лечение препаратами тироксина наиболее эффективно при солитарных коллоидных узлах паренхиматозного типа строения, сочетающихся с увеличением ЩЖ и/или наличием в ткани железы зобных изменений, определяемых при ультразвуковом исследовании(УЗИ).
Левотироксин в лечении диффузного нетоксического зоба
Диффузный нетоксический зоб
Диффузный нетоксический зоб – общее диффузное увеличение щитовидной железы без нарушения ее функции. Основной причиной диффузного зоба является недостаточное содержание йода в окружающей среде и как следствие сниженное его потребление населением с привычными продуктами питания. В зависимости от распространенности диффузного зоба (ДЗ) в популяции различают спорадический и эндемический зоб. Зоб считается эндемическим, если в обследуемом регионе частота встречаемости зоба у детей младшего и среднего школьного возраста составляет более 5%. Хотя в подавляющем большинстве случаев причиной ДЗ является недостаточное поступление в организм человека йода, ряд закономерностей позволяет предположить о влияние генетических факторов на его формирование. Обращает на себя внимание тот факт, что в одном и том же регионе при одном и том же йодном обеспечении зоб определяется не у всего населения, а лишь у части. Важность генетических факторов подтверждена многими популяционными, семейными и близнецовыми исследованиями. Кроме того, при ДЗ выявлены некоторые мутации в таких генах, как ТРО, NIS, TG, TSHR.
Известно, что распространенность любых форм зоба в популяции существенно различается в зависимости от возраста. Считается, что ДЗ как первая стадия йододефицитного заболевания чаще встречается у молодых людей. Этот факт нашел свое подтверждение и на территории Москвы – зоны легкого йодного дефицита, при сравнении частоты встречаемости ДЗ в различных возрастных группах взрослого населения (рис. 1).
ДЗ достоверно чаще встречался у лиц моложе 45 лет.
Хотя пациенты с ДЗ, как правило, не предъявляют жалоб, функция ЩЖ у них не нарушена, они все же нуждаются в лечении данного заболевания, поскольку оно является первой фазой(обратимой при правильном лечении) формирования узлового и многоузлового йододефицитного зоба, в том числе и с развитием синдрома тиреотоксикоза на поздних стадиях процесса.
На сегодняшний день существует три варианта консервативной терапии ДЗ:
Монотерапия левотироксином была научно обоснована в лечении ДЗ при описании регуляции ЩЖ гипоталамо-гипофизарной системой. Предполагалось, что в условиях дефицита йода снижается синтез и секреция тироксина и трийодтиронина, для которых йод является основным структурным компонентом, что по принципу отрицательной обратной связи ведет к усилению секреции ТТГ. Поэтому основной целью терапии левотироксином было подавление ТТГ, способствующего увеличению объема ЩЖ (супрессивная терапия). Однако неоднократно было показано, что уменьшение объема ЩЖ не зависит от степени супрессии тиреотропина. Существуют исследования, доказывающие, что средний уровень ТТГ в йододефицитных районах достоверно ниже, чем в тех районах, где потребление йода нормальное. Более того, есть данные экспериментальных работ, демонстрирующих, что простимулировать рост фолликулов, содержащих достаточное количество йода, не удается введением ТТГ.
- Монотерапия левотироксином (Эутирокс).
- Монотерапия препаратами йода (Йодбаланс).
- Комбинированная терапия препаратами йода и левотироксина.
Как было сказано, назначение левотироксина широко применялось для лечения эутиреоидного ДЗ в прошлом. При этом на начальном этапе достигались отличные результаты. Во многих клинических исследованиях было показано, что уже через 3–4 мес от начала терапии происходило значительное (не менее 20%) уменьшение объема железы. Чаще же всего в клинической практике использовались дозы 150 мкг у взрослых и 100 мкг у подростков. Однако в многочисленных работах однозначно продемонстрирован «феномен отмены» – увеличение размеров ЩЖ почти до исходного уровня через короткое время после прекращения лечения. Данный феномен объясняется прежде всего тем, что при подавлении ТТГ снижается активность Na-I симпортера, а следовательно, уменьшается активный захват йода ЩЖ. На фоне резкого падения интратиреоидного содержания йода при отмене лекарственного препарата происходит новый рост железы. Также к нежелательным побочным явлениям терапии гормонами ЩЖ относят возможное возникновение лекарственного тиреотоксикоза, тахиаритмии, остеопороза, что ограничивает использование этой группы препаратов при длительном лечении ДЗ. Однако иногда для быстрого достижения терапевтического эффекта прибегают к кратковременному курсу лечения ДЗ Эутироксом с дальнейшим переходом на поддерживающую терапию Йодбалансом.
Рис. 2. Динамика объема ЩЖ в группе «Монотерапия препаратом йода» исходно, на 8 и 12-м месяце.
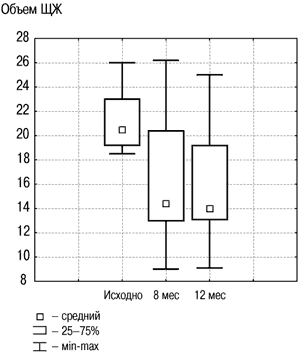
Рис. 3. Динамика объема ЩЖ в группе «Комбинированная терапия» исходно, на 8 и 12 месяце.
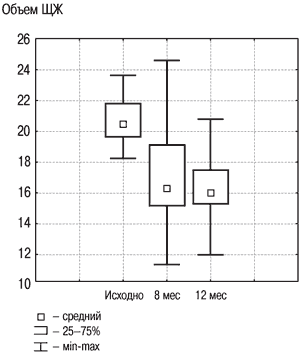
Таблица 3. Сравнение основных показателей между группами «Монотерапия» и «Комбинированная терапия» через 12 мес
* – антитела к тиреоидной пероксидазе
Показатель Монотерапия Комбинированная терапия р (критерий) Объем ЩЖ 16,1 (13,1; 19,2) 16,1 (15,2; 17,5) 0,83 (Рм-у=0,21) ТТГ 0,9 (0,8; 1,1) 1,2 (1; 1,48) 0,07 (Рм-у=0,92) АТ к ТПО*, % 3 0 1 Монотерапия препаратом йода и комбинированная терапия
Наиболее предпочтителен метод лечения ДЗ, являющийся этиологическим. Препараты йода назначают в физиологических дозировках (200 мкг в сутки) на 6 мес с последующей оценкой динамики объема ЩЖ.
При отсутствии выраженного эффекта от приема йодидов через 6 мес может быть рекомендован переход на комбинированную терапию. При этом предпочтение должно отдаваться либо фиксированной комбинации 75 мкг левотироксина +150 мкг йодида, либо индивидуально подобранной дозе Эутирокса из расчета 1 мкг на 1 кг массы тела в сочетании с 150 мкг йодида в сутки.
В настоящее время клиницисты имеют возможность использовать в этих целях комбинированные препараты, в состав которых входит как левотироксин, так и йод. Так, препарат Йодтирокс («Никомед») оптимально сочетает левотироксина натрий – 100 мкг и калия йодид – 100 мкг. Суточную дозу Йодтирокса принимают 1 раз в день утром, натощак, за 30 мин до завтрака, запивая таблетку небольшим количеством жидкости и не разжевывая.
Комбинированная терапия препаратами йода и тироксина, как было неоднократно показано, имеет ряд преимуществ. Во-первых, воздействуя на несколько патогенетических механизмов образования зоба, подавляется и гипертрофия, и гиперплазия тиреоцитов. Это позволяет добиться результатов, по эффективности сопоставимых с монотерапией тироксином (при гораздо меньшем его содержании), что в свою очередь уменьшает количество побочных эффектов, связанных с приемом тиреоидных препаратов. Во-вторых, снижается также склонность к «эффекту отмены» при кратковременном перерыве в лечении. В-третьих, менее выражено подавление уровня ТТГ, например по сравнению с эффектом тироксина в дозе 150 мкг.
Результаты исследования динамики объема ЩЖ у лиц с ДЗ на фоне разных схем терапии, проведенного в ФГУ ЭНЦ, представлены на рис. 2, 3. В целом по группе объем ЩЖ уменьшился на 20% к моменту завершения лечения, что явилось статистически значимым (р1–2<0,001), и продолжал удерживаться примерно на том же уровне спустя еще как минимум 4 мес после его прекращения (р2–3=0,31). Случаев изменения функции ЩЖ (развития гипер- и гипотиреоза) отмечено не было, колебания уровня ТТГ не выходили за пределы нормальных значений.
В данной группе объем ЩЖ в среднем снизился на 20,6% через 8 мес лечения, что было значимо относительно начала лечения (р1–2<0,001), и оставался на том же уровне через 4 мес спустя после его отмены (р2–3<0,77). Субклинический тиреотоксикоз был выявлен у 1 пациента на 8-м месяце наблюдения (ТТГ–0,01 мЕд/л, свободный Т4–19 пмоль/л). В целом по группе уровень ТТГ не выходил за пределы нормальных значений на протяжении всего периода наблюдения.
При использовании анализа повторных изменений было показано, что как в группе «Монотерапия», так и в группе «Комбинированная терапия» объем ЩЖ уменьшился до нормы на фоне 8-месячного лечения и оставался примерно на том же уровне спустя 4 мес после лечения. Для оценки преимущества одного метода лечения перед другим изучаемые параметры обеих групп были сравнены между собой (см. табл. 2).
При сравнении показателей между группами на 8 и 12-м месяцах наблюдения статистически значимой разницы между уменьшением объема ЩЖ, уровнем ТТГ, АТ к ТПО не обнаружено. Таким образом, и монотерапия препаратами калия йодида, и комбинированная терапия препаратами калия йодида и левотироксина в равной степени эффективны и безопасны для лечения эутиреоидного ДЗ. Также было показано, что результат лечения ДЗ с использованием монотерапии препаратами йода может зависеть от генетических факторов: носители генотипов АА и АС полиморфного маркера rs 3783949 гена TSHR чаще имели удовлетворительный результат лечения, носители генотипа СС – неудовлетворительный результат. Результат лечения ДЗ при помощи комбинированной терапии не зависел от распределения полиморфных маркеров генов TSHR (rs 3783949, замена – A/С), NIS (rs 7250346, замена – C/G), DUOX1(rs2467825, замена – A/G) DUOX2 (rs7171366, замена – G/T), TPO (rs 17091737, замена – G/T).
Заключение
Решение о начале заместительной или супрессивной терапии препаратами левотироксина (Эутирокс) или комбинированной терапии (Йодтирокс) должно быть обосновано данными клинического и лабораторного обследования пациента. Несмотря на наличие вполне определенных алгоритмов назначения препарата и режима его дозирования, всегда следует учитывать индивидуальные особенности пациента в каждом конкретном случае во избежание возможных побочных эффектов от назначаемого лечения.
Литература
- Charib H, Mazzferri EL. Thyroxine suppressive therapy in patients with nodular thyroid disease. Am Internat Metabol 1998; 128: 386–94.
- Cooper DS, Specker B, Ho M et al. Thyrotropin suppression and disease progression in patients with differentiated thyroid cancer: results from the National Thyroid Cancer Treatment Cooperative Registry. Thyroid 1998; 8: 737–44.
- Cobin RH. Thyroid hormone excess and bone a clinical review. Endocrin Practical 1995; 1: 404–9 .
- Hay ID, McConahey WM, Goellner JR. Managing patients with papillary thyroid carcinoma: insights gained from the Mayo Clinic's through 2000. Trans American Clinical Clim Assoc 2000; 113: 241–60.
- Hundahl SA, Cady B, Cunningham MP et al. Initial results from a prospective cohort study of 5583 cases of thyroid carcinoma treated in the United States during 1996. J Cancer 2000; 89: 202–17.
- Kaplan MM. (Ed). Thyroid carcinoma. Endocrinology and Mrtatabolis. Clin North Am 1990; 19: 469–766
- Mazzaferri EL, Jhiang SM. Long term impact of intial surgical and medical therapy on papillary and follicular thyroid cancer. Am J Med 1994; 49: 418–28.
- Mazzaferri EL, Jhiang SM. Long-term impact of initial surgical and medical therapy on papillary and follicular thyroid cancer. Am J Med 1994; 97: 418–28.
- Esnajla NF, Cantor SB, Sherman SI et al. Optimal treatment strategy in patientswith papillary thyroid cancer: A decision analysis. J Surg 2001; 130: 921–30.
- Wilders-Truschnig MM, Warnkross H, Leb G. The effect of treatment with levothyroxine or iodine on thyroid size and thyroid growth stimulating immunoglobulins in endemic goiter patients. Clin Endocrinol (Oxf.) 1993; 39 (3): 281–6 .
- Kreissl M, Tiemann M, Hanscheid H. Comparison of the effectiveness of two different dosages of levothyroxine-iodide combinations for the therapy of euthyroid diffuse goiter. Dtsch Med Wochenschr 2001; 126 (9): 227–31.
- Галкина Н.В., Мазурина Н.В., Трошина Е.А. Гены-кандидаты тиреоидной патологии. Клин. и эксперим. тиреодол. 2006; 1: 10–4 .
- Трошина Е.А., Н.В.Галкина, Мазурина Н.В., Мартиросян И.Т. Структурные изменения щитовидной железы: результаты скринингового ультразвукового обследования населения Москвы. Пробл. эндокринол. 2005; 51 (5): 36–9 .
- Трошина Е.А., Мазурина Н.В., Галкина Н.В. Диффузный эутиреоидный зоб: эпидемиология, диагностика, лечение: болезни щитовидной железы. Cons Med 2005; 7 (9): 769–73.
| Май 2011 г. |