Последующая информация предназначена только для медицинских работников!
Выбрав ссылку "Продолжить", Вы подтверждаете, что являетесь специалистом в области здравоохранения.
Опубликовано в журнале:
«Врач», 2006, №2, с. 57-62Рациональная терапия хронического гепатита С. Альтернативные возможности
В. В. Стельмах, В. Г. Радченко, В. К. Козлов
Гепато-билиарный центр Северо-Западного федерального округа, Санкт-Петербургская государственная медицинская академия им. И. И. Мечникова, кафедра внутренних болезней МПФ с курсом терапии и нефрологии ФПК, Медицинская академия последипломного образования, Санкт-Петербург, РоссияАктуальные проблемы противовирусной терапии хронического гепатита С
Заболевания печени остаются серьезной социально-экономической и клинико-эпидемиологической проблемой здравоохранения всех стран мира. С парентеральными вирусными гепатитами связаны практически все летальные исходы у больных острыми вирусными гепатитами, а также все случаи развития у них хронических заболеваний печени, включая циррозы и первичный рак печени.
По данным ВОЗ, в мире насчитывается более 170 млн больных хроническим гепатитом С (ХГС). В Европе наиболее высокая заболеваемость хроническими гепатитами встречается в Молдове, Венгрии, Италии, Германии и Франции, где уровни смертности от данных заболеваний колеблются от 32,7 (Франция) до 127,4 (Молдова) на 100 тысяч населения [6].
По прогнозам специалистов, через 10-20 лет заболеваемость HCV-инфекцией в мире окажется еще более серьезной медицинской и экономической проблемой. Наряду с увеличением количества больных на цирротической стадии, мы окажемся свидетелями увеличения смертности от осложнений портальной гипертензии, возрастет доля гепатоцеллюлярного рака, увеличится необходимость в трансплантации печени.
Возросшая значимость ХГС в масштабах России обусловлена высоким уровнем заболеваемости, ростом числа вирусоносителей, изменением структуры путей передачи возбудителей (заражение при введении наркотиков и активная реализация полового пути), а также возрастной структуры заболеваемости с преобладанием лиц молодого возраста [11].
Актуальность необходимости противовирусной терапии на различных стадиях HCV-инфекции несомненна: при остром гепатите С предотвращается хронизация процесса, при хроническом гепатите С — формирование цирротической стадии, при циррозе печени — его декомпенсация, развитие гепатоцеллюлярной карциномы (ГЦК).
В создавшейся сегодня ситуации неуклонного роста заболеваемости гепатитом С, отсутствия специфических средств профилактики, вопросы повышения эффективности интерферонотерапии (ИФН-терапии) остаются открытыми.
К сожалению, основной, но не всегда достижимой целью противовирусной терапии является эрадикация HCV, поэтому важно предотвратить прогрессирование заболевания печени (стабилизировать или улучшить гистологическую картину и функции печени) для профилактики осложнений портальной гипертензии и предотвращения развития ГЦК. По данным Н. Yoshida (1999), среди нелеченных пациентов с ХГС ежегодная частота развития ГЦК увеличивается пропорционально степени фиброза в печени: от 0,5% среди пациентов со стадией F0-F1 к 7,9% среди пациентов со стадией F4. Современная ИФН-терапия значительно уменьшает риск развития гепатоцеллюлярной карциномы, особенно среди пациентов, достигающих вирусологической или биохимической ремиссии [29].
Результаты лечения гепатита С со времени открытия вируса гепатита С быстро улучшались: проведение с 1998 г. комбинированной терапии препаратами рекомбинантного ИФН-а и рибавирином увеличило частоту достижения стойкого вирусологического ответа (СВО) с 12 до 44%; создание пегилированных форм ИФН-а и их применение с 2001 г. позволило повысить этот показатель до 82% [13, 20, 26].
Несмотря на создание высокотехнологичных препаратов, интерферонотерапия сопряжена с развитием побочных эффектов в 72% случаев [15]. Помимо наиболее часто встречающегося гриппоподобного синдрома, другие серьезные побочные эффекты интерферонотерапии (гастроинтестинальные и психиатрические симптомы, миелосупрессия, нарушения функции щитовидной и паращитовидной желез) наблюдаются у 10-42% больных ХГС [14]. Кроме того, экзогенно вводимый интерферон у 42% пациентов вызывает продукцию аутоантител, что, по мнению ряда авторов, сказывается на эффективности проводимой терапии [23].
На основании 10-летнего опыта лечения и серьезного изучения факторов, влияющих на успех противовирусной терапии ХГС, разработан ряд положений, касающихся отбора пациентов. Наибольшие трудности возникают в лечении больных с рецидивом после предыдущего курса ПВТ или отсутствием ответа на него, особенно если ранее использовалась комбинация ПЭГ-ИФН и рибавирина. Повторное лечение больных, не достигнувших стойкого вирусологического ответа на противовирусную терапию, является актуальным, поскольку доказано дальнейшее прогрессирование фиброза печени в этой категории больных. Трудность лечения данной категории больных заключается в еще более низком результате лечения (около 10%), при сочетании 1-го генотипа HCV и цирроза печени.
Одна из актуальнейших проблем гепатологии — лечение вирусного цирроза печени, финальной стадии заболевания, когда еще совсем недавно терапевтические воздействия ограничивались симптоматическими методами лечения. В настоящее время целью противовирусной терапии данной категории больных является не достижение авиремии, а уменьшение скорости прогрессирования, а в ряде случаев и улучшения гистологических изменений ткани печени, что позволяет рассчитывать на снижение риска развития осложнений портальной гипертензии и ГЦК. На современном этапе проводится научная доказательная база обоснованности низкодозовой поддерживающей противовирусной терапии препаратами рекомбинантных ИФН-а у больных циррозом печени в исходе ХГС с сохраняющейся на фоне лечения виремией [17].
Около 50% пациентов, инфицированных вирусом гепатита С, не отвечают на интерферонотерапию. Традиционен поиск предикторов эффективности этиотропной терапии хронического гепатита С среди вирусологических критериев. Попытки определения иммунологических критериев эффективности терапии на уровне макроорганизма фрагментарны, но в то же время многими исследователями признается важная роль иммунной системы в процессах хронизации заболевания и элиминации вируса.
Несмотря на успехи, достигнутые в последние годы в области лечения больных с ХГС, более глубокое понимание механизмов патогенеза заболевания и регуляции иммунного ответа способствует развитию новых подходов в диагностике и оптимизации этиопатогенетической терапии ХГС. Обнадеживающей перспективой лечения данной категории больных является комбинация различных методов ингибиции вирусной репликации и индукции адекватного иммунного ответа.
Система интерферона при хроническом гепатите С. Индукторы интерфероногенеза в лечении хронического гепатита С
Исследование природы резистентности к ИФН 1-го типа при проведении ИФН-терапии (преобладание иммунного ответа Th-2 типа, генетически детерминированная устойчивость HCV к ИФН, наличие экстрапеченочной репликации HCV в периферических мононуклеарных клетках) привело к выводу, что вирус гепатита С высокоадаптирован к реакциям неспецифического иммунного ответа. Резистентность к ИФН-терапии развивается в результате сложных процессов становления персистенции вирусной инфекции, обеспечивающей функциональной активностью вирусных белков, изменяющих активность лимфокинов, при которых противовирусная защита клеток, и в первую очередь система ИФН, существенно подавлена.
«Система интерферона» по значимости среди системных компонентов иммунореактивности занимает одно из ведущих мест в иммунной системе. Ее формируют интерфероны различных типов, регуляторы продукции и действия интерферонов, клетки-продуценты интерферонов и клетки-мишени. Выделяют две основные функции системы интерферона: 1) неспецифическая защита всех типов клеток организма от проникновения и репродукции чужеродной генетической информации (вирусов и некоторых других внутриклеточных микроорганизмов; 2) участие в регуляции развития основных стадий специфического иммунного ответа.
Интерфероны относятся к цитокинам и представлены семейством белков, обладающих антивирусной, иммуномодулирующей и противоопухолевой активностью, что позволяет отнести их к полифункциональным биорегуляторам широкого спектра действия. К настоящему времени известно около 20 интерферонов, различающихся по структуре и биологическим свойствам и составляющих 3 типа (α, β, γ), объединенных в 2 вида: ИФН‑α/β и ИФН‑γ [15]. Среди клеток, ответственных за синтез ИФН‑α в организме, наряду с макрофагами фигурируют Т‑ и В-лимфоциты, NK-клетки. Близкие по строению и функциям ИФН‑α и ИФН‑β синтезируются практически всеми типами клеток и в большей степени отвечают за неспецифическую защиту организма. ИФН‑γ, продуцируемый только иммунными клетками, в первую очередь является регулятором развития иммунного ответа. Естественными интерфероногенами являются вирусы, компоненты и продукты бактерий, полинуклеотиды, опухолевые клетки и др. Установлена слабая роль вирусов как индукторов интерфероногенеза [2].
Многообразие описанных к настоящему времени эффектов интерферона указывает на широкие контрольно-регуляторные функции этой системы. Рецепторы для ИФН‑α/β экспрессированы на подавляющем большинстве клеток организма, включая и иммунокомпетентные клетки. Индуцированные ИФН‑α/β белки могут опосредовать различные эффекты: ингибицию репликации вирусов, супрессию клеточной пролиферации и экспрессии онкогенов, нарушение клеточной дифференцировки или иммунорегуляцию.
Блокирование интерферонами стадии инициации трансляции и разрушение и-РНК вируса обусловливают его универсальный механизм действия при инфекциях, вызванных вирусами с различным генетическим материалом. Синтез интерферонов в клетке сопровождается развитием в ней антивирусного состояния, проявляющегося в активации ферментных систем, из которых наиболее хорошо изучены ферменты: 2–5-олигоаденилат-синтетаза, eIF-2a-протеинкиназа, Мх-белки. Индуцированные ИФН‑α/β белки оказывают выраженное иммуномодулирующее действие на макрофаги, NK-клетки, Т‑ и В-лимфоциты, стволовые клетки костного мозга. ИФН‑α повышает экспрессию антигенов гистосовместимости — HLA I класса, FcγR, Т‑клеточных антигенов и рецепторов, а также других молекул [10].
Рекомбинантные ИФН, являясь аналогами естественных пептидных биорегуляторов, обладают спектром биологической активности, идентичным эндогенным молекулам. Основная цель их использования как лекарственных препаратов — восполнение недостатка естественных медиаторов и воспроизведение их биологических функций, в частности противовирусной активности.
При применении препаратов короткодействущих ИФН существуют периоды, когда их концентрация существенно снижается и процессы вирусной репликации преобладают над элиминацией, происходит неизбежное инфицирование новых гепатоцитов, в связи с чем оправдано сочетанное применение препаратов других фармакологических групп с целью повышения эффективности противовирусной терапии.
Использование индукторов интерфероногенеза для увеличения активного синтеза ИФН различными клетками in vivo может рассматриваться как альтернативный подход к оптимизации терапии больных ХГС. Разработанное в России целое поколение индукторов интерфероногенеза представлено разнообразными соединениями с различными механизмами действия и с одним конечным фармакологическим эффектом — активацией противовирусной защиты на клеточном и системном уровнях. Обеспечивая ту же целевую установку терапии, что и заместительная коррекция рекомбинантными интерферонами, — увеличение уровней ИФН в организме, индукторы интерфероногенеза как лекарственные средства обладают рядом существенных преимуществ.
Преимущества «эндогенной интерферонизации»:
- эндогенный ИФН, вырабатываемый в ответ на введение интерфероногенов, не обладает антигенностью;
- синтез эндогенного ИФН в организме сбалансирован и подвергается контрольно-регуляторным механизмам, обеспечивающим защиту организма от перенасыщения;
- отсутствие побочных эффектов, свойственных экзогенно вводимым препаратам рекомбинантных ИФН;
- однократное введение индукторов ИФН обеспечивает относительно длительную циркуляцию ИФН на терапевтическом уровне;
- различные индукторы ИФН индуцируют синтез ИФН в определенных популяциях клеток, что имеет преимущества перед поликлональной стимуляцией иммуноцитов рекомбинантными ИФН;
- индукторы ИФН при сочетанном применении с рекомбинантными ИФН вызывают синергидный эффект.
За рубежом в настоящее время наиболее изученным индуктором лимфокинов на основе имидазохинолинов является имиквимод, что, к сожалению, трудно сказать об отечественных препаратах [16, 21].
Среди индукторов интерфероногенеза клинически эффективными и нашедшими применение в отечественной медицинской практике оказались лишь немногие, одним из которых является циклоферон, вызывающий образование значительных количеств интерферонов в печени и селезенке, циклоферон, препарат акридинового ряда, разработан НТФФ «Полисан» (Санкт-Петербург), обладает мягким пролонгированным иммунокорригирующим эффектом. Циклоферон выпускается в ампулах по 2 мл 12,5% раствора для внутримышечного или внутривенного введения и в таблетках по 150 мг.
Изучение кинетики накопления интерферонов в ответ на индукцию показало, что циклоферон индуцирует синтез раннего ИФН в В-клетках и макрофагах. Максимум накопления интерферона в сыворотке крови отмечается уже через 2 часа после индукции, однако синтез его быстро прекращается, и к 24 часам он почти полностью исчезает из кровотока. Гипореактивная фаза в ответ на стимуляцию циклофероном длится 2 суток, в связи с чем прерывистая методика введения препарата предполагает индуктивный механизм воздействия, учитывающий биологический цикл ответа иммунокомпетентных клеток на индукцию в виде выработки эндогенного интерферона [7].
Спектр прямых иммунотропных эффектов циклоферона:
- Интерферон-индуцирующее действие:
- Стимуляция продукции эндогенного ИФН-а/b и ИФН-y лейкоцитами, макрофагами, эпителиальными клетками.
- Иммунокорригирующее действие:
- Увеличение функциональной активности мононуклеарных фагоцитов, нейтрофилов.
- Увеличение функциональной активности NK-клеток.
- Противовирусное действие:
- Блокирует инкорпорацию вирусной генетической информации в пресформированные капсиды.
Спектр опосредованных иммунотропных эффектов циклоферона:
- Коррекция субпопуляционного дисбаланса Th-1 и Th-2 клеток.
- Коррекция профиля цитокиновой регуляции.
- Увеличение функциональной активности специфических цито-токсических Т-лимфоцитов.
- Активация эффекторных функций моноцитов/макрофагов.
- Ингибирование продукции провоспалительных цитокинов (IL-8, TNF-α).
Индукторы интерфероногенеза обладают рядом существенных преимуществ перед препаратами ИФН. Однако при выраженной депрессии эндогенной системы интерферона применение индукторов интерфероногенеза далеко не всегда влечет за собой положительный клинический эффект [4].
Имеющийся отечественный опыт применения различных режимов комбинированных противовирусных схем с использованием препаратов рекомбинантных ИФН, индукторов ИФН позволяет рекомендовать нижеуказанные схемы последовательного и сочетанного применения данных препаратов [4].
Состояние системы интерферона при ХГС, и ее роль в предсказании результата интерферонотерапии
Универсальность интерферонов, делающая их важнейшими факторами неспецифической резистентности организма, послужила основанием для предложения интегрального понятия интерферонового статуса как метода оценки иммунореактивности при различных формах патологии. Способность лейкоцитов продуцировать ИФН-а при строго стандартизированных условиях вирусной индукции была разработана и названа В. Д. Соловьевым и Т. А. Бектемировым интерфероновой реакцией лейкоцитов [8].
С целью объективной оценки состояния эндогенной системы интерферона в клинической практике используют понятие «интерферонового статуса», который включает ряд показателей: 1) содержание различных типов ИФН в сыворотке крови (s-ИФН); 2) способность лейкоцитов крови к продукции различных типов ИФН (продукция ИФН-а/b, ИФН-y). Интерфероновый статус в норме характеризуется низкими концентрациями ИФН в сыворотке крови и выраженной способностью лейкоцитов к продукции ИФН в ответ на индукцию.
Параметры «интерферонового статуса»:
- Содержание различных типов ИФН в сыворотке крови (s-ИФН). У здоровых лиц содержание эндогенного циркулирующего s-IFN не превышает следовых количеств (3,1±1,6 МЕ/мл).
- Способность лейкоцитов крови к продукции различных типов ИФН (продукция ИФН-а/b, ИФН-y).
У здоровых лиц индуцированная продукция ИФН-а/b — 394,3 ± 36,6 МЕ/мл; ИФН-у — 206,3 ± 26,0 МЕ/мл.
В случаях хронических инфекций различной природы характерно развитие интерфероне- и иммунодефицитов, при этом значительное угнетение показателей интерферонового статуса является неблагоприятным прогнозом.
Вышесказанное определило целесообразность проведения комплекса исследований функционального состояния системы эндогенного интерферона у больных с хроническим вирусным гепатитом С для возможности дифференцированной коррекции выявленной дисфункции препаратами рекомбинантного интерферона, индукторами интерфероногенеза с целью повышения эффективности этиопатогенетической терапии данной категории больных.
Нами установлены закономерности интерфероногенеза у больных ХГС в зависимости от стадии и длительности заболевания. При изучении показателей интерферонового статуса у исследуемых больных ХГС выявлена различная степень угнетения способности клеток-продуцентов к индуцированной продукции ИФН-а/b: отмечалось снижение продукции ИФН-а/b в 2-4 раза по сравнению со здоровыми лицами, ИФН-у — в 4-8 раз по сравнению с нормой при повышенных значениях сывороточного интерферона (р<0,05). При этом величина индуцированной продукции ИФН-а/b коррелировала с основными клинико-лабораторными показателями: установлена обратная корреляционная связь средней силы между уровнем индуцированной продукции ИФН-а/b и основными параметрами цитолитического, холестатического и мезенхимально-воспалительного синдромов. Угнетение способности клеток-продуцентов к индуцированной продукции ИФН-а/b и ИФН-у было классифицировано по степеням выраженности эффекта и имело градации от I до III степени [31]. Показатели интерферонового статуса у больных ХГС в зависимости от степени угнетения индуцированной продукции ИФН-а/b мононуклеарами отражены на рис 1.
Рис. 1. Состояние системы интерферона у больных ХГС
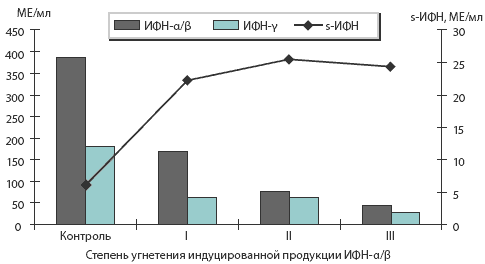
Рис. 2. Зависимость ответа на противовирусную терапию от степени угнетения индуцированной продукции ИФН-α/β
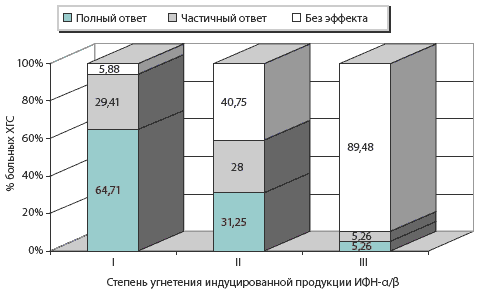
Как следствие персистирующей виремии, у больных ХГС наблюдается прогрессивное истощение функциональной активности клеток-продуцентов интерферонов с уменьшением их способности к индуцированной продукции данных цитокинов, что позволяет отнести метод исследования интерферонового статуса к диагностическим предикторам ответа на интерферонотерапию.
С увеличением выраженности иммунных дисфункций в системе интерферона ухудшается ответ пациентов на интерферонотерапию. Наибольшее количество пациентов (64,71%) с полным ответом на проводимую терапию оказалось среди больных, интерфероновый статус которых характеризовался I степенью угнетения индуцированной продукции ИФН-а/b, а наименьшее (5,26%) — при III степени угнетения (р<0,05).
При выборе адекватных схем комбинированной противовирусной терапии с использованием препаратов рекомбинантных интерферонов и индукторов интерфероногенеза следует учитывать состояние системы интерферона — этого важнейшего компонента противовирусной защиты, так как выбор стратегии терапии и ее эффективность будут определяться выраженностью дисфункций этого звена иммунореактивности у больных ХГС.
Назначение индукторов интерфероногенеза (препарат циклоферон) как средств монотерапии больным ХГС, интерфероновый статус которых характеризуется выраженной депрессией системы ИФН, нецелесообразно по причине невозможности достижения положительных клинических результатов. Это объясняется тем обстоятельством, что воздействие индуктора неспособно обеспечить продукцию достаточных количеств эндогенного ИФН у таких больных, поскольку система интерферона не в состоянии ответить на индуцирующее воздействие. Больным с ХГС, у которых установлен дефицит продукции интерферонов, перед назначением индукторов ИФН, в частности препарата циклоферон целесообразно проводить заместительную терапию препаратами рекомбинантного ИФН-а. Сравнительный анализ результатов использования разных схем противовирусной терапии у больных ХГС позволил установить, что с возрастанием степени угнетения параметров интерферонового статуса ухудшается ответ на интерферонотерапию [4].
Результаты открытого рандомизированного сравнительного исследования эффективности различных схем комбинированной терапии с использованием препаратов рекомбинантных интерферонов, индукторов интерфероногенеза при ХГС
Целью исследования явилась оценка влияния различных режимов комбинированной противовирусной терапии с использованием лекарственных форм рекомбинантных интерферонов-а и индукторов интерфероногенеза (циклоферон) на показатели печеночных функциональных тестов и содержание РНК вируса гепатита С в сыворотке крови больных с хроническим гепатитом С.
По данным проведенного за период с 1999 по 2005 г. в Гепатобилиарном центре СЗФО открытого рандомизированного сравнительного исследования эффективности двух режимов комбинированной противовирусной терапии больных с ХГС с использованием препаратов рекомбинантных интерферонов, индукторов интерфероногенеза, включено 128 пациентов с хроническим вирусным гепатитом С (75 мужчин и 53 женщины, средний возраст 42,8 ± 7,6 года).
Критерии включения пациентов в исследование:
- Лица мужского и женского пола в возрасте 18-60 лет.
- Наличие серологических признаков ХГС (по позитивному результату теста на антитела к HCV).
- Обнаружение HCV-RNA в сыворотке крови и/или в гепатобиоптате;
- Повышение активности АлАТ в сыворотке крови.
- Результаты биопсии печени, свидетельствующие о ХГС (фиброз 0-3).
- Отсутствие беременности по отрицательному результату теста на беременность при исследовании крови или мочи (для женщин, способных к деторождению), которое необходимо проводить не позднее, чем за 24 часа до получения пациентом первой дозы используемого лекарственного препарата.
Критерии исключения:
- Беременные или кормящие женщины.
- Диагностированная гепатоцеллюлярная карцинома.
- Указание в анамнезе или симптомы кровотечения из варикозно расширенных вен пищевода, или наличие других проявлений, свидетельствующих о декомпенсированной печеночной патологии.
- Уменьшение количества нейтрофилов до (и менее) 1500 клеток в 1 мкл или тромбоцитов до 90 000 клеток в 1 мкл при скрининге образцов крови.
- Увеличение содержания креатинина в сыворотке более чем в 1,5 раза (от верхнего значения нормы) при скрининге образцов крови.
- Наличие психогенной или иной депрессии, а также тяжелых психических заболеваний, включая ранее перенесенные (клинический прогноз и определение тяжести психического заболевания определяется по критерию приема пациентами антидепрессантов или больших транквилизаторов в терапевтических дозах на протяжении 3 месяцев).
- При больших депрессиях и психозах: наличие клинических проявлений и/или указание в анамнезе указаний на факты суицидальных попыток, госпитализаций по поводу психических заболеваний и/или периодов нетрудоспособности в связи с психическим заболеванием.
- Наличие в анамнезе указаний на тяжелые судорожные расстройства и/или применение в настоящее время противосудорожных препаратов.
- Наличие заболеваний, связанных с нарушениями со стороны иммунной системы.
- Наличие тяжелых болезней сердца и хронических заболеваний легких с функциональными нарушениями, наличие в анамнезе указаний на пересадку крупных органов и/или данных о других тяжелых заболеваниях и злокачественных новообразованиях.
- Наличие заболеваний щитовидной железы, не компенсируемых или с трудом компенсируемых медикаментозными средствами с повышением концентрации тиреотропного гормона (ТТГ), с увеличением титров антител к тиреоидной пероксидазе и/или с любыми клиническими проявлениями.
- Наличие тяжелой ретинопатии (например, цитомегаловирусного ретинита, дегенерации макулы).
- Наличие активной наркомании (в том числе алкогольной) и/или указаний в анамнезе на факты наркомании, продолжавшейся в течение года.
- Наличие некомплаентности.
- Наличие гиперчувствительности к препаратам ИФН-а и/или циклоферону (клинические формы: крапивница, ангионевротический отек, бронхиальная астма, анафилаксия).
Исследуемые больные методом случайной выборки были разделены на 2 группы к назначению различных режимов комбинированной противовирусной терапии с использованием препаратов рекомбинантных ИФН-а («Реаферон», «Реальдирон», «Интрон-А», «Роферон-А») и индуктора интерферонов — препарата циклоферон (НТФФ «Полисан», Санкт-Петербург). В соответствии с современными рекомендациями у больных с генотипом 1 HCV терапию продолжали 48 недель. Пациенты с другими генотипами получали 24-недельную терапию, за исключением больных с 3-й стадией фиброза в печени, которым проводился полный 48-недельный курс комбинированной терапии. Группы были сопоставимы по полу, исходному уровню АлАТ, ГГТП, вирусной нагрузке, данным гистологического исследования печени, показателям интерферонового статуса.
В 1-ю группу вошли 48 больных ХГС, средний возраст больных составил 38,4 ± 5,4 года. Пациентам 1-й группы наряду с парентеральным использованием витаминов группы В, гепатопротекторов в течение первых 2 недель назначался препарат рекомбинантного ИФН-а, вводимый подкожно в дозе 3 млн ME 3 раза в неделю, а на протяжении последующих 12 недель больные получали таблетированный циклоферон в дозе 600 мг, однократно, за 30 минут до еды по схеме: на 1, 2, 4, 6, 8, 11, 14, 17, 20, 23-и сутки, затем 1 раз в 5 дней. Суммарно проводилось 2-4 указанных курса комбинированной терапии. Количество курсов определялось генотипом HCV.
2-ю группу составили 50 больных ХГС, средний возраст составил 36,5 ± 7,6 года. Пациентам 2-й группы наряду с парентеральным назначением витаминов группы В, гепатопротекторов проводилась сочетанная комбинированная противовирусная терапия препаратом рекомбинантного ИФН-а, вводимым подкожно в дозе 3 млн ME 3 раза в неделю и таблетированным циклофероном в дозе 600 мг 2 раза в неделю на протяжении 6-12 мес. в зависимости от генотипа HCV.
3-ю группу (группу сравнения) составили 30 больных ХГС, средний возраст составил 37,4 ± 4,8 года. Больным 3-й группы наряду с парентеральным использованием витаминов группы В, гепатопротекторов назначалась монотерапия препаратом рекомбинантного ИФН-а, вводимым подкожно в дозе 3 млн ME 3 раза в неделю на протяжении 6-12 мес. Контрольную (4-ю группу) составили 30 практически здоровых лиц возрастом 28,0 ± 4,2 года.
Разовые и курсовые дозы препаратов, режимы дозирования и особенности схем назначения препаратов представлены в табл. 1.
Таблица 1. Исследуемые схемы комбинированной противовирусной терапии хронического гепатита С
Группа больных Препарат Суточная доза Кратность назначения Условное наименование I (n=48) Интерферон-а 3 млн ME, внутримышечно 3 раза в неделю Последовательное применение интерферона-а и циклоферона (интерферон-а, циклоферон) Циклоферон 600 мг/сут., внутрь на 1,2, 4, 6, 8, 11, 14, 17, 20, 23-и сутки, затем 1 раз в 5 дней(до 4 курсов) II (n=50) Интерферон-а 3 млн ME, внутримышечно 3 раза в неделю Сочетанное применение интерферона-а и циклоферона (интерферон-а + циклоферон) Циклоферон 600 мг/сут., внутрь 2 раза в неделю Группа
сравнения
(п=30)Интерферон-а 3 млн ME, внутримышечно 3 раза в неделю Монотерапия интерфероном-а Всем больным проводились общепринятые в гепатологических отделениях исследования: вирусологические (HCV-RNA методом ПЦР в сыворотке крови и в исследуемых гепатобиоптатах, серологические маркеры вирусов гепатита В, С методом ИФА); морфологические (ИГА по Knodell, стадии фиброзирования); основные клинико-лабораторные показатели; показатели клеточного иммунитета и уровень провоспалительных цитокинов сыворотки крови (IL-1β, TNF-α); показатели интерферонового статуса (сывороточный интерферон (s-ИФН), индуцированная продукция ИФН‑α/β, ИФН‑γ). Пункционная биопсия печени проводилась 79 (61,7%) пациентам до начала противовирусной терапии и спустя 6 мес. после окончания курса лечения чрескожным методом с помощью иглы Менгини (Menghini) с последующей морфологической оценкой и интрапеченочной ПЦР-диагностикой полученных гепатобиоптатов на содержание HCV-RNA и HBV-DNA.
Рис. 3. Генетическая принадлежность HCV-RNA исследуемых больных
Инструментальное исследование предусматривало ультразвуковое исследование печени, желчного пузыря и желчевыводящих путей, поджелудочной железы, селезенки; фиброгастродуоденоскопию с определением степени варикозного расширения вен пищевода; радиоизотопное исследование печени.
При формулировке диагноза использовалась классификация международного конгресса гастроэнтерологов (Лос-Анджелес, 1994 г.). Полный ответ на противовирусную терапию устанавливался при достижении биохимической и вирусологической ремиссии (нормализации АлАТ, негативации HCV-RNA, в сыворотке крови) к концу курса терапии и через 6 мес. после окончания лечения; частичный ответ — при достижении биохимической или вирусологической ремиссии к концу курса терапии; отсутствие эффекта на противовирусную терапию расценивалось при сохранявшейся повышенной активности АлАТ и репликации вируса гепатита С.
Выбор схем комбинированной противовирусной терапии
Сравнительный анализ применения разных схем противовирусной терапии показал, что с ростом степени угнетения параметров интерферонового статуса ухудшается ответ на интерферонотерапию. При ХГС наблюдается прогрессивное истощение функциональной активности клеток-продуцентов интерферонов, как следствие персистирующей виремии, что следует учитывать при выборе адекватных схем комбинированной противовирусной терапии с использованием препаратов рекомбинантных интерферонов, индукторов интерфероногенеза.
Результаты клинического исследования эффективности использования разных схем противовирусной терапии у больных ХГС позволяют констатировать преимущества схем комбинированной терапии в сравнении со схемами монотерапии препаратами рекомбинантного ИФН-а. Оба варианта схем комбинированного назначения: 1) последовательное применение заместительной терапии препаратом ИФН-а, a затем назначение больным циклоферона; 2) сочетанное (одновременное) назначение больным препарата ИФН-а совместно с циклофероном оказалось более эффективным, чем использование моноварианта заместительной терапии ИФН-а.
Эффективность комбинированных схем противовирусной терапии зависела от исходного состояния интерферонового статуса пациентов. Схемы комбинированного лечения препаратом ИФН-а и циклофероном у пациентов больных ХГС при слабом (I степень) или умеренном (II степень) угнетении способности клеток-продуцентов к индуцированной продукции ИФН-а/b позволяли повысить степень ответа на противовирусную терапию в сравнении со схемой монотерапии препаратом ИФН-а: при слабом снижении индуцированной продукции ИФН-а/b до 59,62%, а при умеренном — до 31,25% (рис. 4).
Рис. 4. Возрастание частоты полного ответа больных на проводимую терапию при комбинированном лечении препаратом рекомбинантного ИФН-а и циклофероном в сравнении со стандартным лечением (монотерапия ИФН-а) у больных ХГС (анализ результатов лечения всех больных, включенных в клиническое исследование)
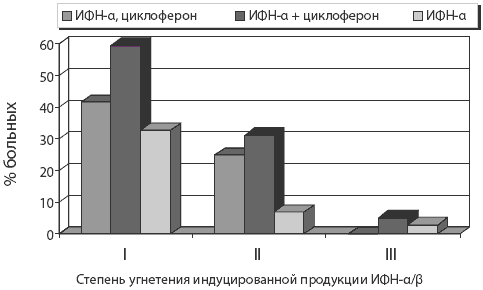
Очевидно, что в данной клинической ситуации использование схем комбинированной терапии препаратом ИФН-а в сочетании с индуктором интерфероногенеза циклофероном сопровождается эффектом синергизма лекарственных препаратов. У больных к концу курса терапии при достижении биохимической и вирусологической ремиссии наблюдали также повышение количества лейкоцитов (р<0,05), возрастание индуцированной продукции ИФН-а/b (р<0,05) и снижение уровней s-ИФН (р<0,05).
При умеренном снижении индуцированной продукции ИФН-а/b, сопровождающемся лейкопеническим и тромбоцитопеническим синдромами, наиболее щадящим методом лечения больных ХГС является схема комбинированной терапии, предусматривающая последовательное использование препарата ИФН-а и циклоферона.
В данном случае дефицит функциональной активности клеток-продуцентов интерферонов компенсируется заместительной терапией препаратом ИФН-а. Вводимый с целью заместительной терапии ИФН-а повышает потенциальную способность клеток-продуцентов к выработке эндогенных интерферонов, что потенцируется последующей стимуляцией интерфероногенеза с помощью индуктора.
У пациентов с ХГС, имеющих существенные нарушения интерферонового статуса с выраженным угнетением индуцированной продукции интерферонов, применение схем комбинированной противовирусной терапии препаратом ИФН-а и циклофероном не выявило никаких преимуществ в сравнении с монотерапией препаратом ИФН-а. Вероятно, в данной клинической ситуации воздействие индукторов интерфероногенеза на функционально истощенные клетки-продуценты не способно обеспечить продукцию достаточного количества ИФН, поскольку система не в состоянии адекватно ответить на индуцирующее воздействие. В подобных случаях дополнительное назначение больным индукторов интерфероногенеза не является оправданной мерой, и более целесообразно применение препаратов ИФН-а в режиме заместительной терапии или использование других адъювантов интерферонотерапии.
Таблица 2. Побочные эффекты терапии (частота прекращения лечения, необходимость снижения дозы, другие нежелательные проявления)
% больных, получивших терапию по схеме: последовательное применение препарата ИФН-а и циклоферона (ИФН-а, циклоферон) сочетанное применение препарата ИФН-а и циклоферона (ИФН-а+циклоферон) монотерапия препаратом ИФН-а Необходимость отмены лечения - 4 4 Необходимость снижения дозы - 7 12 Нежелательные проявления терапии: Анемия 2 5 9 Лейкопения 6 8 12 Снижение массы тела 6 16 22 Гриппоподобный синдром 32 67 78 Артралгии 5 11 10 Симптомы ЖКТ 3 6 8 Психиатрические симптомы 12 25 30 Кожные проявления 5 8 12 Нарушение функции щитовидной железы 4 4 6 Таблица 3. Выбор схемы этиопатогенетической комбинированной терапии
ПОКАЗАТЕЛИ ИНТЕРФЕРОНОВОГО СТАТУСА Рекомендуемая схема комбинированной терапии Степень угнетения продукции ИФН‑α/β Уровень интерферонов в сыворотке крови s-ИФН, МЕ/мл Индуцированная продукция ИФН‑α/β, МЕ/мл Индуцированная продукция ИФН‑γ, МЕ/мл I 20-23 165-190 50-70 «Схема 1» Последовательное применение препарата ИФН‑α и циклоферона (ИФН‑α, циклоферон) I-II 20-27 110-190 70-90 «Схема 2» Сочетанное применение препарата ИФН‑α и циклоферона (ИФН‑α + циклоферон) III 24-27 40-50 25-30 Монотерапия препаратом ИФН‑α Комбинированная сочетанная терапия ИФН-а и циклофероном (схема 2) пациентов с хроническим гепатитом С, не ответивших на начальный курс монотерапии ИФН-а, приводит к устойчивому ответу у 28% больных.
Таблица 4. Схемы комбинированной этиопатогенетической терапии
I. Последовательное применение препарата ИФН-α и циклоферона
Препарат ИФН-α — 3 млн МЕ на введение, подкожно, 3 раза в неделю, на протяжении 2 недель
Циклоферон — 600 мг/сутки, внутрь на 1, 2, 4, 6, 8, 11, 14, 17, 20, 23-и сутки, затем 1 раз в 5 дней на протяжении 12 недель (2–4 последовательных курса)II. Сочетанное применение препарата ИФН-α и циклоферона
Препарат ИФН-α — 3 млн МЕ на введение, п/к, 3 раза в неделю, на протяжении 6–12 месяцев
Циклоферон — 600 мг/сутки, внутрь 2 раза в неделю на протяжении 6–12 месяцевВ целом приведенные материалы обосновывают необходимость применения дифференцированного подхода к применению индукторов интерфероногенеза, в частности циклоферона, с целью повышения эффективности этиопатогенетической терапии хронического гепатита С. Применение комбинированных схем противовирусной терапии с использованием различных режимов назначения препаратов рекомбинантных интерферонов, индукторов интерфероногенеза с учетом функционального состояния эндогенной системы интерферона может существенно увеличить контингент больных HCV-инфекцией, получающих этиотропную терапию, и достичь предпочтительных результатов лечения.
Выводы
- При проведении противовирусной терапии при хроническом гепатите С необходим дифференцированный подход в использовании препаратов рекомбинантных интерферонов, индукторов интерферонов, основанный на предварительной оценке параметров функционального состояния эндогенной системы интерфероногенеза, а именно: степени угнетения индуцированной продукции ИФН-а/b.
- В сравнении со стандартной монотерапией препаратами рекомбинантного ИФН-а, применение комбинации индуктора интерфероногенеза препарата циклоферон с препаратами рекомбинантного ИФН-а позволяет увеличить частоту достижения вирусологического ответа на проводимую терапию. Комбинированная терапия безопасна и уменьшает частоту побочных эффектов интерфероновых препаратов.
- При слабом или умеренном снижении индуцированной продукции ИФН-а/b наиболее эффективной является комбинированная сочетанная терапия препаратами рекомбинантных ИФН-а и индукторами интерфероногенеза (циклоферон) (схема 2), позволяющая повысить степень ответа на противовирусную терапию при слабом снижении индуцированной продукции ИФН-а/b до 59,62%, а при умеренном снижении индуцированной продукции ИФН-а/b — до 31,25% по сравнению с монотерапией ИФН-а в стандартных дозах.
- Комбинированная сочетанная терапия ИФН-а и циклофероном (схема 2) пациентов с хроническим гепатитом С, не ответивших на начальный курс монотерапии ИФН-а, приводит к устойчивому ответу у 28% больных.
- При умеренном снижении индуцированной продукции ИФН-а/b, сопровождающимся лейкопеническим и тромбоцитопеническим синдромами у больных хроническим гепатитом С, наиболее щадящим методом лечения является последовательное применение ИФН-а и циклоферона (схема 1).
- При существенном угнетении показателей системы эндогенного интерферона, когда невозможен ответ на интерфероноиндукцию, показана заместительная терапия препаратами рекомбинантного ИФН-а.
- Глубокое угнетение системы эндогенного интерферона у больных хроническим вирусным гепатитом С следует рассматривать как неблагоприятный предиктор ответа на противовирусную терапию.
ЛИТЕРАТУРА
1. Авксеныпьева М. В., Воробьев П. А., Герасимов В. Б. и др. Экономическая оценка эффективности лекарственной терапии (фармакоэкономический анализ). М.: «Ньюдиамед», 2000. 80 с.
2. Ершов Ф. И., Киселев О. И. Интерфероны и их индукторы (от молекул до лекарств). М.: ГЭОТАР-Медиа. 2005. 356 с.
3. Определение интерферонового статуса как метод оценки иммунореактивности при различных формах патологии / О. И. Киселев, В. И. Мазуров, В. В. Малиновская и др. // Пособие для врачей. СПб, 2002. 25 с.
4. Радченко В. Г., Стельмах В. В., Козлов В. К. Оптимизация этиопатогенетической терапии хронического гепатита С. СПб.: Тактик-Студио. 2004. 166 с.
5. Радченко В. Г., Стельмах В. В. Способ лечения больных хроническим гепатитом С. Патент № 2212248 от 20.09.2003.
6. Радченко В. Г., Шабров А. В., Нечаев В. В. Хронические заболевания печени. СПб.: Лань. 2000. 190 с.
7. Романцов М. Г., Ершов Ф. И., Коваленко А. Л. и др. Иммунодефицитные состояния и коррекция циклофероном. СПб.: Аполлон.. 1998.. 80 с.
8. Соловьев В. Д., Бектимиров Т. А. Интерферон в теории и практике медицины. М.: Медицина, 1970. 271 с.
9. Сравнение затратной эффективности пэгинтерферона альфа-2а (40 кДа) (ПЕГАСИС) с рибавирином и интерферона альфа-2а с рибавирином при хроническом гепатите С. Sullivan S. D., Green J., Patel К. К., Graxi A., Alberti A., Giuliani G., Carli CDe.
10. Тотолян А. А. Фрейдлин И. С. Клетки иммунной системы. СПб.: Наука, 2000.231с.
11. Шахгилъдян Д. И. Эпидемиология парентеральных вирусных гепатитов в России / Д. И. Шахгильдян // Рос. журн. гастроэнтерол., гепатол., колопро-ктол. 2001. №4. С. 46-47.
12. Almasio P. L., Di Marco V., Вопига С. et al. Viral and host factors in determining response of relapsers with chronic hepatitis С to retreatment with interferon. Dig. Dis. Sci. 1999; May; 44 (5): 1013-9.
13. Arase Y., Ikeda K., Chayama K. et al. Clinical and virological features of chronic hepatitis С carriers with normal alanine aminotransferase levels despite positive serum HCV-RNA after interferon therapy. J. Gastroenterol. 1999. V. 34. N 5. P. 594-9.
14. Calvino J. Secondary hyperparathyroidism exacerbation: a rare side-effect of interferon-alpha? / J. Calvino, R. Romero, J. M. Suarez-Penaranda, V. Arcocha et al.//Clin. Nephrol. 1999. V. 51. N 4. P. 248-51.
15. Diago J. I., del Olmo D., Alcazar V., et al. [Thyroid disorders associated with interferon treatment in patients with chronic viral hepatitis or multiple sclerosis]. Med. Clin. (Bare) 1999 Jun. 19; 113 (2): 50-1.
16. Dockrell D. H., Kinghorn G. R. Imiquimod and resiquimod as novel immunomodulators. J. of Antimicrobial Chemotherapy, 2001. Vol. 48. P. 751-755
17. Everson G. Т., Jensen D. M., Craig J. R. et al. Efficacy of interferon treatment for patients with chronic hepatitis C: comparison of response in cirrhotics, fibrotics, or nonfibrotics. Hepatology 1999 Jul; 30 (1): 271-6
18. Fernandez M., Quiroga J. A., Martin J, et al. In vivo and in vitro induction of MxA protein in peripheral blood mononuclear cells from patients chronically infected with hepatitis С virus. J. Infect. Dis. 1999. Aug; 180 (2): 262-7.
19. Glue P., Rouzier-Panis R., Raffanel C. et al. A dose-ranging study of pegylated interferon alfa-2b and ribavirin in chronic hepatitis С The Hepatitis С Intervention Therapy Group. Hepatology. 2000; 32 (3): 647-653.
20. Jensen D. M., Krawitt E. L., Keeffe E. B. et al. Biochemical and viral response to consensus interferon (CIFN) therapy in chronic hepatitis С patients: effect of baseline viral concentration. Consensus Interferon Study Group. Am. J. Gastroenterol. 1999 Dec; 94 (12): 3583-8.
21. Kaisho H. H., Takeuchi O., Sato S. et al. Small antiviral compounds activate immune cells via TL MyD88-dependent signaling pathway. Nat. Immunol, 2002. Vol. 3, P. 196-200.
22. Kano S., Kamoshita H., Kawaguchi N. et al. [Spinal myoclonus which appeared during the administration of alpha interferon]. Rinsho Shinkeigaku. 1999. Feb.-Mar.; 39 (2-3): 316-20.
23. Liptakova H., Kontsekova E., Kabat P. et al. Therapy-induced antibodies to interferon-alpha 2a recognise its receptor-binding site. Acta Virol. 1998. Nov.; 42 (5): 279-84.
24. Mangia A., Gentile R., Cascavilla I. et al. HLA class II favors clearance of HCV infection and progression of the chronic liver damage. J. Hepatol. 1999 Jun.; 30 (6): 984-9
25. Milella M., Santantonio Т., Pietromatera G. et al. Retreatment of non-responder or relapser chronic hepatitis С patients with interferon plus ribavirin vs interferon alone. Ital. J. Gastroenterol. Hepatol. 1999 Apr; 31 (3): 211-5.
26. Rajender K. R. Efficacy and safety of pegylated (40-kd) interferon ct2a compared with interferon ct2a in non-cirrhotic patients with chronic hepatitis С / К. R Rajender, T. L. Wright, P. J. Pockros // Hepatology. 2001. V 33. P. 433-438.
27. Reichard О., Glaumann H., Fryden A. et al. Long-term follow-up of chronic hepatitis С patients with sustained virological response to alpha-interferon. J. Hepatol. 1999; May; 30 (5): 783-7.
28. Shiffman M. L. Use of high-dose interferon in the treatment of chronic hepatitis С Semin Liver Dis. 1999; 19 Suppl 1: 25-33.
29. Yoshida H., Shiratori Y, Moriyama M. et al. Interferon therapy reduces the risk for hepatocellular carcinoma: national surveillance program of cirrhotic and noncirrhotic patients with chronic hepatitis С in Japan. IHIT Study Group. Inhibition of Hepatocarcinogenesis by Interferon Therapy. Ann. Intern. Med. 1999 Aug. 3; 131 (3): 174-81.
| Август 2009 г. |