Последующая информация предназначена только для медицинских работников!
Выбрав ссылку "Продолжить", Вы подтверждаете, что являетесь специалистом в области здравоохранения.
ОПТИМИЗАЦИЯ ИНТЕНСИВНОЙ ТЕРАПИИ ТЯЖЕЛЫХ ФОРМ ЛЕПТОСПИРОЗА
Усовершенствованная медицинская технологияВ.Н. Городин, В.В. Лебедев, И.Б. Заболотских
Под редакцией В.В. Лебедева
ГОУ ВПО «Кубанский государственный медицинский университет» Федерального агентства по здравоохранению и социальному развитию
ГУЗ «Специализированная клиническая инфекционная больница» департамента здравоохранения Краснодарского края
Краснодар, 2007 Организации разработчики:
- ГОУ ВПО «Кубанский государственный медицинский университет» Федерального агентства по здравоохранению и социальному развитию;
- ГУЗ «Специализированная клиническая инфекционная больница» департамента здравоохранения Краснодарского края
Авторы: В.Н. Городин, В.В. Лебедев, И.Б. ЗаболотскихРецензенты:
- заведующий кафедрой инфекционных болезней ГОУ ВПО «Ростовский государственный медицинский университет», профессор Ю.М. Амбалов;
- профессор кафедры анестезиологии, реанимации и трансфузиологии ФПК и ППС ГОУ ВПО «Кубанский государственный медицинский университет» Ю.М. МалышевУсовершенствованная медицинская технология посвящена оптимизации способов лечения тяжелых форм лептоспироза.
Издание рассчитано на инфекционистов, анестезиологов-реаниматологов, врачей клинических специальностей, интернов, клинических ординаторов, курсантов факультета повышения квалификации и профессиональной переподготовки специалистов медицинских ВУЗов.
Печатается по решению методического совета факультета повышения квалификации и профессиональной переподготовки специалистов Кубанского государственного медицинского университета, протокол № 4 от 04.07.2007 г.
Оглавление
СПИСОК СОКРАЩЕНИЙ
АОС
-
антиоксидантная система
АРЗ
-
антирадикальная защита
АФК
-
активные формы кислорода
ГПИ
-
гематологический показатель интоксикации
ДВС
-
диссеминированное внутрисосудистое свертывание
ИТШ
-
инфекционно-токсический шок
КАэр, КАгем
-
каталаза интактных эритроцитов, каталаза гемолизата
ЛИИ
-
лейкоцитарный индекс интоксикации
ОКА, ЭКА
-
общая и эффективная концентрация альбумина
ОНГМ
-
отек-набухание головного мозга
ОПН
-
острая почечная недостаточность
ОППН
-
острая почечно-печеночная недостаточность
ПОЛ
-
перекисное окисление липидов
ПОН
-
полиорганная недостаточность
РДСВ
-
респираторный дистресс-синдром взрослых
РМА
-
реакция микроагглютинации
СДГ
-
сукцинатдегидрогеназа
СМП
-
среднемолекулярные пептиды
ССВО
-
синдром системного воспалительного ответа
СОД
-
супероксиддисмутаза
СОПЛ
-
синдром острого повреждения легких
СРО
-
свободнорадикальное окисление
СЭИ
-
синдром эндогенной интоксикации
СТЭ
-
синдром токсической энцефалопатии
ЭКоГ
-
электрокоагулограмма
TNF-α
-
фактор некроза опухоли альфа
Введение
Лептоспироз является одним из наиболее тяжело протекающих зоонозных инфекционных заболеваний. В России заболеваемость людей лептоспирозом регистрируется практически во всех климатогеографических зонах, на всех административных территориях и, в среднем, находится на уровне 1,0 на 100 тыс. населения. Наибольшее неблагополучие имеет место на Северном Кавказе, где лептоспироз является самым распространенным и тяжело протекающим зоонозным заболеванием. В Краснодарском крае заболеваемость лептоспирозом за последние 10 лет колебалась от 2,25 до 29,6 на 100 тысяч населения. Так, в 1997 г. количество зарегистрированных случаев приблизилось к 1500. Меньше всего случаев лептоспироза было зарегистрировано в 2005 г. – 129. Широкое распространение заболевание имеет также в Санкт-Петербурге.
Наиболее тяжелое течение болезни долгие годы было характерно преимущественно для иктерогеморрагического типа инфекции. Однако в последние годы отмечается тенденция роста числа тяжелых форм, обусловленных и другими серотипами лептоспир. Преобладание среди заболевших лиц трудоспособного возраста, высокая летальность при тяжелом течении болезни обусловливают особую значимость данной проблемы для практического здравоохранения.
Лечение больных лептоспирозом является сложным и включает комплекс организационных мероприятий лечебно-диагностического процесса на различных уровнях оказания больным специализированной помощи. Необходима ранняя диагностика лептоспироза и стандартизация лечебно-диагностических мероприятий при поступлении больных в специализированные отделения. Проводится комплексное лабораторно-инструментальное обследование больных и установление индивидуального диагноза, отражающего период болезни, тяжесть состояния пациента и ведущий клинико-патогенетический синдром. Назначается этиотропная и комплексная упреждающая интенсивная терапия с активным антимедиаторным и детоксикационным воздействием, направленная на стабилизацию показателей гемодинамики и коррекцию нарушений основных звеньев гомеостаза. Применяются патогенетически обоснованные лекарственные препараты различных фармакологических групп.
Усовершенствованная медицинская технология посвящена оптимизации способов лечения тяжелых форм лептоспироза. Издание рассчитано на инфекционистов, анестезиологов-реаниматологов, врачей клинических специальностей, интернов, клинических ординаторов, курсантов факультета повышения квалификации и профессиональной переподготовки специалистов медицинских ВУЗов.
Раздел 1. Информационная база и технология
Информационная база основывается на данных наблюдения больных лептоспирозом в ГУЗ «Специализированная клиническая инфекционная больница» департамента здравоохранения Краснодарского края в 1982-2006 гг. Всего за указанный период пролечено 2172 больных лептоспирозом, в том числе 1221 (56,2%) тяжелой формой заболевания.
Основная задача интенсивной терапии больных с тяжелым течением лептоспироза заключаются в своевременном назначении этиотропной терапии и профилактике полиорганной недостаточности с помощью следующих лечебно-диагностических мероприятий:
1. Установление индивидуального диагноза и объективная оценка тяжести состояния больного.
2. Антибактериальная терапия.
3. Коррекция эндотоксикоза и иммуномодулирующая терапия.
4. Гемодинамическая и респираторная поддержка (терапия).
5. Профилактика и лечение ДВС-синдрома.
6. Заместительная терапия, коррекция метаболических расстройств, адекватное обеспечение энерго-пластических потребностей организма (нутритивная поддержка).
7. Применение эфферентных методов детоксикации и гемокоррекции.В целях оптимизации лечения тяжелых форм лептоспироза в период с 1999 по 2006 гг. были обоснованы и последовательно внедрены новые методы и схемы лечения больных с применением лекарственных препаратов различных фармакологических групп, дана клиническая оценка их эффективности. Внедрение методов лечения происходило поэтапно. Для решения поставленных задач по мере внедрения новых методов и схем лечения формировались группы пациентов, получавших соответствующее лечение. Для оценки эффективности новых методов лечения сформированные основные группы сравнивались с контрольными. Группы были сопоставимы по основным критериям: возрасту, полу, тяжести клинического течения, срокам поступления в стационар и начала проведения терапии. Из исследования были исключены наблюдения одновременного применения оцениваемых препаратов. Контрольные группы (по 30 человек) составляли больные, получавшие традиционную интенсивную терапию. Проанализированы результаты лечения у 246 больных лептоспирозом. Общая характеристика применяемых у них методов лечения представлены в таблице 1.1.
Выбор того или иного метода лечения зависел от индивидуального диагноза, отражающего как нозологический, так и патогенетический ди-
Таблица 1.1
Методы патогенетической терапии, использованные в целях оптимизации лечения больных лептоспирозом
Наименование метода лечения, количество пролеченных больных (n)
Фармакологический препарат и способ применения
Коррекция метаболических расстройств с использованием полифункциональной инфузионной среды (n = 31).
Реамберин по 400 мл в/в 1-2 раза в сутки в течение 3-6 дней.
Коррекция нарушений системы гемостаза с использованием низкомолекулярных гепаринов (n = 31)
Эноксипарин натрий (клексан) по 20-40 мг/сутки однократно до 10 дней.
Противовоспалительная и иммуномодулирующая терапия (n = 30).
Галавит или тамерит по 100 мг в/м 2 раза в сутки в течение 5 дней.
Имунофан по 1 мл в/м 1 раз в день в течение 6 дней.
Системная энзимотерапия (n = 30).
Вобензим по 5-8 табл. 3 раза в день в течение 5 дней, потом по 3 табл. 1 раз в день до 1 мес.
агноз (период болезни и тяжесть состояния больного, наличие сопутствующей патологии, осложнений заболевания и т.д.) на момент начала терапии. Нозологический диагноз устанавливался исходя из наиболее вероятной диагностической гипотезы на основании клинико-эпидемиологических и лабораторных данных. При этом было сохранено основное направление терапии лептоспироза – одновременное воздействие на возбудитель и его токсины, реактивность организма, отдельные звенья патогенеза.
РАЗДЕЛ 2. ОБЩИЕ ПРИНЦИПЫ И МЕТОДЫ ЛЕЧЕНИЯ БОЛЬНЫХ ЛЕПТОСПИРОЗОМ
Общими принципами лечения больных лептоспирозом являются раннее начало терапии, ее индивидуальность и комплексность (воздействие на все составляющие инфекционного процесса).
Комплексная терапия включает постельный режим в течение всего лихорадочного периода, гигиенический уход, полноценное питание, назначение этиотропных препаратов и строго индивидуализированного патогенетического лечения. Полноценное и сбалансированное питание является существенным дополнением к лечению особенно при тяжелых формах лептоспироза, так как у больных наряду с мультиорганной дисфункцией практически всегда страдают белковый, жировой, углеводный, минеральный и витаминный обмены. У больных лептоспирозом во время пребывания в стационаре назначается общий вариант диеты (ОВД), а при наличии поражения почек с пониженным содержанием соли.
Этиотропная терапия. Наиболее эффективным антибактериальным препаратом при лептоспирозе, как и прежде, является пенициллин и его производные. Бензилпенициллина натриевая соль назначается внутримышечно в дозе от 4 до 12 млн ЕД в сутки в течение 5–10 дней, до 3-5 дня нормальной температуры. В случаях лептоспирозного менингита доза пенициллина увеличивается до 18–20 млн ЕД/сутки и вводится одновременно внутримышечно и внутривенно.
Показанием к применению цефалоспоринов I – III поколений (цефазолин, цефтазидим, цефтриаксон), к которым отмечается высокая чувствительность лептоспир, является наличие второй волны лихорадки и развитие осложнений с формированием полиорганной недостаточности.
Учитывая возможный массивный бактериолиз с развитием инфекционно-токсического шока, первые введения антибиотиков осуществляются на фоне инфузионно-дезинтоксикационной терапии и применения глюкокортикостероидов. Результаты назначения бактериостатиков (левомицетина сукцинат) в качестве этиотропного препарата для лечения ИТШ у больных лептоспирозом показали отсутствие его преимущества перед пенициллином. С учетом нефро- и гепатотоксичности (особенно в больших дозах) аминогликозидов, тетрациклинов и макролидов их назначение при лептоспирозе нежелательно. При активации вторичной бактериальной флоры в более поздние сроки болезни на фоне развивающегося иммунодефицита проводится направленная терапия с учетом антибиотикограммы.
В литературе имеются сообщения о сочетанном применении антибиотиков, противолептоспирозного гетерологичного или гомологичного g-глобулина и плазмы с высоким содержанием противолептоспирозных антител в ранние сроки болезни. Эффективно использование человеческой плазмы с высоким титром противолептоспирозных антител (1:80–1:320) по 200 мл ежедневно в течение 3 дней и аллогенного иммуноглобулина. Назначение g-глобулина позже 3-5 дней болезни нецелесообразно в виду низкой его эффективности. У наблюдаемых нами больных данные методы лечения не применялись.
Патогенетическая терапия определяется наличием ведущего в текущий момент симптомокомплекса и может значительно отличаться в зависимости от периода болезни и тяжести патологического процесса. При легкой и среднетяжелой форме лептоспироза назначаются НПВС, антигистаминные препараты, поливитамины, энтеросорбенты. В качестве энтеросорбентов применяются как активированные угли медицинского назначения (АУВ «Днепр», микросорб, энтеросгель), так и полимеры растительного происхождения (полифепан, фильтрум, лактофильтрум). Энтеросорбцию проводят по схеме: 30–50 г. сорбента каждые 4–6 час в течение 5–7 дней.
При тяжелой форме болезни в комплексе терапевтических методов особое значение приобретают методы интенсивной терапии, включающие дезинтоксикацию, коррекцию нарушений гомеостаза и функций жизненно важных органов.
Целью инфузионной терапии при лептоспирозе является коррекция гиповолемии, водно-электролитного и кислотно-основного дисбалансов, нарушений реологических и коагуляционных свойств крови, расстройств микроциркуляции и обмена веществ, а также обеспечение активного транспорта кислорода, дезинтоксикация.
Выбор инфузионного раствора осуществляется с учетом механизмов действия препаратов и показаний к применению. На всех этапах проведения инфузионной терапии проводится посиндромный клинический контроль изменений системных функциональных показателей: сознание, параметры центральной гемодинамики и внешнего дыхания, работа желудочно-кишечного тракта, диурез, температура тела и др. Это позволяет правильно оценить динамику состояния пациента и, что очень важно, своевременно корригировать проводимую инфузионную терапию.
В качестве инфузионных сред (ИС) при лептоспирозе используются кристаллоидные растворы: базисные, обеспечивающие физиологическую потребность в воде и электролитах (5-10 % раствор глюкозы, изотонический раствор NaCl), замещающие (раствор Рингера, лактосол) и корригирующие (хлосоль, ацесоль), коллоидные гетерогенные (растворы декстрана – реополиклюкин) и аутогенные (нативная или свежезамороженная плазма, альбумин, другие препараты крови), препараты для парентерального питания.
Инфузию кристаллоидов осуществляют в объеме до 50 мл/кг массы в сутки со скоростью 4–8 мл/кг/ч с первых дней госпитализации с учётом физиологических и патологических потерь.
Таким образом, в начальном периоде заболевания стартовой терапией лептоспироза является интракорпоральная детоксикация организма на фоне этиотропного лечения. Хороших результатов в лечении тяжелых форм лептоспироза достигнуты благодаря раннему применению активных методов детоксикации, позволяющих эффективно снизить в циркуляторных системах концентрацию токсичных лигандов.
Особого внимания у больных лептоспирозом требует лечение инфекционно-токсического шока (ИТШ). Целью терапии шока является устранение острой сердечно-сосудистой и профилактика полиорганной недостаточности, а основными принципами лечения – восстановление гемодинамики, устранение интоксикации, дыхательной недостаточности, восстановление нарушенной функции органов и систем.
Наиболее перспективными представляются лечебные мероприятия, направленные на пусковые, начальные каскадные механизмы шока. Использование антимедиаторной стратегии является залогом успешной профилактики шока при лептоспирозе. Эффективность специфической антицитокиновой терапия с использованием моноклональных антител к TNFα и другим представителям провоспалительных цитокинов доказана только в эксперименте. На практике нами показано эффективное использование для «цитокиновой блокады» при лептоспирозе производных аминофталгидразидов (см. раздел 3.3). При угрозе шока эффективной являетя экстракорпоральная элиминация цитокинов: гемосорбция (гемокарбоперфузия), лечебный плазмаферез, пролонгированная гемофильтрация. Купирование «окислительного стресса», который всегда сопровождает шок, достигается применением антиоксидантов и антигипоксантов (реамберин, аскорбиновая кислота, a-токоферола ацетат, супероксиддисмутаза, неотон, ацетилцистеин).
Противошоковые мероприятия должны по возможности проводиться при тщательном мониторинге за основными показателями гомеостаза, к которым относятся: САД, ЦВД, коллоидно-осмотическое давление (КОД), давление заклинивания в легочных капиллярах (ДЗЛК), сердечный индекс (СИ), общее периферическое сопротивление сосудов (ОППС), параметры транспорта кислорода, диурез.
Рациональная коррекция гемодинамики должна быть осуществлена в течение 24-48 час с момента развития шока. Восполнение объема циркулирующей крови (ОЦК) при лептоспирозе проводится осторожно с учетом имеющихся глубоких нарушений в микроциркуляторном русле и повышенной проницаемости капилляров, опасности развития отека легких. Нормализация показателей центральной гемодинамики достигается путем проведения инфузионной терапии. Из кристаллоидных растворов в лечении шока используется раствор Рингера, глюкозо-поляризующую смесь, которая оказывает положительное инотропное действие и улучшает гемодинамику при низком СИ. Для восполнения ОЦК применяются и коллоидные растворы (реополиглюкин), которые лучше кристаллоидных повышают сердечный выброс и доставку кислорода к тканям. В некоторых случаях при низком гематокрите проводится переливание эритроцитарной массы. Объем инфузии в первые сутки лечения у больных лептоспирозом с учетом угрозы развития интерстициального отека легких и ОПН не должен превышать 2/3 от расчетной физиологической нормы.
Наряду с активной инфузионно-трансфузионной терапией назначаются инотропные препараты. Применение препаратов с b-1 позитивным действием (допамин, добутамин) у больных с ИТШ показано при развитии изменений контрактильной, инотропной функции миокарда, наличии гиперметаболического синдрома с увеличением потребности в кислороде и тканевой гипоксией. В силу особенностей фармакокинетики инотропные препараты обычно назначаются в виде непрерывной инфузии, что позволяет поддержать необходимую концентрацию препарата в плазме. Допамин (дофамин) используется в дозе 2–20 мкг/кг/мин, добутамин (добутрекс) 5–20 мкг/кг/мин. Длительность применения сосудистой поддержки определяется сроками восстановления показателей гемодинамики и колеблется от нескольких часов до нескольких суток, в среднем составляет 28,4±4,2 часов.
Глюкокортикостероиды (ГКС), обладающие мощным противовоспалительным действием с уменьшением проницаемости сосудистых стенок и тканевых мембран широко используются в терапии ИТШ у больных лептоспирозом. ГКС назначаются в дозе 5–30 мг/кг/сут в зависимости от стадии шока. В последние годы применялась тактика использования больших доз ГКС на ранних этапах шока (в/в каждые 3–4 час, общая доза 1,0–2,0 г/сут).
При уже развившемся шоке наиболее предпочтительной и наименее травматичной для пациента, находящегося в критическом состоянии, является высокообъемная гемофильтрация.
Все больные с тяжелой формой лептоспироза нуждаются в коррекции энергодефицита путем энтерального и парентерального питания (не менее 2500 ккал/сут). Для восполнения энерготрат необходимо обеспечить 40-60 ккал/кг в сутки, использовать углеводы (в среднем 9 г/кг), жиры (2 г/кг), белки (1,5-2 г/кг) в сутки. В этих целях используются сбалансированные энтеральные смеси и инфузионные среды (аминосол, интралипид и др.).
Пациентам с ИТШ показана респираторная поддержка. Для улучшения газообмена и оксигенации крови осуществляется оксигенотерапия, обеспечение проходимости дыхательных путей и улучшение дренажной функции трахеобронхиального дерева. Важной задачей является поддержать PaO2 на уровне не менее 60 мм.рт.ст., а сатурацию гемоглобина не менее 90%. Выбор метода лечения острой дыхательной недостаточности (ОДН) при шоке зависит от степени нарушения газообмена в легких, механизмов его развития и признаков избыточной нагрузки на аппарат дыхания. Критериями наличия у больных лептоспирозом СОПЛ (РДСВ) является острая дыхательная недостаточность, развивающаяся на фоне выраженных признаков эндотоксикоза, рентгенологические признаки интерстициального или альвеолярного отека легких при нормальных размерах сердца и отсутствии плеврального выпота, нормальные показатели ЦВД, гипоксемия артериальной и капиллярной крови. При прогрессировании дыхательной недостаточности методом выбора является ИВЛ в режиме ПДКВ, эктракорпоральная мембранная оксигенация.
Особое внимание при лечении тяжелых форм лептоспироза придается улучшению гемоциркуляции и оптимизации микроциркуляции. Для этого используются реологические инфузионные среды (реополиглюкин), а также анти- и дезагреганты: дипиридамол (курантил), пентоксифиллин (трентал).
Критериями эффективности проводимых противошоковых мероприятий служат стабилизация центральной гемодинамики, нормализация диуреза, устранение периферических признаков шока, исчезновение (уменьшение) одышки, нормализация показателей КЩС и газового состава крови.
ИТШ всегда сопровождаются развитием ДВС – синдрома и в процессе интенсивной терапии должны быть устранены нарушения коагуляции. Для полноценной диагностики синдрома ДВС необходима его клиническая оценка, определение типа течения и стадии синдрома (лабораторный или клинический), а также комплексная лабораторная диагностика. Клинические признаки синдрома ДВС в зависимости от стадии имеют локальный или генерализованный характер. При генерализованном характере признаки тромбообразования проявляются в виде полиорганной недостаточности (акроцианоз, ишемические микроинсульты, инфаркты, повреждение легких с развитием ОДН, внутрисосудистый гемолиз с наличием фрагментированных эритроцитов, признаки повреждения почек в виде олигурии, азотемии, кортикального некроза), а геморрагические – в виде неудержимой генерализованной кровоточивости (кровоизлияния в кожу и слизистые, желудочно-кишечные, маточные кровотечения, субкапсулярные гематомы, гематурия).
Необходимыми условиями лечения синдрома ДВС являются адекватная этиотропная и посиндромная терапия с коррекцией нарушений водно-электролитного обмена, газообмена, гемодинамических нарушений, анемии и гипопротеинемии, нутритивного статуса. Специфическая гемостазиологическая коррекция зависит от стадии синдрома ДВС, которая может быть определена на основании данных электрокоагулограммы (ЭКоГ), позволяющей установить взаимоотношение между коагуляцией и фибринолизом.
I стадия может иметь коагуляционный или фибринолитический вариант. При коагуляционном варианте на ЭКоГ у больных лептоспирозом наблюдается гиперкоагуляция на фоне угнетения фибринолиза и формирования плотного сгустка. При коагуляционном варианте I стадии синдрома ДВС основным компонентом специфической терапии является применение антикоагулянтов, предпочтительнее низкомолекулярных гепаринов, обладающих профибринолитической активностью – эноксипарин по 40-80 мг п/к один раз в сутки (см. раздел 3.2). При повышенной агрегационной активности тромбоцитов назначаются антиагреганты (пентоксифиллин, трентал по 100 мг в/в 2 раза в сутки). При наличии дефицита антитромбина III – инфузия СЗП в дозе 3-3,5 мл/кг/сут. При фибринолитическом варианте I стадии синдрома ДВС отмечаются активация фибринолиза с формированием рыхлого сгустка на фоне гипер- или нормокоагуляции. Основным компонентом терапии в этом случае являются ингибиторы протеаз (трасилол сначала в/в болюсно 70 – 100 тыс. ЕД, а затем в виде в/в непрерывной инфузии – до 500 тыс ЕД/сут) в сочетании с препаратом, снижающим сосудистую проницаемость – дициноном по 250 мг в/в 4-6 раз в сут. Антикоагулянтная терапия проводится препаратом выбора – низкомолекулярным гепарином, не обладающим профибринолитической активностью – фраксипарином по 0,3-0,6 мл п/к два раза в сутки (см. раздел 3.2). Дефицит антитромбина III восполнялся также, как и при коагуляционном варианте.
II стадия синдрома ДВС (коагулопатия потребления) – на ЭКоГ отмечается гипокоагуляция с формированием рыхлого (гемостатически неполноценного) сгустка на фоне нормального или активированного фибринолиза. Основным компонентом лечения этой стадии является плазмообмен – плазмаферез с инфузией больших доз СЗП (до 30 мл/кг/сут). Ингибиторы протеаз назначаются также как при фибринолитическом варианте I стадии. Из антикоагулянтов может быть назначен нефракционированный гепарин в виде в/в постоянной инфузии в дозе 30-50 ЕД/кг/сут. При тромбоцитопении менее 50 тыс/мкл иногда возникает необходимость трансфузии тромбоцитарной массы.
Терапия синдрома ДВС проводится под постоянным контролем гемостазиологических параметров, которые определяются 2-4 раза в сутки, в зависимости от клинической ситуации.
В целях фармакологической регуляции синдрома ДВС и углубляющейся при нем эндогенной интоксикации, в комплексной терапии больных лептоспирозом применяется ингибитор биосинтеза простагландинов индометацин, назначаемый при поступлении в стационар по 50-75 мг 2-3 раза в день.
У больных тяжелой формой безжелтушного лептоспироза нередко развивается изолированная почечная недостаточность (ОПН). При изолированной ОПН по мере развития уремии влияние метаболических нарушений, связанных с почечной недостаточностью, возрастает за счет нарушений кислотно-щелочного состояния (метаболический ацидоз) и гипергидратации с развитием синдрома влажного легкого и отека мозга. Лечение ОПН условно можно разделить на два этапа: консервативной и заместительной терапии. Этап консервативной терапии включал профилактику ОПН (терапия шока, коррекция онкотического давления, адекватные дозировки допамина или его комбинации с добутамином, отказ от введения диуретиков, нефротоксичных препаратов и растворов, содержащих поливинилпирролидон, раннее назначение пульс дозы ГКС). Полный объем консервативной интенсивной терапии осуществляется до тех пор, пока уровень сывороточного креатинина не вырастет до 0,2 ммоль/л, а уровень мочевина до 20 ммоль/л (при отсутствии грубых нарушений КОС и осмолярности).
Развитие уремии, маркерируемое снижением клубочковой фильтрации до 40 мл/мин/1,73 м2, возрастанием уровня мочевины плазмы > 20 ммоль/л, креатинина > 0,4 ммоль/л, некоррегируемым нарушением КЩС и/ или осмолярности плазмы, является показанием для перевода больных в специализированные отделения (центры) для проведения заместительного этапа терапии. Этап заместительной терапии включает эфферентные методы. При лечении больных лептоспирозом применяются гемодиализ, ультрафильтрация, гемофильтрация, гемодиафильтрация, мембранный плазмаферез, гемокарбоперфузия.
У наблюдавшихся нами больных с тяжелыми желтушными формами лептоспироза более чем в 80% случаев имела место острая почечно-печеночная недостаточность (ОППН). До сих пор отсутствует единое мнение о причинах гепаторенального синдрома при лептоспирозе. У большинства исследователей не вызывает сомнения факт сочетанного воздействия на печень и почки нескольких неблагоприятных факторов. С одной стороны, доказана колонизация лептоспир в печени и почках, воздействие на органы самих лептоспир и их метаболитов. Это приводит к различной степени дисфункции печени и почек. С другой стороны любое критическое состояние, обусловленное выраженным эндотоксикозом с развитием шока, нейрогуморальной дисфункции, наличием глубоких гемодинамических и метаболических расстройств, сопровождается ОППН. Мы рассматриваем ОППН при лептоспирозе как компонент полиорганной недостаточности. Лечебная тактика при этом должна соответствовать принципам комплексной интенсивной терапии ПОН. Пациентам назначается обменный плазмаферез + гемоксигенация с интервалом 24–48 час. Курс из 3–4 сеансов. При развитии олигоанурии, уровне креатинина > 0,4 ммоль/л, общего билирубина > 180 мкмоль/л – плазмаферез + гемодиафильтрация, курс 3–4 сеанса. После детоксикации и восстановления диуреза – УФОК – 3–4 сеанса с интервалом 48 час. Оптимальный объем эксфузии при проведении обменного плазмафереза – 1600–2000 мл. Необходимое восполнение эксфузированных белковых компонентов производится донорским альбумином, свежезамороженной плазмой на 60 –70%, остальной объем восполняется коллоидными и кристаллоидными растворами. При нестабильности гемодинамических показателей объем эксфузии уменьшали до 800–1000 мл. При анурии, признаках гипергидратации и застоя в малом круге кровообращения, уровне креатинина > 0,7 – 0,8 ммоль/л были показаны мембранные эфферентные методы (МЭфМ). В фазе восстановления диуреза больным лептоспирозом показано проведение 3–5 сеансов УФОК с интервалом 24 – 48 час.
Таблица 2.1. Применяемые методы эфферентной терапии у больных лептоспирозом с полиорганной недостаточностью
Применяемые
методы эфферентной терапии
Число больных
Количество операций
Интервал
Гемосорбция (ГС)
48
2-3
24-48 час.
Плазмафарез (ПФ)
56
2
24 час.
ГС + ПФ
16
2
Ультрафильтрация (УФ)
22
1
Гемодиафильтрация (ГФ)
12
1
Гемодиализ (ГД)
9
2
48 час.
УФ +ГС +гемоксигенация
8
2
ГС + ГД
9
2
ГС + ГД + ГО
6
1
НЭХО
49
3-7
УФОК
31
3-5
24
Энтеросорбция
260
5-7
На фоне выраженного синдрома эндогенной интоксикации, нефро- и гепатопатии тяжелой степени (ОППН) у 70% больных с тяжелым желтушным лептоспирозом на 7-14 дни болезни (в среднем на 8,9 ± 1,1 день) выявляются признаки токсической энцефалопатии с различными ее проявлениями от состояния оглушения, возбуждения до комы. При этом отмечаются резко выраженные головные боли, психомоторное возбуждение, нарушение сознания, иногда выявляются менингеальные симптомы. У больных с сопутствующей алкогольной болезнью практически всегда развивается тяжелый психоз по типу абстинентного синдрома, алкогольного галлюциноза или делирия. При наличии признаков токсической энцефалопатии больным назначаются инфузии 1,5% раствора реамберина, препараты липоевой кислоты (берлитон – по 600 мг/сут), кортексин по 10 мг/сут однократно в/м, мексидол в дозе 100–200 мг 2 раза в сутки внутримышечно. Длительность курса от 10 до 15 дней.
Лептоспирозные менингиты чаще регистрируются при безжелтушной форме заболевания на 2–3-й неделях болезни. Ранние менингиты могли возникнуть в конце 1-й – начале 2-й недели болезни, поздние – на 14–21 день заболевания. В большинстве случаев лептоспирозные менингиты являются серозными, но возможен и гнойный характер процесса в спинномозговых оболочках. Особенностью клинического течения менингитов при лептоспирозе являются умеренно выраженная общемозговая симптоматика с нередким отсутствием четких менингеальных симптомов. Антибактериальная терапия менингитов проводится пенициллином в указанной выше дозировке или цефтриаксоном по 2–4 г/сут внутривенно до снижения плеоцитоза до 10 клеток (лимфоцитов) в 1 мкл. В алгоритм лечебных мероприятий входит уменьшение внутричерепной гипертензии (осмодиуретики), улучшение микроциркуляции и метаболизма нервной ткани (винпоцетин, циннаризин, девинкан, церебролизин, пирацетам, пиритинол).
Следует заметить, что только констатация критического неблагополучия в состоянии систем жизнеобеспечения у наблюдавшихся намибольных лептоспирозом не всегда отражала стадийность, динамику патологического процесса, что затрудняло оперативный контроль состояния пациентов и выбор гибкой тактики интенсивной терапии. Изученные нами сроки развития критических состояний и динамики клинико-лабораторных данных свидетельствуют об этапности вовлечения в патологический процесс органов и систем. Инфекционно-токсический шок у больных лептоспирозом развивается на 3–8 сутки заболевания, в среднем на 5,3 ± 0,2 день болезни. Дыхательные расстройства и клиника РДСВ – синдрома отмечаются через 1,5 ± 0,8 суток, ОППН – через 1,8 ± 0, 5 суток, геморрагические проявления и синдром ДВС – через 12 – 36 часов от момента развития шока. При наличии изолированных осложнений мы придерживаемся вышеописанной терапевтической тактики. Сочетание неотложных состояний при лептоспирозе, их наслоение одного на другое затрудняет оценку взаимоотношений и выраженности нарушений гомеостаза и нередко усложняет выбор способа и степени «агрессивности» поддерживающей и заместительной интенсивной терапии.
Критериями эффективности проводимой терапии служат: уменьшение клинических проявлений синдрома интоксикации, купирование токсической энцефалопатии, положительная динамика лабораторных показателей – снижение пула СМП, гематологических показателей интоксикации (ЛИИ, ГПИ), уровня ЦИК, увеличение общей и эффективной концентрации альбумина (ОКА, ЭКА). Рекомендуемая кратность лечебных мероприятий может быть изменена в связи с достигнутым эффектом.
Лечение больных лептоспирозом не заканчивается купированием полиорганной недостаточности. Нередко в конце 2-й – начале 3-й недели у больных лептоспирозом появляется вторая волна лихорадки, связанная с активацией вторичной бактериальной флоры и появлением очагов воспаления нелептоспирозной этиологии. В этот период мы наблюдали возникновение гнойно-септических процессов: бактериального эндокардита, пневмоний, гнойных менингитов, абсцесса головного мозга, пиелонефритов, отитов. У значительного числа больных с тяжелыми формами лептоспироза диагностируется суб- и декомпенсированный дисбиоз кишечника. Для профилактики развития затяжного пролонгированного течения инфекционного процесса у больных лептоспирозом применялись препараты, обладающие иммуностимулирующим действием. В периоде реконвалесценции по показаниям применяют методы общеукрепляющей терапии, физиолечение, ультрафиолетовое облучение крови.
РАЗДЕЛ 3. ОПТИМИЗАЦИЯ ИНТЕНСИВНОЙ ТЕРАПИИ ЛЕПТОСПИРОЗА
3.1. Применение полифункционального раствора «реамберин» в комплексной интенсивной терапии лептоспирозаВажную роль в терапии тяжелых форм лептоспироза, позволяющую существенно повысить качество лечения больных, играет комплекс методов лечения, направленных на коррекцию нарушений тканевого метаболизма, в первую очередь связанных с гипоксией и ее последствиями – активацией свободнорадикального окисления, прогрессированием эндогенной интоксикации у больных в критическом состоянии. В последние годы в практике интенсивной терапии критических состояний различного генеза в качестве инфузионной среды широко используется сукцинат-содержащий инфузионный препарат реамберин, обладающей дезинтоксикационным, антигипоксическим, антиоксидантным, гепато-, нефро- и кардиопротекторным действием [Оболенский С.В., 2002]. Сукцинат натрия по клинической квалификации относится к субстратным (метаболическим) антигипоксантам. В клинике критических состояний выявлены антигипоксантные, антитоксические, антиоксидантные свойства препарата. В условиях гипоксии, при резком снижении активности NAD - зависимых ферментов цикла Кребса, остро встает необходимость активации альтернативных NAD-метаболических потоков и, прежде всего, окисляющего янтарную кислоту сукцинатдегидрогеназного шунта. Сукцинат обладает антиоксидантным действием, дезактивируя пероксидазу в митохондриях, усиливает активность NAD-зависимых ферментов. В основе лечебного действия сукцината лежит модифицирующее влияние на процессы тканевого метаболизма – клеточное дыхание, ионный транспорт, синтез белков. При этом амплитуда и направленность модификаций зависят от исходного функционального состояния тканей, а конечный результат выражается в оптимизации параметров их функционирования [Семиголовский Н.Ю., 1997; Оболенский С.В., 2001].
«Реамберин» (регистрационный номер 420320158401 от 2001 года, производитель: НТФФ «Полисан», Россия) представляет собой сбалансированный полиионный раствор, содержащий: натрия хлорид - 6,00 г., калия хлорид - 0,3 г., магния хлорид - 0,12 г., N-(1-дезокси-D-глюцинол-1ил)-N-метиламмония натрия сукцинат – 15,0 г., воду для инъекций – до 1 литра. Ионный состав раствора: натрия – 142,4 ммоль, калия – 4,0 ммоль, магния – 1,2 ммоль, хлорида – 109,0 ммоль, сукцината – 44,7 ммоль, N – метилглюкаммония – 44,7 ммоль. «Реамберин» в виде 1,5% раствора является изотоническим раствором в пределах нормальных значений рН для крови. В основе его действия лежит модифицирующее влияние на процессы тканевого метаболизма – клеточное дыхание, ионный транспорт, синтез белков.
Нами проведено изучение действия реамберина на основные звенья гомеостаза у 30 больных лептоспирозом (группа А). Контрольную группу (группа сравнения, группа В) составили 30 больных лептоспирозом, получавших стандартную интенсивную терапию без реамберина. Группы были рандомизированы по полу, возрасту, срокам поступления в стационар, тяжести состояния по шкале APACHE III и срокам начала комплексной интенсивной терапии. Реамберина 1,5% раствор использовали в отделении реанимации и интенсивной терапии в составе комплексной терапии лептоспироза в суточной дозе 400-800 мл со скоростью 20-30 капель в минуту в течение первых трех-шести суток от момента развития критического состояния. Курс лечения составлял 5-11 инфузий реамберина в общей дозе 2000 – 4400 мл, т.е. 30-66 г сукцината натрия. В процессе лечения больным проводилось комплексное обследование: общие анализы крови и мочи, биохимический анализ крови (глюкоза, ОКА, ЭКА, СМП, общий билирубин, креатинин, мочевина в сыворотке крови, показатели СРО-АРЗ), КОС артериальной и смешанной венозной крови, гематокрит (Ht), ионограмма (К+, Na+), электрокардиограмма (ЭКГ), рентгенография легких. Оценивались изменения основных клинико-лабораторных данных на 3-е и 6-е сутки от начала терапии. Сравнительная характеристика изучаемых основных лабораторных показателей (синдрома интоксикации и системы СРО-АРЗ) в зависимости от видов терапии представлена в таблице 3.1.1.
Таблица 3.1.1 Влияние реамберина на показатели синдрома интоксикации и системы СРО-АРЗ у больных лептоспирозом
Показатели
Нормальные
значения
Исходные значения
Через 3 суток
Через 6 суток
Группа А
Группа В
Группа А
Группа В
Группа А
Группа В
ССЭ
35,6±1,3
53,3±1,8*
54,7±1,8*
46,1±0,8
54,1±0,8
42,1±0,6
53,9±0,6
ПЭМ
17,8±0,32
22,2±0,39*
22,0±0,41*
20,8±0,23
24,8±0,63
19,6±0,2
23,4±0,5
ОКА
52,0±0,51
38,6±0,95*
38,4±0,9*
46,6±1,2
37,7±0,9
52,5±1,3
45,2±1,1
ЭКА
44,0±0,52
26,4±1,2*
27,2±1,3*
31,1±1,5
26,5±1,3
33,0±1,5
31,4±1,5
ЛИИ
0,62±0,09
9,1±1,0*
7,7±1,0*
7,9±0,99
8,3±0,98
6,2±0,4
8,6±0,96
СМП
240,0±2,22
660,7±30,4*
652,1±25,6*
597,6±32,7
677,8±21,2
519,9±21,1
635,5±22,1
Креатинин
0,08±0,001
0,48±0,02*
0,46±0,02*
0,45±0,02
0,50±0,02
0,39±0,02
0,47±0,02
Мочевина
6,80±0,09
18,2±1,2*
17,8±0,8*
16,5±0,8
18,5±0,8
12,1±0,6
18,3±0,8
Билирубин
14,6±0,32
147,9±11,2*
145,7±9,5*
136,2±10,9
150,1±8,6
93,7±9,6
144,95±6,0
АФК
1,90±0,04
5,2±0,1*
4,6±0,3*
4,7±0,1
5,1±0,2
3,95±0,6
4,8±0,3
МДА
3,34±0,1
35,5±1,8*
35,9±1,8*
22,5±0,8
40,3±1,5
4,4±0,1
64,6±2,3
ДК
62,38±0,77
289,4±8,7*
299,3±9,0*
210,8±7,9
357,8±13,3
81,1±1,0
608,6±22,7
КАэр
4,3±0,05
3,6±0,06*
3,7±0,06*
3,8±0,07
3,7±0,06
3,7±0,09
3,6±0,06
КАгем
56,40±0,01
46,8±0,1*
49,7±0,6*
48,6±0,3
47,0±0,3
53,2±0,2
49,1±0,6
СОД
118,40±0,20
47,9±0,1*
49,6±0,6*
52,8±0,6
48,1±0,2
54,7±0,1
50,4±0,6
СДГ
136,8±0,31
48,0±0,2*
47,5±0,2*
53,2±0,8
47,6±0,2
46,3±0,2
47,4±0,3
Г-6-ФДГ(эр)
26,13±0,45
15,3±0,1*
16,1±0,5*
19,2±0,5
15,3±0,1
17,3±0,8
16,4±0,5
SH-группы
21,68±0,04
8,0±0,1*
8,2±0,1*
8,8±0,2
7,95±0,1
8,6 ±0,01
8,3±0,1
ЦП
354,0±3,18
520,0±23,2*
513,2±22,9*
454,2±20,3
554,1±24,7
382,4±17,1
482,3±19,1
Примечание: Группа А - получавшие препарат реамберин, Группа В (контрольная)- не получавшие препарат реамберин
* - отличия достоверны в сравнении с нормой
† – отличия достоверны по отношению к исходным значениям
Δ - отличия достоверны по отношению к предыдущему периоду исследования
¤- отличия достоверны между группами А и В (при p<0,05)Рис. 3.1 Динамика некоторых показателей эндотоксикоза (в % по отношению к норме) на фоне различных методов лечения (группа А с применением реамберина, группа сравнения В без включения в терапию реамберина).
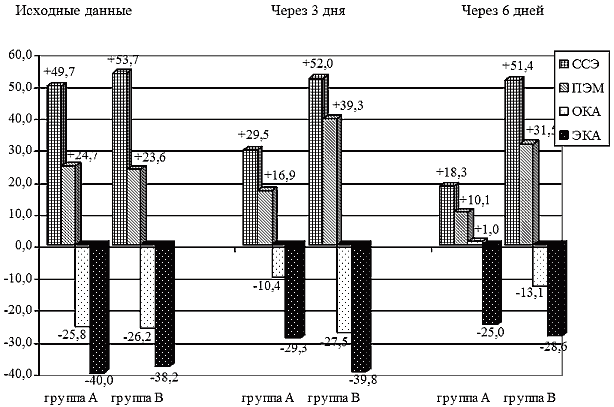
Как было показано в предыдущих главах, при тяжелом течении лептоспироза существенно страдает гемоциркуляция. Следствием этого является активация симпатической и эндокринной систем, централизация кровообращения, нарушение переферического кровотока и микроциркуляции, ишемия и развитие гипоксии органов и тканей. При чрезмерной выраженности и продолжительности этих реакций и срыве адаптационных механизмов развивается шок. При прогрессировании тканевой ишемии в условиях дефицита кислорода и энергетических субстратов, включаются патохимические реакции на клеточном и субклеточном уровнях, что сопровождается накоплением недоокисленных кислородом продуктов обмена, переходу метаболических процессов на анаэробный путь окисления, развитию метаболического ацидоза. В условиях гипоксии и энергодефицита нарушается утилизация кислорода, блокируется его полное четырехвалентное восстановление. Это приводит к повышению гидроксильных, супероксидных и пероксидных радикалов, активации свободнорадикального окисления. Усиление окислительных процессов при недостаточности системы антиоксидантной защиты ведет к развитию «оксидантного стресса», являющегося одним из механизмов повреждения биологических мембран, затрагивающим как липидный бислой, так и мембранные белки, включая ферменты, участвующие в дыхательной цепи митохондрий. При этом вместо окислительного фосфолирирования активируется компенсаторный метаболический поток по сукцинатоксидазному пути окисления. Поэтому для коррекции клеточной гипоксии его активация достигается повышением активности сукцинатдегидрогенеазы и улучшением проникновения экзогенного и эндогенного сукцината в митохондрии клеток.
Исходные лабораторные показатели при поступлении больных лептоспирозом в ОРИТ свидетельствовали о наличии эндотоксикоза, активации СРО и изменениях активности ферментов антирадикальной защиты в обеих группах. При включении в комплексную интенсивную терапию раствора реамберина уже через 3-е суток отмечено уменьшение как клинических, так и лабораторных проявлений интоксикации. В группе А, получавших реамберин отмечены достоверные изменения, свидетельствующие о стабилизации клеточных мембран (снижение ССЭ 46,1±0,8 против 53,3±1,8 до лечения, ПЭМ 20,8±0,23 против 22,2±0,39 в исходных значениях), снижение интенсивности генерации АФК (4,7±0,1 против 5,2±0,1 до лечения). В группе А отмечено достоверное снижение показателей ПОЛ (МДА, ДК), в то время как в группе В продолжалась активация процессов липопероксидации. Изменение активности антиоксидантной системы – ее ферментативной и неферментативной составляющих показано на рис. 3.1. Более выраженные позитивные эффекты при включении в терапию реамберина были отмечены через 6 суток от начала лечения практически по всем лабораторным параметрам, отражающим выраженность эндотоксикоза, соотношение в системе СРО-АРЗ, а также лабораторным критериям органной дисфункции. В частности, отмечена положительная динамика лабораторных показателей гепаторенального синдрома в виде снижения содержания креатинина, мочевины, общего билирубина. В группе сравнения, не получавших реамберин лабораторные маркеры поражения клеточных мембран, органных поражений (печени и почек) не имели достоверной положительной динамики, а такие показатели как МДА, ДК имели отрицательную динамику. Повышение уровня лактата и глюкозы в крови больных лептоспирозом подтверждает снижение тканевой перфузии, наличие кислородной задолженности. При критическом состоянии больных лептоспирозом компенсаторные механизмы требуют повышенных энергозатрат, но в условиях централизации кровообращения, ведущим звеном в патогенезе становится дефицит энергии, связанный с переходом метаболизма на энергетически менее выгодный анаэробный путь, что подтверждается у наблюдавшихся больных с тяжелым течением лептоспироза гипергликемией до 11,1±1,1 ммоль/л и повышением уровня лактата свыше 40 мг/дл. При включении в комплексную терапию реамберина у больных нормализация концентрации глюкозы, лактата наступала быстрее, чем в группе сравнения.
Таким образом, применение реамберина в комплексной терапии тяжелых форм лептоспироза, сопровождающихся активацией СРО, снижает интенсивность образования продуктов ПОЛ и повышает активность систем антиоксидантной защиты. Реамберин оказывает не только энергостимулирующее воздействие, но и способствует уменьшению клеточной гипоксии, коррекции метаболических расстройств у больных лептоспирозом.
3.2. Применение низкомолекулярных гепаринов в целях коррекции гемостаза и профилактики тромбогенных осложнений
Нарушения в иммунной системе и нарушения гемостаза являются важными патогенетическими звеньями лептоспирозной инфекции. При воспалении последовательно секретируются провоспалительные цитокины и другие медиаторы воспаления (оксид азота, протеазы), которые действуя аутокринно, усиливают цитотоксическую и килерную активность макрофагов и опосредованно оказывают прокоагулянтный эффект. Оксид азота способен регулировать содержание цГМФ в тканях и тонус сосудов. Потеря тонуса артериол под действием этого фактора приводит к микроциркуляторным нарушениям с изменением проницаемости стенки сосудов, стазом, гипоксии и развитием ДВС-синдрома. Одновременно повреждение эндотелиальных клеток под действием свободных радикалов и TNFα, в свою очередь будет способствовать усилению образования этих факторов и гиперактивности макрофагального звена с формированием порочного круга. Таким образом, иммунитет, неспецифическая резистентность и гемостаз при лептоспирозе составляют единую клеточно-гуморальную систему защиты организма.
Коррекция гемостазиологических нарушений у больных с тяжелыми формами лептоспироза – одна из основных задач интенсивной терапии. При тяжелых формах лептоспироза ДВС-синдром является наиболее ранним и частым компонентом развивающейся полиорганной недостаточности. Очевидно, что проявления этого синдрома обусловлены разбалансировкой свертывающей и противосвертывающей систем с системой фибринолиза. Развивающийся при тяжелых формах заболевания ССВО сопровождается упомянутым выше каскадом взаимообусловленных патологических реакций, приводящих к угнетению фибринолиза на фоне гиперфибриногенемии и повышенной агрегации тромбоцитов, что является одной из причин микроциркуляторных нарушений и фактором риска тромбогенных осложнений. В результате активации свертывающей системы крови, образование тромбина не только поддерживает отложение фибрина в микроциркуляторном русле, но и усиливает продолжающееся воспаление через прямые и косвенные механизмы, что ведет к развитию полиорганной недостаточности. Актуальность проблемы коррекции гемостаза у больных лептоспирозом определяется следующими причинами: развитием синдрома системной воспалительной реакции, патогенетически обусловленной выраженной тромбоцитопенией, гемостазиологической нестабильностью в острый период заболевания, что приводит к сочетанию риска тромботических и гемморагических осложнений.
Нами проведена оценка эффективности применения НМГ (эноксипарин натрий) в комплексной терапии гемостазиологических нарушений при тяжелых формах лептоспироза. Под наблюдением в отделении реанимации и интенсивной терапии краевого лептоспирозного центра находилось 67 больных лептоспирозом. Все больные были мужского пола в возрасте от 21 до 75 лет. У всех больных диагноз выставлен на основании клинико-лабораторных, эпидемиологических данных и подтвержден в РМА с живыми культурами лептоспир. Больные поступали в стационар на 2–8 день болезни, в среднем на 5,2 ± 1,1. У всех наблюдаемых больных заболевание характеризовалось тяжелым течением. В клинической картине лептоспироза при поступлении в ОРИТ превалировали выраженные признаки интоксикации вплоть до развития инфекционно-токсического шока (ИТШ) у 29 пациентов (43,3%). Сроки развития гемостазиологических нарушений колебались с 5 по 8 день болезни. Как правило, признаки ДВС-синдрома развивались одновременно или спустя 4–6 часов от момента развития ИТШ. Далее при развитии ПОН с различной частотой развивались РДСВ-синдром, ОППН, токсическая энцефалопатия, инфекционно-токсический миокардит. Клинические проявления характеризовались блокадой микроциркуляции (по данным бульбарной микроскопии и положительному симптому Маневича), нарушениями системной гемодинамики, функции внешнего дыхания, гепато- и нефропатией различной степени выраженности. Геморрагический синдром диагностирован в 74,6% случаев и проявлялся петехиальной сыпью (67,2%), кровоизлияниями в склеры, конъюнктиву, в местах инъекций (70,2%). Отмечались носовые и желудочно-кишечные кровотечения (31 и 11,9 % соответственно). У 8 больных отмечался геморрагический герпес, у 2 больных – кровохаркание.
Лечение было комплексным: антибактериальная терапия, системная энзимотерапия, интра- и экстракорпоральная детоксикация, вазопрессорная поддержка при нарушениях системной гемодинамики, иммунокоррекция. Специфическая гемостазиологическая коррекция зависела от стадии синдрома ДВС. Для устранения нарушений в системе гемостаза у всех больных наряду с антикоагулянтами (НФГ, НМГ) использовались трансфузии СЗП (400-800 мл/сут), дезагреганты (дипиридамол, пентоксифиллин). До лечения у большей части больных отмечалась гиперкоагуляционная направленность ДВС-синдрома и угнетение фибринолиза. Больные были распределены на 2 рандомизированные группы. В 1-й группе (33 чел.) больные получали дробно гепарин в суточной дозе 5000–20 000 ЕД, во 2-й группе (34 больных) назначался (при количестве тромбоцитов в крови не ниже 40х109/л.) эноксипарин натрий (клексан) в дозе 20–40 мг/сут однократно. По международному стандарту LMWH 1 мг клексана содержит 100-анти-Ха единиц низкомолекулярных гепаринов. Средняя продолжительность антикоагулянтной терапии составила 6,9 ± 0,2 суток.
Для определения эффективности НМГ наряду с общепринятыми методиками у всех больных изучали следующие параметры гемостаза: количество тромбоцитов, уровень фибриногена, АЧТВ, ПТВ, АТ III, растворимые комплексы фибрин-мономера (РКФМ). Экспресс-диагностику нарушений гемостаза проводили на электрокоагулографе Н-334. Лабораторный контроль осуществляли до начала терапии и на 1, 3, 5, 7-е сутки от начала лечения.
При анализе воздействия НФГ и НМГ на количество тромбоцитов у больных лептоспирозом установлено, что на фоне применения НФГ уровень тромбоцитопении продолжает нарастать – с 94,3±1,6 до 75,1±1,4 тыс/мкл к концу наблюдения, что свидетельствовало о наличии ДВС-синдрома. Назначение клексана предотвращало дальнейшее снижение количества тромбоцитов, начиная с 3-х суток назначения препарата. К концу наблюдения количество тромбоцитов в 1-й группе составляло 75,1±1,4 и достоверно отличалось от 2-й – 102,3±3,1 тыс/мкл (p<0,05).
При сравнении эффективности НФГ и НМГ в ингибировании коагуляции мы получили следующие данные. Антикоагуляционный эффект в отношении внутреннего механизма свертывания при применении клексана развивался в течение первых суток от начала применения препарата, о чем свидетельствовало снижение АЧТВ с 44,1±0,03 до 42,1±0,03 с. Через 7 суток лечения показатель составлял 38,2±0,06 с и не имел достоверных отличий от нормальных значений. При применении гепарина в течение первых суток лечения АЧТВ повышалось до 45,2±0,04 против 43,5±0,06 с. до начала терапии. В последующие периоды, начиная с 3-х суток показатель снижался и к 7-м суткам составлял 40,5±0,05 против 43,5±0,06 с до лечения. То есть, оба препарата обладали достаточным антикоагуляционным потенциалом.
При анализе показателей, характеризующих внешний механизм свертывания, в частности ПТИ, НМГ продемонстрировали эффект увеличения ПТИ с первых суток назначения препарата с максимальным значением в конце лечения (82,1±1,7 после курса назначения клексана, против 53,8±2,4 % до начала терапии). При применении НФГ в первые дни лечения отмечалась тенденция увеличения показателя с 55,2±3,2 до 59,3±2,8% через 3-е суток лечения с последующим снижением ПТИ ниже нормальных значений (58,8±1,6 против 86,0±0,82%), что свидетельствовало о недостаточности факторов внешнего механизма свертывания крови.
У больных лептоспирозом при поступлении в стационар уровень фибриногена превышал нормальные показатели в 1,5–2,8 раза, что свидетельствовало о наличии выраженного воспалительного процесса и возможной деструкции тканей. Гиперфибриногенемия является важным фактором риска тромбогенных осложнений. Настоящим исследованием установлено, что гепарин не оказывает существенного влияния на снижение уровня фибриногена – 5,6±0,02 до лечения и 5,7±0,02 г/л после лечения. При назначении клексана уровень фибриногена в конце лечения был достоверно ниже исходного (3,1±0,04 против 5,1±0,05 г/л, p<0,05).
Сравнение воздействия на содержание препаратов на АТ III – основного естественного антикоагулянта и маркера ДВС-синдрома показало, что на начальном этапе лечения НФГ уровень АТ III снижался с 88,7±1,3 до82,2±1,1 % с последующим нарастанием к концу лечения. Однако и спустя 7 суток от начала терапии его уровень был несколько ниже нормы – 95,2±1,2 против 104,0±1,5%. В то время как при назначении клексана содержание АТ III нарастало в течение всего периода наблюдения и к окончанию лечения не отличалось от нормы (105,1±1,1 против 104,0±1,4%).
При ДВС-синдроме за счет свободного тромбина происходит постоянный процесс трансформации фибриногена в фибрин с появлением в крови фибринопептидов А и В, накоплением мономеров фибрина. Продукты деградации фибрина взаимодействуют с фибрин-мономерами, увеличивая количество фибрин-мономерных комплексов (РФМК). В конце первой-начале второй недели заболевания и особенно в периоде разгара заболевания у больных лептоспирозом отмечается существенное увеличение РФМК, что также является маркером ДВС-синдрома. При проведении антикоагулянтной терапии нами получены следующие данные. При назначении гепарина имелась тенденция к снижению РФМК на протяжении всего периода наблюдения, однако, их уровень по-прежнему оставался высоким 19,7±1,2 против 21,6±1,4 мг% до начала терапии. Применение клексана продемонстрировало достоверное снижение показателя РФМК к окончанию курса лечения – 5,2±0,8 против 20,9±1,3 мг% (p<0,05).
Фибринолиз является защитным механизмом системы гемостаза, препятствующим отложению фибрина на уровне микроциркуляторного русла. Уровень фибринолитической активности крови отражает время лизиса эуглобулиновой фракции. Укорочение времени лизиса свидетельствует об активации фибринолиза, а увеличение об его угнетении.
В изучаемых группах больных лептоспирозом при поступлении в стационар исходно отмечалось угнетение фибринолиза (217,0±4,2 и 216,8±5,7 против 205,6±2,3 в контрольной группе здоровых лиц). При назначении гепарина было отмечено дальнейшее угнетение фибринолиза с 217,0±4,2 до 241,5±2,7 мин к концу лечения, в то время как при назначении клексана время лизиса эуглобулинов приходило к нормальным показателям (207,8±3,2 против исходных 216,8±5,7 мин).
Таким образом, применение НМГ клексана у больных тяжелой формой лептоспироза с гиперкоагуляционной направленностью ДВС-синдрома и угнетением фибринолиза продемонстрировало его клиническую эффективность. В результате проведенного исследования установлено, что у больных, получавших в комплексной терапии НМГ, в сравнении с пациентами 1-й группы, в более короткие сроки достоверно повышалось количество тромбоцитов, нормализовалось содержание АТ III, РКФМ. Антикоагуляционное действие клексана было направлено на оба механизма активации свертывания, в то время как НФГ демонстрировали воздействие преимущественно на внутренний механизм.
Фибринолитическая активность крови при использовании клексана оставалась в пределах физиологической нормы, а при применении гепарина была снижена. Угнетение фибринолиза на фоне гиперфибриногенемии и нарушений тромбоцитарного звена гемостаза являются причиной микроциркуляторных нарушений. Последние приводят к снижению уровня тканевой перфузии и являются одной из причин развития полиорганной недостаточности при лептоспирозе. Использование в комплексе интенсивной терапии ДВС-синдрома НМГ позволяет стабилизировать уровень АТ III, тромбоцитов, фибриногена, снизить интенсивность микротромбирования сосудов органов и тканей.
3.3. Применение иммуномодуляторов в комплексной терапии лептоспироза
Настоящим исследованием показано, что под действием эндотоксина лептоспир (ЛПС) в организме больных наблюдается несколько параллельно протекающих и взаимозависимых процессов: развитие блокады полноценного иммунного ответа (ранний иммунодефицит) и гиперпродукция провоспалительных цитокинов, вызывающая ряд симптомов эндотоксикоза, а также участвующая в генезе полиорганной недостаточности и ранних летальных исходов (ИТШ). Результатом первичного поражения иммунного ответа является развитие «иммунного паралича» за счет несостоятельности как неспецифического, так и клеточного и гуморального (в меньшей степени) звеньев иммунитета. При дальнейшем течении патологического процесса персистенции ИДС способствуют белковый и энергетический дефицит вследствие недостаточного поступления субстратов энергетического и пластического метаболизма («острофазовый» катаболизм, «оксидантный» стресс), ятрогении (применение антибиотиков, гормонов). Совершенно очевидно, что наблюдаемые при лептоспирозе иммунные нарушения требуют применения в комплексной терапии иммунокорректоров с соответствующим спектром фармакодинамической активности и разработки адекватных методов направленной иммунокоррекции.
В соответствие цели и задачам работы проведено исследование влияния различных иммуномодуляторов на течение патологического процесса при лептоспирозе. Проанализированы результаты применения в комплексной терапии тяжелых форм лептоспироза производных аминофталгидразидов (галавит, тамерит) и иммунорегуляторного пептида IV поколения имунофана.
Производные аминофталгидразидов (5-амино-1,2,3,4-тетра- гидрофталазин-1,4-диона натриевой соли) галавит ( регистрационный номер Р № 000088/02-2000 МЗ РФ, ЦСМ Медикор) и тамерит (регистрационный номер № 2000/113/5 от 03.04.2000, Абидофарма) относятся к фармгруппе иммуномодуляторы (6.4.) и обладают иммуномодулирующим, противовоспалительным и антиоксидантным фармакологическим действием. Тамерит, в отличие от галавита, представляет комбинацию в одном препарате двух активных аминофталгидразидов (легкорастворимой натриевой соли 5-аминофтал- гидразида и гидрофобного 5-аминофталгидразида в соотношении 1:1 и 1:0,5), что продлевает терапевтический эффект препарата.
Имунофан (аргинил-альфа-аспартил-лизилвалил-тирозил-аргинин) – гексапептид с молекулярной массой 836 D (регистрационный номер № 000106 /02-2000, НПП «Бионокс») обладает иммунорегулирующим, детоксицирующим, гепатопротективным действием. Фармакологическое действие пептидного иммуноксиредуктанта основано на достижении коррекции иммунной и окислительно-антиокислительной системы организма.
Исследование проведено в краевом лептоспирозном центре в период с 1999 по 2006 гг. Под наблюдением находилось 63 пациента мужского пола в возрасте от 15 до 67 лет, в среднем 45,1±1,4 лет. У 57 больных (90,5%) был диагностирован иктерогеморрагический лептоспироз, у 6 – заболевание было вызвано другими видами лептоспир. Во всех случаях диагноз лептоспироза был подтвержден наличием диагностических титров в РМА. Больные были госпитализированы в стационар в тяжелом состоянии, обусловленном выраженными явлениями интоксикации и органной дисфункцией с 4 по 9-й дни заболевания (в среднем, на 6,8±1,1 день болезни).
Наблюдаемые больные лептоспирозом были произвольно распределены на 2 основные группы сравнения. В первую основную группу были включены 33 пациента, в комплексной терапии которых использованы производные аминофталгидразидов. Галавит или тамерит назначались по 100 мг в/м 2 раза в сутки в течение 5 дней. Во вторую основную группу вошли 30 пациента, которым в качестве иммуномодулирующего препарата был назначен имунофан по 1 мл в/м 1 раз в день в течение 6 дней. Контрольную группу составили 30 больных с тяжелым течением иктерогеморрагического лептоспироза, в комплексной терапии которых иммуноориентированные препараты не применялись. Группы были сопоставимы по возрасту, срокам поступления в стационар и тяжести течения патологического процесса.
Все больные были комплексно обследованы при поступлении в стационар и по окончании курса применения препаратов – на 6–8 день пребывания в стационаре, контрольная группа была обследована в эти же сроки. В качестве клинических критериев эффективности проводимой терапии учитывалась продолжительность симптомов интоксикации (лихорадка, головная боль, общая слабость, тошнота, анорексия, миалгии).
В результате проведенного исследования установлено, что включение в комплексную терапию иммуноориентированных препаратов демонстрирует их клиническую эффективность в виде достоверного сокращения продолжительности основных симптомов синдрома эндогенной интоксикации, более быстрого восстановления границ печени и нормализации ее функциональных проб, а также сокращения сроков стационарного лечения больных с тяжелым течением заболевания (таб.3.3.1.). Существенным клиническим эффектом назначения АФГ и имунофана является сокращение длительности антибактериальной терапии на 4,6 и 3,8 дня соответственно.
Таблица 3.3.1. Клиническая эффективность иммуномодулирующей терапии у больных с тяжелым течением лептоспироза
Наименование признаков
Продолжительность (сут.)
АФГ
Имунофан
Контрольная группа
Лихорадка
3,8±0,1*
3,9 ± 0,1*
5,6 ± 0,2
Головная боль
2,7±0,1*
2,9 ± 0,2*
4,5 ± 0,3
Миалгии
3,5±0,2*
4,3 ± 0,3*
7,2 ± 0,3
Тошнота
2,5±0,1*
2,7 ± 0,2*
3,9 ± 0,2
Рвота
1,4±0,2*
1,6 ± 0,1*
2,8 ± 0,2
Общая слабость
8,4±0,4*
10,3 ± 0,3*
16,8 ± 0,8
Нормализация функциональных проб печени
15,1±1,1*
15,3 ± 1,2*
21,9 ± 1,5
Нормализация границ печени
17,9±1,4*
19,7 ± 1,2*
29,1 ± 1,7
Длительность а/б терапии
6,7±0,3*
7,5±0,1*
11,3±0,6
Средний койко-день
25,4±1,1*
27,2±1,3*
31,2±1,2
· - различия достоверны в сравнении с контрольной группой, p<0,05
Комплексное лабораторное обследование включало определение в динамике количества эритроцитов, тромбоцитов, лейкоцитов, гематологических показателей интоксикации, некоторых интегральных маркеров интоксикации – креатинина, мочевины, билирубина, активности аминотрансфераз, а также исследование основных провоспалительных цитокинов и иммунного статуса (комплекс тестов II уровня: определение Т-, В-лимфоцитов, а также их субпопуляций с помощью моноклональных антител; НСТ-тест, реакция бактериального фагоцитоза нейтрофилов с определением степени его завершенности и др.). Результаты лабораторных исследований представлены в таблицах 3.3.2 и 3.3.3.
Применение иммуномодулирующей терапии не оказывало существенного влияния на показатели эритроцитов крови больных, в то время как число тромбоцитов возрастало с 131,5±10,4 до 212,6±9,2, а имунофана- с 130,2±10,8 до 164,2±8,4 109/л.
Включение в комплексную терапию АФГ и имунофана с момента поступления больных в стационар через неделю приводило к достоверному снижению повышенного количества лейкоцитов периферической
Таблица 3.3.2. Влияние иммуноориентированной терапии на динамику интегральных маркеров интоксикации у больных с тяжелым течением лептоспироза
Показатели
Контрольная группа
(n=30)
I группа АФГ
(n=33)
II группа Имунофан
(n=30)
До лечения
Через неделю
До лечения
Через неделю
До лечения
Через неделю
Эритроциты
3,8±0,3
3,3±0,2‡
3,9± 0,1
3,4±0,1‡
4,0 ± 0,1
3,5±0,1‡
Тромбоциты
139,1±10,8
140,5±13,4
131,5 ± 10,4
212,6±9,2†
130,2 ± 10,8
164,2±8,4†
Лейкоциты
13,4±0,8
16,2±0,9†
13,7 ± 1,0
10,7±0,9‡
13,9 ± 0,9
11,3±0,5‡
СОЭ
43,8±2,8
45,6±1,2
38,8 ± 2,5
32,2±2,1‡
39,5 ± 1,8
34,2±1,2‡
ЛИ
0,46±0,02
0,20±0,03‡
0,20 ± 0,02
0,45±0,01†
0,21 ± 0,02
0,42±0,06†
ККП
4,9±0,5
5,5±0,8
5,82 ± 0,4
3,9±0,4‡
4,5 ± 0,3
3,6±0,3‡
ЛИИ
6,9±1,3
6,6±0,4
8,98 ± 0,6
5,2±0,6‡
7,4 ± 0,5
4,6±0,4‡
ГПИ
20,1±3,6
24,8±2,4
26,1 ± 2,5
9,2±2,4‡
16,6 ± 2,1
10,2±1,2‡
Мочевина
20,8±1,2
22,6±1,1
20,6 ± 1,5
9,3±1,3‡
20,9 ± 1,7
10,9±1,1‡
Креатинин
0,39±0,16
0,42±0,15
0,306 ± 0,13
0,260±0,23
0,311 ± 0,03
0,246±0,01‡
Билирубин
158,9±10,5
267,3±14,6†
203,9 ± 18,6
151,3±13,1‡
201,2 ± 16,7
152,4±13,9‡
АЛТ
60,7±6,7
68,2±5,4
83,6 ± 5,6
59,0±4,3‡
79,5 ± 6,8
61,3±5,3‡
АСТ
98,3±12,6
99,5±10,7
104,1 ± 7,3
68,8±8,4‡
98,8 ± 6,8
74,8±7,3‡
СМП
0,468±0,05
0,610±0,04†
0,454 ± 0,03
0,347±0,02‡
0,545 ± 0,05
0,369±0,06‡
ОКА
42,9±1,1
38,4±1,6‡
40,9 ± 1,2
43,6±1,3†
40,7 ± 1,1
45,1±1,3†
ЭКА
30,1±1,2
25,4±1,1‡
29,0 ± 1,1
33,6±1,2†
30,6 ± 1,3
34,5±1,4†
П р и м е ч а н и е: ‡ †- различия достоверны между значениями показателей в группах больных при поступлении и через неделю на фоне различных схем терапии (р<0,05)
Таблица 3.3.3. Влияние иммуноориентированной терапии на показатели свободнорадикального окисления и антирадикальной защиты у больных с тяжелым течением лептоспироза (M ± m)
Показатель
(ед.изм.)
Контрольная группа
(n=30)
I группа АФГ
(n=33)
II группа Имунофан
(n=30)
До лечения
Через неделю
До лечения
Через неделю
До лечения
Через неделю
АФК (у.е.)
4,1±0,32
5,5±0,47†
4,0±0,68
2,3±0,31‡*
3,9±0,92
3,3±0,25‡*¤
МДА (мкмоль/л)
22,2±1,21
29,5±0,75†
21,6±1,3
17,4±1,2‡*
23,5±1,3
19,3±1,4‡*
ДК (нмоль/мл)
152,1±3,75
284,1±5,63†
156,2±2,46
119,2±3,12‡*
153,8±3,42
139,4±3,91‡*¤
СОД (мкМ НТС /109 Эр/мин)
152,3±0,43
52,0±0,61‡
151,5±0,94
120,2±2,4‡*
149,6±2,7
131,5±3,1‡*¤
КА эр (ммоль Н2О2 /109 Эр/мин)
3,8±0,04
2,9±0,05‡
3,7±0,09
4,9±0,02†*
3,6±0,06
4,3±0,05†*¤
SH-группы (ммоль/л)
15,6±0,32
8,2±0,21‡
15,9±0,48
22,1±1,1†*
16,2±0,67
18,6±0,9†*¤
П р и м е ч а н и е: ‡ †- различия достоверны между значениями показателей в соответствующих группах больных при поступлении и через неделю на фоне различных схем терапии (р<0,05);
* - различия достоверны с показателями контрольной группы через неделю от начала терапии (р<0,05);
¤ - различия достоверны между значениями показателей в группах больных получавших АФГ и имунофан после лечения (р<0,05);
крови, СОЭ снижению уровня гематологических (ЛИИ, ККП, ГПИ) и других интегральных маркеров интоксикации (мочнвина, билирубин, СМП, ОКА, ЭКА). При этом исходно сниженный лейкоцитарный индекс Шагана (ЛИ) после получения недельного курса терапии АФГ и имунофаном приближался к норме (соответственно 0,20±0,02 до и 0,45±0,01 после; 0,21±0,02 до и 0,42±0,06 у.е. после).
После установления патогенетической и прогностической роли медиаторов воспаления и оксидантного стресса при лептоспирозе, наряду с исследованием иммунного статуса нами проведено исследование для определения влияния АФГ и имунофана на систему СРО-АРЗ и синтез провоспалительных цитокинов в процессе лечения (табл. 3.3.4-3.3.5). Выявлено, что назначение иммуноориентированной терапии (производные АФГ, имунофан) существенно снижают экспрессию активных форм кислорода в остром периоде заболевания, в то время как на фоне стандартной терапии у больных лептоспирозом на 1-2 неделях болезни происходит усиление процессов липопероксидации и нарушения ферментативного и неферментативного звеньев антиоксидантной системы. Через неделю применения АФГ генерация АФК снижается в 1,7 раза, имунофана – в 1,2 раза (соответственно 4,0±0,68 и 3,9±0,25 до назначения препаратов и 2,3±0,31 и 3,3±0,25 у.е. после их назначения, p<0,05). Уровень МДА достоверно снижался с 21,6±1,3 до 17,4±1,2 при назначении АФГ и с 23,5±1,3 до 19,3±1,4 мкмоль/л при назначении имунофана, в то время как в контрольной группе продолжалось его увеличение с 22,2±1,21 до 29,5±0,75 мкмоль/л. Аналогичные изменения происходили с концентрацией ДК – достоверное снижение с 156,2±2,46 до 119,2±3,12 нмоль/л при назначении АФГ и с 153,8±3,42 до 139,4±3,91 нмоль/л при назначении имунофана (p<0,05). В контрольной группе в это же время происходило нарастание ДК в 1,9 раза.
В начальном периоде заболевания в ответ на усиление СРО происходят разнонаправленные изменения ферментов АОС. К примеру активность важнейшего фермента АОС супероксиддусмутазы эритроцитов, устраняющего супероксидный радикал путем образования Н2О2 и тем самым блокирующего ПОЛ на стадии инициации, при тяжелом течении лептоспироза компенсаторно повышается, в среднем 28% выше показателя здоровых лиц. Активность каталазы эритроцитов также повышается у больных лептоспирозом при легком и среднетяжелом течении. У больных с тяжелым течением лептоспироза отмечалось истощение активности фермента к концу первой неделе болезни. Это являлось неблагоприятным признаком, поскольку КАэр не только устраняет перекись водорода, но и обеспечивает инициацию процессов оксигенации гемоглобина, а также участвует в обеспечении антибактериальной защиты организма. Депрессия энзимной активности у больных с тяжелым течением лептоспироза приводила к углублению гипоксии и усилению синдрома эндогенной интоксикации, характерного для острого периода заболевания. Назначение иммуноориентированной терапии у больных с тяжелым течением лептоспироза демонстрировало регуляторное её воздействие на активность указанных ферментов: снижало повышенную активность СОД до интервала нормальных значений (с 151,5± 0,9 до 120,2±2,4 при назначении АФГ и с 149,6±2,7 до 131,5± 3,1 мкМ НТС/ 10 9 Эр/мин при назначении имунофана при показателе активности СОД в группе здоровых лиц 118,3 ± 0,21). У больных, получавших стандартную терапию в эти же сроки, наблюдалось угнетение активности СОД в 3,0 раза. Позитивное влияние АФГ, имунофана было отмечено на регуляцию активности КАэр. При исходно сниженной активности фермента на фоне применения имуноориентированной терапии ее показатели приближались к диапазону нормальных значений: с 3,7±0,09 до 4,9±0,02 при применении АФГ и с 3,6±0,06 до 4,3±0,05 ммоль Н2О2/ 109 Эр/мин при применении имунофана (p<0,05).
При тяжелом течении лептоспироза значительно страдает и неферментативное звено АОС. Его угнетение является результатом воздействия продуктов липопероксидации на мембраны эритроцитов, и маркером окислительной модификации белков в силу недостатка водородных эквивалентов, поставляемых Г-6-ФДГ, а также происходящими катаболическими процессами и нарушением синтеза белка. При включении в комплексную терапию АФГ, имунофана происходит достоверное увеличение содержания SH-групп до диапазона нормальных значений, в то время как при стандартной терапии происходит дальнейшее углубление процесса окислительной модификации со снижением SH-групп.
Таким образом, применение имуноориентированной терапии оказывает позитивное влияние на процессы СРО-АРЗ.
Тяжелое течение лептоспирозной инфекции характеризуется изменениями клеточного и гуморального иммунитета, в связи с чем необходимым звеном патогенетически обоснованной активной неспецифической иммунотерапии должно стать применение полимодальных иммуноориентированных препаратов. Изучение иммунного статуса больных, получавших в комплексной терапии АФГ (табл. 3.3.6), показало достоверное влияние его на клеточное звено иммунитета: снижение содержания общего количества Т-лимфоцитов при снижении количества CD4 (+) и CD8(+)-лимфоцитов, увеличение количества В-лимфоцитов. При применении имунофана (табл. 3.3.7) выявлены иные эффекты на клеточный иммунитет: достоверное увеличение количества Т-лимфоцитов, CD4 (+) и
Таблица 3.3.4 Влияние аминофталгидразидов на синтез провоспалительных цитокинов, состояние микробицидных систем нейтрофильных гранулоцитов и фагоцитарную функцию нейтрофилов у больных с тяжелым течением лептоспироза
Показатель
Форма предст.
Здоровые лица
Контрольная группа (n=30)
Больные получавшие АФГ (n=33)
До лечения
Через 1 нед
До лечения
Через 1 нед
IL-1ß
пг/мл
3,1±0,15
25,6±1,2
31,7±1,8
26,5±1,3
6,5±1,2‡*
IL-6
пг/мл
0,6±0,02
6,9±0,2
9,7±0,4
6,8±0,7
1,2±1,1‡*
TNF-α
пг/мл
14,5±0,25
168,2±1,3
184,7±1,6
154,9±1,2
54,8±3,8‡*
НСТ сп.
у.е.
15,6±2,62
13,3 ± 1,8
12,0±1,0
13,0 ± 1,2
17,9±1,4†*
НСТ ст.
у.е.
43,7±2,81
33,5 ± 2,1
28,5±2,4
31,5 ± 3,6
42,8±2,5†*
ИС
абс. ед.
1,8±0,05
1,8 ± 0,02
1,7±0,02
1,9 ± 0,02
1,8±0,02‡*
ФЧ
3,3±0,13
1,5 ± 0,5
1,1±0,4
1,5 ± 0,3
2,6±0,2†*
ФИ
1,9±0,06
1,3 ± 0,02
1,1±0,01
1,4 ± 0,02
1,9±0,02†*
% Ф
55,6±1,2
38,9 ± 3,5
36,3±3,1
39,1 ± 2,9
47,9±2,6†*
% П
74,1±2,19
59,1 ± 3,5
56,1±2,3
56,4 ± 3,6
65,1±2,3†*
ИП
1,9±0,05
1,4 ± 0,02
1,3±0,01
1,5 ± 0,01
1,8±0,02†*
П р и м е ч а н и е: * - различия достоверны между значениями показателей в группе больных, получавших АФГ и контрольной группы (р<0,05); †‡ - различия достоверны между значениями показателей до и после лечения в группе больных, получавших АФГ (р<0,05)
Таблица 3.3.5 Влияние имунофана на синтез провоспалительных цитокинов, состояние микробицидных систем нейтрофильных гранулоцитов и фагоцитарную функцию нейтрофилов у больных с тяжелым течением лептоспироза
Показатель
Форма предст.
Здоровые лица
Контрольная группа (n=30)
Больные, получавшие имунофан (n=30)
До лечения
Через 1 нед
До лечения
Через 1 нед
IL-1ß
пг/мл
3,1±0,15
25,6±1,2
31,7±1,8
24,9±2,4
10,3±1,6‡*
IL-6
пг/мл
0,6±0,02
6,9±0,2
9,7±0,4
6,5±0,4
1,9±1,2‡*
TNF-α
пг/мл
14,5±0,25
168,2±1,3
184,7±1,6
162,6±2,4
65,9±4,1‡*
НСТ сп.
у.е.
15,6±2,62
13,3 ± 1,8
12,0±1,0
12,1±1,5
16,2±1,3†*
НСТ ст.
у.е.
43,7±2,81
33,5 ± 2,1
28,5±2,4
30,7±2,8
43,2±2,1†*
ИС
абс. ед.
1,8±0,05
1,8 ± 0,02
1,7±0,02
2,0±0,01
1,75±0,03‡*
ФЧ
3,3±0,13
1,5 ± 0,5
1,1±0,4
1,4±0,2
2,9±0,3†*
ФИ
1,9±0,06
1,3 ± 0,02
1,1±0,01
1,26±0,01
1,85±0,02†*
% Ф
55,6±1,2
38,9 ± 3,5
36,3±3,1
36,8±1,9
49,4±2,1†*
% П
74,1±2,19
59,1 ± 3,5
56,1±2,3
58,7±2,8
67,2±3,1†*
ИП
1,9±0,05
1,4 ± 0,02
1,3±0,01
1,45±0,02
1,8±0,02†*
П р и м е ч а н и е: * - различия достоверны между значениями показателей в группах больных, получавших имунофан и контрольной группы (р<0,05); †‡ - различия достоверны между значениями показателей в группах больных, получавших имунофан до и после лечения (р<0,05)
Таблица 3.3.6 Изменение показателей клеточного и гуморального иммунитета у больных с тяжелым течением лептоспироза на фоне применения аминофталгидразидов
Показатель
Форма предст.
Здоровых лиц
Контрольная группа (n=30)
Больные получавшие АФГ (n=33)
До лечения
Через 1 нед
До лечения
Через 1 нед
CD3
%
58,7±1,24
45,3 ± 2,2
42,8±2,0
45,6 ± 1,1
41,3±1,7‡
109/л
1,22±0,06
0,76 ± 0,04
0,79±0,01
0,84 ± 0,01
0,72±0,02‡*
CD19
%
16,7±0,34
19,0 ± 1,6
19,7±1,8
14,8 ± 1,1
19,8±1,2†
109/л
0,23±0,01
0,3 ± 0,04
0,2±0,04
0,2± 0,02
0,4±0,01†
CD4
%
40,3±2,06
33,7 ± 2,7
30,3±1,9
37,9 ± 1,2
34,1±1,2‡
109/л
0,85±0,05
0,6 ± 0,01
0,5±0,05
0,7 ± 0,01
0,5±0,05‡
CD8
%
19,6±0,51
12,3 ± 1,2
10,6±1,1
11,8 ± 1,2
8,3±1,1‡
109/л
0,43±0,04
0,21 ± 0,01
0,18±0,01
0,22 ± 0,01
0,17±0,02‡
ИРИ
2,96±0,10
2,7± 0,1
2,8±0,1
3,3 ± 0,1
4,2±0,2†*
Ig A
г/л
1,9±0,14
1,6 ± 0,1
1,4±0,1
1,5 ± 0,1
1,9±0,1†*
Ig M
г/л
2,0±0,14
1,7 ± 0,1
1,6±0,1
1,6 ± 0,1
1,9±0,1†*
Ig G
г/л
11,5±0,36
8,3 ± 0,4
8,5±0,2
8,1 ± 0,3
7,5±0,4
ЦИК
ед.экст.
0,03±0,002
0,293 ±0,03
0,360±0,02
0,295 ±0,02
0,168±0,03‡*
П р и м е ч а н и е: * - различия достоверны между значениями показателей в группе больных, получавших АФГ и контрольной группы (р<0,05), †‡ - различия достоверны между значениями показателей до и после лечения в группе больных, получавших АФГ (р<0,05)
Таблица 3.3.7 Изменение показателей клеточного и гуморального иммунитета у больных с тяжелым течением
лептоспироза на фоне применения имунофана
Показатель
Форма предст.
Здоровые лиц
Контрольная группа (n=30)
Больные, получавшие имунофан (n=30)
До лечения
Через 1 нед
До лечения
Через 1 нед
CD3
%
58,7±1,24
45,3 ± 2,2
42,8±2,0
49,6±1,8
54,9±1,2†*
109/л
1,22±0,06
0,76 ± 0,04
0,79±0,01
0,88±0,03
1,1±0,01†*
CD19
%
16,7±0,34
19,0 ± 1,6
19,7±1,8
17,9±1,4
16,8±1,6
109/л
0,23±0,01
0,3 ± 0,04
0,2±0,04
0,3±0,03
0,2±0,02
CD4
%
40,3±2,06
33,7 ± 2,7
30,3±1,9
35,4±1,3
39,5±1,4†*
109/л
0,85±0,05
0,6 ± 0,01
0,5±0,05
0,6±0,01
0,75±0,02†*
CD8
%
19,6±0,51
12,3 ± 1,2
10,6±1,1
11,6±2,2
17,9±1,7†*
109/л
0,43±0,04
0,21 ± 0,01
0,18±0,01
0,19±0,02
0,31±0,03†*
ИРИ
2,96±0,10
2,7± 0,1
2,8±0,1
3,2±0,1
3,6±0,1†*
Ig A
г/л
1,9±0,14
1,6 ± 0,1
1,4±0,1
1,3±0,2
1,8±0,1†*
Ig M
г/л
2,0±0,14
1,7 ± 0,1
1,6±0,1
1,6±0,1
1,9±0,1†*
Ig G
г/л
11,5±0,36
8,3 ± 0,4
8,5±0,2
7,9±0,9
8,2±0,2
ЦИК
ед.экст.
0,03±0,002
0,293 ±0,03
0,360±0,02
0,310±0,06
0,165±0,04‡*
П р и м е ч а н и е: * - различия достоверны между значениями показателей в группе больных, получавших имунофан, и контрольной группы (р<0,05); †‡ - различия достоверны между значениями показателей до и после лечения в группе больных, получавших имунофан (р<0,05)
CD8(+)-лимфоцитов, отсутствие достоверных изменений содержания В-лимфоцитов. Различие воздействия препаратов на показатели клеточного иммунитета, вероятнее всего, связано с фазами действия имунофана, действие которого развивается в течение 2-3 часов (быстрая фаза) и продолжается до 4 месяцев (средняя и медленная фазы). Согласно литературным данным в течение быстрой фазы (продолжительностью до 2-3 суток) проявляется прежде всего детоксикационный и антиоксидантный эффекты препарата. В течение средней фазы (начинается через 2-3 суток, продолжительность до 7-10 суток) и медленной фазы (начинает развиваться на 7-10 сутки, продолжительность до 4 месяцев) происходит усиление реакций фагоцитоза и проявляется иммунорегуляторное действие препарата – восстановление нарушенных показателей клеточного иммунитета [Лебедев В.В. и соавт., 1992; Покровский В.И. и соавт., 1992].
Отмечено однонаправленное действие АФГ и имунофана на показатели гуморального иммунитета: достоверное увеличение концентрации Ig А и М, снижение содержания ЦИК.
Одним из важнейших медиаторов иммуногенеза при лептоспирозе является TNF-α, продуцируемый макрофагами и Т-клетками. Резкое увеличение продукции TNF-α, как медиатора воспаления, служит одной из причин нарушения сосудистой проницаемости, развития системной воспалительной реакции и расстройства иммунной реакции организма у больных лептоспирозом.
Изучено влияние иммуноориентированной терапии на синтез провоспалительных цитокинов, состояние микробицидных систем нейтрофильных гранулоцитов и фагоцитарную функцию нейтрофилов у больных с тяжелым течением лептоспироза (табл. 3.3.6, 3.3.7). Показано достоверное снижение синтеза провоспалительных цитокинов из гиперактивированных макрофагов на фоне применения различных схем иммуноориентированной терапии: применение АФГ, имунофана позволило снизить концентрацию в крови больных лептоспирозом TNF-α в 2,5-2,8 раза, IL-1ß в 2,4-4,1 раза, IL-6 в 3,4-5,7 раза.
Назначение АФГ, имунофана положительно влияло на активность микробицидной системы нейтрофилов. До назначения препаратов показатель % ФПК (спонтанный НСТ-тест) у больных лептоспирозом был равен 13,0±1,2 и 12,1±1,5 у.е., после окончания курса лечения – 17,9±1,4 и 16,2±1,3 у.е. соответственно. В настоящем исследовании также установлено, что на фоне применения АФГ, имунофана достоверно улучшаются показатели фагоцитоза: ФЧ с 1,5±0,3 до 2,6±0,2 и 1,4±0,2 до 2,9±0,3 соответственно, ФИ с 1,4±0,02 до 1,9±0,02 на фоне применения АФГ и с 1,26±0,01 до 1,85±0,02 на фоне имунофана. Процент фагоцитоза при применении АФГ увеличивался с 39,1±2,9 до 47,9±2,6, а при применении имунофана с 36,8±1,9 до 49,4±2,1.
Таким образом, оптимизация терапии тяжелых форм лептоспироза с применением иммуноориентированных препаратов (АФГ, имунофан) была эффективной и свидетельствовала о целесообразности их применения с первых дней госпитализации больных в стационар. Выявленные положительные эффекты препаратов: детоксикационный, антиоксидантный, ингибирующий синтез провоспалительных цитокинов гиперактивированных макрофагов позволяют воздействовать на ведущие звенья патогенеза лептоспироза.
3.4. Применение системной энзимотерапии у больных лептоспирозом
Системная энзимотерапия (СЭТ) представляет собой терапевтический метод, основанный на применении комбинированных энзимных препаратов (гидролаз), которые частично связываются в пищеварительном тракте и оказывают системное воздействие на организм. Среди наиболее изученных эффектов СЭТ следует отметить противовоспалительный, иммуномодулирующий, анальгетический, фибринолитический и тромболитический и потенцирующий эффекты. Установлено, что резорбированные энзимы, попадая в кровь, оказывают направленное фармакологическое воздействие. При их непосредственном участии уменьшается инфильтрация плазматическими белками интерстиция, увеличивается элиминация белкового детрита и депозитов фибрина в зоне воспаления, уменьшается гидрофильность тканей. Это, в свою очередь, обеспечивает восстановление микроциркуляции, утилизацию продуктов воспаления, а также улучшение снабжения тканей кислородом [Ющук Н.Д. и соавт., 2002].
Под нашим наблюдением находилось 60 больных тяжелой желтушной формой иктерогеморрагического лептоспироза. Больным основной группы (группа А, n=30) в комплексной терапии (как компонент бустер-терапии) был назначен Вобэнзим (регистрационный номер П № 011530/01-1999 от 30.11.1999, производитель MUCOS Pharma GmbH&Co., Германия), в состав которого входят энзимы растительного и животного происхождения в оптимально подобранных комбинациях и концентрациях (в 1 таблетке, покрытой кишечнорастворимой оболочкой содержатся бромелайн 45 мг., папаин 60 мг., панкреатин 100 мг., химотрипсин 1 мг., трипсин 24 мг., амилаза 10 мг., липаза 10 мг., рутозид 50 мг). Препарат относится к следующим фармгруппам - антиагреганты (2.1), иммуномодуляторы (6.4), ненаркотические анальгетики (10).
Препарат назначался (при количестве тромбоцитов в крови не ниже 40х109/л.) первые 5 дней пребывания в стационаре в дозе от 5 до 8 таблеток 3 раза в день. В последующем пациенты получали СЭТ в поддерживающей дозе (однократно 3 таблетки в сутки) до 1 месяца, в среднем 23,1±7,3 сут. Контрольная группа больных (группа В, n=30) получала традиционную интенсивную терапию. У пациентов обеих групп изучались клинико-лабораторные показатели интоксикации (СМП, ЛИИ, ГПИ, ОКА и ЭКА), функциональной активности печени, показатели СРО и активность некоторых ферментов антиоксидантной системы (АОС) эритроцитов (каталаза, Г-6-ФДГ, СОД). Проводился мониторинг показателей гемостаза и иммунного статуса. В обеих группах изучались исходные основные лабораторные показатели (до начала лечения) и через 6 дней от начала проводимой терапии.
Было установлено, что в группе больных, получивших полный курс СЭТ, продолжительность клинических признаков интоксикации (лихорадка, головная боль, тошнота, рвота, общая слабость, миалгии) была меньше в 1,4-1,7 раза (табл. 7.2.1.1).
Таблица 3.4.1 Клиническая эффективность системной энзимотерапии
Наименование признаков
Продолжительность (сут.)
Основная группа
Контрольная группа
Лихорадка
4,0 ± 0,1
5,6 ± 0,2*
Головная боль
3,2 ± 0,2
4,5 ± 0,3*
Миалгии
5,0 ± 0,4
7,2 ± 0,3*
Тошнота
2,8 ± 0,1
3,9 ± 0,2*
Рвота
1,7 ± 0,1
2,8 ± 0,2*
Общая слабость
10,3 ± 0,3
16,8 ± 0,8*
Нормализация функциональных проб печени
16,0 ± 1,1
21,9 ± 1,5*
Нормализация границ печени
20,8 ± 1,3
29,1 ± 1,7*
Длительность а/б терапии
7,8±0,2
11,3±0,6*
* - достоверность различия в сравниваемых группах, p<0,05
Среди других позитивных клинических эффектов в группе больных, получавших Вобэнзим, следует отметить более раннюю нормализацию границ печени и ее функциональных проб (p<0,05). Клиническая эффективность включения в комплексную терапию Вобэнзима, подтверждена положительной динамикой интегральных маркеров интоксикации (табл. 7.2.1.2). Достоверное снижение на фоне приема ВОБЭНЗИМА гематологических показателей интоксикации, уровня СМП, возрастание ОКА и ЭКА и наличие достоверных различий с контрольной группой (p<0,05) свидетельствует о присутствии детоксицирующего эффекта СЭТ.
У больных лептоспирозом при назначении ВОБЭНЗИМА снижалась интенсивность процессов свободнорадикального окисления, возрастал антиоксидантный потенциал крови. В остром периоде болезни активность ферментов АРЗ в основной группе нормализовалась, в среднем на 3,1 суток раньше, чем в контрольной группе больных.
Влияние СЭТ на некоторые лабораторные показатели интоксикации, оксидантного стресса и иммунного статуса у больных лептоспирозом представлено в таблице 7.2.1.2. При включении в терапию ВОБЭНЗИМА у больных лептоспирозом достоверно снижалась генерация АФК (2,9±0,4 против 4,8±0,3 у.е. у лиц не получавших СЭТ), интенсивность перекисного окисления липидов (МДА 15,1±1,1 против 64,6±2,3 мкмоль/л; ДК 106,6±4,9 против 608,6±22,7 нмоль/л в контрольной группе). При снижении интенсивности липопероксидации в основной группе пациентов, получавших СЭТ, в контрольной происходило дальнейшее усиление ПОЛ. Назначение ВОБЭНЗИ МА существенно не влияло на активность таких ферментов АОС как каталаза эритроцитов Г-6-ФДГ. Угнетение активности СОД у больных, получавших СЭТ, было достоверно меньше, чем не получавших ВОБЭНЗИМ (58,5±1,2 против 50,4±0,6 мкМ НТС/109 Эр/мин). У больных, получавших СЭТ активность СДГ возросла в сравнении с исходными данными, в то время, как в группе больных без СЭТ она оставалась в прежних значениях (68,5±2,4 против 47,4±0,3 мкМ НТС/109 Эр/мин). Назначение ВОБЭНЗИМА приостанавливало процессы окислительной модификации белков, что находило отражение в изменении SH-групп (10,4±0,3 против 8,3±0,1 ммоль/л у лиц, не получавших СЭТ).
Кроме того, в результате исследования у больных лептоспирозом было отмечено позитивное воздействие СЭТ на показатели фибринолитической активности и реологию крови. У больных, получавших ВОБЭНЗИМ, увеличивалось АПТВ, содержание антитромбина III в 1,2-1,3 раза. Количество тромбоцитов возрастало в 1,4 раза, показатель гематокрита приходил к нормальным показателям к исходу основного курса терапии.
Мониторинг иммунологических показателей у больных, получавших СЭТ, выявил достоверное снижение уровня ЦИК периферической крови (0,10±0,01 против 0,14±0,01 у.е. до назначения ВОБЭНЗИМА), в то время как в контрольной продолжался рост концентрации ЦИКов (с 0,12±0,02 до 0,138±0,03 у.е. через неделю стандартной терапии). Уже к концу первой недели приема ВОБЭНЗИМА возрастал уровень Ig М и G, увеличивалась активности макрофагов, улучшались показатели фагоцитоза. У больных, получавших СЭТ, отмечено достоверное увеличение в 1, 3 раза относительного и абсолютного количества Т-лимфоцитов. Положительные тенденции отмечены в отношении увеличения числа моноцитов, абсолютного и относительного содержания CD8+, снижения количества лейкоцитов.
Таблица 3.4.2 Влияние системной энзимотерапии на показатели синдрома интоксикации и оксидантного стресса и иммунного статуса у больных лептоспирозом
Показатель
(ед. изм.)
Нормальные
значения
Исходные значения
Через 6 сут. лечения
Группа А
n=30
Группа В
n=30
Группа А
n=30
Группа В
n=30
ЛИИ
0,62±0,09
8,1±1,0
7,7±1,0
5,3±0,9 ‡
8,6±0,96 ¤
СМП
240,0±2,22
640,7±28,4
652,1±25,6
521,3±14,8‡
635,5±22,1 ¤
ОКА
52,0±0,51
37,6±1,9
38,4±0,9
49,6±1,2 †
45,2±1,1†¤
ЭКА
44,0±0,52
26,7±1,2
27,2±1,3
32,4±1,2†
31,4±1,5†
АФК
1,90±0,04
3,9±0,3
4,6±0,3
2,9±0,2‡
4,8±0,3¤
МДА
3,34±0,1
37,7±1,1
35,9±1,8
15,1±1,1‡
64,6±2,3†¤
ДК
62,38±0,77
299,9±8,6
299,3±9,0
106,6±4,9‡
608,6±22,7†¤
КАэр
4,3±0,05
3,9±0,1
3,7±0,06
3,9±0,1
3,6±0,06
КАгем
56,40±0,01
50,4±0,4
49,7±0,6
52,8±0,2†
49,1±0,6¤
СОД
118,40±0,20
47,8±0,9
49,6±0,6
58,5±1,2†
50,4±0,6¤
СДГ
136,8±0,31
49,6±1,3
47,5±0,2
68,5±2,4†
47,4±0,3¤
Г-6-ФДГ(эр)
26,13±0,45
15,9±1,9
16,1±0,5
17,5±0,6
16,4±0,5
SH-группы
21,68±0,04
9,1±0,9
8,2±0,1
10,4±0,3†
8,3±0,1¤
ЦП
354,0±3,18
536,6±17,8
513,2±22,9
425,1±17,2‡
482,3±19,1¤
Тромбоциты
265,0±1,81
108,5±1,2
110,9 ± 1,3
151,9±1,1†
128,7 ± 3,5†¤
ЦИК
0,03±0,002
0,14±0,01
0,12±0,02
0,10±0,01‡
0,138 ± 0,03†¤
Ig M
2,0±0,14
1,5±0,02
1,5±0,03
1,8±0,01†
1,6±0,07¤
Ig G
11,5±0,36
8,5±0,04
8,5±0,03
9,8±0,03†
8,6±0,06¤
Т-лимфоц. (%)
58,7±1,24
39,3±3,4
37,3±2,4
49,7±1,5†
42,2±1,7¤
Абс.
1,22±0,06
0,79±0,06
0,83±0,07
0,99±0,02†
0,86±0,05
Примечание:
†‡ – различия достоверны до и после лечения;
¤ – различия достоверны между группами А и В после лечения (p<0,05)
Однако достоверных изменений других показателей клеточного иммунитета на фоне назначения СЭТ нами не выявлено.
В группе больных, получавших СЭТ, положительная динамика клинико-лабораторных данных позволила сократить длительность проведения антибактериальной терапии и применения глюкокортикостероидов, в среднем на 2,4 и 1,8 дней соответственно. В периоде ранней реконвалесценции, у лиц перенесших критическое состояние, достоверно реже развивались вторичные бактериальные осложнения и дисбиоз кишечника (p<0,05). Побочных действий и нежелательных эффектов при приёме препарата отмечено не было.
Таким образом, полимодальность воздействия СЭТ на организм больных лептоспирозом позволяет сделать вывод, что использование Вобэнзима в комплексном лечении тяжелых форм заболевания патогенетически обосновано и демонстрирует многосторонний системный эффект (противовоспалительный, дезинтоксикационный, иммуномодулирующий, гемореологический, окислительнорегулирующий). Оказывая существенное влияние на эффективность проводимой терапии, СЭТ может рассматриваться как важный компонент «терапии усиления».
3.5. Результаты оптимизации интенсивной терапии лептоспироза в ГУЗ "СКИБ" департамента здравоохранения Краснодарского края
За период 1982-2006 гг. в ГУЗ «Специализированная клиническая инфекционная больница» департамента здравоохранения Краснодарского края проведено лечение 2172 больных лептоспирозом. В результате постоянного совершенствования комплексной терапии летальность больных лептоспирозом за этот период существенно снизилась (таб. 3.5.1).
Таблица 3.5.1. Эффективность лечения больных лептоспирозом на фоне оптимизации методов интенсивной терапии
Годы
Группа больных
Число больных
Летальность
Абс. число
%
1982–1988
Все больные
358
19
5,3
Больные с тяжелым течением (36,8 %)
132
19
14,4
1989–1998
Все больные
1029
33
3,2
Больные с тяжелым течением (54,3 %)
559
33
5,9
1999–2006
Все больные
785
11
1,4
Больные с тяжелым течением (67,5 %)
530
11
2,1
В 1982–1988 гг. в больнице находилось на лечении 358 больных лептоспирозом, тяжелая форма заболевания имела место у 132 (36,9%). В то время в больнице отсутствовало отделение интенсивной терапии и реанимации и не использовались эфферентные методы терапии. Умерло 19 человек, летальность среди всех больных составила 5,3%, при тяжелой форме - 14,4%.
В 1989–1998 гг. (после организации ОРИТ и внедрения в практику лечения больных лептоспирозом эфферентных методов детоксикации) проведено лечение 1029 больным лептоспирозом, из них с тяжелой формой болезни – 559 (54,3 %). В этой период умерло 33 больных. Летальность среди всех больных была 3,2 %, при тяжелой форме – 5,9 %.
В 1999–2006 гг. пролечено 785 больных лептоспирозом, из них с тяжелым течением 530 человек (67,5%). В течение последнего периода были внедрены современные методы лабораторной и инструментальной диагностики нарушений основных звеньев гомеостаза, стали применяться шкалы объктивной оценки тяжести и функционального состояния пациентов, стадий эндогенной интоксикации. Оптимизированы схемы интенсивной терапии с использованием иммуноориентированных препаратов, гемокорректоров, корректоров метаболического статуса, усовершенствованы подходы к применению эфферентных методов терапии. За этот период умерло 11 больных лептоспирозом. Общая летальность снизилась до 1,4%, а при тяжелых формах болезни до 2,1%.
Длительность стационарного лечения в 1982–1988 гг. у больных лептоспирозом, в среднем, составляла 23,3±1,0, в 1989–1998 гг. – 23,1±0,9, в 1999–2006 гг. – 21,1±0,5 дня. То есть, средняя продолжительность лечения больных в стационаре снизилась на 2 койко-дня, однако также следует учитывать, что число больных с тяжелыми формами лептоспироза, госпитализированных в больницу за период наблюдения, увеличивалось с 36,8 до 67,5%.
Таким образом, применение комплексной упреждающей интенсивной терапии с использованием оптимизированных схем лечения позволило снизить летальность при тяжелых формах лептоспироза в ГУЗ «Специализированная клиническая инфекционная больница» департамента здравоохранения Краснодарского края в 2,8 раза – с 5,9 до 2,1%, а общую летальность от лептоспироза в 2,3 раза – с 3,2 до 1,4%.
Заключение
Лечение тяжелых форм лептоспироза представляет определенные сложности и главной её целью должно быть профилактика и купирование развивающейся полиорганной недостаточности. Оптимизация лечения тяжелых форм лептоспироза предполагает влияние на все составляющие инфекционного процесса, а конкретным направлением терапии должно быть одновременной воздействие на возбудитель и его токсины, реактивность организма, отдельные звенья патогенеза. Этим подходом определяется принцип комплексности терапии. Другим принципом должно стать индивидуализация лечения. В разные периоды болезни у больных может существенно меняться удельный вес каждого из трех направлений терапии. Не менее важным является необходимость как можно более раннего начала лечения.
Этиотропная терапия рассматривается традиционно как воздействие на возбудитель и его токсины, и включало в себя, главным образом, использование антибиотиков. В настоящее время включение в комплекс лечебных мероприятий методов эфферентной терапии позволяет связывать и удалять не только микробные токсины, но и сами микроорганизмы. Рационализация антибактериальной терапии (снижение её продолжительности, курсовой дозы, побочных эффектов) может быть достигнута с помощью «терапии усиления».
Синдром эндогенной интоксикации (СЭИ) является показателем тяжести состояния больных, выбора адекватного лечения и прогноза заболевания. Его течение и исход существенным образом зависят от успешной дезинтоксикационной терапии. Однако, широко применяемые традиционные методы (инфузионно-трансфузионная терапия, гемодилюция, форсированный диурез) не всегда приводят к разрешению его симптомов, что связано с ограниченными детоксикационными возможностями указанных методов, либо с наличием противопоказаний для их применения. Применение методов ЭКДГ способно прервать формирование «порочных кругов» поражения органов и тканей организма аномальными продуктами иммунного ответа или экспрессированными таким ответом медиаторами. В подавляющем большинстве случаев вмешательство целесообразно проводить на ранних сроках инфекционного процесса, до развития тяжелых органных, системных поражений. Циклическое течение инфекционного процесса при лептоспирозе предопределяет возможность раннего эфферентного воздействия, направленного на предотвращение закономерно ожидаемых органных и системных поражений. При этом следует отметить, что степень реализации традиционной консервативной терапии не должна рассматриваться как фактор, определяющий необходимость подключения к терапии методов ЭКДГ. Основными показаниями к применению методов ЭКДГ являются «традиционные» синдромы и состояния: субкомпенсированный или декомпенсированный эндотоксикоз (по классификации стадий СЭИ), угроза развития или развитие системных и (или) органных поражений (СОПЛ, ОПН, ОППН и др.).
Важную роль в терапии тяжелых форм лептоспироза, позволяющую существенно повысить качество лечения больных, играет комплекс методов лечения, направленных на коррекцию нарушений тканевого метаболизма, в первую очередь связанных с гипоксией и ее последствиями. На сегодня известно, что гипоксия и, связанная с ней ишемия тканей вызывают развитие патохимических каскадных реакций и блокируют образование энергии в метаболических путях. В связи с чем, комплексная терапия должна включать в себя коррекцию гипоксии и оксидантного стресса. Повреждающее действие свободных радикалов базируется не только на нарушении структуры и функций мембран, но и на аутоиммунной агрессии, которая является одним из первых шагов к развитию реакции системного воспаления. Это обусловливает максимально раннее применение антиоксидантов и антигипоксических препаратов.
Применение субстратного антигипоксанта «Реамберина» в комплексной терапии тяжелых форм лептоспироза снижает интенсивность липопероксидации и повышает активность систем антиоксидантной защиты. Реамберин оказывает не только энергостимулирующее воздействие, но и способствует уменьшению клеточной гипоксии, коррекции метаболических расстройств у больных лептоспирозом. Метаболическое сопровождение нутритивной поддержки с помощью реамберина у больных лептоспирозом с полиорганной недостаточностью позволяло ликвидировать тканевую гипоксию, уменьшить гиперлактатемию, гиперкатаболизм белка и повысить эффективность и безопасность парентерального и энтерального питания. Полученные результаты свидетельствуют о безопасности, эффективности и перспективности базисной инфузионной терапии реамберином при критических состояниях.
Важным направлением комплексной терапии тяжелых форм лептоспироза является коррекция возникающих гемостазиологических расстройств. Использование в комплексе интенсивной терапии ДВС-синдрома НМГ позволяет стабилизировать уровень АТ III, тромбоцитов, снизить интенсивность микротромбирования сосудов органов и тканей.
Существенную роль в патогенезе тяжелых осложненных форм лептоспироза играют нарушения в специфическом и врожденном иммунитете. Лептоспиры и их метаболиты вызывают подавление либо истощение функций иммунитета и развитие вторичной иммунной недостаточности, поэтому средства иммуноориентированной терапии – необходимый компонент лечения больных лептоспирозом. Назначение таким больным производных фталгидразидов (галавит, тамерит) с противовоспалительным и иммуномодулирующим действием в дозе 100 мг/мл и иммунорегуляторного пептида имунофана в дозе по 1.0 мл 0,005% раствора приводило к достоверному уменьшению синтеза провоспалительных цитокинов. Кроме того, благоприятное воздействие производных фталгидразидов и имунофана на функционально-метаболическую активность лейкоцитов, бактерицидную систему нейтрофилов позволяют рекомендовать их к широкому применению в стартовой комплексной патогенетической терапии лептоспироза.
Полимодальность воздействия системной энзимотерапии на организм больных лептоспирозом позволяет сделать вывод, что использование вобэнзима в комплексном лечении тяжелых форм лептоспироза патогенетически обосновано и демонстрирует многосторонний системный эффект (противовоспалительный, дезинтоксикационный, иммуномодулирующий, гемореологический, окислительнорегулирующий). Использование СЭТ у больных лептоспирозом позволило достоверно сократить продолжительность проявлений синдрома эндогенной интоксикации, выраженность и продолжительность поражения печени, а также длительность антибактериальной терапии в среднем на 3,5 дня.
Применение оптимизированных схем лечения больных лептоспирозом в ГУЗ «Специализированная клиническая инфекционная больница» департамента здравоохранения Краснодарского края позволило снизить летальность при тяжелых формах заболевания в 2,8 раза – с 5,9 до 2,1%, а общую при этой болезни в 2,3 раза – с 3,2 до 1,4%. Средняя продолжительность лечения больных лептоспирозом в стационаре уменьшилась на 2 койко-дня.
Литература
1. Авдеева М.Г. Лептоспироз как заболевание с пролонгированным осложненным течением (иммунопатогенез, диагностика, прогноз, лечение, реабилитация): Автореф. дис. ...д-ра мед. наук – Москва, 1997.-32 с.
2. Башков Г.В., Калишевская Т.М., Голубева М.Г., Соловьева М.Е. Низкомолекулярные гепарины: механизм действия, фармакология и клиническое применение // Экспериментальная и клиническая фармакология.-1990.- № 4, С. 66-76.
3. Городин В.Н. Шок и полиорганная недостаточность как маркеры сепсиса у больных лептоспирозом // Сепсис. Проблемы диагностики, терапии и профилактики. Мат. науч.-практ. конф. с межд. участием - Харьков, 2006, С.73-74.
4. Городин В.Н. Патогенетическое обоснование антитромботической терапии низкомолекулярными гепаринами у больных лептоспирозом // Инфекционные болезни: проблемы здравоохранения и военной медицины. Материалы Российской научно-практической конференции - СПб, ВМедА.-2006.- С.83
5. Городин В.Н. Роль свободнорадикального окисления в патогенезе полиорганной недостаточности у больных лептоспирозом // Актуальные вопросы инфекционной патологии Юга России. Мат. II Южнороссийской научно-практ.конф. с междун. Участием, Майкоп, 2006.- С.35-36.
6. Городин В.Н. Синдром системного воспалительного ответа у больных лептоспирозом // Вестник интенсивной терапии, 2006, № 5. – С.251-253.
7. Городин В.Н.Современные подходы к лечению лептоспироза // Вестник интенсивной терапии, 2006, № 5. – С.254-260.
8. Городин В.Н. Современная клинико-эпидемиологическая характеристика лептоспироза // VII Российский съезд инфекционистов. Новые технологии в диагностике и лечении инфекционных болезней - Н. Новгород, 2006, С.78.
9. Городин В.Н., Лебедев В.В., Козырева В.В., Дегтярь Л.Д., .Журавлев А.Ю., Савенко О.Н., Линник О.Ж. Лабораторная оценка синдрома интоксикации у больных иктерогеморрагическим лептоспирозом // Актуальные вопросы инфекционной патологии и современные методы лечения. – Материалы Всероссийской научно-практической конференции. – Пенза. – 1997. - С. 105-106.
10. Городин В.Н., Лебедев В.В., Борданов В.П., Астапов К.А. Организация специализированной помощи больным лептоспирозом в Краснодарском крае // В сб.: Мат. Всерос. научн. конф. «Современные технологии диагностики и терапии инфекционных болезней».- СПб, 1999. – С. 55.
11. Городин В.Н., Лебедев В.В., Астапов К.А., Зотов С.В., Сафонов А.Н., Ковтун С.И., Ванюков А.А., Евтушенко Л.А. Показатели эндотоксикоза у больных лептоспирозом с летальным исходом // В сб.: Мат. Всерос. научн. конф. «Современные технологии диагностики и терапии инфекционных болезней».- СПб, 1999. – С. 54.
12. Городин В.Н., Лебедев В.В., Заболотских И.Б., Астапов К.А. Классификация стадий эндогенной интоксикации при лептоспирозе // В сб.: Мат. Всерос. научн. конф. «Современные технологии диагностики и терапии инфекционных болезней».- СПб, 1999. – С. 53.
13. Городин В.Н., Лебедев В.В., Астапов К.А., Ковтун С.И., Зотов С.В. Синдром последовательных органных повреждений у больных лептоспирозом // В сб.: «Инфекционные болезни: диагностика, лечение, профилактика» VI Российско-Итальянская научная конфер. – СПб.- 2000.- С.63.
14. Городин В.Н., Лебедев В.В., Астапов К.А., Ковтун С.И., Сафонов А.Н., Зотов С.В. Интенсивная терапия и профилактика полиорганной недостаточности при инфекционно-токсическом шоке у больных лептоспирозом // Инфекционные болезни на рубеже XXI века. - Мат. научно-практич. конф. – М., 2000. – ч. I. – С.28.
15. Городин В.Н., Лебедев В.В. Синдром интоксикации при иктерогеморрагическом лептоспирозе // Вестник интенсивной терапии. – 2000.- № 5-6. – С.180-183.
16. Городин В.Н. Системная энзимотерапия в лечении тяжелых и осложненных форм иктерогеморрагического лептоспироза // Эфферентная терапия, 2003, т.9.- № 1, С. 71.
17. Городин В.Н., Лебедев В.В., Плахотнюкова В.В., Дегтярь Л.Д., Зотов С.В., Ковтун С.И. Возможности применения регуляторных пептидов в комплексной патогенетической терапии иктерогеморрагического лептоспироза // Аллергология и иммунология, - т.4.- № 2.- 2003.- С.124.
18. Городин В.Н. Применение плазмафереза в терапии лептоспироза // Эфферентная терапия. - 2003, т. 9.- № 1, С. 70.
19. Городин В.Н. Патогенетическое обоснование и оптимизация интенсивной терапии тяжелых форм лептоспироза // Вестник интенсивной терапии, 2003. - № 5.- С.64-66.
20. Городин В.Н. Цитокиновый профиль и клеточные факторы иммунитета у больных лептоспирозом // VI съезд инфекционистов. – Мат. съезда.- СПб.- 2003.- С. 91.
21. Городин В.Н., Лебедев В.В., Зотов С.В. Показатели эндогенной интоксикации и оксидантного стресса у больных с тяжелым течением иктерогеморрагического лептоспироза // VI съезд инфекционистов. – Мат съезда.- СПб.- 2003.- С. 91-92.
22. Городин В.Н., Лебедев В.В., Заболотских И.Б. Современные аспекты гемостазиологических нарушений и возможности их коррекции при тяжелых формах лептоспироза // Анестезиология и реаниматология.- 2004.- № 3.- С. 24-29.
23. Дегтярь Л.Д. Исходы лептоспироза и принципы реабилитации реконвалесцентов: Автореф. дис. … канд. мед. наук.- Санкт-Петербург, 1999.-18с.
24. Заболотских И.Б. Патофизиология эндогенных интоксикаций. – Краснодар. – 1994.- 15 с.
25. Заболотских И.Б., Синьков С.В., Голубцов В.В., Городин В.Н. Основные принципы интенсивной терапии синдрома ДВС // В кн.: Основы гемостазиологии (справочник).- Краснодар, 2002.- С. 195-197.
26. Заболотских И.Б., Синьков С.В., Мануйлов А.М. Протокол диагностики и лечения синдрома диссеминированного внутрисосудистого свертывания // Вестник интенсивной терапии. – 2004. - № 5. – С. 201-204.
27. Лебедев В.В. Клинико-цитохимическая характеристика и лечение тяжелых форм лептоспироза: Автореф. дис. …д-ра мед. наук.-М.- 1996.- 34 с.
28. Лебедев В.В. Иктерогеморрагический лептоспироз: Пособие для врачей. – Краснодар, 1999. – 48 с.
29. Лебедев В.В., Авдеева М.Г., Шубич М.Г., Ананьина Ю.В., Турьянов М.Х., Лучшев В.И. Иктерогеморрагический лептоспироз. - Краснодар: «Советская Кубань», 2001.– 208 с.
30. Лебедев В.В., Городин В.Н., Астапов К.А., Борданов В.П. Эффективность применения экстракорпоральной детоксикации при тяжелых формах лептоспироза // В сб.: Пятый Российский съезд инфекционистов. Тез. докл.- Москва, - 1998.- С. 175.
31. Лебедев В.В., Городин В.Н. Совершенствование лечения больных лептоспирозом в городской клинической инфекционной больнице Краснодара // Инфекционные болезни и антимикробные средства.: Мат-лы III науч.-практ.конф.- Москва, 2005. - С.20-21.
32. Лебедев В.В., Лучшев В.И. Иктерогеморрагический лептоспироз (лекция) //Рос. мед. журнал.- 1999. - № 4. – С. 47-52.
33. Лебедев В.В., Турьянов М.Х., Александрова О.К., Городин В.Н., Зотов С.В., Кулагин В.В., Абидов М.Т. Применение тамерита в терапии тяжелых форм лептоспироза // Бюллетень экспериментальной биологии и медицины.- 2000, приложение 3.- С.91-92.
34. Стриханов С.Н., Лебедев В.В., Городин В.Н. Динамика изменений некоторых показателей центральной гемодинамики в сопоставлении с уровнем интоксикации при лептоспирозе // Диагностика, консервативное и хирургическое лечение коронарной болезни сердца, артериальных гипертензий, Саратов. – 1997. - С. 60.
35. Федоровский Н.М., Сергиенко И.И., Шилов В.Н., Фомин П.В., Груздев В.Е. Динамика перекисного окисления липидов у больных с эндотоксикозом при детоксикации гипохлоритом натрия //Анестезиология и реаниматология.- 1997. - № 4. – С. 38-40.
36. Ямпольский А.Ф. Мембранные эфферентные методы в интенсивной терапии почечной и полиорганной недостаточности // Вестник интенсивной терапии. – 1999. - № 5-6. – С.122-125.
37. Ямпольский А.Ф. Протокол ведения больного с изолированной острой почечной недостаточностью // Вестник интенсивной терапии. – 2004. - № 5. – С. 136-139.
38. Anselmo M., De Leo P., Calcagno G., Donelli E., Tirotta A., Menardo G.. Ceftazidime in the treatment of Weil's disease // Infez. Med. - 2000. – Vol. 8, N 2. - P. 106-109.
39. Bone R.C. Immunologic dissonance: a continuing evolution in our understanding of the systemic inflammatory response syndrome (SIRS) and the multiple organ dysfunction syndrome (MODS) // Ann. Intern. Med. -1996. – Vol. 125, N 8. – P. 680-687.
40. Duke G.J., Briedis J.H., Weaver R.A. Renal support in critically ill patients: low-dose dopamine or low-dose dobutamine? // Crit. Care Med. – 1994. – Vol. 22, N 12. – P. 1919-1925.
41. Jorstad S., Shaldon S. Treatment of multiorgan failure [editorial] // Blood Purif. – 1996. – Vol. 14, N 1. – P. 84-85.
42. Yamagishi T., Ishikawa S., Otaki A., Otani Y., Takahashi T., Sato Y., Yoshida I., Kunimoto F., Arai K., Morishita Y. Extracorporeal membrane oxygenation for respiratory failure // Surg. Today. – 1995. – Vol. 25, N 8. – P. 690-6933.
43. Yukawa M., Kamata H., Ohba S., Kadoi K., Mochizuki K. Effect of immune serum, an antibiotic, and a corticosteroid used alone or in combination on experimental leptospirosis in Mongolian gerbils (Meriones unguiculatus) //J. Basic. Microbiol. -1994. – Vol. 34, N 1. – P. 49-55.
| Ноябрь 2011 г. |