Опубликовано в журнале:
«РМЖ» »» ТОМ 18, № 17, 2010
Хронические облитерирующие заболевания артерий нижних конечностей – диагностика и тактика лечения
К.м.н. В.Н. Оболенский, к.м.н. Д.В. Яншин, к.м.н. Г.А. Исаев, А.А. Плотников
ГКБ № 13, НИИСП им. Н.В. Склифосовского, Москва
Хронической артериальной недостаточностью нижних конечностей страдает 2–3% населения, среди которых на долю облитерирующего атеросклероза артерий приходится 80–90% [1,2]. Из всех пациентов, страдающих этим заболеванием, каждый второй умирает в течение 10 лет от появления первых симптомов, если пациент не начнет лечиться у врача; ежегодно это заболевание становится причиной ампутации конечностей у 35 тыс. пациентов. Социальная значимость проблемы лечения этих больных определяется не только распространенностью данной патологии, но и значительным числом среди этих пациентов людей трудоспособного возраста и их инвалидизацией.
Наиболее точным определением следует считать ХОЗАНК (хронические облитерирующие заболевания артерий нижних конечностей). Используемые термины «заболевания периферических артерий», «заболевания периферических сосудов», «облитерирующий атеросклероз» и другие более расплывчаты и выходят за рамки рассматриваемой патологии.
Ранние стадии ХОЗАНК протекают бессимптомно; появление и нарастание клинических признаков – чувство онемения и зябкость стоп, снижение чувствительности дистальных отделов стоп, снижение оволосения голеней, атрофия мышц, перемежающаяся хромота (боли в мышцах голеней при физической нагрузке), боли в покое при горизонтальном положении конечности, образование болезненных трофических язв (чаще локализуются на дорсальной и боковых поверхностях пальцев, на тыле стопы, по передне–латеральной поверхности голени) и развитие гангрены – свидетельствуют о запущенности процесса. В то же время жалобы пациентов на боли, онемение и судороги в нижних конечностях, связанные с положением тела, боли в покое в вертикальном положении, наличие трофических язв других локализаций могут быть проявлением иных заболеваний – грыжа межпозвоночного диска с корешковым синдромом, ишиалгия и прочая неврологическая патология, хроническая венозная недостаточность, синдром Марторелла, криоглобулинемические васкулиты, осложнения сахарного диабета, ангиодисплазии и т.д.
По данным многочисленных исследований, частота наиболее часто возникающего симптома ХОЗАНК (перемежающейся хромоты) составляет от 0,4 до 14,4% населения, распространенность связана с полом и возрастом (мужчины заболевают в 1,5–2 раза чаще, чем женщины); критическая ишемия (боль в покое, трофические язвы, гангрены) составляет около 0,25% населения; бессимптомная стадия встречается намного чаще – от 0,9 до 22% людей [3].
Следует также отметить, что наличие ХОЗАНК указывает и на высокую вероятность атеросклеротического поражения других артерий, в частности, коронарных и сонных. Риск развития инфаркта миокарда и ишемического инсульта у таких пациентов в разы выше; среди больных с критической ишемией летальность в течение года составляет 20 – 22%, в течение 5 лет – до 70%, причем смертность от сердечно–сосудистой потологии в 5 раз выше, чем при других заболеваниях.
Факторы риска развития ХОЗАНК
Табакокурение повышает риск развития заболевания в 3 раза, наличие сахарного диабета – в 2–4 раза, артериальной гипертензии – в 2,5 раза, хронических воспалительных процессов – в 2 раза; слабая корреляция выявлена между риском развития ХОЗАНК и ожирением, гиперлипидемией и гиподинамией. По данным разных авторов, мужчины заболевают ХОЗАНК в среднем в 1,5 раза чаще, чем женщины.
Классификация
Классификация ХОЗАНК представлена в таблицах 1 и 2.
Таблица 1. Классификация степеней тяжести острой критической ишемии по Резерфорду
Степень тяжести критической ишемии Критерий 1 Конечность жизнеспособна без специального лечения 2а Моторные и сенсорные функции сохранены – конечность не требует срочной реваскуляризации 2b Мышечная моторика и сенсорные функции нарушены – требуется срочная реваскуляризация конечности 3 Конечность поражена необратимо – показана ампутация Таблица 2. Классификация облитерирующих заболеваний периферических артерий по Фонтейну–Покровскому
Стадия Название Клиническая картина ЛПИ 1 Начальные проявления Зябкость, чувство похолодания, бледность, повышенная потливость, нарушение чувствительности 0,75–1,0 2 Перемежающаяся хромота В покое боли в ногах пока нет, но она появляется:
IIа – при прохождении более 200 м
II6 – при прохождении менее 200 м0,35–0,9 3 Боли в покое Боли в ногах по ночам; расстояние безболевой ходьбы до 50 м и менее <0,4 4 Появление язв Сильные боли, язвы <0,25 Диагностика
При сборе анамнеза следует выяснить наличие факторов риска, проведенных ранее диагностических и лечебных мероприятий, характер и локализацию болевого синдрома, факторы, ослабляющие боль, дальность безболевой ходьбы.
При физическом осмотре следует обратить внимание на цвет кожных покровов конечности и его изменение при поднятии и опускании ноги, характер и симметричность оволосения, наличие трофических изменений, трещин и язв. Пальпаторно определяется наличие и характер пульса на бедренной, подколенной, задней большеберцовой артерии и артерии тыла стопы, а также температура кожных покровов. Аускультативно можно выявить сосудистые шумы, возникающие вследствие турбулентного кровотока в местах стенозов и аневризм.
В большинстве случаев для постановки диагноза достаточно сбора анамнеза и физикального обследования; для его верификации – определение лодыжечно–плечевого индекса (ЛПИ) и определение ЛПИ с физической нагрузкой (тредмил–тест), измерение сегментарного давления в конечностях, дуплексное ультразвуковое ангиосканирование (УЗАС) и/или ультразвуковая допплерография (УЗДГ). При необходимости более детальной диагностики характера и уровня поражения, определения тактики лечения (консервативной либо оперативной, вида и объема вмешательства), динамического контроля используются дополнительные лабораторные и инструментальные методы исследований.
Среди дополнительных инструментальных методов исследований применяются транскутанное определение напряжения кислорода (ТсрО2) и углекислого газа в тканях, инвазивная рентген–контрастная ангиография (РКА) и цифровая субтракционная ангиография (ЦСА), мультиспиральная компьютерная томография–ангиография (МСКТА), магнитно–резонансная томография сосудов (МРА, 3D–МРА), радионуклидные методики (сцинтиграфия, позитронно–эмиссионная томография), интраваскулярная ультрасонография, лазерная флоуметрия, плетизмография; в ряде случаев необходимо Холтеровское мониторирование и мониторинг АД.
Дифференциальный диагноз
Заболевания, с которыми следует дифференцировать ХОЗАНК атеросклеротического генеза, можно разделить на две группы: это другие заболевания артерий, не связанные с атеросклерозом, и заболевания, не связанные с патологией артерий.
К первой группе можно отнести врожденные структурные аномалии (коарктация аорты, атрезия артерий), болезни соединительной ткани, воспалительные заболевания (артериит Такаясу), тромбоэмболии артерий конечности, синдромы сдавления (синдром подколенной артерии), склероз артерий после лучевой терапии и др.
Ко второй группе относятся неврологические проблемы вследствие стеноза позвоночного канала или сдавления седалищного нерва, кокс– или гонартроз, венозная гипертензия конечности, затрудняющая поступление артериальной крови в ткани.
В дифференциальной диагностике заболеваний, приводящих к симптоматике артериальной недостаточности нижних конечностей, помимо стандартных лабораторных анализов, используются гистологические и цитологические исследования, ревмопробы, определение титра антител ANCA и криоглобулинов, а также описанные выше дополнительные инструментальные методы обследования.
Диагностическая ценность различных инструментальных методов
Следует принимать во внимание, что чувствительность метода УЗДГ в оценке сосудов голени и бедра при выраженном стенозе или окклюзии вышележащих отделов (подвздошно–бедренного сегмента) составляет не более 73%, что часто приводит к отказу от реконструкции сосудов и проведению неоправданных ампутаций, а хорошо развитое коллатеральное кровообращение в бассейне артерий голени является частой причиной ложноположительной оценки и ошибочных показаний к проведению реконструктивной операции на подвздошной и бедренной артериях. Кроме того, результаты ультразвуковых методов исследования являются «операторзависимыми», т.е. в какой–то мере субъективными [4,5].
Чувствительность дуплексного УЗАС при выявлении стенозов артерий нижних конечностей составляет 95%, специфичность – 99%; при диагностике окклюзий – 92% и 97% соответственно. К недостаткам метода следует отнести невозможность дифференцировки двойных стенозов, получения изображений сосудов в области коленного сустава и ряда других.
Метод ТсрО2 также не лишен недостатков, т.к. величина рО2 зависит от парциального давления кислорода в артериальной крови и сердечного выброса и может существенно снижаться при заболеваниях сердца, легких или анемии.
Инвазивная РКА и ее более прогрессивная модификация ЦСА до сих пор считаются «золотым стандартом» обследования больных с ХОЗАНК и определения тактики ангиохирургического и эндоваскулярного вмешательства. Однако получаемые изображения двухмерны и не позволяют выявить эксцентрично расположенные бляшки, что приводит к ложноотрицательному результату; визуализируется только просвет сосуда, поэтому аневризма, заполненная тромбом или бляшкой, может остаться незамеченной; структура бляшки или тромба также на диагностируется. Кроме того, инвазивность и риск осложнений артериального доступа, частая необходимость в седации пациента также являются недостатками метода.
Чувствительность 3D–МРА в сравнении с ЦСА составляет 90%, специфичность – 95%. К достоинствам метода следует отнести неинвазивность, отсутствие ионизирующего излучения, оценка анатомии окружающих тканей и возможность сохранить полученные данные на электронном носителе. Однако результаты также часто «операторзависимы»; наличие у больного кардиостимулятора, имплантантов из ферромагнитных сплавов, наложенных на аневризмы клипс, а также выраженное ожирение, клаустрофобия являются противопоказаниями к исследованию; наличие стента в сосуде не позволяет оценить его проходимость.
Диагностическая ценность МСКТА по сравнению со всеми другими методами выше: чувствительность составляет 92%, специфичность – 99% (данные для 4–х детекторной КТА). Исследование также малоинвазивно (в/в инфузия контраста), занимает минимальное количество времени, не вызывает приступов клаустрофобии; получаемые тонкие срезы позволяют дифференцировать тромботическую окклюзию от атеросклеротической; доступна детальная оценка костей, суставов и мягких тканей; получаемые 3D–реконструкции сосудов, освобожденных от наслаивающихся костных структур, позволяют развернуть изображение в любом ракурсе и любом масштабе. Все это позволяет оценить патологию, не доступную диагностике при использовании других методов: в частности, оценить проходимость установленных стентов, диагностировать патологию сосудистой стенки и наличие тромбированных аневризм. Кроме того, выявляются артерио–венозные шунты, ангиодисплазии; при необходимости оценивается венозное русло (венозная фаза исследования).
Одинаковым противопоказанием к использованию всех трех последних рассмотренных методов является непереносимость или аллергическая реакция на контрастные соединения и тяжелая почечная недостаточность.
Немаловажно сравнение экономических показателей – стоимость исследования различается в разы; проведение одной РКА (ЦСА) = 2 3D–МРА = 4 МСКТА = 7 дуплексных УЗАС [3,6].
Консервативная терапия
Одним из необходимых методов лечения и профилактики ХОЗАНК является лечебная физкультура – тренировочная ходьба (45–60 минут в сутки).
С целью коррекции нарушений свертывающей системы и сосудорасширяющего воздействия применяются ангиопротекторы, дезагреганты и реологические препараты – ацетилсалициловая кислота, никотиновая кислота и ее производные, клопидогрел, пентоксифиллин (Трентал), простагландины Е1, тиклопедин, дипиридамол, экстракт Гинко Билоба, гепарин, низкомолекулярные гепарины, не требующие постоянного лабораторного мониторинга, гепарин–сульфаты – ломопоран, сулодексид, реополиглюкин; спазмолитики (папаверин, дротаверин (Но–шпа), никошпан).
В качестве основных антитромбоцитарных препаратов применяют ацетилсалициловую кислоту в дозе от 75 до 375 мг/сут и клопидогрел 75 мг/сут.
Пентоксифиллин (производное метилксантина) представляет собой вазоактивное соединение, улучшающее реологические свойства крови и оказывающее легкое фибринолитическое действие, обладает выраженным венотонизирующим действием, высоким лимфодренирующим эффектом, а также предотвращающее миграцию, адгезию и активацию лейкоцитов – важного звена патогенеза трофических расстройств [Л.И. Богданец с соавт.]. Пентоксифиллин улучшает пластические свойства эритроцитов за счет повышения в них АТФ, блокирует токсическое действие фактора некроза опухоли TNF–α на клетки эндотелия, подавляет активность фосфодиэстеразы, подавляет цитокин–опосредованную активацию нейтрофилов и адгезию лейкоцитов к эндотелию, а также снижает выделение свободных радикалов кислорода; принимает активное участие в снижении агрегации и адгезии тромбоцитов, эритроцитов, повышении уровня активности плазминогена и плазмина, антитромбина III, снижении фибриногена в плазме крови, уровня антиплазмина, антитрипсина и макроглобулина [2].
Оригинальный пентоксифиллин (Трентал) был синтезирован в Германии компанией Hoechst. С 1967 г. по настоящее время используется в клинической практике, причем в США применяется с 1984 года, а в России – с 1976 года. До недавнего времени это был единственный препарат, одобренный FDA для лечения перемежающейся хромоты. Пентоксифиллин отличается хорошей переносимостью и отсутствием «синдрома отмены». На эффективность лечения пентоксифиллином негативно влияет курение, что связано с угнетением его метаболизма, проявляющееся снижением плазменной концентрации препарата на 20%. Оптимальной дозой препарата является 1200 мг/сут. Ряд авторов рекомендуют при 3–й стадии ХАН применять пентоксифиллин в дозе 1600 и даже 2400 мг/сут коротким курсом 10 дней, однако в России максимально разрешенная суточная доза составляет 1200 мг [7,8].
В настоящее время для лечения больных ХОЗАНК наряду с пентоксифиллином FDA рекомендован цилостазол (в РФ не зарегистрирован). Его сравнение с пентоксифиллином показало, что последний в большей степени увеличивает дистанцию безболевой ходьбы. При этом качество жизни больных практическим не изменялось. Цилостазол чаще вызывал побочные эффекты (головная боль, сердцебиения, желудочно-кишечные расстройства), сердечная недостаточность является противопоказанием к его применению. С учетом накопленного опыта больным рекомендовано сначала принимать пентоксифиллин, а затем при его хорошей переносимости – цилостазол [7].
Простагландины расширяют артерии малого калибра, усиливают кровоток в капиллярах, повышают фибринолитическую активность крови, подавляют агрегацию и адгезию тромбоцитов и лейкоцитов. Применяемые дозы препарата алпростадил в зависимости от выраженности ХОЗАНК – от 20 до 80 мг/сут при медленном в/в введении; терапия простагландинами требует мониторинга ЭКГ.
Пентоксифиллин и простагландины используют, как правило, в лечении критической ишемии нижних конечностей и трофических язв, связанных с нарушением артериального кровообращения, в лечении нейро–ишемической формы СДС, при КГВ, синдроме Марторелла. Хронические венозные язвы также можно рассматривать в качестве показания к применению простагландинов и пентоксифиллина.
Для снижения местной гипоксии тканей используется депротеинизированный дериват крови телят, который существенно увеличивает поглощение кислорода и обмен веществ в клетках, обладает антиоксидантными свойствами, повышает устойчивость тканей к гипоксии [9].
Обязательной является холестеринснижающая терапия, поскольку устранение дислипидемии не только снижает риск развития ХОЗАНК и сердечно–сосудистых заболеваний, но и замедляют развитие, уменьшают выраженность симптоматики уже имеющегося заболевания. Применяют различные статины (симвастин, правастатин и др.).
Уделяют внимание нормализации артериального давления, применяя ингибиторы АПФ, ß–блокаторы, блокаторы кальциевых каналов и диуретики. Также с целью уменьшения стрессорных реакций и болевого синдрома рекомендовано применение антидепрессантов.
При наличии сахарного диабета необходим строгий контроль и коррекция гликемии.
С целью облегчения отказа от курения применяют ряд заменителей никотина, например, бупропион или недавно выпущенный и более эффективный агонист ацетилхолиновых рецепторов к никотину варениклин. Все эти препараты в России не зарегистрированы [3].
Дополнительные методы лечения
Гипербарическая оксигенация нарушает процессы жизнедеятельности микробов и снижает их резистентность к антибактериальной терапии. Это особенно относится к анаэробной флоре. Также отмечено положительное влияние ГБО на состояние свертывающей системы крови в плане снижения концентрации фибриногена и повышения фибринолитической активности [10].
Баротерапия в камере Кравченко (камера локального отрицательно давления) показана при облитерирующем эндартериите и атеросклерозе артерий конечностей при ХАН I–II стадии, ангиоспазме, синдроме Рейно. Противопоказаниями являются ХАН III и IV стадии, ХВН, злокачественные опухоли, туберкулез, инфекционные болезни, декомпенсация сердечной деятельности, выраженные явления склероза сосудов головного мозга/сердца/почек, гипертоническая болезнь I и II стадии с высокими цифрами давления и наклонностью к гипертоническим кризам, ИБС, последствия ОНМК.
Магнитотерапию назначают для оказания сосудорасширяющего, обезболивающего, противоотечного и седативного действия.
Озонотерапия оказывает бактерицидный и бактериостатический эффект, усиливает микроциркуляцию, улучшает реологические свойства крови, способствует очищению ран и ускорению эпителизации, нормализует соотношение процессов перекисного окисления липидов и антиоксидантной защиты, обладает противовоспалительным и иммуномоделирующим действием, увеличивает оксигенацию крови и снижает таневую гипоксию. В/в вводят по 200–400 мл физиологического раствора с концентрацией озона 3–4 мкг/мл. NO–терапию также используют в лечении хронических заболеваний периферических сосудов. Экзогенный оксид азота, получаемый из атмосферного воздуха, оказывает эндотелий–протективное действие, стимулирует рост соединительной ткани, а также обладает бактерицидным эффектом. Показаниями к NО–терапии являются трофические нарушения кожи и язвы, развивающиеся на фоне хронических заболеваний периферических сосудов.
Малоинвазивные вмешательства.
Внутрисосудистая оксигенацияСреди патогенетически обоснованных оперативных пособий следует отметить поясничную симпатэктомию (удаление ганглиев L3–L4 симпатического ствола) – воздействие на тонус вегетативной нервной системы, увеличение кровотока на стопе, а также шунтирование тонкого кишечника, применяемое с целью коррекции липидного обмена.
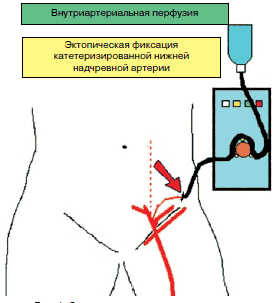
Метод внутриартериальной перфузии позволяет проводить регионарную инфузионную терапию пораженной конечности; противопоказаниями являются тяжелая общая инфекция, окклюзия артерий конечности. Для проведения внутриартериальных перфузий необходимо катетеризировать приводящий артериальный сосуд. Современные методы пункционной катетеризации с использованием ангиографии вследствие недостаточно надежной фиксации катетера на сосуде не всегда могут обеспечить длительное функционирование катетера, поэтому целесообразнее катетеризировать артерию открытым способом.
Для лечения патологии нижних конечностей катетеризируется либо нижняя надчревная артерия, либо глубокая артерия, огибающая подвздошную кость. Нижняя надчревная артерия выделяется параректальным разрезом по заднемедиальной поверхности прямой мышцы живота в нижней ее трети. Артерия перевязывается, отсекается, скелетизируется и катетеризируется. Катетер глубоко низводится в общую бедренную артерию, фиксируется на сосуде и укладывается горизонтально в подкожную клетчатку вдоль пупартовой связки. Под кожей артерия вместе с катетером выводится через контраппертуру и подшивается. Обычно для внутриартериальной перфузии используется инфузомат, способный в автоматическом режиме длительно поддерживать необходимую дозу препаратов.
В ГКБ № 13 проводилась катетеризация a. epigastrica inferior параректальным доступом с последующей круглосуточной внутриартериальной регионарной инфузией лекарственных препаратов и введением озонированного физиологического раствора. В состав инфузата, вводимого внутриартериально, входили: реополиглюкин 100–200 мл в сутки; препараты, влияющие на реологические свойства крови (пентоксифиллин 10 мл в сут ки), антикоагулянты (гепарин 2500–5000 ЕД в сутки); простагландины (алпростадил 20 мг в сутки); активаторы клеточного метаболизма (актовегин 160–240 мг в сутки); спазмолитики (Но–шпа, папаверин); антибиотики по показаниям (линкомицин или цефтриаксон); озонированный физиологический раствор с концентрацией озона 3–4 мкг/мл (20–40 мл в сутки). Инфузат вводился со скоростью от 2 до 10 мл в час круглосуточно без перерыва в течение 7–15 дней.
В лечении артериальной недостаточности нижних конечностей операция катетеризации приводящей артерии часто сочетается с поясничной симпатэктомией на той же стороне. Ликвидация артериального спазма после поясничной симпатэктомии способствует как улучшению проходимости центральных сосудов, так и дополнительному раскрытию коллатералей. Ниже представлена схема катетеризации a. epigastrica inferior по методике, используемой в НИИСП им. Н.В. Склифосовского (рис. 1).
Введение молекулярного кислорода в вену впервые описано в литературе еще в 1848 году, когда Берг вводил полученный из бертолетовой соли кислород в вену для лечения стенокардии, получив обнадеживающие результаты.
Сочетанное воздействие на кровь кислорода и ультрафиолетового облучения вызывает в организме активацию синтеза простациклинов. Это открытие шведских ученых удостоено Нобелевской премии в 1977 году.
Современные методы насыщения крови кислородом весьма разнообразны. Предложен широкий спектр оксигенаторов разных конструкций, в том числе насыщение как самой крови кислородом через мембрану, так и введение насыщенного кислородом раствора в кровь. Последние два метода успешно применяются в НИИСП им. Н.В. Склифосовского на протяжении более 10 лет. На способы оксигенации получены патенты и рационализаторские свидетельства.
Рис. 1. Схема операции катетеризации нижней надчревной артерии (НИИСП)
Методика внутрисосудистой оксигенации заключается во внутривенном введении насыщенного кислородом раствор с активацией его модифицированным ультрафиолетовым облучением. Раствор, попадая в кровь, активирует ее, обогащает кислородом и активными лекарственными препаратами.
Кровь приобретает особенные свойства. Она обладает бактерицидными, противовоспалительными и антистатическими свойствами, реологически активна. Под воздействием ультрафиолета и кислорода в клетках ретикуло–эндотелиальной системы, которые находятся на бифуркациях артерий, вырабатываются простациклины. Попадая в дистальное русло, простациклины преобразуются в простагландины, которые, в свою очередь, снижают периферическое сопротивление сосудов, раскрывают коллатеральную сеть, улучшают микроциркуляцию.
В результате даже однократного воздействия на длительный срок улучшается кровоснабжение органов и тканей. Попадая в жизненно важные органы, активная кровь стимулирует их деятельность. Так повышается детоксикационная и синтетическая функции печени, выделительная функция почек, улучшается кровообращение миокарда, ликвидируется легочная гипертензия.
По месту введения и поставленным целям внутрисосудистая оксигенация подразделяется на внутривенную, внутриартериальную оксигенацию и ретроградную внутривенную оксигенацию. Внутриартериальная оксигенация проводится аналогично внутривенной. Для проведения метода не нужен инфузомат, так как давление в оксигенаторе превышает артериальное. Скорость введения оксигенированного раствора одновременно является показателем состояния периферического сопротивления сосудов. В процессе проведения внутриартериальной оксигенации, за счет активного кислорода, снижается периферический спазм и раскрываются коллатерали. Показателем снижения периферического вазоспазма является увеличение скорости перфузии при том же режиме давления в оксигенаторе. Методика может проводиться ежедневно, а в промежутках возможно поддерживающее лекарственное лечение с помощью инфузомата.
Особое место в списке внутрисосудистых оксигенаций занимает разработанная в НИИСП им. Н.В. Склифосовкого ретроградная внутривенная оксигенированная перфузия (РВОП). Она сочетает в себе моделирование ретроградной внутривенной анестезии, разгрузочное артерио–венозное шунтирование и локальное введение реологически активных препаратов в конечность (рис. 2).
Рис. 2.
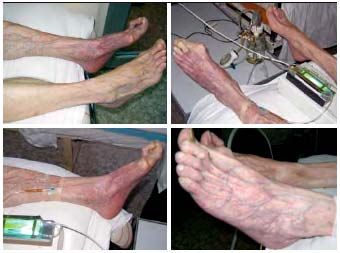
Стопа после реконструкции НПА Стопа после РВОП через 2 часаМетодика заключается в пункции вены голени или стопы в ретроградном направлении под дозированной компрессией вены выше места пункции. Внутривенно, через оксигенатор–перфузатор для стерильных растворов, в режиме умеренной гипербарии вводится раствор спазмолитиков и антибиотиков с гепарином в объеме 400–600 мл. Контроль осуществляется пульсоксиметрией. Эффект определяется стойким повышением насыщения капилляров кислородом, появлением коллатерального или центрального кровотока, клиническим эффектом.
Ретроградная оксигенированная перфузия успешно применяется не только в раннем послеоперационном периоде, но и вместо оперативного лечения, когда реконструкция сосудов невозможна в связи с распространенностью процесса или отсутствием дистального русла.
При неэффективности консервативной терапии, отсутствии противопоказаний, наличии анатомических возможностей, ишемии IIб – IV ст. применяются сосудистые реконструктивные операции, направленные на реваскуляризацию сосудов пораженной конечности – эндартерэктомия, шунтирование и протезирование, установка стентов, баллонная ангиопластика, артериализация венозного русла по методике А.А. Покровского с соавт. (2001 г.). Также используется реваскуляризирующая роторная остеотрепанация, предложенная Ф.Н. Зусмановичем в 1996 году, и ее модификации.
Таким образом, в клинической практике по эффективности, доказанной многочисленными клиническими исследованиями, переносимости, универсальности действия, экономической доступности, соотношению эффективности и стоимости, эффективности и частоты побочных эффектов преимущество имеет Трентал.
Список использованной литературы
- Савельев В.С., Кошкин В.М. Критическая ишемия нижних конечностей. М.: Медицина, 1997.
- Богданец Л.И., Кошкин В.М., Кириенко А.И. Роль пентоксифиллина в лечении и профилактике трофических язв сосудистого генеза. / «Трудный пациент». – 2006. – № 1
- Заболевания периферических артерий. / Под ред. Э.Р. Молера III, М.Р. Джаффа; пер. с англ. под ред. М.В. Писарева. – М.: ГЭОТАР–Медиа, 2010. – 224 с.
- Ультразвуковая доплеровская диагностика сосудистых заболеваний. / Под ред. Никитина Ю.М., Труханова А.И. – М.: Видар. – 1998. – 432 с.
- Лелюк В.Г., Лелюк С.Э. Ультразвуковая ангиология. – М.: Реальное время. – 1999. – 288 с./li<>
- Прокоп М., Галански М. Спиральная и многослойная компьютерная томография. Учебное пособие: в 2 т. / Пер. с англ. под ред. А.В. Зубарева, Ш.Ш. Шотемора. – М.: МЕДпресс–информ. – Т. 1. – 2006. – 416 с.; – Т. 2. – 2007. – 712 с.
- Кошкин В.М., Богданец Л.И., Наставшева О.Д., Алексеева Е.А. Место Трентала (пентоксифиллина) в программе лечения хронических облитерирующих заболеваний артерий конечностей и различных сосудистых осложнений. // РМЖ. – 2009. – том 17. – № 5. – с. 354–456.
- Покровский А.В., Чупин А.В., Калинин А.А., Маркосян А.А., Замский К.С., Колосов Р.В. Вазонит ретард в лечении больных с перемежающейся хромотой при облитерирующих заболеваниях артерий нижних конечностей. // Ангиология и сосудистая хирургия. – 2003. – том 9. – № 2.
- Ушкалова Е.А. Антиоксидантные и антигипоксические и свойства актовегина у кардиологических больных. / Трудный пациент. – 2005. – № 3.
- Ефунин С.Н. Руководство по гипербарической оксигенации. / М.: Медицина. – 1986.
| Март 2013 г. |