Опубликовано в журнале:
Хирургия. Журнал им. Н.И. Пирогова, 2007; 11 : 46-50Системная и регионарная антиоксидантная терапия при осложненных формах диабетической стопы
Проф. А.Н. БЕЛЯЕВ, канд. мед. наук Е.А. РЫГИН, А.Н. ЗАХВАТОВ, А.Н. ГУЛИН, А.Г. ГРУЗНОВ
Sistem and regional antioxidan therapy by complicated diabetic foot
A.N. BELYAEV, E.A. RYGIN, A.N. ZAKHVATOV, A.N. GULIN, A.G. GRUZNOVКафедра общей хирургии и анестезиологии им. Н.И. Атясова (зав. - проф. А.Н. Беляев) Мордовского государственного университета имени Н.П. Огарева
Введение
Одним из основных факторов, характеризующих рациональность проводимой терапии, является выбор путей введения препаратов в организм, что особенно актуально при лечении диабетических ангиопатий нижних конечностей [4, 18].
Известно, что при осложненных формах диабетической стопы инфекция локализуется как в мягких тканях, так и в костных структурах, поэтому традиционно используемые внутривенный и внутриартериальный методы введения лекарственных растворов [1, 19] не всегда приводят к ограничению развития гнойно-некротического процесса.
Экспериментальные и клинические исследования показали, что внутрикостно вливаемая жидкость из губчатого вещества кости поступает в глубокую, а затем и в поверхностную венозные системы, распространяясь в проксимальном направлении [2, 9, 16], частично проникает в артериальные сосуды [8, 11]. Внутрикостные вены анастамозируют с венами надкостницы, венозной системой мышц, сухожилий, окружающих мягких тканей [3].
Целесообразность внутрикостных введений обосновывается тем, что при внутривенных вливаниях лекарственные препараты проходят легочный фильтр, что значительно снижает их концентрацию в гнойном очаге конечности. Однако, несмотря на преимущества внутрикостной фармакотерапии как метода регионарной и внутритканевой терапии, он не нашел широкого применения в лечении гнойно-воспалительных заболеваний конечностей.
Материал и методы
Под наблюдением находились 132 больных (мужчин - 70, 53% женщин - 62, 47%, возраст от 37 до 76 лет) инсулиннезависимым сахарным диабетом типа II. У большинства (96, или 72,7%) больных имелась средняя степень тяжести, у 36 (27,3%) - тяжелое течение СД.
Длительность течения заболевания составляла от впервые выявленного до 24 лет. Большинство больных (43, или 32,6%) страдали СД от 10 до 15 лет, 35, или 26,51% - от 5 до 10 лет, 30, или 22,7% - более 15 лет.
Все больные поступили в хирургический стационар с выраженными клиническими признаками заболевания и гипергликемией от 6,26 до 18,53 ммоль/л. У 101 (76,5%) больных гипергликемия сопровождалась глюкозурией от 2,3 до 34,7 ммоль/л и кетонурией. Сопутствующие заболевания (ишемическая болезнь сердца, артериальная гипертензия, нарушения мозгового кровообращения, перенесенный инфаркт миокарда, ожирение) имелись у 88,43% больных. При распределении больных выделено 4 варианта заболевания, учитывая этиологические, патогенетические и клинические аспекты [5].
Гангрена одного или нескольких пальцев наблюдалась у 34 (25,75%) больных, гангрена стопы - у 33 (25%), язвы на пальцах, тыле и подошвенной поверхности стопы - у 34 (25,75%) больных, гнилостно-некротическая флегмона стопы - у 31 (23,5%).
В зависимости от применявшейся лечебной тактики больные были разделены на 3 группы. По полу, возрастному составу больных, состоянию компенсации диабета, наличию сопутствующих заболеваний, а также по характеру гнойно-некротического поражения эти группы были сопоставимыми.
В 1-ю группу вошли 42 больных. Им проводилась принятая в клинике традиционная терапия с учетом осложнений и сопутствующих заболеваний. Назначались диета, подкожное введение адекватных доз инсулина, а также аскорбиновая и никотиновая кислота, витамины группы В, кокарбоксилаза. С целью активизации неспецифической иммунологической реактивности использовали тималин и метилурацил. Применялись ангиопротекторы (трентал, продектин), сосудорасширяющие средства (папаверин, но-шпа), препараты антиагрегантного действия (ацетилсалициловая кислота, курантил), антикоагулянты прямого действия (гепарин). Переливались кровезаменители (реополиглюкин). Хирургическое лечение сочеталось с активной антибактериальной терапией, которая проводилась с использованием антибиотиков широкого спектра, либо комбинированием антибиотиков с разным механизмом и диапазоном действия.
Во 2-й группе были 44 больных, которым наряду с традиционным лечением проводили внутривенное вливание 400 мг мексидола на 200 мл изотонического раствора натрия хлорида 1 раз ежедневно в течение 10 дней.
В 3-ю группу вошли 46 больных, которым на фоне традиционной терапии применяли внутрикостные вливания мексидола по следующей методике. В перевязочной с соблюдением правил асептики на уровне нижней трети голени пораженной конечности накладывали резиновый бинт с целью сдавления поверхностных вен голени. Для проведения внутрикостных вливаний использовали лечебно-диагностическую костномозговую иглу диаметром 1,5 мм с мандреном. Кожу на наружной поверхности пяточной кости и надкостницу обезболивали 5-10 мл 0,5% раствора новокаина. Затем в губчатое вещество кости вращательными движениями при умеренном давлении по оси вводили иглу на глубину 1-1,5 см. Мексидол вводили в дозе 400 мг, разведенной в 15 мл изотонического раствора натрия хлорида, 1 раз ежедневно в течение 7-10 дней. По окончании внутрикостной инъекции резиновый бинт на уровне нижней трети голени сохраняли в течение 15 мин. Иглу закрывали марлевой подушкой и оставляли в костной ткани для последующих внутрикостных вливаний мексидола (рис. 1).
Рис. 1. Техника регионарных внутрикостных инфузий лекарственных препаратов у больных с гнойно-некротическими осложнениями сахарного диабета.
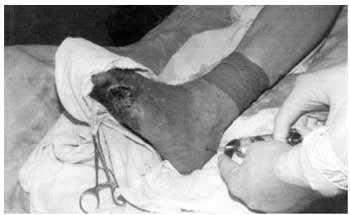
При невозможности внутрикостного введения препарата в пяточную кость, которому препятствовало распространение гнойно-некротического процесса, внутрикостные введения мексидола проводили в бугристость большеберцовой кости по этой же методике. При этом резиновый бинт накладывали на нижнюю треть бедра.
Для оценки эффективности лечения и сравнения полученных результатов исследования проводили у больных при поступлении в стационар и на 20-25-е сутки лечения. Эти же показатели исследовали у 12 здоровых добровольцев соответствующего возраста, которые были приняты за норму.
Интенсивность перекисного окисления липидов (ПОЛ) оценивали по накоплению в плазме крови и эритроцитах больных вторичного продукта липопероксидации - малонового диальдегида (МДА) по методике С.Г. Конюховой и соавт. [6].
О состоянии антиоксидантной защиты судили по активности в плазме крови фермента каталазы, которую определяли по методике М.А. Королюк и соавт. [7].
Эффективность лечения оценивали по выраженности местных признаков воспаления; отека мягких тканей, гиперемии окружающей рану кожи, некроза, учитывали характер отделяемого, состояние дна и краев раны. При этом принимали во внимание сроки ее очищения от гнойно-некротических масс, появление полноценной грануляционной ткани, начало краевой эпителизации раны, а также сокращение ее площади, которую определяли по методу Л.Н. Поповой [10].
Полученные данные обрабатывали методом вариационной статистики с использованием t-критерия Стьюдента. Вычисляли среднее арифметическое выборочной совокупности (М), ошибку среднего арифметического (m). Различие средних величин считали статистически достоверными при p<0,05. Достоверность различий определяли в следующих группах сравнения: р - достоверность различий цифровых значений при поступлении по отношению к данным у здоровых людей; р1 - достоверность различий по отношению к данным при поступлении.
Результаты
Интенсивность процессов перекисного окисления липидов. Нормальные показатели ПОЛ соответствовали: МДА плазмы 3,47±0,21 мкмоль/л, МДА эритроцитов 16,36±0,54 мкмоль/л. Каталазная активность плазмы крови составляла 0,88±0,06 мккат/(с*л.), каталаза эритроцитов - 3,42±0,18 мккат/(с*л.).
При поступлении у больных отмечалась выраженная активация процессов липопероксидации на фоне депрессии антиоксидантной системы, увеличивалось содержание МДА в плазме крови в 2,8 раза (р<0,001), в эритроцитах на 72,43% (p<0,001) относительно нормальных величин. До лечения у больных наблюдалось снижение каталазной активности плазмы крови на 51,13%, каталазы эритроцитов - на 43,27% (р<0,001).
На 20-25-е сутки традиционного лечения содержание МДА в плазме уменьшилось на 25,81%, в эритроцитах - на 14% (р1<0,05) по отношению к данным при поступлении. Содержание каталазы в плазме и эритроцитах возрастало на 20,93 и 18,55% соответственно (р1<0,05).
Внутривенные инфузии мексидола к 20-25-м суткам приводили к снижению МДА в плазме на 40,37%, в эритроцитах на 25,7% (р1<0,001). Содержание каталазы в плазме увеличивалось на 44%, в эритроцитах - на 35% (р1<0,01) (рис. 2 ).
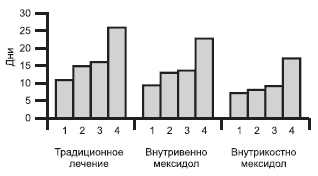
Рис. 2. Динамика течения раневого процесса при традиционном лечении гнойно-некротических форм диабетической стопы и на фоне различных путей введения мексидола.
1 - купирование отека и гиперемии; 2 - очищение раны; 3 - появление грануляций; 4 - начало краевой эпителизации.
Регионарное внутрикостное введение мексидола на 20-25-е сутки способствовало снижению уровня МДА в плазме и эритроцитах на 60,04 и 39,31% соответственно (р1<0,001). Содержание каталазы в плазме увеличивалось на 90,7%, в эритроцитах - на 73,7% (р1<0,001).
Динамика течения раневого процесса. При поступлении у больных в ране имелись участки некротизированных и частично лизированных тканей, гнойное отделяемое, отек и гиперемия окружающих рану тканей. Сроки очищения ран от гнойно-некротических тканей в 1-й группе больных составили 15,1±0,6 сут. Гиперемия и отек тканей вокруг раны исчезали через 11,3±0,6 сут. Появление грануляций наблюдалось через 15,8±0,8 сут. Начало краевой эпителизации отмечалось через 26,2±0,8 сут с момента поступления.
Во 2-й группе изучаемые показатели соответствовали: сроки очищения ран - 13,5±0,4 сут (р1<0,05), исчезновение гиперемии и отека - 9,7±0,4 сут (р1<0,05), появление грануляций - 13,5±0,5 сут, начало краевой эпителизации - 23,3±0,8 сут (Р1<0,01).
У больных 3-й группы сроки очищения ран от гнойно-некротических тканей составили 8,5±0,6 сут, гиперемия и отек тканей вокруг раны купировались через 7,1±0,4 сут, грануляционная ткань появлялась через 9,2±0,4 сут, краевая эпителизация - через 17,2±0,4 сут с момента поступления (см. рис. 2).
Для оценки скорости заживления ран проводилось динамическое измерение площади раневой поверхности. До лечения средняя площадь ран у больных с осложненными формами диабетической стопой в 1-й группе составляла 596±21,3 мм2, во 2-й группе - 648±19,3 мм2, в 3-й группе - 626±18,1 мм2.
К 20-25-м суткам у больных 1-й группы площадь раны уменьшилась до 342±15,8 мм2, у больных 2-й группы - до 253±14,7 мм2, у больных 3-й группы - до 82±4,6 мм2 (р1<0,001).
Результаты хирургического лечения. В процессе лечения гнойно-некротических осложнений диабетической ангиопатии мы стремились к снижению уровня ампутаций и максимально возможному сохранению опорной функции конечности. Анализ результатов хирургического лечения свидетельствовал о значительном повышении органосохраняющих операций при включении в комплексную терапию мексидола (см. таблицу).
Характер операций у больных с осложненными формами диабетической стопы при традиционном лечении и на фоне применения мексидола
Характер операции Традиционное лечение Внутривенное введение мексидола Внутрикостное введение мексидол число операций % число операций % число операций % Ампутация на уровне бедра 16 40 13 31,8 8 19,1 Ампутация на уровне голени 10 25 11 26,8 13 30,9 Экзартикуляция пальцев стопы с резекцией головок плюсневых костей 1 2,5 3 7,3 5 11,9 Ампутация стопы 3 7,5 4 9,7 7 16,6 Вскрытие флегмоны стопы 10 25 10 24,4 9 21,4 Всего 40 100 41 100 42 100 Обсуждение
У больных с осложненными формами диабетической стопы наблюдалось повышение интенсивности процессов ПОЛ и угнетение антиоксидантной системы, которые являются индикаторами тяжести диабетических осложнений [14]. По выраженности этих процессов можно судить о развитии у них состояния окислительного стресса [13, 17]. Гипергликемия приводит к дефициту внутриклеточных антиоксидантных ферментов и усилению деструктивных процессов на клеточном уровне [15]. Свободные радикалы, усиленно продуцируемые при гипергликемии, в основном оказывают повреждающее действие на эндотелиальные клетки [12], тем самым вызывая существенные микроциркуляторные нарушения. Применяемая комплексная традиционная терапия давала определенный антиоксидантный эффект, по-видимому, вследствие улучшения микроциркуляции и нормализации метаболических процессов, о чем свидетельствовало уменьшение к 20- 25-м суткам лечения на 26% процессов липопероксидации и возрастание на 21% содержания в плазме каталазы - маркерного фермента, отражающего состояние антиоксидантной защиты организма. Вместе с тем остающееся к концу срока лечения почти двукратное повышенное содержание продуктов липопероксидации является патогенетическим обоснованием использования в комплексной терапии экзогенных антиоксидантов.
У больных 2-й группы внутривенное применение мексидола по сравнению с традиционной терапией способствовало почти в 2 раза снижению процессов липопероксидации и возрастанию содержания каталазы как в плазме, так и в эритроцитах.
Используемый внутрикостный метод введения антиоксидантов оказался наиболее эффективным по ингибированию процессов липопероксидации и повышению антиоксидантного потенциала по сравнению как с традиционным лечением, так и с внутривенным введением мексидола. После регионарного внутрикостного введения мексидола по сравнению с внутривенным его применением содержание МДА в плазме крови уменьшалось на 32,98%, в эритроцитах - на 18,32%. Активность каталазы в плазме увеличивалась на 34,43%, в эритроцитах - на 29,12%.
Клинически эффективность применения антиоксидантов оценивалась также по динамике течения раневого процесса. Время купирования отека и гиперемии кожи вокруг раны при внутривенном и внутрикостном введении мексидола опережало данные при традиционном лечении соответственно на 1,6 и 4,2 сут, сроки очищения раны от гнойно-некротических масс - на 2,1 и 6,6 сут, появление грануляций - на 2,3 и 6,6 сут, начало краевой эпителизации - на 2,9 и 9 сут.
Результаты хирургического лечения рассмотрены нами по отдельным группам в зависимости от формы гнойно-некротического поражения: язвы на пальцах, тыле и подошвенной поверхности стопы, гангрены одного или нескольких пальцев стопы, гангрены стопы, гнилостно-некротической флегмоны стопы.
При сравнительной оценке исследованных групп установлено, что после внутривенного введения мексидола по сравнению с традиционным лечением снижалось количество ампутаций на уровне бедра на 8,2% (р<0,05), увеличивалось количество ампутаций на уровне голени на 1,8% (р>0,05). Количество операций, сохраняющих опорную функцию пораженной конечности, возросло на 7% (р<0,05) (рис. 3).
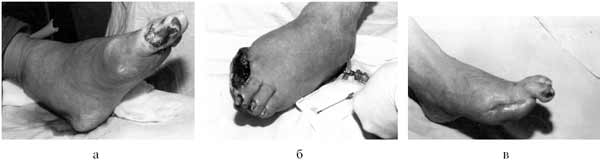
Рис. 3. Экзартикуляция I пальца стопы на фоне внутрикостного введения мексидола.
А - гангрена I-II пальцев левой стопы при поступлении; Б - выполнена операция: экзартикуляция I-II пальцев левой стопы на фоне регионарных внутрикостных вливаний мексидола в пяточную кость. Вид раны на 2-е сутки после операции. В - вид левой стопы при выписке. Рана зажила вторичным натяжением.
При сравнении традиционного лечения и внутрикостного введения мексидола (на фоне традиционного лечения) отмечалось снижение количества ампутаций на уровне бедра на 20,9% (р<0,001), увеличение количества ампутаций на уровне голени на 5,9% (р<0,05), а также операций, сохраняющих опорную функцию пораженной конечности, на 18,5% (р<0,001).
Таким образом, развитие окислительного стресса при осложненных формах диабетической стопы диктует целесообразность включения в традиционную терапию антиоксидантов, в частности мексидола, применение которого повышает регенераторные процессы в ране. Метод регионарного внутрикостного введения антиоксидантов позволяет более длительное время и в более высокой концентрации воздействовать на очаг гнойно-воспалительного процесса, что приводит к существенной коррекции основных патогенетических механизмов повреждения и способствует снижению на 20,9% количества ампутаций конечности на уровне бедра.
ЛИТЕРАТУРА
1. Атясов Н.И., Шаров В.Г., Бояринов Г.А. Внутрикостные вливания лекарственных и других жидкостей по экстренным показаниям на догоспитальном этапе. Саранск 1998;67-68.
2. Атясов Н.И., Атясов И.Н. Новые технологии использования венозного русла костей в экстремальной медицине. Саранск 2001;210-212.
3. Всеволодов Г.Ф. Внутрикостные вены трубчатых костей человека. Арх анатом гистол эмбриол 1953;4:4:77-81.
4. Гришин И.Н., Чур Н.Н. Синдром диабетической стопы. Минск 2000;170-172.
5. Газетов Б. М., Калинин А.П. Хирургические заболевания у больных сахарным диабетом. М: Медицина 1991;256.
6. Конюхова С.Г., Маркин С.Г., Конюхова А.А., Федорова Т.Н. Перекисное окисление липидов и методы определения продуктов липопероксидации в биологических средах. Лаб дело 1989;9:40-46.
7. Королюк М.А., Иванова Л.И., Майорова И.Г., Токарев В.Е. Метод определения активности каталазы. Лаб дело 1988;1:16-19.
8. Крупко И.Л., Воронцов А.В., Ткаченко С.С. Внутрикостная анестезия. Л: Медицина 1969;197.
9. Маркизов Ф.П. Особенности венозного русла в различных тканях и органах человеческого тела. Арх анатом гистол эмбриол 1959;1:36:7-24.
10. Попова Л.Н. Как измеряются границы вновь образующегося эпидермиса при заживлении ран: Автореф. дис. ... канд. мед. наук. Воронеж 1942.
11. Шуляк Г.М., Акилова А.Т. Внутрикостный метод обезболивания и его анатомическое обоснование Л: Медгиз 1953;153.
12. Beckman J.A., Goldfine A.B., Gordon M.B., Creager M.A. Ascorbate restores endothelium-dependent vasodilation impaired by acute hyperglycemia in humans. Circulation 2001;103:1618-1623.
13. Cai H, Harrison D.G. Endothelial dysfunction in cardiovascular disease: the role of oxidant stress. Circulat Res 2000;87:840-844.
14. Ceriello А. New insights on oxidative stress and diabetic complications may lead to a "Causal" antioxidant therapy. Diabet Care 2003;26:1589-1596.
15. Ceriello A., Morocutti A., Mercuri L. et al. Defective intracellular antioxidant enzyme production in type 1 diabetic patients with nephropathy. Diabetes 2000;49:2170-2177.
16. Diognardi H. La Flebografia transmedullaosea. Ahn Ital Chining 1952;29:726-730.
17. FordE.S, MokdadA.H, Giles W.H., Brown D.W. The Metabolic Syndrome and Antioxidant Concentrations Diabetes. Diabet Care 2003;52:2346-2352.
18. Halliwell B., Gutteridge J.M.C. The antioxidants of human extracellular fluids. Arch Biochem Biophys 1999;280:1:1-8.
19. Reiber G.E. The epidemiology of the diabetic foot problems. Diabet Med 1996;13:6-11.
| Июнь 2008 г. |