ПРИМЕНЕНИЕ МЕКСИДОЛА В КОМПЛЕКСНОМ КОНСЕРВАТИВНОМ И АНГИОХИРУРГИЧЕСКОМ ЛЕЧЕНИИ ИШЕМИЧЕСКИХ НАРУШЕНИЙ МОЗГОВОГО КРОВООБРАЩЕНИЯ ЭКСТРАКРАНИАЛЬНОГО ГЕНЕЗА
Д.В. Кандыба, Н.М. Жулев, Г.Ю. Сокуренко, О.С. Маркова, О.Ю. Николаева, О.Н. Зуева Санкт-Петербургская медицинская академия последипломного образования, Санкт-Петербург
Комплексное клинико-инструментальное исследование, включившее 272 больных с ишемическими нарушениями мозгового кровообращения при патологии экстракраниальных отделов сонных и позвоночных артерий, позволило выделить основные патогенетические факторы указанных состояний. Были исследованы показатели антиоксидантной системы и интенсивности перекисного окисления в эритроцитах крови. На основании данных динамического нейрофизиологического обследования и сравнения с контрольными группами установлена эффективность Мексидола в лечении и профилактике ишемических нарушений мозгового кровообращения. Использование Мексидола в до- и послеоперационном лечении больных с гемодинамически значимой патологией экстракраниальных артерий повышает безопасность хирургического вмешательства и уменьшает выраженность постоперационного гиперперфузионного синдрома. При этом улучшаются адаптационно-компенсаторные возможности организма, устойчивость головного мозга к хронической ишемии и резким изменениям объемного мозгового кровотока.
Введение
Ежегодно в Санкт-Петербурге инсульт поражает около 20 тыс. человек. Соотношение ишемических (ИИ) и геморрагических инсультов - 5 : 1. Летальность при острых нарушениях мозгового кровообращения (НМК) в Санкт-Петербурге составляет 24 % при лечении в стационаре и 43 % - в домашних условиях. Повторный инсульт в 25-33 % случаев развивается в ближайшие 2-5 лет после первого, эмболия сосудов головного мозга в течение года рецидивирует у 2/3 больных [2-4]. Всего в городе насчитывается более 100 тыс. пациентов с различными формами НМК, причем более чем у трети причиной ИИ являются атеросклеротические поражения экстракраниальных артерий (ЭКА; мозговых сосудов до входа в полость черепа). Распространенность окклюзий ветвей дуги аорты составляет 3-5 % среди лиц 40-60 лет, заболеваемость ИИ у них - 8-12 на 1000 в год [3, 5]. Изучение роли патологии ЭКА в развитии ишемических НМК является актуальным направлением современной ангионеврологии. Доступность ЭКА различным методам лучевого обследования и хирургическим вмешательствам позволяет проводить раннее выявление и своевременное, экономически более выгодное лечение начальных стадий ишемических НМК [6].
Несмотря на улучшение гемодинамических параметров на фоне вазоактивной и нейропротекторной терапии у больных с церебральной ишемией, обусловленной патологией ЭКА, у них нередко отмечается отсутствие значимого клинического улучшения, что побуждает к активному поиску дополнительных механизмов антигипоксической защиты головного мозга. Во многих экспериментальных исследованиях установлено, что основную опасность для нервных клеток в ишемическом очаге представляют истощение энергетических ресурсов, избыточное накопление нейротоксичных аминокислот и образование активных форм кислорода [7]. Избыточное внутриклеточное накопление свободных радикалов активирует процессы перекисного окисления липидов (ПОЛ), инициируя оксидантный стресс.
Головной мозг весьма чувствителен к оксидантному стрессу, который ведет к срыву цереброваскулярной ауторегуляции, длительному спазму сосудов, деструкции мембран, прогрессированию постишемического отека и усугублению дезинтеграции нейронов при хронической церебральной ишемии [8]. Ишемия мозга формируется в результате локальных нарушений кровообращения как комбинация гипоксии (ухудшение снабжения клеток кислородом), гипогликемии (снижения притока глюкозы) и ацидоза (накопление продуктов гликолиза, не удаляемых с током крови). Для их устранения следует восстановить нормальное кровоснабжение головного мозга [1]. Однако на фоне мощной реперфузии, наблюдаемой после операций на ЭКА, увеличение снабжения тканей кислородом чревато активацией ПОЛ. Защиту от оксидантного стресса обеспечивает специальная антиоксидантная система (АОС), предохраняющая ткани от избытка свободных радикалов. Исходя из особенностей антигипоксических механизмов в нейронах головного мозга на фоне изменений гемодинамики в ЭКА, необходимо дополнительно использовать мощный и эффективный антиоксидант.
Мексидол (оксиметилэтилпиридина сукцинат) является ингибитором свободнорадикальных процессов (антиоксидантом) и оказывает выраженное антигипоксическое действие. Препарат усиливает компенсаторную активацию аэробного гликолиза, снижает степень угнетения окислительных процессов в цикле Кребса в условиях гипоксии, увеличивает содержание АТФ, креатинфосфата, стабилизирует клеточные мембраны. Мексидол улучшает кровоснабжение и метаболизм головного мозга, корригирует расстройства в регуляторной и микроциркуляторной системах, улучшает реологические свойства крови и деятельность иммунной системы, ограничивает зону ишемического повреждения, стимулирует репаративные процессы. Кроме антигипоксического и антиоксидантного Мексидол обладает церебропротективным, стресспротективным и анксиолитическим действием. Такое сочетание позволяет достаточно эффективно, в комплексе с базовой терапией, уменьшить церебральную ишемию, особенно у больных пожилого и старческого возраста с вертебрально-базилярной недостаточностью (ВБН) и у пациентов, которым показано оперативное лечение патологии ЭКА.
Целью представленного ниже исследования было изучение эффективности Мексидола в профилактике церебральной ишемии, обусловленной патологией ЭКА, при комплексной консервативной терапии и оперативных вмешательствах на сонных и позвоночных артериях.
Материал и методы
Объект исследования
Обследовано 272 пациента с ишемическими НМК экстракраниального генеза. Они были разделены на четыре группы:
1-я - 46 больных с ВБН, обусловленной патологией экстракраниальных отделов позвоночных артерий (ПА; 34 женщины, 12 мужчин); 2-я - 32 больных с поражением экстракраниальных отделов сонных артерий (СА; 13 женщин, 19 мужчин); 3-я - 74 больных пожилого и старческого возраста (от 61 до 91 года) с ВБН экстракраниального генеза; 4-я - 120 больных, которым выполнены операции на экстракраниальных отделах СА и/или ПА. Возраст большинства больных 1-й, 2-й и 4-й групп составил от 40 до 60 лет. Пациенты 3-й группы с учетом комплексного неврологического и лучевого обследования были распределены на подгруппы в связи с тремя клинико-патогенетическими вариантами развития ВБН:
1-я подгруппа - 27 больных с вертеброгенной ВБН; 2-я подгруппа - 24 больных с ВБН, обусловленной поражением экстракраниальных отделов ПА; 3-я подгруппа - 23 больных с ВБН при патологии экстракраниальных отделов СА. У пациентов 4-й группы выполнялись операции на ПА (1-я подгруппа - 34 больных) или на СА (2-я подгруппа - 86 больных). Наиболее распространенные виды вмешательств: эндартерэктомия внутренней СА, эндартерэктомия ПА, резекция и транспозиция СА или ПА по поводу патологической извитости, операция Пауэрса на ПА. Методы исследования
В исследовании использовались следующие методы диагностики:
клинико-неврологическое обследование с дополнительными функциональными пробами (для объективизации динамики разработана 5-балльная шкала); рентгенография шейного отдела позвоночника с функциональными пробами; магнитно-резонансная томография (МРТ) головного мозга и шейного отдела позвоночника; ультразвуковая (УЗ) допплерография, в т. ч. с определением индекса фотореактивности и поворотами головы; дуплексное сканирование сосудов шеи; магнитно-резонансная ангиография сосудов шеи и головного мозга; у оперированных больных рентгеноконтрастная ангиография; слуховые стволовые вызванные потенциалы с дополнительными пробами (патент № 2005111690); когнитивные вызванные потенциалы головного мозга Р-300, нейропсихологическое тестирование (тест Спилбергера, опросник качества жизни SF 36, шкала оценки когнитивных качеств MMSE); стабилография с дополнительными нагрузочными пробами. Большинство методов, за исключением рентгенографии, томографии, ангиографии, выполнялись до лечения, после его окончания и через 6 месяцев. Дополнительно изучались состояние АОС и интенсивность ПОЛ в трех группах: первая - 12 пациентов, оперированных на ПА, с применением Мексидола (контроль - 10 пациентов без Мексидола); вторая - 24 пациента, оперированных на внутренней СА, с применением Мексидола (контроль - 25 пациентов без Мексидола); третья - 14 пациентов пожилого и старческого возраста с ВБН, получавших Мексидол (контроль - 12 пациентов без Мексидола). Забор крови проводили из локтевой вены. В эритроцитах определяли ряд показателей свободнорадикальных процессов и системы глутатиона: концентрацию восстановленного глутатиона (ВГ) по Ellman G.L. (1959) в модификации Глушкова С.И. (1998), сульфгидрильных (SH) групп белков по Bellomo G. (1990), малонового диальдегида (МДА) по Uchiyma M. (1978), активность глюкозо-6-фосфатдегидрогеназы (Г-6-Ф-ДГ) по Kornberg А.и соавт. (1955), глутатионредуктазы (ГР) по Carlberg I., Mannervik B. (1985), глутатионпероксидазы (ГП) по Гавриловой А.Н. (1986), каталазы по Королюк М.А. (1988). Состояние АОС оценивалось после лечения в сравнении с группами контроля.
Лечебные методики
У пациентов 1-й группы применялись вазоактивные средства (винпоцетин, пирацетам), нейропротекторы (Церебролизин, милдронат), бетагистин, Мексидол (внутримышечно по 4 мл № 10, затем внутрь - у 18 пациентов), физиотерапия (лазеротерапия, СМТ с ганглиоблокатором, селективная фотохромотерапия), массаж шейного отдела позвоночника.
Во 2-йгруппе - дезагреганты (ацетилсалициловая кислота, клопидогрель), вазоактивные средства (циннаризин, пентоксифиллин, пирацетам), нейропротекторы (Церебролизин, милдронат), Мексидол (внутримышечно по 4 мл № 10, затем внутрь - у 15 пациентов).
В 3-й- вазоактивные средства (винпоцетин, пирацетам), нейропротекторы (Церебролизин, милдронат), бетагистин, Мексидол (внутримышечно по 2 мл 2 раза в сутки 10 дней, затем 12 месяца внутрь - у 24 пациентов), внутривенное лазерное облучение крови (аппарат АЛТ-101П, курс из семи процедур через день).
В 4-й- дезагреганты (ацетилсалициловая кислота, клопидогрель), вазоактивные средства (циннаризин, винпоцетин, пирацетам), нейропротекторы (Церебролизин, Глиатилин), Мексидол (внутримышечно по 4 мл № 15 в до- и послеоперационном периоде, затем 2 месяца внутрь - у 36 пациентов).
Результаты и их обсуждение
Особенности клинико-неврологической симптоматики в различных группах пациентов с ишемическими НМК, обусловленными патологией экстракраниальных отделов СА и ПА, представлены в табл. 1.
Таблица 1. Клинические проявления ишемических нарушений мозгового кровообращения экстракраниального генеза
В клинической картине цереброваскулярной болезни у пациентов, подвергшихся оперативному лечению по поводу патологии экстракраниальных артерий (4-я группа), малосимптомное течение хронического НМК отмечалось в 19 (15,8 %), транзиторные ишемические атаки - в 73 (60,8 %), последствия ИИ - в 28 (23,3 %) случаях. При тщательном клинико-неврологическом и лучевом обследовании выявлены наиболее значимые патогенетические факторы церебральной ишемии.
Синдромы Группы 1-я (n = 46) 2-й (n = 32) 3-я (n = 74) 1-я (n = 27) 2-я (n = 24) 3-я (n = 23) Вестибулярный 46 (100 %) 8 (25,0 %) 27 (100,0 %) 24 (100,0 %) 7 (30,4 %) Мозжечковый 34 (73,9 %) 5 (15,6 %) 20 (74,0 %) 24 (100,0 %) 23 (100 %) Головная боль 27 (58,6 %) 14 (43,7 %) 11 (40,7%) 3 (12,5 %) 13 (56,5 %) Кохлеарный 46 (100 %) 11 (34,7 %) 14 (51,8 %) 21 (87,5 %) 17 (73,9 %) Вертеброгенная боль 26 (56,5 %) 8 (25,0 %) 24 (88,8 %) 9 (37,5 %) 5 (21,7 %) Обмороки и падения 28 (60,8 %) 6 (18,7 %) 8 (29,6 %) 14 (58,3 %) 15 (65,2 %) Зрительные расстройства 32 (69,5 %) 19 (59,3 %) 6 (22,2 %) 8 (33,3 %) 19 (82,6 %) Проводниковая очаговая симптоматика 18 (39,1 %) 23 (71,8 %) 4 (14,8 %) 5 (20,8 %) 15 (65,2 %) Транзиторные ишемические атаки 36 (78,2 %) 17 (53,1 %) 5 (18,5 %) 17 (70,8 %) 6 (26,0 %) ИИ в анамнезе 11 (23,9 %) 9 (28,1 %) 4 (14,8 %) 5 (20,8 %) 8 (34,7 %) В 1-й группе: стеноз ПА (преимущественно в устье) отмечен у 31 (67,4 %), патологическая извитость ПА - у 8 (17,4 %), экстра-интракраниальные стенозы в сосудах вертебрально-базилярного бассейна - у 5 (10,9 %), экстравазальное сдавление ПА - у 2 (4,3 %) больных. Их клиническая значимость увеличилась при гипоплазии другой ПА, перепадах и особенно снижении системного артериального давления, пароксизмах мерцательной аритмии, разомкнутости задних отделов Виллизиева круга, ортостатической неустойчивости. Патология ПА может проявляться в виде самостоятельной вертеброгенной ВБН (синдром позвоночной артерии) или оказывать дополнительное провоцирующее воздействие на вертебрально-базилярный кровоток на фоне декомпенсации мозговой гемодинамики.
Во 2-й группе: атеросклеротическая стенозирующая, гемодинамически значимая бляшка в устье внутренней СА выявлена у 17 (53,1 %), патологическая извитость внутренней СА в частом сочетании с атеросклеротическим поражением - у 11 (34,4 %), "тандем-стенозы" в каротидном бассейне - у 4 (12,5 %) больных. При каротидном стенозе церебральная ишемия реализовывалась следующими основными механизмами: гемодинамическим, атеростенотическим, атеротромботическим и артерио-артериальной эмболией. Для характера и степени ишемии мозга огромное значение имеют скорость развития стеноза/окклюзии СА, адекватность коллатерального кровообращения, стабильность системной гемодинамики, своевременность назначения дезагрегантной, антиоксидантной и нейропротективной терапии.
В 3-й группе:
1-я подгруппа: деформирующий унковертебральный артроз - у 10 (37 %), патология кранио-вертебральной области (аномалии, обызвествление атланто-окципитальной связки) - у 7 (25,9 %), нестабильность дегенеративно измененных позвоночных сегментов - у 6 (22,2 %), атеросклеротическое поражение ПА (чаще в устье) - у 4 (14,8 %) больных; 2-я подгруппа: атеросклеротическое поражение ПА - у 14 (58,3 %), извитость ПА - у 5 (20,8 %), экстраинтракраниальные стенозы в вертебрально-базилярном бассейне (ВББ) - у 3 (12,5 %), экстравазальное воздействие на ПА - у 2 (8,3 %) больных; 3-я подгруппа: стеноз в области бифуркации общей СА и устье внутренней СА, тандем-"стенозы" экстраинтракраниальных отделов внутренней СА - у 11 (47,8 %), снижение кровотока по ПА и сосудам ВББ - у 8 (34,8 %), патологическая извитость внутренних СА (часто с обеих сторон) - у 4 (17,4 %) больных. В 4-й группе:
1-я подгруппа: атеростенотическое поражение ПА - у 14 (41,1 %), сочетание атеростеноза и патологической извитости ПА - у 8 (23,3 %), сочетание патологической извитости и экстравазального сдавления ПА - у 11 (32,3 %), сочетание экстравазального воздействия и аномалий строения ПА - у 3 (8,8%) больных; 2-я подгруппа: атеростенозирующее или окклюзирующее поражение общей СА и/или внутренней СА и/или наружной СА - у 51 (59,3 %), патологическая извитость внутренней СА - у 24 (27,9 %), сочетание атеростеноза и патологической извитости внутренней СА - у 11 (12,7 %) больных. Сложность диагностики и лечения ишемических НМК связана с многообразием (гетерогенностью) патогенетических механизмов, лежащих в их основе. На основании клинико-лучевой диагностики нами были выявлены наиболее значимые факторы церебральной ишемии при патологии ЭКА, что позволяет подойти к лечению более целенаправленно и эффективно.
При оценке состояния и динамики показателей АОС и ПОЛ в эритроцитах больных с церебральной ишемией был выявлен ряд закономерностей (табл. 2). В этот фрагмент исследования были включены больные пожилого и старческого возраста с ВБН (3-я группа), а также больные 4-й группы, оперированные на ПА (1-я подгруппа) или СА (2-я подгруппа).
Таблица 2. Динамика показателей АОС и ПОЛ у обследованных пациентов
Показатель Группы группа 3-я (n = 26) 4-я (подгруппа 1; n = 22) 4-я(подгруппа 2; n = 49) ВГ (мкмоль/г гемоглобина) Основная 3,65 ± 0,54 * 5,21 ± 0,29 6,46 ± 0,37 * Контрольная 3,12 ± 0,42 5,14 ± 0,31 4,34 ± 0,22 SH (мкмоль/г гемоглобина) Основная 3,01 ± 0,56 4,51 ± 0,61 6,66 ± 0,74 * Контрольная 3,08 ± 0,38 4,35 ± 0,56 4,67 ± 0,46 МДА (нмоль/г гемоглобина) Основная 6,67 ± 0,35 * 9,62 ± 1,21 7,83 ± 0,78 Контрольная 8,21 ± 0,23 9,87 ± 0,92 8,07 ± 0,94 Г-6-Ф-ДГ (мкмоль/мин/г гемоглобина) Основная 7,35 ± 0,54 * 3,67 ± 0,53 3,86 ± 0,35 * Контрольная 5,23 ± 0,45 3,14 ± 0,41 3,02 ± 0,45 ГР (мкмоль/мин/г гемоглобина) Основная 342,3 ± 34,0 * 179,7 ± 42,5 * 226,0 ± 24,1 Контрольная 209,0 ± 23,8 182,3 ± 21,5 226,4 ± 17,8 ГП (мкмоль/мин/г гемоглобина) Основная 0,276 ± 0,028 0,369 ± 0,030 0,345 ± 0,017 * Контрольная 0,234 ± 0,023 0,362 ± 0,021 0,247 ± 0,039 Каталаза (мкмоль/мин/г гемоглобина) Основная 17,70 ± 1,21 * 17,26 ± 1,39 17,32 ± 0,98 * Контрольная 16,70 ± 1,09 16,89 ± 1,18 16,29 ± 1,27 * Достоверность различия между группами р < 0,05.Контрольные группы пациентов получали базисное консервативное и хирургическое лечение, а пациентам основных групп дополнительно назначался Мексидол.
Во всех трех категорий обследованных больных отмечалось снижение содержания ВГ и SH-групп, что свидетельствует о значимой нагрузке на АОС. Однако отмечалась статистически значимая разница между основной и контрольной группами пациентов, прооперированных на СА. Анализ показателей АОС и ПОЛ у больных с патологией ЭКА указывает на прямую зависимость между степенью и тяжестью хронической церебральной ишемии и снижением уровня ВГ и SH-групп белков. Увеличение среднего содержания ВГ у пациентов 2-й подгруппы можно объяснить восстановлением кислородозависимого дыхания, накоплением НАДФН и макроэргических соединений, необходимых для синтеза ВГ в тканях печени и головного мозга с его дальнейшим переносом в эритроциты крови.
Уровень МДА, отражающего активность ПОЛ, был повышен у пациентов после операций на ЭКА, особенно в 1-й подгруппе (операция на ПА). По сравнению с контролем МДА был ниже во всех трех основных группах больных, получавших Мексидол. У пациентов 3-й группы выявлено статистически более значимое увеличение среднего содержания Г-6-Ф-ДГ и ГР по сравнению с больными 4-й и контрольной групп. В связи с тем, что данные ферментные системы отражают уровень компенсации, можно оценить пациентов 3-й группы как находящихся в адаптивной фазе, а 4-й- в фазе субкомпенсации. Скорость образования ВГ под действием ГР требует достаточного содержания НАДФН, единственным значимым источником которого является глюкозо-6-фосфатдегидрогеназная реакция, которая и лимитирует возможности восстановления глутатиона в условиях активации процессов пероксидации. Глутатионзависимый антиоксидантный фермент ГП осуществляет утилизацию активных форм кислорода и продуктов ПОЛ, имеет большое сродство к перекиси водорода и играет ведущую роль в метаболизме физиологических количеств этого соединения. Кроме того, глутатион-пероксидазная реакция - основной путь образования окисленной формы глутатиона, имеющей высокую биологическую активность (Глушков С.И., 1998; Сулай К.Е., 2005). Кроме ГП в процессе утилизации перекиси водорода важное место занимает каталаза, хотя в нашем исследовании статистически значимой динамики активности этого фермента в разных группах пациентов и даже после применения Мексидола не выявлено.
Подводя итог оценке определения средних количественных значений маркеров АОС и ПОЛ, можно отметить статистически значимые различия показателей в отдельных группах больных и на фоне лечения Мексидолом в сравнении с контрольными группами. Наличие умеренной разницы параметров АОС у больных с преимущественным поражением каротидного или вертебрально-базилярного бассейнов требует дальнейших более углубленных исследований. Не вызывает сомнения эффективность Мексидола не только в отношении повышения активности антигипоксической и антиоксидантной защиты головного мозга и организма в целом, но и наблюдавшихся клинико-неврологических нарушений. Позитивный эффект Мексидола в комплексном консервативном и хирургическом лечении ишемических НМК экстракраниального генеза, особенно в группе пациентов пожилого и старческого возраста, подтвержден положительной динамикой показателей допплерографии, компъютерной стабилографии, когнитивных вызванных потенциалов головного мозга Р-300. Оценка качества жизни больных, оперированных на СА или ПА, позволило выявить следующие закономерности. Наибольшая положительная динамика отмечалась у пациентов с поражением каротидного бассейна и не имевших в анамнезе инсульта. Достоверное улучшение качества жизни наблюдалось по следующим показателям: "физическая активность", роль "физических проблем в ограничении жизнедеятельности", "общее здоровье", психическое здоровье". У пациентов пожилого и старческого возраста на фоне лечения Мексидолом в сочетании с внутривенным лазерным облучением крови улучшились такие показатели, как "социальная активность", "психическое здоровье", роль эмоциональных проблем в ограничении жизнедеятельности". Это свидетельствует об анксиолитическом, рединамизирующем и антистрессовом действиях Мексидола у пациентов с хронической ВБН, что очень важно, поскольку из-за частого головокружения, обмороков, нарушения функции ходьбы они становятся социально и физически ограниченными. Хроническое пароксизмальное течение ВБН при патологии экстракраниальных отделов ПА приводит к повышению уровня ситуационной и реактивной тревожности у больных по данным теста Спилбергера. После комплексного лечения с применением Мексидола признаки астенизации, депрессии и тревожности уменьшились. В плане коррекции данных расстройств особенно эффективным было сочетание курсов парентерального введения Мексидола с его длительным (2-3 месяца) приемом внутрь.
Наибольшие нарушения в показателях когнитивных функций были выявлены у пациентов с сочетанными выраженными поражениями каротидного (атеростеноз обеих внутренних СА > 70 % площади сечения) и вертебрально-базилярного бассейнов. Дополнительным неблагоприятным фактором служили невысокие цифры системного артериального давления и сопутствующая кардиальная патология. Когнитивные нарушения оценивались по шкале мини-исследования умственного состояния (MMSE), где в баллах отмечаются наличие и степень выраженности следующих показателей: ориентация, восприятие, внимание и счет, память, речь, чтение, письмо. У пациентов 4-й группы также проводилось исследование когнитивных вызванных потенциалов Р-300. Когнитивное обследование не выявило значимых изменений сразу после лечения. Через 6 месяцев после операции и курса лечения Мексидолом положительный эффект с увеличением когнитивных показателей и уменьшением латентности Р-300 более чем на 30 мс наблюдался у большинства больных, оперированных на ПА. Выявлена корреляция между повышением латентности Р-300 на 6080 мс и уменьшением балльной оценки (на 3-8) по шкале MMSE у пациентов с патологией экстракраниальных артерий, перенесших ИИ.
Следует отметить важность сотрудничества неврологов, ангиохирургов и врачей функциональной диагностики в определении диагностической и лечебной тактики, показаний к оперативному вмешательству на экстракраниальных артериях. При всех основных клинических формах ишемических НМК экстракраниального генеза ведущими показаниями для дополнительной антиоксидантной терапии Мексидолом являются следующие: дефицит факторов антиоксидантной защиты и увеличение интенсивности процессов ПОЛ, наличие признаков ишемизации мозговых структур при системном характере нарушений церебральной гемодинамики на магистральном и регионарном уровнях.
Выводы
1. Комплексная клинико-лучевая диагностика пациентов с ишемическими НМК, обусловленными патологией ЭКА, выявляет наиболее значимые патогенетические факторы, учитывая которые возможно подойти к проблеме профилактики ИИ более целенаправленно и эффективно.
2. Исследование АОС и ПОЛ в эритроцитах позволяет уточнить степень устойчивости головного мозга к хронической ишемии и определить показания к обязательному дополнительному назначению антиоксидантов (в частности, Мексидола).
3. Применение Мексидола у пациентов пожилого и старческого возраста с ВБН экстракраниального генеза улучшает показатели клинико-неврологического статуса, качества жизни, маркеров состояния АОС и ПОЛ, компьютерной стабилографии, когнитивных функций.
4. Использование Мексидола в до- и послеоперационном лечении больных с гемодинамически значимой патологией ЭКА повышает безопасность хирургического вмешательства и уменьшает выраженность постоперационного гиперперфузионного синдрома. При этом улучшаются адаптационно-компенсаторные возможности организма, устойчивость головного мозга к хронической ишемии и резким изменениям объемного мозгового кровотока.ЛИТЕРАТУРА
1. Болдырев А.А. Окислительный стресс и мозг // Соросовский образовательный журнал. 2001. № 4. С. 21-28.
2. Вавилов В.Н., Токаревич К.К., Лапина В.М. Диагностика и лечение поражений прецеребральных артерий. Учебное пособие. СПб., 1998. С. 4-17.
3. Верещагин Н.В., Булевская Т.С., Миловидов Ю.К. и др. Предупреждение ишемического инсульта: неврологические и ангиохирургические аспекты //Клиническая медицина. 1992. № 11-12. С. 5-9.
4. Верещагин Н.В. Нейронаука и клиническая ангионеврология: проблемы гетерогенности ишемических поражений головного мозга // Вестник РАМН. 1993. № 7. С. 40-42.
5. Виленский Б.С. и др. Актуальные вопросы клинической ангионеврологии. Материалы и тезисы научно-практической конференции врачей-неврологов Северо-Западного региона России. СПб., 1997. С. 12-14.
6. Жулев Н.М., Яковлев Н.А., Кандыба Д.В. и др. Инсульт экстракраниального генеза. Руководство для врачей. СПб., 2004. 587 с.
7. Максимова М.Ю. Перекисное окисление липидов и гемостатическая активация при ишемическом инсульте. Автореф. к. м. н. М., 1996. С. 3-5.
8. Румянцева С.А. Комплексная антиоксидантная терапия реамберином у больных с критическими состояниями неврологического генеза. Сборник научных статей "Реамберин:реальность и перспективы". СПб., 2002. С. 74-98.Рис. 1. Рентгенограмма краниовертебральной области. Аномалия Киммерле
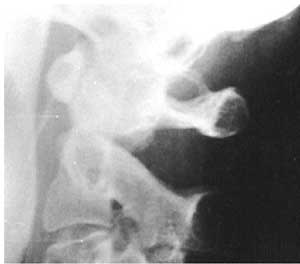
Рис. 2. Магнитно-резонансная томограмма головного мозга. Ишемический инсульт в бассейне правой средней мозговой артерии
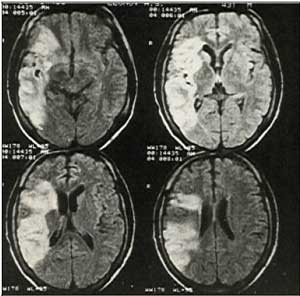
Рис. 3. Допплерография. Выраженный стеноз внутренней сонной артерии
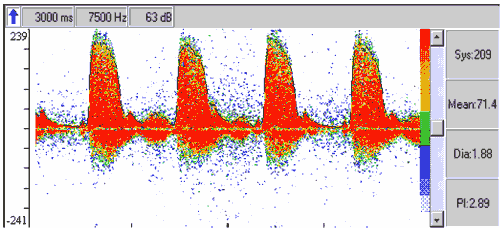
Рис. 4. Дуплексное сканирование. S - образная извитость внутренней сонной артерии
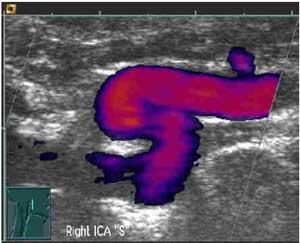
Рис. 5. Магнитно-резонансная ангиограмма. Патологическая извитость левой позвоночной артерии
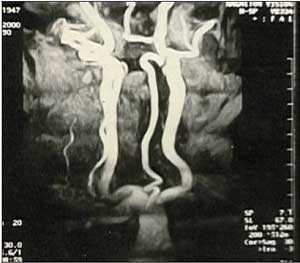
Рис. 6. Рентгенконтрастная ангиограмма. Патологическая извитость левой общей сонной артерии и левой внутренней сонной артерии
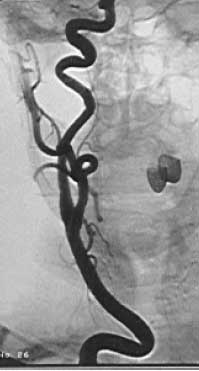
Рис. 7. Рентгенконтрастная ангиограмма. Стеноз в устье правой позвоночной артерии
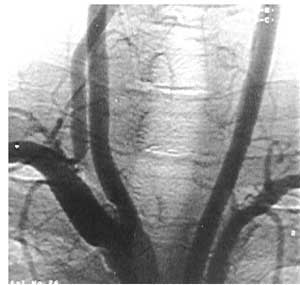
Рис. 8. Рентгенконтрастная ангиограмма. Окклюзия левой общей сонной артерии
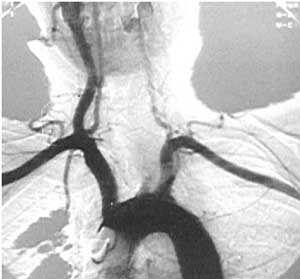
| Июнь 2008 г. |