Опубликовано в журнале:
УРОЛОГИЯ, 2009, № 6Роль комбинированной терапии аденомы предстательной железы после биопсии предстательной железы по поводу повышения уровня ПСА
В. Е. Охриц, А. Б. Богданов, Е. И. Велиев
РМАПО, МоскваАденома предстательной железы (АПЖ) - медленно прогрессирующее заболевание, однако у некоторых пациентов прогрессирование носит выраженный характер. У 80% пациентов прогрессирование заболевания связано с усилением симптомов заболевания. Возраст пациента, нарастание симптоматики, низкие урофлоуметрические показатели, большой объем остаточной мочи, высокий исходный уровень простатического специфического антигена (ПСА), объем простаты являются основными факторами клинического прогрессирования АПЖ [1]. В настоящее время большое количество исследований направлено на определение генетических и молекулярных механизмов возникновения и прогрессирования АПЖ. В нормальной ткани простаты процессы клеточной пролиферации уравновешиваются процессами апоптоза. При АПЖ пролиферация, регулируемая тестостероном, преобладает над клеточной гибелью, что приводит к увеличению объема простаты. Традиционно считается, что АПЖ не является предраковым состоянием, однако в научных публикациях в течение многих лет поднимаются вопросы связи АПЖ с простатической интраэпителиальной неоплазией (ПИН) и раком простаты (РП). Данные аутопсий подтверждают, что до 83% РП сочетаются с АПЖ [2]. Эпидемиологические исследования показывают, что распространенность и АПЖ, и РП увеличивается с возрастом. Около 8% мужчин в возрасте 31 года - 40 лет имеют гистологические признаки АПЖ, к 6-му десятилетию жизни этот уровень увеличивается до 50%, достигая 90% к 80 годам [3]. Данные аутопсий молодых мужчин, умерших от травм, демонстрируют, что гистологические признаки РП выявляются уже на 3-м десятке жизни [4]. В отличие от гистологических данных клинически РП обычно выявляется у мужчин старше 50 лет. Процесс является гормонозависимым, и появляется все больше данных о роли воспаления в генезе этих заболеваний.
Высказываются мнения, что РП, исходящий из переходной зоны, может быть связан с некоторыми формами гиперплазии. Морфологические и генетические исследования подтверждают, что большинство РП развивается на фоне предсуществующей АПЖ. Кроме того, высокий уровень прогрессирования АПЖ может быть ассоциирован с большим риском развития РП, причем в этом случае заболевание может носить агрессивный характер [5]. В других исследованиях, напротив, большой объем простаты являлся протективным фактором в отношении агрессивного рака [6].
Условием правильного выбора терапии является точная диагностика и определение биологической природы заболевания, выявление пациентов с высоким риском его прогрессирования.
Материалы и методы. На кафедре урологии и хирургической андрологии Российской медицинской академии последипломного образования с мая 2007 г. по октябрь 2008 г. проведена оценка клинической эффективности и безопасности применения тамсулозина (фокусин) и финастерида (пенестер) у 26 больных в возрасте от 59 до 77 лет (средний возрасте 68 лет) с симптомами нарушения функции нижних мочевыводящих путей, обусловленного АПЖ. Особенностью данной работы явилось то, что пациенты были включены в исследование после проведения трансректальной мулътифокальной биопсии простаты по поводу повышения уровня ПСА. В одной группе использовали тамсулозин в качестве монотерапии, в другой - комбинированное назначение тамсулозина и финастерида. Период наблюдения составил 12 мес.
Оценивали влияние приема препаратов на выраженность симптомов АПЖ по шкале I-PSS, размеры предстательной железы (по данным ТРУЗИ), максимальную скорость потока мочи (Qmax), среднюю скорость потока мочи (Qave), функциональную емкость мочевого пузыря (Vcomp), объем остаточной мочи (Vres), уровень ПСА, артериальное давление, мнение пациента об эффективности терапии, а также наличие нежелательных эффектов, вызванных приемом препаратов.
Критерии включения: возраст старше 50 лет, выраженность симптомов по шкале I-PSS ≥ 8 и ≤30 баллов, Qmax ≥ 4, и ≤15 мл/с, уровень остаточной мочи не более 125 мл, отсутствие клинических признаков РП.
Критерии исключения: оперативные вмешательства на органах малого таза, термотерапия; лучевая терапия органов малого таза; осложненное течение АПЖ (в том числе камни и дивертикулы мочевого пузыря); острая задержка мочеиспускания (ОЗМ) в анамнезе, известная непереносимость препаратов групп α-адреноблокаторов, ингибиторов 5α-редуктазы.
Всем пациентам до начала терапии была проведена первичная трансректальная мультифокальная биопсия простаты из 12-26 точек в связи с повышенным уровнем ПСА. У всех пациентов при гистологическом исследовании биоптатов были подтверждены АПЖ и отсутствие РП. У 4 пациентов по данным первичной биопсии была обнаружена ПИН высокой степени и у 2 пациентов - атипичная мелкоацинарная гиперплазия (ASAP), что явилось показанием для повторной биопсии простаты через 6 мес. С целью профилактики воспалительных осложнений после биопсии простаты пациентам был рекомендован прием препаратов группы фторхинолонов в течение 5 дней.
Перед началом терапии пациенты заполняли опросник МИЭФ-5 для оценки сексуальной функции. Выявлено, что 85% пациентов либо не живут половой жизнью, либо имеют тяжелую степень нарушения эректильной функции. Учитывая эти данные, дальнейшая оценка сексуальной функций не проводилась.
Тамсулозин пациенты принимали ежедневно по 0,4 мг однократно после завтрака, финастерид - ежедневно по 5 мг однократно независимо от приема пищи.
Результаты лечения оценивали через 1 мес после начала терапии, затем каждые 3 мес терапии.
Результаты. Все включенные в исследование пациенты относились к группе высокого риска прогрессирования заболевания (исходный высокий уровень ПСА, объем простаты, выраженная симптоматика). За время наблюдения на фоне лечения в обеих группах произошло значимое снижение как обструктивных, так и ирритативных симптомов заболевания, описываемых шкалой I-PSS. Качество жизни пациентов (QoL), выраженное в баллах, в группе монотерапии тамсулозином в начале терапии составило 3,88, через 6 мес терапии - 2,68 и через 12 мес лечения - 2,75. В группе комбинированной терапии аналогичные показатели составили 3,66, 3 и 2,91 балла соответственно. В группе монотерапии через 12 мес лечения количество баллов при ответе на 1-й вопрос снизилось с 1,9 до 1,38, на 2-й вопрос - с 3,2 до 0,87, на 3-й вопрос - с 2,5 до 1,87, на 4-й вопрос - с 2,8 до 2, на 5-й вопрос - с 2,9 до 2,18, на 6-й вопрос - с 1,2 до 1,13, на 7-й вопрос - с 2,9 до 1,88 балла (рис. 1, 2).
Рис. 1. Динамика обструктивных симптомов (в баллах) по шкале I-PSS (вопросы 1, 3, 5-й) на фоне монотерапии тамсулозином.
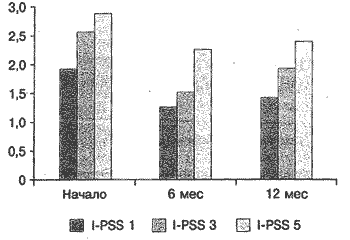
Рис. 2. Динамика ирритативных симптомов (в баллах) по шкале I-PSS (вопросы 2, 4, 6, 7-й) на фоне ионотерапии тамсулозином.
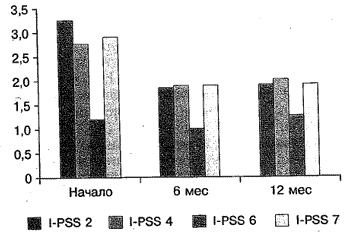
В группе комбинированной терапии количество баллов при ответе на 1-й вопрос снизилось с 1,7 до 0,8 балла, на 2-й вопрос - с 2,2 до 1,5, на 3-й вопрос - с 2,1 до 1,4, на 4-й вопрос - с 2,2 до 1,83, на 5-й вопрос - с 3,2 до 2, на 6-й вопрос - с 2,2 до 1,66, на 7-й вопрос - с 2,8 до 1,83 балла. Сумма баллов через 12 мес лечения в группе монотерапии снизилась с 17,1 до 12,5 балла, а в группе комбинированной терапии - с 16,5 до 11,1 балла (рис. 3,4)
Рис. 3. Динамика обструктивных симптомов (в баллах) по шкале I-PSS (вопросы 1, 3, 5-й) на фоне комбинированной терапии тамсулозином и финастеридом.
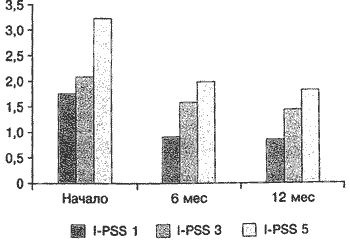
Рис. 4. Динамика ирритативных симптомов (в баллах) по шкале I-PSS (вопросы 2, 4, 6, 7-й) на фоне комбинированной терапии тамсулозином и финастеридом.
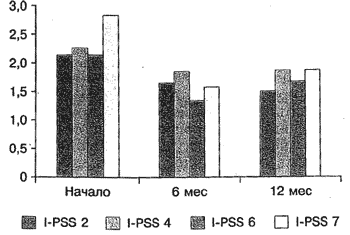
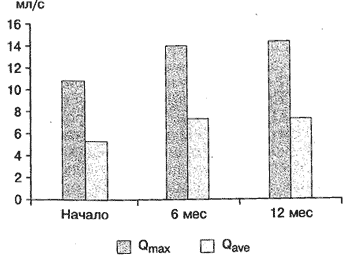
В группе монотерапии через 12 мес лечения Qmax увеличилась с 10,8 до 14,4 мл/с, Qave - с 5,3 до 7,2 мл/с, V снизился с 21 до 1,25 мл (рис. 5).
Рис. 5. Динамика уродинамических показателей (Qmax и Qaver) на фоне монотерапии тамсулозином.
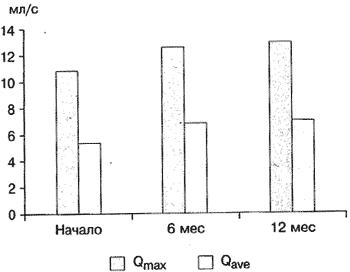
В группе комбинированной терапии через 12 мес лечения Qmax увеличилась с 9 до 13 мл/с, Qave - с 4,6 до 6,9 мл/с (рис. 6), Vres снизился с 28,4 до 10,8 мл.
Рис. 6. Динамика уродинамических показателей (Qmax и Qaver) на фоне комбинированной терапии тамсулозином и финастеридом.
В группе монотерапии за 12 мес лечения значимого снижения объема простаты не отмечено, снижение ПСА произошло с 7,2 до 5,37 нг/мл (на 30,3%).
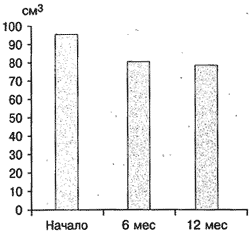
В группе комбинированной терапии через 12 мес лечения отмечено уменьшение объема простаты с 96,2 до 78,6 мл (на 18,2%) (рис. 7). Снижение уровня ПСА произошло с 8,1 до 4,2 нг/мл (на 48,2%).
Рис. 7. Динамика объема простаты на фоне комбинированной терапии тамсулозином и финастеридом.
При повторной биопсии у обоих пациентов с выявленной при первичной биопсии ASAP был обнаружен РП (один из пациентов получал монотерапию тамсулозином, второй - комбинированную терапию). Также аденокарцинома обнаружена у одного пациента, получавшего комбинированную терапию, имевшего ПИН высокой степени при первичной биопсии. Всем 3 пациентам была выполнена радикальная позадилонная простатэктомия. Согласно патоморфологическому заключению у всех пациентов с РП имелась локализованная форма заболевания. У одного пациента, получавшего монотерапию тамсулозином, выявлено осложнение заболевания в виде образования камня мочевого пузыря, в связи с чем пациенту выполнена позадилонная аденомэктомия. Интересно отметить, что в патоморфологическом образце у данного пациента имелся фокус ASAP.
Обсуждение. В течение многих лет медикаментозное лечение АПЖ основывалось на облегчении симптомов заболевания. Традиционно для этих целей врачи назначают α1-адреноблокаторы, которые позволяют воздействовать и на симптомы накопления, и на симптомы опорожнения. Результаты лечения в группе, получавшей монотерапию тамсулозином, в нашем исследовании подтверждают данные литературы о значимом уменьшении обструктивных и ирритативных симптомов через 1 и 3 мес лечения. Данные нашего исследования показывают, что через 6 мес лечения в группе монотерапии тамсулозином не происходит дальнейшего улучшения симптоматики и объективной оценки мочеиспускания. Данные крупных исследований (см. таблицу) также демонстрируют, что у пациентов с высоким риском прогрессирования заболевания (объем простаты более 30 см3, уровень ПСА более 1,5 нг/мл) монотерапии α1-адреноблокаторами недостаточно [7]. Этим пациентам, безусловно, показана комбинированная терапия с назначением ингибиторов 5α-редуктазы, которые уменьшают объем предстательной железы, ингибируя продукцию дигидротестостерона, и облегчают симптоматику заболевания. Показано, что именно у пациентов с большим объемом предстательной железы происходит наиболее значимое уменьшение выраженности симптомов АПЖ в ответ на терапию ин-гибиторами 5α-редуктазы.
Эффект медикаментозной терапии (в %) при АПЖ по данным долгосрочных клинических исследований
Исследование Ингибиторы 5α-редуктазы α-Адреноблокаторы Комбинированная терапия объем простаты ОЗМ оперативное вмешательство прогрессирование симптомов объем простаты ОЗМ оперативное вмешательство прогрессирование симптомов объем простаты ОЗМ оперативное вмешательство прогрессирование симптомов MTOPS [4] -19 -68 -64 -30 +29 -35 -3 -45 -12 -81 -67 -64 p 0,009 <0,001 0,016 нз нз <0,001 <0,001 <0,001 <0,001 PLESS [4] -18 -57 -55 - - - - - - - - - p <0,001 <0,001 <0,001 PROWESS [2] Финастерид -15,3 -57 -40 p 0,001 ALTESS [2] - - - - - 0,3 -22 -30 - - - - p нз нз 0,001 Важно знать, что через 3-6 мес постоянного применения ингибиторов 5α-редуктазы сывороточный уровень ПСА уменьшается вдвое. Применение правила удвоения ПСА позволяет сохранить ценность ПСА в скрининге РП на фоне лечения ингибиторами 5α-редуктазы [8]. В урологическом сообществе продолжаются активные обсуждения влияния ингибиторов 5α-редуктазы на либидо и эректильную функцию. Обратим внимание на то, что в нашем исследовании 85% пациентов либо не вели половую жизнь, либо имели тяжелую эректильную дисфункцию согласно опроснику МИЭФ-5. Приоритетным для больных являлось улучшение мочеиспускания.
В литературе широко обсуждается вопрос о необходимой длительности терапии. Y. Jeong и соавт. [9] опубликовали данные проспективного исследования по влиянию прекращения приема ингибитора 5α-редуктазы на объем простаты и выраженность симптомов АПЖ спустя год после приема препарата. В течение года после отмены препарата вновь отмечалось увеличение объема простаты в среднем на 20%, также наблюдалось ухудшение симптомов. Авторы заключают, что в целях предотвращения прогрессирования заболевания терапия ингибитором 5α-редуктазы должна носить пожизненный характер.
Как было сказано выше, АПЖ часто сочетается с другими патоморфологическими изменениями в простате - простатитом, ПИН различной степени и РП. Данные о влиянии финастерида на частоту ПИН высокой степени были опубликованы I. Thompson и соавт. [10] на основании проведения дополнительного анализа результатов РСРТ (Prostate Cancer Prevention Trial). Было показано, что в группе финастерида отмечалось значимое уменьшение ПИН высокой степени. Возможно, это является одним из объяснений того, что ингибиторы 5а-редуктазы уменьшают риск РП. Эти данные обращают нас к интригующему спору современной урологической общественности: должны ли ингибиторы 5α-редуктазы использоваться в профилактике РП?
Привлекательность ингибиторов 5α-редуктазы в качестве мишени для профилактики рака объясняется тем, что уменьшается андрогенная стимуляция простаты без снижения уровня циркулирующего тестостерона. Ингибирование 5α-редуктазы приводит к снижению уровня дигидротестостерона в простате ниже кастрационного уровня. Концентрация тестостерона повышается, но не до уровня дигидротестостерона в группах плацебо. Таким образом, ингибирование 5α-редуктазы приводит к замещению дигидротестостерона менее активным андрогеном [11]. На моделях животных продемонстрировано, что тестостерон может подавлять опухолевый рост при заблокированном образовании дигидростестостерона, так как он стимулирует клеточную дифференцировку [12]. Этот дополнительный механизм, по которому ингибиторы 5α-редуктазы предотвращают развитие РП, пока изучен недостаточно. Лучшее доказательство роли ингибиторов 5α-редуктазы в профилактике РП получено в исследовании РСРТ. РСРТ стартовало в 1993 г. более чем в 200 центрах США. Обязательными критериями отбора для исследования служили возраст старше 55 лет, уровень ПСА ≤ 3,5 нг/мл и отсутствие изменений при пальцевом ректальном исследовании (ПРИ). В начале исследования биопсий не проводилось. Пациенты были рандомизированы на две группы: получающие 5 мг финастерида в день и группа плацебо. Проводили ежегодные определения уровня ПСА и ПРИ. В случае повышения уровня ПСА более 4 нг/мл или изменений при ПРИ проводили биопсию простаты. В группе, получавшей финастерид, значение ПСА удваивалось. В конце исследования через 7 лет всем пациентам была рекомендована биопсия простаты. Всего было рандомизировано 18 882 человека. В группе финастерида было зарегистрировано уменьшение частоты возникновения РП на 24,8% [13]. В то же время в группе финастерида был выявлен увеличенный риск обнаружения низкодифференцированного РП (280 опухолей с показателем Глисона 7- 10 в группе финастерида по сравнению с 237 опухолями в группе плацебо). Это привело к предположению, что финастерид не следует использовать для химиопрофилактики.
Были проведены 3 дополнительных анализа с целью определения истинного влияния финастерида на развитие низкодифференцированного РП [14-16]. Результаты варьировали от увеличения частоты низкодифференцированного рака, когда учитывали изменение объема простаты, до уменьшения относительного риска низкодифференцированного рака в группе финастерида на 27% при учете данных препаратов после простатэктомии вместо данных биопсии. К сожалению, проведенные работы носили ретроспективный характер, и использование их результатов возможно лишь в качестве предположений, а не четких доказательств. Кроме того, лишь у 27% пациентов с диагностированным РП были доступны морфологические образцы после операции.
Существует предположение, что финастерид, ингибируя рост и секрецию ПСА, уменьшает вероятность развития и прогрессирования высокодифференцированного рака, который, вероятно, не приведет к смерти пациента, и увеличивает частоту более злокачественного потенциала рака, который не "отвечает" на финастерид и, следовательно, имеет высокий риск прогрессирования. Необходимы дальнейшие исследования, чтобы подтвердить или опровергнуть эти гипотезы. У многих мужчин уже имеются фокусы РП, поэтому ингибиторы 5α-редуктазы должны не только предотвращать конверсию нормальной клетки в опухолевую, но и контролировать рост уже существующего РП.
Так следует ли использовать ингибиторы 5α-редуктазы для профилактики рака? Положительно на этот вопрос можно ответить в случае увеличенного объема простаты, повышенного уровня ПСА, наличия выраженных симптомов заболевания, т. е. у пациентов с высоким риском прогрессирования АПЖ. Очевидно, что ингибиторы 5α-редуктазы уменьшают число биопсий, выполняемых по поводу повышения ПСА, и по крайней мере за 7-летний период не вызывают вреда от пропущенных или низкодифференцированных раков. В нашем исследовании было выполнено 6 повторных биопсий (2 по поводу ASAP и 4 по поводу ПИН высокой степени) простаты. В трех наблюдениях был выявлен РП. Согласно патоморфологическому заключению после операции, у этих пациентов имел место локализованный рак.
У пациентов с отсутствием симптомов споры о назначении ингибиторов 5α-редуктазы до сих пор продолжаются. Исследования по экономической целесообразности их использования, основанные на результатах РСРТ, показали, что выгоды не оправдывают расходов [17]. Однако в выводах РСРТ указано, что к настоящему времени применение финастерида - единственный способ уменьшения частоты РП.
Заключение. АПЖ и РП являются заболеваниями, оказывающими значительное влияние на состояние здоровья, качество жизни и смертность мужчин. В отношение АПЖ разработаны алгоритмы, позволяющие определить оптимальную терапию с использованием либо α-адреноблокатора, либо комбинированной терапии с учетом факторов риска прогрессирования заболевания.
Проведение молекулярно-генетических, биологических исследований позволило приоткрыть завесу патологических процессов, лежащих в основе этих двух зачастую сосуществующих патологических процессов. Это привело к разработке препаратов, дающих не только симптоматический, но и патогенетический эффект. В настоящее время изучаются возможности для проведения профилактики и АПЖ, и РП. Дальнейшие исследования позволят уточнить эффективность и безопасность применения ингибиторов 5α-редуктазы в профилактике РП.
ЛИТЕРАТУРА
1. Trachtenberg J. Treatment of lower urinary tract symptoms suggestive of benign prostatic hyperplasia in relation to the patient's risk profile for progression. Br. J. Urol. Int. 2005; 95 (suppl. 4): 6-11.
2. Bostwick D. G. et al. The association of benign prostatic hyperplasia and cancer of the prostate. Cancer 1992; 70 (suool. 1): 291-301.
3. Alcaraz A. et al. Is there evidence of a relation between benign prostatic hyperplasia and prostate cancer? Eur. Urol. 2009; 55: 864-875.
4. Sakr W. A., Grignon D. J., Crissman J. D. et al. High grade prostatic intraepithelial neoplasia (HGPIN) and prostatic adenocarcinoma between the ages of 20-69: an autopsy study of 249 cases. In Vivo 1994; 8: 439-443.
5. Hammarsten J. et al. Calculated fast-growing benign prostatic hyperplasia - a risk factor for developing clinical prostate cancer. Scand. J. Urol. Nephrol. 2002; 36: 330-338.
6. Briganti A. et al. Prostate volume and adverse prostate cancer features: fact not artifact. Eur. J. Cancer 2007; 43: 2669-2677.
7. Emberton M. et al. Managing the progression of lower urinary tract symptoms/benign prostatic hyperplasia: therapeutic options for the man at risk. Br. J. Urol. Int. 2007; 100: 249-253.
8. McConnell J. D. et al. MTOPS Steering Committee. The impact of medical therapy on the clinical progression of BPH: Results of the MTOPS trial. J. Urol. (Baltimore) 2002; 167: A1042.
9. Jeong Y. B. et al. Effect of discontinuation of 5alpha-reductase inhibitors on prostate volume and symptoms in men with BPH: a prospective study. Urology 2009; 73 (4): 802-806.
10. Thompson I. M. et al. Finasteride decreases the risk of prostatic intraepithelial neoplasia. J. Urol. (Baltimore) 2007; 178 (1): 107-109.
11. Rittmaster R. et al. Effect of dutasteride on intraprostatic androgen levels in men with benign prostatic hyperplasia or prostate cancer. Urology 2008; 72: 808-912.
12. Eggener S. E. et al. Enhancement of intermittent androgen ablation by "off-cycle" maintenance with finasteride in LNCaP prostate cancer xenograft model. Prostate 2006; 66: 495-502.
13. Thompson I. M. et al. The influence of finasteride in the development of prostate cancer. N. Engl. J. Med. 2003; 349: 215- 224.
14. Cohen Y. C. et al. Detection bias due to the effect of finasteride on prostate volume: a modeling approach for analysis of the prostate cancer prevention trial. J. Natl. Cancer Inst. 2007; 99: 1366-1374.
15. Pinsky P., Parnes H., Ford L. Estimating rates of true highgrade disease in the prostate cancer prevention trial. Cancer Prev. Res. 2008; 1: 182-186.
16. Redman M. W. et al. Finasteride does not increase the risk of highgrade prostate cancer: a bias-adjusted modeling approach. Cancer Prev. Res. 2008; 1: 182-186.
17. Svatek R. S., Lee J. J., Roehrborn C. G. et al. Cost-effectiveness of prostate cancer chemoprevention: a quality of life-years analysis. Cancer 2008; 112: 1058-1065.
| Сентябрь 2010 г. |