Опубликовано в журнале:
Военно-медицинский журнал, 7'2007Применение блокаторов альфа1-адренорецепторов в урологической практике
Шаплыгин Л.В., заслуженный врач РФ, профессор, полковник медицинской службыНарушение акта мочеиспускания - одна из наиболее частых жалоб, являющихся основанием для обращения к урологу. Распространённость расстройств мочеиспускания прямо пропорциональна возрасту. В наибольшей степени этому недугу подвержены люди старше 50 Лет. Согласно международным данным, у 31% мужчин в возрасте от 50 до 80 лет имеется средней степени или значительно выраженная дисфункция, проявляющаяся симптомами нижних мочевых путей (СНМП).
Термин СНМП является общеупотребительным и включает совокупность симптомов, условно разделяющихся на обструктивные (ослабление струи мочи, прерывистое, затруднённое мочеиспускание, ощущение неполного опорожнения мочевого пузыря, задержка мочи) и ирритативные (императивные позывы, учащённое дневное и ночное мочеиспускание, невозможность удерживать мочу при возникновении позыва). СНМП чаще всего развиваются при инфравезикальной обструкции.
Как известно, инфравезикальную обструкцию составляют 2 компонента: 1-й - механический и 2-й - динамический [10].
Первый компонент является следствием непосредственного увеличения аденоматознымй узлами транзиторной и периуретральной простатических зон (обеспечивает 61% общего уретрального давления).
Действие механизма второго компонента инфравезикальной обструкции обусловливается увеличивающейся активностью симпатических нервных волокон и чувствительностью α1-адренорецепторов [9], повышающих тонус мышечных структур основания мочевого пузыря, задней уретры и предстательной железы (ПЖ) и обеспечивающих 39% общего уретрального давления [6]. Помимо катехоламинового воздействия важное значение имеет влияние ишемического фактора (спазма сосудов), вызывающего в совокупности вторичные структурно-функциональные изменения детрузора в связи с повреждением гладкомышечных элементов мочевого пузыря.
Причин возникновения СНМП много. Однако наиболее частыми из них традиционно считаются доброкачественная гиперплазия и рак предстательной железы (ДГПЖ, РПЖ). В развитии ДГПЖ первостепенное значение приобретает стромальная и железистая пролиферация в периуретральной зоне ПЖ, связанная с замедленным апоптозом (отсутствием программируемой клеточной гибели) и повышенной пролиферацией клеток. В результате увеличивается абсолютный объём аденоматозной ткани.
Результаты исследований в последние годы дают основание полагать, что при ДГПЖ возрастает активность функции симпатических нервных волокон, что вызывает повышение тонуса гладкомышечных структур основания мочевого пузыря, задней уретры и ПЖ. Повышенная активность функции симпатической нервной системы ухудшает кровоснабжение органов малого таза, в частности мочевого пузыря. В итоге наступает гипоксия мочевого пузыря, ухудшаются биоэнергетика и сократительная способность детрузора.
Наиболее грозное осложнение ДГПЖ - развитие острой задержки мочи - ОЗМ (табл.1). Данные эпидемиологических исследований свидетельствуют о. возрастании почти в 3-4 раза риска развития ОЗМ в связи с увеличением объёма ПЖ (>40 мл) и уровня простато-специфического антигена (ПСА) более 1,4нг/мл [12].
Таблица 1. Частота причин возникновения острой задержки мочи у мужчин (по S.Choong, M.Emberton) [7]
Причина % Доброкачественная гиперплазия ПЖ 53,0 Запоры 7,5 Рак ПЖ 7,0 Стриктура уретры 3,5 Гемотампонада мочевого пузыря 3,0 Неврологические заболевания 2,0 Послеоперационная ОЗМ 2,0 Камни мочевых путей 2,0 Действие лекарственных препаратов 2,0 Инфекционно-воспалительные заболевания 2,0 Иные причины, в т. ч. неустановленные 16,0 Риск развития ОЗМ связывают также с увеличением возраста и выраженностью симптомов нарушения мочеиспускания по различным опросникам (IPSS, AUA, Boyarsky). Вероятность развития ОЗМ у мужчин в возрасте старше 70 лет в 8 раз выше, чему 40-летних [12].
ОЗМ обусловливается анатомической обструкцией, гипертонусом гладких миоцитов и энергетическим дисбалансом детрузора. Стимуляция α-адренергических рецепторов ПЖ, вызванная перерастяжением детрузора при задержке мочи, наряду со вторичным снижением внутрипузырного давления приводит к дальнейшему развитию и сохранению ОЗМ [4].
Задержка может развиваться не только у пациентов с ДГПЖ. Хирургам нередко приходится оказывать помощь больным с острой задержкой мочеиспускания после любых, даже небольших по объёму операций. Послеоперационную ОЗМ характеризуют как состояние, при котором пациент не способен помочиться в течение 6 - 10 ч после операции. Пальпаторно у него определяется увеличенный мочевой пузырь. Послеоперационная ОЗМ может быть обусловлена отсутствием привычки к мочеиспусканию в лежачем положении, болью в ране при напряжении мышц передней брюшной стенки, снижением тонуса детрузора после наркоза, перидуральной и спинномозговой анестезией.
ОЗМ после различных операций у мужчин пожилого возраста может не иметь чисто рефлекторного характера, а быть следствием ранее нераспознанной ДГПЖ. Иммобилизация у таких больных ведёт к венозному застою в малом тазу, отёку ПЖ, гипотонии детрузора. Вместе взятые данные обстоятельства и провоцирует ОЗМ.
Вероятность возникновения ОЗМ в послеоперационный период выше у страдающих ДГПЖ и имеющих исходные нарушения мочеиспускания. Данное осложнение требует принятия неотложных мер, поскольку при ишурии нарушается опорожнение не только нижних, но и верхних мочевых путей, что грозит развитием острого гнойно-воспалительного процесса. Часто (17%) ишурии сопутствует пузырно-мочеточниковый рефлюкс. А это повышает опасность возникновения острого пиелонефрита. Снижаются почечный кровоток, клубочковая фильтрация и диурез. В результате при ОЗМ может возникнуть почечная недостаточность [2, 3].
В связи с изложенным особую опасность представляет ишурия у больных, перенёсших нефрэктомию. ОЗМ у них может привести к быстрому развитию острой почечной недостаточности. При возникновении ишурии повышается артериальное давление, нарушается мозговой кровоток, возможно развитие сердечной недостаточности. Происходят патологические сдвиги в состоянии свёртывающей и противосвёртывающей систем крови, что может обусловливать развитие геморрагических и тромбоэмболических осложнений [3].
Анатомическая и динамическая обструкция, приводящая к повышению давления и нарушениям потока мочи, имеет особо важное значение в патогенезе простатита.
Хронический простатит (ХП) - наиболее распространённое урологическое заболевание у мужчин моложе 50 лет и 3-й по Частоте урологический диагноз в возрасте старше 50 лет (после ДГПЖ и рака простаты) [13]. С возрастом частота заболевания увеличивается и достигает 30-73% [11].
Несмотря на то что единого мнения об этиологии ХП (СХТБ - синдрома хронической тазовой боли) не существует, большинство урологов признаёт высокую частоту нейрогенных расстройств, приводящих к обструктивному мочеиспусканию у этих больных. При обследовании мужчин в возрасте до 50 лет с клиническим диагнозом ХП функциональная обструкция в зоне простатического отдела уретры выявляется у свыше половины из них, детрузорно-сфинктерная диссинергия - у 24%, нестабильность детрузора - примерно у 50% [8, 15].
Неполное раскрытие шейки мочевого пузыря при мочеиспускании, сопровождающееся повышенным тонусом уретры с её сужением на уровне наружного сфинктера, значительно повышает в нём давление, способствует возникновению турбулентного тока и снижению максимальной и средней скорости мочи.
Перечисленные обстоятельства приводят к рефлюксу уретрального содержимого в протоки простатических желёз. Следующая за этим воспалительная реакция паренхимы простаты может проявляться асептическим воспалением, если моча стерильная, или же иметь бактериальную природу, если она была инфицирована.
Как бы то ни было, воспалительная реакция вызывает или усугубляет имеющуюся дисфункцию симпатической нервной системы и гиперактивность α-адренорецепторов. Повышение активности α-адренорецепторов, в свою очередь, повышает тонус гладких мышц шейки мочевого пузыря, сфинктера простаты и задней уретры. В результате ухудшается дренирование простатических ацинусов и усугубляется нарушение уродинамики, провоцирующих повторный рефлюкс. Отёк приводит к ишемизации ткани ПЖ и ещё сильнее усугубляет воспалительный процесс.
Современная стратегия терапии обструктивного мочеиспускания строится на основании сравнения эффективности того или иного способа лечения с потенциальными осложнениями. Начало 90-х годов прошлого века ознаменовалось резким повышением научного интереса урологов к проблеме оптимизации медикаментозной терапии обструктивного мочеиспускания, обусловленного болезнями мочевого пузыря, простаты и уретры. На фоне многообразия лекарственных препаратов, применяемых в лечении СНМП, группа селективных α1-адреноблокаторов заняла лидирующие позиции благодаря высокой эффективности, быстроте действия, относительно невысокой цене и небольшой частоте побочных эффектов.
Основой патогенеза нарушения мочеиспускания у большинства урологических больных является уменьшение просвета мочеиспускательного канала за счёт его сдавления увеличенной ПЖ и ослабления функции детрузора. Наиболее явной причиной, ухудшающей качество мочеиспускания, считается повышение возбудимости симпатической нервной системы в области малого таза вследствие различных урологических болезней, таких, как ДГПЖ и хронические воспалительные заболевания - простатит, цистит и уретрит.
α1-Адреноблокаторы устраняют гипертонус гладкой мускулатуры стромы ПЖ, занимающей до 60% её объёма при гиперплазии. Благодаря этому нивелируется динамический компонент инфравезикальной обструкции. С другой стороны, усиление кровоснабжения мочевого пузыря за счёт вазодилатации на фоне лечения α1-адреноблокаторами улучшает биоэнергетику детрузора, восстанавливает его адаптационную и сократительную активность и уменьшает выраженность расстройства мочеиспускания [4].
На фоне лечения α1-адреноблокаторами пациентов с ДГПЖ выраженность СНМП уменьшается на 35-50%, максимальная объёмная скорость мочеиспускания возрастает на 30-47%, а количество остаточной мочи сокращается на 50%. Одновременно возрастает максимальная скорость мочеиспускания на 1,5-3,5 мл/с, или на 30-47%, снижается максимальное давление детрузора и давление открытия, а также количество остаточной мочи (в среднем на 50%).
Таким образом, уменьшаются инфравезикальная обструкция и выраженность ирритативной симптоматики при лечении α1-адреноблокаторами. Указанные положительные изменения появляются обычно на 2-4-й неделе приема препарата и сохраняются на всём протяжении лечения.
Наиболее частые побочные эффекты при лечении α-адреноблокаторами - снижение артериального давления и, как следствие, головокружение, ортостатическая гипотензия и головная боль, возникающие у 4-10% больных, как правило, в первые дни приема препарата. Побочные эффекты наименее выражены у тамсулозина, относящегося к подгруппе α1a-адреноблокаторов.
α1a-Адренорецепторы находятся исключительно в ПЖ и составляют 70% от общего количества её адренорецепторов. В связи с высокой селективностью у тамсулозина практически отсутствует вазодилатирующий эффект. Вследствие этого на фоне приёма препарата артериальное давление не снижается, а его эффективность сопоставима с таковой у других α1-адреноблокаторов.
У пациентов с ДГПЖ и сопутствующей артериальной гипертензией (что наблюдается в половине случаев) α1-адреноблокаторы, влияющие на α1a-1b- и 1d- рецепторы, снижают артериальное давление. При исходно нормальных его значениях гипотензивный эффект практиче-ски отсутствует.
При большом объёме ПЖ (более 40 мм3) и высоком риске прогрессии ДГПЖ рекомендуется комбинированная терапия: α1-адреноблокатор + ингибитор 5 α-редуктазы (финастерид), способствующий уменьшению размеров железы.
Длительный опыт применения α-адреноблокаторов помимо эффективности и безопасности симптоматического лечения нарушений мочеиспускания вследствие ДГПЖ показал, что практически не отмечено ОЗМ у пациентов, длительно принимавших α1-адреноблокаторы. Более того, благодаря профилактическому приёму α1-адреноблокаторов за 5 дней до хирургических операций и 3 дня после них у больных с ДГПЖ, оперированных на других органах, уменьшился риск развития ОЗМ в послеоперационный период: 2,7 против 19,0% в контрольной группе [1]. По данным S.F.McNeill и соавт. [14], у 55% больных с ОЗМ, обусловленной ДГПЖ и получавших α-адреноблокаторы после удаления уретрального катетера, восстановилось самостоятельное мочеиспускание, у получавших плацебо - 29%.
α1-Адреноблокаторы ослабляют динамический компонент обструкции, уменьшают гипоксию детрузора и восстанавливают координированную работу детрузора и замыкательного аппарата мочевого пузыря. Эти обстоятельства дают основание надеяться на минимизацию вероятности развития послеоперационной ишурии. Их приём в предоперационный и ранний послеоперационный периоды будет способствовать адаптации волокон детрузора процессу перерастяжения. Наряду с воздействием на динамический компонент инфравезикальной обструкции α1-адреноблокаторы снижают вероятность ОЗМ в послеоперационный период.
Высокая популярность α-адреноблокаторов в лечении ХП и СХТБ объясняется современным представлением об этиологии этих болезней. В силу особенностей механизма действия α-адреноблокаторы обладают поливалентной направленностью и способны воздействовать на несколько звеньев патогенеза ХП (СХТБ) и на факторы, его поддерживающие.
Блокада α-адренорецепторов в области малого таза, ПЖ и мочеполовой диафрагмы восстанавливает нормальную сократительную активность гладких мышц в железе и устраняет застойные явления в простате. При воздействии на зону шейки мочевого пузыря и сфинктерный аппарат уменьшаются или устраняются явления инфравезикальной обструкции. В результате снижается вероятность повторного уретропростатического рефлюкса. Воздействие на α1d-подтип адренорецепторов спинного мозга благотворно влияет на снижение выраженности нейрогенных расстройств органов малого таза.
С другой стороны, экспериментально доказано улучшение кровоснабжения мочевого пузыря, простаты и органов малого таза на фоне лечения α-адреноблокаторами [5]. Большинство специалистов высказывает мнение о необходимости длительного приема α1-адреноблокаторов, ибо при коротких курсах (менее 6-8 мес) лечения часто рецидивируют симптомы. Считается, что длительные курсы терапии α-адреноблокаторами способны необратимо снизить чувствительность α1-адренорецепторов и таким образом сохранить эффект лечения после отмены препарата.
В настоящее время в России больным доступны несколько α1-адреноблокаторов. Сравнительные исследования во многих урологических клиниках мира доказали их практически равную эффективность. Подбор оптимального препарата этой группы определяется не степенью его воздействия на симптомы, а в основном удобством использования, частотой побочных эффектов и доступностью для пациентов.
Материал и методы
В урологическом центре Главного военного клинического госпиталя им. Н.Н.Бурденко в последние 3 года накоплен обширный клинический опыт лечения доксазозином (зоксоном) и тамсулозином (фокусином) пациентов с различными заболеваниями мочеполовой системы - ДГПЖ, ХП (СХТБ), а также в пред- и послеоперационный периоды для предупреждения послеоперационных осложнений. Мы проанализировали применение зоксона и фокусина у 273 пациентов в возрасте от 52 до 74 лет (табл. 2, 3).
Таблица 2. Распределение урологических пациентов в соответствии с нозологической формой и лечением препаратом, абс. число
Группа Зоксон Фокусин Итого 1-я-ДГПЖ 163 44 207 2-я - хронический простатит 32 13 45 3-я - СХТБ 17 4 21 Всего... 212 61 273 Таблица 3. Распределение пациентов после хирургических вмешательств в послеоперационный период, абс. число
Операции Зоксон Фокусин Итого На органах брюшной полости 3 2 5 На органах грудной клетки 4 2 6 На костях 5 4 9 На органах забрюшинного пространства 28 23 51 Всего... 40 31 71 Оценивали влияние препаратов на выраженность СНМП по шкалам IPSS и QOL, на максимальную скорость потока мочи (Qmax), объём остаточной мочи и артериальное давление, а также переносимость терапии. Кроме того, оценивали применение этих препаратов в послеоперационный период для профилактики нарушения мочеиспускания у 71 пациента после хирургических вмешательств на органах грудной и брюшной полостей и костях.
Результаты и обсуждение
Доброкачественная гиперплазия простаты
Проанализированы результаты лечения 207 пациентов с ДГПЖ. Их средний возраст - 64,8 года. У всех лечившихся имелась выраженная ирритативная симптоматика при умеренных проявлениях инфравезикальной обструкции.
Препараты принимали по схеме: зоксон - ежедневно вечером, перед сном. Начальная его доза - 1 мг/сут; затем доза постепенно возрастала в течение 1-2 нед до 2 мг/сут, далее - до 4 мг/сут. Сравнивались данные до и после назначения препаратов. Средний период наблюдения - 3 мес.
Оценивали влияние зоксона и фокусина на выраженность СНМП по шкале IPSS, на максимальную скорость потока мочи (Qmax), среднюю скорость потока мочи (Qave), функциональную ёмкость мочевого пузыря, объём остаточной мочи, артериальное давление, сексуальную функцию (по МИЭФ), мнение пациента об эффективности терапии, нежелательные эффекты, вызванные приёмом препаратов.
В обеих группах пациентов (табл. 4) статистически значимо снизилось проявление обструктивных и ирритативных СНМП, описываемых шкалой IPSS. Качество жизни пациентов существенно улучшилось (р<0,01). Наблюдались увеличение Qmax почти на 2 мл/с и субъективное улучшение качества самостоятельного мочеиспускания (n=199, или 96,1±1,3%).
Таблица 4. Влияние зоксона и фокусина на основные функциональные показатели у пациентов с ДГПЖ,
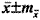
Показатели Зоксон Фокусин До лечения Через 3 мес лечения До лечения Через 3 мес лечения Баллы по шкале IPSS 17,3±2,8 10,2±2,9 17,8±3,2 10,4±2,4 Баллы по шкале QOL 4,1±0,9 2,4±0,9 4,3±0,8 2,6±0,6 Объём ПЖ, см3 61,22±28,58 60,15±28,64 54,34±22,12 54,14±21,96 V остаточной мочи, мл 48,60±20,12 27,80± 12,32 46,22±18,12 24,22±9,58 Qmax, МЛ/С 8,60±2,34 10,43±2,12 8,90±2,57 10,80±2,40 Показатели систолического и диастолического артериального давления изменились на фоне лечения зоксоном: отмечен гипотензивный эффект, среднее снижение систолического АД - 7,2±4,8 мм рт. ст., а диастолического - 6,6±3,8 мм рт. ст. У 3 пациентов на фоне первого приёма 4 мг зоксона однократно появились симптомы артериальной гипотонии (слабость, головокружение) в первые 30 мин после первого приёма препарата. Однако это не явилось основанием для отмены лечения зоксоном.
У одного пациента при первом приёме 4 мг/г зоксона артериальное давление снизилось с 140/90 до 110/70 мм рт. ст. В связи с этим больной стал получать доксазозин по 2 мг/сут. В дальнейшем (при коррекции антигипертензивной терапии) дозу зоксона удалось повысить до 4 мг/сут.
При лечении фокусином не отмечалось влияния на систолическое и диастолическое артериальное давление. Отмечен быстрый эффект препаратов: улучшение параметров мочеиспускания уже на 1-й неделе лечения.
Хронический простатит (симптомы нижних мочевых путей)
Проанализированы результаты лечения 66 пациентов с ХП и СХТБ. Их средний возраст составил 50,2 года (табл. 5).
Таблица 5. Влияние зоксона и фокусина на основные функциональные показатели у пациентов с хроническим простатитом (СХТБ),
сокра-тительна
Показатель Зоксон Фокусин До лечения После лечения До лечения После лечения Баллы по шкале IPSS 20,8±2,7 10,7±2,9 21,3±2,6 10,9±3,1 Баллы по шкале QOL 4,3±0,8 1,5±0,6 4,8±1,4 1,5±0,6 V остаточной мочи, мл 320,0±42,6 50,0±10,2 300,0±54,8 48,2±9,0 Qmax, мл/с 5,9±0,8 15,2±1,8 6,0±1,1 15,1±2,0 Благодаря применению α1-адреноблокаторов зоксона и фокусина наблюдалось симптоматическое улучшение у 99% пациентов с ХП (СХТБ): уменьшение суммы баллов по шкалам IPSS и QOL, возросло значение Qmax, снизился объём остаточной мочи.
Профилактика острой задержки мочи
С целью профилактики послеоперационной задержки мочи, а также для сокращения времени катетеризации мочевого пузыря препараты применяли по следующей схеме: зоксон - 1 мг/сут до операции, в послеоперационный период - 4 мг/сут в течение 2 дней; фокусин - по 1 капсуле до операции и в течение 2 сут после операции.
Все пациенты принимали препарат в положении лёжа при тщательном контроле артериального давления. Благодаря лечению у большинства пациентов быстро (в течение первых суток после операции) восстанавливалось самостоятельное мочеиспускание. Не наблюдалось ни одного случая послеоперационной задержки мочи.
У всех пациентов во время лечения не было ни одного отказа от терапии зоксоном и фокусином. Отмечалась хорошая переносимость этих препаратов.
ВЫВОДЫ
1. Зоксон и фокусин являются эффективными препаратами для лечения обструктивной и ирритативной симптоматики болезней мочевого пузыря, предстательной железы и уретры. Применив этих α1-адреноблокаторов при болезнях ПЖ приводит к достоверному снижению баллов по шкале IPSS, улучшению качества жизни пациентов, увеличению максимальной скорости мочеиспускания и уменьшению объёма остаточной мочи.
2. Лечение зоксоном и фокусином хорошо переносится пациентами.
3. Применение зоксона и фокусина у пациентов в пред- и послеоперционный периоды позволяет сократить время катетеризации мочевого пузыря и уменьшить возможные неблагоприятные последствия катетризации, предупредить развитие послеоперационной задержки мочи.
4. Зоксон и фокусин могут быть рекомендованы для лечения пациентов с доброкачественной гиперплазией ПЖ, хроническим простатитом, синдромом хронической тазовой боли, а также в пред- и послеоперационный периоды с целью предупреждения задержки мочи и сокращения времени катетеризации.
Литература
1. Аляев Ю.Г., Борисов Б.В., Мельников А.В. Применение альфа-адреноблокаторов для профилактики и лечения послеоперационной острой задержки мочи // Актуальные вопросы урологии: Материалы юбилейной науч.-практ. конф., посвященной 100-летию клиники им. А.В.Вишневского. Казань, 17 нояб. 2000 г. - Казань: Медицина, 2000. -С. 47-52.
2. Антипов Д.В. Неотложные аденомэктомия и трансуретральная электрорезекция аденомы предстательной железы: Автореф. дис.... канд. мед. наук. - М., 1982. - 20 с.
3. Хомяков Б.К. Неотложное хирургическое лечение больных аденомой предстательной железы, осложнённой хронической почечной недостаточностью: Автореф. дис.... канд. мед. наук. - Л., 1986. - 19 с.
4. Лоран О.Б., Вишневский Е.Л., Вишневский А.Е., Данилов В.В. // Урология. - 2000. -№ 2, прил. - С. 14-19.
5. ПушкарьД.Ю., Лоран О.Б., Раснер П.И. // Consilium med. - 2002. - Т. 4, № 7. - С. 19.
6. Аbbои М., Salomon М., Chopin М. et al. //Ann. Urol. Paris. -1996. - Vol. 30 - P. 302-310.
7. Choong S., Emberton M. // BJU Intern. - 2000. - Vol. 85. - P. 186-201.
8. Kaplan SA, Bowers D.L., Te A.E., Olsson С A //J. Urol. - 1996. - Vol. 155 (4). - P. 1305-1308.
9. Kaplan SA, Bowers D.L., Те A. E., Olsson CA // J. Urol. - 1996. - Vol. 155 - P. 1305-1308.
10. Lepor H. // Urol. Clin. North. Am. - 1995. -Vol. 22.-P. 375-386.
11. Luzzi G. // Int. STD AIDS. - 1996. -Vol. 7. - P. 471-478.
12. Marberger M.J., Andersen J.T., Nickel J.C. et al. // Eur. Urol. - 2000. - Vol. 38. - P. 563-568.
13. McNaughton-Collins M., Stafford R.S. et al. //J. Urol. - 1998. - Vol. 159. - P. 1224-1228.
14. McNeill S.F., Daruwala P.D., Mitchell I.D.C. et. al. // BJU Intern. - 1999. - Vol. 84. -P. 622-627.
15. Zermann D.H., Schmidt R.A. Neurophysiology of the pelvic floor: Its role in prostate and pelvic pain. Textbook of prostatitis. -Oxford: UK, ISIS Medical Media, 1999. -P. 95-105.
| Сентябрь 2010 г. |