Опубликовано в журнале:
УРОЛОГИЯ, 2009, № 5Возможности комбинированной терапии доксазозином и финастеридом в лечении больных с аденомой простаты больших размеров
Н. И. Тарасов, Р. И. Измайлов
Кафедра урологии и андрологии (зав. - проф. Н. И. Тарасов) ГОУ ДПО Уральская государственная медицинская академия дополнительного образования Росздрава, ЧелябинскВведение. Аденома предстательной железы (АПЖ) является одним из частых заболеваний мужчин пожилого и старческого возраста. Заболевание с возрастом прогрессирует, о чем убедительно свидетельствуют материалы специальных исследований [1].
Уместно отметить, что широкое использование только а1-адреноблокаторов как препаратов первой линии в консервативной терапии АПЖ привело к увеличению доли больных с большими (более 80 см3) размерами простаты при обращении к урологу [2]. Отечественные и зарубежные авторы, анализируя результаты исследований таких больных, отмечают, что у них преобладают обструктивные симптомы, имеется повышенный риск прогрессировать заболевания и развития осложнений - острой задержки мочеиспускания, высока вероятность операции [3-5]. Вполне очевидно, что общие принципы терапии этого страдания при большой массе предстательной железы не всегда приемлемы.
В современных условиях целью терапии АПЖ являются облегчение симптомов заболевания и улучшение качества жизни, а также профилактика дальнейшего прогрессирования болезни, осложнений и риска оперативного вмешательства [1]. Согласно этой концепции, в качестве основного принципа консервативного лечения АПЖ рекомендовано использование ингибиторов 5а-редуктазы в сочетании с а1-адреноблокаторами [1, 3, 5]. При большой массе простаты возможности такой программы лечения АПЖ изучены недостаточно. Кроме того, при возникновении показаний к операции по-прежнему дискутабельным остается вопрос о выборе способа операции - открытой чреспузырной аденомэктомии или трансуретральной резекции (ТУР).
В зарубежной литературе приводятся убедительные данные об успешном использовании гольмиевого лазера и техники HoLEP (Holmium Laser Enucleation of the Prostate) у больных с АПЖ независимо от массы органа. Но, несмотря на обнадеживающие данные о том, что эта техника является новым "золотым" стандартом оперативного лечения АПЖ [6-9], тогда как ряд авторов полагают, что при большой массе предпочтительной является открытая операция [10].
У больных с массой простаты до 60 см3 общепризнанным стандартом лечения является ТУР. Она позволяет избежать ряда осложнений, связанных с аденомэктомией, и дает возможность произвести оперативное вмешательство с меньшим риском для больного. По эффективности она не уступает открытой операции и обладает рядом преимуществ: меньшая инвазивность, возможность повторения без повышения риска для больного, сокращение длительности реабилитационного периода [2, 11].
Нерешенным остается вопрос о возможности и путях расширения показаний к ТУР у больных с АПЖ больших размеров. Ограничения к ТУР в этой ситуации обусловлены большой продолжительностью операции, с которой связаны грозные осложнения - кровотечение и дилюционная гипонатриемия (ТУР-синдром). Возможности выполнения ТУР простаты массой более 60 см3 возрастают при применении биполярной резекции в среде физиологического раствора [12], системы супрапубического дренирования (система низкого давления) [13]. Опубликованы и другие подходы.
Одним из способов снижения риска развития осложнений ТУР у больных с АПЖ является назначение им перед операцией ингибиторов 5а-редуктазы [2, 3, 14, 15]. Авторы установили, что с помощью финастерида достигается снижение плотности сосудов за счет ингибирования сосудистого эндотелиального фактора [16, 17] и назначение этого препарата на 3 мес перед планируемой операцией на предстательной железе позволяет уменьшить объем интраоперационной кровопотери [2, 14, 15, 18].
Однако в опубликованных работах продолжительность приема ингибиторов 5a-редуктазы была от 38 сут [2] до 3 мес [14, 15, 18]. Авторы этих публикаций справедливо отмечают, что длительность предоперационного лечения требует дальнейших исследований, в том числе с учетом потенциального уменьшения массы простаты, которое обычно наступает после достаточно продолжительного приема препарата. Это особенно важно для больных с АПЖ при большой массе простаты. В связи с этим целью настоящего исследования явилась оценка эффективности и безопасности продолжительного (более 6 мес) применения комбинированной терапии для подготовки к ТУР у пациентов с большой массой простаты.
Материалы и методы. В период с 2006 по 2008 г. под нашим наблюдением находилось 38 больных с АПЖ с большой массой простаты (89,54 ± 11,64 см3), средний возраст которых до лечения составил 68,26 ± 7,97 года. Длительность заболевания в среднем 26,05 мес (медиана 18 мес, 25-й процентиль - 12 мес, 75-й процентиль - 36 мес). Больные обследованы до и после лечения. У всех больных отсутствовали указания на ранее проводимую терапию ингибиторами 5а-редуктазы, на наличие коагулопатий и подозрения на рак простаты.
Для обоснования показаний к лечению и оценки его результатов учитывали степень выраженности клинических проявлений заболевания по Международной шкале IPSS, показатель качества жизни пациентов. Уродинамические исследования проводили на аппарате "Urocap III" ("Laborie medical technologies", Канада).
Ультразвуковое исследование предстательной железы проводили на аппарате "Toshiba Xario XG" (Япония). При трансректальном сканировании оценивали эхоструктуру, размеры предстательной железы и транзиторной зоны. Объем простаты и транзиторной зоны (в см3) рассчитывали по формуле неправильного эллипсоида - V = продольный размер (в см) х поперечный размер (в см) х переднезадний размер (в см) х 0,52. Индекс транзиторной зоны использовали как показатель наличия анатомической инфравезикальной обструкции [19, 20]. Он определяется отношением объема транзиторной зоны к объему простаты. При трансабдоминальном сканировании оценивали состояние мочевого пузыря, толщину его стенки, а также контуры, форму, размеры, объем предстательной железы и количество остаточной мочи.
Определяли также уровень общего простатоспецифического антигена (ПСА) в сыворотке крови количественным методом. При подозрении на рак простаты выполняли мультифокальную биопсию под ультразвуковым наведением.
Показанием к комбинированному лечению доксазозином и финастеридом у больных с аденомой простаты больших размеров считали выраженные расстройства акта мочеиспускания, наличие дневной и ночной поллакиурии, остаточной мочи до 150 мл, а также высокий риск прогрессирования заболевания и вероятность развития осложнений.
Изначально всем 38 больным сообщалось о цели комбинированного лечения - выполнить ТУР после консервативной терапии. Им было проведено комбинированное лечение а1-адреноблокатором доксазозином 1 мг (зоксон) и ингибитором 5a-редуктазы финастеридом 5 мг (пенестер). Дозу доксазозина не титровали, так как отмечался эффект, не требовавший повышения его дозы. Терапию больные получали в течение 5-12 мес, в среднем 7,26 мес (медиана 7 мес, 25-й процентиль - 6 мес, 75-й процентиль - 8 мес).
По окончании терапии после контрольного обследования 20 больным была выполнена ТУР простаты. Показаниями к операции считали сохранение умеренной симптоматики по шкале IPSS, а также, согласно рекомендациям Европейской ассоциации урологов, отказ больного от медикаментозной терапии по разным причинам и требование оперативного лечения, направленного на радикальное избавление от этого страдания. Абсолютных показаний к операции [1, 3, 21] - рефрактерной задержки мочеиспускания, хронической почечной недостаточности, инфекции мочевыводящих путей или гематурии, устойчивой к терапии финастеридом, у больных не было.
У 18 из 38 наблюдаемых больных удалось избежать операции при наличии мотивации с их стороны продолжить консервативное лечение. Нами были проанализированы особенности операции, течение послеоперационного периода у 20 больных с большой массой простаты, которым была проведена комбинированная терапия доксазозином и финастеридом, в сравнении с контрольной группой больных (28 человек), которым выполнена стандартная ТУР простаты без предварительного медикаментозного лечения. До комбинированного лечения больные обеих групп по массе простаты и возрасту статистически были равнозначны. Несмотря на то что у больных основной группы перед операцией масса простаты уменьшилась до 70,55 ± 9,99 см3, считаем такое сравнение обоснованным, так как сравнивали два вида лечения: ТУР простаты у больных с аденомой простаты больших размеров, предварительно получавших комбинированную терапию (1-я группа - основная), и ТУР простаты у больных с большой массой (2-я группа - контрольная) без предварительного медикаментозного лечения. Подобный подход был представлен А. Г. Мартовым и Д. В. Ергаковым [2], которые сравнивали результаты ТУР при применении тамсулозина и комбинации этого препарата с дутастеридом. В их статье отсутствовали данные об уменьшении массы предстательной железы, вероятно в связи с кратковременным использованием дутастерида.
Операцию выполняли под спинномозговой анестезией по методике Barnes в одинаковых технических условиях: монополярная коагуляция, проточный резектоскоп "Karl Storz" типа "Iglesias" с наружным диаметром тубуса 26 Ch. Анализировали длительность операции, объем резецированной ткани, длительность дренирования мочевого пузыря уретральным катетером в послеоперационном периоде, объем кровопотери в миллилитрах, который рассчитывали по формуле [2]:
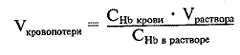 где СHb - содержание гемоглобина в крови; Vраствора - oбъем ирригационного раствора; СНb в растворе - содержание гемоглобина в ирригационном растворе.
где СHb - содержание гемоглобина в крови; Vраствора - oбъем ирригационного раствора; СНb в растворе - содержание гемоглобина в ирригационном растворе.Оценивали также количество, характер осложнений и результаты лечения в каждой группе.
Материал обрабатывали с помощью программного пакета для статистической обработки данных SPSS 13.0. Для определения типа распределения количественного признака выборки использовали тест Колмогорова-Смирнова. В случае, если выборка была извлечена из нормально распределенной совокупности, применяли параметрические методы статистики. При сравнении двух независимых групп применяли критерий Стьюдента. Для анализа повторных изменений использовали парный критерий Стьюдента. В случае асимметричного распределения признака в группе использовали методы непараметрической статистики. Для анализа двух независимых выборок использовали тест Манна-Уитни, а для повторных изменений - критерий Вилкоксона. Различия считали статистически значимыми при значении р < 0,05 [22].
Результаты. Положительный эффект от комбинированного лечения доксазозином и финастеридом был достигнут у всех 38 больных с аденомой простаты больших размеров, результаты приведены в табл. 1 (рис. 1).
Таблица 1.Результаты лечения больных АПЖ пенестером и зоксоном (n = 38)
Критерий оценки результатов лечения Исходные данные После лечения Степень достоверности (р) Суммарный балл по шкале IPSS 21,21 ± 4,35 15,89 ± 5,86 < 0,0001* Показатель качества жизни, баллы 4,42 ± 0,13 3,13 ± 0,16 < 0,0001** Количество остаточной мочи, мл 68,37 36,03 < 0,001** Объем предстательной железы, см3 89,54 ± 11,64 70,55 ± 9,99 < 0,0001* Индекс транзиторной зоны 0,73 ± 0,039 0,65 ± 0,057 < 0,0001* Уровень ПСА, нг/мл 5,96 2,16 < 0,0001** Примечание.* - парный критерий Стьюдента, ** - критерий Вилкоксона.Рис. 1. Урофлоуграмма больного К., 83 лет, до начала комбинированной терапии.
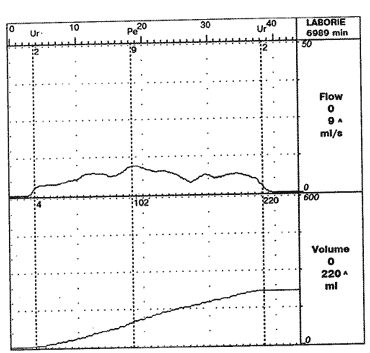
Из табл. 1 видно, что одновременно со снижением суммарного балла симптоматики достоверно улучшалось и качество жизни пациентов. В процессе комбинированного лечения показатели максимальной скорости мочеиспускания, объема остаточной мочи достоверно улучшились. Через 7,26 мес комбинированного лечения объем предстательной железы достоверно уменьшился на 19 см3, наряду с этим отмечено снижение индекса транзиторной зоны, что позволяет сделать заключение о том, что комбинированная терапия эффективна в устранении инфравезикальной обструкции. Достигнуто также снижение уровня общего ПСА с 5,96 нг/мл до лечения до 2,16 нг/мл к завершению курса терапии.
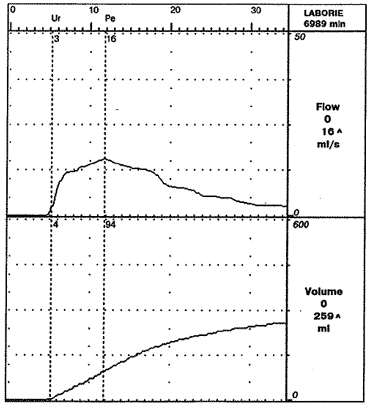
Констатировано существенное улучшение акта мочеиспускания практически у всех больных, однако у 1 больного после лечения на фоне зафиксированного уменьшения массы простаты, уменьшения индекса транзиторной зоны отмечено ухудшение симптоматики и качества жизни (рис. 2). Это произошло, вероятно, из-за образовавшихся в мочевом пузыре камней. Больному была выполнена ТУР простаты с цистолитотрипсией с хорошим результатом.
Рис. 2. Урофлоуграмма того же больного через 8 мес терапии доксазозином и финастерйдом.
18 (47,3%) из 38 больных отказались от выполнения ТУР простаты и продолжили комбинированную терапию как эффективную в лечении симптомов, обусловленных АПЖ.
Приводим сравнительный анализ характера операции и ее результатов у больных основной и контрольной групп. У больных, ранее получавших комбинированную терапию доксазозином и финастеридом, было резецировано достоверно меньшее количество аденоматозной ткани, на что потребовалось меньше времени по сравнению с контрольной группой. Уменьшение массы простаты, плотности сосудов в ней привело к уменьшению объема интраоперационной кровопотери - 98,50 ± 41,58 мл в основной и 147,1 ± 71,27 мл в контрольной группе (р = 0,0089). Это нашло отражение в длительности дренирования мочевого пузыря по уретре в послеоперационном периоде - 20,70 и 31,07 ч соответственно в основной и контрольной группах (р = 0,007).
Таким образом, предпринятое комбинированное лечение у 20 из 38 больных с АПЖ больших размеров позволило эффективно выполнить ТУР простаты без развития осложнений, тогда как 3 (10,7%) из 28 больных контрольной группы потребовалась гемотрансфузия свежезамороженной плазмы. У 1 (3,5%) больного лабораторно было зафиксировано начало развития ТУР-синдрома, которое купировано неотложной помощью в отделении реанимации. У1 (3,5%) больного развился острый простатит с последующей стриктурой задней уретры и необходимостью последующей ТУР шейки мочевого пузыря с хорошим результатом.
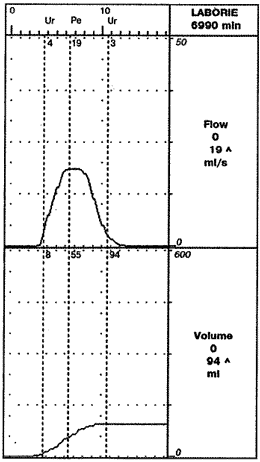
Отдаленные результаты ТУР у больных с АПЖ обеих групп (с предварительной медикаментозной подготовкой и контрольной), в среднем через 6 мес, оказались сопоставимыми (рис. 3). Различия имели место только в уровне общего ПСА в сыворотке крови - 0,91 нг/мл в 1-й и 1,87 нг/мл во 2-й группе (р = 0,017). Можно допустить, что более низкий уровень ПСА в основной группе обусловлен активацией апоптоза ингибиторами 5a-редуктазы в ткани АПЖ у больных при гистологически доказанном отсутствии рака простаты либо влиянием терапии на имеющееся сопутствующее воспаление.
Рис. 3. Урофлоуграмма того же больного через 6 мес после ТУР простаты.
Обсуждение. У больных с большой массой простаты риск развития осложнений и необходимости в операции всегда высок, преобладают обструктивные симптомы и имеется высокий риск прогрессирования заболевания. С другой стороны, несмотря на имеющиеся возможности консервативной терапии - уменьшить массу простаты, приостановить прогрессирование болезни, радикальным по-прежнему остается только оперативный метод.
ТУР простаты у больных с АПЖ большой массы даже на фоне постоянно совершенствующегося оборудования по-прежнему сопряжена с серьезными осложнениями - инфекционного характера, массивным кровотечением, требующим проведения гемотрансфузии, и синдромом дилюционной гипонатриемии. Уролог, выполняющий ТУР, ограничен во времени, а при большой массе простаты уложиться в заданный интервал времени не всегда возможно.
Таблица 2. Результаты ТУР простаты у больных с большой массой простаты в основной и контрольной группах
Критерий оценки результатов лечения Основная группа (n = 20) Контрольная группа (n = 28) Степень достоверности (р) Длительность операции, мин 44,50 65,54 < 0,0001** Кровопотеря, мл 98,50 ± 42,58 147,1 ± 71,27 0,0089* Масса резецированной ткани, г 46,25 ± 7,41 62,14 ± 11,58 < 0,0001* Длительность стояния уретрального катетера, ч 20,70 31,07 0,007** Примечание. Здесь и в табл. 3: * - критерий Стьюдента, ** - тест Манна-Уитни.Таблица 3. Отдаленные результаты ТУР простаты у больных основной и контрольной групп
Критерий оценки результатов лечения Основная группа (n = 20) Контрольная группа (n = 28) Ошибка (Р) Суммарный балл по шкале IPSS 5,10 ± 0,53 5,85 ± 0,58 0,3661* Показатель качества жизни, баллы 1,70 ± 0,16 1,53 ± 0,14 0,4690* Количество остаточной мочи, мл 8,75 3,89 0,44** Объем предстательной железы, см3 21,95 ± 0,78 21,25 ± 0,98 0,593* Индекс транзиторной зоны 0,12 ± 0,02 0,09 ± 0,01 0,2102* Уровень ПСА, нг/мл 0,91 1,87 0,017** Опубликованные ранее данные о краткосрочных курсах терапии ингибиторами 5a-редуктазы у больных с АПЖ в качестве подготовки к планируемой ТУР простаты свидетельствуют о хороших результатах как самой операции, так и послеоперационного периода. У таких больных исследователи оценивали степень изменений в кровоснабжении простаты (показатели кровотока - допплеровскими методами), стромально-эпителиальное соотношение (гистологическими методами), а также объемы кровопотери [2, 3, 14, 15, 18]. Ими берутся в расчет эффекты, вызванные уменьшением плотности сосудов, через влияние на андрогензависимые факторы, посредством снижения образования дигидротестостерона в простате. Это реализуется супрессией ангиогенеза через влияние на сосудистый эндотелиальный фактор роста (VEGF) [16, 17, 23, 24]. Однако анализ эффективности проводился при кратковременных приемах финастерида и без учета возможного уменьшения массы простаты. По данным многоцентровых рандомизированных исследований длительный прием этого препарата способствует уменьшению массы простаты на 18-30% (исследования PLESS, MTOPS, PREDICT, PROSPECT, PROWESS и т. д.) [3-5].
Нами после применения комбинированной терапии на протяжении 7,26 мес отмечено сокращение массы простаты у больных на 21% (с 89,54 ± 11,64 до 70,55 ± 9,99 см3), что сопоставимо с данными литературы. Используя комбинированную терапию у больных с АПЖ с большой массой простаты для подготовки к операции, у ряда больных можно полностью избежать операции [3-5]. В такой ситуации 18 наблюдаемых нами больных решили продолжить комбинированное лечение и отказались от радикального лечения даже малотравматичным методом.
Ингибиторы 5а-редуктазы вызывают редукцию эпителиальной ткани, вместе с тем достигается уменьшение плотности сосудов. Это позволило нам выполнить операцию за более короткое время и с меньшей кровопотерей, а также избежать осложнений инфекционно-воспалительного характера. Как и в работах А. Г. Мартова, А. А. Камалова, В. Н. Ткачука и их соавторов, в наших наблюдениях результаты лечения (величина кровопотери, длительность операции, количество осложнений и другие критерии) были достоверно выше в основной группе [2, 14, 15]. Отдаленные результаты у наблюдаемых больных оказались хорошими.
Заключение. Анализ полученных нами результатов позволяет сделать вывод, что длительная (более 6 мес) комбинированная терапия доксазозином и финастеридом больных с аденомой простаты больших размеров дает возможность улучшить суммарный балл IPSS, качество жизни и достоверно уменьшить массу простаты на 21%.
Благодаря уменьшению массы простаты, ее транзиторной зоны достигается возможность успешно выполнить ТУР с меньшей продолжительностью пособия и более благоприятным течением послеоперационного периода по сравнению с пациентами, которым выполняли ТУР аденомы больших размеров без предварительной терапии.
С другой стороны, у значительного числа пациентов с большой массой предстательной железы улучшение клинической симптоматики и объективных показателей мочеиспускания и уменьшение массы в соответствии с мотивацией пациентов позволяют воздержаться от операции и продолжить консервативное лечение.
Это дает основание считать, что у больных с аденомой простаты больших размеров комбинированная терапия доксазозином и финастеридом может рассматриваться как стартовый этап для подготовки к ТУР и выбора метода дальнейшего лечения.
Ключевые слова: аденома простаты, консервативное лечение, оперативное лечение, результаты лечения
ЛИТЕРАТУРА
1. Novara G, Galfano A., Gardi М. et al. Critical review of guidelines for BPH diagnosis and treatment strategy. Eur. Urol. Suppi. 2006; 5: 418-429.
2. Мартов А. Г., Ергаков Д. В. Опыт применения дутастерида перед трансуретральной резекцией простаты по поводу аденомы больших размеров. Урология 2008; 4: 46-50.
3. Аляев Ю. Г., Винаров А. 3., Локшин К. Л., Спивак Л. Г. Выбор метода лечения больных гиперплазией предстательной железы. М.: Клиника урологии ММА им. И. М. Сеченова; 2005.
4. McConnell J. D., Bruskewitz R., Walsh P. et al. The effect of finasteride on the risk of acute urinary retention and the need for surgical treatment among men with benign prostatic hyperplasia. N. Engl. J. Med. 1998; 338: 557-563.
5. Madersbacher S., Marszalek M., Lackner J. et al. The long-term outcome of medical therapy for BPH. Eur. Urol. 2007; 51: 1522-1531.
6. Kuntz R. M., Lehrich K., Ahyai S. A. Holmium laser enucleation of the prostate versus open prostatectomy for prostates greater than 100 grams: 5-year follow-up results of a randomised clinical trial. Eur. Urol. 2008; 53: 160-168.
7. Vavassori L., Volenti S., Naspro R. et al. Three-year outcome following Holmium laser enucleation of the prostate combined with mechanical morcellation in 330 consecutive patients. Eur. Urol. 2008; 53: 599-606.
8. Gilling P. J., Aho Т. E, Frampton С. M. et al. Holmium laser enucleation of the prostate: results at 6 years. Eur. Urol. 2008; 53: 744-749.
9. Elzayat E. A., Elhilal M. M. Holmium laser enucleation of the prostate (HoLEP): Long-term results, reoperation rate, and possible impact of the learning curve. Eur. Urol. 2007; 52: 1465-1472.
10. Rigatti P., Cestari A., Gilling P. Open to debate. The motion: Large BPH should be treated by open surgery. Eur. Urol. 2006; 51: 845-848.
11. Сергиенко H. Ф., Романов К. E., Шаплыгин Л. В., Бегаев А. И. Ошибки, опасности и осложнения при трансуретральной резекции гиперплазии предстательной железы. Урология 2000; 6: 29-34.
12. Issa M. M., Young М. R., Bullock A. R. et al. Dilutional hyponatremia of TURP syndrome: A historical event in the 21st century. J. Urol. 2004; 64: 298-301.
13. Манагадзе Г., Хвадагиани Г., Церетели А. и др. Трансуретральная резекция простаты без ограничения массы простаты, 10-летний опыт. В кн.: Материалы X Российского съезда урологов. М.; 2002. 142.
14. Камалов А. А., Рябой А. В., Игнашин Н. С. и др. Применение проскара в качестве предоперационной подготовки больных с доброкачественной гиперплазией простаты перед трансуретральной ее резекцией. Урология 2002; 5: 16- 19.
15. Ткачук В. Н., Алъ-Шукри С. X, Ткачук И. Н. Применение финастерида при подготовке больных аденомой предстательной железы к трансуретральной резекции простаты. Урология 2008; 1: 27-31.
16. Pareek G., Shevchuk М., Armenakas N. A. et al. The effect of finasteride on the expression of vascular endothelial growth factor and microvessel density: A possible mechanism for decreased prostatic bleeding in treated patients. J. Urol. (Baltimore) 2003; 169: 20-23.
17. Hochberg D. A., Basillote J. В., Armenakas N. A. et al. Decreased suburethral prostatic microvessel density in finasteride treated prostates. J. Urol. (Baltimore) 2002; 167: 1731-1733.
18. Sanfeldt L., Bailey D., Hahn R. Blood loss during transurethral resection of the prostate after 3 months of treatment with finasteride. Urology 2001; 58: 972-976.
19. Kaplan S. А., Те A. E., Pressler L. В., Olsson C. A. Transition zone index as a method of assessing benign prostatic hyperplasia: correlation with symptoms, urine flow and detrusor pressure. J. Urol. (Baltimore) 1995; 154: 1764-1769.
20. Абоян И. А., Головко С. Ю., Хишарьян А. Г. и др. Шкала диагностики инфравезикальной обструкции у больных с доброкачественной гиперплазией простаты. Урология 1998; 6: 32-37.
21. Мартов А. Г., Лопаткин Н. А. Руководство по трансуретральной эндоскопической электрохирургии доброкачественной гиперплазии предстательной железы. М.: Триада X; 1997.
22. Гланц С. Медико-биологическая статистика: Пер. с англ. М.: Практика; 1998.
23. Donohue J. F., Sharma H., Abraham R. et al. Transurethral prostate resection and bleeding: A randomized, placebo controlled trial of the role of finasteride for decreasing operative blood loss. J. Urol. (Baltimore) 2002; 168: 2024-2026.
24. Puchner P. J., Miller M. I. The effects of finasteride on hematuria associated with benign prostatic hyperplasia: A preliminary report. J. Urol. (Baltimore) 1995; 154: 1779-1782.
| Сентябрь 2010 г. |