Правила . . Технология и оборудование для покраски дисков . |
Опубликовано в журнале:
Трудный пациент, №3, том 5, 2007.Эффективность и безопасность комбинированного применения доксазозина и финастерида при лечении доброкачественной гиперплазии предстательной железы
А.Б. Богданов, И.В. Лукьянов, Е.И. Велиев
Кафедра урологии и хирургической андрологии РМАПО, МоскваДоброкачественная гиперплазия предстательной железы (ДГПЖ) является широко распространённым заболеванием мужчин среднего и пожилого возраста [1]. Клинические проявления заболевания определяются степенью нарушения оттока мочи. Симптомокомплекс заболевания включает обструктивные и ирритативные симптомы, которые объединяют в симптомы нижних мочевых путей (СНМП). Инфравезикальная обструкция наблюдается чаще всего при ДГПЖ, однако при обследовании подобных пациентов необходимо исключить целый ряд заболеваний мочевого пузыря и предстательной железы. Хотя симптомы нарушения оттока мочи (слабая струя, прерывистое мочеиспускание) встречаются значительно реже, чем ирритативные симптомы (учащённое мочеиспускание малыми порциями, никтурия, императивные позывы, недержание мочи), они являются доминирующими среди симптомов, снижающих качество жизни пациентов [2].
Данные аутопсий свидетельствуют, что признаки ДГПЖ обнаруживаются у 42 % мужчин в возрасте 51-60 лет и увеличиваются до 85 % у мужчин старше 80 лет [3]. Клинические исследования показывают, что СНМП преобладают и прогрессивно нарастают с возрастом [4]. Поэтому около 25 % мужчин после 50 лет имеют симптомы нижних мочевых путей (СНМП), выраженность которых обычно определяется суммой баллов Международной Шкалы Симптомов Предстательной железы (I-PSS), которая была разработана для объективизации клинических проявлений ДГПЖ [5, 6]. В связи с ростом продолжительности жизни в Европе число пожилых людей преклонного возраста растёт и через 10-20 лет значительно увеличится. Вот почему имеет особое значение своевременное лечение ДГПЖ.
На кафедре урологии и хирургической урологии РМАПО впервые в России проведено анкетирование 133 пациентов с использованием интернет-технологий. На сайте клиники респондентам было предложено заполнить анкету I-PSS, если те имеют ту или иную степень расстройства мочеиспускания. Средний возраст отвечавших составил 58 лет. Ответы были распределены по степени нарушения мочеиспускания: лёгкая, средняя и тяжёлая степень. Лёгкая степень нарушения была у 13 (9,7 %) пациентов, средняя степень - у 98 (73,6 %) и тяжёлая степень нарушения мочеиспускания отмечена у 22 (16,5 %) человек. Данные показатели подчёркивают распространённость расстройств мочеиспускания средней степени тяжести среди мужчин, страдающих СНМП. Данные результаты требуют дополнительного обсуждения и оценки, но уже понятно, что они открывают новые горизонты в популяционных исследованиях.
Истинная этиология ДГПЖ остаётся неясной. Большая роль в её развитии придаётся стромальной и железистой пролиферации в периуретральной зоне предстательной железы, связанной с замедленным апоптозом (отсутствием программируемой клеточной гибели) и повышенной пролиферацией клеток, и как результат - увеличение абсолютного объёма аденоматозной ткани [7].
Отношение к консервативной терапии ДГПЖ на протяжении последних 10 лет стремительно менялось. Этот процесс продолжается и сейчас. Если обобщить события, которые произошли за этот срок, можно сказать, что ДГПЖ уже давно вышло за пределы понятия "хирургической патологии". Значительная часть больных в современном мире получают пожизненную консервативную терапию ДГПЖ, что, несомненно, указывает на большие научные достижения в понимании патогенеза данного заболевания. Беседуя с нашими пациентами, мы с каждым годом отмечаем рост числа тех, кто начинает получать лечение на начальных стадиях заболевания, что указывает на рост образования урологов на местах и осведомлённости наших пациентов. Все это влияет на исход, снижая число осложнений заболевания и операций, выполненных по поводу ДГПЖ.
Рассматривая механизм нарушения оттока мочи у больных с ДГПЖ, специалисты выделяют два фактора: пассивный - как результат увеличения массы предстательной железы (ПЖ) и динамический. По некоторым данным, гладкомышечные элементы занимают около 40 % объёма гиперплазированной предстательной железы. Стимуляция а-адренорецепторов (а-АР) в результате роста и прогрессирования ДГПЖ приводит к повышению тонуса гладкомышечных структур [1]. В экспериментах in vivo доказано, что примерно половина общего уретрального давления у мужчин с ДГПЖ регулируется через а-адренергический механизм [8], который, по мнению большинства исследователей, ответственен за развитие динамической обструкции при ДГПЖ. Считается, что a1A подтип рецепторов преимущественно регулирует сокращение гладкомышечных элементов предстательной железы. В свою очередь а-адреноблокаторы (а-АБ), воздействуя на а-АР нижних мочевых путей, приводят к расслаблению гладкомышечных клеток в области шейки мочевого пузыря, стромы, капсулы предстательной железы и простатической уретры, способствуя снижению ирритативной и в определённой мере обструктивной симптоматики [9]. Также установлено, что дисфункция мочевого пузыря при ДГПЖ во многом связана с развитием гипоксии детрузора. По мнению О.Б. Лорана и соавт., а-АБ вызывают улучшение обменных процессов в детрузоре за счёт дилатации пузырных артерий [2].
Лечение ДГПЖ включает наблюдение, фармакотерапию с использованием а-адреноблокаторов (доксазозин, теразозин, альфузозин, силодазин, тамсулозин) и ингибиторов 5-а редуктазы (5АРИ) (финастерид, дутастерид, эпистерид, туростерид) и оперативное лечение. Выбор терапии зависит от выраженности заболевания, сопутствующей патологии, предпочтений пациента и сравнения эффективности и возможных побочных явлений доступной терапии.
Основными направлениями консервативной терапии ДГПЖ являются:
снижение выраженности симптомов, улучшение качества жизни, предотвращение прогрессии заболевания (в частности, предотвращение такого тяжёлого осложнения, как острая задержка мочи, и необходимости оперативного лечения) [10]. Терапия а-АБ в целом переносится хорошо. Редкими нежелательными эффектами являются ортостатическая гипотензия и расстройства эякуляции. Как уже отмечалось, a1-AP располагаются в гладко-мышечных клетках предстательной железы, а а2-АР - в гладкомышечных клетках сердечно-сосудистой системы, что и обуславливает кардиоваскулярные побочные эффекты при приёме неселективных a-АБ. Эти побочные эффекты потенциально могут привести к падениям и переломам [11]. В обновлённом метаанализе плацебо-контролируемых исследований a-АБ, собранном В. Djavan с соавт., показано незначительное число побочных эффектов, таких как головокружение и ортостатическая гипотензия, встречающихся при приёме тамсулозина и альфузозина по сравнению с теразозином и доксазозином [12]. В свою очередь, прямые исследования, направленные на изучение побочных эффектов, показывают, что по сравнению с альфузозином тамсулозин не имеет влияния на артериальное давление, тогда как альфузозин вызывал значительное снижение артериального давления стоя и в положении лёжа [13]. Среди пациентов старше 75 лет, имеющих сердечно-сосудистые заболевания и получающих альфузозин, риск развития головокружения в 1,5 раза выше, чем у пациентов до 60 лет. И наоборот, приём тамсулозина у подобной группы пациентов показал их высокую толерантность к терапии [11].
W. Koff с соавт. в своём двойном слепом исследовании сравнили эффективность и переносимость доксазозина и тамсулозина при лечении ДГПЖ. Авторы нашли почти идентичными улучшение уродинамики, параметров шкалы I-PSS в двух группах с более ранним развитием эффекта при приёме доксазозина. Двенадцатинедельный приём доксазозина, в отличие от группы, получавшей тамсулозин, не приводил к расстройствам эякуляции [14]. В похожем исследовании М. Wyllie с коллегами изучили влияние квиназолина и тамсулозина на сексуальную функцию и показали, что, несмотря на то что квиназолин имеет высокую аффинность к а-1А, а-1В, и а-1D рецепторам нижних мочевых путей, а тамсулозин всего лишь к а-1А и а-1D, последний при концентрациях 0,4 или 0,8 мг демонстрирует взаимодействие с рецепторами серотонина (5-НТ1А) и допамина (D3), что, по всей видимости, может приводить к расстройствам эякуляции [15].
С. Roehrborn в своём мета-анализе привёл данные, что около 1 % пациентов, принимающих а-АБ, сталкиваются с ретроградной эякуляцией. В других плацебо-контролируемых исследованиях, сравнивающих расстройства эякуляции, указывается, что случаи ретроградной эякуляции при приёме альфузозина имели место в 0,6 % случаев [16]. В исследованиях, проведённых в Европе и США, тамсулозин имел наивысшее число нарушений эякуляции, которое составило 5-11 % [16]. Однако, несмотря на существование большого числа нарушений эякуляции у тамсулозина, пожилые пациенты не рассмативают их как большую проблему. К. Hofner также показал, что нарушения эякуляции, вызванные приёмом тамсулозина, не имеют значительного влияния на сексуальную функцию по сравнению с плацебо и альфузозином [17]. Эректильная дисфункция нарастает с возрастом, и, возможно, мужчины, страдающие ДГПЖ, будут получать терапию ингибиторами фосфодиэстеразы 5 типа (силденафил, тадалафил, фарденафил), которые широко используются во всём мире для лечения эректильной дисфункции. Однако, как и а-АБ, эти препараты могут быть причиной сиптоматической гипотензии. Хотя данные по совместному использованию препаратов этой группы в настоящее время ограничены, использование силденафила у пациентов, принимающих а-АБ, ограничено минимальными дозами, как и других препаратов группы ингибиторов фосфодиэстеразы 5 типа.
Чаще всего применяемыми ингибиторами 5АРИ являются финастерид - ингибитор 5-а редуктазы I типа и дутастерид ингибитор 5-а редуктазы I и II типа. Наиболее изученным препаратом группы ингибиторов 5-а редуктазы является финастерид. 5АРИ подавляют изоэнзимы 5-а редуктазы, которые ответственны за превращение тестостерона в дигидротестостерон, стимулирующий увеличение предстательной железы. До конца не ясно, действительно ли этот или какой-либо другой механизм играет роль в симптоматическом и уродинамическом улучшении, вызванном финастеридом. Серией морфологических исследований было продемонстрировано, что финастерид приводит к атрофическим процессам в железистой и стромальной ткани, причём в первом случае изменения обнаруживаются уже через три месяца приёма. По данным различных исследований, уменьшение объёма предстательной железы за три месяца приёма препарата составляет около 18 %, достигая 25 % к 6 месяцам. Важно отметить, что препарат не связывается с андрогеновыми рецепторами и не даёт побочных эффектов, характерных для "классических" гормональных препаратов, являясь эффективным средством лечения больных при остаточной моче не более 100 мл и максимальной скорости мочеиспускания не ниже 5 мл/сек [2]. Побочные эффекты такой терапии крайне редки и составляют около 1 %.
Так как дигидротестостерон потенцирует эффекты тестостерона, нежелательные эффекты в виде сексуальной дисфункции являются закономерными. Как показали современные исследования III фазы, нежелательные эффекты терапии по мере убывания распределились следующим образом: импотенция, снижение либидо, расстройства эякуляции и гинекомастия [18]. Указанное исследование включило 4325 пациентов с ДГПЖ, которые были распределены случайным образом на приём плацебо и дутостерида. Через два года двойной слепой фазы пациенты были переведены в открытую фазу. Нарушения сексуальной сферы были максимальны в первые 6 месяцев терапии и плавно снижались с дальнейшим приёмом препарата. Гинекомастия встречалась реже всего и сохранялась на протяжении всего исследования в пределах 1,3 % на первом и втором годах, 1,8 % на третьем году и 0,7 % на четвёртом. Менее 1 % пациентов были исключены из исследования через два года в связи с нарушениями в сексуальной сфере [18].
Одним из эффектов применения 5АРИ является снижение уровня ПСА, которое может сказаться на раннем выявлении рака предстательной железы. По данным, приведённым F. Debruyne и соавт., уровень ПСА снижается до 53 % от первоначального уровня к двум годам терапии и до 57 % - к четырём годам терапии [18]. По данным других авторов, уровень ПСА у пациентов, принимающих 5АРИ, должен быть увеличен в два раза и только после этого может быть сравнён с возрастными нормами. Также необходимо отметить, что на фоне терапии дутастеридом уровень сывороточного тестостерона остаётся физиологическим, повышаясь до 20 % ко второму году, и удерживается на таковом уровне до четвёртого года. В случае терапии финастеридом также отмечено незначительное, но статистически значимое повыение уровня сывороточного тестостерона по сравнению с плацебо [19].
Как было показано в исследовании MTOPS, использование финастерида и доксазозина имеет наибольшее преимущество в лечении симптомов нижних мочевых путей и увеличении максимальной скорости мочеиспускания, чем этих препаратов по отдельности [20].
В том же исследовании было продемонстрировано, что применение комбинированной схемы лечения препаратами группы а-АБ и 5АРИ не приводит к увеличению числа нежелательных явлений. Число пациентов, отказывающихся от комбинированной терапии, составило 18 % по сравнению с монотерапией финастеридом (24 %) и доксазозином (27 %). Исследование SMART, где пациенты получали комбинированное лечение тамсулозином и дутастеридом на протяжении некоторого времени, показало, что число пациентов, отказавшихся от терапии, было сравнимо с числом отказов в случае лечения другими препаратами [21]. Подводя итог вышесказанному, хочется указать, что на сегодняшний день показания к комбинированному лечению ДГПЖ значительно расширились.
На кафедре урологии и хирургической андрологии Российской медицинской академии последипломного образования в период с января 2005 по май 2006 г. проведено проспективное исследование, в котором изучалась клиническая эффективность и безопасность комбинированного применения доксазозина (Зоксон) и финастерида (Пенестер) у больных с симптомами нарушения функции ни;них мочевых путей, обусловленных ДГПЖ. Сравнивались данные до и после комбинированного назначения препаратов. В исследовании приняли участие 50 пациентов в возрасте от 53 до 83 лет. Средний возраст составил 67,4 года, а период наблюдения составил 6 месяцев. Оценивалось влияние приёма препаратов на выраженность СНМП по шкале I-PSS, размеры предстательной железы (ТРуЗИ), максимальную скорость потока мочи (Qmax), среднюю скорость потока мочи (Qave), функциональную ёмкость мочевого пузыря (Vcomp), объём остаточной мочи (Vres), артериальное давление, уровень ПСА, сексуальную функцию (МИЭФ), мнение пациента об эффективности терапии, а также наличие нежелательных явлений (НЯ), вызванных приёмом препаратов.
Результаты
За время наблюдения произошло статистически значимое снижение как обструктивных, так и ирритативных СНМП, описываемых шкалой I-PSS. Качество жизни пациентов (QoL), выраженное в баллах, улучшилось с 3,4 до 2,3, (р < 0,01). Количество баллов снизилось соответственно при ответе на первый вопрос с 1,9 до 1,3 баллов, на второй вопрос - с 2,7 до 1,5 баллов, на третий - с 2,2 до 1,9, пятый - с 3,5 до 2,6, шестой - с 1,7 до 1,5, и на седьмой вопрос - с 2,9 до 2 баллов (р < 0,01; см. рис. 1, 2). Сумма баллов снизилась с 16,3 до 12,2 (рис. 3).
Рис 1. Динамика показателей шкалы I-PSS (QoL, вопросы 1-3)
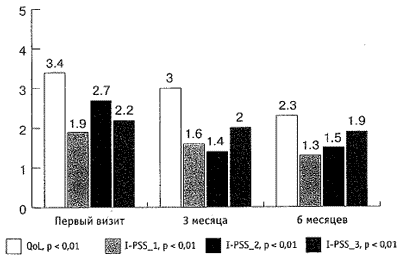
Рис. 2. Динамика показателей шкалы I-PSS (вопросы 5- 7)
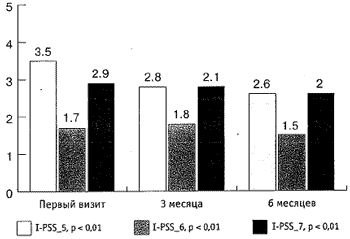
Рис. 3. Динамика суммы баллов шкалы I-PSS
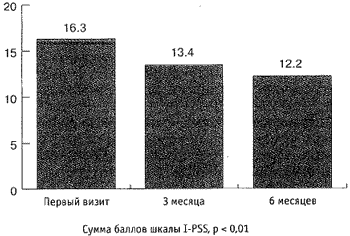
Максимальная скорость мочеиспускания (Qmax) увеличилась с 10,2 мл/сек до 11,6 мл/сек (рис. 5), средняя скорость мочеиспускания увеличилась с 5,4 мл/сек до 6,1 мл/сек, объём остаточной мочи (Vres) снизился с 35,2 мл до 7,7 мл (р < 0,01; рис. 4, 5). Объём ПЖ снизился с 55,8 см3 до 46 см3 (р < 0,01; рис. 6). Снижение ПСА произошло с 2,8 нг/мл до 1,4 нг/мл и составило 1,4 нг/мл, т. е. 50 % (р < 0,01; рис. 6). За время наблюдения не отмечено гемодинамически значимого снижения цифр систолического и диастолического артериального давления (р < 0,01; рис. 7). При оценке эректильной функции выяснилось, что у 11 (22 %) из 50 пациентов не отмечено снижение эректильной функции, 39 (78 %) других половую жизнь на момент первого визита отрицали.
Рис. 4. Динамика показателей Qmax и Qave
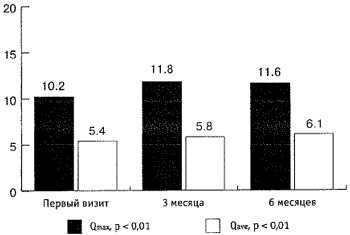
Рис. 5. Динамика объёма остаточной мочи
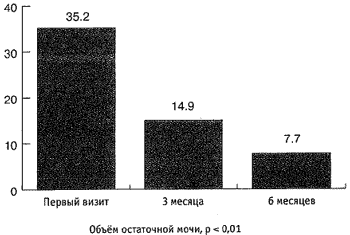
Рис. 6. Динамика объёма предстательной железы
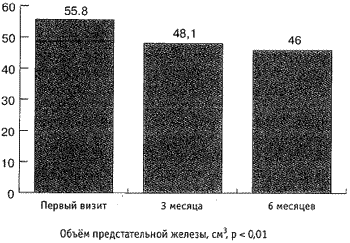
Рис.7. Динамика показателей артериального давления
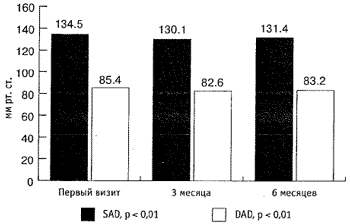
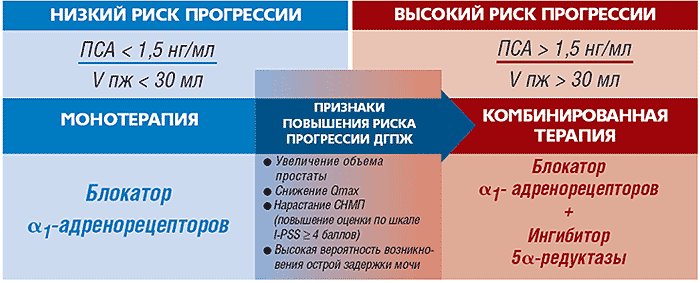
Рис.8. Алгоритм лечения больных ДГПЖ и тактика выбора консервативной терапии
АЛГОРИТМ ЛЕЧЕНИЯ БОЛЬНЫХ ДГПЖ22-24
ДИНАМИЧЕСКОЕ НАБЛЮДЕНИЕ КОНСЕРВАТИВНАЯ ТЕРАПИЯ ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ Рак простаты исключен I-PSS<8 Качество жизни существенно не страдает из-за имеющихся симптомов Балл I-PSS 8-19 QOL >3 Qmах5-15мл/с Объем мочеиспускания >100 мл Объем остаточной мочи <150 мл Наличие противопоказаний к оперативному лечению Социальные причины (отказ от операции и др.) Осложнения ДГПЖ: острая и хроническая задержка мочи, гематурия, камни мочевых путей, большой дивертикул мочевого пузыря Хирургические вмешательства на простате в анамнезе o Рост преимущественно за счет средней доли o Невозможность лекарственной терапии
ВЫБОР КОНСЕРВАТИВНОЙ ТЕРАПИИ
Заключение
Комбинированная схема лечения ДГПЖ (доксазозин + финастерид) приводит к клинически значимому улучшению качества жизни пациентов, параметров мочеиспускания, снижает объём остаточной мочи. Не определялось гемодинамически значимого снижения цифр систолического и диастолического артериального давления. Отмечена хорошая переносимость предложенной терапии. Комбинированная терапия доксазозином и финастеридом может быть рекомендована как основная схема лечения пациентов с риском прогрессии доброкачественной гиперплазии предстательной железы.
Также в результате проделанной работы нами были разработаны алгоритм лечения больных ДГПЖ и тактика выбора консервативной терапии.
Литература
1. Петров С.Б., Левковский Н.С. Современные методы диагностики и лечения больных о доброкачественной гиперплазией предстательной железы. СПб., 1998. С. 14-17.
2. Лопаткин Н.А., Сивков А.В. Доброкачественная гиперплазия предстательной железы. М., 1999. С. 99-102.
3. Berry S.J., Coffey D.S., Walsh Р.С., et al. The development or human benign prostatic hyperplasia with age // J.Urol. 1984. 132.474-79.
4. Logie J. W., Clifford G.M. et al. Lower urinary tract symptoms suggestive of benign prostatic obstruction - Triumph: the role of general practice databases // Eur. Urol. 2001; Vol. 39. (SBppI 3). P. 42-7.
5. Chute C.G., PanserLA., Girman C.J. et al. The prevalence of prostatism: a population-based survey of urinary symptoms // J. Urol. 1993.150. P. 85-9.
6. GarrawayW.M., Collins G.N., Lee R.J. High prevalence of benign prostatic hypertrophy in the community // Lancet 1991. 338. P. 469-71.
7. Bartsch G., МЯller.H.R., OberholzerM. et al. Light microscopic stereological analysis of the normal human prostate and of benign prostatic hyperplasia//J. Urol. 1979. 122. P. 487-491.
8. FuruyaS., Kumamoto Y., Yokoyama E, Tsukamoto T. et al. Alpha-Adrenergic activity and urethral pressure in prostatic zone in benign prostatic hypertrophy//J. Urol. 1982. 128. P. 836-839.
9. Kyprianou N., LitvakJ.P., BorkowskiA., et al. Induction of prostate apoptosis by doxazosin in benign prostatic hyperplasia // J. Urol. 1998. 159. P. 1810-1815.
10. F. Montorsi, I. Moncada Safety and tolerability of treatment for BPH // Eur. Urol. Sappl. 2006. 5. P. 1005.
11. Barendrecfit M.M., Koopmans R.P., de la J.Rosette, et al. Treatment of lower urinary tract symptoms suggestive of benign prostatic hyperplasia: cardiovascular system // BJU int. 2005.95. P. 19-28.
12.Djavan B., ChapleC, MilaniS., etal. State of the art on the efficacy and tolerability of alpha-adrenoreceptor antagonists in patients with low urinary tract symptoms suggestive of benign hyperplasia// Urology. 2004.64. P. 1081-8.
13. Buzelin J.M., Fonteyne E., Kontturi M., et al. Comparison of tamsulosih with alfuzosin in the treatment of patient with lower urinary tract symptoms suggestive of bladder outlet obstruction (symptomatic benign hyperplasia). The European Tamsulosin Study Group // Br. J. Urology. 1997. 80. P. 597-605.
14. Koff W., Bertero E., Pinheiro G., et al. A randomized, double-blind study comparing the efficacy and tolerability of controlled-release doxazosin and tamsulosin in the treatment of benign prostatic hyperplasia // Program and abstracts of the American Urological Association Annual Meeting. May 21-26. 2005. San Antonio, Texas. Abstract. 1643.
15. Hellstrom W., Smith W., Sikka C. Effects of alpha-blockers on ejaculatory function in normal subjects // Program and abstracts of the American Urological Association Annual Meeting. May 21-26. 2005. San Antonio, Texas. Abstract. P. 874.
16. Roehrborn C.G., Van Kerrebroeck P., Nordling J. Safety an.defficacy of alfusozin 10 mg once-daily in the treatment of lower urinary tract symptoms and clinical benign prostatic hyperplasia: a pooled analysis of three double- blind, placebo-controlled stadies // BJU int. 2003.92.257-61.
17. Hofner K., Claes H., De Reijke T.M., et al. Tamsulosin 0,4 mg once daily: effect on sexual function in patints with lower urinary tract symptoms suggestive of benign prostatic obstruction // Eur. Urol. 1999. 36. 335-41.
18. Debruyne F., Barkin J., van Erps P.M., et al. Efficacy and safety of longterm treatment with the dual 56-reductase inhibitir dutasteride in men with symptomatic benign hyperplasia // Eur. Urol. 2004.46.488-95.
19. C.G. Roehorborn, M. Lee, A. Meehan, PLESS Study Groupe. Effects of finasteride on serum testosterone and body mass index in men with benign prostatic hyperplasia // Urology. 2003. 62.894-9.
20. Controlled Clinical Trials the MTOPS // Elsevier science 24. 2003. P. 224-243.
21. Barkin J., Guimaraes M., Jacobi G., et al, on behalf of the SMART-1 Investigator Groupe. Alfa-blocker therapy can be withdrawn in the majority of men following initial combination therapy with the dual 56-reductase inhibitor dutasteride // Eur. Urol. 2003.44.461-6.
22. The 5th International Consultation on ВНР Proceedings. 2001
23. Marks L.S. Preventing BPH Disease in asimptomatic Men at risk of progression. UAU. April/May 2006.
24. MarbergerM. et al., Eur. Urol., 45 (2004) 411-419.
Сентябрь 2010 г.