Опубликовано в: "Hypertension", 1995г, №25, С.92-97.Регресс гипертрофии левого желудочка, вызванный рамиприлом у больных артериальной гипертонией
М. Lievre, P. Gueret, С. Gayet, R. Roudaut, Μ.С. Haugh, S. Delair, J.P. Boissel от группы исследователей HYCARРезюме. Целью настоящего исследования было изучение влияния б-месячной терапии рамиприлом в двух дозах на массу левого желудочка и его зависимости от изменений АД у больных артериальной гипертонией и гипертрофией миокарда. После 4-6-недельной фазы отбора, во время которой больные получали фуросемид в дозе 20 мг/сут, были рандомизированы 1 1 5 пациентов с контролируемой или неконтролируемой артериальной гипертонией и гипертрофией левого желудочка. Им назначали плацебо (n=40) или рамиприл в дозах 1,25 мг (низкая доза; n=38) или 5 мг (обычная доза; n=37) на 6 месяцев. Лечение фуросемидом продолжали в той же дозе. Первичной конечной точкой исследования был регресс гипертрофии левого желудочка, который оценивали с помощью эхокардиографии. Ее проводили исходно и через 6 мес, а результаты анализировали централизованно. Динамика офисного АД или результатов суточного мониторирования АД достоверно не отличалась между тремя группами. Лечение рамиприлом в дозе 5 мг привело к значительному снижению индекса массы миокарда левого желудочка по сравнению с плацебо (-10,8+3,7 и +4,1+4,0 г/м2 соответственно; p=0.008). У больных, получавших рамиприл в дозе 1,25 мг, разница с группой плацебо приближалась к статистически значимой (-7,0+4,3 г/м2; p=0.06). Сходные результаты были получены при анализе динамики массы левого желудочка (-20,3 + 6,6 и-1 3,0+7,8 г/м2 при лечении рамиприлом в дозе 5 и 1,25 мг соответственно и +9,1 ±7,2 г/м2 в группе плацебо; p=0.004 и 0,04 соответственно). С помощью многофакторного регрессионного анализа, в который включили 1 0 переменных, было показано, что этот эффект зависел от терапии рамиприлом в дозах 1,25 и 5,0 мг (p=0.04 и 0,01 соответственно) и исходных значений индекса массы миокарда левого желудочка (p=0.005). Изменения показателей амбулаторного мониторирования АД и офисного систолического или диастолического АД не позволяли предсказать динамику массы миокарда (p=0.15 и 0,1 6 соответственно). Терапия рамиприлом в дозах 1,25 и 5 мг/сут в течение 6 мес вызывает регресс гипертрофии левого желудочка независимо от изменений АД у больных артериальной гипертонией, получающих фуросемид в дозе 20 мг/сут. Необходимо оценить, приводит ли регресс гипертрофии миокарда к снижению сердечнососудистой заболеваемости и смертности.
Ключевые слова: клинические исследования, гипертрофия левого желудочка, эссенциальная гипертония, ингибиторы ангиотензинпревращающего фермента
В начале 70-х годов во Фрамингемском исследовании было показано, что гипертрофия левого желудочка, которую диагностировали с помощью ЭКГ, является фактором риска развития коронарной болезни сердца [1]. Позднее было установлено, что эхокардиографические признаки гипертрофии левого желудочка позволяют прогнозировать развитие сердечно-сосудистых осложнений у больных артериальной гипертонией [2]. В последующем прогностическое значение гипертрофии миокарда, выявленной с помощью эхокардиографии, было подтверждено во Фрамингемском исследовании. В настоящее время ее считают независимым фактором риска, поэтому уменьшение массы миокарда может служить самостоятельной целью антигипертензивной терапии. Прежде чем оценивать роль гипертрофии левого желудочка как потенциальную мишень для терапии, необходимо доказать возможность ее регресса независимо от снижения АД. В последующем могут быть проведены крупные клинические исследования для оценки пользы регресса гипертрофии миокарда сточки зрения профилактики сердечно-сосудистой заболеваемости и смертности.
Во многих неконтролируемых исследованиях антигипертензивная терапия вызывала уменьшение эхокардиографических признаков гипертрофии миокарда левого желудочка. Результаты обзора литературы [4] свидетельствуют о том, что большинство антигипертензивных средств, в том числе ингибиторы ангиотензинпревращающего фермента (АПФ), бета-блока торы, антагонисты кальция и, вероятно, диуретики, способны вызвать регресс гипертрофии левого желудочка. Однако опубликованы результаты только 6 плацебо-контролируемых исследований, в 5 из которых изучались антагонисты кальция [5-10]. В одном из них [5] значительное уменьшение гипертрофии миокарда по сравнению с группой плацебо ассоциировалось со снижением массы тела, но не с антигипертензивной терапией. В оставшихся 5 исследованиях [6-10] результаты анализировали отдельно в каждой группе, а сравнение между группами не проводилось. Хотя прямые сравнительные исследования отсутствуют, полагают, что ингибиторы АПФ оказывают более выраженное влияние на массу миокара, чем препараты других классов. Это позволяет обсуждать роль ренинангиотензиновой системы в развитии гипертрофии левого желудочка [11].
В опытах на животных ингибитор АПФ рамиприл (1 мг/кг) вызывал значительное снижение массы миокарда, в то время как антагонисты кальция и дигидралазин в том же эксперименте при сопоставимом снижении АД не оказывали на нее существенного действия [13]. В этом же исследовании рамиприл в очень низкой дозе (0,01 мг/кг) не давал антигипертензивного эффекта, но вызывал регресс гипертрофии левого желудочка, что указывало на прямое влияние препарата на сердце. Эти данные согласуются с результатами других экспериментов, в которых рамиприл изучали в течение 1 года на той же модели [13].
Чтобы оценить способность рамиприла вызывать регресс гипертрофии левого желудочка (оценивали с помощью эхокардиографии) и возможную зависимость этого эффекта от антигипертензивного действия, мы провели 6-месячное рандомизированное, двойное слепое, плацебоконтро-лируемое, многоцентровое исследование у больных артериальной гипертонией и гипертрофией миокарда (HYCAR - Hypertrophic Cardiaque et Ramipril). Изучали две дозы рамиприла - низкую и стандартную. Массу миокарда измеряли с помощью эхокардиографии. Регистрировали офисное АД и проводили суточное амбулаторное мониторирование АД. Нам представлялось неэтичным оставлять больных артериальной гипертонией без лечения на 6 месяцев (группа плацебо), поэтому было решено, что во время фазы отбора и двойной слепой фазы все пациенты будут принимать антигипертензивный препарат. Выбор фуросемида 20 мг определялся тем, что он используется для лечения артериальной гипертонии во Франции. Рамиприл применяли в стандартной дозе 5 мг, в которой он оказывает антигипертензивное действие, и в низкой дозе 1,25 мг, которая не обеспечивает статистически значимого снижения АД [14].
Методы
Отбор больных
В исследование включали больных с леченной (диастолическое АД менее 110 мм рт. ст.) и нелеченной (диастолическое АД 95-110 мм рт. ст., систолическое АД более 160 мм рт. ст.) артериальной гипертонией и гипертрофией левого желудочка. Критерием ее диагностики было отношение массы миокарда левого желудочка к площади поверхности тела более 1 20 г/м2 у мужчин и более 98 г/м2 у женщин. Эти показатели соответствуют 90-му перцентилю индекса в выборке из 225 здоровых людей [15]. Массу миокарда рассчитывали по формуле Devereux и Reichek [16]. Все пациенты дали письменное информированное согласие на участие в исследовании, протокол которого был одобрен этическим комитетом больницы университета Клода Бернара. Критериями исключения служили возраст более 70 лет, плохое качество эхокардиографического изображения, заболевания сердца, препятствующие интерпретации результатов эхокардиографии, недавно перенесенный инфаркт миокарда, стенокардия, гиперкалиемия или гипокалиемия, лечение ингибитором АПФ.
Дизайн исследования<
Фаза отбора
После оценки критериев отбора, в том числе результатов эхокардиографии, и подписания информированного согласия больных включали в фазу отбора, которая продолжалась от 4 до 6 недель. Во время этой фазы все пациенты получали фуросемид в дозе 20 мг/сут. Все остальные антигипертензивные препараты отменяли (осторожно, чтобы избежать развития синдромы отмены).
Двойная слепая фаза
Если в конце фазы отбора диастол ическое АД составляло менее 110 мм рт. ст. и отсутствовали признаки непереносимости фуросемида, то начинали лечение рамиприлом или плацебо двойным слепым методом. Перед началом второй фазы записывали исходную эхокардиограмму и проводили 24-часовое амбулаторное мониторирование АД. Пациенты продолжали прием фуросемида в той же дозе, к которому добавляли рамиприл в дозе 1,25 или 5 мг один раз в день или плацебо. Рандомизацию проводили централизованно блоками по 3 человека со стратификацией по центрам. Пациенты посещали врача через 1, 3 и 6 мес после рандомизации. Через 6 мес проводили повторную эхокардиографию и суточное амбулаторное мониторирование АД, При появлении легких нежелательных явлений, которые могли быть связаны с лечением, допускалось снижение дозы максимум на 10 дней (до 2,5 мг/сут у больных, получавших рамиприл в дозе 5 мг/сут; в остальных случаях назначали плацебо). Все исследуемые препараты (рамиприл, фуросемид и плацебо) были предоставлены компанией Hoechst.
Эхокардиография
Эхокардиографию во всех случаях проводили трижды: первую - для оценки возможности включения больного в исследования, вторую - в конце фазы отбора (исходная) и третью - в конце фазы лечения. Эхокардиография выполнялась опытными кардиологами, которые были утверждены специальным комитетом по эхокардиографии после предоставления пробного изображения. В некоторых случаях исследователи направляли своих пациентов на эхокардиографию в специальный центр.
М-эхокардиограмму записывали в положении больного на левом боку с приподнятым головным концом кровати на 30°. Датчик устанавливали в третье или четвертое межреберье, а изображение левого желудочка регистрировали чуть дистальнее кончиков створок митрального клапана (3-5 сердечных циклов). Чтобы получить оптимальную М-эхокардиограмму, использовали двухмерное изображение (находили линию, перпендикулярную межжелудочковой перегородке и задней стенке левого желудочка).
При отборе больных эхокардиограммы анализировали непосредственно в лаборатории центра. Результаты эхокардиографии, выполненной до и после лечения, анализировались двумя членами комитета по эхокардиографии независимо друг от друга слепым методом. Конечный диастолический размер (КДР) левого желудочка, толщину межжелудочковой перегородки (ТМЖП) и задней стенки левого желудочка (ТЗСЛЖ) измеряли на уровне максимального зубца комплекса QRS на одновременно регистрируемой ЭКГ [16]. Массу миокарда левого желудочка рассчитывали на основании анализа нескольких комплексов (до 5) по формуле Devereux:
ММЛЖ(г) =1,04 χ [(ТМЖП + ТЗСЛЖ + КДР)3 - КДР3] - 1 3,6. Результаты расчета массы миокарда по этой формуле соответствуют анатомическим данным [16]. Индекс массы миокарда левого желудочка рассчитывали как отношение массы миокарда к площади поверхности тела (в м2) [1 5]. Если величина этого индекса, рассчитанная двумя исследователями, отличалась более чем на 5%, то они совместно анализировали изображение, чтобы придти к согласию.
Мониторирование АД
Офисное АД регистрировали при скрининге, а также при каждом визите. Амбулаторное мониторирование АД проводили до и после двойной слепой фазы с помощью автоматического монитора (каждые 1 5 минут в течение дня и каждые 30 минут в течение ночи). Время дня и ночи определяли с учетом привычек пациента.
Расчет выборки
Чтобы выявить разницу индекса массы миокарда левого желудочка, равную 8-1 2 г/м2, между группами рамиприла 1,25 мг и плацебо со статистической силой 80% (двухсторонний тест), в исследование следовало включить 1 20 больных (по 40 человек в каждую группу). Расчеты основывались на гипотезе о том, что стандартное отклонение динамики этого индекса в группе плацебо будет находиться в интервале от 10 до 18 г/м2.
Статистический анализ
Статистический анализ проводили с помощью программы SAS 6.07. Качественные переменные сравнивали с помощью критерия хи-квадрат или точного метода Фишера, количественные показатели - с помощью критерия t Стьюдента или рангового метода Вилкоксона. Эффекты лечения в трех группах сравнивали с помощью метода ANOVA. Анализ динамики индекса массы миокарда левого желудочка проводили на основании всех имеющихся данных, а затем в выборке intention-to-treat. В последнем случае считали, что при отсутствии данных эхокардиографические показатели не изменились. Результаты амбулаторного мониторирования АД сравнивали на основании средних показателей. Проводили множественный регрессионный анализ.
Результаты
Больные
С января 1990 года по март 1992 года в 20 центрах в исследование были включены 125 больных. Десять из них не были рандомизированы (отказ от участия у 4, возраст старше 70 лету 1, низкая эхогенность у 2, асимметричная гипертрофия перегородки у 1, неизвестная причина у 1). Перед началом двойной слепой фазы характеристики трех групп больных существенно не отличались (исключение составляли сердечно-сосудистые заболевания в анамнезе; табл. 1). Во время лечения одним фуросемидом офисное систолическое и диастолическое АД снизилось соответственно со 1 61 ,б±1,5 до 1 55,4±1,3 мм рт. ст. и с 95,0±1,0 до 91,2±0,9 мм рт. ст. В конце этой фазы у 77 (67%) больных диастолическое АД составляло 95 мм рт. ст. или менее (у 28 из 40 пациентов в группе плацебо, у 23 из 38 больных в группе рамиприла 1,25 мг и у 26 из 37 больных в группе рамиприла 5 мг). Исходный индекс массы миокарда левого желудочка составлял в среднем 137 г/м2 (134, 134 и 143 г/м2 в группах плацебо и рамиприла 1,25 и 5 мг соответственно).
Таблица 1. Исходные характеристики больных
Приведены М±т или проценты, 'единственный показатель, который достоверно отличался между группами (p=0.01 3)
Показатели Плацебо
(n=40)Рамиприл 1,25мг
(п=38)Рамиприл 5 мг
(n=37)Мужчины, % 63 66 59 Средний возраст, лет 54,8 + 1,9 51,2 + 2,0 54,5 + 1,4 Масса тела, кг 77,8 + 2,1 78,4±2,6 79,0±2,2 Рост, см 168,1±1,5 1 69,0 + 1,7 169,6 + 1,4 Курение, % 7,5 21,1 8,1 Офисное систолическое АД, мм рт. ст. 165,5 + 2,7 160,5 + 2,3 158,6 + 2,4 Офисное диастолическое АД, мм рт ст. 95,3 + 1,5 944,0±1,7 95,2 + 1,8 Частота сердечных сокращений в минуту 70,8 + 1,7 74,0±2,0 72,5 + 1,6 Антигипертензивная терапия, % 37,5 47,5 58,8 Сердечно-сосудистые заболевания, %* 0 0 10,8 Некардиоваскульярная заболевания, % 35,0 36,6 32,4 Другая сопутствующая терапия, % 37,5 47,4 45,9 Толщина задней стенки левого желудочка, см 1,04+0,03 1,06+0,03 1,08+0,02 Толщина межжелудочковой перегородки, см 1,22+0,04 1,23+0,04 1,27+0,05 Масса левого желудочка, г 250,4±10,4 251,7 + 1 7,2 269,2 + 11,5 Индекс массы левого желудочка, г/м2 1 33,5+4,8 1 33,6+7,5 143,2 + 5,5 Среднесуточное систолическое АД, мм рт. ст. 1 38,1 +2,5 1 38,7 + 2,5 1 38,3 + 2,9 Среднесуточное диастолическое АД, мм рт. ст. 88,7 + 1,7 87,7±2,0 87,1 +2,2 Среднесуточная частота сердечных сокращений в минуту 75,7 + 1,6 77,1 +1,9 78,8 + 1,6 Приверженность лечению и отсутствие данных
Из-под наблюдения выбыли 2 больных, получавших рамиприл в дозе 1,25 мг, и 1 больной из группы рамиприла 5 мг. Лечение было прекращено досрочно у 2 больных в группе плацебо (инфаркт миокарда у 1, артериальная гипотония у 1), 1 больного в группе рамиприла 1,25 мг (стойкий кашель) и 3 больных в группе рамиприла 5 мг (стойкий кашель во всех случаях). У этих 6 больных была проведена повторная эхокардиография, результаты которой включили в анализ. У 9 больных (5 - плацебо, 3 - рамиприл 1,25 мг, 1 -рамиприл 5 мг) интерпретация эхокардиограмм была невозможной из-за низкого качества изображения; таким образом, результаты анализировали у 103 (89,6%) больных. Результаты амбулаторного мониторирования АД имелись у 104 (90,4%) пациентов. Офисное АД регистрировали у всех пациентов.
Артериальное давление
Динамика АД достоверно не отличалась в трех группах (табл. 2). В конце исследования у 97 (86,6%) из 11 2 больных, завершивших лечение, офисное АД составляло <95 мм рт. ст. (у 35, 32 и 30 больных в группах плацебо и рамиприла 1,25 и 5 мг соответственно).
Размеры левого желудочка
Расхождение результатов измерений, выполненных двумя исследователями, превышало 5% в 70% случаев; в соответствии с протоколом согласие между ними было достигнуто при совместном анализе эхокардиограмм. Результаты эхокардиографии анализировали у 103 больных с адекватным качеством изображений. Изменения массы миокарда левого желудочка и толщины задней стенки в обеих группах больных, получавших рамиприл, были достоверными по сравнению с группой плацебо (рис.). Индекс массы миокарда левого желудочка достоверно снизился при лечении рамиприлом в дозе 5 мг (-10,8±3,7 против +4,1 ±4,0 г/м2 в группе плацебо; p=0,008), в то время как его динамика при применении рамиприла в дозе 1,25 мг имела пограничное статистическое значение (-7,0±4,3 г/м2; p=0,06) (табл. 2). После замены на ноль девяти неизвестных значений (в случае невозможности интерпретации изображений) и показателей у трех больных, выбывших из исследования, снижение индекса массы миокарда левого желудочка оставалось статистически значимым в группе рамиприла 5 мг (p=0,006), но не в группе рамиприла 1,25 мг (p=0,062). Динамика толщины межжелудочковой перегородки и конечного диастолического размера левого желудочка достоверно не отличалась между группами.
Рис. Изменения массы левого желудочка (вверху) и толщина задней стенки левого желудочка (внизу) в трех группах
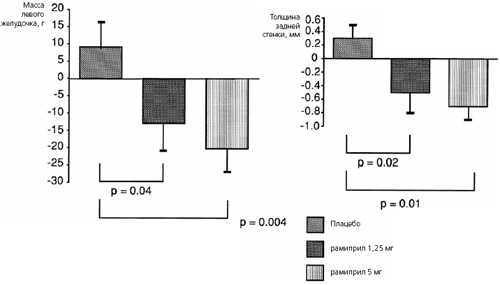
Таблица 2. Изменения эхокардиографических показателей и АД через 6 месяцев по сравнению с исходными
Приведены М±т. Результаты эхокардиографии можно было интерпретировать у 103 больных, а результаты суточного мониторирования АД - у 104 (соответственно у 35 и 36 больных в группе плацебо, у 33 и 38 - в группе рамиприла 1,25 мг и у 35 и 32 - в группе рамиприла 5 мг). Офисное АД было известно у всех пациентов * по сравнению с исходным, p=0.11, по сравнению с плацебо, p=0.063 + по сравнению с исходным, p=0.004, по сравнению с плацебо, p=0.008 ** по сравнению с плацебо, p=0.04 § по сравнению с исходным, p=0.06, по сравнению с плацебо, p=0.004 # по сравнению с плацебо, p=0.01 1| по сравнению с плацебо, p=0.02
Показатели Плацебо Рамиприл 1,25 мг Рамиприл 5 мг Индекс массы левого желудочка, г/м2 +4,1 ±4,0 -7,0±4,3* -10,8 + 3,7+ Масса левого желудочка, г +9,1 ±7,2 -13,0±7,8** -20,3±6,6§ Толщина задней стенки левого желудочка, см +0,03±0,02 -0,06±0,03# -0,7±0,02# Толщина межжелудочковой перегородки, см -0,01 ±0,03 -0,05±0,03 -0,07±0,02 Диастолический размер левого желудочка, см +0,07±0,07 +0,06±0,07 +0,01 ±0,08 Частота сердечных сокращений, уд/мин + 1,9±1,5 + 1,8 + 1,7 -2,3 + 1,6 Офисное систолическое АД, мм рт. ст. -9,4±2,4 -7,6 + 2,2 -11,8 + 2,1 Офисное диастолическое АД, мм рт ст. -4,1 ±1,7 -5,2 + 1,3 -7,1+1,8 Среднесуточная частота сердечных сокращений, уд/мин +0,1 ±1,3 + 2,4+1,5 -0,9 + 1,2 Среднесуточное систолическое АД, мм рт. ст. -1,1+1,9 -2,3 + 1,7 -5,7 + 1,7 Среднесуточное диастолическое АД, мм рт. ст. -1,0+1,3 -2,1+1,2 -3,1+1,7 Многофакторный регрессионный анализ
При многофактороном регрессионном анализе оценивали влияние на изменения индекса массы миокарда левого желудочка следующих переменных: исходные значение индекса массы миокарда, терапия рамиприлом в дозе 1,25 или 5 мг, возраст, пол, длительность гипертонии, предыдущая антигипертензивная терапия, курение и изменения амбулаторного систолического и диастолического АД по сравнению с исходными показателями. На основании полученных данных был сделан вывод о том, что изменения индекса массы миокарда левого желудочка в течение 6 месяцев после рандомизации достоверно зависели только от первых трех переменных, т.е. исходного значения индекса (p=0,005) и терапии рамиприлом в дозах 1,25 мг (p=0,03) и 5 мг (p=0,01). Результаты амбулаторного мониторирования систолического и диастолического АД не оказывали на них влияния (p=0,15 и 0,16 соответственно). После внесения поправки на все переменные, включенные в модель, снижение индекса массы миокарда левого желудочка по сравнению с плацебо составило 10,7±б,0 г/м2 и 1 5,7±б,0 г/м2 в группах больных, получавших рамиприл в дозах 1,25 и 5 мг соответственно. Сходные результаты были получены при тестировании офисного АД на той же модели и использования в качестве расчетного показателя массы миокарда левого желудочка.
Нежелательные явления
Во время исследования зарегистрировали только одно серьезное нежелательное явление (инфаркт миокарда) у больного группы плацебо; случаев смерти не было. По крайней мере, одно легкое нежелательное явления наблюдали у 22 пациентов (7 - плацебо, 5 - рамиприл 1,25 мг и 10 - рамиприл 5 мг). Нежелательными реакциями, которые можно было связать с диуретиком и/или ингибитором АПФ, были императивные позывы (по 1 в каждой группе), сухой кашель (1 -рамиприл 1,25 мг, 1 - рамиприл 5 мг) и гипотония (1 - плацебо). Через 6 мес уровень калия крови был менее 3,5 ммоль/л у 2 больных группы плацебо и 1 пациента, получавшего рамиприл в дозе 5 мг.
Обсуждение
Результаты настоящего исследования показали, что 6-месячная терапия рамиприлом в дозах 5 мг (стандартная антигипертензивная доза) или 1,25 мг (доза, не обеспечивающая значимое снижение АД) приводит к значительному снижению массы миокарда левого желудочка у больных среднего возраста с артериальной гипертонией, получающих фуросемид в дозе 20 мг/сут. Выявленные изменения не зависели от динамики АД. В результате терапии фуросемидом контроля артериальной гипертонией перед рандомизацией удалось добиться у 67% больных. Этим можно объяснить, почему во время двойной слепой фазы исследования у больных, получавших рамиприл в обеих дозах, отсутствовало значимое снижение офисного и амбулаторного АД по сравнению с группой плацебо. Другим объяснением может быть недостаточная статистическая сила исследования, так как при зарегистрированных изменениях результатов амбулаторного мониторирования АД она составляла всего 70% (возможность выявления разницы между группами, по крайней мере, 5 мм рт. ст. при ошибке альфа 0,05). Отбор больных производился в основном частнопрактикующими кардиологами (только 8 пациентов были включены врачами общей практики). Все они относились к группе низкого риска, так как только у 4 больных наблюдались сердечно-сосудистые заболевания до исследования. Таким образом, несмотря на наличие гипертрофии левого желудочка, процесс отбора привел к исключению пациентов группы более высокого риска, страдавших сердечно-сосудистыми заболеваниями помимо артериальной гипертонии. Перед началом лечения (после 4-недельного приема фуросемида) индекс массы миокарда левого желудочка составил в среднем 137 г/м2 и превышал 97,5-й перцентильэтого показателя в выборке здоровых мужчин [15]. Это подтверждало наличие гипертрофии левого желудочка. Через 6 месяцев индекс массы миокарда левого желудочка достоверно снизился при лечении рамиприлом в дозе 5 мг, в то время как различия его динамики между группами рамиприла 1,25 мг и плацебо имели пограничное статистическое значение. Масса миокарда левого желудочка достоверно снизилась по сравнению с плацебо в обеих группах больных, получавших рамиприл. Уменьшение массы миокарда при лечении рамиприлом было в основном связано со статистически значимым уменьшением толщины задней стенки левого желудочка. Динамика толщины межжелудочковой перегородки была недостоверной, однако она вносила вклад в снижение расчетных массы и индекса массы миокарда левого желудочка.
В 4-летнем рандомизированном, плацебокон-тролируемом, двойном слепом исследовании TOMHS [14] у больных мягкой и умеренной артериальной гипертонией, сочетавшейся или не сочетавшейся с гипертрофией левого желудочка, при лечении хлорталидоном было отмечено более выраженное снижение массы миокарда левого желудочка, чем при использовании эналаприла. Выявленная разница, по-видимому, была связана с изменениями размера левого желудочка, который уменьшился в группе хлорталидона и не изменился в группе эналаприла. В исследовании HYCAR диаметр левого желудочка во всех трех группах оставался неизменным во время двойной слепой фазы, однако это могло объясняться тем, что диуретик применяли в низкой дозе и назначали, по крайней мере, за 4 недели до исходной эхокардиографии.
По сравнению с исследованиями, в которых все эхокардиограммы регистрировались одним опытным оператором, многоцентровой характер нашего исследования явно ухудшал точность и воспроизводимость данных. Вариабельность динамики индекса массы миокарда левого желудочка у всех обследованных больных оказалась выше, чем ожидалось (фактическая 539 г/м2, ожидаемая менее 324 г/м2).
J.Cruickshank и соавт. [18] проанализировали 147 исследований, в которых изучалось влияние антигипертензивной терапии на гипертрофию левого желудочка; в 23 из них применяли ингибиторы АПФ у 321 больного. При непрямом сравнении было высказано предположение о том, что ингибиторы АПФ вызывают более выраженное снижение массы миокарда левого желудочка (в среднем на 17 г за 7 мес), чем вазодилататоры, дигидропиридиновые антагонисты кальция и бета-блокаторы. Изменения массы миокарда и среднего АД не зависели друг от друга при лечении ингибиторами АПФ, но обратно коррелировали при использовании бета-адреноблокаторов. Хотя этот обзор имеет многочисленные ограничения с точки зрения методологии (прежде всего непрямое сравнение динамики массы миокарда), тем не менее, полученные данные подтверждают результаты нашего исследования. В б-месячном двойном слепом контролируемом исследовании у 44 больных (в анализ включили только 30 из них) каптоприл значительно снижал индекс массы миокарда левого желудочка и толщину задней стенки и межжелудочковой перегородки по сравнению с миноксидилом; контроль АД был сопоставимым в двух группах [19]. В другом 6-месячном двойном слепом контролируемом исследовании индекс массы миокарда значительно снизился по сравнению с исходными значениями при лечении ингибитором АПФ периндоприлом или нифедипином [20]. В этом исследовании достигнутый эффект коррелировал со снижением амбулаторного АД в группе нифедипина, но не периндоприла.
Результаты исследования HYCAR свидетельствуют о том, что у человека эффект рамиприла на массу миокарда левого желудочка не зависит от степени снижения АД. При многофакторном регрессионном анализе было показано, что уменьшение индекса массы миокарда левого желудочка зависит от лечения (рамиприл в дозах 1,25 или 5 мг/сут) и исходных значений индекса, но не от изменений АД. Эти данные согласуются с результатами опытов на животных. Например, в одном исследовании у крыс, получавших каптоприл в высоких дозах (30 мг/кг/сут в течение 22 дней), масса миокарда и диаметр миоцитов были ниже, чем у крыс, которым не давали каптоприл, при сопоставимом АД [21]. В очень низкой дозе (0,01 мг/кг/сут в течение 6 недель) рамиприл вызывал регресс гипертрофии левого желудочка у крыс с артериальной гипертонией, обусловленной стенозом аорты, при отсутствии изменений АД [1 2].
Одним из возможных объяснений способности ингибиторов АПФ вызывать регресс гипертрофии левого желудочка является участие ангиотензина II в ее патогенезе. Увеличение внутриклеточного содержания белка и скорости синтеза протеинов, индуцированное ангиотензином II в эмбриональных миоцитах, блокировалось антагонистом [8агЧ1е8]ангиотензина II [22]. У крыс с гипертрофией левого желудочка, вызванной пережатием брюшной аорты, содержание мРНК ангиотензиногена в миокарде было выше, чем в контрольной группе животных, через 1 5 дней после операции [23]. Активность ренина плазмы у опытных животных повышалась только на 1 день, однако эналаприл предупреждал развитие гипертрофии левого желудочка. Это указывало на возможную роль локальной ренинангиотензиновой системы в развитии гипертрофии левого желудочка. Нельзя также исключить роль накопления брадикинина в ткани сердца, где имеется локальная калликреин-кининовая система [24]. У крыс с сужением аорты специфические антагонисты брадикининовых В2-рецепторов блокировали профилактический эффект рамиприла в отношении гипертрофии левого желудочка, но не влияли на ее регресс [25].
Мы не исключаем, что применение диуретика у всех больных, включенных в исследование HYCAR, могло повысить их чувствительность к ингибитору АПФ за счет стимуляции ренинангиотензинальдостероновой системы. Это может объяснить небольшое увеличение массы миокарда в группе плацебо. Однако все больные принимали фуросемид в низкой дозе, поэтому возможная стимуляция ренинангиотензинальдостероновой системы была минимальной.
Мы в первую очередь анализировали изменения массы миокарда левого желудочка и АД, поэтому исследование не обладало статистической силой, достаточной для выявления изменений заболеваемости и смертности. Однако мы показали, что ингибитор АПФ снижает массу миокарда левого желудочка независимо от изменений АД у больных артериальной гипертонией, получающих фуросемид. Эти данные служат основанием для проведения дополнительных исследований с целью изучения влияния регресса гипертрофии миокарда на сердечно-сосудистую заболеваемость и смертность.
Литература
1. Kannel WB, Gordon Τ, Castelli WP, Margolis JR. Electrocardiographic left ventricular hypertrophy and risk of coronary heart disease: the Framingham Study. Ann Intern Med. 1 970;72:81 3-822.
2. Casale PN, Devereux RB, Milner M, Zullo G, Harshfield GA, Pickering TG, Laragh JH. Value of echocardiographic measurement of left ventricular mass in predicting cardiovascular morbid events in hypertensive men. Ann Intern Med. 1986;105:173-178.
3. Levy D, Garrison RJ, Davage DD, Kannel WB, Castelli WP. Prognostic implications of echocardiographically determined left ventricular mass in the Framingham Heart Study. N Engl J Med. 1990;322:1561-1566.
4. Dahlbf В, Pennert К, Hansson L. Regression of left ventricular hypertrophy: a meta-analysis. Clin Exp Hypertens. 1992;14:173-180.
5. MacMahon SW, Wilcken DEL, Macdonald GJ. The effect of weight reduction on left ventricular mass: a randomized controlled trial in young, overweight hypertensive patients. N Engl J Med. 1986;314:334-339.
6. Dittrich НС, Adler J, Ong J, Reitman Μ, Weber Μ, Ziegler Μ. Effects of sustained-release nicardipine on regression of left ventricular hypertrophy in systemic hypertension. Am J Cardiol. 1 992;69:1 559-1564.
7. Ferrara LA, de Simone G, Mancini M, Fasano ML, Pasanisi F, Vallone G. Changes in left ventricular mass during a double-blind study with chlorthalidone and slow-release nifedipine. Eur J Clin Pharmacol. 1984;24:525-528.
8. Ferrara LA, Fasano ML, de Simone G, Soro S, Gagliardi R. Antihypertensive and cardiovascular effects of nitrendipine: a controlled study vs placebo. Clin Pharmacol Ther. 1 985;38:434-438.
9. Genovesi-Ebert A, Marabotti С, Palombo С, Ghione S, Cattaneo G, Noseda A, Spinazzi A. Effect of a new multifactorial antihypertensive on heart morphology and function in mild to moderate essential arterial hypertension. Eur Heart J. 1 992;1 3(suppl A):45-48.
10. Szlachcic J, Tubau JF, Vollmer C, Massie B. Effect of diltiazem on left ventricular mass and diastolicfilling in mild to moderate hypertension. AmJ Cardiol. 1989;63:198-201.
11. Dahlbf B. The importance of the renin-angiotensin system in reversal of left ventricular hypertrophy. J Hypertens. 1 993;1 1 :S29-S35.
12. Linz W, Schblkens BA, Ganten D. Converting enzyme inhibition specifically prevents the development and induces regression of cardiac hypertrophy in rats. Clin Exp Hypertens A. 1 989; 11:1 325-1350.
13. Linz W, Schaper J, Wiemer G, Albus U, Schblkens BA. Ramipril prevents left ventricular hypertrophy with myocardial fibrosis without blood pressure reduction: a one year study in rats. Br J Pharmacol. 1992;107:970-975.
14. Vasmant D, Bender N. The renin-angiotensin system and ramipril, a new converting enzyme inhibitor. J Cardiovasc Pharmacol. 1989;14:S46-S52.
15. Devereux RB, Lutas EM, Casale PN, Kligfield P, Eisenberg RR, Hammond IW, Miller DH, Reis G, Alderman MH, Laragh JH. Standardization of M-mode echocardiographic left ventricular anatomic measurements. J Am Coll Cardiol. 1 984;4:1 222-1 230.
16. Devereux RB, Reichek N. Echocardiographic determination of left ventricular mass in man: anatomic validation of method. Circulation. 1977;55:613-618.
17. Neaton JD, Grimm RH, Prineas RJ, Stamler J, Grandits GA, Elmer PJ, Cutler JA, Flack JM, Schoenberger JA, McDonald R, et al for the Treatment of Mild Hypertension Study Research Group. Treatment of Mild Hypertension Study. JAMA. 1 993;270:71 3-724.
18. Cruickshank JM, Lewis J, Moore V, Dodd С Reversibility of left ventricular hypertrophy by differing types of antihypertensive therapy. J Hum Hypertens. 1992;6:85-90.
19. Julien J, Dufloux MA, Prasquier R, Chatellier G, Menard D, Plouin PF, Menard J, Corvol P. Effects of captopril and minoxidil on left ventricular hypertrophy in resistant hypertensive patients: a six-month double-blind comparison. J Am Coll Cardiol. 1990;16:137-142.
20. Schulte KL, Meyer-Sabellek W, Liederwald H, van Gemmeren D, Lenz T, Gotzen R. Relation of regression of left ventricular hypertrophy to changes in ambulatory blood pressure after long-term therapy with perindopril versus nifedipine. Am J Cardiol. 1 992;70:468-473.
21. Rossi MA, Peres LC. Effect of captopril on the prevention and regression of myocardial cell hypertrophy and interstitial fibrosis in pressure overload cardiac hypertrophy. Am Heart J. 1992;124:700-709.
22. Baker KM, Aceto JF. Angiotensin II stimulation of protein synthesis and cell growth in chick heart cells. Am J Physiol. 1 990;258:H61 0-H618.
23. Baker KM, Chernon Ml, Wixson SK, Aceto JF. Renin-angiotensin system involvement in pressure-overload cardiac hypertrophy in rats. Am J Physiol. 1990;258:H324-H332.
24. Nolly Η, Carbini LH, Scicli G, Carretero OA, Scicli AG. A local kallikrein-kinin system is present in rat hearts. Hypertension. 1 993;22:P429. Abstract. 25. Linz W, Schblkens BA. A specific B2-bradykinin receptor antagonist HOE 140 abolishes the antihypertrophic effect of ramipril. Br J Pharmacol. 1992;105:771-772.
| Октябрь 2007 г. |