Опубликовано в журнале:
«Экспериментальная и клиническая урология», 2010, №2, с. 88-92Клиническая эффективность и безопасность препарата Тулозин (тамсулозин) у больных доброкачественной гиперплазией предстательной железы
М. Э. Ситдыкова
Казанский государственный медицинский университет, КазаньClinical efectiveness and safety of Tulosin (tamsulosin) in patients with benign prostatic hyperplasia
M.E. SitdykovaTe author presented results of the clinical study on efectivness and safety of alpha1-adrenoreceptor antagonist Tulosin (produced by «Egis») as a single agent therapy in patients with benign prostatic hyperplasia (BPH). Te research team included 30 patients aged 50 to 82 years. Inclusion criteria – patients with BPH, expressiveness symptoms on a scale International Prostate Symptom Score (IPSS) more 9 points, the volume of residual urine not more than 100 ml. Treatment was conducted within 2 months, with compulsory monitoring of patient every month. Using phases of defning symptoms of the disease, blood analysis, defnition of creatinine, ultrasound prostate visualisation with the defnition of its volume and volume of residual urine, urofoumetry were also conducted. Specifcity of side efects if they were available was estimated. Te study results indicate that in the course of therapy relieving in-fravesical obstruction occurs which confrmed by increase in urination rate and decrease in residual urine volume. Additionally benign pros-tatic hyperplasia symptoms abated as shown by the questionnaire IPSS and improving quality of life. Only 1 of 29 patients underwent surgery, transvesical adenomectomy was per formed.
Terefore, Tulosin (tamsulosin) has a high efectiveness and safety and may be recommended for treatment patients sufering from benign prostatic hyperplasia with signifcant irritative symptoms and moderate infravesical obstruction.
Доброкачественная гиперплазия предстательной железы (ДГПЖ) - наиболее распространенное заболевание мужчин пожилого возраста. По данным аутопсийных исследований первые признаки ДГПЖ обнаруживаются у 8% мужчин в возрасте от 31 до 40 лет [1]. У мужчин старше 61 года частота этого заболевания достигает 70% и более, а после 80 лет - 90% [2]. Учитывая тенденцию старения населения планеты, можно предположить возрастание актуальности проблемы диагностики и лечения ДГПЖ.
Если еще двадцать лет назад реальной альтернативы оперативному лечению ДГПЖ практически не было, то сегодня существует целый ряд разнообразных консервативных методов. Среди них медикаментозная терапия ДГПЖ - одна из наиболее динамично развивающихся областей урологии [3, 4, 5].
Блокаторы α1-адренорецепторов (α1-АР) стали стандартными препаратами в терапии ДГПЖ [6, 7, 8, 9]. Исследованиями последних лет доказана ведущая роль α1-АР в патогенезе заболевания. Стимуляция их повышает тонус гладкомышечных элементов шейки мочевого пузыря, простатического отдела уретры и простаты, поддерживая в значительной степени внутриуретральное давление [10]. Сократительная функция простаты также находится под контролем α1-АР, которые локализуются преимущественно в стромальных элементах железы, занимающих до 60% объема органа. Эти эффекты активации α1-АР, а также увеличение их количества и плотности в ткани простаты при ДГПЖ приводят к развитию динамического компонента инфравезикальной обструкции [11]. По мере прогрессирования ДГПЖ развиваются функциональные и морфологические изменения детрузора, сопровождающиеся гипоксией гладкомышечных элементов, и приводящие к нарушениям биохимических процессов (в т.ч. энергетического баланса) в клетках детрузора [4].
Исходя из этого, блокаторы α-АР должны не только уменьшать уретральное сопротивление за счет снижения тонуса гладкой мускулатуры простаты и уретры, но и устранять вторичные изменения детрузора в результате улучшения кровоснабжения мочевого пузыря, влияя таким образом на устранение динамического компонента инфравезикальной обструкции.
В настоящее время наибольшее распространение при лечении ДГПЖ получили так называемые селективные α-блокаторы, действующие на подтип 1 α-АР: тамсулозин, альфузозин, теразозин, доксазозин. Они селективно блокируют постсинаптические альфа1А-адренорецепторы гладкой мускулатуры предстательной железы, шейки мочевого пузыря и простатической части уретры. Эта разновидность рецепторов, составляющая 70% от всех α-АР, локализуется преимущественно в простате [10]. Возможно, именно эти рецепторы играют наибольшую роль в развитии динамического компонента инфравезикальной обструкции.
Эффективность селективных α-блокаторов в устранении обструктивной и, особенно ирритативной симптоматики примерно одинакова, тогда как выраженность побочных эффектов вследствие снижения артериального давления (ортостатической гипотензии, сонливости, головокружения, сердцебиения и тахикардии) различна [12, 13]. У тамсулозина способность блокировать альфа1А-адренорецепторы в 20 раз больше, по сравнению с действием на альфа1B-адренорецепторы гладкой мускулатуры сосудов. Клинически это проявляется в его незначительном влиянии на системное артериальное давление.
Эффективное и безопасное применение тамсулозина у больных с гиперплазией предстательной железы доказано многочисленными исследованиями [15-18]. Достоверно продемонстрировано, что тамсулозин по сравнению с плацебо заметно уменьшает выраженность симптомов, а также нарушений мочеиспускания, обусловленных гиперплазией простаты. Кроме того, в этих исследованиях было показано, что применение тамсулозина безопасно и сопровождается незначительным числом побочных реакций [19-22]. В то же время накопление дополнительного клинического опыта применения тамсулозина дает возможность дальнейшей оценки значения данного препарата в лечении больных с гиперплазией простаты.
В России зарегистрирован и разрешен к применению препарат α1адреноблокатор Тулозин, который по данным публикаций является самым назначаемым. Тулозин биоэквивалентен оригинальному препарату тамсулозину и является дженериком фармацевтического завода «ЭГИС» (Венгрия).
Цель исследования: определение эффективности и безопасности Тулозина у пациентов с аденомой предстательной железы (ДГПЖ).
Материалы и Методы
Пострегистрационное исследование препарата Тулозин фармацевтического завода «ЭГИС» проводилось в Урологической клинике Казанского государственного медицинского университета с апреля по ноябрь 2009 г.
Оценка эффективности препарата осуществлялась:
- на основании анализа изменений параметров мочеиспускания, используя международную систему IPSS и качества жизни;
- на основании изменений уродинамических показателей: максимальной скорости потока мочи и средней скорости мочеиспускания;
- на основании определения остаточной мочи;
- УЗИ предстательной железы.
В исследовательскую группу включено 30 пациентов в возрасте от 50 до 82 лет, соответствующих следующим критериям:
- подтвержденный диагноз ДГПЖ, установленный в условиях урологического стационара;
- выраженность симптомов по шкале IPSS более 9 баллов (умеренная симптоматика);
- объем остаточной мочи не более 100 мл;
- пациенты, не принимающие ранее препараты для лечения ДГПЖ.
Критериями исключения считали:
- осложненное течение ДГПЖ;
- инфекция мочевых путей;
- онкологические заболевания;
- сопутствующие соматические заболевания (тяжелые сердечнососудистые и цереброваскулярные заболевания);
- почечная и печеночная недостаточность.
Наблюдение пациентов осуществлялось в три этапа. На первом - осуществлялся отбор пациентов с обязательным письменным согласием на участие в исследовании и соблюдение рекомендаций врача. Пациенту выдавался препарат с режимом приема по 1 капсуле (0,4 мг) в сутки после первого приема пищи. Лечение проводилось в течение 2-х месяцев, с обязательным контролем состояния пациентов каждый месяц (второй и третий этапы). На контрольных этапах уточнялись изменения в симптоматике заболевания (анкета IPSS и Qol); лабораторные исследования, включая анализ крови и определения показателей креатинина. Проводилось ультразвуковое исследование предстательной железы с определением ее объема и объема остаточной мочи, определялась скорость мочеиспускания, выяснялись побочные явления, если такие имелись.
Оценка безопасности препарата проводилось путем регистрации и анализа нежелательных явлений, а так же определения общего анализа крови в динамике и определение биохимических показателей крови.
Результаты исследования
На основании данных обследования оказалось, что основными жалобами пациентов до начала лечения были учащенное мочеиспускание в ночное время 2-3-4 раза, вялая струя мочи. Пальцевое ректальное исследование выявило увеличение предстательной железы с признаками, характерными для доброкачественной гиперплазии. Средние размеры увеличенной предстательной железы определены по данным УЗИ. Исходные параметры основных критериев представлены в таблице 1.
Таблица 1. Средние величины исходных показателей (этап 1)
Параметры IPSS
(баллы)Qol
(баллы)Qmax
(мл/сек.)Средняя скорость мочеиспускания (мл/сек.) Объем остаточной мочи (мл) Объем предстательной железы (см3) Количество больных 30 17,67 ± 5,2 4,0 ± 1,1 9,2 ± 0,9 6,01 ± 0,95 71,9 ± 21,6 51,3 ± 14,5 Лабораторные анализы крови были без патологических изменений. У 8 из 30 пациентов остаточной мочи не было отмечено, несмотря на увеличение предстательной железы и наличие другой симптоматики. I стадия ДГПЖ была определена у 24 пациентов, II стадия - у 6 пациентов, которым по разным причинам оперативное лечение пока выполнено быть не могло, или они отказывались от операции.
Исследуемую группу составили пациенты, которым ранее медикаментозная терапия не приводилась. Среднее значение PSA сыворотки крови составило 1,5 ± 1,1 нг/мл.
Данные трансректального УЗИ (ТРУЗИ) простаты являются одним из критериев степени эффективности, используемого препарата для оценки терапевтического эффекта у пациентов с доброкачественной гиперплазией предстательной железы. Для удобства сравнения полученных результатов выделен показатель объема предстательной железы. В таблице 2 приведена динамика изменений объема предстательной железы в процессе проводимого лечения.
Как следует из приведенной таблицы на фоне приема препарата тамсулозина отмечено незначительное уменьшение объема простаты через один и два месяца наблюдения. Однако эти изменения оказались недостоверными.При определении количества остаточной мочи в процессе лечения нами установлено, что Тулозин способствует уменьшению количества остаточной мочи, причем достоверные изменения отмечены уже через месяц после приема препарата (этап 2). Пациентами было отмечено улучшение качества мочеиспускания, снижение ночной поллакиурии, появилось чувство удовлетворения после мочеиспускания (рисунок 1).
Рисунок 1. Динамика изменений объема остаточной мочи в процессе лечения.
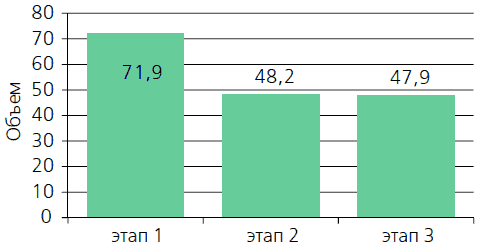
Таблица 2. Динамика объема простаты по данным ТРУЗИ
Этап 1 Этап 2 Этап 3 Средний объем простаты 51,3 ± 14,5 48,2 ± 14,3 47,9 ± 14,0 Достоверность изменений (р) 0 >0,1 >0,1 Объективными критериями эффективности Тулозина у больных с ДГПЖ следует считать показатели уродинамических исследований нижних мочевых путей: максимальную и среднюю скорости мочеиспускания. Исследования проводились на оборудовании Toshiba Satellite A 10-131 Delphis UDS 9,4-Вт фирмы Laborie Medical Тechnologies до назначения препарата, через месяц и через два месяца лечения.
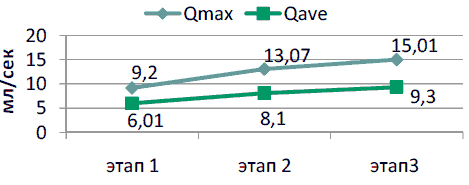
В течение двухмесячного наблюдения за пациентами отобранной группы установлено достоверное улучшение уродинамических показателей (рисунок 2). Так показатели урофлоуметрии, проведенной на втором и третьем визитах достоверно увеличились по сравнению с исходным уровнем.
Рисунок 2. Изменения уродинамических показателей
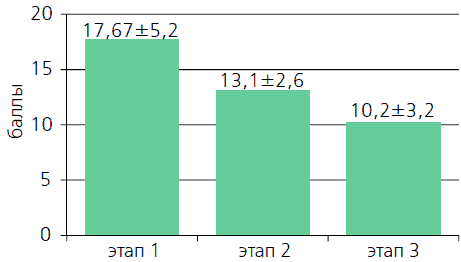
Динамика обструктивных и ирритативных симптомов оценивалось по международной системе оценки заболеваний предстательной железы IPSS – Qol с определением качества жизни на каждом визите. Исходные показатели IPSS были в среднем 17,67 ± 5,2, что соответствует умеренной симптоматике. Установлено, что в процессе лечения Тулозином уже через месяц пациенты отметили улучшение симптоматики. У 7 пациентов ночная поллакиурия исчезла. Количество пациентов с незначительными симптомами последовательно увеличивалось в течение двух месяцев.
29 из 30 пациентов на втором этапе отметили значительное уменьшение симптомов, улучшение состояния и качества жизни (таблица 3, рисунок 3). У одного пациента показатели IPSS не изменились и остались на уровне первого визита, хотя количество остаточной мочи у него уменьшилось со 100 мл до 47 мл через два месяца, а при оценке качества жизни определил как смешанное чувство.
Таблица 3. Изменение симптоматики (IPSS) у пациентов с ДГПЖ
Количество баллов Этап 1 Этап 2 Этап 3 0 – 7 0 7 (23,3%) 11 (36,6%) 8 – 19 28 (93%) 22 (73,3%) 18 (60,0%) 20 – 35 2 (6,6%) 1 (3,3%) 1 (3,3%) Рисунок 3. Динамика средних значений IPSS в процессе лечения.
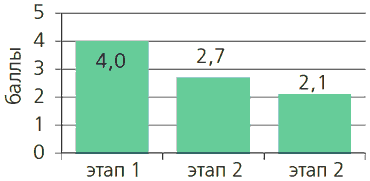
У большинства пациентов выявлено достоверное снижение среднего значения оценки качества жизни от первого визита к третьему, что свидетельствует об эффективности лечения (рисунок 4).
Рисунок 4. Динамика показателей качества жизни (QOL).
Через два месяца лечения количество пациентов, которые оценивали свое состояние как хорошее, увеличилось до 11 пациентов, а удовлетворительное – у 18 пациентов (рисунок 5).
Рисунок 5. Результаты лечения
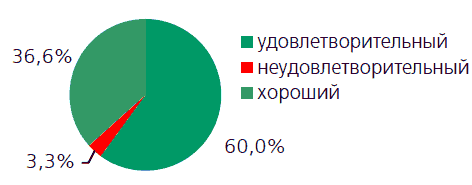
Таким образом, лечение оказалось эффективным у 29 пациентов, что составило 96,6%.
За время клинического исследования ни один пациент не выбыл из исследуемой группы в связи с нежелательными явлениями. У одного пациента через 10 дней после начала лечения возникла диарея. Как оказалось, это не было связанно с приемом исследуемого препарата, поэтому лечение было продолжено.
Такие побочные явления как гипертензия, головокружение, тошнота, которые иногда встречаются при приеме препаратов группы α1-адреноблокаторов, в нашем исследовании не наблюдались. Не отмечено и изменений показателей крови. За время наблюдения не отмечено ухудшения биохимических показателей крови. Креатинин, печеночные пробы были в пределах нормы.
Заключение
Таким образом, проведенное клиническое исследование изучения эффективности и безопасности препарата Тулозин фармацевтического завода «ЭГИС» в качестве монотерапии у пациентов с ДГПЖ позволяет заключить, что на фоне проводимой терапии отмечено уменьшение инфравезикальной обструкции, что подтверждается увеличением скорости мочеиспускания и уменьшением количества остаточной мочи. Кроме того, уменьшилась выраженность симптоматики ДГПЖ, о чем свидетельствуют полученные данные анкетирования по Международной школе простатических симптомов IPSS и улучшения качества жизни пациентов.
Нежелательных явлений при приеме препарата не выявлено. После завершения клинических исследований 29 пациентов продолжили лечение препаратом Тулозин. Лишь один пациент был прооперирован - ему выполнена чреспузырная аденомэктомия.
Препарат Тулозин обладает высоким уровнем эффективности и безопасности, может быть рекомендован для лечения пациентов с доброкачественной гиперплазией простаты, проявляющейся выраженной ирритативной симптоматикой с умеренной инфравезикальной обструкцией.
Ключевые слова: доброкачественная гиперплазия предстательной железы, лечение медикаметозное, альфа-блокаторы, тулозин
ЛИТЕРАТУРА
1. Berry S.J., Cofey D.S., Walsh P.C., Ewing L. Te development of human benign prostatic hypertrophy with age // J Urol. 1984. Vol. 132. P. 474-479.
2. Шабад А.Л. Учебное пособие по урологии: Учебное пособие. 3-е изд., переработанное и дополненное. М. Медицина, 1990.
3. Jacobsen S.J., Girman C.J., Guess H.A., Oesterling J.E., Lieber M.M. Diagnosis and treatment guidelines for benign prostatic hyperplasia: potential impact in the community // Arch. Intern. Med. 1995. Vol.155. P. 477-481.
4. Лоран О.Б., Вишневский Е.Л. Лечение расстройств мочеиспускания у больных доброкачественной гиперплазией простаты α-адрено-блокаторами. М. 1998.
5. Сивков А.В. Диагностика и лечение доброкачественной гиперплазии предстательной железы. Урология // Consilium Medicum. 2002, (Приложение). C. 9-18.
6. Винаров А.3. Медикаментозное лечение больных гиперплазией предстательной железы: Дис. д-ра мед. наук. M. 1999.
7. Chapple С. Selective alpha-1-adrenoceptors antagonists in benign pros-tatic hyperplasia, rationale and clinical experience. // Eur. Urol. 1996. Vol. 29. P.129-144.
8. Kirby R., Andersson K.E., Lepor H., Steers W. D. Alpha (l)-adrenoceptor selectivity and the treatment of benign prostatic hyperplasia and lower urinary tract symptoms //Prostate Cancer. 2000. № 3. P. 76-83.
9. Lepor H. Alpha blockade for the treatment of benign prostatic hyperplasia // Urol. Clin. N. Am. 1995. Vol. 22. P. 375-386.
10. Furuya S., Kumamoto Y., Yokoyama E., Tsukamoto T., Izumi T., Abiko Y. Alpha-adrenergic activity and urethral pressure in prostatic zone in benign prostatic hypertrophy // J. Urol. 1982. Vol. 128. P. 836-839.
11. Yamada S., Ashizawa N., Ushijima H., Nakayama K., Hayashi E., Honda K. Alpha-1 adrenoceptors in human prostate: characterization and alteration in benign prostatic hypertrophy // J Pharmacol Exp Ter. 1987. Vol. 242. № 1. P.326-330.
12. Djavan B., Marberger M. A metaanalysis on the efcacy and tolerability of alpha1-adrenoceptor antagonists in patients with lower urinary tract symptoms suggestive of benign prostatic obstruction // Eur Urol. 1999. Vol. 36. № 1. P.1-13.
13. Chapple C. Pharmacotherapy for benign prostatic hyperplasia--the potential for alpha 1-adrenoceptor subtype-specifc blockade // Br J Urol. 1998. Vol. 81. Suppl 1. P.34-47.
14. Schalken J.A. Molecular and cellular prostate biology: origin of prostate-specifc antigen expression and implications for benign prostatic hyperpla-sia // BJU Int. 2004. Vol.93. Suppl 1. P.5-9.
15. Ren R.M., Kou M., Lan X.X. Efcacy and safety of tamsulosin for the treatment of benign prostatic hyperplasia: a meta analysis // Chin Med J. 2010. Vol. 123. № 2. P. 234-238.
16. Michel M.C. Te forefront for novel therapeutic agents based on the pathophysiology of lower urinary tract dysfunction: alpha-blockers in the treatment of male voiding dysfunction – how do they work and why do they difer in tolerability? //J. Pharmacol Sci. 2010. Vol.112. № 2. P.151-157. Epub 2010 Feb 4.
17. Roehrborn C.G. Efcacy of alpha-Adrenergic Receptor Blockers in the Treatment of Male Lower Urinary Tract Symptoms //Rev Urol. 2009. Fall.11. Suppl 1. S.1-8.
18. Nickel J.C., Sander S., Moon T.D. A meta-analysis of the vascular-related safety profle and efcacy of alpha-adrenergic blockers for symptoms related to benign prostatic hyperplasia //Int J Clin Pract. 2008. Vol.62. № 10. P. 1547-1559.
19. Dong Z., Wang Z., Yang K., Liu Y., Gao W. , Chen W. Tamsulosin versus terazosin for benign prostatic hyperplasia: a systematic review // Syst Biol Reprod Med. 2009. Vol.55. № 4. P.129-136.
20. Ogata I., Yamasaki K., Tsuruda A., Tsuzaki S., Ishimatsu T., Hirayama H., Seo H. Some problems for dosage form based on questionnaire surveying compliance in patients taking tamsulosin hydrochloride //Yakugaku Zasshi. 2008. Vol. 128. № 2. P.291-297.
21. Naslund M.J., Miner M. A review of the clinical efcacy and safety of 5al-pha-reductase inhibitors for the enlarged prostate //Clin Ter. 2007. Vol. 29. № 1. P.17-25.
22. Narayan P. , Tunuguntla H.S. Long-term efcacy and safety of tamsulosin for benign prostatic hyperplasia. // Rev Urol. 2005. Vol.7. Suppl 4. S.42-48.
| Ноябрь 2010 г. |