Опубликовано в журнале, Южно-Российский Медицинский журнал, 2003;5-6:13-21Влияние грандаксина на показатели качества жизни и темп реабилитации больных с сердечной недостаточностью, перенесших инфаркт миокарда
М.Е. Стаценко, О.А. Говоруха
Волгоградский государственный медицинский университет, МУЗ ГКБ №3, г. ВолгоградСреди заболеваний, представляющих угрозу для жизни и здоровья населения нашей планеты на ближайшие 20 лет, первые места принадлежат ишемической болезни сердца (ИБС) и депрессиям [1]. Сочетание этих болезней значительно ухудшает клинический и социальный прогноз каждой из них. Доля пациентов, страдающих депрессией, среди больных ИБС варьирует от 12 до 47% [2]. При этом исходный уровень депрессии и личностной тревожности у этой категории пациентов является более существенным фактором снижения качества жизни, чем число коронарных артерий с более чем 50%-ной окклюзией [1].
В последние годы накапливается все больше доказательств того, что депрессия является независимым фактором риска ИБС и должна рассматриваться в совокупности с такими признанными факторами риска, как дислипидемия, артериальная гипертония и курение [2]. Показана прямая связь между депрессией и развитием повторного инфаркта миокарда и/или рецидивирующим его течением. Установлено, что депрессия является достоверным прогностическим признаком смерти в течение 6-18 мес. после развития инфаркта миокарда, в 4 раза повышая летальность таких больных. Также значительно увеличивается риск утраты трудоспособности, который возрастает в 1,5-2 раза в сравнении со случаями тех же соматических болезней, но без сопутствующих тревожно-депрессивных расстройств [3].
На сегодняшний день рассматриваются два основных механизма, объясняющих связь между депрессией и повышенной смертностью у больных ИБС.
Первый механизм - влияние депрессии на приверженность лечению (комплаентность). При наличии депрессии больные, перенесшие инфаркт миокарда, реже придерживаются здорового образа жизни, хуже выполняют врачебные рекомендации по соблюдению диеты, отказу от курения, необходимости ограничения алкоголя и постепенного наращивания физических нагрузок для успешной реабилитации [4,5].
Второй механизм - наличие у депрессивных больных некоторых патофизиологических особенностей: нарушение баланса между симпатическим и парасимпатическим отделами вегетативной нервной системы, что опосредованно приводит к нарушениям ритма сердца и может быть причиной повышенной сердечно-сосудистой смертности [6].
Таким образом, от того, диагностировал ли врач депрессию у коронарного больного и назначил ли соответствующее лечение, зависит исход основного заболевания у пациента.
В настоящее время в кардиологической клинике для коррекции психо-висцеральных взаимоотношений наиболее часто используются производные бензодиазепинов. Длительные контролируемые исследования с транквилизаторами бензодиазепинового ряда у больных с сердечно-сосудистыми заболеваниями не проводились. Достоверные данные о распространенности их кардио-токсических эффектов, особенностях лекарственных взаимодействий транквилизаторов с соматотропными препаратами ограниченны. Поэтому для кардиологов интересен атипичный представитель бензодиазепинового ряда - Грандаксин (тофизопам), известный в Европе более 20 лет как транквилизатор с анксиолитическими свойствами.
Грандаксин имеет следующие особенности (10):
1) выраженный вегетокорригирующий эффект;
2) мягкое анксиолитическое действие;
3) отсутствие седативного и миорелаксирующего эффекта;
4) хорошая переносимость препарата пациентами;
5) отсутствие привыкания при курсовом применении;
6) мягкое антидепрессивное действие.Проведен целый ряд исследований, которые подтвердили эффективность и хорошую переносимость Грандаксина у больных ИБС, артериальной гипертензией. В отличие от этих исследований мы проследили динамику тревожно-депрессивной симптоматики у больных хронической сердечной недостаточностью (ХСН) в раннем постинфарктном периоде (14-30 суток от начала заболевания) в течение 6 месяцев. В данной работе проанализированы динамика клинических проявлений кардиальной недостаточности у больных ИБС, изменение толерантности к физическим нагрузкам при расширении режима двигательной активности на фоне дополнения базисной терапии ХСН Грандаксином. Также проведена оценка безопасности и эффективности применения Грандаксина в составе базисной терапии ХСН.
Настоящее исследование имеет целью уточнение роли психологических характеристик личности больных, соотношения показателей качества жизни (КЖ) с клиническими характеристиками заболевания и их влияние на особенности течения лечебно-реабилитационного процесса, а также уточнение спектра клинической активности и безопасности Грандаксина при психологической коррекции у больных ХСН в раннем постинфарктном периоде.
Материал и методы
В исследование включены 88 больных ХСН I-IV функционального класса (ФК) по NYHA, перенесших инфаркт миокарда, от 40 до 65 лет с признаками тревожности и депрессии.Выборку для исследования составили 88 пациентов, из них 48% мужчин и 52% женщин; 42 больных включены в опытную группу, 46 - в контрольную. Средний возраст 57±8,5 лет. Все больные проходили стационарный этап реабилитации после инфаркта миокарда. Структура диагноза пациентов складывалась следующим образом: инфаркт миокарда с зубцом Q имели 46,8%, а инфаркт миокарда без зубца Q - 43,2% больных; постинфарктный кардиосклероз в анамнезе определялся у 30% исследуемых. Течение подострого периода инфаркта миокарда осложнилось рецидивом у 24%, развитием аневризмы левого желудочка - у 10% больных, постинфарктной стенокардией - у 76,6%, нарушениями ритма (частая желудочковая экстрасистолия, пароксизмы мерцательной аритмии и т.д.) - у 24%. Артериальная гипертензия отмечалась у 76,6% пациентов.
Объективные данные о состоянии пациентов были получены при физикальном исследовании, а также с помощью методов эхокардиографии (ЭхоКГ) и электрокардиографии (ЭКГ), холтеровского мониторирования ЭКГ (ХМ ЭКГ). У всех больных определялись выраженность тревожно-депрессивной симптоматики, тип личности, наличие вегетативной дисфункции. Функциональный класс больных устанавливался согласно классификации NYHA и тесту шестиминутной ходьбы (ТШХ). Помимо объективных методов исследования для оценки состояния пациентов использовались различные разнонаправленные опросники и шкалы, которые можно разделить на две группы.
1. Специфические
Л. Шкала оценки клинического состояния больного с ХСН (модификация В.Ю. Мареева, 2000 г.). Каждый из пунктов, вошедших в версию этой шкалы, отражает основные симптомы ХСН (наличие одышки при нагрузке, в покое; наличие отеков, хрипов в легких и т.д.). В итоге количество баллов может быть от 0, что отражает отсутствие признаков ХСН, до 20, что соответствует критической выраженности симптомов декомпенсации. Изменение этих баллов количественно свидетельствует об изменениях состояния больного, даже если не изменяются ФК и толерантность к физическим нагрузкам [14].Б. Миннесотский опросник качества жизни у больных с ХСН (MLHFO). Опросник содержит 21 вопрос, ответы на которые позволяют оценить, насколько имеющаяся сердечная недостаточность ограничивает, во-первых, физические возможности больного справляться с обычными повседневными нагрузками (самообслуживание, толерантность к физическим, социальным, эмоциональным нагрузкам, необходимость иметь адекватный сон и отдых, мобильность и независимость); во-вторых, социально-экономические аспекты и общественные связи пациента (участие в жизни семьи, материальное обеспечение и расходы на лечение, профессиональные обязанности, связь с друзьями и активный отдых); в-третьих, негативное эмоциональное восприятие жизни (ощущение себя обузой для родных, потеря контроля над жизнью, страх за будущее, безысходность). Этот опросник с успехом используется во многих исследованиях, в том числе и в России [14].
В. Сиетловский опросник качества жизни больных стенокардией. Опросник содержит 11 вопросов, ответы на которые позволяют оценить, насколько ангинозные приступы ограничивают физические возможности больного справляться с обычными повседневными нагрузками, эмоциональное восприятие жизни (страх перед новым приступом стенокардии, возможной смертью), удовлетворенность лечением и усилиями врачей [23].
2. Неспецифические опросники
A. MOS SF-36 (MOS 36-ltem Short-Form Health Survey). Опросник используется в клинических исследованиях и при индивидуальном мониторинге качества жизни здорового населения и больных с различными заболеваниями. MOS SF-36 содержит 9 шкал, каждая из которых состоит из 2-10 подпунктов, отражающих физическое, социальное, эмоциональное функционирование человека, а также изменения состояния здоровья. По специальной формуле рассчитывается коэффициент качества жизни, выражаемый в процентах [15].Б. Шкала балльной оценки проявлений вегетативной дистонии. Шкала предложена A.M. Вейном. Данная шкала позволяет диагностировать наличие синдрома вегетативной дисфункции. Общая сумма баллов, полученная при изучении признаков по вопроснику, у здоровых лиц не должна превышать 15, в случае превышения можно говорить о наличии синдрома вегетативной дисфункции [11].
B. Госпитальная шкала тревоги и депрессии (HADS) относится к субъективным шкалам. Шкала предназначена для выявления тревоги и депрессии в общесоматической практике. HADS содержит две подшкалы - "тревога" и "депрессия". При интерпретации результатов учитывается суммарный показатель по каждой подшкале, при этом выделяются три области его значений: 0-7-"норма", 8-10-"субклинически выраженная тревога/депрессия", 11 и выше - "клинически выраженная тревога/депрессия" [16].
Г. Анкета субъективной оценки нарушений сна. Суммарная оценка 22 и более баллов -сон нормальный, 19-21 балл - пограничные значения, менее 19 баллов-сон нарушен [17].
Д. Анкета для скрининга синдрома апноэ во сне, которая при значениях более 4-х баллов позволяет с большой вероятностью подозревать у больного присутствие синдрома апноэ во сне. Шкала позволяет определить наличие противопоказаний к назначению лекарственных средств, а также оценить их безопасность [17].
Е. Экспресс-метод оценки психического статуса пациента. С помощью этого метода оцениваются произвольное внимание, логическое мышление, кратковременная память и т.д. в баллах. На выполнение тестов дается 5-10 минут. Максимально возможное количество баллов 30 (норма), оценка менее 24 баллов свидетельствует о наличии у больного деменции [18].
Все больные с ХСН в зависимости от тяжести состояния получали необходимую базисную терапию: иАПФ (лизиноприл), р-блокаторы (метопролол), при необходимости - диуретики, сердечные гликозиды, нитраты.
Пациенты были рандомизированы по принципу "1-2" в отношении базисной терапии и базисной терапии + Грандаксин. Грандаксин назначался в стандартной суточной дозировке 100 мг курсом до 3 месяцев. Время наблюдения - 6 месяцев. Исходно контрольная (2) и основная (1) группы были сопоставимы по всем стандартным параметрам.
Оценка эффективности и безопасности проводилась в ходе трех визитов (точки обследования пациентов) после инициальной оценки - через 1, 3 и 6 месяцев от начала исследования.
Для оценки безопасности регистрировались все побочные эффекты проводимой терапии, установленные как по жалобам, так и при целенаправленном расспросе и анализе динамики стандартных инструментальных (продолжительность ЭКГ- интервалов) и лабораторных параметров.
Полученные результаты
Полностью завершили 12-недельный курс терапии 23 пациента опытной группы - все с выраженными тревожно-депрессивными расстройствами на фоне прогрессирования ХСН. Остальные 11 пациентов данной группы принимали Грандаксин только 6 недель. Из них 9 больных-с субклиническими проявлениями тревоги и депрессии (полная редукция тревожно-депрессивной симптоматики, по данным HADS, на фоне 6-недельной терапии Грандаксином), 3 - по причинам, не связанным с приемом препарата.Результаты исследования представлены в таблице №1.
Таблица 1. Динамика основных показателей качества жизни, вегетативной дисфункции, объективных данных, оцениваемых у больных ХСН
Показатели Основная группа (n=42) Контрольная группа (п=46) Т* Р* Исходно 6 мес Δ% Т p исходно 6 мес Δ% Т p Дистанция 6 мин.ходьбы, м 341,5+16,34 429,5+17,3 20 25 0,005 342,8+15,85 413,3+20,3 17 19 0,005 4,2 0,005 Конечный диастолический размер левого желудочка (КДРЛЖ), мм 52,89+6,79 50,61+6,29 4,5 1,5 0,015 52,9+6,99 50,61+6,4 4 1,23 0,014 0,001 1,0 Размер левого предсердия (ЛП), мм 38,57+4,38 36,65+4 5 2,4 0,015 38,7+4,5 38,4+4,21 0,8 1,09 0,27 1,23 0,21 Фракция сердечного выброса (ФВ),% 54,38+8,29 56,87+4,9 4.4 2,2 0,028 55,08+8,2 55,16+5,27 0,1 0,001 1,0 1,98 0,05 Индекс сократимости (ИС) 3,04+3,09 2,85+3,05 6,3 1,65 0,1 3,12+3 3+3,07 1,4 0,001 1,0 1,65 0,102 SF-36, шкалы: Физич. здоровье 22,63+2,98 17,59+2,32 23 9,7 19,18+3,64 21,42+3,53 10,5 2,4 0,015 4,2 Боль 5,85+1 9,1+0,92 35,8 14,84 6,72+1,6 7,2+1,34 6,7 3,13 0,002 9,89 Общего здоровья 6,3+0,63 18,85+1,34 99,4 64,3 6,3+0,7 11,3+1,06 78,8 24,4 39,5 Жизнелюбия 12,3+1,16 20,42+0.77 66,8 39,5 12,3+1,16 15,38+1,58 21,1 9,39 15,65 Соц-го функционир. 6,12+0,97 3,71+0,44 39,4 9,8 6,3+0,96 5,57+0,52 8,01 4,9 4,95 Эмоции 3,46+0,49 5,59+0,48 39,2 14,8 3,46+0,49 4,55+0,53 24,1 4,9 9,89 Псих.здоровья 14,4+1,34 21.85+2,49 41,2 25 14+1,3 19,4+3,56 34,4 8,48 4,69 КЖ,% 47,14+4,23 65,59+6,77 39,1 16,49 47,15+4,2 53,4+3,6 13,2 8,4 11,9 Тревога (HADS) 12,7+1,2 5,9+0,9 63,5 34,6 12,6+1,2 10,3+1,7 19,9 14,84 19,7 Депрессия (HADS) 9,69+1,23 7,87+0,5 19,8 9,8 10,3+1,7 9,44+1,5 8,4 4,9 4,9 Сон 16,81+1,24 23,04+0,71 37 29,6 16,8+1,2 20,44+1,09 21,6 14,8 14,84 Апноэ 2,55+0,49 2,63+0,47 3,1 0,0001 1,0 2,6+0,49 2,64+0,47 3,8 0,001 1,0 0,001 1,0 Миннесотский опросник 63,89+8,5 49,3+6,56 22,8 9,2 64,3+8,02 59,1 +6,31 8,1 3,23 0,002 7,59 Сиетлский опросник 42,9+9,3 69,9+10 62,9 14.04 42,9+9,26 53,7+4,96 25,1 7,4 10,0 Вегетативная дисфункция 23,4+3,5 14,08+0,64 38,9 19,96 0,121 22,9+4 19,28+3,5 15,9 3,7 8,48 Время выполнения тестов (внимание, память, мышление), мин 10,53+2,16 8,95+1,19 15,4 6,26 10,65+3 9,7+1.52 8,5 6,26 4,95 Примечание: р- достоверность различий между исходными и конечными результатами;
р* - достоверность различий между конечными результатами в основной и контрольной группах;
t- критерий достоверности Стьюдента между исходными и конечными результатами;
t* - критерий достоверности Стьюдента между конечными результатами в основной и контрольной группахВ результате проведённого исследования установлено, что у больных ХСН ФКИ-IV нарушения психического статуса выявляются чаще (82%), чем при ХСН ФК 1-18%. У пациентов опытной группы с преобладающей тревожной симптоматикой уже в начале исследования была установлена высокая анксиолитическая эффективность Грандаксина в составе базисной терапии ХСН (D%= 63,5, р<0,005), рис. 1.
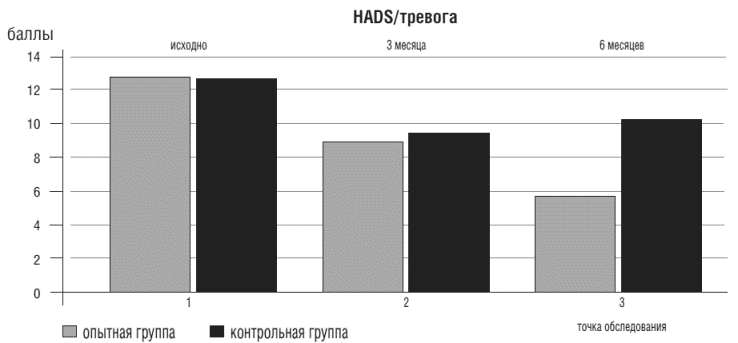
Рисунок 1. Показатели тревожности у больных ХСН в опытной и контрольной группах в точках обследования
На фоне дополнения базисной терапии ХСН Грандаксином значимо снизились показатели депрессии у пациентов 1 группы (D%= 19,8, р<0,05), рис. 2.
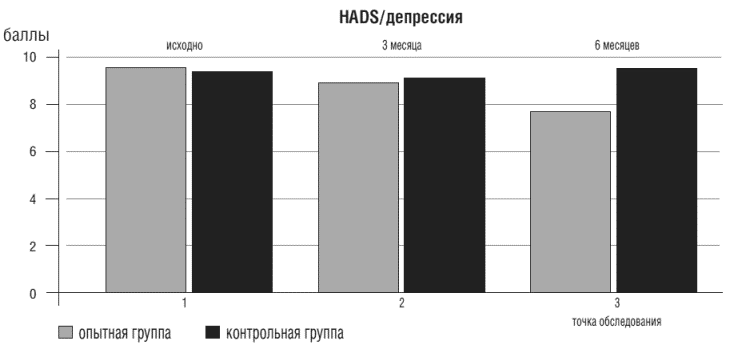
Рисунок 2. Показатели депрессии у больных ХСН опытной и контрольной групп в точках
Необходимо отметить, что показатели тревоги и депрессии у пациентов контрольной группы тоже снижались (D%=19,9 и D%=8,4, соответственно, р<0,05), но так и не достигли нормальных значений к концу исследования.
Эффективность препарата оценивалась по редукции тревожно-депрессивной симптоматики у обследуемых больных, согласно HADS:
а) хороший эффект- уменьшение выраженности тревожной симптоматики более чем на 75% от исходного уровня;
б) удовлетворительный эффект - уменьшение уровня тревоги на 50-75% от исходного уровня;
в) неудовлетворительный эффект - снижение уровня тревоги менее чем на 50% от исходного уровня.В исследуемой группе хорошая эффективность препарата отмечена у 78,5% пациентов, удовлетворительная - у 21,5%. Неудовлетворительных оценок эффективности препарата не отмечено (рис.3).
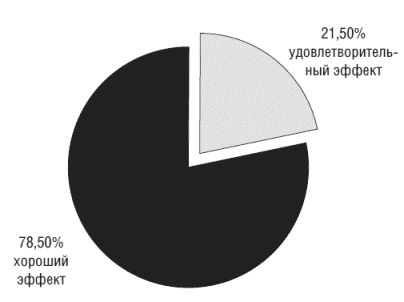
Рисунок 3. Показатели эффективности Грандаксина в составе базисной терапии ХСН
Важно отметить, что с уменьшением выраженности аффективных расстройств у пациентов опытной группы снижение ФК ХСН было более значимым, чем в контрольной группе (табл. 1). Это подтверждается увеличением дистанции теста шестиминутной ходьбы (ТШХ) на 20% - в первой и на 17% - во второй группе (р<0,05), что отражает рост толерантности к физическим нагрузкам.
Оценка клинического состояния пациентов также свидетельствует об улучшении ФК ХСН у 17 больных опытной группы и только у 12- контрольной группы. 4 пациента контрольной группы перешли из 3-го ФК в 4-й (схема 1).

Схема 1. Динамика клинического статуса больных хронической сердечной недостаточностью, перенесших инфаркт миокарда (период наблюдения - 6 месяцев)
У 30% больных проводилось ХМЭКГ в течение суток с целью выявления ишемических изменений сегмента ST и нарушений ритма. В опытной группе в начале исследования ишемические изменения сегмента ST и зубца Т были выявлены в 68% случаев. К концу исследования эта цифра составила уже только 18% (р<0,05). В контрольной группе ишемические изменения выявлялись у 65% в начале и у 30% больных - в конце исследования; различие между группами достоверно.
В обеих группах претерпела изменения геометрия сердца. Конечный диастолический размер левого желудочка (КДРЛЖ) уменьшился по сравнению с исходными значениями на 4,5% и 4%, соответственно. Размер левого предсердия (ЛП) в исследуемой группе уменьшился на 5%, в контрольной группе этот показатель составил 0,8%, р*=0,21.
К концу 6-го месяца исследования в первой группе больных наметилась тенденция к росту фракции сердечного выброса (ФВ) на 4,4%, что привело к увеличению сократительной способности миокарда. Индекс сократительной способности миокарда (ИС) уменьшился на 6,3%. Снижение ИС отражает восстановление сократительной способности миокарда [13]. Однако статистически достоверных различий в уменьшении этих показателей в обеих группах не выявлено (рис.4).
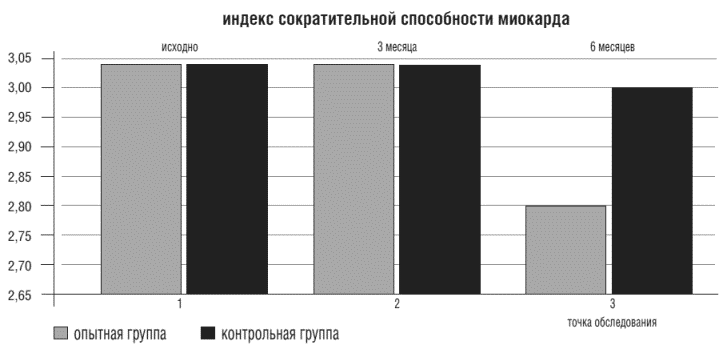
Рисунок 4. Показатели сократительной способности миокарда в опытной и контрольной группах в точках обследования
Нарушение геометрии сердца присуще всем пациентам с хронической сердечной недостаточностью и часто предшествует уменьшению фракции сердечного выброса, нарушениям системной гемодинамики и клиническим проявлениям сердечной недостаточности [19]. Эти изменения в структуре и геометрии камер сердца, именуемые "ремоделированием", могут самостоятельно усугублять систолическую и диастолическую дисфункцию желудочков и отрицательно влиять на качество жизни и выживаемость больных.
Структурные изменения региональной геометрии левого желудочка могут способствовать позднему прогрессирующему нарушению функции левого желудочка, которое продолжается длительное время в отсутствие дополнительных эпизодов ишемии и некрозов миокарда [20].
В табл. 2 представлено распределение пациентов с различными типами ремоделирования миокарда левого желудочка в зависимости от ФК ХСН в точках исследования.
Таблица 2. Распределение пациентов с концентрической гипертрофией и концентрическим ремоделированием миокарда левого желудочка в зависимости от ФК ХСН
ФКХСН Опытная группа (n=42) Контрольная группа (n=46) 0 нед 24 нед 0 нед 24 нед ФКI - концентрическая гипертрофия 2% 0 2% 0 ФКI - концентрическое ремоделирование 2% 4% 2% 4% ФК II - концентрическая гипертрофия 10% 10% 10% 8% ФК II - концентрическое ремоделирование 26% 26% 26% 28% ФК III - концентрическая гипертрофия 20% 18% 18% 16% ФК III - концентрическое ремоделирование 30% 32% 32% 34% ФК IV - концентрическая гипертрофия 0 2% 0 2% ФК IV- концентрическое ремоделирование 8% 6% 8% 6% Анализ динамики изменения характера ремоделирования сердца в процессе терапии больных 1 и 2 групп свидетельствует об отсутствии достоверных различий между пациентами опытной и контрольной групп. Так, в конце 6-месячного наблюдения концентрическая гипертрофия (увеличение массы миокарда и относительной толщины стенки левого желудочка) наблюдалась у 30% пациентов опытной и у 32% - контрольной групп. В остальных случаях пациенты имели концентрическое ремоделирование миокарда (нормальная масса миокарда и увеличенная относительная толщина стенки левого желудочка).
Более выраженные изменения дистанции ТШХ, показателей ХМЭКГ, ФВ и ИС в конце 6-месячной терапии у больных опытной группы по сравнению с пациентами контрольной нашли отражение и в существенном различии показателей КЖ больных 1 и 2 групп (рис. 5).
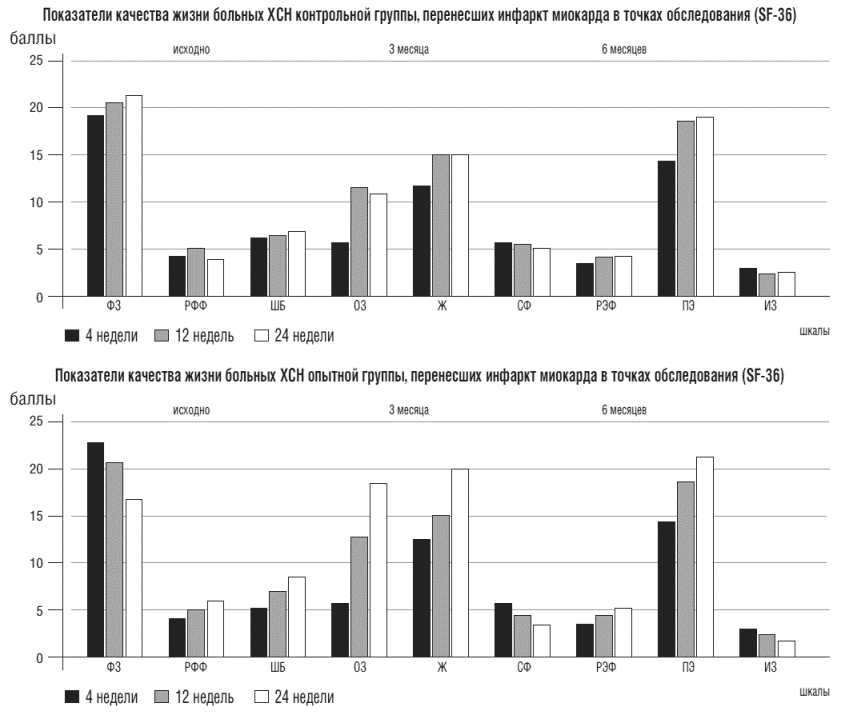
Рисунок 5. Показатели качества жизни больных хронической сердечной недостаточностью контрольной и опытной групп в точках обследования
Шкалы: ФЗ - физическое здоровье, РФФ - ролевое физическое функционирование, ШБ - шкала боли, 03 -общего здоровья, Ж - жизнелюбия, СФ - социального функционирования, РЭФ - ролевого эмоционального функционирования, ПЗ - психического здоровья, ИЗ - изменения состояния здоровья, КЖ - коэффициент качества жизни (%)
Согласно Миннесотскому опроснику и опроснику SF - 36, включающему в себя все аспекты деятельности человека (физический, социальный и эмоциональный), показатели КЖ в опытной группе достоверно увеличились на 22,8% и 39,1%, соответственно (рис. 8). Динамика этих показателей в контрольной группе составила 8,1 % и 13,2%, соответственно; различие между 1 и 2 группами достоверно (р<0,05). Это не может не сказаться на продолжительности и результатах реабилитации, цель которой - снижение инвалидизации населения после перенесенного инфаркта миокарда и возвращение больного к полноценной жизни.
Важной также является установленная в ходе исследования зависимость между увеличением толерантности к нагрузкам (по данным ТШХ), уменьшением частоты эпизодов ишемии миокарда и показателями психологических тестов: шкала боли SF-36 и Сиетлский опросник. Показатели этих шкал выросли по сравнению с исходными на 35,8% (р<0,05) и на 62,9% (р<0,05), соответственно. То есть у пациентов основной группы на фоне роста коронарного резерва, редукции тревожно-депрессивной симптоматики уменьшились количество и интенсивность ангинозных приступов (рис.6).
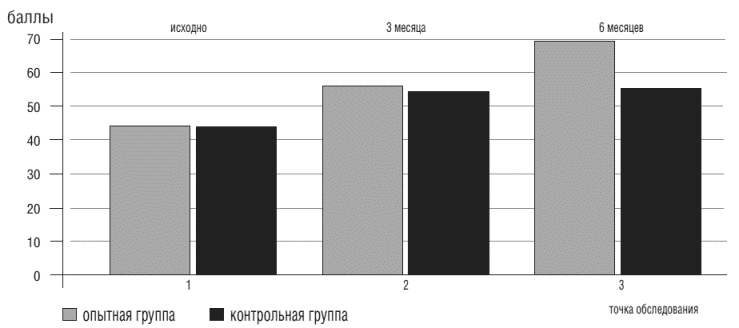
Рисунок 6. Показатели качества жизни больных со стенокардией в точках обследования (Сиетлский опросник)
Анализ взаимосвязи качества жизни пациентов и типов ремоделирования миокарда свидетельствует об отсутствии линейной зависимости между соматическим состоянием больных, клиническим течением болезни и степенью удовлетворенности жизнью. При более детальном анализе показателей качества жизни в группе пациентов с концентрической гипертрофией миокарда установлены достоверно более высокие показатели по шкале социального функционирования и более низкие - по шкале ролевого эмоционального функционирования (SF-36). Это свидетельствуете выраженной психо-социальной дезадаптации этих больных по сравнению с группой пациентов с концентрическим ремоделированием миокарда. Основными причинами снижения качества жизни у больных в раннем постинфарктном периоде являются разного рода ограничения, прежде всего - в социальном статусе и повседневной активности.
Так как у пациентов с тревожно - депрессивной симптоматикой имеется нарушение баланса между симпатическим и парасимпатическим отделами вегетативной нервной системы, это опосредованно может приводить к нарушениям ритма сердца. В связи с этим проводилась оценка вегетативного статуса пациентов с помощью шкалы балльной оценки проявлений вегетативной дистонии [11]. На момент включения в исследование у пациентов обеих групп был одинаковый уровень проявлений вегетативной дисфункции. На фоне применения Грандаксина в составе базисной терапии ХСН уровень вегетативной дисфункции снизился на 38,9% (нормализовался), а в контрольной группе (прием только базисных препаратов) - на 15,9% (межгрупповые различия достоверны, р<0,05) (рис. 7).
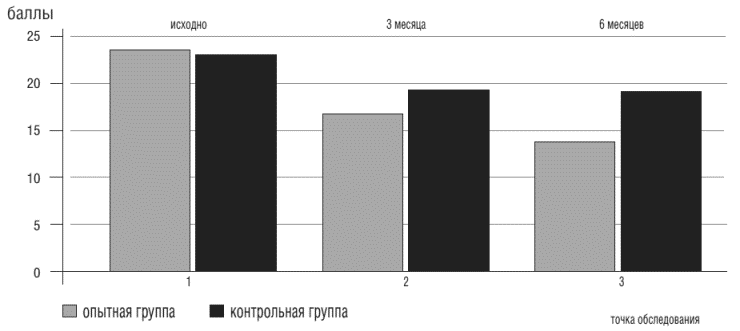
Рисунок 7. Показатели синдрома вегетативной дисфункции у больных ХСН в точках обследования
Таким образом, в ходе лечения психический и соматический компоненты заболевания подвергались обратному развитию параллельно, что подтверждает сочетание противотревожного и вегетостабилизирующего эффектов в спектре клинической эффективности Грандаксина. Снижение исходного уровня тревоги на фоне улучшения объективных характеристик (ТШХ, ФВ, ИС и т.д.) проявлялось редукцией эмоциональных нарушений, опасений за неблагоприятный исход восстановительного периода инфаркта миокарда. Уже через 1-2 недели лечения Грандаксином пациенты отмечали уменьшение частоты и выраженности ощущения учащенного сердцебиения, напряжения в теле, плаксивости; нормализовался сон. На этом фоне повышался уровень социальной адаптации больных опытной группы. Эти пациенты, оказавшись вне поля зрения врача, смогли вернуться к прежнему уровню активности (физической и социальной).
В ходе проведенного исследования установлено, что переносимость препарата в целом хорошая. Случаев преждевременной отмены Грандаксина из-за побочных эффектов не было. Гематологические, клинико-биохимические показатели при дополнении препаратом базисной терапии ХСН не изменялись. После отмены Грандаксина не обнаружено признаков лекарственной зависимости.
Анализ основных параметров ЭКГ пациентов основной группы в начале и в конце исследования показал, что применение Грандаксина в сочетании с препаратами лечения ХСН не влияет на продолжительность основных ЭКГ-интервалов (PQ, QT и т.д.) (табл. 3).
Таблица 3. Показатели электрокардиограммы у больных ХСН, перенесших инфаркт миокарда, на фоне дополнения базисной терапии Грандаксином
Показатели ЭКГ Опытная группа (n=42) Контрольная группа (n=46) На момент включения в исследование В конце исследования На момент включения в исследование В конце исследования R-R,сек 3,683+0,032 4,12+0,014 3,742+0,034 4,123+0,023 P-Q,сек 0,154+0,043 0,194+0,015 0,134+0,032 0,187+0,014 Q-T, сек 0,318+0,043 0,381+0,0123 0,321 ±0,022 0,379+0,012 Многие психотропные препараты, в том числе и транквилизаторы, противопоказаны при наличии у пациента синдрома апноэ во сне, так как могут усугубить его проявления. Поэтому входе настоящего исследования оценивались показатели шкалы для выявления апноэ во сне до и после окончания приема препарата. Анализ полученных данных показал, что применение Грандаксина не влияет на выраженность апноэ во сне (пограничное значение по шкале "Апноэ во сне" - 3 балла) (рис.8).
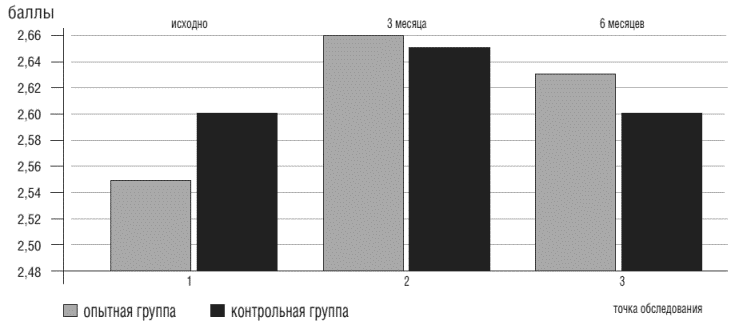
Рисунок 8. Показатели опросника "апноэ во сне" у больных ХСН в точках обследования на фоне приема Грандаксина
С учетом данных ряда публикаций о неблагоприятном влиянии транквилизаторов на уровень внимания и оперативной памяти [12] изучались показатели когнитивных функций, исходно изменённые у многих больных с тяжелыми формами ИБС. Ни у одного из пациентов опытной группы клинически значимых нарушений когнитивного статуса не наблюдалось. К концу исследования в обеих группах сократилось общее время выполнения тестов, свидетельствующих об уровне внимания, кратковременной и долговременной памяти, логического мышления (на 15,4% - в опытной и на 8,5% - в контрольной группах, р<0,05). Это можно объяснить улучшением сократительной способности миокарда, увеличением ФВ, а следовательно - кровообращения головного мозга.
За время наблюдения (6 мес) признаков неблагоприятного лекарственного взаимодействия Грандаксина с соматотропными препаратами (нитраты, р-блокаторы, антиаритмики, ингибиторы АПФ, сердечные гликозиды, мочегонные) не отмечалось.
Заключение
Полученные данные свидетельствуют об эффективности Грандаксина в терапии тревожно-депрессивных расстройств у больных ХСН в раннем постинфарктном периоде. На фоне нормализации психологического статуса пациентов, получавших Грандаксин, прослеживается положительная динамика их объективного статуса: рост фракции сердечного выброса, увеличение дистанции ТШХ, снижение индекса сократительной способности миокарда. Психическое состояние и качество жизни больных хронической сердечной недостаточностью, перенесших инфаркт миокарда, весьма динамично. Основными причинами снижения качества жизни у больных в раннем постинфарктном периоде являются разного рода ограничения, прежде всего - в социальном статусе и повседневной активности. Взаимосвязь между соматическим состоянием, психологическим статусом и качеством жизни больных хронической сердечной недостаточностью в раннем постинфарктном периоде не носит характера прямой линейной зависимости.У пациентов опытной группы в ходе 6-месячного наблюдения установлена значимая редукция тревожно-депрессивной симптоматики, что сопровождается уменьшением выраженности симптомов ХСН и коронарной недостаточности, снижением индекса локальной сократимости миокарда и ростом фракции сердечного выброса. Это позитивно сказывается на когнитивно-мнестических функциях данных пациентов. Кроме того, обнаружено, что Грандаксин опосредованно влияет на электрическую стабильность миокарда за счет нормализации баланса между парасимпатическим и симпатическим отделами вегетативной нервной системы. Резюмируя вышеизложенное, можно констатировать, что применение Грандаксина улучшает качество жизни постинфарктных больных, сокращает сроки реабилитационного периода, позволяет лучше адаптироваться к окружающей действительности и вновь стать полноценным членом общества.
Грандаксин характеризуется высокими показателями переносимости и безопасности. Результаты исследования позволяют рекомендовать использование Грандаксина с целью коррекции психологического статуса у больных ХСН в раннем постинфарктном периоде, имеющих тревожные расстройства, умеренные проявления вегетативной дисфункции, умеренные инсомнические нарушения.
Отсутствие значимого положительного эффекта этого препарата у пациентов с субклинической депрессией, по-видимому, требует дополнительного назначения антидепрессантов.
Таким образом, применение Грандаксина в составе базисной терапии ХСН улучшает не только физическое функционирование больных, перенесших инфаркт миокарда и имеющих аффективные расстройства, но и улучшает качество жизни пациентов (их психологический и социальный статус), обеспечивая лучший эффект от реабилитационных мероприятий по сравнению с базисной терапией.
Литература
1. Беленков Ю.Н, Мареев В.Ю. Принципы рационального лечения хронической сердечной недостаточности. М; 2000:254.
2. Вейн A.M. Вегетативные расстройства. М. 2000:749.
3. Вейн A.M., Рябус М.В. Нарушения сна в общемедицинской практике. М. Медпресс. 1998:43.
4. Дробижев М.Ю. Лечение депрессивных расстройств в кардиологии. Consilium Medicum. Экстравыпуск. 2002:15-18.
5. Левин Я.И, Садыкова Э.Т. Золпидем в лечении нарушений сна у больных ишемическим инсультом. Российский медицинский журнал. 1996;3:16-19.
6. Новик А.А., Ионова Т.И. Концепция исследования качества жизни в медицине/Изд. "Элби"; Санкт -Петербург. 1999;139.
7. Оганов Р.Г, Масленникова Г.Я. Стратегия преодоления стресса в современных условиях. Кардиология. 2002;44:7: 72-76.
8. Погосова Г.В. Депрессия: новый фактор риска ИБС и предиктор коронарной смерти. Кардиология. 2002; 42:4:86-90.
9. Смулевич А.Б. Депрессивные расстройства в кардиологии. Consilium Medicum. Экстравыпуск. 2002:3-5.
10. Сыркин А.Л. Ишемическая болезнь сердца и соматизированные депрессии: особенности клиники, дифференциальной диагностики и терапевтических подходов. Consilium Medicum. Экстравыпуск. 2002:7-9.
11. Сыркин А.Л. Инфаркт миокарда. М. 1998; 548.
12. Шейдер Р. Психиатрия. М. Практика, 1998; 765.
13. Beckers Т. Symptoms of depression, acute myocardial infarction and total mortality in a community sample. Vision Res. 2001;411:417:2297-2303.
14. Carney R.M, Saunders R.D, Freedland K.E. et al. Association of depression with reduced heart rate variability in coronary artery disease. Am. J. Cardiol. 1995; 67:562-564.
15. Devorux R.B, Alderman M.H. Role of preclinical care iscular disease in the evoluation from risk factor exposure to clinical morbid event. Circulation 1993; 88:1444-1445.
16. Eng C, Zhao M, Factor S. M, Sonenblick E. H. Post-ischaemic cardiac dilatacion and remodeling: reperfusion injury of the interstitium. Eur. Heart. J. 199
17. Gorman J.M., Sloan R. P. Heart rate v. and anxiety disorders. Am. Heart J. 20
18. Koren M. J, DevereuxR. B. Relation с and geometry to morbidity and mortality in uncomplicated essential hypertension. Ann. Intern. MED. 1991; 114:345-352.
19. Krittagaphong R. et al. Heart rate variability in patients with coronary artery disease: differences in patients with higher and lower depression scores. Psychosom. Med. 1997; 59; 231-255.
20. Lam C.L, Chan A.W. Can the Hospital Anxiety and Depression (HAD) Scale be used on Chinese elderly in general practice? Fam. Pract. 1995; 12:2:149-54.
21. Levy D, Garrison R.J, Savage D.D. et al. Prognosis implication of echocardiographiccally determined left ventricular mass in the Framingham Heart Study. N. Engl. J. Med. 1990; 322:1561-1566.
22. Malkom H. Leader. Association of depressive symptoms with reduced baroreflex cardiac control in coronary artery diseasy. Am. Psychosom. Med. 1999;57:260-264.
23. Spertus J. A. Monitoring the Quality of life in patients with Coronary Artery Disease. Am. J. Cardiol. 1994; 74: 1240-1244.
| Май 2014 г. |