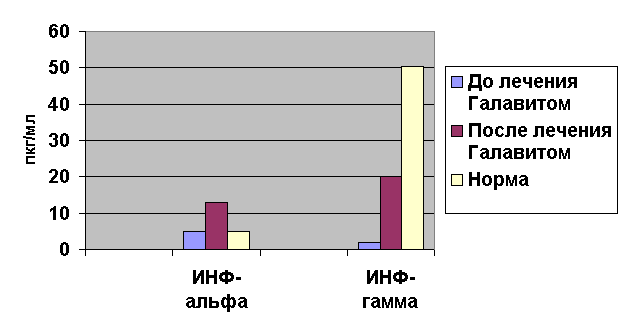№ 3/2003
Галавит в комплексной терапии больных с хронической рецидивирующей герпесвирусной инфекцией
А. Е. Шульженко, канд. мед. наук, зав. отделением аллергологии и иммунотерапии ГНЦ, Институт иммунологии МЗ РФ
И. Н. Зуйкова, клинический ординатор
Генитальный герпес (ГГ) в настоящее время относится к наиболее частым заболеваниям, передаваемым половым путем, и представляет собой одну из наиболее социальнозначимых проблем в медицине. Частота генитального герпеса, регистрирующаяся в разных странах, значительно увеличилась за последние годы, что о многом мере связано с распространением бессимптомной и недиагностированной герпетической инфекции.
По современным оценкам в России, число больных, обращающихся по поводу генитального герпеса, составляет около 15 % от реальной частоты заболевания, а общее число больных, страдающих острыми и рецидивирующими формами ГГ, может составлять около 8 млн человек. В целом у 90% взрослого населения в крови содержатся антитела к вирусам простого герпеса, при этом многие из них ни разу не переносили клинически выраженного эпизода заболевания.
В зависимости от биологических свойств и путей передачи вирусы простого герпеса (ВПГ) условно подразделяют на два типа: ВПГ первого типа (ВПГ 1) и ВПГ второго типа (ВПГ 2). В подавляющем большинстве случаев при генитальном герпесе инфекционным агентом является ВПГ 2, при этом в 10–26% случаев генитальный герпес вызван ВПГ 1, что объясняется орально-генитальным путем заражения. Заболевание передается как от больного генитальным герпесом, так и от носителей вируса, не имеющих (что особенно важно) клинических проявлений заболевания. Следует отметить, что наличие инфицированности ВПГ 1 не предотвращает возможности реинфицирования ВПГ 2, при этом вполне вероятно одновременное сосуществование нескольких видов и штаммов вирусов.
Входными воротами для генитального герпеса служат кожные покровы, слизистые оболочки половых органов. Далее вирус распространяется преимущественно по нервным окончаниям, а также по гематогенным и лимфогенным путям. Спектр клинических проявлений герпетической инфекции характеризуется значительным полиморфизмом вследствие тропизма ВПГ к эпителиальным и нервным тканям и зависит от места локализации патологического процесса, его интенсивности и распространенности, а также состояния иммунной системы.
Согласно данным исследователей только 20% инфицированных ВПГ имеют диагностированный генитальный герпес, 60% – нераспознанный симптоматический генитальный герпес (атипичную форму) и 20% – бессимптомный герпес. Бессимптомная форма представляет наибольшую эпидемиологическую угрозу, т. к. больные с бессимптомным генитальным герпесом чаще всего становятся источниками инфицирования, а беременные женщины – источником инфицирования ребенка.
Герпетическая инфекция, наряду с цитомегаловирусной, является одним из главных повреждающих факторов плода и новорожденного, вызывая увеличение самопроизвольных абортов, преждевременных родов, рождения детей с патологией ЦНС и внутренних органов. Кроме того, многочисленные исследования
показали, наличие связи между рецидивирующей герпесвирусной инфекцией и развитием онкологической патологии у женщин.
Исследования последних лет указывают на частое сочетание герпетической инфекции гениталий с хламидиями, микоплазмами, трихомонадами, гарднереллами, грибами рода Candida. Длительная персистенция герпесвирусов в организме человека и специфический иммунодефицит, сформированный у больных рецидивирующим генитальным герпесом, способствуют присоединению других инфекций урогенитального тракта.
Характерной особенностью герпесвирусов является способность, попав однажды, пожизненно персистировать в организме хозяина и вызывать многообразные формы заболеваний на фоне иммунной дисфункции. В латентной фазе экспрессируется ограниченное количество вирусных генов, продукты которых поддерживают вирус в неактивном состоянии. Реактивация, т. е. переход от персистенции к активной репликации, наблюдается при нарушении динамического равновесия между иммунным гомеостазом и вирусами, что отражает срыв контролирующих механизмов хозяина. Способность к длительному персистированию обусловливается наличием у герпесвирусов многочисленных механизмов, воздействующих на формирование противовирусной иммунной защиты и приводящих к уклонению патогенов от иммунологического надзора. Индуцированное вирусами ослабление иммунной защиты позволяет им благополучно размножаться и распространяться в организме хозяина в течение длительного времени.
Таким образом, в лечении рецидивирующего генитального герпеса до сих пор, несмотря на существенное развитие фармакологической терапии, имеются значительные методические и практические трудности. Современные фармакологические методы не способны прервать длительную персистенцию герпесвирусов в организме человека, а также бессимптомное вирусовыделение.
В тактике лечения генитального герпеса можно выделить следующие задачи:
1) ослабление выраженности клинических симптомов инфекции (зуд, жжение, боль, лихорадка и лимфоаденопатия);
2) сокращение срока полной реэпителизации поражения;
3) уменьшение частоты и тяжести рецидивов;
4) предупреждение передачи инфекции половому партнеру или новорожденному.
Для достижения этих задач в настоящее время используются следующие подходы: противовирусная химиотерапия, иммунотерапия и комбинация этих методов.
«Золотым стандартом» противогерпетической химиотерапии является первый лечебный синтетический нуклеозид – ацикловир, ациклический аналог гуанозина. Гуанозин – один из самых частых концевых и внутренних нуклеозидов ДНК герпес-вирусов и составляет 16% всех повторов в цепях ДНК герпеса, что обусловило очень высокую терапевтическую активность ацикловира. Механизм действия ацикловира основан на его высокоспецифичности в отношении вирусной тимидинкиназы, которая фосфорилирует ацикловир. ДНК-полимераза вируса ошибочно включает фосфорилированный ацикловир вместо естественного дезоксигуанозинтрифосфата в концевые участки новых вирусных ДНК. Это обрывает процесс репликации вируса на любой стадии, и новые генерации вирусов не образуются.
В последнее время синтезированы и широко используются новые противовирусные препараты этой группы валтрекс и фамвир, в которых преодолен основной недостаток ацикловира – низкая биодоступность при пероральном применении.
К настоящему времени более 50 млн человек успешно прошли лечение ацикловиром и его аналогами различными способами – местно, орально и парентерально, короткими и многолетними курсами. Следует отметить, что при длительном приеме (превентивная терапия), помимо снижения частоты рецидивов, отмечается уменьшение бессимптомного выделения вируса. Следовательно, это теоретически может снижать риск передачи вируса. Однако в ряде случаев даже на фоне длительной превентивной терапии могут возникать обострения и эпизоды бессимптомного вирусовыделения, при которых не исключена возможность неумышленного инфицирования половых партнеров. Это объясняется, прежде всего, развитием устойчивости вируса герпеса к ацикловиру.
За последние 10 лет увеличилось число исследований, в которых показано, что изоляты вируса простого герпеса (ВПГ 2), полученные от пациенток с продолжающимися рецидивами генитального герпеса на фоне длительной супрессивной терапии (более 4 мес.), обладают резистентностью по отношению к ацикловиру. Кроме того, ни один из существующих противовирусных препаратов не способен элиминировать вирус из организма.
Поэтому наиболее перспективным представляются методы сочетанного применения химиопрепаратов и иммунотерапии с целью стимуляции звеньев иммунной системы больных генитальным герпесом, тем самым способствуя блокаде репродукции вируса.
Таким образом, в настоящее время являются актуальными вопросы включения в терапию рецидивирующего генитального герпеса препаратов иммуномодулирующей направленности и изучения эффективности схем комплексной терапии.
Целью данного исследования являлось изучение эффективности применения препарата Галавит (ЗАО «Центр современной медицины Медикор», Россия) в комплексной терапии у пациентов с хронической рецидивирующей генитальной герпесвирусной инфекцией.
Материалы и методы исследования
Для исследования было отобрано 30 человек в возрасте от 16 до 65 лет с клиническими проявлениями генитальной формы герпесвирусной
инфекции, резистентной к противовирусной терапии. Критериями отбора являлись:
наличие анамнеза герпетического
поражения половых органов; клиническая картина рекуррентного герпеса половых
органов в периоде продромы или обострения, при этом не более 48 часов от
момента появления высыпаний, а также полноценная контрацепция у женщин
детородного возраста.
На предварительном этапе отбора методом произвольной
выборки были сформированы две группы пациентов. В основную группу вошли 20
человек, которые получали базисную терапию валтрексом по 500 мг 2 раза в день в
комплексе с – по 100 мг в/м ежедневно 5 инъекций, далее по 100 мг через день
еще 15 инъекций. Контрольную группу составили 10 человек, которые получали
только базисную терапию валтрексом (таблица 1).
Таблица 1. Характеристика пациентов с ГГ, охваченных
исследованием
|
Группа
|
Общая численность
|
Соотношение в группе по полу, %
|
Средний возраст, лет
|
|
муж.
|
жен.
|
муж.
|
жен.
|
|
основная
|
20
|
35
|
65
|
38,3
|
31,5
|
|
контрольная
|
10
|
40
|
60
|
40,2
|
39,6
|
Анамнестически в обеих группах средняя
продолжительность заболевания (время с момента появления первого клинического
эпизода) составила 3 года, частота рецидивов – не менее 6 раз в год (средняя
частота по обеим группам – 8 раз в год).
До лечения всем
пациентам для подтверждения наличия герпесвирусной инфекции проводилась
ПЦР-диагностика (выявление ВПГ 2 в 100 % случаев).
У всех пациентов были жалобы на пузырьковые или
эрозивные высыпания в области гениталий, зуд, жжение.
Методы исследования
Все пациенты прошли комплексное клиническое и
лабораторное обследование до приема препаратов, на 6-й день от начала приема и
после окончания приема препаратов.
Объективное обследование
включало в себя наружный осмотр места поражения. Оценивалось состояние кожных
покровов и слизистых: наличие
пузырьков, язвочек, корочек, гиперемии. Выяснялись жалобы пациента (зуд,
жжение, общее состояние, температура, миалгия).
Для оценки степени
выраженности местных симптомов больной опрашивался по следующей шкале оценок:
0.
Боль
и зуд отсутствуют.
1.
Симптомы
выражены слабо.
2.
Симптомы
выражены умеренно.
3.
Симптомы
выражены сильно.
Общая площадь поражения
подсчитывалась путем суммирования размеров площадей отдельных поражений.
Лабораторное обследование
включало в себя: общеклиническое исследование крови (гемоглобин, эритроциты, лейкоциты,
нейтрофилы, эозинофилы, лимфоциты, моноциты, СОЭ), определение иммунного
статуса (субпопуляции лимфоцитов CD3+, CD4+, CD8+, CD16+, CD25+, HLA-DR в
периферической крови, содержание иммуноглобулинов А, М, G в сыворотке,
ИФН-статус с определением уровня ИФН-a в сыворотке, его спонтанной
и стимулированной продукции, определение спонтанной и стимулированной продукции
ИФН-γ), биохимический анализ крови (общий белок, глюкоза, билирубин, АЛТ/АСТ,
тимоловая проба), общий анализ мочи,
идентификация возбудителя в мазках методом ПЦР.
Результаты
Оценка эффективности лечения
осуществлялась по первичному и вторичному критериям. Первичным критерием
служило время достижения полного выздоровления (полная реэпителизация),
вторичными были время, необходимое для образования корочек, и время
продолжительности местных симптомов (боль, зуд).
В основной группе больных
исчезновение везикул и образование корочек на фоне лечения Галавитом отмечалось уже на третий день от начала лечения, в то
время как в контрольной группе острая фаза местного воспаления купировалась
лишь к пятому дню. Полная реэпителизация в основной и контрольной группах
наступила к началу седьмого дня лечения. При этом возбудитель ВПГ 2 в мазках
методом ПЦР не выявлялся у 97% больных основной группы и у 95% больных группы
контроля. В процессе лечения препаратом свежие высыпания ни у кого не
наблюдались.
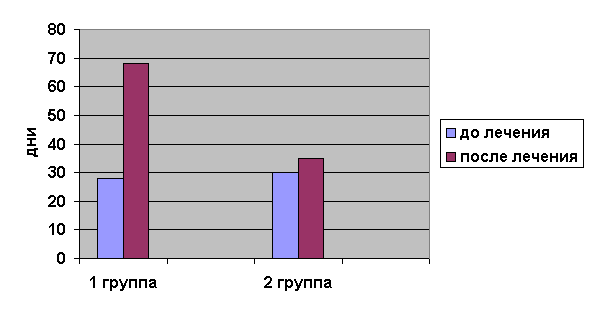
Кроме того, отмечено увеличение длительности
клинической ремиссии в отдаленном периоде в основной группе до 4-х месяцев (в
среднем до 68 дней), в контрольной группе она осталась практически без
изменений – 35 дней (рис. 1).
Рис. 1. Длительность клинической ремиссии в основной группе (после терапии Галавитом) и контрольной
Как уже упоминалось выше, у пациентов,
страдающих генитальной рецидивирующей герпесвирусной инфекцией, имеется
специфический иммунодефицит, сформированный персистированием вируса герпеса в
организме. Этот факт подтвердился при обследовании больных, охваченных в данным
исследованием, у них выявлялись
лабораторные признаки вторичного иммунодефицита.
В иммунном статусе пациентов, страдающих генитальной
герпесвирусной инфекцией, наиболее значимые изменения касались показателей, играющих важную роль в противовирусной
защите: содержания CD4+ лимфоцитов, NK-клеток, уровня выработки
ИФН-α и γ (табл. 2).
Таблица 2. Изменения в иммунограмме, наблюдаемые у
пациентов с ВПГ 2 до и после лечения
|
Показатели иммунограммы
|
Норма
|
До лечения
|
После лечения
|
|
Основная группа
|
Контроль
ная группа
|
Основная группа
|
Контроль
ная группа
|
|
CD 4+, %
|
31 – 49
|
28,3 ± 2,6
|
27,4 ± 2,8
|
45,4 ± 3,5*
|
30,7 ± 2,6
|
|
NK , %
|
10 – 20
|
7,2 ± 1,4
|
8,6 ± 1,3
|
14,4 ± 1,2*
|
9,3 ± 1,3
|
|
ИФН–γ,
пкг/мл
|
0 – 50
|
2,0 ± 0,7
|
2,0 ± 0,8
|
20,6 ± 4,5**
|
12,4 ± 4,8
|
|
ИФН–α,
пкг/мл
|
5 – 10
|
5,4 ± 1,2
|
4,2 ± 1,4
|
13,4 ± 2,1**
|
8,2 ± 2,8
|
* – Достоверно отличается от
исходного значения – р<0,01.
** – Достоверно отличается
от исходного значения – р<0,05.
Исходно в
основной и контрольной группе было снижено содержание CD4+ лимфоцитов (28% и 27%
соответственно) и NK–клеток (7% и 8% соответственно). Эти изменения
отражают способность вирусов герпеса угнетать ответ Т-лимфоцитов и NK–клеток,
воздействуя на систему MHC (главный комплекс
гистосовместимости). Кроме того, отмечалось одинаковое для обеих групп снижение уровней
выработки ИФН-α и γ. Снижение продукции ИФН-a, играющего важнейшую роль в осуществлении
противовирусной защиты, может способствовать развитию вирусной инфекции.
Недостаточность продукции "иммуннорегуляторного" ИФН-g отражает нарушение функциональной активности
CD4+ клеток у больных с рецидивирующим генитальным герпесом, которая также вносит заметный вклад в формирование у
больных иммунной дисфункции. В целом, снижение реактивности клеточного звена и
системы интерферона способствует
хроническому часто рецидивирующему течению герпесвирусной инфекции.
При анализе влияния терапии Галавитом в
основной группе отмечалось достоверное увеличение количества CD4+
лимфоцитов и NK–клеток до нормальных величин (рис. 2). Помимо
снижения количества иммунокомпетентных клеток, при герпесвирусной инфекции
характерно также снижение их функциональной активности, что проявляется в
снижении выработки цитокинов и, в частности, интерферонов.
Рис. 2 Основные изменения в иммунограмме у пациентов с ВПГ 2 в основной и контрольной группе до и после терапии Галавитом

Так, в основной группе наблюдался подъем уровней
ИФН-α и γ (рисунок 3). Повышение выработки ИФН-α способствует подавлению репликации
вируса, увеличивая экспрессию антигенов MHC I
класса, вследствие чего повышается чувствительность вирус-инфицированных клеток
к цитотоксическому действию Т-лимфоцитов. Кроме того, под действием ИФН-α
активируются NK-клетки, в результате чего усиливается синтез ИФН-γ, являющегося важнейшим фактором в
дифференцировке Т-хелперов и развитии противовирусной защиты.
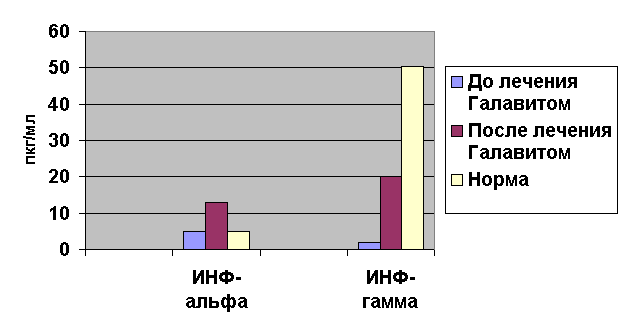
Рис. 3. Изменения уровня ИНФ-a и ИНФ-y у пациентов основной группы с ВПГ 2 до и после лечения Галавитом
В целом после приема Галавита у пациентов с хронической рецидивирующей герпесвирусной
инфекцией отмечалось некоторое восстановление содержания и функциональной активности клеток
(Т-хелперов, NK-клеток), участвующих в подавлении репликации
вируса, что отражается в увеличении длительности периода ремиссии.
В контрольной группе таких изменений не наблюдалось;
после проведения курса базисной терапии отмечалась тенденция в сторону
повышения только уровня интерферонов.
По данным общеклинических и лабораторных методов
исследования, побочных эффектов и осложнений при приеме препарата Галавит не выявлено.
Выводы
1.
Препарат Галавит оказывает иммунокорригирующее действие на систему иммунитета у больных, страдающих хронической рецидивирующей герпесвирусной инфекцией, увеличивая содержание CD4+ лимфоцитов и NK–клеток, активирующих систему интерферона.
2.
Применение Галавита в комплексной терапии пациентов с генитальной формой хронической рецидивирующей герпесвирусной инфекции сокращает длительность рецидивов и заметно уменьшает частоту рецидивов в отдаленном периоде.
Список использованной литературы находится в редакции.