Опубликовано в журнале:
Ричард Фарелл, Марк Пепперкорн
Отдел гастроэнтерологии, Центр воспалительных заболеваний кишечника, Медицинский центр имени Диаконисы Бете Исраэль, Гарвардская школа медицины, г. Бостон, штат Массачусетс, США
Lancet, Vol. 359, January 26, 2002.
Язвенный колит - это хроническое воспалительное заболевание прямой и толстой кишки. Результаты исследований воспаления кишечника в клинике и на животных показывают, что язвенный колит развивается от такого действия факторов среды, при котором теряется толерантность к нормальной кишечной флоре, если у организма-хозяина имеется соответствующая генетическая предрасположенность. Хотя, в общем, в лечении данного заболевания достигнут определенный прогресс, но за последнее время не появилось ни одной новой методики. В отличие от болезни Крона, данных по биологическим средствам лечения язвенного колита весьма мало. В контролируемых клинических испытаниях изучается несколько факторов, вышедших из эксперимента, а также традиционные действующие начала. Из всей совокупности изучаемых факторов наиболее перспективными представляются пробиотики.
Язвенный колит - это распространенное по всему миру, хроническое, идиопатическое воспалительное заболевание слизистой прямой и толстой кишки. В 1990-е годы мы стали глубже понимать роль факторов микросреды, и, в особенности, микрофлоры кишечника, а также генетических и иммунных факторов в патогенезе язвенного колита. Хотя, в общем, результаты лечения этой болезни стали лучше, но в последнее время не было разработано ни одной новой методики. Самые эффективные виды лечения всё больше отвечают требованиям доказательной медицины, чётче стали очерчиваться стадии лечения - индукционное и поддерживающее [I]. Успех лечения зависит от выбора лекарств, соответствующих тяжести и локализации заболевания у данного больного, причем аминосалицилаты являются основой лечения легких и средне-тяжелых форм. Хотя мощные иммуномодуляторы азатиоприи и 6-меркаптопурин получают растущее признание как средства лечения стероид-зависимого заболевания, но проблема токсичности этих веществ привела к тому, что на практике применяется циклоспорин в высоких дозах, и то, только при тяжелом активном язвенном колите. К несчастью, недостаточно еще клинических данных по применению инфликсимаба (infliximab) и других биологических препаратов у данных больных. Имеется ряд перспективных экспериментальных и традиционных активных факторов, изученных в контролируемых клинических испытаниях. К ним относятся иробиотики. Широко известно, что колоректальный рак может быть осложнением язвенного колита, однако, до сих пор нет единого подхода к практике колоноскопического скрининга, и не выработано оптимальной стратегии. К важным достижениям относятся: высокая степень согласия среди натоморфологов по классификации колоректальной эпителиальной неоплазии, получение данных в поддержку эндоскопического лечения полиповидиых диспластических образований при хроническом колите, а также накопление сведений о том, что аминосалицилаты препятствуют развитию колоректального рака. Мы представляем обзор недавних достижений в понимании патогенеза язвенного колита, современного лечения и методов, которые сейчас только появляются. Кроме того, мы анализируем формирующиеся подходы к уменьшению риска колоректального рака.
Достижения в понимании патогенеза
Внегеномные факторы
Многие данные из наблюдений за больными, а также из экспериментов с животными указывают на то, что язвенный колит является результатом действия факторов среды, которые у людей с генетической предрасположенностью вызывают срыв регуляторных механизмов, сдерживающих иммунные реакции на кишечные бактерии [2, 3J. Малая величина конкордантности по язвенному колиту у монозиготных близнецов (6-14%), по сравнению с близнецовой конкордантностью при болезни Крона (44-50%) является самым сильным свидетельством того, что для патогенеза язвенного колита факторы местной среды более важны, чем генетические факторы [4, 5]. Из всех факторов среды больше всего удивляет курение, которое препятствует развитию язвенного колита (а при болезни Крона оказывает вредоносный эффект) [6]. В одном исследовании констатировано, что у лиц, ранее куривших помногу, а затем бросивших, а также у всех бросивших курить, у некурящих и у курящих относительный риск развития язвенного колита, составил, соответственно 4,4, 2,5, 1,0 и 0,6 [7]. По-видимому, ингредиентом, вносящим наибольший вклад в эти закономерности, является никотин, но механизм остается неясным. Было показано, что курение влияет на клеточный [8] и гуморальный [9] иммунитет, а также повышает образование слизи в толстой кишке [10]; в то же время, курение и никотин (11) тормозят моторику толстой кишки. Нет данных о том, что курение может влиять на проницаемость кишечной стенки, но концентрация провоспалительных цитокинов интерлейкина-1бета и интерлейкина-8 в слизистой толстой кишки при язвенном колите существенно ниже у курящих, с чем у некурящих [12). Результаты исследований in-vivo показали, что никотин оказывает подавляющее действие на функцию Т-хелперов-2 (Th-2), которые преобладают при язвенном колите, однако, никотин не действует на клетки Th-1[13].
Описания отдельных случаев, наблюдения в динамике и эпидемиологические исследования показывают, что нестероидные противовоспалительные препараты могут спровоцировать обострение язвенного колита и даже иногда вызывать болезнь de novo [14]. В качестве возможных механизмов называются: понижение выработки простагландина, защищающего слизистую, и стимуляция способности лейкоцитов к прикреплению и к миграции. Хотя поначалу такие эффекты объясняли ингибированием цикло-оксигеназы-1 (СОХ-1), но селективные ингибиторы СОХ-2 в этом отношении не менее активны, чем индометацин [15]. Результаты популяционного американского исследования с контрольной группой показали, что применение контрацептивов, приходящееся на 6 месяцев до начала язвенного колита, несло с собой двукратное увеличение риска этого заболевания [16], но длительное применение этих препаратов оказалось несвязанным с повышенным риском, кроме того, в итальянском контролируемом исследовании с большей выборкой было показано, что оральные контрацептивы не являются существенным фактором риска [17].
Психологический стресс часто упоминается как потенциальный триггер язвенного колита (доля таких больных достигает 40%) 118]. Получено достаточно много данных, свидетельствующих в пользу связи психологического стресса с повышенной заболеваемостью, и, возможно, с большей подверженностью инфекциям, которая обусловлена нарушением функциональных иммунных реакций [19]. Было показано, что стресс запускает рецидивы колита у животных, вероятно, посредством уменьшения количества муцина толстой кишки и повышения проницаемости кишечника [20]. Продолжительность стресса также может быть важной, ведь есть сведения, что риск обострении болезни повышается за счет долговременного, но не за счет кратковременного стресса [21]. Эти данные находят параллели в наблюдениях над особой разновидностью приматов тамаринов, у которых колит развивается спонтанно только в условиях длительной неволи [22]. Кроме того, сообщалось о двух видах больных: чувствительных к стрессу и стресс-нейтральных, причем у больных, чувствительных к стрессу, отсутствовали околоядерные антинейрофильные цитоплазмати-ческие антитела (pANCA) [23].
Повышенный риск болезни, как сообщалось, связан с перенесением многих детских инфекций и с искусственным «скармливанием [17, 24). Аппендэктомия в молодом возрасте оказывала самый сильный профилактический эффект в отношении развития язвенного колита [25]. Это наблюдение было подтверждено в исследованиях с группами контроля [26], и очень масштабное популяционное исследование недавно вновь показало обратную зависимость между аппендэктомией и язвенным колитом у больных, которым операция проведена в возрасте до 20 лет [27]. У мышей, лишенных Т-клеточных рецепторов-ос, после удаления цекального сегмента в месячном возрасте [28] наблюдалось подавление развития колита, что указывает на иммунологическую роль аппендикса, либо на то, что находящийся в аппендиксе потенциальный возбудитель инфекции или связанный с этим возбудителем антиген играют роль в патогенезе язвенного колита. В популяционном исследовании [27] риск язвенного колита сокращался только у больных, которые перенесли аппендэктомию по поводу аппендицита или мезентериального лимфаденита, а не у тех, кому аппендикс удален случайно или но поводу неспецифической абдоминальной боли. Такой результат показывает, что, скорее всего, не сама аппендэктомия, а приводящий к аппендэктомии воспалительный процесс в молодом возрасте защищает от последующего развития язвенного колита, и, вопреки некоторым авторам [29], сама аппендэктомия имеет ограниченную профилактическую или лечебную роль. Другое возможное объяснение данной обратной закономерности заключается в том, что генетическая предрасположенность к язвенному колиту, вероятно, защищает от развития аппендицита.
Микробные факторы
Наибольшее число свидетельств о связи микрофлоры толстой кишки с патогенезом язвенного колита накоплено при наблюдениях за животными, подвергнутыми генной инженерии и живущими в искусственной среде, в которой отсутствуют специфические возбудители. У этих животных развивается язвенный колит, если они входят в контакт с непатогенной бактериальной микрофлорой, характерной для толстой кишки, причем эта болезнь не развивается в стерильной среде, лишенной микробов. Более того, экспериментальный колит ослабевает, если животных лечат антибиотиками широкого спектра действия [З].
Защитная иммунная реакция против инвазивиых кишечных микробов-возбудителей является физиологически обязательной, и, в то же время, иммунная система слизистой имеет деликатную задачу сосуществовать с многочисленными представителями комменсальной бактериальной флоры (в каждом грамме фекалий в толстой кишке содержится 1012 бактерий, которые являются представителями 400 разных видов с преобладанием анаэробов). Картина осложняется тем, что некоторые микробы-комменсалы могут стать патогенными и подходящих условиях, и распространенность такого балансирования видна па примере сходства протеинов безвредного комменсала Escherichia coli 11 происходящих от неё патогенных микробов. Burke и Ахоn [30] обнаружили у больных язвенным колитом особые штаммы Е. coli, прикрепляющиеся к слизистой толстой кишки, но это наблюдение не было подтверждено другими авторами [311. При язвенном колите имеются специфические нарушения барьерной функции слизистой [32, 33]. Кроме того, развитие колита у мышей при дефиците кишечного фактора «трилистника» показывает важность местно-продуцируемых факторов роста для поддержания гомеостаза слизистой [34]. Остаётся неясным, предшествует ли нарушение кишечного барьера воспалению слизистой кишки у лиц, предрасположенных к язвенному колиту.
Давнее представление о язвенном колите как об аутоиммунном заболевании [35] в последнее время получило новое развитие благодаря сведениям, что комменсальная микрофлора и продукты ее жизнедеятельности служат в качестве аутоантигенов [36], и что язвенный колит развивается за счет потери толерантности к веществам нормальной кишечной флоры, которые обычно безвредны [37]. К наиболее воспроизводимым доказательствам неэпителиального аутоиммунитета при язвенном колите относятся: высокая частота (около 70%) обнаружения pANCA при язвенном колите [38] и ещё более высокая частота распространения pANCA среди больных со слерозирующим холангитом [39], с рефрактерным левосторонним язвенным колитом [40], а также развитие хронического воспаления сумки-калосборника после наложения тонкокишечно-сумочного анастомоза [41]. Не столь доказательно мнение о том, что pANCA является маркером генетической подверженности язвенному колиту [42]. В независимом подтверждении [45] нуждаются и данные, согласно которым эпителиальный иммунитет развивается через посредство антигена 40 kd (тропомиозин), изолированного из сыворотки и слизистой толстой кишки при язвенном колите [431. Этот антиген даёт перекрестные реакции в эпителии кожи, желчных протоков, суставов и глаз [44]. Подобные аутоиммунные белки, несомненно, встречаются при язвенном колите более часто, чем при болезни Крона, но не доказано, что эти белки обладают тканеповреждающими свойствами. Более вероятно, что они являются маркерами первичной иммунной дизрегуляции, либо имеют свойство перекрестного реагирования с факторами микросреды, в том числе - с комменсальными толстокишечными бактериями. Например, сходство между молекулой тропомиозина и бактериальными белками может объяснить предполагаемую реакцию организма на аутоантиген 40 kd [46]. Синтез человеческих моноклональных антител к антигену pANCA помог выявить перекрестно реагирующие антигены, среди которых: цитоплазматический антиген тучных клеток, находящихся в слизистой толстой кишки [47J, глазные антигены цилиарного тела и клеток ганглиев сетчатки [48], и, что более существенно, белки бактерий-комменсалов, таких как Bacteroides сассае и Е. coli [49 J. Итак, белки толсто-кишечных бактерий являются мишенями генетически обусловленной иммунной реакции со стороны организма-хозяина, пораженного язвенным колитом, при котором образуется pANCA. Данная роль бактериальных белков как мишеней обосновывает тот факт, что pANCA является маркером особой группы лиц, страдающих болезнью Крона, у которых патологические изменения ограничены толстой кишкой [50].
Генетические факторы
Хотя язвенный колит с высокой частотой встречается в некоторых семьях [51], и более распространен среди евреев, чем среди неевреев [52], но при болезни Крона [53], по сравнению с язвенным колитом, выше заболеваемость в семьях, уровень конкордантности для монозиготных близнецов [4, 5] и уровень конкордантности у следующего поколения по форме заболевания. Однако, при язвенном колите, по сравнению с болезню Крона, отмечается более существенная связь с генами пула лейкоцитарных антигенов, регулирующими иммунный отпет [54]. Даже при поправках на этническое происхождение и на гетерогенность болезни, данная снизь проявляется как наиболее сильная среди больных с распространенным язвенным колитом. Сообщалось о положительной связи с DR2 (в особенности с подтипом DRB1*1502) и с редкими аллелями DRB1*0103 и DRB1*12, в то же время отмечалась отрицательная связь с DR4 и DRw6 [2, 54]. И, псе же, гены, обусловливающие подверженность к язвенному колиту, очевидно, лежат за пределами зоны лейкоцитарных антигенов человека, и исследования с обзором всего генома показали связь между язвенным колитом и регионами III, VII и XII хромосом [55J.
Хотя язвенный колит и болезнь Крона имеют некоторые сходные гены подверженности, но, очевидно, разные гены определяют тяжесть этих болезней [54, 56], широту распространенности патологических изменений [57], чувствительность к стероидам [40, 58 J. потребность в стероидах [56] и внекишечные проявления [59J. Хотя нет данных, что полиморфизм антагониста рецензоров интерлейкина-1 и фактора некроза опухолей а являются факторами сильного риска в плане общей подверженности язвенному колиту, но полиморфизм антагониста рецепторов интрелейкина-1 может влиять на тяжесть и распространенность этого заболевания, особенно у лиц, позитивных на pANCA [60]. При молекулярном генотипировании получены предварительные данные, что врожденный полиморфизм по MUCU, то есть, по гену, который кодирует кишечные муцины, также может быть связан с патогенезом язвенного колита [61].
Иммунные факторы
При язвенном колите растет популяция В-лимфоцитов и плазмоцитов. Раньше это рассматривалось как доказательство гипотезы, согласно которой развитие язвенного колита зависит от антител и комплемента [62]. Однако, в настоящее время самым важным нарушением и движущей силой воспаления считается чрезмерная реакция со стороны Т-лимфоцитов, определяющая гиперреакцию слизистой на бактерии-комменсалы [63]. В-клеточная реакция и повышенное образование IgIG и аутоантител представляют собой вторичную - защитную реакцию, призванную очистить пораженный орган от клеток, подвергшихся апоптозу [64].Т-лимфоциты типа CD4+ из периферической крови и из собственной пластинки перекрестие реагируют с естественной флорой (бактероидами, бифидобактериями и различными энтеробактериями) у больных при язвенном колите и при болезни Крона. Следовательно, в патогенезе колита важны патологические иммунные специфические реакции со стороны Т-лимфоцитов на флору организма-хозяина [65]. По сравнению с циркулирующими Т-лимфоцитами, Т-лимфоциты собственной пластинки легче подвергаются апоптозу при посредстве Fas [66], то есть физиологическому процессу отмирания клеток, который, если изменить его темп, может способствовать воспалению. Кстати, при активном язвенном колите (но не при болезни Крона) Fas-лиганд (FasL) в больших количествах экспрессируется Т-клетками. Поэтому есть основание предполагать, что апоптоз, индуцированный Fas-Fasl, принимает участие и повреждении слизистой при язвенном колите [67).
Хотя роль цитокинов при язвенном колите не столь изучена, как при болезни Крона, но есть данные, что при уже развившемся колите, происходит модифицированная реакция Т-2-лимфоцитов, для которой характерно накопление таких цитокинов, как интерлейкин-5 и интерлейкин-10, но не интерлейкина-4 168]. Наоборот, в работах, изучавших цитокины слизистой и модель с двойным выключением в геноме мышей, подчеркивается важность интерлейкина-4 как ключевого фактора в патогенезе активного колита [69, 70]. Результаты исследований мышей с выключениями в геноме также показали, что иммунорегуляторные цитокины, интерлейкин-10 и фактор роста опухолей в, образуемые, соответственно, в Т-лимфоцитах CD4+, в Т-регуляторных клетках 1-го типа (Тг-1) и в Th-3, играют ведущую роль в формировании толерантности к внутрипросветным антигенам [71, 72]. Более того, приём антигена внутрь может вызвать толерантность и разрешение колита посредством стимуляции Th-3-регуляторных клеток, специфических в отношении данного антигена, при этом сдвигается баланс между регуляторными и эффекторными Т-клетками [73], что имеет важные последствия для лечения, и может объяснять эффекты пробиотиков в клинических исследованиях.
Достижения в лечении
Хотя достигнуто общее улучшение результатов лечения язвенного колита, но до сих пор не предложено инновационной терапии, которая бы радикально изменила принципы лечения этой болезни. Самые лучшие результаты лечения все больше опираются на доказательность и все больше разделяются на индукционное и поддерживающее лечение. Лечение язвенного колита в последнее время подробно описывалось в обзорах [1, 74, 75], поэтому мы ограничимся усовершенствованиями существующих методов лечения и новыми действующими началами.
Методы, прочно вошедшие в практику
Аминосалицилаты являются основой для индукции ремиссии при язвенном колите легкой или средней степени тяжести, а также для поддержания ремиссии [76, 77]. Накапливающиеся данные контролируемых исследований и мета-анализов постоянно подтверждают ранее установленную зависимость «доза-эффект» для этих препаратов. Было показано, что топическое применение мезалазина (inesalazine) превосходит по своему эффекту оральный приём мезалазина и тоническую аппликацию кортикостероидов у больных с дистальным язвенным колитом [76]. В то же время, есть данные, что сочетание оральных и топических 5-аминосалицилатов более эффективно, чем каждая из этих форм в отдельности для индукционной терапии [78] и для поддерживающего лечения [79] дистальной формы заболевания легком и средней степени тяжести. Следовательно, всем больным необходимо назначать максимально переносимые дозы аминосалицилатов (в том числе, с комбинированием форм лекарства при заболевании дистального типа) - в течение, по меньшей мере, 4-6 недель, и только потом следует рассмотреть вопрос о топическом или парэнтеральном применении кортикостероидов.
Изучены эффекты будесонида (budesonide) при язвенном колите. Будесонид представляет собой мощный кортикостероид, системная активность которого мала, так как при всасывании он непосредственно поступает в печень, где метаболизируется. Контролируемые исследования показали, что клизмы с этим препаратом эффективны в индуцировании ремиссии дистального язвенного колита [80], и что оральная форма с контролируемым высвобождением так же эффективна, как преднизолон при лечении активного дисталыюго и распространенного колита, но в отличие от преднизолона, не вызывает-столь выраженного эндогенного подавления кортизола [81]. Хотя первоначальное контролируемое исследование продемонстрировало существенное превосходство клизм с будесонидом над ретенционными преднизолоновыми клизмами при активном дистальном колите [82], но последующие многоцентровые исследования показали сходную эффективность у будесонида и преднизолона в клизмах [83], а также у будесонида и мезалазипа в клизмах [84].
У многих больных с язвенным колитом аминосалицилаты и кортикостероиды оказываются неэффективными, что не зависит от степени распространенности заболевания. Результаты популяциоппого исследования показали, что 16% больных резистентны к стероидам, и спустя 1 год после назначения кортикостероидов только 48% больных язвенным колитом уже прекратили принимать эти препараты и избежали операцию, 22% были зависимы от стероидов, а 29% больным потребовалась операция [85]. Долговременная польза (в виде поддержания ремиссии и снятия необходимости в стероидах) от применения азатиоприна и 6-меркаптопурина [75, 86, 87] значительно перевешивает возможный риск [88]. Фармакогенетические исследования показали, что дозы азатиоприна и 6-меркаптопурина могут определяться по индивидуальным особенностям генотипа [89]. Однако, необходимо проведение проспективных исследований для определения оптимальных доз этих лекарств и терапевтического диапазона активного метаболита 6-тиогуанина, а также стоимости скрининга, при котором можно определять активность тиопурин-метилтрансферазы (латинское сокращение: ТРМР). Контролируемые исследования показали, что, в отличие от ситуации при болезни Крона, при язвенном колите метотрексат не эффективен в качестве индукционного и поддерживающего лечения больных, у которых нельзя применять стероиды [90]. Мофетил микофенолата (Mycophenolate mofetil) является мощным ингибитором инозин-монофосфат-дегидрогеназы и биосинтеза пуринов в лимфоцитах [91]. Этот препарат сравнивался с азатиоприном в небольшом немаскированном исследовании, проведенном в Германии [92]. Получены данные, говорящие в пользу того, что у больных со стероид-зависимым язвенным колитом замена стероидов на азатиоприн более безопасна и более эффективна, чем переход к микофенолату [92J.
Данные контролируемых исследований показывают, что внутривенное введение циклоспорина в высокой дозе (4 мг/кг) вызывает ремиссию у 60-80% больных с тяжелым язвенным колитом [93-95]. Хотя большинство побочных эффектов выражены слабо, и с ними можно справиться небольшой корректировкой дозы, но частота тяжелых и иногда смертельных оппортунистических инфекций [96-98], особенно пневмонии, вызываемой Pneumocystis carinii, достаточно высока. Отсюда -законные опасения и ограничения в использовании данного препарата. Циклоспорин следует применять только в специализированном учреждении третьего уровня, где накоплен соответствующий опыт, и где есть возможность рутинно определять концентрацию в крови. При язвенном колите циклоспорин и стероиды применяются в дозах того же порядка, что и при трансплантации органов. Следовательно, если циклоспорин в высоких дозах комбинируется с другими иммуномодуляторами, включая стероиды, необходимо рассмотреть вопрос о профилактике инфекции P.carinii клотримазолом [98]. Результаты исследований показывают, что применение более низких доз циклоспорина (2 мг/кг) [99] или Монотерапии циклоспорином [100] могут быть эффективными при тяжелом язвенном колите и при этом довольно безопасны. Долговременные исследования больных тяжелым язвенным колитом показывают, что, по прошествии 3-5 лет за счет лечения циклоспорином 53-62% больным удается избежать колэктомию [101, 102]. Добавление азатиоприна или 6-меркаптопурина к схемам лечения рекомендуется у всех больных, у которых отмечается эффект от циклоспорина, так как у больных, переходящих на хронический прием препаратов, эти лекарства позволяют предотвратить определенное число колэктомий [102]. У больного, принимающего эти лекарства, качество жизни страдает не так сильно, как после колэктомий [103]. Применение циклоспорина per os принесло разочаровывающие результаты, но данные немаскированных исследований показывают, что у ряда больных циклоспорин в форме микроэмульсии (Neoral), для которой характерно лучшее всасывание при приеме внутрь, может представлять экономически эффективный способ поддерживающего лечения [104, 105]. Предварительные сообщения о пользе циклоспориновых клизм при активном дистальном язвенном колите не подтверждены в плацебо-контролируемых работах [106].
Новые методы
Хотя проктколэктомия стала стандартным подходом при рефрактерности язвенного колита к стероидам, риск хронического воспаления сумки-калосборника стимулировал интерес к попыткам спасти сегменты толстой кишки, особенно у больных с рефракторным проктосигмоидитом или с левосторонним заболеванием. Пробиотики представляются наиболее многообещающими из ряда экспериментальных и традиционных средств, изученных в контролируемых клинических испытаниях.
Можно только удивляться тому, что, несмотря на обилие информации, указывающей на роль микробных факторов в развитии язвенного колита, имеется мало убедительных данных об эффективности антибиотиков при этом заболевании, за исключением воспаления собирательного мешка [107]. Сообщалось, что ципрофлоксацин полезен для индукции и поддержания ремиссии у больных с умеренным или тяжелым язвенным колитом, рефракторным к традиционным методам лечения [108], однако, в том исследовании в группе ципрофлоксацина имелся избыток курильщиков, и определение рефракторной болезни базировалось не на чувствительности к лечению, а на оценке местного врача, что привело к включению в эту категорию больных, которым до присоединения их к выборке проводилось недостаточное лечение. Небольшое итальянское плацебо-контролируемое исследование [109] показало, что дополнительная терапия рифаксимином (неабсорбируемым антибиотиком группы рифамицина) не давала существенных преимуществ, в сравнении с плацебо, по уменьшению активности болезни и по доле больных, у которых удалось избежать применения стероидов при умеренном и тяжелом язвенном колите, рефрактерном к стероидам. Накапливаются данные по решающей роли кишечной флоры в патогенезе язвенного колита, и, соответственно, растет интерес к благоприятным эффектам, которые, вероятно, можно добиться, манипулируя нормальной кишечной флорой с помощью пробиотиков [110]. Пробиотики -это живые микроорганизмы, которые благотворно действуют на здоровье через изменение состава микробной флоры. К возможным механизмам действия относятся: выработка антимикробных веществ, конкурентное взаимодействие с возбудителями, восстановление равновесия в микробной флоре кишки, запуск противовоспалительных реакций в эпителии кишечника и в иммунном аппарате слизистой [73, 110]. Два рандомизированных контролируемых исследования показали, что капсулы, растворяющиеся в кишечнике, которые содержат непатогенные Е. coli (Nissle, 1917) столь же эффективны, как мезалазин (mesalazine) в поддержании ремиссии язвенного колита [111, 112]. Venturi с соавторы сообщили [113], что курс пробиотического лечения продолжительностью 1 год (заключающийся в ежедневном приеме препарата, содержащего - в каждом грамме - 5х1011 клеток, а именно бифидобактерии, лактобациллы и Streptococcus thermophilus) хорошо переносился и помог поддержать ремиссию у 15 из 20 больных язвенным колитом. Venturi с соавт. также сообщили о высокой эффективности этого курса для поддержания ремиссии хронического воспаления калосборной сумки. Приведенные примеры вселяют оптимизм, особенно если рассматривать их в свете других достижений пробиотической терапии [115]. Следовательно, пробиотическая терапия способна играть важную роль в поддерживающем лечении больных с легкой и средней степенью колита. Эффективность пробиотиков при активном или стероид-зависимом колите неизвестна.
В ранних, плацебо-контролируемых исследованиях было показано, что эйкосапентаеноевая кислота (eicosapentaenoic acid) - активный ингредиент препаратов рыбьего жира и мощный ингибитор синтеза лейкотриена и иммунной реактивности является эффективным методом лечения колита легкой и умеренной степени [116, 117]. Однако, нет свидетельств, что рыбий жир эффективен в качестве поддерживающей терапии [118], к тому же соблюдение рекомендаций затруднено из-за большого числа капсул, которое приходится ежедневно принимать; дополнительную проблему представляет запах рыбы, который примешивается к дыханию. Было показано, что у больных с легкой и средней степенью активного колита сульфасалазин даёт лучший эффект, по сравнению с жирной кислотой омега-3 рыбьего жира [119].
Накожные наклейки никотина могут поставить под контроль активный язвенный колит легкой и средней степени [120, 121]. Однако, их эффективность оказывается меньшей, чем у средних доз кортикостероидов [122], и такие наклейки не поддерживают ремиссию [123]. В некоторых исследованиях, носивших предварительный характер, оценивалась эффективность разных лекарственных форм никотина, в том числе, оральных капсул с рН-зависимым высвобождением, а также клизм [124], которые, направляя никотин на метаболизм первой линии в печени, тем самым могут предотвратить те побочные эффекты никотина, которые характерны для его трансдермальной формы и особенно сильны у некурящих. Следовательно, с клизмами и рН-зависимыми капсулами можно вводить более высокие дозы.
Имеются данные, что дистальные колоноциты сильно зависят от находящихся в просвете кишки жирных кислот с короткими цепочками (short chain fatty acids - SCFA), которые образуются в бактериях, и особенно это относится к бутирату. Следовательно, язвенный колит может возникать от голодания колоноцитов, вызванного нарушенным метаболизмом SCFA. Наблюдения, свидетельствующие об эффективности клизм с бутиратом при колите вы
ведения, стимулировала клинические испытания у больных дистальным язвенным колитом. Хотя в одном контролируемом исследовании не выявлено эффективности 60-миллилитровой клизмы с бутиратом по одному разу в ночное время [125], но в другом исследовании продемонстрировано, что длительное лечение приводило к существенному улучшению, если судить по фискальному обследованию и эндоскопии [126]. К сожалению, практическое применение клизмы с бутиратом ограничено из-за её неприятного запаха, и поэтому изучаются оральные формы SCFA в виде капсул с чувствительностью к рН. Семена растения Plantago ovata (применяемые для получения пищевой клетчатки) перерабатываются бактериями кишечника с образованием довольно большого количества фекального бутирата. Эти семена хорошо переносятся и имеют ту же способность к поддержанию ремиссии при язвенном колите, что и мезалазин [127].
В 1990-х годах накапливались доказательства терапевтической роли нефракционированного гепарина. К возможным механизмам действия относятся:
антикоагулянтные эффекты, противовоспалительное действие посредством подавления рекрутирования нейтрофилов и сокращения продукции провоспалительных цитокинов или активных метаболитов кислорода, стимуляция заживления изъязвлений кишечника посредством связывания с фактором роста фибробластов [12Н, 129]. В одном неконтролируемом исследовании 75% больных, поступивших на лечение по поводу тяжелого стероид-резистентного язвенного колита, вошли в ремиссию в течение 1-й недели внутривенного применения гепарина как дополнительного вида лечения, при этом не произошло увеличения трансанального выделения крови [130]. В мультцентровом рандомизированном исследовании больных со среднетяжелым или с тяжелым язвенным колитом обнаружено, что монотерапия гепарином (в дозе, увеличивающей частичное тромбопластиновое время в 1,5-2 раза, по сравнению с контролем) оказалась неэффективной, в сравнении с метилпреднизолоном, и она сопровождалась дополнительной кровопотерей [131]. Впрочем, в другом рандомизированном исследовании, в ходе которого все больные получали аминосалицилаты, было показано, что при тяжелом язвенном колите гепарин был столь же эффективен, как внутривенное введение кортикостероидов, и хорошо переносился [132]. Роль, которую должен играть гепарин, остается неясной. Гепарин мог бы применяться как дополнительная методика при кратковременном лечении рефракторных больных, при этом гепарин мог бы играть роль «моста» для перехода к другому иммуносупрессивному препарату. Необходимы данные долговременного наблюдения, чтобы прояснить исходы и особенности лечения больных, у которых выявляется положительная динамика в ответ на гепарин.
Такролимус (Tacrolimus) (FK506) - это макролидный лактон, ингибирующий Т-клеточные реакции через связывание иммуноглобулинов и через подавление фосфорилирования кальциневрина. Первоначально такролимус был разработан для применения в трансплантологии и при аутоиммунных болезнях, кроме того, он был изучен на предмет возможной активности при язвенном колите. По сравнению с циклоспорином, такролимус имеет тот же профиль иммуносупрессивных свойств и побочных эффектов, однако он лучше всасывается при приеме внутрь. В самом крупном исследовании такролимуса [133J 14-ти больным стероид-резистентным язвенным колитом сначала, в течение 1 недели, внутривенно вводился такролимус в дозе 0,01-0,02 мг/кг в день, а затем они переходили на ежедневный приём препарата внутрь. У 10 из этих 14 больных по прошествии 14 дней от начала лечения наблюдалось улучшение. 7 больных с тяжелым язвенным колитом получали такролимус per os, и у 5 из них отмечалась немедленная положительная реакция. Ввиду наличия у такролимуса серьезных побочных эффектов, необходимы контролируемые исследования, и только затем можно ставить вопрос о введении его в рутинную практику.
К несчастью, имеется очень мало данных по роли биологических методов лечения при язвенном колите. Широкомасштабное мультицентровое исследование по оценке инфликсимаба (infliximab) при язвенном колите находится на стадии, предшествующей формированию выборки. Впрочем, в одном немаскированном исследовании недавно было обнаружено, что у 16 из 17 больных тяжелым язвенным колитом отмечалась положительная динамика в ответ на инфликсимаб [134], а в ходе двойного маскированного плацебо-контролируемого пилотного исследования констатировано, что у 4 из 8 больных со стероид-рефрактерным язвенным колитом лечение данным препаратом было успешным [135]. Опубликованы результаты немаскированного исследования, согласно которым, редукция симптоматики достигнута у 10 из 15 больных, получавших CDP571 (антитело к человеческому фактору некроза опухолей) [136]. Хотя фактор некроза опухолей при болезни Крона играет более активную роль, но и при язвенном колите этот фактор обнаруживается в повышенных концентрациях - в сыворотке и в слизистой толстой кишки, кроме того, концентрация растворимых рецепторов к этому фактору тесно коррелирует с активностью процесса при язвенном колите [137].
Риск колоректального рака
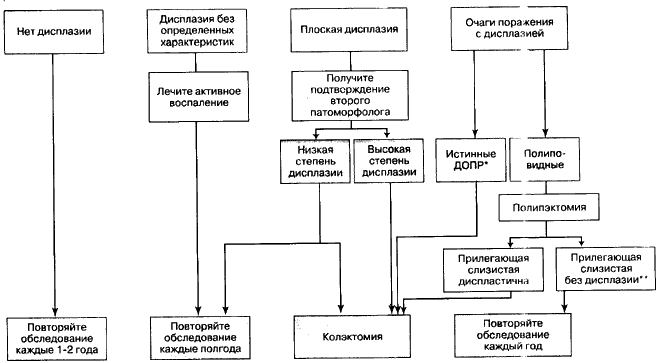
Больные язвенным колитом имеют повышенный риск возникновения колоректального рака, по сравнению общей популяцией. Этот риск зависит от распространенности и длительности болезни, но ire от её активности (даже тлеющее заболевание сопряжено с риском, который тем выше, чем длиннее анамнез). Ekbom с соавторами [138] рассчитали стандартизированное относительное увеличение риска развития колоректального рака среди больных язвенным колитом: при проктите оно составило 1,7, при распространении болезни за пределы прямой кишки, но не выше печеночного угла - 2,8, а при болезни, распространяющейся дальше - 14,8. К независимым факторам риска в отношении развития колоректального рака также причислены: наличие колоректального рака в семейном анамнезе [139], наличие в настоящее время первичного склерозирующего холангита [140] или илеита ретроградного заброса [141]. Защищающими от рака оказались следующие факторы: продолжение поддерживающего лечения 5-аминосалицилатом [142] и сульфасалазином [143] (вероятно, такая связь осуществляется посредством ингибирования СОХ-2, то есть благодаря прямому противораковому эффекту [144]), курение [143], а также, возможно, пищевые добавки с фолиевой кислотой [145] и витамином Е. В одном контролируемом исследовании [142] больные, страдавшие сочетанием язвенного колита и колоректального рака, сравнивались с группой контроля, соответствующей первой группе по всем показателям, кроме наличия колоректального рака; при этом у лиц, регулярно получавших 5-аминосалицилаты, обнаружено 75%-ное снижение риска рака. Существенное снижение риска отмечалось даже при малой дозе мезалазина (mesalazine) (1,2 грамма в день), но не при малой дозе сульфасалазина [142]. В отличие от спорадического колоректального рака, колоректальный рак, возникающий на фоне язвенного колита, примерно с одинаковой вероятностью поражает разные сегменты толстой кишки, чаще имеет мультицентрический рост, а также более высокую степень злокачественности на момент постановки диагноза [146]. Признано, что при язвенном колите раку предшествует дисплазия, и это служит обоснованием регулярных обследований с применением колоноскопии, однако, до сих пор ведутся споры о пользе подобного скрининга, надежности получаемых данных и о стоимости [147, 148]. Западные и японские патоморфологи недавно приняли более стандартизированную классификацию гастроинтестинальной эпителиальной неоплазии [149], но между эксиертами-патоморфологами сохраняются разногласия по различению дисплазии низкой степени и дисплазии без определенных характеристик. Ещё предстоит провести рандомизированные контролируемые исследования для оценки эффективности регулярного обследования, к тому же, до сих пор не определены показания для колэктомии [150]. Впрочем, имеется согласие насчет того, что в программы регулярных обследований должны включаться больные с распространенным язвенным колитом, длящимся 7-8 лет, и с левосторонним колитом продолжительностью 15 лет, - это отражено в существующих рекомендациях. Однако, несмотря па этот принцип и на положения рекомендаций [151], клиницисты придерживаются разных мнении. Только 24% из общего числа гастроэнтерологов, которые ответили на вопросы Всебританской массовой проверки, проводили скрининг больным с левосторонним колитом, только 2% брали более 20 образцов ткани при биопсии (а необходимо, по меньшей мере, 33 образца, чтобы с 90%-ной вероятностью выявить дисплазию), и только 53% рекомендовали колэктомию больным с сильно выраженной дисплазией [152]. В двух исследованиях было показано, что аденома-подобные диспластические образования
или опухоли у больных хроническим колитом, независимо от локализации, можно лечить полипэктомией но таким же показаниям, как у больных, не страдающих колитом, а после операции обследование можно проводить 1 раз в год с помощью колоноскопии; данный подход не рекомендуется при наличии дисплазии в прилегающей ровной слизистой
или в других локусах биопсии [153, 154]. На рис. 1 представлена стратегия наблюдения в динамике, основанная на накопленных знаниях и на предложенных рекомендациях.
Техника обследования
Кандидаты
Рис. 1. Стратегия регулярных обследований при хроническом язвенном колите для выявления колоректального рака.
* Диспластичный очаг поражения или разрастание (ДОПР = DALM), который не выглядит как аденома, то есть патологическое разрастание слизистой, циркулярное или секторное сужение, либо опухоль на широком основании;
** Диспластические полипы можно без какого-либо опасения лечить эндоскопически. при условии, если прилегающая слизистая не диспластична [153. 154].
Полная библиография к статье находится в редакции журнала
ЯЗВЕННЫЙ КОЛИТ
Колоноскопия до уровня слепой кишки: по меньшей мере, 33 биопсий в случайных локусах,
либо 4-квадрантные биопсии через каждые 10 см (максимально возможное общее число образцов);
удаление всех диспластичных очагов поражения или разрастании (ДОПР), если позволяет техника
Распространенный язвенный колит в течение >8 лет
Левосторонний колит в течение > 15 лет
Проктит: рекомендации совпадают с принципами скрининга для всего населения
Первичный склерозирующий холангит: скрининг начинать сразу после установки этого диагноза
Ряды малых окон (сверху вниз, в пределах каждого ряда - слева направо):
Апрель 2003 г.