поговорим о выборе Свадебного платья. |
Опубликовано в журнале:
Неврология
Резюме
С целью определения функционального состояния афферентных путей спинного мозга (АПСМ) и пирамидного тракта у больных миастенией были исследованы 26 больных прогрессирующей формой миастении в возрасте от 12 лет до 57. Группу контроля составили 24 неврологически здоровых пациента в возрасте от 17 до 28 лет. Проведенные исследования показали, что у больных миастенией наблюдалось поражение преимущественно АПСМ. Таким образом, при миастении происходит нарушение не только двигательной (эфферентной) системы, но и чувствительной (афферентной).
Введение
Миастения является наиболее распространённой из синаптических болезней человека [2]. "Тяжёлая миастения (myasthenia gravis) является заболеванием, а, точнее, набором болезней, при котором нервно-мышечные синапсы оказываются местом приложения аутоиммунных процессов. Повреждаются постсинаптические мембраны и, в первую очередь, ацетилхолиновые рецепторы" - пишет [8]. Важность современной диагностики для раннего применения патогенетически обоснованного лечения, а также значительная частота ошибочных диагнозов [б], определяют необходимость разработки и систематизированного обобщения принципов клинической и пара-клинической диагностики.
Миастения - заболевание редкое, но не исключено, что оно встречается чаще, чем можно было бы думать, исходя из официальных данных о его распространённости (0,5-5 на 100 000 населения), так как на одного выявленного больного приходятся два недиагностированньк случая заболевания [6,7]. В последнее время интерес к миастении возрос и, возможно, в результате этого возросло число диагностированных случаев [6].
Симптомы у больных миастенией являются следствием слабости (часто непостоянной) поперечнополосатых мышц. В основу выделения клинических форм миастении положен принцип оценки работоспособности и выраженности в различных группах мышц патологической мышечной утомляемости. По характеру течения миастенического процесса выделяют миастенические эпизоды, миастенические состояния, прогрессирующую и злокачественную форму миастении [2]. По степени генерализации двигательных расстройств выделяют следующие формы миастении; 1) генерализованную, 2) локальную;
по тяжести двигательных расстройств выделяют степени: 1) лёгкую, 2) средней тяжести, 3) тяжёлую [2,4]. По интенсивности восстановления двигательных функций после введения оптимальной для данного больного дозы прозерина выделяют полную, неполную и плохую степень компенсации [2].
В настоящее время новый нейрофизиологический метод магнитной стимуляции (МС) нашел широкое применение в клинической практике при исследовании проведения возбуждения по пирамидному тракту при различных формах поражений центральной нервной системы [1-3,12-15].
Цель настоящего исследования - изучить функциональное состояние афферентных путей спинного мозга (АПСМ) и пирамидного тракта у больных миастенией.
Материалы и методы
В исследование были включены 26 больных прогрессирующей формой миастении в возрасте от 12 до 57 лет и 24 неврологически здоровых лиц в возрасте от 17 до 28 лет. В группе больных 21 пациент - с генерализованной формой миастении, лёгкой и средней тяжести, с неполной компенсацией при введении антихолинэстеразных препаратов и 5 больных локальной (глазной) формой миастении, лёгкой и средней тяжести, с неполной компенсацией при введении антихолинэстеразных препаратов. Развитие заболевания наблюдалось у больных в течение 5-18 лет.
По степени выраженности заболевания у исследованных больных преобладали лёгкая и средняя тяжесть заболевания. Лёгкая степень тяжести характеризовалась незначительным нарушением приспособительной активности, которая постоянно проявлялась в обычных ситуациях и усиливалась при повышенных требованиях к организму: затруднение при беге и при ходьбе на значительное расстояние, при работе руками, переноске тяжести, громкой речи, длительной фиксации взгляда и др. Больные отмечали мышечное утомление после относительно недолгой напряжённой работы или в конце дня. Средняя степень тяжести миастении характеризовалась умеренным нарушением приспособительной активности, которое возникало в обычных жизненных ситуациях: ограничение при передвижении на расстояния, ранее легко преодолеваемые пешеходом, ограниченное восприятие окружающего мира и общения с окружающими за счёт умеренных речевых и глазодвигательных нарушений, умеренное нарушение глотания и жевания, умеренное нарушение способности к труду и обучению, некоторое ограничение само - и взоимообслуживания при сохранности элементарных видов самообслуживания (одевание, умывание, физиологические отправления и др.). Клинический диагноз подтверждался стационарно в неврологическом отделении Алтайской краевой клинической больницы и городской больницы №5 (г. Барнаул). При обработке материала анализировали случаи миастении, подтвержденные предварительным электромиографическим исследованием декремента амплитуды М-ответа различных мышц [2,3]. При этом было зарегистрировано патологическое снижение нервно-мышечной передачи от 30% до 60%.
Пациентам определяли функциональное состояние АПСМ и пирамидного тракта при помощи метода МС [II].
Функциональное состояние АПСМ оценивали при МС спинного мозга в двух точках: 1) на уровне позвонков CIV-CVII; 2) на уровне позвонков LII-LIV [II]. Активные отводящие электроды, заполненные электродным гелем, располагали на круговой мышце глаза, на верхнем веке, референтные отводящие электроды - на коже лица в проекции скуловой кости симметрично с двух сторон лица. Регистрацию вызванных ответов осуществляли при помощи электромиографа. Полоса пропускания усилителя устанавливалась на 20-2000 Гц.
В результате МС шейного и поясничного отделов спинного мозга регистрировали моторные ответы круговой мышцы глаза (МОКМГ). Анализировали латентность МОКМГ, которую определяли от артефакта раздражения до начала отрицательной фазы МОКМГ. Отношением расстояния между центром катушки при стимуляции в двух точках к разнице латентного периода регистрируемых МОКМГ определяли скорость распространения возбуждения (СРВ) по АПСМ на участке спинного мозга, расположенном между точками стимуляции.
При оценке функционального состояния пирамидного тракта МС осуществляли в 3 точках:
1) в области двигательной коры головного мозга, над теменной областью; 2) над шейным отделом спинного мозга в области позвонков CVI-CVII; 3) над поясничным отделом спинного мозга в области позвонков L4-SI-SII. Регистрирующие поверхностные электроды были установлены в зоне двигательной точки m. abductor pollicis brevis (при исследовании верхних конечностей) и m. abductor hallucis (при исследовании нижних конечностей). Расположение отводящих электродов имеет условное значение. Допустимо использование и других мышц для отведения вызванных ответов, например, m. abductor digiti minimi, m. tibialis anterior, m. extensor digitorum brevis, m. flexor halucis brevis и других.
Исследование разности латентности моторных ответов, возникающих при МС двигательной коры, шейного или поясничного отдела спинного мозга позволяет определять время центрального моторного проведения (ВЦМП) от коры головного мозга до корешков CVI-CVII (ВЦМП-1) и ВЦМП от коры головного мозга до корешков L4-SI-SII (ВЦМП-2). Величины ВЦМП на уровнях кора -шейный сегмент и кора - поясничный сегмент характеризуют состояние пирамидного тракта.
МС осуществляли при помощи магнитного стимулятора Magstim-200 (Magstim Company Limited, Великобритания). Вызванные ответы регистрировали при помощи электромиографа Sapphire 2M (Medelec, Великобритания).
Результаты
СРВ по АПСМ у здоровых пациентов составила в среднем 90,7±1,6 м/с. Все результаты представлены в виде М±m, где М - среднее арифметическое, m - стандартная ошибка. Параметры функционального состояния пирамидного тракта у здоровых: ВЦМП-1 в среднем 8,0±0,3 мс, ВЦМП-2 в среднем 15,8±0,5 мс. Показатели ВЦМП значительно не отличались от аналогичных, полученных другими исследователями [1,3,10].
Больным с выраженной классической картиной миастении осуществляли исследование АПСМ и ВЦМП. Ниже приведено клиническое наблюдение.
Больная С. 31 года при поступлении предъявляла жалобы на появление мышечной слабости, возникающей при передвижении на расстояния, ранее легко преодолеваемые, появления расстройства глотания в виде попёрхивания при еде, снижение фонации при длительном разговоре, появление двоения и птоза при чтении. Мышечная слабость проходила после отдыха, в вечернее время слабости практически не бывает.
Anamnesis morbi. Больной себя считает с 1997 г., когда в возрасте 29 лет после беременности и родов, стала отмечать периодическое двоение в глазах в вечернее время, которое проходило самостоятельно. В связи с рождением ребёнка обследоваться и лечиться не могла. В октябре 1998 г. появилась слабость в мышцах конечностей, с декабря 1998 г. присоединилось нарушение фонации и глотания. Проводилась гормональная терапия. После курса лечения уменьшилась слабость в мышцах, регрессировало нарушение глотания, двоение сохранилось. Больная впервые отметила, что после применения прозерина отмечалось четкое улучшение состояния.
Проведено электромиографическое исследование -патологическое снижение нервно-мышечной передачи от 45% до 53%., МРТ органов средостения - гиперплазия вилочковой железы III стадии.
Соматический статус без патологии.
Неврологический статус: ослаблена конвергенция, диплопия, птоз 1-11 степени, острота зрения не нарушена, ослаблены глоточные рефлексы. Сила мышц в верхних конечностях снижена до 4-5 баллов. Тонус мышц диффузно снижен. Сухожильные и периостальные рефлексы снижены с верхних и нижних конечностей. Патологических знаков нет. Брюшные рефлексы отсутствуют. Все виды чувствительности сохранены. В позе Ромберга устойчива. При зажмуривании до 40 раз - нарастает птоз верхнего века до III степени, усиливается диплопия, появляется ограничение движений глазных яблок при взгляде в стороны. После 7 приседания встаёт с трудом, держась за стул. При громком чтении через 4-5 минут появляется глухой оттенок голоса с дальнейшим затуханием речи. Состояние больной улучшается после отдыха (до 20 минут).
Диагноз: миастения, генерализованная форма, средней степени тяжести, тимогенная (гиперплазия до III степени), первично хроническое, прогредиентное течение, обострение, умеренная реактивность наантихолинэстеразные препараты.
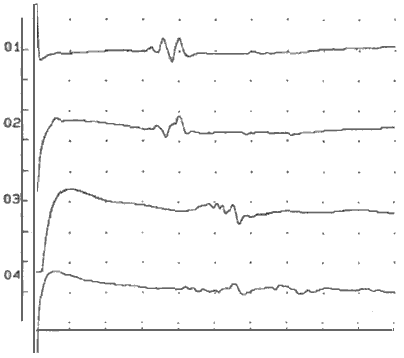
Больной проведено исследование функционального состояния АПСМ. На рисунке 1 представлены МОКМГ при МС шейного и поясничного отделов спинного мозга.
Из рисунка видно, что МС спинного мозга у больной миастенией характеризовалась регистрацией МОКМГ - вызванного ответа в виде группы волн без преобладания положительной или отрицательной фазы потенциала действия. Латентность МОКМГ при МС шейного отдела спинного мозга справа 30,7 мс, слева 32,7 мс, при МС поясничного отдела спинного мозга справа - 42,3 мс, слева - 40,5 мс. Путем отношения расстояния между точками стимуляции (в этом случае -520 мм), к разнице латентных периодов МОКМГ (справа -11,6 мс, слева - 7,8 мс) определяли СРВ на участке спинного мозга между точками стимуляции для каждой стороны. Справа величина СРВ - 44,8 м/с, слева - 66,7 м/с. При сравнении величин СРВ, полученных у больной, с данными, полученными у неврологически здоровых лиц, оказалось, что СРВ была снижена справа на 49,4%, слева - на 73,5%.
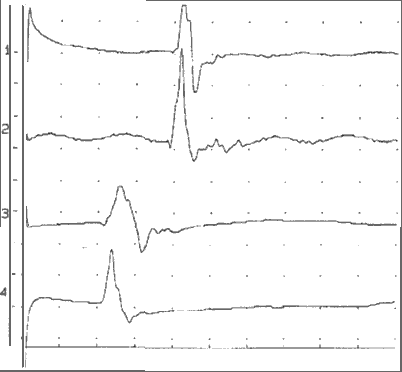
Кроме того, пациентке проведено исследование функционального состояния пирамидного тракта. На рисунке 2 представлен графический результат определения ВЦМП-2.
Из рисунка видно, что латентность моторных ответов при МС двигательной коры составила справа 39,1 мс, слева 38,3 мс; при МС поясничного ответа спинного мозга справа - 22,3 мс, слева - 21,7 мс. Таким образом, ВЦМП-2 справа - 16,8 мс, слева - 16,6 мс. Показатели ВЦМП-2 значимо не отличались от аналогичных, полученных при исследовании группы здоровых и приведенных в литературе [1,2,10].
Для определения количественной характеристики функционального состояния АПСМ у больных миастенией исследовали группу пациентов, состоящую из 26 больных. Изменения показателей МОКМГ при МС спинного мозга были зарегистрированы у 20 больных (76,9%).
Средний показатель СРВ - 56,1±2,6 (различия показателей у здоровых и больных достоверны, р<0,01, где р - достоверность различий с группой здоровых лиц). Необходимо отметить, что из 20 больньк миастенией с зарегистрированными изменениями функционального состояния АПСМ у 17 больных (85,0%) изменения были двухсторонними.
При исследовании функционального состояния пирамидного тракта изменения величин ВЦМП-1 были зарегистрированы у трёх больньк миастенией (11,5%), изменения ВЦМП-2 - у одного больного (3,8%) в сочетании с увеличением ВЦМП-1. Средние величины ВЦМП, характеризующие функциональное состояние пирамидного тракта у остальных 23 больных были удовлетворительными (ВЦМП-1 - 8,2±0,3 мс, ВЦМП-2 -15,7±0,4 мс).
Обсуждение
В настоящее время остаётся еще много неясного и противоречивого в изучении такой важнейшей проблемы миастении, как её патогенез.
Рис. 1. Моторные ответы правой (1,3) и левой (2,4)
круговой мышцы глаза при МС шейного (1,2)
и поясничного отдела (3,4) спинного мозга.
примечание: Ось абсцисс - время, цена деления 10 мс; ось
ординат - амплитуда, цена деления 1мВ.
Особенно это касается выяснения патогенетических механизмов расстройств функций чувствительности при этом заболевании. К настоящему времени известно большое количество данных об электромиографических изменениях при миастеническом нарушении двигательных функций [3,6,9]. Следует отметить, что существуют различные клинические варианты миастении. Однако, для всех случаев миастении общим является своеобразное нарушение двигательной функции, определяемое как миастенический тип расстройств двигательной функции. Основной чертой этой формы нарушения функции двигательного аппарата является патологическая утомляемость мышцы [7].
Результаты проведённых исследований имеют принципиальное значение. Они показывают, что у больных миастенией существует нарушение проведения возбуждения по АПСМ.
Проблему нарушения проведения возбуждения по афферентным путям нервной системы при миастении необходимо рассматривать с нескольких сторон. Во-первых, при этом заболевании возникает недостаток количества нейромедиатора (уменьшение выработки, уменьшение количества последнего в синапсе, уменьшение количества рецепторов). Во-вторых, возникает активация процессов торможения. Больные миастенией из-за возникающей мышечной Слабости при выполнении физической нагрузки для осуществления мышечных сокращений вынуждены значительно увеличивать афферентные посылы для выполнения движений. При этом происходит усиленная афферентная стимуляция нейронов нервной системы, что вызывает функциональное напряжение и перенапряжение нейронов. Всё это может привести к функциональным, а затем и к морфологическим изменениям нейрона, вплоть до его гибели. Для защиты нейрона от действия поражающих факторов возникает защитное или предохранительное торможение афферентных посылов нейрону.
Рис. 2
Моторные ответы правой (1,3) и левой (2,4) m. abductor hallucis при МС двигательной коры (1,2) и поясничного отдела (3,4) спинного мозга
примечание: Ось абсцисс - время, цена деления 10 мс;
ось ординат - амплитуда, цена деления 1 мВ
При этом происходит формирование патологического круга, который при схематичном представлении выглядит так: недостаток движения - усиленная афферентация - напряжение и поражение нейрона - торможение - еще больший недостаток движения.
В-третьих, нарушение проведения возбуждения по афферентным путям ЦНС может быть обусловлено действием патологического медиатора. Качественные перестройки затрагивают изменения в нейромедиаторной системе, когда вместо действующего в норме нейромедиатора начинает действовать другой медиатор [5], или качественные изменения синаптических рецепторов, происходящих, в частности, под действием аутоантител.
В-четвертых, изменение проведения возбуждения по афферентным путям ЦНС может быть обусловлено интегративными перестройками - нарушением нервной и эндокринной регуляции, обеспечивающих гармоничное сотрудничество отдельных функций организма, постоянство внутренней среды и способность организма адаптироваться к изменчивым условиям внешней среды.
Всё изложенное выше позволяет рассматривать миастению как проявление сниженной функциональной лабильности нервно-мышечных синапсов, вследствие нарушения регуляторных механизмов целостной интегративной нейро-эндокринной деятельности с участием афферентных и эфферентных механизмов.
Литература
1. Вейн А.М., Садеков Р.А., Данилов А.Б., Купершмидг Л.А. Применение магнитной стимуляции при органических и психогенных заболеваниях // Журн. невропатол. и психиатр. - 1994. - №4. - С.60-61.
2. Гехт Б.М., Ильина Н.А. Нервно-мышечные болезни. -M.: Медицина, 1982. - 350с.
3. Гехг Б.М., Касаткина Л.Ф., Самойлов М.И., Санадзе А.Г. Электромиография в диагностике нервно-мышечных заболеваний. - Таганрог, 1997. - 369с.
4. Коган О.Г., Гурков Я.В., Иванов В.В. и др. Клинико-морфо-функциональная классификация миастении и принципы диагностики. - Новокузнецк. - 1982. - 76с.
5. Крыжановский Г.Н. Общая патофизиология нервной
системы. - М.: Медицина, 1997. - 350с.
6. Кузин М.И., Гехт Б.М. Миастения. - М.: Медицина,
1996. - 224с.
7. Лайсек Р.П., Барчи Р.Л. Миастения. - М.: Медицина,
1984. - 270с.
8. Лехтенберг Р. Неврология в вопросах и ответах. Санкт-Петербург: Питер. 1997. - 315 с.
9. Перкин Г.Д. Диагностические тесты в неврологии. - М.:
Медицина, 1994.-297с.
10. Пилипенко П.И. Саногенетические механизмы дисфункции кортико-спинального тракта при патологии нервной системы с явлениями центрального паралича: Автореф.
дис. ... докт. мед. наук. - Новосибирск, 1997. - 41с.
11. Ремнёв А.Г., Смирнов К.В. Способ диагностики функционального состояния афферентных путей спинного мозга. Патент на изобретение № 2136328, приоритет
от 22.03.1996 г.
12.Jahanshahi М., Ridding M.C., Limousin P., Profice P.,
Fogel W., Dressier D., Fuller R., Brown R.G., Brown P.,
Rothwell J.C. Rapid rate transcranial magnetic stimulation - a safety study // Electroenceph clin Neurophysiol. - 1997.- V.105. -P. 422-429.
13 ohonen J., Ravazzani P., Grandori F. Functional
magnetic stimulation: theory and coil optimization //
Bioelectrochemistry and Bioenergetics. - 1998. - V.47. - P.213-219.
14. Wassermann E.M., Cohen L.G., Flitman S.S., Chen R.,
Hallett М. Seizure in healthy people with repeated "safe"
trains of transcranial magnetic stimulation // Lancet. -
1996. - V.347. - P.825.
15. Wassermann E.M. Risk and safety of repetitive transcranial
magnetic stimulation: report and suggested guidelines from
the International Workshop on the Safety of Repetitive
Transcranial Magnetic Stimulation, June 5-7, 1996 //
Electroenceph. clin. Neurophysiol. - 1998. - V108. - P. 1-16.
ПЕРВЫЙ ОПЫТ КОМПЛЕКСНОЙ ОЦЕНКИ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ ПРОВОДЯЩИХ ПУТЕЙ СПИННОГО МОЗГА ПРИ МИАСТЕНИИ
А. Г. Ремнёв
Алтайский диагностический центр, г. Барнаул
Август 2000 г.