Опубликовано в журнале:
»» N 5 2004 ВЛИЯНИЕ МОНОТЕРАПИИ И СОЧЕТАННОГО ЛЕЧЕНИЯ ИНГИБИТОРАМИ АНГИОТЕНЗИНПРЕВРАЩАЮЩЕГО ФЕРМЕНТА НА РЕГРЕССИЮ ГИПЕРТРОФИИ ЛЕВОГО ЖЕЛУДОЧКА У БОЛЬНЫХ НА ПРОГРАММНОМ ГЕМОДИАЛИЗЕ
Козлова Т.А., Шутов Е.В., *Сафонов В.В. Ермоленко В.М., * Кухтевич А.В.
Российская медицинская академия последипломного образования;
*Московская медицинская академия им. И.М. СеченоваРезюме
Обследован 71 больной с АГ, получающие программный амбулаторный гемодиализ. Больные были разделены на 4группы: I гр. составили 16 больных с АГ I-II ст., которым был назначен периндоприл в дозе 2-4 мг/сут; II гр. – 16 больных c АГ I<II cт.< получали амлодипин 5-10 мг/сут; III гр. – 16 больных с АГ II<III cт. – получали комбинированную терапию периндоприлом и амлодипином;IV гр. – 21 больной, преимущественно с АГ I ст., составляли группу сравнения. При ЭхоКГ исследовании через 6 мес. выявлено, что при применении периндоприла и его сочетания с амлодипином уменьшается ММЛЖ, ИММЛЖ, улучшаются показатели диастолической функции миокарда. Монотерапия амлодипином снижает темп прогрессирования ГЛЖ. У больных без гипотензивной терапии нарастают негативные изменения в структуре миокарда.
Ключевые слова: гемодиализные больные, ингибиторы ангиотензинпревращающего фермента, влияние на структуру и функции миокарда, 6-месячное наблюдение.
Abstract
Seventy<one arterial hypertension (AH) patients on programmed, ambulatory hemodialysis were divided into four groups: 16 patients with Stage I-II AH (Group I), receiving perindopril (2-4 mg/d); 16 patients with Stage I-II AH, receiving
amplodipine (5-10 mg/d); 16 patients with Stage II-III AH, receiving a combination of perindopril and amlodipine (Group III); and 21 patients, mostly with Stage I AH (Group IV, controls). Echocardiography, performed 6 months later, demonstrated that perindopril alone and in combination with amlodipine decreased left ventricular myocardial mass, left ventricular myocardial mass index, and improved diastolic myocardial function. Amlodipine as monotherapy prevented progression of left ventricular hypertrophy. Progression of negative dynamics in myocardial structure was observed in patients not receiving hypotensive therapy.
Keywords: hemodialysis patients, ACE inhibitors, effect on myocardial structure and function, 6-month follow-up.
Поступила 23/12/2003
Летальность среди диализных больных в 40-60% случаев обусловлена сердечно3сосудистыми осложнениями [2, 10]. Гипертрофия левого желудочка при артериальной гипертензии (АГ) независимо от величины АД, служит самостоятельным важным фактором риска сердечно3сосудистых осложнений [1,4,16].
У больных на гемодиализе с гипертрофией левого желудочка (ГЛЖ) риск развития сердечно-сосудистых осложнений в 2-6 раз выше, чем у пациентов с нормальными параметрами левых отделов сердца [7,10].Наряду с коррекцией анемии, контроль за АД способен уменьшить степень ГЛЖ [14,16].
Цель данного рандомизированного проспективного исследования – изучение антигипертензивной эффективности периндоприла и блокатора кальциевых каналов амлодипина и их влияния на структурно– функциональные изменения в сердце у больных с уремией, находящихся на гемодиализе.
Материалы и методы
Обследованы больные (71 чел.) с АГ 1-3 степени, по классификации ВОЗ, 1999 г., находящиеся на программном амбулаторном гемодиализе. Средний возраст больных составлял 36,5 ± 12,7г. (от 19 до 70 лет), женщин было 32, мужчин – 37. Причинами ХПН у 61,5% больных был хронический гломерулонефрит, у 15,3% – пиелонефрит, у 3,2%– аномалия развития почек, у 4,5% – поликистоз почек, прочие причины – 15,5%, время пребывания на гемодиализе составило 17,67± 9,48 мес. Все больные, включенные в исследование, были рандомизированы по группам; I группу составили 16 больных с АГ I и II степени; им назначали периндоприл в дозе 234 мг ежедневно. Вторая группа, которая состояла также из 16 больных, получала амлодипин в суточной дозе 5-10мг (доза подбиралась в течение месяца, в зависимости от АД). Другие гипотензивные препараты были отменены. Комбинированная терапия периндоприлом и амлодипином проводилась в III группе – 16 больным с АГ II и III степени. Группу сравнения (IY группа) составлял 21 больной с АГ, преимущественно I степени, без гипотензивной терапии.
Все больные получали стандартный бикарбонатный гемодиализ 3 раза в неделю, длительностью от 434,5 ч; площадь диализной мембраны – 1,331,8м2. Доза диализа назначалась индивидуально, чтобы Кt/V был выше 1,2 (расчеты Кt/V осуществлялись по формулам J. Daugirdas [5]). Сухой вес у больных определяли на основании клинических данных (как наименьший вес, переносимый больным без появления симптоматики или гипотонии) [3,5,11].
Для поддержания гемоглобина выше 100г/л, больные получали индивидуально подобранную дозу искусственного рекомбинантного эритропоэтина (рекормон), а также препараты железа (венофер). Большинство пациентов принимали карбонат Са и витамин Д3 (по показаниям). Наблюдение за больными осуществлялось в течение 6 месяцев.
Всем больным выполнялось ультразвуковое исследование сердца в М-режиме импульсным датчиком 3,5 МГц в положении на левом боку, аппаратом ACUSON 128/XP10 (США) по стандартной методике-до начала и через 6 месяцев лечения. Измеряли толщину межжелудочковой перегородки (МЖП, мм) и задней стенки левого желудочка (ЗСЛЖ, мм) в диастолу, определяли конечный диастолический (КДР, мм) и конечный систолический размер (КСР, мм) левого желудочка, диаметр левого предсердия (ЛП, мм). Рассчитывали объем левого желудочка в систолу и в диастолу (КДО мл), ударный объем (УО, мл), фракцию выброса (ФВ%). Систолическую дисфункцию диагностировали при ФВ < 50%. Диастолическую функцию левого желудочка оценивали в режиме импульсной допплерографии по методике L.Hatle, B.Angelsen [15]. Исследование проводилось одним и тем же лицом в одинаковых условиях.
Диастолическую дисфункцию диагностировали по величине пиковых скоростей диастолического наполнения левого желудочка– быстрое и медленное (Е и А)– и их соотношения.
Массу миокарда левого желудочка (ММЛЖ) рассчитывали по формуле Devereux R.[6]: ММЛЖ=1,04 х [(КДР + толщина МЖП в конце диастолы +ЗСЛЖ в конце диастолы)3 – КДР 3] – 13,6. Определяли индекс массы миокарда левого желудочка (ИММЛЖ) как отношение ММЛЖ к площади поверхности тела.
Площадь поверхности тела рассчитывали по формуле BSA= 0,0001Ч71,84(wt0,425)Ч(ht0,725). Гипертрофию левого желудочка диагностировали при ИММЛЖ 135 и более г/м2 у мужчин и 111 г/м2 и более у женщин. Относительную толщину стенки (ОТС) рассчитывали по формуле: ОТС= 2 Ч ЗСЛЖ /КДР.
Согласно классификации, предложенной A. Ganau [9] и дополненной D. Levy [12], нормальной геометрией левого желудочка считали ОТС<0,45 при нормальном ИММЛЖ, концентрическую гипертрофию ЛЖ диагностировали при ОТС>0,45 и увеличенном ИММЛЖ, эксцентрическую гипертрофию ЛЖ – при ОТС<0,45 и увеличенном ИММЛЖ, концентрическое ремоделирование – при ОТС>0,45 и нормальном ИММЛЖ.
Двое больных выбыли из исследования: мужчина 29 лет, в связи со сменой места жительства, и мужчина 37 лет с неконтролируемой АГ, упорно нарушающий водный, солевой режимы, нерегулярно принимающий предписанные препараты, с междиализной прибавкой веса более 5 кг, анемией, декомпенсацией сердечной недостаточности.
Результаты исследования обрабатывались статистически с использованием пакета прикладных программ Statistica for Windows, version 6.0. Данные представлены в виде средних значений и их стандартных отклонений (М±SD). Достоверность различий оценивалась при помощи парного критерия Вилкоксона; р< 0,05.Корреляционные связи определялись методом Спирмена. Анализ показателей в группах проводился при помощи метода КрускалаУоллиса. Пошаговый регрессионный анализ использовался для определения факторов, значимых для изменений ИММЛЖ и ММЛЖ.
Результаты и обсуждение
В целом, в 4-х группах больных ГЛЖ диагностирована у 71% больных. Наблюдалось значительное преобладание концентрического типа гипертрофии левого желудочка – у 39% больных, концентрическое ремоделирование – у 14,5%, эксцентрический тип выявлен у 17,4%, нормальная эхокардиографическая картина отмечена у 29 % больных. Исходно ИММЛЖ прямо коррелировал с систолическим АД (r=0,33, p<0,05).
При лечении периндоприлом обнаружено значимое снижение ИММЛЖ, ММЛЖ, ТМЖП и диастолического АД (табл. 1).
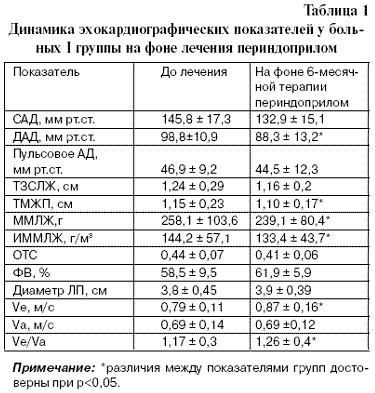
Размеры и объемы ЛЖ (КДР, КСР, КСО, КДО) статистически достоверно не изменились. Регрессионный анализ между ΔИММЛЖ, как зависимого фактора, и ΔСАД, ΔДАД и пульсового АД показал отсутствие статистически значимого их влияния на регресс ГЛЖ. Следует отметить и благоприятное влияние периндоприла на диастолическую функцию миокарда, о чем свидетельствует достоверное увеличение Ve и соотношения Ve/Va .
Результаты лечения больных II группы, получавших амлодипин, представлены в табл. 2.
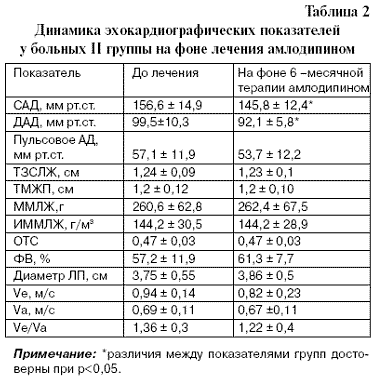
Как видно из представленных данных, при лечении амлодипином достоверно изменилось только систолическое и диастолическое АД, в то время как другие гемодинамические показатели остались без существенной динамики. Геометрия ЛЖ также не претерпела существенных изменений. Результаты влияния комбинированной терапии (амлодипином и периндоприлом (группа III) на АД и морфологию ЛЖ представлены в табл.3.

В группе больных, получавших комбинированную терапию, произошло достоверное снижение ММЛЖ, ИММЛЖ, диастолического АД, ТЗС ЛЖ, улучшились показатели диастолической функции левого желудочка. При проведении множественного сравнения средних в группах больных, получавших только периндоприл и сочетанную терапию, не было выявлено достоверных различий в изменении ИММЛЖ, ММЛЖ и АД. При сравнении степени влияния используемых гипотензивных препаратов на ΔАД, ΔММЛЖ, ΔИММЛЖ оказалось, что наиболее выраженные изменения произошли при сочетанной терапии периндоприлом и амлодипином; несколько меньше изменились эти показатели при монотерапии периндоприлом (табл. 4).

Данные исследования больных в IV группе – группе сравнения – показали нарастание негативных процессов в геометрии ЛЖ и ухудшение гемодинамических параметров (табл. 5).
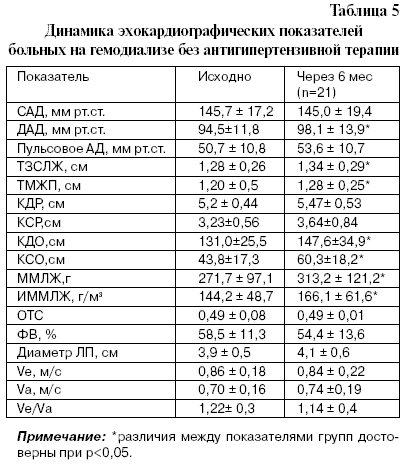
У больных группы сравнения увеличились КДО,КСО,ЗСЛЖ,ТМЖП, ИММЛЖ,ММЛЖ, повысилось диастолическое АД.
Пошаговый регрессионный анализ не выявил значимых факторов (Δгемоглобина, ΔАД, Δвозраста, Δдлительности ГД), влияющих на регресс ГЛЖ и диастолическую функцию ЛЖ. Наиболее выраженные изменения в геометрии миокарда произошли под влиянием периндоприла, что свидетельствует о специфических механизмах воздействия этого препарата, как представителя группы ингибиторов АПФ [13]. В частности, известно, что подавление РААС приводит к уменьшению гипертрофии и пролиферации гладкомышечных клеток периферических сосудов, происходит коррекция структурных повреждений (фиброза и склероза) кардиомиоцитов [1, 4].
Выводы
1. Периндоприл и амлодипин в равной степени снижают АД.
2. Длительная монотерапия периндоприлом (в течении 6 мес.) оказывает положительное влияние на геометрию левого желудочка, уменьшает ИММЛЖ, ММЛЖ, а также улучшает диастолическую функцию миокарда.
3. Амлодипин не оказывает существенного влияния на геометрию левого желудочка, в то же время снижает темпы прогрессирования гипертрофии миокарда.
4. У больных с АГ, не получающих гипотензивной терапии, в процессе пребывания на гемодиализе нарастают негативные изменения в структуре миокарда, что проявляется увеличением ИММЛЖ, ММЛЖ, КДО, КСО.
Литература
1. Беленков Ю.Н., Марев В.Ю. Принципы рационального лечения сердечной недостаточности. М. 2000г.
2. Волгина Г.В. Клиническая эпидемиология кардиоваскулярных нарушений при хронической почечной недостаточности //Нефрология и диализ. 2000;том 2;№132: стр.25-32.
3. Земченков А.Ю. Адекватность гемодиализа. Классический подход // Нефрология и диализ. 2001; том3;№1:стр 4-20.
4. Мареев В.Ю. Ингибиторы ангиотензинпревращающего фермента в лечении больных коронарной болезнью сердца. Взгляд 2003 года // Кардиология. 2003; том 12, стр 4-14.
5. Daugirdas J.T. Estimation of equilibrated Kt/V using the unequilibrated post dialysis BUN// Sem. Dial. 1995; 8: PP. 283-284.
6. Devereux R.B., Reichek N. Echocardiographic determination of left ventricular mass in man: anatomic validation of the method// Circulation. 1977; Vol.55: pp.613-618.
7. Ernesto Paolettti, Paolo Cassottana, Diego Bellino et al. Left ventricular geometry and adverse cardiovascular events in cronic
hemodialysis patiens on prolonged therapy with ACE Inhibitors// Am. J. Kidney Disеases.2002; Vol.40; № 4: pp.728-736.
8. Foley R. N., Parfrey P.S., Harnett J.D. et al. Hypoalbuminemia, cardiac mortality and morbidity in end3stage renal disease// J.A.
Soc. Nephron 1996; № 7: 728-736.
9. Ganau A., Saba P.G., Roman M.J.et al. Agein induces left ventricular concentric remodelling in normotensive subjects// J.
Hypertens.1995;13:PP.1818-1822.
10. Herzog C.A. Dismal long3term survival of dialysis patients after acute myocardial infarction: can we alter the outcome// Nephrol.
Dial. Transplant. 2002; Vol.17; No1: pp.7-10.
11. Jaeger J.Q., Mebta R.L.Assessment of Dry Weight in Hemodialysis: An overview// J. Am. Soc. Nephrol. 1998;10(2):98-104.
12. Levy D., Garrison R.J., Savage D.D. et al. Prognostic implications of echocardographically determined left ventricular mass in the
Framingham Heart Study// N. Engl. J. Med. 1990; 322: PP.1561-1566.
13. London G.M. Benefits from ACE inhibition in patients with renal failure. A Satellite Symposium held during the ESC ( European
Society of Cardiology) Congress 2002.Stockholm( Green Zone). Messe Berlin.
14. Milagros Fernandez Lucas, Carlos Quereda, Jose Luis Teruel,et al. Effect of Hypertension Before Beginning Dialysis on Survival of
Hemodialysis Patients// Am. J. Kidney Diseases. 2003, Vol 41;№4(april): 814-821.
15. Hatle L., Angelsen B. Doppler Ultrasound in Cardiology. Physical principles and clinical application. Phyladelphia. 1985,pp.74-253.
16. 2003 European Society of Hypertension– European Society of cardiology Guidelines for the management of Arterial Hypertension.
Guidelines Committee// J. Hypertens. 2003; 21: pp.1011-1053.
Июль 2005 г.