Опубликовано в журнале:
»» N 5 2004 НЕПОСРЕДСТВЕННЫЕ И ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ АНЕВРИЗМ И РАССЛОЕНИЙ ВОСХОДЯЩЕГО ОТДЕЛА И ДУГИ АОРТЫ
Белов Ю.В., Степаненко А.Б., Кузнечевский Ф.В.
Российский научный центр хирургии РАМН, МоскваВ сердечно-сосудистой хирургии существуют области, которые всегда считаются крайне трудными даже для очень многоопытных хирургических клиник. К таковым относятся все виды аневризм и расслоений грудной аорты, особенно включающие ее дугу. Здесь в единый узел сплетаются проблемы своевременной и точной диагностики, сложность хирургического доступа, непредсказуемость патологической анатомии и структуры тканей, коагулопатии и послеоперационная полиорганная недостаточность. По образному выражению D. Cooley, «операции на дуге аорты представляют собой своеобразный «вызов» специалистам в области сердечно-сосудистой хирургии» [1]. Вместе с тем, за последние два десятилетия во многих развитых странах отмечается неуклонный рост общего количества операций, производимых на грудной аорте. Если проанализировать статистику, то станет ясно, что прирост происходит, главным образом, за счет увеличения вмешательств по поводу аневризм и расслоений грудного отдела аорты. Такое положение вещей объясняется совокупностью причин. Во-первых, среди врачей всех специальностей значительно возросла настороженность в отношении этих заболеваний. Во-вторых, увеличившиеся диагностические возможности позволяют распознать патологию на более ранних этапах – до развития фатальных осложнений – и довести больного до операционного стола. В-третьих, все исследователи отмечают, что наблюдается постоянное повышение количества дегенеративных повреждений стенки аорты, связанных с такими факторами, как генетические аномалии, атеросклероз и гипертоническая болезнь. И, в-четвертых, после заметных успехов ряда ведущих клиник в лечении аневризм и расслоений аорты резко возросла хирургическая активность во многих других кардиохирургических центрах. Настоящая работа посвящена анализу результатов хирургического лечения аневризм восходящего отдела и дуги аорты на основе материалов Российского Научного Центра Хирургии РАМН.
Материалы и методы
В отделении хирургии аорты и ее ветвей РНЦХ РАМН с 1993 по 2001 гг. были оперированы 284 пациента с аневризмами и расслоениями различных отделов аорты. В настоящей работе производился анализ диагностики и хирургического лечения всех больных, у которых имелась патология восходящего отдела и дуги аорты, то есть все случаи, когда для выполнения операций требовалось применение кардиохирургических технологий. В эту категорию вошло 139 пациентов: 106 человек, которым было произведено вмешательство на восходящей аорте (с коррекцией аортальной недостаточности или без нее) –первая группа пациентов; и 33 человека, которым производилось вмешательство на дуге аорты, – вторая группа.
Сразу же следует подчеркнуть, что в данном исследовании не ставилась задача сравнить результаты хирургического лечения в этих группах. Такое разделение было необходимо, так как при операциях на дуге аорты, помимо стандартного ИК, требуется обеспечение защиты головного мозга. В свою очередь, защита головного мозга в сосудистой хирургии представляет собой самостоятельную многокомпонентную проблему. Это обстоятельство значительно усложняет саму операцию и повышает риск развития неврологических и других осложнений. Поэтому простое статистическое сравнение результатов оперативного лечения в этих группах было бы некорректным. Тем не менее, характеристику пациентов обеих групп следует давать отдельно, так как, по мере исследования, для каждой группы были выявлены некоторые особенности.
В первой группе больных было 84 мужчины (79,2%) и 22 женщины (20,7%). Средний возраст пациентов составил 42,7±9,7 года. В группе операций, включавших вмешательство на дуге аорты, было 24 мужчины (72,7%) и 9 женщин (27,3%), а средний возраст равнялся 45,5±9,3 года.
Анализ распределения больных по полу и возрасту в обеих группах показывает, что наибольшее число пациентов относится к трудоспособному возрасту – от двадцати до шестидесяти лет, 124 человека (89,2%).
Распределение больных первой группы по этиологии заболевания представлено на диаграмме (табл. 1), из которой видно, что самой частой причиной развития аневризм или расслоений аорты в ее восходящем отделе являются дегенеративные процессы – болезнь Марфана и идиопатический медионекроз. В свою очередь, из этих двух заболеваний чаще встречается именно врожденная патология аорты – болезнь Марфана – в 40% случаев. Считается, что и болезнь Марфана, и идиопатический медионекроз (болезнь Эрдгейма) в конечном итоге находят единое патоморфологическое выражение, а именно, дегенеративные изменения эластина и коллагена – главных прочностных структур стенки аорты. И все3таки, необходимо подчеркнуть, что чем ближе патологический очаг находится к корню аорты, тем чаще встречается врожденный патогенетический фактор и молодой возраст пациента. Расслоение аорты в первой группе пациентов встретилось в 35 случаях из 106, что составляет 33%.
Сопутствующая патология аортального клапана, потребовавшая коррекции аортального порока сердца, наблюдалась у 94 пациентов (88,7%) и лишь у 12 больных она отсутствовала или была выражена очень незначительно (11,3 %).
Распределение пациентов по этиологии заболевания во второй группе представлено в диаграмме (табл. 2). Здесь на первый план выступает идиопатический медионекроз аорты (болезнь Эрдгейма) – более половины всех случаев. Все случаи дегенерации стенки аорты (в том числе, сочетающиеся с атеросклерозом) составили 64%. Во второй группе расслоение аорты встречалось гораздо чаще, чем в первой – у 30 пациентов, что составляет 90,9%. Во всех случаях это были расслоения первого типа по классификации DeBakey с распространением процесса практически на все отделы аорты. Этот факт объясняется, естественно, тем, что во вторую группу как раз и входили больные, у которых вмешательство не могло ограничиться только восходящим отделом аорты. Повреждение аортального клапана во второй группе больных было несколько реже, чем в первой – в 23 случаях (69,7%), что можно объяснить перераспределением этиологических факторов в пользу идиопатического медионекроза. Гипертоническая болезнь, являющаяся одним из признанных патогенетических факторов развития аневризм и расслоений аорты, также встречалась в обеих группах в разных соотношениях. В группе вмешательств только на восходящей аорте она была выявлена у 66 пациентов (62,9%), а в группе операций на дуге аорты артериальная гипертензия была у 25 пациентов (75,8%).


Полученные данные о наличии гипертонической болезни в анамнезе и расслоении аорты в первой и во второй группах пациентов подтверждают присутствие корреляции между этими явлениями. Кроме того, истинная роль артериальной гипертонии в патогенезе расслоений аорты, видимо, несколько выше, так как в острой стадии расслоения пациенты могут поступать в кардиохирургический стационар в состоянии кардиогенного шока. В этих условиях подтвердить факт артериальной гипертензии сложно, особенно, если это был однократный подъем артериального давления, или первый в жизни гипертонический криз, или пациент ранее никогда не обращался к врачам с кардиологическими жалобами. Среди наших больных, поступивших в клинику с острым расслоением или разрывом аорты, по меньшей мере еще у четырех человек можно подозревать наличие артериальной гипертензии, однако зафиксировать ее на момент поступления не удалось именно по причине кардиогенного шока.
Очевидно, что артериальная гипертензия является одним из главных предрасполагающих факторов в развитии расслоений аорты у пациентов старше 40 лет. Она повышает механическую и метаболическую нагрузку на медиальный слой аорты, создавая условия для процессов дегенерации соединительно-тканного каркаса и гладкомышечных клеток.
В табл. 3 и 4 представлены основные и сопутствующие методы хирургического лечения, которые применялись в первой и второй группах аневризм восходящего отдела и дуги аорты, соответственно.
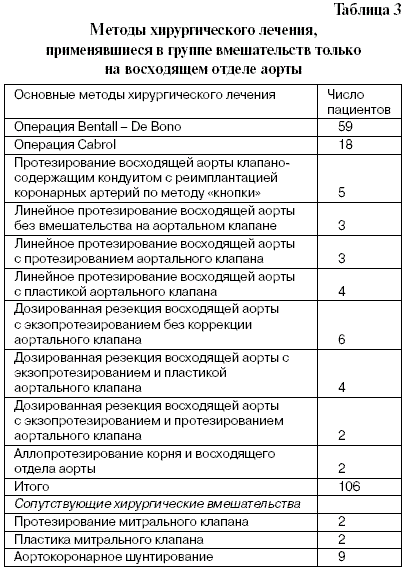

Всего из 139 операций у 48 человек они относились к категории экстренных (34,5%), причем в группе операций только на восходящем отделе аорты такие операции были выполнены у 27 человек (25,5%), а в группе операций с вмешательством на дуге аорты – у 21 пациента (63,6%). Такое процентное соотношение экстренных операций в группах пациентов объясняется, по-видимому, тем, что во второй группе было больше больных с продолжающимся острым расслоением I типа по классификации DeBakey.
Особенностью данного исследования является то, что в обеих группах пациентов невозможно окончательно стандартизировать методы хирургического лечения, так как большинство операций и их обеспечение были поисковыми. Действительно, простое перечисление модификаций проксимальных и дистальных анастомозов, методов коррекции аортальной недостаточности, принципов выбора кондуита для протезирования аорты, сопутствующих операций, а также способов защиты головного мозга говорит о том, что почти каждая операция была уникальной и, сама по себе, представляла большой интерес в выборе хирургической тактики.
В раннем послеоперационном периоде оценивали периоперационную летальность и количество осложнений (послеоперационные кровотечения, острая сердечная недостаточность, неврологические нарушения, полиорганная недостаточность, гнойно-септические осложнения). При изучении отдаленных результатов операций проводился актуарный анализ выживаемости пациентов, а также оценивалась стабильность хороших результатов (актуарный анализ отсутствия осложнений, связанных с аортой, аортальным клапаном или кондуитом аорты). Сюда относились: образование повторных аневризм и расслоений аорты, ложных аневризм аорты, отсроченные протезные эндокардиты и аортиты, тромбозы и окклюзии ветвей протеза аорты, а также тромбоэмболический синдром.
Результаты и обсуждение
Общая госпитальная летальность составила 10,8%, то есть из 139 больных в ближайшем послеоперационном периоде умерло 15 человек. Необходимо сразу же оговориться, что часть летальных исходов была связана с несовершенством сосудистых протезов и накоплением первоначального опыта, особенно в случаях вмешательства на восходящем отделе и дуге аорты.
В группе операций на восходящем отделе аорты она равнялась 7,6% (8 больных из 106 оперированных), причем за последние три года этот показатель не превышал 2,8%, что вполне сопоставимо с уровнем летальности после протезирования аортального клапана. В группе операций на восходящем отделе и дуге аорты в ближайшем послеоперационном периоде из 33 больных умерло 8 человек, что соответствует 24,2%. Структура госпитальной летальности в обеих группах больных представлена в табл. 5. Геморрагические осложнения. Одно из первых осложнений, с которым сталкивается вся хирургическая бригада во время и сразу после вмешательства на аорте, является продолжающееся кровотечение. Установлено, что причиной кровотечения могут быть технические дефекты и различные виды коагулопатий. Хороший гемостаз после операций с длительным периодом искусственного кровообращения (ИК), глубокой гипотермией, выраженной гемодилюцией и прочими атрибутами сложных реконструктивных операций на аорте определяется целым комплексом мероприятий, которые начинают готовить и проводить уже до начала операции. К ним относятся: коррекция взаимодействия свертывающей и противосвертывающей систем крови с помощью лекарственных препаратов, заготовка аутологичной крови до начала искусственного кровообращения, использование во время всей операции аппарата для аутогемотрансфузии, или «селлсейвера» (cell-saver), ультрагемофильтрация во время и сразу после ИК.
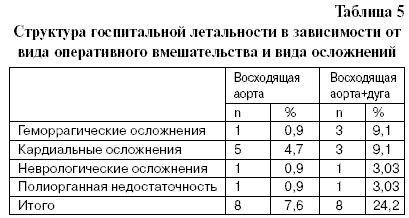
В нашей серии после операций по поводу аневризм и расслоений только восходящего отдела аорты рестернотомии из-за продолжающегося кровотечения были выполнены у 8 из 106 пациентов, что составило 7,6%. Хирургический источник кровотечения был выявлен и устранен с помощью дополнительных швов в двух из этих восьми случаев, а у остальных шести больных наблюдалось так называемое «биохимическое кровотечение». Таким образом, хирургические кровотечения встречались в 1,9% случаев, а биохимические – в 5,7% в этой группе пациентов.
В группе вмешательств на восходящем отделе и дуге аорты рестернотомий по поводу продолжающегося после операции кровотечения было 9, но приходились они на 33 пациента (27,3%), причем у одного оперированного рестернотомия была выполнена дважды. Хирургический источник был найден в двух случаях, а в оставшихся 7 случаях кровотечение было классифицировано как коагулопатия. Продолжая сопоставление, мы выяснили, что хирургическая операция для остановки кровотечения после вмешательства на восходящем отделе и дуге аорты потребовалась в 6,1% случаев. Что же касается коагулопатий, потребовавших ревизии органов средостения, то они в этой группе встречались гораздо чаще – у 21,2% пациентов. Последний факт объясняется тем, что при реконструкции дуги применялась глубокая гипотермия и циркуляторный аррест; как правило, был дольше период ИК, наблюдался бульший объем кровопотери во время первой операции и часто исходное состояние пациента было очень тяжелым. Суммарный объем периоперационной кровопотери значительно разнился в исследуемых группах. В группе операций только на восходящем отделе аорты общая кровопотеря равнялась 1 547±119 мл, в то время как после операций на восходящем отделе и дуге аорты общая кровопотеря составила, в среднем, 5 233±1 262 мл. Разница объема кровопотери после операций в разных группах статистически достоверна (p=0,002).
Наши данные по периоперационным кровотечениям близки к результатам других отечественных и зарубежных клиник. По сообщениям разных авторов частота рестернотомий из-за кровотечений после реконструктивных операций на восходящем отделе и дуге аорты колеблется в пределах между 10% и 30% [2,3, 4, 5].
Кардиальные осложнения. Среди осложнений со стороны сердечно-сосудистой системы после операций на восходящем отделе и дуге аорты наиболее опасным и довольно распространенным является синдром низкого сердечного выброса, который изначально может проявляться интраоперационно, а также спустя часы и даже сутки после операции. Причин развития низкого сердечного выброса может быть довольно много и среди них:
- исходная острая гипоксия всего организма (в том числе и миокарда), если, например, пациент взят на операционный стол при состоявшемся разрыве аорты до подключения ИК, в состоянии клинической смерти и т.д.;
- исходная слабость миокарда левого желудочка, обусловленная длительно существующим пороком аортального клапана (как недостаточностью, так и его стенозом);
- неадекватная кардиоплегия;
- травма коронарных сосудов или неадекватное сопутствующее аортокоронарное шунтирование;
- повреждение проводящей системы сердца во время манипуляций на фиброзном кольце аортального клапана;
- перегрузка миокарда левого желудочка вследствие неполной коррекции аортального порока сердца;
- перегрузка миокарда правого желудочка при массивном лево-правом сбросе через соустье между парааортальным мешком и ушком правого предсердия.
В ближайшем послеоперационном периоде острая сердечная недостаточность развилась у 12 из 139 наших пациентов, что составило 8,6%. Эти данные соответствуют результатам, полученным в последние годы в известных зарубежных клиниках [5, 6, 7]. Анализ возникновения синдрома низкого сердечного выброса представлен в табл. 6 (проценты указаны от общего числа случаев развития этого осложнения).
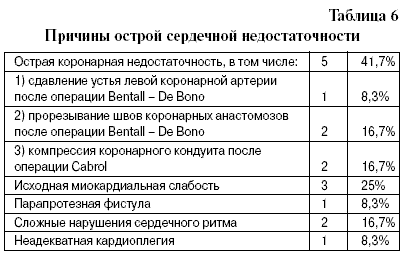
Классическая форма низкого сердечного выброса после операций на восходящем отделе и дуге аорты обычно развивается вследствие нарушения коронарного кровотока. Одним из его вариантов является ситуация, когда расслоение аорты переходит на устья коронарных артерий и сопровождается разрывом внутренней мембраны. Это, в первую очередь, может сказаться на результативности антеградной кардиоплегии через устья коронарных артерий. Вследствие этого, в ряде кардиохирургических центров, в том числе и в РНЦХ РАМН, иногда используют ретроградную кардиоплегию через устье коронарного синуса [8]. Однако интерпозиция внутренней мембраны может явиться причиной острой коронарной недостаточности и после снятия зажима с аорты и восстановления сердечной деятельности. По наблюдениям разных авторов и нашим данным, чаще всего расслоение переходит на устье правой коронарной артерии [5, 7, 9], где чаще всего происходит фрагментация внутренней мембраны, что увеличивает риск эмболии правой коронарной артерии.
Согласно статистике, нарушения коронарного кровотока в ближайшем послеоперационном периоде возникают чаще после протезирования восходящей аорты по методу Cabrol [7, 10, 11, 12]. Наши данные подтверждают это наблюдение. Так, после операции Bentall – De Bono эти осложнения возникли у трех из 84 пациентов (3,6%), а после операции Cabrol – у двух из 19 (10,5%). Разные авторы наблюдали окклюзию сосудистого протеза, соединяющего коронарные артерии, перед устьем правой коронарной артерии, что было обусловлено его кинкингом или тромбированием парааортального пространства. Как сообщает E.S. Crawford, в связи с этим осложнением у пяти пациентов после протезирования восходящего отдела аорты по методу Cabrol, они были вынужденывыполнить аутовенозное АКШ правой коронарной артерии при уже развившейся острой коронарной недостаточности [13].
В последнее время при избыточном натяжении в области коронарных анастомозов все большее предпочтение отдается мобилизации устьев коронарных артерий. По нашему мнению и сообщениям других авторов, эта методика является наиболее предпочтительной во избежание проблем с коронарными анастомозами, однако она, в свою очередь, требует наложения изначально герметичного шва, то есть использования техники «кнопки» [8, 9, 11, 12, 14]. Длительное наблюдение показало, что при наложении обычного обвивного шва в области коронарных анастомозов при мобилизации коронарных артерий прорезывание стенки аорты произошло в 50% случаев (что соответствует результатам L.K. Groves et al., 1964), в то время как в группе, где использовалась техника «кнопки», таких осложнений не было [15]. Как известно, при синдроме Марфана, как и при других соединительно-тканных дисплазиях, в миокарде нередко возникают эктопические очаги электрической нестабильности. Это может приводить к возникновению сложных нарушений ритма даже после непродолжительного периода ишемии миокарда. Самыми частыми из них являются политопная экстрасистолия, наджелудочковая и желудочковая тахиаритмии. Подобные нарушения ритма также могут стать причиной внезапной смерти пациентов с аневризмами и расслоениями восходящего отдела аорты. По сообщениям разных авторов, нарушения ритма, сопровождаемые сердечной недостаточностью, наблюдаются у 7% – 22 % пациентов после операций на восходящей аорте и вносят существенный вклад в госпитальную летальность [7].
В нашей серии в ближайшем послеоперационном периоде синдром малого сердечного выброса вследствие сложных нарушений ритма, которые достоверно не были связаны с нарушением коронарного кровотока или неадекватной кардиоплегией, наблюдался у двух пациентов. В обоих случаях осложнение было устранено с помощью насыщения миокарда больных кордароном с дальнейшим его назначением в течение нескольких месяцев. Для выявления склонности пациента к стойким нарушениям ритма, которые увеличивают риск фибрилляции желудочков и внезапной смерти, рекомендуется по возможности до операции проводить холтеровское мониторирование. Если выявлены характерные предвестники (укорочение интервала PQ, расширение комплекса QRS и приступы реципрокной желудочковой тахиаритмии), необходима консультация кардиоаритмолога и возможное назначение уже до операции антиаритмических препаратов.
Неврологические осложнения. Частота развития неврологических осложнений после протезирования только восходящего отдела аорты в последнее время незначительно отличается от той, которая бывает при протезировании аортального клапана. Исключение могут составить те случаи, когда после протезирования восходящего отдела может произойти рецидив расслоения аорты с переходом на брахиоцефальные сосуды. Подобные осложнения, как в ближайшем, так и отдаленном периодах наблюдения, с использованием специальных средств фиксации дистального анастомоза (клей, прокладки) и без них были описаны в литературе [16, 17], однако в нашем исследовании не встречались.
В литературе не прекращается дискуссия о выборе оптимального метода защиты головного мозга. Постоянно появляются сообщения о новых или усовершенствованных старых методиках, позволяющих хотя бы гипотетически улучшить состояние переживания головного мозга, в которое он неизбежно попадает при манипуляциях на дуге аорты. Это свидетельствует, прежде всего, о том, что применяемые ныне методы защиты головного мозга далеки от совершенства.
Большая часть операций на дуге аорты в нашем исследовании проводилась в условиях гипотермической остановки кровообращения – у 15 пациентов (45,5%). Несколько реже применялся циркуляторный аррест в сочетании с ретроградной перфузией головы с помощью нагнетания оксигенированной крови в верхнюю полую вену – у 13 больных (39,4%). Наименьшее число раз защита головного мозга осуществлялась с помощью антеградной перфузии головного мозга – в 5 случаях (15,2%). Соотношение разных методов защиты головного мозга и неврологических осложнений представлено в табл. 7.

Наиболее частым неврологическим осложнением, которое можно связывать с защитой головного мозга во время операции на дуге аорты, была постгипоксическая энцефалопатия – у 5 пациентов (15,2%). В некоторых случаях она носила временный характер, в некоторых – была причиной летального исхода. Реже встречались очаговые расстройства мозгового кровообращения, включающие гемипарезы, гемиплегии и инфаркт мозга – у 4 пациентов (12,1%).
Гипотермическая остановка кровообращения. В нашей серии из 15 пациентов продолжительность полной остановки кровообращения в условиях глубокой гипотермии минимально составила 5 минут, максимально – 92 минуты, а среднее ее значение равняется 47,5±27,2 минуты. Температура внутренних органов находилась в пределах от 13oС до 18oС, но обычно ее стремились держать на уровне 14°С.
Несмотря на то, что в последних исследованиях говорится о явных преимуществах антеградной перфузии головного мозга перед другими методами защиты при операциях на дуге аорты (ее даже сравнивают по степени риска с обычным ИК), в большинстве кардиохирургических центров все-таки чаще применяют гипотермическую остановку кровообращения. Причем необходимо отметить, что, как правило, гипотермический циркуляторный аррест используется в центрах, обладающих наибольшим опытом операций на дуге аорты [18, 7]. Многими клиническими исследованиями подтверждено, что гипотермический циркуляторный аррест с успехом может применяться как метод защиты мозга, важно лишь не превышать допустимые ограничения по времени его продолжительности и температуре. Традиционно считается относительно безопасным период в 40 мин при t 18oC [19, 7]. Эти цифры получены при статистической обработке большого количества клинических наблюдений, говорящих о том, что при выходе за эти пределы кривая неврологических осложнений резко идет вверх.
Однако, как классические, так и современные клинико-физиологические исследования говорят о том, что медленные волны на ЭЭГ не исчезают до тех пор, пока мозг человека не охладится до t 13°С(329). Получается, что для обеспечения относительной безопасности мозга при остановке кровообращения на 40 минут, температура его не должна превышать 10°С. Но эти условия мало приемлемы для гомеостаза, так как требуют значительной гемодилюции уже на этапе охлаждения пациента с помощью системного ИК. Основоположники этого метода защиты головного мозга – R. Griepp et al. – предлагают в качестве критерия безопасной продолжительности циркуляторного арреста использовать насыщение венозной крови кислородом. Для этого необходимо осуществлять постоянный мониторинг этого показателя в луковице яремной вены. До тех пор, пока сатурация кислорода в яремной вене не упала ниже 95%, R. Griepp et al. считают циркуляторный аррест безопасным. Как только сатурация стала ниже 95%, необходимо возобновлять ИК. По наблюдениям авторов, ориентировка на этот критерий соответствует опять же 30-40 минутам полной остановки кровообращения [19].
В поисках взаимоприемлемых условий мы пришли к выводу, что подходящей температурой внутренних органов для циркуляторного арреста является 14-15°С, но нужно стремиться, чтобы период его не превышал 30 минут. Согласно нашим наблюдениям, пациенты с такими параметрами гипотермического циркуляторного арреста, при отсутствии других серьезных осложнений, не имели каких-либо признаков неврологического дефицита. Дальнейшее продолжение остановки кровообращения приводило к стимуляции процессов анаэробного гликолиза, накоплению лактата и внутриклеточному ацидозу, что затем обычно вызывало отек головного мозга и постгипоксическую энцефалопатию. Возможной причиной неврологических осложнений при расслоениях аорты может быть заворот интимы, либо компрессия истинного канала в области устий ветвей дуги аорты. Для своевременной их диагностики мы считаем обязательным уделять особое внимание изменению ЭЭГ и зрачков в начале ИК.
При возникновении осложнений необходимо остановить ИК, выполнить переканюляцию артериальной магистрали из бедренной в подмышечную артерию с последующим возобновлением ИК. Еще одним немаловажным моментом в реализации безопасного циркуляторного арреста считаем обязательное определение кислотно-основного состояния с помощью альфа-стат системы, а не с помощью рН-стат системы, так как последняя не дает истинных результатов в условиях глубокой гипотермии. Использование рН-стат системы не выявляет должного уровня накопления ионов водорода, что приводит к неадекватной коррекции ацидоза. Неполное устранение ацидоза у пациентов, перенесших полную остановку кровообращения, крайне негативно сказывается на всех системах организма, но, в первую очередь, приводит к серьезным неврологическим нарушениям в ближайшем послеоперационном периоде.
Гипотермическая остановка кровообращения с ретроградной перфузией головы была использована в 13 случаях. Во время ретроградной перфузии через верхнюю полую вену температуру внутренних органов стремились держать на уровне 16°С. При этом продолжительность применения этого метода минимально составила 16 минут, максимально – 74 минуты, что, в среднем, равнялось 33,7±16,0 минутам.
Для сравнения можно привести последние данные апологета ретроградной перфузии Y. Ueda. В его серии, подобной по технике операций и тяжести больных нашей, время продолжительности процедуры длилось от 5 до 93 минут и, в среднем, составило 41 минуту [20].
Ретроградная перфузия головы является относительно новым методом защиты головного мозга во время операций на дуге аорты. Эффективность и безопасность его до сих пор окончательно не определена. Следует отметить, что существует много работ, как поддерживающих применение этого метода, так и отрицающих его пользу, но часто условия проведения ретроградной перфузии не одинаковы, поэтому сравнение результатов затруднено.
Одно из последних фундаментальных исследований, включающее экспериментальную часть, выполненную на собаках, и большую клиническую часть, показывает, что те преимущества, которые дает ретроградная перфузия головы, основываются не на обеспечении ткани головного мозга кислородом, а на равномерном поддержании гипотермии во время остановки кровообращения [21]. Соотношение неврологических осложнений в нашей серии между гипотермической остановкой кровообращения и ретроградной перфузией головы (табл. 7) указывает, что два этих метода защиты действительно близки по эффективности, а снижение частоты постгипоксической энцефалопатии имеет недостоверный характер и указывает лишь на тенденцию (р=0,79).
Но ретроградная перфузия имеет еще одно неоспоримое преимущество перед другими методами защиты головного мозга. Это – вымывание, как материальных микроэмболов, так и микропузырьков воздуха из мелких артерий по окончании периода циркуляторного арреста. По нашему мнению и мнению других авторов, это качество ретроградной перфузии головы может быть аргументом в пользу того, чтобы она была обязательной частью протокола при применении любого другого метода защиты головного мозга.
Антеградная перфузия головного мозга применялась в нашей серии всего в 5 случаях, однако некоторое представление об особенностях этого метода и результатах его использования мы получили.
Наиболее проблемными были случаи, когда мы использовали билатеральную прямую канюляцию брахиоцефального ствола и левой общей сонной артерии после остановки кровообращения и продольного вскрытия аорты. В одном случае операция осложнилась инфарктом мозга, во втором – преходящей гемиплегией. Причем, необходимо отметить, время продолжительности антеградной перфузии во время обеих операций было очень небольшим, с точки зрения всех канонов экстракорпорального обеспечения, – 28 минут и 12 минут.
По мнению N. Nakajama et al., одним из основных недостатков билатеральной перфузии является не возможность устранить серьезный риск материальной и воздушной эмболии во время ее исполнения. Более того, авторы, обладающие одним из наиболее богатых опытов применения разных методов защиты головного мозга во время операций на дуге аорты, пришли к выводу, что применение антеградной перфузии или ее неприменение (в случае ее неприменения использовался обычный гипотермический циркуляторный аррест) никак не улучшило госпитальную летальность – 14% и 15%, соответственно. На материале одной из самых больших серий по применению антеградной перфузии головного мозга они утверждают, что «многие осложнения, связанные с этим методом, обусловлены превышением показаний к его применению» [22].
Более удачно проходили вмешательства с антеградной унилатеральной перфузией через правую плечевую артерию с пережатием брахиоцефального ствола ближе к его устью. Особенности кровоснабжения головного мозга (Виллизиев круг) позволяют обеспечить адекватный равномерный кровоток во всем головном мозге. При температуре внутренних органов 20-22°С антеградную перфузию проводили с объемной скоростью 300-500 мл/мин – так, чтобы давление в перфузируемом экстракраниальном сосуде мозга находилось в пределах от 40 до 50 мм рт. ст. У трех пациентов, оперированных в условиях этой методики, после операции не наблюдалось никакого неврологического дефицита. Мы считаем, что в настоящее время из всех вариантов антеградной перфузии головного мозга при операциях на дуге аорты унилатеральная перфузия через правую подмышечную артерию является наиболее действенным и безопасным методом.
Наши данные согласуются с результатами последних исследований других коллективов, которые тоже пришли к выводу, что унилатеральная перфузия эффективна и не несет тех осложнений, которые характерны для билатеральной перфузии [23, 24, 25]. Так, K.M. Dossche et al. при сравнении билатеральной и унилатеральной перфузии головного мозга, выявили, что именно первая является достоверным предиктором более высокой смертности [24].
Коллектив O. Tasdemir et al. сообщает об очень хороших результатах применения антеградной унилатеральной перфузии через правую аксиллярную артерию при температуре 26°С с объемной скоростью 8-10 мл/кг/мин. В их серии из 104 операций на дуге аорты частота неврологических нарушений составила 1,9% [25]. В свою очередь, H. Aebert et al. не имели неврологических осложнений в 7 случаях применения антеградной перфузии через правую подмышечную артерию при лечении расслаивающих аневризм «А» типа с максимальной продолжительностью процедуры 82 мин [23].
Согласно нашему опыту и большинству сообщений об осложнениях после одновременной реконструкции восходящего отдела и дуги аорты, отдельное поражение тех или иных систем и органов происходит довольно редко. Все-таки чаще речь идет о полиорганной или, как ее называют в англоязычной литературе, мультисистемной недостаточности.
Обычно полиорганную недостаточность (ПОН) определяют как одновременное неспецифическое поражение всех органов и тканей агрессивными медиаторами критического состояния. ПОН является универсальным ответом на критическое состояние организма, которое возникает в связи с резким утяжелением какой-либо патологии или ятрогенным повреждением. Современные представления о патогенезе ПОН довольно сложны. Выделяют целый ряд физиологических механизмов, по которым течет ПОН. Среди них центральное место занимает физиология эндотелиальной системы и медиаторов паракринного и аутокринного воздействия – цитокинов.
Цитокины являются низкомолекулярными белками, которые образуются в клетках эндотелия сосудов, лейкоцитах, фибробластах и других клетках организма. Они осуществляют свою медиаторную функцию
через специфические рецепторы в этих же клетках (аутокринный эффект) и в ближайших клетках (паракринный эффект). В настоящее время известно уже более 200 цитокинов и подобных им соединений, с помощью которых происходит саморегуляция эндотелиальной и иммунной систем организма. При критическом состоянии происходит массивный хаотичный выброс цитокинов клетками, их продуцирующими. В результате этого в обмене веществ, главным образом, эндотелия сосудов резко ускоряются процессы катаболизма, что приводит к аутолизу и разворачиванию воспалительной реакции. Повреждение эндотелия микрососудов, играющего основную роль в активном транспорте газов между клетками крови и остального организма, приводит к дальнейшему усугублению ишемии тканей. Последняя вызывает новый рост выброса медиаторов повреждения, и порочный круг критического состояния замыкается. На этом этапе клиническая картина ПОН разворачивается полностью. Обычно в практике общей реаниматологии она вовлекает системы организма в такой последовательности: синдром дыхательных расстройств, энцефалопатия, синдром почечной дисфункции, синдром печеночной дисфункции, стрессовые язвы желудочно-кишечного тракта, острая сердечно-сосудистая недостаточность.
В хирургии восходящего отдела и дуги аорты этиологическими факторами ПОН могут быть резкое ухудшение состояния пациента до операции (разрыв аорты с большой одномоментной кровопотерей, нарушением микроциркуляции и т.п.) и влияние самой операции, включающее такие факторы, как обширное механическое повреждение тканей, искусственое кровообращение, глубокая гипотермия, полнаян остановка кровообращения, массивное кровезамещение. Особенность ПОН после операций на восходящем отделе и дуге аорты заключаются в обязательном ведущем значении сердечно-сосудистой недостаточности с почти одновременным развертыванием дисфункции во всех системах организма. Разрешение сердечно-сосудистой недостаточности, как правило, представляет собой хороший прогностический признак в дальнейшем течении заболевания. Этот факт еще раз подтверждает, что ключевым механизмом развития ПОН у наших пациентов является нарушение общей микроциркуляции на фоне абсолютного или относительного перфузионного дефицита. Можно сказать, что в последнее десятилетие в РНЦХ, по совместным наблюдениям хирургов, анестезиологов и реаниматологов, сформировалось коллективное мнение о том, что среди перечисленных факторов наибольшим эффектом в отношении развития ПОН обладают: а) чрезмерно глубокая гипотермия (ниже 14°С), которая требует также и выраженной гемодилюции; б) длительность циркуляторного арреста более 60 минут; в) переливание более 50% ОЦК донорской крови. Эта точка зрения подтверждается последними данными литературы [7, 19, 26].
Совершенствование хирургической техники, в том числе рациональная последовательность анастомозов, позволило сократить время полной остановки кровообращения, в среднем, до 30 минут. Изолированная перфузии головы через правую плечевую артерию дала возможность ограничить гипотермию на уровне 20-22°С. Применение современных методик аутогемотрансфузии некоторым образом уменьшило остроту проблемы переливания донорской крови. В результате этих инноваций в последние годы заметно снизилась частота развития ПОН после операций на восходящем отделе и дуге аорты. Так, у последних 12 больных с вмешательством на восходящем отделе и дуге аорты, где упомянутые факторы риска были исключены с помощью вышеперечисленных технологий, мы не наблюдали ПОН, в то время как ранее ПОН с преобладанием недостаточности той или иной системы организма наблюдалась в 47,6% случаев (у 10 из 21 больных).
В группе операций на восходящем отделе аорты почечно-печеночная недостаточность и осложнения со стороны желудочно-кишечного тракта не превышали по частоте ту, которая обычно бывает после операций с ИК. В группе операций на восходящем отделе и дуге аорты дистресс-синдром легких, почечно-печеночная недостаточность и желудочно-кишечные кровотечения встречались только в контексте полиорганной недостаточности. Структура осложнений в ближайшем послеоперационном периоде в обеих исследуемых группах представлена в табл. 8.
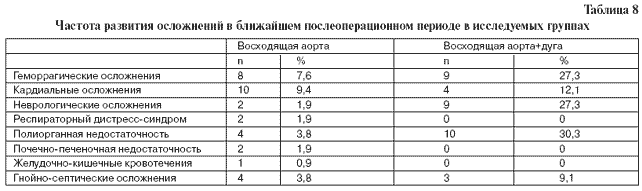
Следует отметить, что полиорганная недостаточность была чаще завершающим моментом, чем это представлено в таблице структуры госпитальной летальности, однако мы намеренно выделили те пусковые осложнения, которые приводили к необратимым изменениям в организме.
Детальный анализ результатов ближайшего послеоперационного периода показал, что самой частой причиной летальности и тяжелых осложнений среди наших больных была неконтролируемая кровопотеря во время операции и в ближайшем послеоперационном периоде. Геморрагические осложнения приводили к наиболее стойким нарушениям гомеостаза и микроциркуляции. С неми можно было связать большинство случаев развития полиорганной недостаточности, респираторного дистресс-синдрома, синдрома диссеминированного внутрисосудистого свертывания крови и, в конечном счете, летальных исходов.
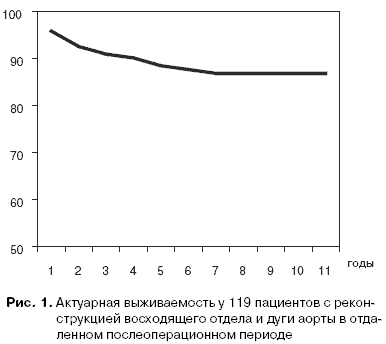
За 124 выжившими пациентами проводилось динамическое наблюдение в сроки от 28 до 128 месяцев. В среднем, оно составило 56±4,2 мес. Пять больных были утеряны из наблюдения, судьба их неизвестна. С остальными 119 осуществляется постоянная связь с помощью переписки, телефонных переговоров, а также посредством приглашения их в РНЦХ для обследования и коррекции проводимой терапии. В отдаленном периоде наблюдения умерло 16 человек, то есть уровень летальности составил 12,9%. Общая актуарная кривая выживаемости для обеих групп представлена на рис. 1. В соответствии с актуарным методом оценки отдаленной выживаемости, к пятому году она составила 88,5%, а к десятому году – 86,9%.
Структура летальности в отдаленном послеоперационном периоде имела свои особенности. Самой частой причиной смерти в отдаленном периоде наблюдения были септические осложнения на фоне протезного аортита и эндокардита – шесть человек.
Причем, состояние этих больных нельзя было классифицировать как вялотекущий сепсис, так как при выписке у них не было никаких признаков воспалительного процесса в организме. Развитие инфекционного протезного аортита происходило самостоятельно и позднее выписки из стационара. Можно предположить, что причиной последующего сепсиса является сочетание парапротезной гематомы и иммунного дефицита, полученного вследствие шокового состояния, связанного с самой патологией или операцией.
Согласно данным литературы, отсроченные септические осложнения являются свойственными и для многоопытных западных и отечественных клиник. Описаны случаи, когда у больных, удачно перенесших операцию Cabrol или Bentall – De Bono год и более назад, приступивших к активной жизни и работе, на фоне полного выздоровления разворачивалась картина сепсиса, и дальнейшее обследование выявляло нагноение парапротезного пространства, протезный эндокардит в области фиброзного кольца аортального клапана или гнойный аортит в области анастомозов [27, 28].
Следующей по частоте причиной смерти в отдаленном периоде был разрыв аорты на фоне продолжавшегося расслоения – пятеро больных. Четверо из них относились к группе вмешательства только на восходящем отделе аорты, один – к группе с протезированием и дуги аорты. Но у всех этих больных с отсроченным разрывом аорты этиологическим фактором расслоения или аневризмы аорты был синдром Марфана. Двое больных умерли от застойной сердечной недостаточности на первом и втором году после операции. Можно отметить, что в обоих случаях до операции наблюдалась кардиомегалия за счет резкой дилатации полости левого желудочка вследствие длительно существующей аортальной недостаточности.
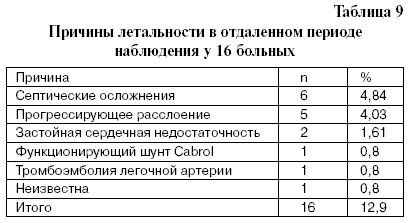
Один больной умер на 3-м году из-за развития парапротезной фистулы и возобновления функционирования шунта Cabrol. Исходное состояние пациента было крайне тяжелым вследствие остро развившегося массивного лево-правого сброса, и повторная операция оказалась безуспешной. Еще один пациент умер на 3 году после операции от массивной эмболии в легочную артерию. Структура летальности в отдаленный период наблюдения представлена в табл. 9.
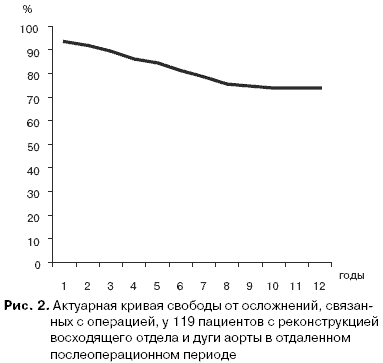
Большинство нелетальных осложнений в отдаленном послеоперационном периоде были связаны с вторичной патологией, формирующейся в парапрoтезном пространстве в области коронарных анастомозов. Как отмечалось выше, после операции протезирования корня аорты по методу Bentall возможно развитие ложных аневризм коронарных соустьев, что мы наблюдали у двух человек. В некоторых случаях создается устойчивое движение крови из парапротезного пространства, куда она поступает из аорты разными способами, в ушко правого предсердия, то есть формируется функционирующий шунт Cabrol. Однако, чаще всего, в области парапротезного пространства накапливается гематома, которая приводит к длительной гипертермии, а в последующем может быть инфицирована и статьпричиной описанных выше фатальных септических осложнений. Следует особо отметить, что те больные, у которых была применена техника «кнопки» для формирования соустий между протезом аорты и коронарными артериями не имели каких-либо осложнений, связанных с коронарными анастомозами. Данные о несмертельных осложнениях в отдаленном периоде наблюдения у 119 выписавшихся пациентов представлены в табл. 10. На рис. 2 представлена актуарная кривая свободы от всех осложнений, связанных с операцией, у 119 пациентов, выписавшихся из РНЦХ после реконструкции восходящего отдела и дуги аорты. Из графика видно, что к 12 году наблюдения от осложнений были свободны 73,77% наблюдаемых. Эти данные сопоставимы с результатами известных зарубежных клиник, где свобода от осложнений после операций на восходящем отделе и дуге аорты колеблется в пределах от 70% до 80% [19].

Выводы
1. При переходе расслоения с восходящего отдела на дугу аорты обязательным компонентом операции является ревизия всей внутренней поверхности дуги и начальных отделов нисходящей аорты, на основании чего принимается решение о выборе метода реконструкции дуги аорты.
2. При операциях на дуге аорты применимы три метода защиты головного мозга, которые, однако, обеспечивают разное ее качество и перечислены в порядке возрастания их эффективности: гипотермическая остановка кровообращения, ретроградная перфузия головного мозга в условиях гипотермической остановки кровообращения, антеградная перфузия головного мозга.
3. Главной причиной большинства тяжелых послеоперационных осложнений и, в конечном счете, летальных исходов были случаи неконтролируемой кровопотери, приводившей к серьезным нарушениям гомеостаза и микроциркуляции.
4. После операции «хобот слона» риск дальнейшего расслоения и разрыва аорты остается довольно высоким, поэтому второй этап протезирования аорты – протезирование ее торакоабдоминального отдела – должен
выполнятся в максимально короткие сроки после первого этапа, тем более что формирование проксимального анастомоза в операции Crawford значительно облегчено за счет имеющегося свободного конца протеза в просвете нисходящей аорты.
5. Пациенты, выписавшиеся после операции протезирования только восходящего отдела аорты или восходящего отдела и частичного протезирования дуги аорты, особенно на фоне врожденных дегенеративных процессов в ее стенке, должны ежегодно обследоваться в стационарах с целью своевременного выявления возможного дальнейшего расслоения аорты или увеличения ее диаметра, значительно повышающего риск разрыва аорты. Для этой цели одинаково хорошо подходят компьютерная и магниторезонансная томография.
Литература
1. Cooley DA, Ott DA, Frasier OH, Walker WE. Surgical treatment of aneurysms of transverse aortic arch: experience with 25 patients using hypothermic techniques.// Ann. Thorac. Surg. 32: 260-72, 1981.
2. Bingley JA, Gardner MA, Stafford EG, et al. Late complications of tissue glues in aortic surgery//Ann.Thorac. Surg. 69: 1764-8, 2000.
3. Cina CS, It SC, Clase CM, Bruin G. J. A cohort study of coagulation parameters and the use of blood products in surgery of the thoracic and thoracoabdominal aorta//Vasc. Surg. 33 (3):462-8, 2001.
4. Niederhauser U, Kaplan Z, Kunzli A, et al. Disadvantages of local repair in acute type A aortic dissection// Ann. Thorac. Surg. 66: 1592-9, 1998.
5. Satdhabudha O, Luengtaviboon K. Surgical management for type A aortic dissection: 38 cases experience in King Chulalongkorn Memorial Hospital: early result and longterm follow3up// J. Med. Assoc.Thai. 85 Suppl 1: S156-62, 2002.
6. Borst HG, Heineman MK, Stone CD: Surgical Treatment of Aortic Dissection. New York, “Churchill Livingstone Inc.”, 1996.
7. Safi HJ, Miller CC, Reardon MJ, et al. Operation for acute and chronic aortic dissection: recent outcome with regard to neurologic deficit and early death// Ann Thorac Surg; 66: 402-11, 1998.
8. Svensson LG, Crawford ES: Cardiovascular and Vascular Disease of the Aorta. Philadelphia, “W.B. Saunders Company”, 1997.
9. Константинов Б.А., Белов Ю.В., Соборов М.А. Аневризма аорты с аортальной недостаточностью: патоморфология и хирургическая тактика// Кардиология 1999; 11:4-8.
10 Белов Ю.В. Руководство по сосудистой хирургии с атласом оперативной техники. Москва, «Де Ново», 2000.
11. Bachet J, Goudot B, Dreyfus G, et al. Surgery of acute type A dissection: what have we learned during the past 25 years?// Z.Kardiol; 89 Suppl 7: 47-54, 2000.
12. Gelsomino S, Morocutti G, Frassani R, et al. Long3term results of Bentall composite aortic root replacement for ascending aortic aneurysms and dissections//Chest. 124: 984-8, 2003.
13. Kazui T,Washiyama N, Terada H, et al. Surgical treatment for proximal ascending aortic lesion in Marfan syndrome; retrospective evaluation of the initial surgical technique at late reoperation//Kyobu. Geka. 55 (8 Suppl): 633-8, 2002.
14. Crawford ES, Svensson LG, Coselli JS, et al. Surgical treatment of aneurysm and/or dissection of the ascending aorta, transverse aortic arch, and ascending aorta and transverse aortic arch. Factors influencing survival in 717 patients// J. Thorac. Cardivasc.Surg. 98: 659-74, 1989.
15. Tabayashi K, Fukujyu T, Turu Y, et al. Replacement of the ascending aorta and aortic valve with a composite graft: operative and longterm results//Tohoku J. Exp. Med. 184 (4): 257-66, 1998.
16. Fukada J, Morishita K, Kawaharada N, et al. Surgical treatment of cardiovascular manifestations of Marfan syndrome//Kyobu Geka;55 (8 Suppl): 658-62, 2002.
17. Kazui T, Washiyama N, Bashar AH, et al. Role of biologic glue repair of proximal aortic dissection in the development of early andmidterm redissection of the aortic root// Ann. Thorac. Surg. 75(3): 1063-4, 2003.
18. Pansini S, Gagliardotto PV, Pompei E, et al. Early and late risk factors in surgical treatment of acute type A aortic dissection// Ann. Thorac. Surg. 66: 779-84, 1998.
19. Hagl C, Ergin MA, Galla JD, et al. Neurological outcome after ascending aorta – aortic arch operations: effect of brain protection on high3risk patients //J. Thorac. Cardiovasc. Surg. 121: 1107- 21, 2001.
20. Ergin MA, O’Connor J, Guinto R, Griepp RB. Experience with profound hypothermia and circulatory arrest in the treatment of aneurysms of the aortic arch// J. Thorac. Cardiovasc. Surg. 84: 649- 655, 1982.
21. Ueda Y. Continuous retrograde cerebral perfusion: brain protection during aortic surgery with hypothermic circulatory arrest/In Kawada S., Ueda T., Shimizu H. (eds.): Cardio-aortic and aortic surgery. “Springer-Verlag”, pp 53359. Tokyo, 2001.
22. Aomi S, Ninama H, Nozi S. Surgery of the ascending aorta and/or aortic arch using deep hypothermic circulatory arrest with retrograde cerebral perfusion and open technique/In Kawada S., Ueda T., Shimizu (eds.): Cardio3aortic and aortic surgery. “Springer-Verlag”, pp 99-104. Tokyo, 2001.
23. Nakajama N, Masuda M, Nakaja M, et al. Brain protection with use of antegrade selective cerebral perfusion and aortic surgery/In Kawada S., Ueda T., Shimizu H. (eds.): Cardio-aortic and aortic surgery. “Springer-Verlag”, pp 44-52. Tokyo, 2001.
24. Aebert H, Reber D, Kobuch R, et al. Aortic arch surgery using moderate systemic hypothermia and antegrade cerebral perfusion via the right subclavian artery//Thorac. Cardiovasc. Surg. 49(5): 28-36, 2001.
25. Dossche KM, Schepens MA, Morshuis WJ, et al. Antegrade selective cerebral perfusion in operations on the proximal thoracic aorta//Ann. Thorac. Surg. 67(6): 1904310; discussion 1919-21, 1999.
26. Tasdemir O, Saritas A, Kucuker S, et al. Aortic arch repair with right brachial artery perfusion// Ann. Thorac. Surg; 73(6): 1837- 42, 2002.
27. Ergin MA, Griepp RB. Progress in treatment of aneurysms of aortic arch//World. J. Surg.4: 535-43, 1980.
28. Hetzer R, Knosalla C, Yankah C. The use of aortic allografts for surgical management of mycotic infections and aneurysms of the thoracic aorta/ In “Cardiac Valve Allografts” Yankah AC, Yacoub MH, Hetzer R. (eds.) p. 243-51, 1997.
29. Vogt PR, Turina MI. Cryopreserved aortic homografts for mycotic aneurysms and infected arterial grafts/In “Cardiac Valve Allografts” eds. Yankah AC, Yacoub MH, Hetzer R. p. 226-41, 1997.
Поступила 28/05/2004
Июль 2005 г.