Опубликовано в журнале:
»» №5 2002
РОЛЬ КОРРЕКЦИИ МЕТАБОЛИЗМА ОКСИДА АЗОТА В ОРГАНИЗМЕ ПРИ ПРОФИЛАКТИКЕ ГИПЕРТОНИЧЕСКОГО РЕМОДЕЛИРОВАНИЯ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
РОЛЬ КОРРЕКЦИИ МЕТАБОЛИЗМА ОКСИДА АЗОТА В ОРГАНИЗМЕ ПРИ ПРОФИЛАКТИКЕ ГИПЕРТОНИЧЕСКОГО РЕМОДЕЛИРОВАНИЯ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
Бувалъцев В.И., Машина С.Ю., Покидышев Д.А., Смирин Б.В., Вайда Л.А., Малышев И.Ю., Манухина Е.Б.
Научно-исследовательский институт общей патологии и патофизиологии РАМН, лаборатория регуляторных механизмов адаптации, лаборатория стресса и адаптации
Резюме
Проведено сравнительное изучение влияния профилактического введения двух бета-блокаторов с различным механизмом действия на морфо-функционалъные показатели сердечно-сосудистой системы у крыс линии SHRSP и их генетического контроля - крыс линии WKY. Изучались АД, концентрация нитратов и нитритов в плазме крови, эндотелий-зависимая релаксация сосудов, структурный компонент сосудистого сопротивления и индекс массы сердца в процессе хронического введения кардиоселективного бета-блокатора небиволола, обладающего способностью модулировать синтез NO в эндотелии сосудов, и кардиоселективного бета-блокатора метопролола, не обладающего таким действием. Выявлено более эффективное снижение АД, массы миокарда, нормализация нитратов и нитритов в крови, выраженное влияние на эндотелий-зависимую релаксацию сосудов и эффективное торможение ремоделирования сосудов при применении небиволола, по сравнению с метопрололом.
Ключевые слова: артериальная гипертония, небиволол, оксид азота, сердечно-сосудистое ремоделирование.
Требования к современной антигипертензивной терапии предусматривают эффективное воздействие не только на функциональные параметры гемодина-мики - уровень АД, ЧСС, периферическое сопротивление сосудов, но и тормозящее влияние на процессы структурной перестройки (ремоделирование) сердца и сосудов. Раскрытие роли локальных регуляторных факторов эндотелия - эндотелина, оксида азота (NO) - позволяют по-новому оценить возможности антигипертензивной терапии. Так, депрессия синтеза эндотелиального NO, мощного вазодилатирующего и вазопротекторного агента, как правило, наблюдающаяся у больных с развившейся артериальной гипертонией (АГ), может вносить вклад в прогрессирование АГ и ускорение ремоделирования сердечно-сосудистой системы [1]. Поэтому теоретически обоснованным представляется применение воздействий и лекарственных препаратов, стимулирующих синтез NO в эндотелии сосудов.
В этой связи особый интерес представляет изучение антиремоделирующих эффектов нового липо-фильного высококардиоселективного бета-блокатора небиволола, обладающего способностью модулировать синтез NO в эндотелии сосудов [2]. В литературе имеются клинические данные, показывающие, что небиволол стимулирует эндотелий-зависимое расслабление сосудов (ЭЗР) как при остром [3], так и при хроническом [4] применении. Однако, экспериментальных исследований для оценки NO-зави-симых механизмов антигипертензивного действия небиволола у животных проводилось мало. Между тем, небиволол, по-видимому, приобретает способность стимулировать синтез NO только после мета-болизирования в организме [5].
В связи с этим, цель настоящего исследования состояла в сравнительном изучении влияния на NO-за-висимые параметры сердечно-сосудистой системы у крыс со спонтанной гипертензией хронического введения двух липофильных кардиоселективных бета-блокаторов - небиволола, модулирующего синтез N0 в эндотелии сосудов, и метопролола, не влияющего на синтез NO.
Материал и методы
Эксперименты были проведены на самцах спонтанно-гипертензивных крыс, предрасположенных к инсульту (SHRSP) и самцах нормотензивных крыс линии Вистар-Киото (WKY), которые являются генетически родственным контролем к линии SHRSP.
Крысам вводили кардиоселективный липофильный b-адреноблокатор с NO-модулирующей активностью - небиволол (1,25 мг/кг, в/б) и препарат сравнения - кардиоселективный липофильный b-адреноблокатор метопролол (30 мг/кг, в/б) ежедневно в течение 10 недель. Введение препаратов начинали с возраста 5 недель, который соответствовал у SHRSP ранней гипертензивной стадии и заканчивали в возрасте 15 недель, который соответствовал у SHRSP стадии развившейся АГ. Курс введения препаратов составлял 5 и 10 недель. Каждая экспериментальная группа включала не менее 9 животных. Измерение АД проводилось у бодрствующих крыс непрямым бескровным методом на хвостовой артерии с помощью установки Physiograph DMP-4F (Narco Bio-Systems, USA).
Крыс забивали декапитацией через 24 часа после последнего введения препарата. Сразу после декапи-тации у крыс извлекали грудную аорту и очищали ее от окружающих тканей. Затем из аорты вырезали кольцевой препарат длиной 3,5 мм. Препарат помещали в термостатируемую (37oС) камеру, содержащую 30 мл раствора Кребса (130 мМ NaCl, 11 мМ глюкозы, 14,9 мМ NaHCO3, 4,7 мМ КС1, 2,5 мМ СаС12, 1,2 мМ MgSO4, 1,18 мМ КН2РО4, рН 7,4), который постоянно аэрировался смесью 95% О2 и 5% СО2. Период стабилизации составлял 60 мин при остаточным напряжении препарата 1,2г. Регистрацию напряжения проводили на двухканальном самописце (Ugo Basile, Italy). Сокращения аорты вызывали кумулятивным добавлением в камеру норадреналина (10-8 - 5x10-7 М). Эндотелий - зависимое расслабление вызывали ацетилхолином (10-8- 10-5 М) на фоне сокращения, вызванного норадреналином (5x10-7 M).
Продукция NO в организме оценивалась по суммарному содержанию в плазме метаболитов NO -нитритов и нитратов [6]. Во время декапитации производился забор крови с использованием гепарина в качестве антикоагулянта. Плазму получали центрифугированием цельной крови при 3000g в течение 15 мин и депротеинизировали путем добавления 1/ 20 объема ZnSO4 в концентрации 300 г/л. После центрифугирования при комнатной температуре (15 мин при 3000 g) в супернатанте проводили восстановление нитратов до нитритов с помощью реакторов Nitralyzer™ (World Precision Instruments, Inc. США) в присутствии 0,5М NH4OH, pH 9,0 в качестве буфера (отношение объема плазмы к объему буфера 9:1). После восстановления аликвоту плазмы смешивали с равным объемом реактива Грисса, инкубировали в течение 10 мин при комнатной температуре для развития окраски и измеряли интенсивность поглощения спектрофотометрически на 540 нм. Концентрацию нитритов определяли по калибровочной кривой (5-50 мкМ NaN02).
Показателем степени гипертрофии миокарда служил индекс массы сердца, который определяли как отношение массы сердца к массе тела в процентах.
Структурный компонент сосудистого сопротивления изучали на модели перфузии изолированного сосудистого бассейна задних конечностей в режиме постоянной объемной скорости потока перфузата через исследуемый орган с одновременной регистрацией перфузионного давления. Для этого после наркотизации нембуталом в брюшную аорту после предварительного наложения лигатуры на проксимальный отдел вводили канюлю, заполненную гепарином. Нижнюю полую вену перерезали для свободного оттока крови и раствора. Эксперименты проводили с использованием перистальтического насоса (LKB6 Швеция). Для измерения перфузионного давления к системе на входе в канюлю параллельно подключали мембранный датчик давления. Перфузию проводили раствором Кребса-Хензелейта следующего состава (мМ): NaCl - 118, КС1 - 4,7, СаС12 - 2,52, MgSO4 - 1,64, КН2РО4 - 1,18, NaHCO3 - 24,88, глюкоза - 10, рН 7,4. После отмывки сосудистого русла задних конечностей насос переводили на низкую скорость подачи раствора и дожидались полного расслабления сосудов и стабилизации регистрируемого перфузионного давления. После выхода давления на плато начинали ступенчатое повышение скорости подачи раствора, одновременно регистрируя значения перфузионного давления для каждого режима работы насоса. Отсутствие отека ткани документировали путем сравнения массы животного до и после эксперимента. Для последующих расчетов заднюю часть туловища (до уровня введения канюли) взвешивали отдельно. Для характеристики структурного компонента периферического сосудистого сопротивления кривые, отражающие зависимость перфузионного давления от объема раствора, прокачиваемого в единицу времени через 100 г ткани, строили отдельно для каждого животного, рассчитывали их уравнения и пересчитывали на стандартные координаты, а затем выводили усредненную кривую для каждой группы животных.
Результаты представлены как среднее ± S.Е.М. не менее, чем по 9 экспериментам в каждой серии. Статистическая обработка проводилась методами непараметрической статистики и с помощью парного t-критерия Стьюдента. Результаты считались достоверными при двустороннем уровне значимости р<0,05.
Результаты
Изучение динамики АД (рис. 1) показало, что в группе SHRSP, не получавших лечения, АД с возрастом увеличилось со 135±3,6 до 219+4,6 мм рт.ст. (р<0,05). Начатое на ранней гипертензивной стадии лечение замедлило развитие гипертензии. При этом гипотензивное действие метопролола было более выраженным после 5 недель, тогда как гипотензивное действие небиволола нарастало медленнее, но после 10 недель лечения оно оказалось достоверно более сильным, чем у метопролола. У нормотензивных крыс небиволол не оказывал достоверного влияния на нормальные показатели АД, тогда как метопролол после 10 недель введения несколько снизил его.
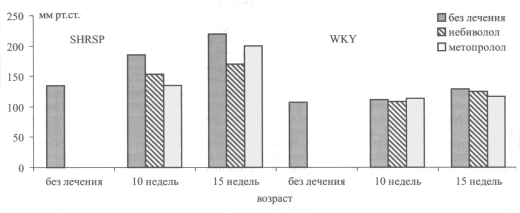
Рис. 1 Динамика АД в группах крыс SHRSP и WKY без лечения и на фоне небиволола и метопролола.
У 5-недельных SHRSP концентрация нитритов и нитратов в плазме не отличалась от WKY (рис. 2). К возрасту 10 и 15 недель у SHRSP она увеличивалась с 28,4±11,8 мкМ до 64,7±7,5 мкМ (р<0,05) и 68,8±7,5 мкМ (р<0,05), соответственно, тогда как у WKY, напротив, несколько снижалась по сравнению с 5-не-дельными животными. У SHRSP, которым в течение 5 и 10 недель вводили небиволол, уровень нитритов и нитратов в плазме не увеличился и сохранился на уровне 20,1±4,8 мкМ и 25,9±7,6 мкМ, соответственно. Эти показатели не отличались от таковых у WKY того же возраста, получавших небиволол В то же время, у SHRSP, получавших метопролол, уровень нитритов и нитратов в плазме после 5 недель введения оставался повышенным по сравнению с WKY и снизился только после 10 недель лечения.
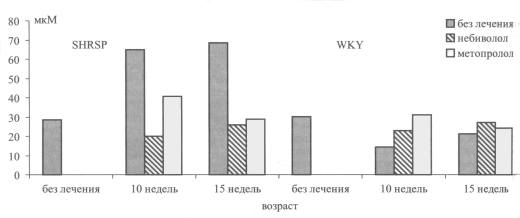
Рис 2. Динамика уровня нитратов/нитрттов в плазме крови у крыс SHRSP и WKY без лечения и на фоне небиволола и метопролола
На рис. 3 видно, что с возрастом у спонтанно-гипертензивных крыс развивается выраженная дисфункция эндотелия, которая проявляется в угнетении эндотелий-зависимого расслабления сосудов. Эндотелий-зависимое расслабление у нелеченных крыс линии WKY не претерпевало динамики до возраста 10 недель, однако к 15-недельному возрасту отмечено ее снижение (51,4±3,9% vs. 34,0±3,2%, р<0,05). Небиволол в значительной степени предупредил снижение этого показателя в обеих группах и даже достоверно улучшил его у SHRSP после 10 и 15 недель введения. У крыс, получавших метопролол, эндотелий-зависимое расслабление составило, соответственно, 30,3±0,6% и 23,5±0,7%. Таким образом, по показателю эндотелий-зависимого расслабления, эффект небиволола был более стойким, чем эффект метопролола.
Изучение индекса массы сердца (рис. 4) показывает, что гипертрофия миокарда развивалась у SHRSP к возрасту 15 недель. Показатель гипертрофии (процентное отношение массы сердца к массе тела животного) у SHRSP увеличился с 0,39±0,0075 до 0,5910,018 (р<0,05), тогда как у WKY любого возраста он не превышал 0,38. Как небиволол, так и метопролол, замедлили развитие гипертрофии, однако если у SHRSP, получавших небиволол в течение 15 недель, этот показатель не отличался от контроля (0,31 vs. 0,38), то у получавших метопролол он оставался повышенным (0,43±0,024). В группах нор-мотензивных крыс существенной динамики индекса массы сердца не выявлено ни в группе контроля, ни на фоне введения бета-блокаторов.
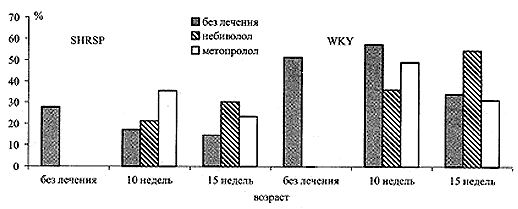
Рис. 3 Динамика эндотелий-зависимого расслабления аорты крыс без лечения и на фоне небиволола и метопролола.
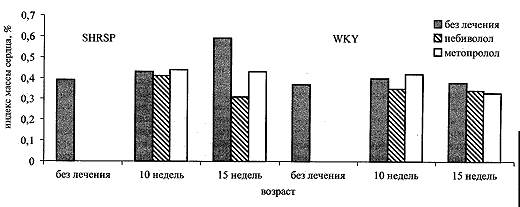
Рис 4. Динамика индекса массы сердца у крысс SHRPS и WKY без лечения и на фыоне небиволола и метопролола
На рис. 5 видно, что структурный компонент сопротивления сосудистого бассейна, отражающий ремоделирование сосуда, у SHRSP с возрастом значительно увеличивался, о чем свидетельствует сдвиг кривой "расход-давление" в область более высоких значений давления. Лечение метопрололом и небиволом достоверно ограничивало увеличение структурного компонента. Этот эффект был больше выражен для небиволола. Эта закономерность сохранялась как после 5, так и после 10 недель введения препаратов. У WKY возрастные изменения структурного компонента сосудистого сопротивления практически отсутствовали. Метопролол и небиволол не оказывали достоверного влияния на этот показатель.
Таким образом, небиволол оказывает более эффективное антигипертензивное действие, чем препарат сравнения - (b-блокатор метопролол и более эффективно предупреждает NO-зависимые нарушения, сопровождающие гипертензию, развитие гипертрофии миокарда и ремоделирование сосудистого русла.
Обсуждение результатов
За последние годы накопилось достаточно оснований полагать, что дисфункция эндотелия (ДЭ) и дефицит эндотелиального синтеза NO, являются не только ранним маркером сосудистого поражения при АГ и атеросклерозе, но также вносят существенный вклад в формирование и прогрессирование АГ [1,7]. Надо отметить, что даже успешная антигипертензивная терапия далеко не всегда приводит к нормализации эндотелий-зависимого расслабления сосудов [8]. Поэтому предпочтительными являются лекарственные препараты, способные не только снизить АД, но и корректировать ДЭ, как ключевое и раннее звено в патогенезе АГ.
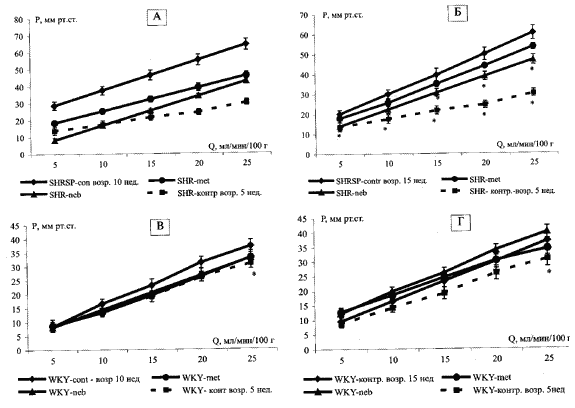
Рис. 5 Влияние метопролола и небиволола на структурный компонент сопротивления сосудистого русла.
А — курс лечения SHRSP 5 недель, Б — курс лечения SHRSP 10 недель, В — курс лечения WKY 5недель,
Г — курс лечения WKY 10 недель.Примечание: по оси абсцисс — расход перфузионного раствора (Q), по оси ординат — перфузионное давление (Р); * - достоверные отличия от контрольных крыс соответствующего возраста, не получавших лечения.
Бета-адреноблокаторы широко используются в клинике для лечения АГ, сердечной недостаточности и ишемической болезни сердца. Как результат эволюции класса (b-блокаторов, за последние годы в клиническую практику внедрены новые b-блокаторы третьего поколения, различающиеся не только своими фармакологическими особенностями, но и обладающие дополнительными вазодилататорными свойствами [9]. При этом механизмы вазодилатации у этих препаратов различны — от альфа-адреноблокады у карведилола и внутренней симпато-миметической активности у бусиндолола и целип-ролола, до модуляции синтеза NO в эндотелии сосудов у небиволола [3].
Именно свойство напрямую модулировать синтез NO в эндотелии принципиально отличает небиволол от большинства антигипертензивных препаратов и значительно расширяет спектр защитных эффектов небиволола, поскольку функция NO в организме не сводится только к его прямому вазо-дилататорному и гипотензивному действию. Так, исследования показали, что, благодаря коррекции синтеза NO в организме, небиволол тормозит агрегацию тромбоцитов [10], повышает чувствительность клеток к инсулину [11] и предупреждает пролиферацию сосудистых гладкомышечных клеток [12]. Все эти свойства небиволола не связаны с b-блокирующим действием и составляют его преимущества перед другими b-адреноблокаторами.
В настоящем исследовании антигипертензивное действие небиволола в дозе, не оказывающей влияния на АД у нормотензивных крыс, после 5 недель лечения было менее выраженным, чем у препарата сравнения метопролола. Однако, при дальнейшем введении оно усиливалось и к концу эксперимента АД у SHRSP, получавших небиволол, было достоверно ниже, чем у крыс, получавших метопролол, хотя ме-топролол, в отличие от небиволола, достоверно снизил АД не только у спонтанно-гипертензивных, но и у нормотензивных крыс. Таким образом, длительное применение небиволола снижает высокое АД и не влияет на нормальные показатели АД.
Для SHRSP характерно быстрое развитие дисфункции эндотелия, которая, по некоторым данным, возникает даже раньше, чем повышение АД [13]. В наших экспериментах эндотелий-зависимое расслабление (ЭЗР) аорты SHRSP уже на ранней гипертензивной стадии достоверно отличалось от показателя у WKY. Небиволол предупредил угнетение ЭЗР, причем после 10 недель введения небиволола показатель у SHRSP практически не отличался от такового у интактных WKY того же возраста. У WKY небиволол также ограничил возрастное ослабление функции эндотелия, которое наблюдалось у 15-недельных животных.
Метопролол после 10 и 15 недель введения также оказал достоверное благоприятное действие на ЭЗР аорты, хотя его эффект был выражен значительно слабее, чем у небиволола. По-видимому, эффект метопролола можно объяснить тем, что любое долговременное снижение АД, независимо от вызвавшей его причины, частично улучшает эндотелий-зависимое расслабление сосудов [14].
Дисфункция эндотелия у SHRSP сопровождалась достоверным усилением суммарной продукции NO в организме, которое проявлялось в повышенной концентрации в плазме стабильных метаболитов NO — нитритов и нитратов. Аналогичные данные были получены и другими авторами [14]. Такое, на первый взгляд, парадоксальное сочетание снижения NO-за-висимой функции эндотелия и усиления общего синтеза NO в организме объясняется тем, что для крыс со спонтанной гипертензией характерно одновременное ослабление активности и экспрессии белка eNOS в эндотелии и высокая активность iNOS, которая появляется у этих крыс в сосудистой гладкой мышце и макрофагах на ранней гипертензивной стадии [14,15].
Избыток NO в гладкой мышце подавляет активность eNOS и прямо повреждает эндотелиальные клетки за счет угнетения дыхания митохондрий и синтеза ДНК [14]. В результате продукция эндотелиаль-ного NO прогрессивно падает, что вносит большой вклад в развитие дисфункции эндотелия и рост АД. Поскольку iNOS продуцирует NO в количествах, на несколько порядков превышающих продукцию NO eNOS, то в условиях индукции iNOS изменения уровня NO в плазме отражают интенсивность синтеза NO именно индуцибельной изоформой NOS, которая в норме в сосудистой стенке отсутствует [16].
В настоящих экспериментах небиволол уже после 5 недель введения полностью предупредил гиперпродукцию NO у SHRSP, причем этот эффект сохранялся на протяжении всего курса лечения небивололом. Нормализующее действие метопролола проявлялось значительно позже и было менее выраженным. По-видимому, это преимущество небиволола было связано с его стимулирующим действием на eNOS. Хорошо известно, что умеренное повышение в организме уровня NO, независимо от источника этого фактора, эффективно предупреждает гиперпродукцию NO и связанные с ней повреждения. В основе этого эффекта может лежать как механизм отрицательной обратной связи, т.е. ограничение активности iNOS самим NO, так и NO-зависимая индукция вторичных протекторных факторов — антиоксидантов, стресс-белков и т.д. [17, 18, 19]. Такой механизм, по-видимому, опосредует также антигипертензивное действие нефармакологических физических факторов, стимулирующих экспрессию гена и активность фермента eNOS — например, адаптации к гипоксии [20], адаптации к физической нагрузке [21] и т.д.
В наших экспериментах у SHRSP, по мере роста АД, наблюдалось нарастание структурного компонента периферического сосудистого сопротивления. Эн-дотелиальный NO считается одним из ведущих факторов сохранения нормальной структуры сосудистой стенки не только благодаря его мощному вазодила-таторному действию, но и благодаря антипролифера-тивному действию, ингибированию агрегации тромбоцитов и адгезии лейкоцитов к эндотелию. Небиволол быстрее и эффективнее, чем метопролол, предупреждал сдвиг вверх кривой "расход-перфузионное давление", который отражает структурный компонент сопротивления, т.е. толщину стенки периферических резистивных сосудов. Действительно, именно процесс утолщения сосудистой стенки инициируется при хроническом ингибировании NOS даже в условиях компенсации повышения АД и, следовательно, является NO-зависимым [22]. Поэтому стимулирование eNOS небивололом может предупредить патологическое ремоделирование сосудов.
В клинических исследованиях было показано, что гипертрофия сердца обратима под действием b1-блокаторов, в частности, метопролола, однако этот процесс протекает очень медленно, и эффект быстро исчезает после отмены препарата [23, 24]. Исследований по профилактическому действию bl-адреноблокаторов, а также по влиянию стимулирования эндогенной продукции NO на гипертрофию миокарда при гипертензии ранее не проводилось. Гипертрофия миокарда, которая закономерно обнаруживается при развившейся стойкой гипертензии, представляет собой результат взаимодействия между хронической гемодинамической перегрузкой и негемодинамическими факторами, важнейшим из которых является NO [25]. NO предупреждает гипертрофию сердца за счет гемодинамической разгрузки сердца, снижая тонус артерий и постнагрузку, а также за счет венодилатации, уменьшая преднагрузку. Дополнительный вклад в защитное действие NO против развития гипертрофии вносит его антипро-лиферативный эффект [26].
Нам удалось предупредить увеличение массы сердца у SHRSP с помощью небиволола и метопролола, хотя эффективность этих препаратов различалась. Гипертрофия миокарда обнаруживалась у SHRSP только в возрасте 15 недель. Оба b-адреноблокатора не влияли на нормальную массу сердца крыс. При этом, профилактическое действие небиволола оказалось более выраженным, чем действие метопролола, что, возможно, связано с NO-стимулирующим действием небиволола
В целом полученные в настоящей работе данные показывают, что небиволол более эффективно, чем метопролол, снижает АД и сосудистое сопротивление у крыс с экспериментальной гипертензией. В отличие от метопролола, небиволол препятствует развитию дисфункции эндотелия. Наконец, небиволол эффективнее, чем метопролол, предупреждает ремоделирование сосудистой стенки и сердца.
При гипертензии прогноз определяется степенью поражения органов-мишеней, важнейшими из которых являются сердце и сосуды. По-видимому, способность небиволола стимулировать синтез NO в эндотелии позволяет улучшить результаты лечения за счет дополнительного вазопротекторного и кардиопротекторного действия этого препарата и, тем самым, обеспечивает его значительные преимущества перед уже ставшим классическим метопрололом. Кроме того, согласно данным клинических испытаний, по своему профилю эффективности и безопасности небиволол также обладает значительными преимуществами перед другими р-блокаторами [27]. Можно предположить, что в дальнейших исследованиях будут выявлены и другие свойства небиволола, связанные с его положительным влиянием на синтез эндотелиального NO. Но уже сейчас очевидно, что это направление антигипертензивной терапии расширяет ее возможности и является перспективным.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (гранты 00-04-4808, 00-04-488086 01-04-48699) и Московского комитета по науке и технологии (грант 1-1-133).
Литература
1. Frohlich ED, Tarazi RC. Is arterial pressure the sole factor responsible for hypertensive cardiac hypertrophy? Amer. J. Cardiol. 1979; V.44, P.959-963.
2. Parenti A; Filippi S; Amerini S et al. Inositol phosphate metabolism and nitric-oxide synthase activity in endothelial cells are involved in the vasorelaxant activity of nebivolol. J. Pharmacol. Exp. Ther. 2000, 292(2):698-703
3. Ritter JM Nebivolol: endothelium-mediated vasodilating effect. J. Cardiovasc. Pharmacol. 2001, Suppl. 3:813-16.
4. Tzemos N, Lim PO, MacDonald TM. Nebivolol reverses endothelial dysfunction in essential hypertension: a randomized, double-blind, crossover study. Circulation, 2001 104(5):511-514.
5. Breeders MA, Doevendans PA, Bekkers ВС, et al.. Nebivolol: a third-generation beta-blocker that augments vascular nitric oxide release: endothelial beta(2)-adrenergic receptor-mediated nitric oxide production. Circulation 2000, 102(6):677-684.
6. Moshage H., Kok В., Huzenga R., Jansen P. Nitrite and nitrate determination in plasma: A critical evaluation. // Clin. Chem. 1995. V. 41. P. 892-896.
7. Puddu P., Puddu G.M., Zaca R, Muscari A. Endothelial dysfunction in hypertension. Acta Cardiol., 2000,55:221-232.
8. Taddei S, Virdis A, Ghiadoni L et al. Effects of antihypertensive drugs on endothelial dysfunction: clinical implications. Drugs 2002; 62(2):265-284
9. Goldstein S. Beta-bloicking drugs and coronary heart disease. Cardiovasc. Drugs Then, 1997, ll(suppl l):219-225.
10. Falciani M, Rinaldi B, D'Agostino В et al. Effects of nebivolol on human platelet aggregation. J. Cardiovasc. Pharmacol. 2001 38(6):922-929.
11. Poirier L, Cleroux J, Nadeau A, Lacourciere Y. Effects of nebivolol and atenolol on insulin sensitivity and haemodynamics in hypertensive patients. J. Hypertens 2001, 19(8): 1429-1435
12. Brehm BR, Wolf SC, Bertsch D et al. Effects of nebivolol on proliferation and apoptosis of human coronary artery smooth muscle and endothelial cells. Cardiovasc. Res. 2001 Feb l;49(2):430-439.
13. Radaelli A, Mircoli L, Mori I et al. Nitric oxide-dependent vasodilation in young spontaneously hypertensive rats. // Hypertension. 1998. V. 32. P. 735-739.
14. Wu CC, Yen MH. Nitric oxide synthase in spontaneously hypertensive rats. Biomed. Sci. 1997. V. 4. P. 249-255.
15. Chou TC, Yen MH, Ding YA. Alterations of nitric oxide synthesis with aging and hypertension in rats. // Hypertension. 1998. V. 31. P. 643-648.
16. Li H, Forstermann U. Nitric oxide in the pathogenesis of vascular disease. J. Pathol., 2000, 90: 244-254.
17. Colasanti M., Hisanori S. The dual personality of NO. TIPS, 2000, 21: 249-252.
18. Muller В., Kleschyov A.L., Gyorgy J.C., Stoclet J.C. Inducible NO synthase activity in blood vessels and heart: new insight into cell origin and consequences. Physiol. Res., 2000, 49: 19-26.
19. Малышев И.Ю., Манухина Е.Б. Стресс, адаптация и оксид азота. Биохимия, 1998, т.63,вып. 7, с. 992-1006.
20. Машина С.Ю., Смирин Б.В., Покидышев Д.А. и др. Роль предупреждения дефицита оксида азота в антигипертен-зивном эффекте адаптации к гипоксии. Известия АН. Серия биол., 2001, № 5, 579-587.
21. Tanaka H., Bassett D.R., Howley E.T. et al. Swimming training lowers the resting blood pressure in individuals with hypertension. //J. Hypertens. -1997.-V.15 P.651-657.
22. Nimaguchi K., Egashira K., Takemoto M. et al. Chronic inhibition of nitric oxide synthesis causes coronary microvascular remodeling in rats. Hypertension, 1995, 26: 957-962.
23. Franz IW, Ketelhut R, Behr U, Tonnesmann U.J. Time course of reduction in left ventricular mass during long-term antihypertensive therapy. Hum. Hypertens. 1994, 8:191-198
24. Schobel HP, Langenfeld M, Gatzka C, Schmieder RE. Treatment and post-treatment effects of alpha- versus beta-receptor blockers on left ventricular structure and function in essential hypertension. Am. Heart J., 1996,132:1004-1009
25. L.Raij, H.Hayakawa. Blood pressure, endothelial dysfunction and target organ injury. Eur. Heart J. \foll (Suppl. L), 1999, L44-L49.
26. Simko R, Simko J. The potential role of nitric oxide in the hypertrophic growth of the left ventricle. Physiol. Res., 2000, 49: 37-46.
27. Pessina A.C. Metabolic effects and safety profile of nebivolol. J. Cardiovasc. Pharmacol. 2001 38 Suppl. 3:833-35.Abstract
Comparative study of preventive effects of two beta-blocking drugs with different mode of action was performed on SHRSP and WKY rats. Morphological and functional parameters — blood pressure, endothelium-dependent vascular relaxation, plasma level of nitric oxide stable metabolites (nitrite/nitrate), cardiac hyperthrophy and vascular remodeling were monitored during chronic nebivolol and metoprolol injection in parallel groups of rats. Nebivolol, a cardioselective beta-blocker with ancillary nitric oxide modulating and vasodilatingproperties exhibited more significant and stable influence on the monitored parameters than metoprolol lacking the nitric oxide modulating activity and more effectively prevented cardiovascular remodeling in experimental hypertension.
Key words: arterial hypertension, nebivolol, nitric oxide, cardiovascular remodeling.
Поступила 17/09-2002
| Февраль 2003 г. |