№ 4'98
ЗНАЧЕНИЕ БИОЛОГИЧЕСКИХ ИНДИКАТОРОВ ДЛЯ ОЦЕНКИ ЭФФЕКТИВНОСТИ СТЕРИЛИЗАЦИИ
Материалы Второго научного симпозиума по значению биологических индикаторов
для контроля стерилизации, состоявшегося в Москве 09 декабря 1998 г.
М.И. Леви, Ю.Г. Сучков, В.Я. Бессонова, Ю.С. Зуева, В.Г. Слизкова,
М.М. Лившиц, Н.Н. Панкова, Г.И. Рубан, С.М. Савенко, А.П. Митюков, И.И.
Корнев, А.И. Воронков
Испытательный лабораторный центр МГЦД, КБ УД Президента РФ,
Московская медицинская академия им. Сеченова, ЦКБ МЦ УД Президента
РФ
Для расчета среднего значения числа жизнеспособных спор,
приходящихся на один биологический индикатор, целесообразно воспользоваться
распределением Пуассона. Линейный характер зависимости логарифма числа
жизнеспособных клеток от времени стерилизации не подтверждается результатами
экспериментов. Использование в экспериментах по контролю стерилизации значительного
числа биологических индикаторов, высокоинформативной питательной среды
и длительных сроков культивирования биологических индикаторов позволило
обнаруживать в них жизнеспособные споры после стерилизации чаще, чем обычно
и практически при всех употребляющихся в практике режимах. Высевы содержимого
биологических индикаторов после стерилизации на плотную питательную среду
подтвердили соответствие распределения чашек Петри по числу выросших колоний
распределению Пуассона, а это означает случайное и изолированное распределение
жизнеспособных спор в биологических индикаторах. В некоторых экспериментах
число биологических индикаторов с жизнеспособными спорами после относительно
длительных сроков стерилизации превышало число таковых после коротких сроков
стерилизации, что не находило себе объяснения в рамках принятых представлений
о стерилизации. Мы предположили, что стерилизация представляет собой затухающий
волнообразный автоколебательный процесс, это и составляет сущность зависимости
логарифма числа жизнеспособных спор в биологических индикаторах от времени
стерилизации.
Контроль стерилизаторов, эксплуатируемых в лечебных учреждениях
Москвы, показал, что во всех случаях остаются биологические индикаторы,
содержавшие жизнеспособные споры после стерилизации. Рекомендованная в
стандартах вероятность неудовлетворительных результатов анализа биологических
индикаторов (10-6) значительно меньше той, которая достигнута
в наших исследованиях.
Экспериментальная паровая стерилизация отрезков трубочек
из синтетических материалов после предстерилизационной очистки сопровождалась
неблагоприятными результатами, аналогичными тем, которые были получены
с биологическими индикаторами.
Число жизнеспособных спор в биологическом индикаторе
после стерилизации является вероятностной величиной, а их обнаружение зависит
от числа индикаторов в стерилизационной камере, качества питательной среды
и длительности культивирования при подходящей температуре.
Адекватным инструментом оценки эффективности стерилизации являются биологические
индикаторы, которые в значительной мере имитируют обсемененные микроорганизмами
медицинские изделия, подвергающиеся стерилизации. Последняя избыточна в
том смысле, что она рассчитана на уничтожение такого количества микробов,
которые обычно на изделиях не обнаруживают, но которые в принципе хоть
и в редких случаях исключить нельзя [11, 18, 19]. Поэтому биологические
индикаторы содержат устойчивые к стерилизующему агенту споры в количестве
на 2-3 порядка выше того количества, которое обычно встречается на стерилизуемых
изделиях [4, 23]. Такой подход диктуется массовым применением стерилизации
в медицинской практике и необходимостью исключения риска заражения больных
и здоровых за счет неэффективной стерилизации.
В связи с тем, что большинство исследователей придерживается убеждения,
что логарифм числа микроорганизмов в биологическом индикаторе или на медицинских
изделиях является линейной функцией времени стерилизации, то временные
рамки могут быть рассчитаны с достаточной определенностью [23, 24]. К настоящему
времени в практике применяются несколько видов стерилизации - паровая,
горячевоздушная, газовая, радиационная, лучевая и некоторые другие. Известны
крупные производители стерилизационной аппаратуры - "МММ", "Луки", "Джонсон
и Джонсон" и др.
Мы задались целью определить оптимальные условия для применения биологических
индикаторов в процессе стерилизации. Основным объектом исследований явились
биологические индикаторы для оценки паровой стерилизации. Биологические
индикаторы готовились и оценивались в нашей лаборатории в соответствии
с принятыми нормами [4, 10, 12, 16, 22]. Методические особенности настоящего
исследования описаны в ходе изложения полученных результатов.
Всякий раз, когда готовится очередная партия спор Bacillus stearothermophilus
для биологических индикаторов, контролирующих паровую стерилизацию, испытывают
их термоустойчивость. Требуется, чтобы готовые биологические индикаторы
(примерно 106 спор в индикаторе) содержали жизнеспособные споры
после 5-минутной паровой стерилизации при 120-121оС, но после
15 минутной стерилизации при указанных условиях таковых не содержали. Производственные
серии биологических индикаторов, которые выпускает наше учреждение, отвечают
этим требованиям. Наш опыт охватывает уже свыше 70 производственных серий
спор В. stearothermophilus, из которых были изготовлены миллионы биологических
индикаторов. Каждую серию биологических индикаторов неоднократно проверяли
на термоустойчивость, в связи с чем накопился изрядный материал. Мы смогли
убедиться в том, что к 15 минутам пребывания в автоклаве при 121оС
обычно жизнеспособные споры в биологических индикаторах не обнаруживаются,
однако в редких случаях из 10 индикаторов (как правило, такое число индикаторов
брали на одну экспозицию) 1 или 2 теста содержали живые споры.
В международных стандартах рекомендуется для определения числа спор
в биологических индикаторах после разных экспозиций при 120-121оС
производить высевы содержимого индикаторов на плотную питательную среду,
а затем культивировать в термостате и подсчитывать число колоний. Такую
методику рекомендуют для тех экспозиций, где предполагается обнаружить
число колониеобразующих единиц (КОЕ) больше 50 и меньше 1000 [20].
Для тех экспозиций, при которых предполагается среднее число спор в
биологическом индикаторе менее 1 (то есть не в каждом индикаторе будут
обнаружены жизнеспособные споры), рекомендовано использовать для подсчетов
распределение редких и случайных событий - распределение Пуассона [7, 11,
20].
Ниже приведен способ применения распределения Пуассона для указанных
целей.
Рх= e-m * mx/x!
где Рх - доля биологических индикаторов с конкретным числом
жизнеспособных спор х;
х - конкретное число спор в индикаторе;
х! - произведение целых чисел в последовательности х (х-1) (х-2)...[х-(х-1)];
m - среднее число спор в группе биологических индикаторов;
е - экспонента.
Если некоторое число биологических индикаторов не содержит жизнеспособных
спор (х = 0), тогда
P0= k/n,
где k - число биологических индикаторов, не содержащих живые споры;
n - число биологических индикаторов в группе.
Прологарифмируем приведенное уравнение распределения Пуассона:
ln Рх= ln (e-m * mx/x!).
Учитывая, что 0! = 1, а m0 = 1, то (ln k - ln n) = -m; m
= ln n - ln k.
Иными словами, среднее число спор на один биологический индикатор в
группе равно разности натуральных логарифмов числа всех биологических индикаторов
и числа биологических индикаторов без живых спор. Справедливость приведенного
способа определения среднего числа спор на один биологический индикатор
подтверждается высевами на агар (рис. 8).

Рис. 8. Результаты испытания биологических индикаторов
со спорами, высушенными на хроматографической бумаге (106 спора
биологическом индикаторе, паровая стерилизация 121оС - 45 мин.,
индикатор типа Attest). По оси ординат - число биологических индикаторов.
Левый столбик - результаты испытаний для обычных биологических индикаторов,
правый - для биологических индикаторов с новой питательной средой. Заштрихованная
часть столбиков - число биологических индикаторов с жизнеспособными спорами.
Приводим пример расчетов. В стерилизационную камеру поместили 20 биологических
индикаторов, а после экспозиции в каждый биологический индикатор прилили
цветную питательную среду (используемые в нашей лаборатории серии питательной
среды реагировали изменением цвета на присутствие единичных живых спор
в биологическом индикаторе при культивировании в термостате при 55oС)
[6, 9, 10, 27, 29]. Из 20 использованных в примере биологических индикаторов
изменение сиреневого цвета питательной среды на желтый отмечено в 14, а
в 6 индикаторах цвет среды остался прежним после культивирования в термостате.
Отсюда m = (ln 20 - ln 6) = 2,996 - 1,792 = 1,204. Теперь если мы хотим
включить эту величину m в систему координат десятичного логарифма числа
спор в биологических индикаторах и времени необходимо взять lg m = lg 1,204
= 0,081.
При многочисленных определениях термоустойчивости спор изредка наблюдалось
такое явление, когда 1-2 биологических индикатора из 10 содержали жизнеспособные
споры после 15-минутного автоклавирования. В некоторых экспериментах мы
расширили набор экспозиций, включив экспозиции в 20, 25, 30 и 35 мин. автоклавирования.
В некоторых, хотя и редких случаях, мы отмечали существование живых спор
в биологических индикаторах и после относительно длительных экспозиций
автоклавирования. Трактовка подобных неожиданных результатов как случайных
не могла быть признана правомочной, так как не имела объяснений. Наиболее
правдоподобным выглядело предположение о существовании в популяции спор
термоустойчивых особей, которые поэтому остаются жизнеспособными после
длительных экспозиций. Однако это предположение не подтвердилось, так как
потомство спор из пожелтевших биологических индикаторов после 20-40 - минутного
автоклавирования обладали термоустойчивостью того же уровня, что и исходная
взвесь спор [11, 23].
К описанной проблеме прибавилась и другая, связанная с сомнениями в
линейной зависимости логарифма числа спор в биологическом индикаторе от
времени стерилизации [11, 17, 24]. Складывалось впечатление, что если и
наблюдается линейная зависимость, то она проявляется лишь на отдельных
участках графика. Что касается сроков изменения окраски питательной среды
в биологических индикаторах после автоклавирования, то в практической деятельности
они ограничивались 48 часами (такой срок рекомендован в инструкциях, имеющих
хождение в России, США и европейских странах, хотя еще 10 лет тому назад,
когда не использовались цветные среды, наблюдение за появлением мутности
в питательном бульоне длилось не менее 7 дней). Однако в наших экспериментах
было замечено, что изменение цвета питательной среды при культивировании
в термостате наступает не только в первые 48 час., но и в последующие дни,
особенно в тех биологических индикаторах, которые относительно долго пребывали
в стерилизационной камере.
Если в прежние годы мы использовали в качестве носителя спор инсулиновые
флаконы, то в последнее время перешли на пробирки Эппендорфа из полипропилена
емкостью 1,5 мл [8, 9, 10, 11]. Эта емкость оказалась гораздо удобнее в
качестве носителя спор, чем инсулиновые флаконы.
Учитывая все вышесказанное, мы решили применить в настоящем исследовании
биологические индикаторы, приготовленные следующим образом. Взвесь спор,
которую мы использовали для изготовления производственных серий биологических
индикаторов, разводили дистиллированной водой таким образом, чтобы в 0,02
мл оказалось нужное число спор, которое и вносилось в каждую пробирку Эппендорфа.
Затем биологические индикаторы оставляли на 24 час. при 37оС
для высушивания спор, после чего биологический индикатор (пробирку Эппендорфа
оставляли открытой) помещали в специальный пакет фирмы Wipack medical,
снабженный бумажным ранним индикатором процесса стерилизации. После автоклавирования
в каждый индикатор приливали 0,5 мл цветной питательной среды и помещали
в термостат при 55оС на 7 дней с ежедневной регистрацией изменения
цвета питательной среды на желтый. Если это случалось, то признавали существование
жизнеспособных спор на момент окончания времени автоклавирования.
Легко убедиться в том, что число биологических индикаторов, в которых
удавалось обнаружить жизнеспособные споры, зависело от исходного числа
индикаторов, помещенных в стерилизационную камеру. Если биологические индикаторы
имитируют обсемененные микроорганизмами медицинские изделия, то мы вправе
заподозрить, что доля биологических индикаторов с жизнеспособными спорами
после стерилизации может соответствовать доле оставшихся нестерильными
медицинских изделий. В этом и есть смысл применения контроля стерилизации
с помощью биологических индикаторов. Но их число не может быть увеличено
до больших чисел, во всяком случае до числа стерилизуемых медицинских изделий.
При принятых в России нормах в относительно небольших автоклавах размещают
по 5 биологических индикаторов, а в больших - до 13 [12]. Нам представляется,
что обозначенного числа биологических индикаторов для изучения пороков
стерилизации явно недостаточно, поэтому в представленных ниже экспериментах
для контроля стерилизации использовали гораздо большее число индикаторов.
Итак, в наших экспериментах использовали не только большее, чем обычно
число биологических индикаторов, но и дольше наблюдали их после стерилизации
во время культивирования в термостате. Наконец, мы использовали не только
то число спор в индикаторе, которое рекомендовано в стандартах (106
спор), но и несколько меньшее (105), и несколько большее (107).
В стерилизационную камеру автоклава в большинстве случаев кроме биологических
индикаторов ничего не помещали, чтобы избежать упреков в избыточном заполнении
камеры.
Данные, представленные на рис. 1, свидетельствуют о том, что единичные
индикаторы содержали жизнеспособные споры даже после 120-минутного автоклавирования
(само собой разумеется, что при использовании 5 или 10 биологических индикаторов
этот факт не был бы "замечен"). В данном опыте использовали споры двух
штаммов В. stearothermophilus - ВКМ-718 (производственный штамм, применяющийся
не только в России, но и в других странах, а также недавно выделенный штамм
КК [15], обладающий повышенной термоустойчивостью). Неожиданным оказалось
то обстоятельство, что иногда индикаторы с жизнеспособными спорами встречались
после 45 или 60 мин. автоклавирования не реже, чем после 30-минутной стерилизации.
|
Споры В. stearothermophilus
|
|
ВК-718
|
КК
|
|
107
|
2,2*106
|

| 
|
|
106
|
1,1*106
|

| 
|
|
105
|
0,7*106
|

| 
|
Рис. 1. Влияние стерилизации паром в автоклаве ВК-75
(121oС без вакуума в стерилизационной камере) на жизнеспособность
спор В. stearothermophilus (штаммы ВК-718 и КК). По оси ординат - число
биологических индикаторов на каждую экспозицию (25 биологических индикаторов),
по оси абсцисс - время стерилизации (мин.). Закрашенная часть столбиков
- число биологических индикаторов с жизнеспособными спорами.
Расхождение полученных данных с ожидаемыми заставило нас разработать
новую питательную среду, возможности которой в проявлении жизнеспособных
спор в биологических индикаторах, прошедших стерилизацию, были гораздо
выше, чем у прежней питательной среды.
Наряду с прежней питательной средой испытали две новых рецептуры, причем
одна из них оказалась весьма информативной (рис. 2).


Рис. 2. Влияние питательной среды на проявление
жизнеспособности спор В. stearothermophilus в биологических индикаторах
(носители - инсулиновые флаконы или пробирки Эппендорфа) после стерилизации
паром (121oС - 45 мин.). n - число биологических индикаторов
в каждой экспозиции, закрашенная часть столбиков - число биологических
индикаторов с жизнеспособными спорами. А - эксперименты с производственной
серией 71, число спор в биологическом индикаторе 3,4*105, Б
- эксперименты с производственной серией 69, число спор в биологическом
индикаторе 106. Номерами 1, 2, 3 обозначены пробы с разными
питательными средами.
Таким образом, наряду с повышенным числом биологических индикаторов,
удлинением сроков наблюдения за культивируемыми в термостате индикаторами,
использовали не только принятую питательную среду, но и новую среду, которая
оказалась более информативной, чем прежняя. Не лишне упомянуть, что в один
пакет помещали три биологических индикатора с разным числом спор, пакеты
размещали в стерилизационной камере случайным образом, после стерилизации
биологические индикаторы одновременно заливали одной и той же серией питательной
среды и оставляли в одном и том же термостате. Если употребляли прежнюю
и новую питательные среды, то число пакетов удваивалось.
Если в прежних опытах автоклавировали биологические индикаторы при 121oС
в течение 45 мин., то в опыте, представленном на рис. 3, биологические
индикаторы стерилизовали паром при температуре 132oС (оба режима
осуществляли в автоклаве отечественного производства - ВК-75).

Рис. 3. Влияние стерилизации паром при 132oС
на биологические индикаторы в зависимости от исходного числа спор в них
(105, 106 и 107 и времени автоклавирования
биологических индикаторов (5, 10, 20, 40 и 60 мин.). По оси ординат - число
биологических индикаторов в опыте. В каждой паре столбцов слева - результаты
определения числа биологических индикаторов с жизнеспособными спорами при
их культивировании в обычной питательной среде, справа - число биологических
индикаторов с жизнеспособными спорами при их культивировании в новой питательной
среде. Закрашенная часть столбика - число биологических индикаторов с жизнеспособными
спорами.
В представленных на рис. 3 данных употребляли различные экспозиции,
в числе их и ту (20 мин.), которая рекомендована в соответствующем режиме.
Можно отметить, что с помощью новой питательной среды, а иногда даже и
с применением прежней, удалось обнаружить жизнеспособные споры в биологических
индикаторах после автоклавирования в течение 20-60 мин. Более того, складывается
впечатление, что время автоклавирования в указанных на рис. 3 пределах,
не очень заметно сказалось на доле биологических индикаторов с жизнеспособными
спорами.
Полученные результаты анализа биологических индикаторов после стерилизации
побудили нас охарактеризовать те режимы паровой стерилизации, которые приняты
в России (рис. 4). Первые два режима осуществлены в аппарате ВК-75, а третий
и четвертый - в аппарате фирмы "МММ" (Германия). Само собой разумеется,
что все стерилизационные аппараты, использованные в наших исследованиях,
находились в полной технической исправности.
|
121oС, 45 мин.
|
132oС, 20 мин.
|

| 
|
120oC, 20 мин. +
вакуум в стерилизационной камере
|
134oC, 5 мин. +
вакуум в стерилизационной камере
|

| 
|
Рис. 4. Влияние питательной среды на результаты бактериологического
контроля стерилизации. По оси ординат - число биологических индикаторов
в опыте. Над каждой парой столбиков указано исходное число спор в биологических
индикаторах. В каждой паре столбцов слева - результаты определения числа
биологических индикаторов с жизнеспособными спорами при их культивировании
в обычной питательной среде, справа - число биологических индикаторов с
жизнеспособными спорами при их культивировании в новой питательной среде.
Закрашенная часть столбика - число биологических индикаторов с жизнеспособными
спорами. Режимы стерилизации приведены над столбиками.
Легко заметить, что ни один из испытанных режимов стерилизации не сопровождался
полным освобождением биологических индикаторов от жизнеспособных спор В.
stearothermophilus, особенно при употреблении новой питательной среды.
Нужно отметить, что процент биологических индикаторов с жизнеспособными
спорами несколько увеличивается, если наблюдение за цветом прежней питательной
среды в термостате вести не 48 час., а 72 час. (рис. 5, по данным рис.
1 для штамма ВКМ-718).

Рис. 5. Динамика пророста биологических индикаторов
(105, 106, 107 спор в биологических индикаторах)
после автоклавирования при 121oС в течение 30, 45, 60, 90 и
120 мин. На каждую пробу брали 25 биологических индикаторов. Учет пророста
биологических индикаторов вели через 18, 24, 48 и 72 часа их культивирования
при 55oС. Столбики указывают число биологических индикаторов
с жизнеспособными спорами на данный срок учета результатов.
Применение новой питательной среды явно ускоряет после стерилизации
появление максимального числа биологических индикаторов с жизнеспособными
спорами при культивировании в термостате при 55oС (рис. 6).

Рис. 6. Динамика пророста биологических индикаторов
(по 105 или 106 спор в биологических индикаторах)
после автоклавирования (121oС, 45 мин.). На каждую пробу брали
20 биологических индикаторов. Учет пророста вели через 18, 24, 48 или 120
час. культивирования при 55oС в разных питательных средах.
Оказалось, что и газовая стерилизация с помощью формальдегида (аппарат
фирмы "МММ", Германия) не освобождает биологические индикаторы от жизнеспособных
спор В. stearothermophilus (рис. 7.)
Стерилизация формальдегидом 75oС - 10 мин.




Рис. 7. Влияние питательной среды на результаты
бактериологического контроля стерилизации. Обозначения в верхней части
рисунка - те же, что и на рис. 4. В нижней части рисунка представлена динамика
пророста биологических индикаторов. Под столбиками - время культивирования
в сутках. Обозначения - те же, что и на рис. 5.
Тем не менее результаты стерилизации формальдегидом, по крайней мере
при использовании прежней питательной среды, выглядят несколько лучше,
чем результаты контроля паровой стерилизации.
В наших опытах споры в биологических индикаторах высушивались непосредственно
в пробирках Эппендорфа, в то время как в американских биологических индикаторах
(Attest) фирмы "3М" споры высушивались на полосках бумаги и в таком виде
вносились в пластмассовые емкости, которые снабжены ампулой с цветной питательной
средой. После стерилизации ампулу разбивают простым нажатием на корпус
индикатора, питательная среда изливается на бумагу с высушенными спорами,
а затем при культивировании в термостате удается зафиксировать жизнеспособные
споры, если цвет среды меняется на желтый [21, 26]. Мы изготовили некоторое
подобие индикатора Attest и проявили их с прежней и новой питательными
средами. Оказалось, что применение новой питательной среды заметно улучшило
результаты биологического индикатора, аналогичного Attest.
Итак, в наших экспериментах мы, как правило, вносили 120 биологических
индикаторов (каждый пакет с биологическими индикаторами занимал объем около
0,1 л) с разной исходной концентрацией спор. Половину индикаторов исследовали
с прежней питательной средой, а другую половину - с новой. В большинстве
случаев те биологические индикаторы, которые исследовали с помощью новой
питательной среды, после автоклавирования вначале заполнялись небольшим
объемом жидкости. Половина этого объема использовалась для засева на питательный
агар, а к остальной части добавляли питательную среду. Культивирование
осуществляли в термостате при 55oС. Выросшие колонии подсчитывали.
Эти наблюдения послужили основанием для сопоставления распределения
чашек Петри с агаром по числу выросших колоний с теоретическим распределением
Пуассона (наличие чашек без выросших колоний позволяло исчислить среднее
значение числа колоний на одну чашку, а затем по таблицам [2] определить
теоретическое распределение и сопоставить его с наблюдаемым в эксперименте).
Мы исходили из положения о том, что сумма пуассоновских распределений есть
тоже пуассоновское распределение; в подсчеты включали данные по всем трем
группам биологических индикаторов (105, 106, 107).
Поэтому в каждой группе оказалось 60 чашек Петри.
Из данных, представленных на рис. 9., следует, что при всех изученных
режимах распределение чашек Петри по числу выросших колоний соответствовало
распределению Пуассона. А это, в свою очередь, говорит о том, что оставшиеся
после стерилизации жизнеспособные споры представляли собой отдельные независимые
друг от друга сущности. Исключение составили данные по режиму паровой стерилизации
121oС - 45 мин., где теоретическая кривая существенно отклонялась
от полученной в эксперименте. В этом последнем случае приходится признать,
что указанные расхождения связаны с образованием комочков или глыбок спор
в биологическом индикаторе, которые распадаются на отдельные споры при
рассеве содержимого на поверхности агара. Так или иначе, но не возникает
сомнения, что после стерилизации жизнеспособными в биологических индикаторах
остаются единичные споры, в то время как подавляющая масса спор погибает.
По крайней мере такая картина вырисовывается при избранном числе биологических
индикаторов, помещенных в стерилизационную камеру.

Рис. 9. Соответствие фактических материалов (число
колоний на агаре) при разных режимах паровой и газовой стерилизации распределению
редких и случайных событий. По оси ординат - общее число биологических
индикаторов стерилизации (суммирование результатов для трех групп биологических
индикаторов с 105, 106 и 107 спорами).
По оси абсцисс - число КОЕ (колониеобразующих единиц), выросших на агаре
после посева материала биологических индикаторов. Сплошная линия - фактические
данные, прерывистая линия - расчетная линия в соответствии с распределением
случайных и редких событий (отсутствие на графике прерывистой линии указывает
на совпадение расчетных и экспериментальных данных).
Одним из поражающих воображение парадоксов является существенное отклонение
экспериментальных данных от линейной зависимости логарифма числа спор в
биологических индикаторах от времени стерилизации. Совершенно не соответствовали
сложившимся представлениям данные об обнаружении жизнеспособных спор в
более поздние от начала стерилизации сроки. И уж совсем не укладывались
в сознание данные о более частом обнаружении жизнеспособных спор в более
поздние сроки, чем в ранние, что отмечалось в некоторых экспериментах.
Случалось даже такое, когда при 15-минутной экспозиции споры в биологических
индикаторах нежизнеспособны, а после 45-минутной экспозиции в том же опыте
обнаруживаются хоть и единичные, но жизнеспособные споры.
В настоящей работе мы представляем свою интерпретацию процесса гибели
спор при стерилизации. Приводимое здесь предположение не имеет пока достаточных
доказательств, однако объясняет упомянутый выше парадокс.
Мы предполагаем, что зависимость логарифма числа спор в биологических
индикаторах от времени стерилизации носит не линейный, а волнообразный
характер. По данным рис. 1 мы дали свою интерпретацию зависимости логарифма
числа спор от времени стерилизации, воспользовавшись теми средними величинами
числа спор в биологических индикаторах, которые были исчислены с помощью
распределения Пуассона (рис. 11, 12). Но вначале мы представляем зависимость
зоны определения средних величин от числа биологических индикаторов (рис.
10).

Рис. 10. Область применения распределения Пуассона
для определения средних значений (m) при различном числе биологических
индикаторов в группе (числа в середине рисунка).
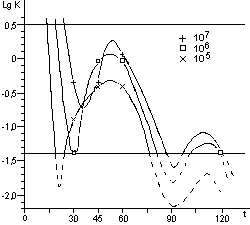
Рис. 11. Влияние стерилизации паром в автоклаве
ВК-75 (121oС без вакуума в стерилизационной камере) на жизнеспособность
спор В. stearothermophilus, штамм ВК-718. Волнообразные кривые - интерпретация
фактических данных. По оси ординат - десятичный логарифм средней концентрации
спор в биологическом индикаторе, по оси абсцисс - время стерилизации (мин.).
Горизонтальные прямые ограничивают область применения распределения Пуассона
для определения средних значений.
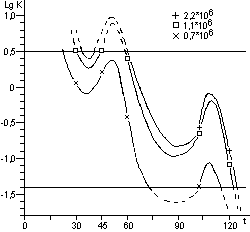
Рис. 12. Влияние стерилизации паром в автоклаве
ВК-75 (121oС без вакуума в стерилизационной камере) на жизнеспособность
спор В. stearothermophilus, штамм КК. Волнообразные кривые - интерпретация
фактических данных. По оси ординат - десятичный логарифм средней концентрации
спор в биологическом индикаторе, по оси абсцисс - время стерилизации (мин.).
Горизонтальные прямые ограничивают область применения распределения Пуассона
для определения средних значений.
Для определения средней величины необходимо иметь биологические индикаторы
без жизнеспособных спор, а для обозначения границ зоны значений средних
нужно, чтобы хотя бы один биологический индикатор содержал жизнеспособные
споры, или, напротив, чтобы хотя бы один биологический индикатор оказался
без жизнеспособных спор. Из сопоставления различных зон можно заключить,
что с увеличением числа биологических индикаторов в наибольшей мере увеличиваются
возможности нижней зоны, в то время как верхняя ее часть расширяется незначительно.
Распределение Пуассона табулировано, а использование вышесказанного позволяет
рассчитать необходимое число биологических индикаторов, которое позволяет
надеяться на обнаружение гораздо большего числа жизнеспособных спор после
стерилизации.
Представление фактических данных с помощью волнообразных кривых позволяет
понять, почему в некоторых экспериментах столь причудливо выстраиваются
на графиках биологические индикаторы с жизнеспособными спорами. Ведь выбор
точек на оси времени носит случайный характер, не связанный с закономерностями
гибели спор, не учитывающий предполагаемый волнообразный характер. Более
того, вполне может случиться, что нижняя. часть волны в районе 15 мин.
может оказаться за пределами возможности обнаружения в биологических индикаторах
(при избранном их количестве) жизнеспособных спор, в то время как при более
длительной экспозиции выбор временной точки совпал с верхней частью волны
и позволил обнаружить биологические индикаторы с жизнеспособными спорами.
Мы полагаем, что зависимость между логарифмом числа спор в биологическом
индикаторе от времени стерилизации отражает затухающий волнообразный автоколебательный
процесс, связанный с тем, что не только споры, но и окружающие их условия
определяют результат стерилизации.
В нижеследующей таблице собраны результаты контроля различных видов
стерилизации с помощью биологических индикаторов в аппаратах, используемых
в практических лечебных учреждениях по тем режимам, которые предусмотрены
существующими стандартами. Мы использовали полный цикл стерилизации, значительное
число биологических индикаторов, длительное их культивирование после стерилизации,
прежнюю и новую питательные среды.
Сводная таблица результатов биологического контроля стерилизации
№
п/п
|
Стерилизационный аппарат
|
Стерилизация
|
Биологические индикаторы
|
|
|
наименование
|
фирма-
производитель,
страна
|
год
выпуска
|
объем
стерили-
зационной
камеры
|
вид
|
режим
|
тест-
культура
|
число
спор
|
число
индика-
торов в
стерилизац.
|
% с
жизнеспо-
собными
спорами
после
стерилизац.
|
обычная
питат.
среда
|
новая
питат.
среда
|
| 1.
| ГК-100-ЗМ
| Тюменский з-д
медоборудования,
Россия
| 1993
| 100 л
| Паровая
| 121oС,
45 мин.
| В. stearo-
themophilus
| 106
| 40
| 0
| 10
|
| 2.
| "
| "
| "
| "
| "
| "
| "
| "
| 40
| 10
| 25
|
| 3.
| BK-75
| "
| "
| 75 л
| "
| "
| "
| 3*105
| 120
| 20
| 45
|
| 4.
| "
| "
| "
| "
| "
| "
| "
| 106
| 60
| 25
| 65
|
| 5.
| "
| "
| "
| "
| "
| "
| "
| 105
| 80
| 25
| 75
|
| 106
| 80
| 3
| 100
|
| 107
| 80
| 13
| 100
|
| 6.
| "
| "
| "
| "
| "
| "
| "
| 105
| 75
| 0
| 7
|
| 106
| 75
| 0
| 8
|
| 107
| 75
| 20
| 20
|
| 7.
| "
| "
| "
| "
| "
| "
| "
| 105
| 75
| 0
| 12
|
| 106
| 75
| 0
| 13
|
| 107
| 75
| 20
| 22
|
| 8.
| ГК-100-ЗМ
| "
| "
| 100 л
| "
| "
| "
| 105
| 40
| 15
| 20
|
| 106
| 40
| 0
| 15
|
| 107
| 40
| 0
| 35
|
| 9.
| BK-75
| "
| 1992
| 75 л
| "
| 121oС,
45 мин.
| "
| 105
| 40
| 0
| 5
|
| 106
| 40
| 0
| 25
|
| 107
| 40
| 0
| 25
|
| 10.
| "
| "
| "
| "
| "
| "
| "
| 106
| 40
| 20
| 50
|
| 107
| 40
| 5
| 60
|
| 11.
| BK-75
| "
| 1992
| 75 л
| Паровая
| 121oС,
45 мин.
| В. stearo-
themophilus
| 105
| 40
| 30
| 95
|
| 106
| 40
| 50
| 90
|
| 107
| 40
| 15
| 100
|
| 12.
| "
| "
| "
| "
| "
| "
| "
| 104
| 40
| 35
| 75
|
| 106
| 40
| 25
| 35
|
| 107
| 40
| 50
| 40
|
| 13.
| ГК-100-3М**)
| "
| 1988
| 100 л
| "
| "
| "
| 105
| 40
| 10
| 10
|
| 106
| 40
| 10
| 10
|
| 107
| 40
| 10
| 15
|
| 14.
| ГК-100-3М**)
| "
| "
| "
| "
| "
| "
| 105
| 40
| 5
| 0
|
| 106
| 40
| 0
| 10
|
| 107
| 40
| 5
| 0
|
| 15.
| ГКД-560
| "ЛАД",
Россия
| 1996
| 560 л
| "
| 120oС,
20 мин.
|
| 105
| 40
| 10
| 5
|
| 106
| 40
| 55
| 10
|
| 107
| 40
| 65
| 55
|
| 16.
| Секурокс
| "МММ",
Германия
| 1993
| 0,5 м3
| "
| "
| "
| 105
| 40
| 15
| 30
|
| 106
| 40
| 20
| 45
|
| 17.
| "
| "
| "
| "
| "
| "
| "
| 105
| 40
| 25
| 70
|
| 106
| 40
| 10
| 75
|
| 18.
| "
| "
| "
| "
| "
| "
| "
| 105
| 40
| 10
| 80
|
| 106
| 40
| 0
| 80
|
| 107
| 40
| 10
| 75
|
| 19.
| Castle
м/с 3622
| USA
| 1997
| 680 л
| "
| "
| "
| 105
| 40
| 0
| 0
|
| 106
| 40
| 0
| 5
|
| 106*)
| 0
| 0
| -
|
| 107
| 40
| 0
| 0
|
| 20.
| Селектомак
| "МММ",
Германия
| 1993
| 100 л
| Паровая
| "
| "
| 105
| 40
| 0
| 0
|
| 106
| 40
| 0
| 10
|
| 107
| 40
| 5
| 20
|
| 21.
| ГК-100-3М**)
| Тюм. з-д
медооор.,
Россия
| 1993
| 100 л
| "
| 132oС,
20 мин.
| "
| 105
| 40
| 0
| 0
|
| 106
| 40
| 0
| 5
|
| 107
| 40
| 10
| 0
|
| 22.
| ВК-75
| "
| 1992
| 75 л
| "
| "
| "
| 105
| 40
| 5
| 40
|
| 106
| 40
| 5
| 60
|
| 107
| 40
| 5
| 75
|
| 23.
| Селектомак
| "МММ",
Германия
| 1993
| 100 л
| Паровая
| 134oС,
5 мин.
| В. stearo-
themophilus
| 105
| 40
| 0
| 0
|
| 106
| 40
| 0
| 20
|
| 107
| 40
| 5
| 10
|
| 24.
| ГКД-560
| "ЛАД",
Россия
| 1996
| 560 л
| Паровая
| 134oС,
5 мин.
| "
| 105
| 40
| 45
| 25
|
| 106
| 40
| 50
| 35
|
| 107
| 40
| 35
| 100
|
| 25.
| Секурекс
| "МММ",
Германия
| 1993
| 500 л
| "
| "
| "
| 105
| 40
| 20
| 55
|
| 106
| 40
| 20
| 45
|
| 107
| 40
| 10
| 70
|
| 26.
| Castle
м/с 3622
| USA
| 1997
| 680 л
| "
| 134oС,
10 мин.
| "
| 105
| 40
| 0
| 0
|
| 106
| 40
| 0
| 20
|
| 106*)
| 20
| 0
| -
|
| 107
| 40
| 20
| 25
|
| 27.
| "
| "
| "
| "
| "
| "
| "
| 105
| 40
| 0
| 25
|
| 106
| 40
| 5
| 15
|
| 107
| 40
| 5
| 30
|
| 28.
| Комбимак
| "МММ",
Германия
| 1993
| 70 л
| Газовая
(формаль-
дегид)
| 75oC,
10 мин.
| "
| 105
| 40
| 5
| 20
|
| 106
| 40
| 10
| 45
|
| 107
| 40
| 5
| 20
|
Примечание: *) - Для контроля применили
биологические индикаторы Biosign фирмы Castle, содержащие фирменную питательную
среду.
**) - Накануне испытаний поставлена новая стерилизационная
камера.
Самым общим признаком результатов контроля стерилизации является то,
что не удалось убедиться в стерильности всех биологических индикаторов
по окончании времени стерилизации. Таким образом, этот важнейший контроль
свидетельствует о неэффективности в принятом смысле стерилизации, причем
наиболее надежной паровой стерилизации. Так как доза 107 спор
в биологическом индикаторе может быть признана чрезмерно высокой, то целесообразно
рассмотреть отдельно результаты контроля стерилизации биологическими индикаторами,
содержавшими 105 и 106 спор. При использовании новой
питательной среды какая-то часть биологических индикаторов после стерилизации
во всех случаях содержала жизнеспособные споры. Если же использовали прежнюю
питательную среду, то в трех случаях при контроле аппарата ВК-75 (30%)
биологические индикаторы не содержали жизнеспособных спор. Чаще подобные
результаты отмечены при контроле аппаратов зарубежного производства и это
может служить некоторым указанием на качественное превосходство над российскими
автоклавами.
Причины сложившейся ситуации неясны, как и возможные предложения по
совершенствованию стерилизации. Что касается применения бумажных индикаторов
стерилизации, то вряд ли следует рассчитывать на большее, нежели контроль
состояния некоторых технических характеристик стерилизационного аппарата,
особенно вначале процесса. Полное доверие показаниям бумажных индикаторов
может способствовать ложному заключению об эффективной стерилизации.
До сих пор речь шла о судьбе биологических индикаторов в процессе стерилизации,
что может не во всех случаях отражать особенности реальной стерилизации
медицинских изделий. Для стерилизации в качестве "медицинских изделий"
брали отрезки трубочек из поливинилхлорида длиной в 1 см, после тщательной
промывки их обсеменяли спорами В. stearothermophilus в объеме 0,02 мл,
высушивали и подвергали предстерилизационной очистке кипячением в 2% растворе
соды в течение 15 мин. [14]. После отмывки в стерильной дистиллированной
воде отрезки трубочек на следующий день стерилизовали в пакетах (121oС
- 45 мин.), после чего каждый отрезок помещали в стерильную пробирку Эппендорфа
и заливали питательной средой. Культивирование отрезков проводили в термостате
при 55oС. Контрольные отрезки обсеменяли спорами, но не подвергали
предстерилизационной обработке. Иными словами, в этом опыте подражали экспериментам
с биологическими индикаторами.
Полученные результаты поражают своей неожиданностью - отрезки трубочек,
обработанные раствором соды при 100oС, оказались после стерилизации
столь же обсемененными, что и не подвергавшиеся предварительной очистке,
которая в настоящее время занимает важное место в методике стерилизации
[1, 3, 14].

Рис. 13. Результаты стерилизации отрезков трубки
из поливинилхлорида после их предстерилизационной очистки и без нее. В
каждой паре столбиков слева - число отрезков трубки с жизнеспособными спорами
при культивировании с обычной питательной средой, справа - с новой питательной
средой. Цифры над столбиками - число спор В. stearothermophilus, нанесенных
изначально на внутреннюю поверхность отрезков трубки.
В другом опыте отрезки трубочек из силиконовой резины размером в 1 см
после тщательной промывки в дистиллированной воде обсеменяли спорами В.
stearothermophilus, затем оставляли на 1 час при комнатной температуре.
По окончании указанного времени опытные отрезки на 30 мин. погружали в
0,2% раствор дезинфицирующего средства "Септабик" [14], отрезки тщательно
промывали в дистиллированной воде, просушивали на фильтровальной бумаге.
Контрольные отрезки обсеменяли спорами, но не обрабатывали средством "Септабик".
На следующий день все отрезки закладывали в пакеты и стерилизовали в автоклаве
(121oС - 45 мин.), после чего каждый отрезок помещали в пробирку
Эппендорфа, заливали питательной средой и культивировали при 55oС.
В опыте (рис. 14) результаты испытаний были несколько лучше, чем в предыдущем,
так как наблюдалась все же разница в доле проросших опытных и контрольных
отрезков трубочек из силиконовой резины, однако эти различия не были впечатляющими.
Во всяком случае даже после предстерилизационной очистки стерилизация макетов
медицинских изделий оказалась неэффективной. И это несмотря на то, что
обрабатывать небольшие отрезки трубочек гораздо легче, чем большие и сложные
изделия, где возможные места обсеменения микроорганизмами менее доступны
для дезинфицирующих растворов.

Рис. 14. Результаты стерилизации отрезков силиконовой
трубки после их предстерилизационной очистки и без нее. В каждой паре столбиков
слева - число отрезков трубки с жизнеспособными спорами при культивировании
с обычной питательной средой, справа - с новой питательной средой. Числа
над столбиками - число спор В. stearothermophilus, нанесенных изначально
на внутреннюю поверхность отрезков трубки.
Ввиду необычности полученных результатов необходимо убедиться в том,
что не были допущены технические погрешности. На протяжении всего времени
исследований и помещениях и в ламинарном боксе расставлялись чашки с питательным
агаром, но ни разу бактерии В. stearothermophilus иыделены не были, как
и не были выделены из питательной среды и других использованных ингредиентов
(в каждом опыте делали посевы питательной среды и дистиллированной воды
на 10 агаровых чашек и 10 пробирок Эппендорфа с питательной средой, но
безрезультатно). Предположение о том, что число бактерий в биологических
индикаторах возрастает во время высушивания, не подтвердилось (известно,
что В. stearothermophilus не размножается при 37oС).
Таким образом полученные результаты являются неутешительными, но все
же, по крайней мере, для некоторых авторов ожидаемыми. Из всей огромной
массы литературы по термоинактивации споровых бактерий, в том числе фундаментальных
исследований [5, 23, 25, 28], ближе всех к нашей трактовке стоит монография
Мунблитн, Тальрозе и Трофимова [13], которые экспериментов не ставили и
пользовались лишь данными литературы. Эти авторы, придерживающиеся объяснения
термоинактивации спор за счет термоповреждений жизненно важных белков и
сублетальных повреждений мембраны, высказали опасения относительно эффективности
стерилизации: "...стандартные условия теплового воздействия (120oС,
30 мин.) в некоторых случаях не обеспечивают высокой надежности стерилизации",
"...существует принципиальная опасность восстановления и размножения в
организме человека микроорганизмов, которые были признаны погибшими". По
нашим данным даже такие облигатные и непатогенные термофилы как В. stearothermophilus
способны к ограниченному размножению при 37oС, если к питательной
среде добавить кровь человека.
Не только биологические индикаторы изредка содержали жизнеспособные
споры после стерилизации, но и макеты обсемененных спорами медицинских
изделий. Более того, предстерилизационная обработка макетов раствором кипящей
соды или 0,2% раствора препарата "Септабик" не сопровождалась достаточным
эффектом - стерилизация была неэффективной.
Теперь задача заключается в том, чтобы разработать новые методы, которые
смогут гарантировать эффективность стерилизации. Наше представление о кинетике
стерилизационного процесса позволили апробировать новые методические предложения,
которые оказались перспективными, но требуют разносторонней проверки.
Выводы
1. Распределение редких и случайных событий позволяет рассчитывать среднее
число спор на один биологический индикатор для условий, когда число жизнеспособных
спор мало и встречаются они далеко не в каждом индикаторе.
2. Имеется достаточно оснований, чтобы усомниться в линейном характере
зависимости между логарифмом числа спор в биологических индикаторах и временем
от начала стерилизации. Жизнеспособные споры были обнаружены в биологических
индикаторах даже через 1-2 часа пребывания в автоклаве при регламентированной
температуре.
3. В экспериментах по контролю паровой стерилизации применяли значительное
число биологических индикаторов, высокоэффективную цветную питательную
среду и недельный срок культивирования в термостате, что в конечном итоге
позволило обнаруживать жизнеспособные споры в биологических индикаторах
после стерилизации чаще, чем обычно и практически при большинстве употребляющихся
в практике режимах.
4. При высевах содержимого биологических индикаторов после стерилизации
на плотную питательную среду в ряде случаев обнаруживались единичные колонии
В. stearothermophilus, причем в большинстве случаев распределение агаровых
чашек Петри по числу колоний в точности соответствовало распределению Пуассона,
а это означало, что жизнеспособные споры не зависят друг от друга и расположены
изолированно и случайно.
5. В некоторых экспериментах процент биологических индикаторов с жизнеспособными
спорами после длительных сроков стерилизации превышал таковой после коротких
сроков стерилизации, что не находило удовлетворительного объяснения. Мы
предположили волнообразный характер зависимости логарифма числа жизнеспособных
спор в биологических индикаторах от времени стерилизации.
6. Контроль стерилизаторов, установленных в практических лечебных учреждениях,
показал, что во всех случаях та или иная часть биологических индикаторов
содержала жизнеспособные споры после стерилизации, а вероятность неудовлетворительных
результатов анализа индикаторов оказалась гораздо выше той, которая рекомендована
в стандартах.
7. Экспериментальная паровая стерилизация отрезков трубочек из синтетических
материалов, обсемененных спорами, после предстерилизационной очистки закончилась
обнаружением жизнеспособных спор у более, чем половины экземпляров, т.
е. результатами, аналогичными тем, которые были получены с биологическими
индикаторами.
8. Число жизнеспособных спор в биологическом индикаторе после стерилизации
является вероятностной величиной, а их обнаружение, кроме всего прочего,
зависит от числа индикаторов в стерилизационной камере.
Литература
1. Абрамова И.М. Новые разработки в области стерилизации изделий медицинского
назначения. Дезинфекционное дело, 1998, №3, с. 25.
2. Большев А.Н., Смирнов Н.В. Таблицы математической статистики. М.,
1965.
3. Вашков В.И. Антимикробные средства и методы дезинфекции при инфекционных
заболеваниях. М., 1977.
4. Гутерман Р.Л. Средства контроля термической стерилизации изделий
медицинского назначения. Дисс. канд. мед. наук. М., 1993.
5. Кашнер Д. Жизнь микробов в экстремальных условиях. М., 1981.
6. Леви М.И., Бессонова В.Я., Лившиц М.М. Применение цветных питательных
сред в процессе контроля стерилизации. Клиническая лабораторная диагностика,
1993, № 2, с. 65-67.
7. Леви М.И. Анализ неблагоприятных результатов паровой и воздушной
стерилизации. Дезинфекционное дело, 1996, № 4, с. 58-63.
8. Леви М.И. Значение контроля стерилизации с помощью бумажных индикаторов
и биотестов. Дезинфекционное дело, 1997, № 3, с. 24-28.
9. Леви М.И., Сучков Ю.Г., Рубан Г.И., Мищенко А.В. Новые формы бактериальных
тестов для контроля разных режимов стерилизации. Там же, с. 29-33.
10. Леви М.И., Сучков Ю.Г., Лившиц М.М. Оптимизация биотестов для контроля
паровой стерилизации. Дезинфекционное дело, 1998, № 2, с. 30-33.
11. Леви М.И. Численное определение величины D, стерилизационного времени
и выбор контрольных биотестов. Там же, с. 34-42.
12. Методические указания по контролю паровых и воздушных стерилизаторов.
Минздрав СССР, от 28.02.91 № 15/6-5.
13. Мунблит В.Я., Тальрозе В.Л., Трофимов В.И. Термоинактивация микроорганизмов.
М., 1985.
14. Под ред. Озерецковского Н.А. и Останина Г.И. Бактерийные и вирусные
лечебно-профилактические препараты. Аллергены. Дезинфекционно-стерилизационные
режимы поликлиник. С.-Петербург, 1998.
15. Сучков Ю.Г., Леви М.И., Бессонова В.Я. Новый термофильный штамм
для бактериологического контроля паровой стерилизации (сообщение 1), Дезинфекционное
дело, 1996, № 3, с. 28-33.
16. Biological systems for testing sterilizers - Part 1: General requirements.
European standard, Draft pr EN 866-1.1995.
17. Farrell J., Rose A.N. Temperature effect on microorganisms. In:
"Thermobiology", p. 147-218. Acad. press, London-New-York, 1967.
18. Graham G.S. Biological indicators for hospital and industrial sterilization,
p. 54-72. In: "Sterilization of medical product". Johnson and Johnson.
Moscow, 1991.
19. Greene V.W. Principles and practice of disinfection, preservation
and sterilization. Oxford, 1982.
20. International standard ISO/DIS 14161. Sterilization of health care
products - guidence for the selection, use and interpretation of results.
1998.
21. McCormick P.J., Scoville J.R. - патент USA № 4.743.537, 1988 г.
22. Medical devices - Estimation of the population of microorganisms
on product. Part 2 guidence, pr EN 1174-2.1994 г.
23 ssel A.D. The destruction of bacterial spores. Acad. press, London-New-York,
1982.
24 ssel A.D. Fundamental aspects of microbial resistance to chemical
and physical agents. In: "Sterilization of medical product", v. V, p. 22-42.
Johnson and Johnson, 1991.
25. Sussman A., Halvorson H. Spores, their dormancy and germinatiom.
New-York-London, 1967.
26. Wicks J.H., Foltz W.E. Европейский патент № 0414.968 A1, 1991 г.
27. Журавлева В.И., Большедворская З.Ф. Оценка питательных сред для
культивирования тест-микроорганизмов, используемых при контроле эффективности
стерилизации в автоклавах. Лабораторное дело, 1988, № 11, с. 63-64.
28. Калинина Н.М., Шилова С.В., Мотина Г.Л., Чайковская С.М. Изучение
термоустойчивости спор культуры Вас. stearothermophilus, используемой для
приготовления биоиндикаторов. Антибиотики, 1982, № 2, с. 117-120.
29. Калинина Н.М., Мотина ГЛ., Чайковская С.М., Шилова С.В. Приготовление
биоиндикаторов для контроля эффективности процессов стерилизации. Антибиотики,
1983, № 10, с. 600-603.

