Опубликовано в журнале:
«ВЕСТНИК ПОСЛЕДИПЛОМНОГО МЕДИЦИНСКОГО ОБРАЗОВАНИЯ»; № 4; 2011; стр. 1-7.Прогностически значимые инфекционные факторы в формировании аутоиммунного оофорита при хронических воспалительных заболеваниях органов малого таза
М. В. Царегородцева
Московский областной перинатальный центрРезюме.
Цель исследования: Изучить инфекционные, клинико-иммунологические факторы формирования аутоиммунного оофорита при хронических воспалительных заболеваниях органов малого таза (ХВЗОТ).Материалы исследования: 537 женщин репродуктивного возраста с ХВЗОТ: 259 (1-я группа) с выявленными циркулирующими антиовариальными антителами, 278 (2-я ) — серонегативные обследуемые по данному признаку.
Методы исследования: Клинико-анамнестический, функциональные, иммунологические. Результаты исследования: Выявлены этиопатогенетические факторы развития аутоиммунного оофорита воспалительного генеза: длительность ХВЗОТ, преобладание в микробном пейзаже микст-форм инфицирования (Chlamidia trachomatis, Neisseria gonorrhoea, условных патогенов Corynebactericeae, Enterobactericeae). Длительное антигенное воздействие данных инфектов реализует активацию провоспалительного цитокинового каскада. Физиологическая модуляция овуляции за счет изменении системных воспалительных, овариальных иммунологических факторов при ХВЗОТ и воздействия антиовариальных антител деформируется в усиление атретических процессов фолликулов, в результате чего формируется аутоиммунный оофорит воспалительного генеза с характерным снижением эстрогенгормонопродуцирующей функции яичников.
Заключение: Выявлена корреляция между инфекционными, клинико-иммунологическими факторами течения ХВЗОТ и частотой развития аутоиммунного оофорита. При учете этих критериев развития аутоиммунных нарушений возможно прогнозирование, диагностика и разработка методов иммунокоррекции аутоиммунного оофорита.
Summary.
Objective: To investigate infectijns and clinico-immunological formation mechanisms of autoimmune oophoritis during the chronic inflammatory diseases of pelvic organs.Design: Prospective investigation.
Methods of Investigation: 537 women of reproductive age with chronic inflammatory diseases of pelvic organs: 259 (1 group) with the discovered circulatory antiovary antibodies, 278 (2 control group) - seronegative investigated by the given sign.
Methods of investigation: Clinico-anamnestic, functional and immunological.
Results of investigation: Etiopathic factors of development of autoimmune ovarian deficiency of the inflammatory nest were displayed: continuous course of the chronic inflammatory diseases of pelvic organs, predominance of the mixed-forms in the microbe view (Chlamidia trachomatis, Neisseria gonorrhoea; from the group of conditional pathogens: Corynebactericeae, Enterobactericeae). Long antigenic influence of the given infectious organisms realizes the activation of proinflammatory cytokine cascade. Physiological modulation of ovulation due to the change of the general systematic inflammatory, local ovarian immunological factors during the chronic inflammatory diseases of pelvic organs and the influence of antiovary antibodies, deforms to the strengthening of atritic processes of follicles. As а result autoimmune ovarian deficiency of the inflammatory nest with the specific decrease of estrogenhormoneproductive ovarian function is formed.
Conclusion: Correlation between clinico-immunological factors of the chronic inflammatory diseases of pelvic organs and frequency of autoimmune ovarian deficiency development has been revealed. Taking into account the revealed etiopathogenetic inflammatory criteria of the development of autoimmune disorders, the scheme of pathogenesis of autoimmune oophoritis has been worked out. Aspects of this scheme allow to prognose and work out methods of early detection and correction of ovarian function.
Хронические воспалительные заболевания органов малого таза (ХВЗОТ) занимают лидирующее положение в структуре гинекологической заболеваемости (3,5). Последствия перенесенного воспалительного процесса достаточно серьезны: от 10 до 59% пациенток страдают бесплодием, 24—30% отмечают выраженный тазовый болевой синдром и хроническую ановуляцию (6,16).
Хронические персистирующие инфекции могут приводить к значительным, иногда малообратимым изменениям общего иммунного статуса, нарушать процесс образования антител, запускать аутоиммунные механизмы, поражающие репродуктивные органы женщины (1,5,6).
Все вышеперечисленные факторы указывают на необходимость изучения этиопатогенетических аспектов иммунных механизмов поражения фолликулярного аппарата яичников при хронических воспалительных заболеваниях органов малого таза, а также выявление факторов, позволяющих прогнозировать развитие аутоиммунного оофорита воспалительного генеза.
Цель исследования.
Изучить инфекционные, клинико-иммунологические факторы формирования аутоиммунного оофорита при хронических воспалительных заболеваниях органов малого таза (ХВЗОТ).Материалы и методы исследования
Было проведено обследование и лечение 537 пациенток репродуктивного возраста, страдавших ХВЗОТ. Пациентки были разделены по признаку наличия или отсутствия в сыворотке крови циркулирующих антиовариальных антител. Первую группу сформировали 259 женщин с идентифицированными циркулирующими антиовариальными антителами (OV+); вторую, контрольную — 278 серонегативные пациентки (OV-); Biosor, Germany).Идентификация инфектов микробного пейзажа репродуктивных путей проводилась методом ПЦР-анализа влагалищной жидкости (Trichomonas vaginalis, Chlamidia trachomatis, Ureaplasma urealiticum, Mycoplasma hominis, Mycoplasma genitalium, Neisseria gonorrhoaea, Gerpes simplex virus type I, Gerpes simplex virus type II, Gardnerella vaginalis). Серологический скрининг выполнен методом иммуноферментного анализа IgG/IgM, Chlamidia trachomatis Gerpes simplex virus type II, Trichomonas vaginalis. Оценка видового и количественного состава условных ассоциантов вагинального содержимого: облигатных и факультативных анаэробов, микроаэрофилов, грибов и трихомонад осуществлялась культуральным методом.
Исследование общей популяции Т-лимфоцитов и их субпопуляций, В-лимфоцитов с моноклональными антителами CD3, CD4, CD5, CD8, CD14, CD16, CD19 проводилась методом проточной цитофлюорометрии. Определение содержания IgA, IgM, IgG, IgE, интерферона (IF-a, у); интерлейкинов (IL-1,4,6,10,12); фактора некроза опухоли (TNF-a); антикардиолипиновых антител; антител к ДНК нативной и денатурированной в сыворотке проводилось методом ИФА.
У обследуемых женщин проводились гормональные исследования сывороточного содержания ФСГ, ЛГ, пролактина, эстрадиола, прогестерона, тестостерона, кортизола, ТТГ, Т3, Т4, антител к микросомальной фракции щитовидной железы (Elisa).
Статистическую обработку данных проводили с применением критерия Стьюдента-Фишера.
Результаты исследования
Возрастных различий между группами не выявлено. Средний возраст женщин 1-й группы составил 29,7±1,3 лет, 2-й группы — 26,9±2,4 лет.Уровень антиовариальных антител в 1-й группе составил 26,3±4,7 Ed/ml (норма до 10 Ed/ml), антитела к блестящей оболочке яйцеклетки (Zp) выявлены у 31 обследуемых (11,96%). Во второй группе содержание OV-антител 5,6±2,9 Ed/ml (p<0,05). Разделяя обследуемых пациенток по признаку наличия или отсутствия в сыворотке крови циркулирующих антиовариальных антител, нами проведен анализ клинико-иммунологических особенностей, прогностически значимых для формирования аутоиммунного оофорита при ХВЗОТ.
Средняя продолжительность ХВЗОТ в 1-й клинической группе (8,3±1,7 лет) была достоверно выше, чем во 2-й (4,1±2,1 года), р<0,05. Причём число пациенток с длительностью ХВЗОТ менее 5 лет во 2-й группе значительно превышало данный показатель (OV+ 72,2%, OV- 15,86%, соответственно, р<0,01). Следовательно, была установлена зависимость между появлением антиовариальных антител и длительностью ХВЗОТ в обследуемых групп.
У большинства обследуемых пациенток 504 (93,85%) выявлены микст-формы инфекций, передаваемых половым путем (ИППП). В 1-й клинической группе количество пациенток с микст — формами ИППП (3 и более патогенных возбудителей) было больше на 30%. Исходя из данных, представленных в табл. 1, в 1-й клинической группе (OV+) у 146 женщин (56,1%) была диагностирована гонорея; в сочетании с хламидиозом — у 124 (47,7%) женщин, что достоверно выше частоты данных инфекций во 2-й (OV-) группе (59 (21,1%) и 44 (15,7%), соответственно, р < 0,05).
Таблица 1.
Этиологическая структура ИППП в обследуемых группах
Виды ИППП 1-я группа 2-я группа Синдром Рейтера 136 (52,3%) 67 (23,9%) Гонорея 146 (56,1%) 59 (21,1%) Хламидиоз 259 (100%) 235 (83,9%) Трихомониаз 259 (100%) 224 (80%) Уреамикоплазмоз 104 (40%) 171 (61,1%) Гонорея + хламидиоз 124 (47,7%) 44 (15,7%) Уреамикоплазмоз выявлялся несколько чаще во 2-й группе (1-я — 144 (40,2%), 2-я — 171 (61,5%, (p>0,05).
Наиболее значимые различия были обнаружены между обследуемыми группами по частоте идентификации осложненных форм хламидиоза и гонореи и их корреляцией с клинической триадой синдрома Рейтера (уретрит, полиартрит, конъюнктивит). В группе OV+ пациентки с синдромом Рейтера встречались почти в два раза чаще (1-я группа — 52,3% обследованных, 2-я группа — 23,9% обследованных, р<0,01).
Результаты изученного микробного пейзажа условнопатогенной флоры у пациенток обследуемых групп отражены в табл. 2. При анализе условнопатогенного микробного пейзажа у OV+ пациенток выявлено достоверное превалирование: Corynebacterium различных типов (1-я группа 199 (76,83%)), (2-я группа 67 (24,10%) p<0,005), Neisseria spp. (1-я группа 49 (18,92%), 2-я группа 3 (1,08%) p<0,005), Enterobacteriaceae (1-я группа 49 (18,92%), 2-я группа 7 (2,52%); p<0,05).
Таблица 2.
Этиологическая структура условно патогенной микрофлоры при ХВЗОТ в обследуемых клинических группах
Результаты микробиологических исследований Клинические группы 1-я группа 2-я группа Количество микроорганизмов Микроорганизмы >10 КОЕ/мл <3 КОЕ/мл >10 КОЕ/мл <3 КОЕ/мл Corynebacterium spp. 53* 11 19* 3 Corynebacterium struarum 13 2 - - Corynebacterium ulcerous 26 - - 1 Corynebacterium renale 107* - 48* 3 Staphylococcus spp. 23 33 34 21 Staphylococcus hominis 9 - - - Staphylococcus epidermidis 41 17 54 47 Streptococcus spp. 3 10 2 - Enterobacteriaceae Enterococcus spp. 22 3 17 4 Enterococcus faecalis, E.coli, Proteus spp. 49 34 7 2 Дрожжеподобные грибы 31 - 17 - Облигатные анаэробы 49* - 9* - Neisseria spp. 49* - 3* - Gemella morbillorum 3 - - - Propionibact. аsnes - 1 - 2 Lactococcus lactus spp. - 14 - 37 Условно-патогенная м/флора не выделена 47 51 Gardenella-vaginalis 35 - 47 - * — p<0,05У большинства пациенток обеих клинических групп неотъемлемой частью микробного пейзажа была трихомонадная инфекция. Трихомониаз регистрировался в 88,4% случаев и был самой распространенной формой ИППП.
При сравнении уровней провоспалительных цитокинов было выявлено достоверное различие содержания IL-1 (1-я группа -1053,41±1,14 пкг/мл, 2-я группа — З68,82±0,10 пкг/мл, p<0,05), TNF-a (1-я группа — 1250±4,70 пкг/мл, 2-я группа — 196,88±4,3 пкг/мл, р<0,05), IF-y (1-я группа 122,37± 0,91 пкг/мл, 2-я группа 59,99±1,1 пкг/мл, p<0,05, табл. 3).
Таблица 3.
Интерлейкиновый статус в обследуемых клинических группах
Цитокины, пкг/мл
Клинические группы
1-я группа 2-я группа Интерлейкин-1 1053,41±1,14 * 368,82 ± 0,10* Интерлейкин-4 181,68 ± 21,13* 78,60 ± 1,71* Интерлейкин-6 83,87± 0,63* 57,61± 0,51* Интерлейкин-10 18,65±0,17 28,63± 2,1 Интерлейкин-12 74,16±0,52 100,40±2,7 TNF-a 1250,0± 4,70* 196,88 ±0,43* Интерферон-y 122,37± 0,91* 59,99±1,1* Интерферон-a 29,61± 0,21 27,84±1.9 Ig A 1,54±0,05 1,77±0,03 Ig M 1,56±0,17 1,67±0,02 Ig G 4,22± 0,04 5,73±0,07 Ig E 79,99±0,60 72,02±1,11 * — p<0,05У всех женщин проводилась сравнительная оценка гормонопродуцирующей функции яичников и особенностей менструального цикла (табл. 4). В группе OV+ пациенток установлено снижение уровня эстрадиола в периферической крови (14 день менструального цикла) по сравнению с 2-й группой (65,73±2,4 пкг/мл и 123,7±3,7 пкг/мл соответственно, p<0,05). Анализ корреляции между длительностью ХВЗОТ и уровнем гормонов позволил четко определить наличие обратно пропорциональной зависимости между длительностью заболевания и концентрацией предовуляторного эстрадиола и кортизола в сыворотке крови.
Таблица 4.
Концентрация гонадотропных и некоторых стероидных овариальных гормонов в периферической крови пациенток клинических групп в овуляторный период менструального цикла
Гормоны 1-я группа 2-я группа Норма ФСГ, мкМЕ/мл 12,41±0,4 5,84±0,9 4,9—20,4 ЛГ, мкМЕ/мл 12,92±0,7 15,26±0,9 13,2—72 Пролактин, мМЕ/л 580,38±65,1 433,26±23,7 360—720 Эстрадиол, пк/мл 65,73±2,4* 123,7±3,7* 130—370 Прогестерон, нг/мл 3,23±0,4 3,08±0,1 до 10 Кортизол, нг/мл 310,6±6,6* 526,8±11,2* 160—720 Тестостерон, нг/мл 0,59±0,05 0,40±0,07 0,2-1,2 У OV+ пациенток сниженный уровень эстрадиола, вероятно обусловил клиническое превалирование гипоменструальных форм нарушений цикла (НМФ). В 1-й группе НМФ диагностированы у 239 женщин (91,9%), во 2-й — 157 (56,41%), p<0,05. У OV-серопозитивных пациенток доминировали такие нозологические формы, как опсоменорея — 47,45%, гипоменструальный синдром 20%. У OV-серонегативных пациенток выявлены следующие формы НМФ: спаниоменорея — 29%, опсоменорея 9,0%. Гипоменструальный синдром во второй группе встречался значительно реже — всего 7,1%, отсутствовала вторичная аменорея.
Настоящее исследование подтвердило тот факт, что у OV серопозитивных женщин имеют место значительные нарушения в клеточном звене иммунитета. Так, было обнаружено снижение общего числа Т-лимфоцитов (CD3+) (1-я группа 40,2±1,1%, 2-я группа 69,8±2,4%, p<0,05). Процентное содержание Т-хелперов/индукторов (CD4+) было также снижено по сравнению со 2-й клинической группой (1-я группа 30,6%±1,4%, 2-я группа 49,6±1,9%, p<0,05). В то же время количество Т-супрессоров (CD8+) уменьшалось. Было показано, что у женщин с идентифицированными антиовариальными антителами коэффициент соотношения CD4/CD8 значительно ниже, чем у OV серонегативных пациенток. В отличие от Т-лимфоцитов, количество В-лимфоцитов (CD19+) различалось в группах с ХВЗОТ незначительно.
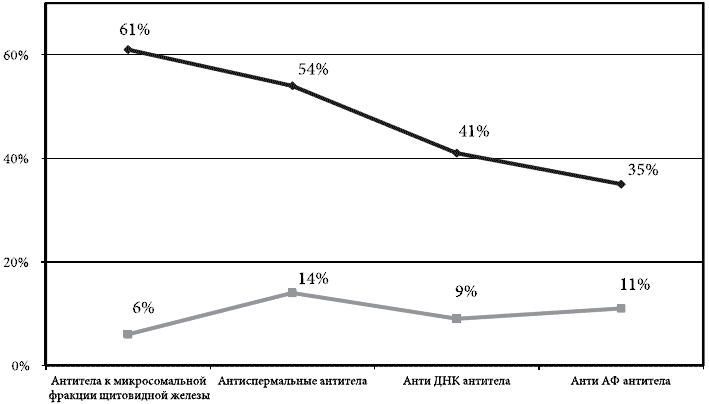
В обеих группах проводился анализ маркеров прочих аутоиммунных процессов. Оценивали содержание антител к микросомальной фракции щитовидной железы, наличие антиспермальных и антифосфолипидных антител. В группе серопозитивных женщин эти показатели были достоверно выше, особенно по частоте обнаружения сопутствующего аутоиммунного тиреоидита. В 50% случаев у OV-серопозитивных женщин обнаруживались повышенные уровни антиспермальных антител, что объясняет снижение репродуктивного потенциала (рис. 1).
Рис. 1. Сравнительная характеристика частоты выявления аутоиммунных маркеров в сыворотке крови обследуемых женщин
Проводимое лечение в обеих группах включало в себя этиотропную антибактериальную терапию — исходя из идентификации этиологической ассоциации микроорганизмов — орнидазол, фторхинолоны, цефалоспорины, азалиды.
Контроль эрадикации патогенных возбудителей проводился спустя 6 недель после окончания этиотропной терапии. Эффективность антибиотикотерапии составила 89,3%.
В стандартные комплексные схемы терапии были включены нестероидные противоспалительные препараты и эубиотики. При внутриклеточном и вирусном микст-инфицировании дополнительно оценивали состояние гуморального звена иммунитета. В период обострения воспалительного процесса в 42,7% случаев (246 женщин) выявлено достоверное повышение содержание циркулирующих OV-антител одновременно с повышением содержания в сыворотке крови провоспалительных цитокинов (TNF-a, IF-y, IL-1).
У некоторых OV+ женщин удавалось добиться кратковременного обратимого — на 20—30 дней — снижения уровня OV- антител путем проведения комплексной противовоспалительной терапии в сочетании 5-ю сеансами плазмафереза с последующим внутривенным введением 25 мл нормального человеческого иммуноглобулина (интервал введения — 3—5 дней). Снижение уровня специфических антител коррелировало с кратковременным клиническим улучшением состояния женщин.
При оценке гуморального звена иммунитета после противовоспалительной терапии у 80,29% пациенток выявлено достоверное снижение содержания IFN-a и повышение уровня TNF-a, IFN-y, IL-1 в сыворотке крови OV+ обследуемых женщин (р<0,05).
Поэтому в данном исследовании в программу лечения OV+ пациенток, резистентных к традиционной антибактериальной и противовоспалительной терапии был включен оригинальный отечественный лекарственный препарат Галавит® (аминодигидрофталазиндион натрия, рег. уд PN000088/02), обладающий противовоспалительным и иммуномодулирующим действием. Препарат назначался внутримышечно по 100 мг ежедневно в течение 5 дней, затем — по 100 мг каждые 72 часа (всего 20 инъекций). Результаты лечения оценивали по окончании терапии и через 1, 2, 3, 6 месяцев. В 75,3% наблюдений на фоне добавления к традиционной терапии препарата Галавит® у OV+ женщин удалось добиться значительного снижения содержания в крови уровней провоспалительных цитокинов: IL-1, TNF-a, IL-6, IFN-y Одновременно улучшилось состояние клеточного звена иммунитета (повысилось содержание иммунокомпетентных клеток CD3 и CD4) и гормональный статус женщин (увеличилось содержание эстрадиола и ИВ при тенденции к снижению ФСГ и ЛГ).
Данные эффекты применения препарата Галавит® связаны с его способностью воздействовать на функционально-метаболическую активность макрофагов и других иммунокомпетентных клеток, при котором подавляется избыточный синтез гиперактивированными макрофагами провоспалительных цитокинов TNF-a, IL-1 и других белков воспаления, определяющих степень и цикличность воспалительных реакций, а также выраженность интоксикации. Нормализация функционального состояния макрофагов приводит к восстановлению адекватного иммунного ответа при инфекционно-воспалительном заболевании, а также к снижению уровня аутоагрессии, то есть механизмов аутоиммунного воспаления. Стабилилизация иммунологических показателей определяла клинический эффект у OV+ женщин: снижение интенсивности тазовых болей, исчезновение дизурических расстройств, восстановление овуляторного менструального цикла.
На фоне клинического улучшения, через 2 месяца после завершения курса лечения проводился повторный мониторинг сывороточного содержания провоспалительных цитокинов в обеих группах. Получены следующие результаты: 1-я группа — IL-1 (до терапии — 800,4±3,1 пкг/мл, после — 207,8±4,1 пкг/мл, р<0,05), TNF-a (до — 496,88 ±4,7 пкг/мл, после 150,0±4,3 пкг/мл, р<0,05). Во 2-й группе пациенток данные показатели уменьшились несущественно: IL-1 (до терапии — 768,82±3,1 пкг/мл, после — 711,8±4,1 пкг/мл, р >0,05), TNF-a (до—596,88±4,7пкг/мл, после—525,0±4,3пкг/мл, р>0,05 (табл. 1).
Исследования изменений показателей клеточного иммунитета после проведенной комплексной противовоспалительной терапии установили повышение общего числа Т-лимфоцитов (CD3) (1-я группа до лечения 61,2±1,1%, после лечения 64,8±1,1%, (р<0,05), 2-я группа до лечения 69,8±2,4%, после лечения 70,1±1,9%. Достоверно повысился коэффициент соотношения CD4/CD8 у пациенток обследуемых групп (1-я группа до лечения 1,12±0,1, после лечения 1,17±0,04, 2-я группа до лечения 1,71± 0,2, после лечения 1,82±0,1, р < 0,05).
Отмечалось положительное влияние комплексной противовоспалительной терапии на критерии овариальной недостаточности: сывороточное содержание ФСГ, предовуляторного подъема эстрадиола, содержание ингибина В. В обследуемых группах содержание ИВ до лечения было 96,8±2,3 пкг/мл, во второй группе — 102,1±1,7 пкг/мл, причем сывороточная концентрация Э2: 1-я группа — (85,73±2,4 пкг/мл) и 2-я группа (90,7±3,7 пкг/мл) и ФСГ: 1-я группа — (11,41 ±0,4 мкМЕ/мл) и 2-я группа (9,84±0,9 мкМЕ/мл) указывают на сопоставимость исходных данных. Через 8—10 недель после лечения в 1-й группе содержание Э2 повысилось до 190,7±3,7 пкг/мл, ингибина В — до 128,11±1,79 пкг/мл, (p<0,05).
Обсуждение
Таким образом, реализация патогенных свойств возбудителей ИППП обусловлена сопутствующим микробным «пейзажем», эндокринными расстройствами, длительностью персистирования возбудителей ИППП в макроорганизме и адекватностью ответа иммунной системы на заболевание.Основываясь на проведенном анализе микробных пейзажей в клинических группах еще на этапе стандартного клинико-лабораторного обследования можно установить прямую корреляционную зависимость между длительностью ХВЗОТ и частотой образования антиовариальных антител, что имеет несомненное прогностическое значение для правильного ведения врачом пациентки с аутоиммунным оофоритом на ранней стадии заболевания.
Анализируя корреляционные связи между аутоиммунной овариальной недостаточностью и структурой ИППП у обследуемых пациенток было выявлено, что микст-инфекционные формы (гонорейно-хламидийные ассоциации в комплексе с клиническими признаками синдрома Рейтера) при длительности ХВЗОТ более 5 лет — являются прогностически-значимыми факторами формирования аутоиммунного оофорита воспалительного генеза в сочетании с циркулирующими антиовариальными антителами.
Иммунный ответ при хламидийной инфекции носит преимущественно Т1-хелперный характер, продуктами активации которого являются: IL-1, вырабатываемый активированными макрофагами, истинный Т-клеточный индуктор и TNF-a. Провоспалительные цитокины IL-1 и TNF-a стимулируют рост диплоидных фибробластов, повышают продукцию коллагена, белков основного вещества соединительной ткани, и тем самым, способствуют фиброобразованию [2, 7, 17]. На этом фоне идет беспрерывный синтез белка теплового шока (hsp 60 — heat shock protein 60 kDa), который запускает вторичный иммунный ответ по типу реакции гиперчувствительности замедленного типа [4, 8, 14]. Запуск порочного круга выработки провоспалительных цитокинов еще больше усугубляет картину аутоиммунных нарушений.
Из литературных данных известно, что гонококковая инфекция может активировать раннее существующую хламидийную инфекцию [3, 7, 16].
Трихомониаз, который часто протекает как смешанная инфекция с гонорей, хламидиозом, микоплазмозом и другими ИППП, необходимо также рассматривать как инфекционный резервуар воспалительных заболеваний мочеполового тракта [3, 15].
Как известно, яичники не обособлены от иммунной системы. В яичниках идентифицированы макрофаги, лимфоциты и другие клетки иммунной системы. Эти клетки способны секретировать цитокины, модулирующие регуляцию гонадотропинами яичников при физиологическом менструальном цикле [10]. Логично предположить, что активация цитокинового каскада, вызванная хроническими воспалительными процессами может нарушать овариальную функцию, приводя к усиленной атрезии фолликулов. На завершающей стадии воздействие цитотоксических CD8 клеток приводит не только к атретическим процесса, но и к воздействию на строму яичников. Активация пролиферативных изменений в строме, стимуляция фибробластов приводит к уменьшению функциональной активности овариальной ткани за счёт гиперплазии стромальных элементов.
Если поликлональные антиовариальные антитела воздействуют преимущественно на микроокружение ооцитов [2], то на определенной стадии процесса, на фоне деструкции ооцита, формируются моноклональные антитела к блестящей оболочке (Zp).
Комплекс общих и локальных аутоиммунных реакций поддерживается определенными антигенными инфекционными стимулами. Однако, даже при эрадикации патогенов, вероятно, благодаря механизмам молекулярных мимикрии между собственными белками и микробными суперагентами, порочный круг поражения овариальной ткани замыкается.
Поэтому для оценки риска развития овариальной недостаточности при ХВЗОТ рекомендовано использовать специально разработанную шкалу, которая позволяет объективизировать клинико-анамнестические признаки заболевания. Степень риска оценивается в баллах и возрастает пропорционально значимости каждого показателя для диагностики и прогноза заболевания. Сумма баллов от 2 до 10 свидетельствует о низкой степени риска, от 10 до 25 - о средней степени риска, более 25 — о высокой степени риска формирования овариальной недостаточности при ХВЗОТ.
№№
п/пФакторы риска Клинико-анамнестические данные Оценка в баллах Социально-биологические
1 Возраст женщины: До 30 лет
более 30 лет0
22 Вредные привычки: да
нет3
03 Частые стрессы да
нет3
04 Экстрагенитальные заболевания в анамнезе да
нет3
0Гинекологический анамнез
5 Нарушения менструального цикла в период менархе да 1 нет 0 6 Нарушения менструального цикла по типу гипоменструального синдрома да
нет3
07 Хронические воспалительные заболевания органов малого таза в анамнезе Длительность:
до 3-х лет
3—5 лет
более 5 лет
2
3
58 Беременность в анамнезе да
нет
непрогрессир.беременность
привычное невынашивание0
3
4
510 Искусственные аборты да
нет1
011 Перенесенные ЗППП, однократно да
нет2
012 Перенесенные ЗППП, неоднократно да
нет5
013 Бесплодие, длительность от 1 до 3-х лет да
нет1
014 Бесплодие, длительность более 3-х лет да
нет5
0Данные лабораторного обследования
15 Наличие повышенного уровня циркулирующих поликлональных антиовариальных антител да
нет4
016 Наличие повышенного уровня циркулирующих моноклональных антител к блестящей оболочке фолликулов да
нет5
017 Наличие повышенного уровня маркеров активности аутоиммунитета (АФС-антител, антиспермальных антител, антител к ДНК, антител к микросомальной фракции щитовидной железы и др.) да
нет3
018 Хламидиоз неосложненный в сочетании с гонореей синдром Рейтера 2
4
519 При микст-форме идентификация различных типов Corynebacterium да
нет5
020 Идентификация различных типов Enterobacteriaceae да
нет5
021 Наличие повышенного уровня прововоспалительных цитокинов (IL-1, TNF-a) да
нет5
122 Индекс TNF-a/Е более 20 усл. ед.
10—20
менее 10да
нет5
3
123 Уровень эстрадиола в норме да
нет0
324 Индекс СД4/СД 8 снижен да
нет3
125 УЗИ: адекватные циклу данные фолликулометрии да
нет0
2Комплексная противовоспалительная терапия с применением антибактериальных препаратов (на этапе эрадикации возбудителей), нестероидных противовоспалительных препаратов и малых доз стероидных гормонов (5) позволяет повысить эффективность лечения ХВЗОТ. Современная клиническая практика предусматривает прежде всего контроль эрадикации инфекционного агентов и исчезновение клинических проявлений ХВЗОТ.
Кроме того, в клинической практике крайне сложно избирательно воздействовать на патогенетически значимые иммуномаркеры при поражении функциональной ткани яичников при хронических оофоритах [7, 11, 13].
Проведенное исследование показало перспективность комплексной терапии, направленной на снижение концентрации провоспалительных цитокинов в организме для коррекции выраженности системных и местных проявлений воспалительной реакции [10, 11, 15]. В частности, использование лекарственного препарата — Галавит® (из группы иммуномодуляторов с доказанным противоспалительным и цитокинмодулирующим действием) обеспечивало достоверное снижение повышенных, резистентных к комплексной противовоспалительной терапии уровней провоспалительных (IL-1, TNF-a, IFN-y) цитокинов у женщин с хроническими воспалительными заболеваниями органов малого таза. Полученный опыт еще раз подтверждает патогенетическую целесообразность включения цитокинмодулирующих препаратов в терапию ХВЗОТ, в первую очередь у женщин с высоким риском формирования аутоиммунного оофорита.
ЛИТЕРАТУРА
1. Айламазян Э. К., Потин В. В., Земченкова И. Г. // Вестн. Росс. ассоц. эндокринологов. С.-Петербург. — 2000.-№ 1 (8). С. 67. К патогенезу нормогонадотропной недостаточности яичников.
2. Гзгзян A. M. Роль аутоиммунного оофорита в развитии гипергонадотропной и нормогонадотропной недостаточности яичников: Автореф. дис. канд. мед. наук.- С.-Петербург, 1995. -21 с.
3. Козлова В. И., Пухнер А. Ф. Вирусные, хламидийные и микоплазменные заболевания гениталий. М.: Триада-X, 2003. — 439 С.
4. Потин В. В., Смагина Е. Е., Гзгзян А. М., Рулин В. В., Иоселиани Т. Г. Патогенез и диагностика аутоиммунного оофорита / Журнал акушерства и женских болезней, 2000, т. 49, № 2. — С. 59—66.
5. Серов В. Н. Акушерская патология и синдром системного воспалительного ответа / Сб. Современные проблемы диагностики и лечения нарушений репродуктивного здоровья женщин. Ростов, 2005. С. 35—38.
6. Серов В. Н., Жаров Е. В., Чантурия Н. Г. // Повышение эффективности лечения больных с урогенитальной хламидийной инфекцией / Журнал Российского общества акушеров-гинекологов, 2005. № 3. С. 1920.
7. Царегородцева М. В., Туркаева Т. Н. // Роль провоспалительных цитокинов в формировании аутоиммунного оофорита при персистирующей хламидийной инфекции /Мат. VII Российского форума «Мать и дитя». — М., 2005. С. 540—541.
8. Bannatyne P., Russell P., Shearman R.P, Autoimmune oophoritis: a clinicopathologic assessment of 12 cases// Int. J. Gynecol. Pathol. -1995. -Vol. 9. -N3. -P. 191—207.
9. Barbarino-Monnier P, Gobert B, Guillet-May F et al.: Ovarian autoimmunity and corticotherapy in an in-vitro fertilization attempt. Hum Reprod 2001; 10:2006—2007.
10. Beal A., Gerra F.. Multiple organ failure syndrome: Systemic inflammatory response and organ dysfunction.// JAMA. 1999.v.272p. 226—260.
| Август 2014 г. |