Опубликовано в :
«Вестник анестезиологии и реаниматологии» »» 2012. Т. 9, № 5
Улучшение функции сердца и лёгких при операциях в условиях искусственного кровообращения с использованием гипертонического раствора хлорида натрия1
В. В. Ломиворотов, Е. В. Фоминский, С. М. Ефремов, В. А. Непомнящих, А. Н. Шилова, А. М. Чернявский, В. Н. ЛомиворотовThe improvement of the heart and lungs functions during operations under extracorporeal circulation with a hypertonic solution of sodium chloride1
V. V. Lomivorotov, E. V. Fominsky, S. M. Efremov, V. A. Nepomnyashchikh, A. N. Shilova, A. M. Chernyavsky, V. N. Lomivorotov
Новосибирский НИИ патологии кровообращения им. акад. Е. Н. Мешалкина
1 - Печатается по просьбе компании «Фрезениус Каби», Германия
Применение раствора 7,2% NaCl/ГЭК 200/0,5 у пациентов с ишемической болезнью сердца приводит к достоверному снижению содержания внесосудистой воды лёгких после реваскуляризации миокарда, обеспечивая тем самым эффективную защиту оксигенирующей функции лёгких. Однократное введение 7,2% NaCl/ГЭК 200/0,5 вызывает кратковременное повышение сердечного индекса и является относительно безопасным в отношении нарушения функции почек, гемостаза и развития неврологических расстройств.
Ключевые слова: гипертонический раствор, внесосудистая вода лёгких, оксигенирующая функция, сердечный индекс, искусственное кровообращение.
The use of 7.2% NaCl/hydroxyethyl starch (HES) 200/0.5 in patients with coronary heart disease causes a significant reduction in the content of extravascular lung water after myocardial revascularization, thereby effectively protecting pulmonary oxygenizing function. The single administration of 7.2% NaCl/HES 200/0.5 causes a short-term increase in cardiac index and it is relatively safe in preventing impairments in renal function and hemostasis and the development of neurological disorders.
Key words: hypertensive solution, extravascular lung water, oxygenizing function, cardiac index, extracorporeal circulation.
Органная дисфункция остаётся нередким осложнением операций на сердце с искусственным кровообращением (ИК). Это осложнение полиэтиологично, однако важнейшей причиной его возникновения является избыточный объём вне-сосудистой жидкости [25, 28]. ИК, наряду с другими факторами, вызывает развитие системного воспаления, в процессе которого провоспалительные цитокины способствуют нарушению целостности эндотелия капилляров, приводя к перемещению жидкости из внутрисосудистого в интерстициальное пространство. В результате этого происходит нарушение микроциркуляции и оксигенации тканей, что ведёт к нарушению функции органов [28].
На сегодняшний день существует ряд методов, направленных на уменьшение тканевого отёка, одним из которых является использование гипертонических растворов (ГР). Большинство клинических исследований по применению ГР выполнено у пациентов с травмой на догоспитальном этапе оказания медицинской помощи [16,26,30]. Инфузия ГР приводила к быстрому восстановлению гемодинамики, нормализации сердечной функции, улучшению исходов, а также продемонстрировала безопасность у пациентов данной категории. Всё это привело к возросшему интересу периоперационного использования ГР у кардиохирургических пациентов. На сегодняшний момент большинство авторов показали, что основным положительным эффектом использования ГР в кардиохирургии является меньший суммарный баланс жидкости в послеоперационном периоде [17]. Также установлено, что добавление коллоидного компонента способствует пролонгации действия раствора. Однако данные о гемодинамических изменениях, а также респираторной функции при использовании ГР носят противоречивый характер и не дают полного представления о механизмах действия и эффектах данного раствора [14,23,24].
Цель исследования - изучение влияния 7,2% NaCl/гидроксиэтилированного крахмала 200/0,5 (ГР/ГЭК) на сердечно-сосудистую и дыхательную систему, а также безопасности использования данного раствора у пациентов с ишемической болезнью сердца (ИБС) после реваскуляризации миокарда в условиях ИК.
Материалы и методы
Проведено проспективное, рандомизированное, слепое исследование. Обследовали 40 больных ИБС, которым было выполнено аортокоронарное шунтирование в условиях ИК. Дизайн настоящей работы был одобрен этическим комитетом института. Также было получено информированное согласие пациентов перед их включением в исследование. Критериями исключения являлись: экстренное оперативное вмешательство, возраст старше 70 лет, фракция выброса левого желудочка менее 40%, инфаркт миокарда давностью менее 6 мес., сопутствующие заболевания дыхательной системы, скорость клубочковой фильтрации менее 90 мл/мин, острое нарушение мозгового кровообращения давностью менее одного года. После рандомизации больным основной группы (n = 20) вводили ГР/ГЭК (ГиперХАЕС, Fresenius Kabi, Германия), а контрольной (n = 20) - 0,9% NaCl в дозе 4 мл/кг в течение 30 мин после индукции анестезии до начала ИК. Интраоперационно, а также в отделении реанимации и интенсивной терапии (ОРИТ) для восполнения перспирационных потерь и диуреза проводили инфузионную терапию кристаллоидными растворами. Для нормализации волемического статуса использовали раствор модифицированного желатина (Гелофузин, B|Braun, Германия). Вводную анестезию осуществляли введением фентанила (3-5 мкг/кг) и мидозалама (0,1-0,15 мг/кг). Миоплегию обеспечивали пипекуронием (0,1 мг/кг). Севофлуран (1-2%) и фентанил дробно использовали для поддержания анестезии, во время ИК применяли инфузию пропофола [2-4 мг/(кг•ч-1)]. Искусственную вентиляцию лёгких (ИВЛ) проводили с фракционной концентрацией кислорода (FiO2) 50%, дыхательным объёмом 8 мл/кг, положительным давлением в конце выдоха 2-5 см вод. ст. и поддержанием нормокапнии. Первичный объём аппарата ИК состоял из 500 мл гелофузина, 500 мл кристаллоидного раствора, 200 мл 10% раствора маннита, 150 мл 4,2% раствора натрия гидрокарбоната. Объёмная скорость перфузии составляла 2,4-2,8 л/(мин • м-2), среднее артериальное давление (САД) поддерживали на уровне 50-70 мм рт. ст., назофарингеальную температуру -36,0-36,6°С. Для защиты миокарда применяли фармакохолодовую кристаллоидную кардиоплегию. Идентичный протокол ультрафильтрации использовали с целью удаления кардиоплегического раствора и раствора первичного заполнения аппарата ИК. Глюкокортикостероидные гормоны не назначали на протяжении всего исследования.
Сердечно-сосудистую систему исследовали, оценивая частоту сердечных сокращений (ЧСС), САД, среднее давление в лёгочной артерии (сДЛА), центральное венозное давление (ЦВД), давление заклинивания лёгочных капилляров (ДЗЛК), общее периферическое сосудистое сопротивление (ОПСС), лёгочное сосудистое сопротивление (ЛСС), индекс ударного объёма (ИУО), сердечный индекс (СИ). Для измерения гемодинамических параметров использовали катетер Свана - Ганца и систему PiCCO plus (Pulsion Medical Systems AG, Германия).
Для оценки респираторной, а также кислородтранспортной функции крови анализировали индекс оксигенации (PaO2/FiO2), альвеолярно-артериальную разницу по кислороду (AaDO2), фракцию венозного шунта (Qs/Qt), индекс доставки (DO2I), потребления (VO2I), и экстракции кислорода (O2EI). Также изучали динамику индекса внесосудистой воды лёгких (ИВСВЛ) с помощью метода транспульмональной термодилюции. Для оценки кислотно-основного состояния определяли pH, стандартный бикарбонат (stHCO3), избыток оснований (BE). Для изучения водно-электролитного обмена использовали осмолярность плазмы крови, концентрацию ионов Na+ и Cl-. Анализ газов и электролитов крови выполняли с помощью аппарата Rapidlab 865 (Bayer Corporation, Великобритания), осмолярность определяли прибором Osmostat 030 (Gonotec, Германия).
Для оценки развития системного воспалительного ответа исследовали в крови концентрацию интерлейкина-6 (IL-6), эндотелиальных молекул адгезии лейкоцитов (sE-selectin), молекул межклеточной адгезии (ICAM-1). Определение вышеперечисленных маркёров осуществляли с помощью ферментсвязанного иммуносорбентного анализа с использованием набора реагентов ELISA (Bender MedSystems GmbH, Австрия).
Анализ почечной функции проводили путём определения в сыворотке крови концентрации креатинина методом Jaffe (Analyticon Biotechnologies AG, Германия), а также измерения концентрации сывороточного цистатина С (более специфичный и чувствительный маркёр нарушения скорости клубочковой фильтрации) методом иммунопреципитации (Thermo Fisher Scientific Oy, Финляндия) [9]. Количественное определение нейтрофильного желатиназо-ассоциированного липокалина (uNGAL) в моче использовали для выявления повреждения почечных канальцев при помощи метода хемилюминесцентного иммуноанализа (ARCHITECT, Abbott Laboratories, Ирландия) [3].
Оценку показателей гемодинамики и ИВСВЛ осуществляли на следующих этапах исследования: после индукции анестезии, 5 мин после инфузии, 5 мин после ИК, 30 мин после ИК, конец операции, 2, 4, 6 и 12 ч после ИК, 1-й послеоперационный день (ПОД). Анализ лабораторных данных выполняли после индукции анестезии, 5 мин после ИК, 2 и 4 ч после ИК, 1-й ПОД, дополнительно на 5-й мин после инфузии и 10-й мин ИК изучали осмолярность и концентрацию Na+.
Суммарный баланс жидкости, баланс вводимых кристаллоидных и коллоидных растворов, объём диуреза изучали к окончанию оперативного вмешательства и в 1-й ПОД.
Проводили анализ клинических данных послеоперационного периода: летальности, длительности нахождения в ОРИТ, длительности госпитализации, частоты инотропной поддержки, нарушений ритма, инфекционных осложнений, объёма дренажных потерь, длительности ИВЛ.
Для оценки нормальности распределения количественных признаков применяли визуальную оценку частотного распределения (по гистограмме и графику нормальности) с последующим использованием критериев Шапиро - Уилка. Нормального распределения признаков не наблюдали, поэтому использовали методы непараметрической статистики. Количественные признаки представлены в виде медианы и границ межквартильного интервала (в скобках). Для качественных признаков приведены доля в процентах от числа всех наблюдений и границы 95%-ного доверительного интервала (в скобках). Сравнительный анализ количественных признаков выполняли с помощью критерия Фишера - Питмана. Сравнение качественных признаков проводили с использованием критерия Фишера. Для всех статистических критериев ошибку первого рода устанавливали равной 0,05. Нулевую гипотезу (отсутствие различий) отвергали, если вероятность (p) не превышала ошибку первого рода. Статистический анализ данных выполняли c использованием лицензионной программы Stata 12 (StatCorp, США).
Результаты
Основные демографические и клинические характеристики больных обеих групп, представленные в табл.1, достоверно между собой не различались. Ни один из пациентов не был исключён из исследования. Продолжительность лёгочной вентиляции, объём кровопотери, частота инотропной поддержки и длительность нахождения пациентов в ОРИТ были сопоставимы в обеих группах (табл. 1).
В результате анализа параметров центральной гемодинамики показано, что через 5 мин после инфузии ГР/ГЭК значения ДЗЛК и ЦВД были достоверно выше в основной группе (р<0,05) по сравнению с контрольной, в этой же точке ИУО и СИ также имели более высокие значения (р<0,05 и р<0,001 соответственно) в группе с ГР/ГЭК. Через 5 мин после инфузии ИССС был значительно ниже (р<0,01) в основной группе (табл. 2).
Показатели ИВСВЛ представлены в табл. 2. Исходные значения ИВСВЛ были сопоставимы в обеих группах. Через 30 мин после окончания ИК и во всех последующих точках исследования у больных основной группы отмечено достоверно меньшее содержание внесосудистой воды лёгких по сравнению с контрольной.
Динамика респираторной функции представлена в табл. 3. Исходные значения респираторных показателей не отличались между группами. Однако через 5 мин, 2 и 4 ч после ИК показатель PaO2/FiO2 был достоверно выше, а величина AaDO2 в этих же точках имела существенно меньшие значения в основной группе по сравнению с контрольной. Значения DO2I были достоверно выше через 5 мин после ИК и в 1-й послеоперационный день (ПОД) в группе с ГР/ГЭК.
При анализе кислотно-основного состояния были выявлены достоверные отличия BE через 2 и 4 ч после ИК, а также в 1-й ПОД, значения которого были достоверно ниже в основной группе по сравнению с контрольной. Соответственно изменениям ВЕ показатели рН также были существенно ниже в основной группе через 2 и 4 ч после ИК. Однако следует заметить, что значения рН не выходили за границы нормальных значений. Концентрация stHCO3 не отличалась среди пациентов обеих групп. Содержание ионов Cl- было значительно выше в основной группе через 5 мин, 2 ч, 4 ч после ИК, а также в 1-й ПОД (табл. 4).
При изучении водно-электролитного обмена установили, что осмолярность плазмы через 5 мин после инфузии ГР/ГЭК и на 10-й мин ИК была выше по сравнению с контрольной группой. Отметим, что через 5 мин, 2 ч, 4 ч и спустя сутки после ИК осмолярность плазмы в обеих группах достоверно не отличалась (табл. 5). Характерно, что содержание натрия было достоверно выше практически во всех точках исследования после введения ГР/ГЭК по сравнению с контрольной группой (табл. 5). Соответственно, суммарный баланс жидкости, а также баланс коллоидных растворов к концу операции был значительно меньше в основной группе по сравнению с контрольной (табл. 6).
В результате исследования показателей, отражающих почечную функцию, обнаружено, что значения креатинина сыворотки были существенно ниже в основной группе (p<0,05) на 5-й мин после ИК и в 1-й ПОД. В этой же группе концентрация цистатина С в сыворотке крови также имела достоверно меньшие значения (p<0,01) через 5 мин, 2 и 4 ч после ИК. При этом необходимо указать, что концентрации креатинина и цистатина С на протяжении исследования не превышали уровня 150% от исходных значений, что соответствовало бы стадии R (risk) острого повреждения почек по классификации RIFLE [27]. Изучение показателей uNGAL выявило повышение содержания данного маркёра выше референсных значений через 4 ч и в 1-й ПОД с достоверно более высокой концентрацией в контрольной группе (p<0,05) по сравнению с основной в 1-й ПОД (табл. 7).
Оценка маркёров системного воспалительного ответа свидетельствовала о том, что уровень IL-6 был достоверно меньше через 4 ч после ИК в группе с ГР/ГЭК. Характерно, что в той же точке, а также в 1-й ПОД уровни ICAM-1 и sE-selectin были значительно ниже в основной группе по сравнению с контрольной (рис.).
Таблица 1. Периоперационные данные пациентов
Примечание: данные представлены как медиана (25–75-й процентили); для качественных признаков приведены доля в процентах от числа всех наблюдений (границы 95%-ного доверительного интервала).
Число пациентов Контрольная группа (n = 20) Основная группа (n = 20) Р Возраст, лет 57 (51-63) 59 (54-63) 0,665 Пол, м 95% (75-100%) 75% (51-91%) 0,182 Индекс массы тела, кг/м2 31,2 (28,1-32,9) 28,9 (26,3-31,6) 0,149 Фракция выброса ЛЖ, % 59(54-64) 64 (56-67) 0,287 ПИКС 75% (51-91%) 80% (56-94%) 1,000 ХСН (NYHA) 2 (2-3) 3(2-3) 0,249 Стеноз БЦА 20% (6-44%) 15% (3-38%) 1,000 ОНМК в анамнезе 10% (1-32%) 0% (0-17%) 0,487 Стенокардия напряжения
0 ФК
I ФК
II ФК
III ФК
IV ФК
Нестабильная стенокардия
EuroSCORE, баллы
10% (1,23-31,7%)
0% (0-16,84%)
20% (5,73-43,66%)
50% (27,2-72,8%)
15% (3,21-37,89%)
5% (0,13-24,87%)
2(0-5)
0% (0-16,84%)
0% (0-16,84%)
20% (5,73-43,66%)
60% (36,05-80,88%)
0% (0-16,84%)
20% (5,73-43,66%)
2(1-4)
0,211
0,546Количество шунтов
1
2
3
4
5% (0,13-24,87%)
40% (19,12-63,95%)
50% (27,2-72,8%)
5% (0,13-24,87%)
0% (0-16,84%)
25% (8,66-49,1%)
60% (36,05-80,88%)
15% (3,21-37,89%)
0,489
Эндартерэктомия 0% (0-17%) 20% (6-44%) 0,106 Время ИК, мин 58 (48-75) 58 (44-73) 0,714 Время окклюзии аорты, мин 36 (27-42) 33 (26-44) 0,628 Объем кардиоплегии, мл 1050 (950-1250) 1050 (950-1250) 1,000 Длительность ИВЛ, ч 7(5-8) 6(5-7) 0,688 Кровопотеря в 1-й ПОД, мл/кг 3,97 (2,67-5,73) 4,97 (3,60-5,54) 0,435 Инотропная поддержка 40% (19-64%) 15% (3-38%) 0,155 Фибрилляция предсердий 15% (3-38%) 20% (6-44%) 1,000 Количество дней в ОРИТ 2(1-3) 1 (1-2) 0,443 Длительность госпитализации, день 18 (16-20) 18 (15-21) 1,000 ПИКС – постинфарктный кардиосклероз; ХСН – хроническая сердечная недостаточность; БЦА – брахиоцефальные артерии; ОНМК – острое нарушение мозгового кровообращения; ИК – искусственное кровообращение; EuroSCORE – Европейская шкала оценки риска кардиохирургической операции; ИВЛ – искусственная вентиляция лёгких; ПОД – послеоперационный день; ОРИТ – отделение реанимации и интенсивной терапии.
Таблица 2. Динамика показателей гемодинамики, ИВСВЛ
Примечание: данные представлены как медиана (25–75-й процентили). *p<0,05; †p<0,01; ‡p<0,001 достоверные различия между группами согласно критерия Фишера – Питмана.
Показатели После ИК После индукции анестезии 5 мин
после
инфузии5 мин
после
ИК30 мин
после
ИККонец
операции2 ч 4 ч 6 ч 12 ч 1-й ПОД ЧСС, сокр./мин ОГ 65
(58–71)77
(67–80)85
(80–90)82
(79–88)85
(81–92)91
(81–96)84
(74–90)79
(77–91)84
(79–89)85
(76–94)КГ 71
(62–76)71
(61–75)83
(78–93)84
(79–91)87
(81–94)86
(80–96)84
(76–93)82
(77–89)80
(77–90)82
(79–94)САД, мм рт. ст. ОГ 83
(78–87)80
(76–87)80
(76–82)73
(70–84)78
(75–82)76
(72–83)78
(72–81)81
(75–87)83
(80–86)84
(77–91)КГ 83
(78–87)84
(77–88)77
(75–86)80
(75–85)76
(71–83)80
(74–85)73
(70–80)73
(68–78)75
(70–79)82
(79–87)ДЗЛК, мм рт. ст. ОГ 11
(9–12)13
(11–14)*12
(11–13)12
(10–13)11
(11–13)10
(8–12)11
(10–12)11
(10–13)11
(11–12)12
(11–14)КГ 10
(8–11)12
(10–13)12
(11–13)12
(11–13)12
(11–13)11
(9–13)13
(12–15)13
(11–14)12
(10–14)13
(11–14)сДЛА, мм рт. ст. ОГ 16
(14–18)19
(18–21)18
(16–21)18
(16–22)19
(17–20)19
(16–21)20
(18–21)21
(19–23)20
(17–24)21
(18–23)КГ 17
(15–19)19
(16–20)18
(17–21)19
(19–21)19
(18–21)18
(16–21)20
(17–21)20
(19–22)20
(18–22)22
(20–24)ЦВД, мм рт. ст. ОГ 7
(5–8)8
(7–10)*9
(9–10)9
(8–11)10
(9–12)9
(8–10)9
(8–11)11
(9–12)10
(9–11)10
(9–12)КГ 7
(7–8)8
(7–8)10
(9–11)10
(9–11)11
(10–12)9
(8–11)10
(9–12)11
(9–11)10
(9–11)11
(10–12)ИЛСС, дин·с·см-5/м2 ОГ 189
(158–246)157
(118–210)142
(110–178)167
(136–227)193
(136–230)194
(168–286)208
(172–244)217
(159–301)206
(168–273)201
(153–242)КГ 222
(123–283)176
(162–255)140
(110–211)172
(156–217)183
(131–228)189
(151–270)160
(112–227)200
(149–251)204
(158–237)219
(186–248)ИУО, мл/м2 ОГ 36
(33–40)45
(39–50)*45
(38–48)37
(35–43)38
(33–42)35
(32–39)37
(33-41)37
(33–44)38
(33–44)35
(33–42)КГ 38
(34–40)42
(33–45)41
(36–45)36
(33–41)35
(34–38)32
(28–38)37
(31–44)40
(30–47)41
(35–48)40
(34–46)ИССС, дин·с·см-5/м2 ОГ 2605
(2114–3067)1724
(1607–1996)†1515
(1300–1854)1763
(1440–2054)1761
(1432–2128)1754
(1449–2005)1859
(1446–2158)1993
(1478–2212)1879
(1636–2231)1946
(1676–2412)КГ 2339
(2103–2612)2161
(1946–2406)1615
(1379–1851)1849
(1560–1922)1678
(1537–1866)1970
(1697–2259)1600
(1370–1924)1571
(1320–2006)1544
(1416–1955)1675
(1436–2042)СИ (л·мин/м2) ОГ 2,36
(2,06–2,56)3,24
(2,95–3,73)‡3,76
(3,15–4,17)3,10
(2,80–3,50)3,15
(2,64–3,64)3,12
(2,78–3,64)2,99
(2,57–3,46)3,07
(2,61–3,39)3,02
(2,78–3,45)3,05
(2,77–3,42)КГ 2,61
(2,31–2,86)2,73
(2,43–2,90)3,28
(3,03–4,06)2,95
(2,78–3,37)3,00
(2,79–3,37)2,71
(2,44–3,34)2,92
(2,65–3,49)3,14
(2,53–3,86)3,32
(2,70–3,66)3,30
(2,93–3,72)ИВСВЛ, мл/кг ОГ 9 (8–10) 9 (8–10) 9 (8–9) 9 (8–9)* 8 (8–9)* 8 (7–8)* 7 (6–8)‡ 7 (6–7)‡ 7 (6–8)‡ 7 (7–8)† КГ 8 (8–9) 8 (8–10) 10 (9–10) 9 (9–10) 9 (8–10) 9 (8–10) 9 (8–10) 9 (8–10) 9 (8–10) 9 (8–10) СИ – сердечный индекс; ИК – искусственное кровообращение; ЦВД – центральное венозное давление; ИВСВЛ – индекс внесосудистой воды лёгких; ЧСС – частота сердечных сокращений; САД – среднее артериальное давление; сДЛА – среднее давление в лёгочной артерии; ДЗЛК – давление заклинивания лёгочных капилляров; ИЛСС – индекс лёгочного сосудистого сопротивления; ИССС – индекс системного сосудистого сопротивления; ИУО – индекс ударного объёма; ИВСВЛ – индекс внесосудистой воды лёгких; ОГ – основная группа; КГ – контрольная группа.
Таблица 3. Динамика респираторной функции
Примечание: данные представлены как медиана (25–75-й процентили). * -p<0,05; † - p<0,01 достоверные различия между группами согласно критерию Фишера – Питмана.
Показатели После индукции
анестезииПосле ИК 1-й ПОД 5 мин 2 ч 4 ч PaO2/FiO2, мм рт. ст. ОГ 378 (336–434) 298 (226–404)† 310 (232–362)* 383 (303–417)* 333 (305–394) КГ 334 (296–422) 206 (156–286) 235 (163–308) 316 (250–354) 302 (279–379) AaDO2, мм рт. ст. ОГ 134 (106–168) 197 (131–231)† 168 (140–203)† 126 (114–169)* 46 (34–83) КГ 164 (119–203) 244 (213–313) 199 (188–294) 191 (135–238) 50 (41–71) Qs/Qt (%) ОГ 8,4 (5,5–12,5) 18,6 (14,7–26,4) 15,2 (10,5–17,8) 10,8 (7,7–13,1) 12,3 (9,2–19) КГ 12,2 (8,8–15,6) 21,4 (17,3–25,2) 14,4 (12,5–18,2) 12,5 (9,3–16,2) 14,6 (10,1–23) DO2I, мл/(мин·м-2) ОГ 426 (382–489) 465 (404–574)† 599 (487–680) 509 (376–547) 504 (380–518)* КГ 455 (390–504) 353 (319–403) 506 (462–591) 444 (392–526) 393 (358–447) VO2I, мл/(мин·м-2) ОГ 103 (91–141) 105 (77–122) 158 (138–184) 143 (119–160) 169 (144–203)* КГ 119 (98–163) 93 (86–109) 180 (142–209) 149 (128–176) 131 (116–170) O2EI (%) ОГ 26,0 (22,5–29,3) 21,9 (19,6–24,8) 28,3 (23,5–32,9)† 29,5 (26,5–32,0) 36,5 (32,3–41,4) КГ 28,8 (22,3–34,3) 27,4 (23,3–30,3) 32,4 (28,9–38,4) 33,7 (27,9–38,3) 35,6 (29,7–40,3) PaO2/FiO2 – индекс оксигенации; AaDO2 – альвеолярно-артериальная разница по кислороду; Qs/Qt – фракция венозного шунта; DO2I – индекс доставки кислорода; VO2I – индекс потребления кислорода; O2EI – индекс экстракции кислорода; ПОД – послеоперационный день; ОГ – основная группа; КГ – контрольная группа.
Таблица 4. Динамика показателей кислотно-основного состояния и Cl -
Примечание: данные представлены как медиана (25–75-й процентили). Достоверные различия между группами согласно критерию Фишера – Питмана.
Параметры Этапы ОГ КГ p pH После ИА 7,440 (7,418–7,459) 7,441 (7,413–7,473) 5 мин после ИК 7,404 (7,383–7,442) 7,428 (7,408–7,447) 2 ч после ИК 7,372 (7,331–7,413) 7,427 (7,383–7,465) 0,002 4 ч после ИК 7,365 (7,331–7,413) 7,428 (7,392–7,451) 0,001 1-й ПОД 7,419 (7,381–7,435) 7,428 (7,407–7,443) stHCO3, ммоль/л После ИА 24,15 (22,8–24,95) 23,7 (22,35–24,75) 5 мин после ИК 23 (22,3–24,15) 23,3 (21,8–24,9) 2 ч после ИК 23,55 (20,9–25,05) 24,7 (23,3-25,95) 4 ч после ИК 23,35 (20,75–24,1) 23,8 (23,15–24,95) 1-й ПОД 25,3 (24,15–27,05) 26,55 (25,8–28,45) stBE, ммоль/л После ИА -0,3 (-1,5– 0,45) -0,6 (-1,85... -0,6) 5 мин после ИК -2,2 (-3,1... -1,25) -1,65 (-3,3... -0,1) 2 ч после ИК -2,2 (-4,95... -1,35) -0,35 (-1,85– 0,85) 0,01 4 ч после ИК -2,6 (-5,5... -1,7) -1,2 (-2,05 –0,4) 0,001 1-й ПОД -0,15 (-1,45... -1,15) -0,85 (-0,3...-2,9) 0,04 Cl -, ммоль/л После ИА 108,5 (104–110) 107 (105–110) 5 мин после ИК 117 (113,5–123,5) 107 (105,5–110) 0,0001 2 ч после ИК 120,5 (116–124) 109 (106,5–113) <0,0001 4 ч после ИК 117,5 (116,5–122,5) 110,5 (106,5–112) 0,0001 1-й ПОД 118 (115–122) 111,5 (107,5–113) 0,0004 pH – отрицательный десятичный логарифм концентрации протонов водорода; stHCO3 – стандартный бикарбонат; stBE – избыток оснований; Cl - – концентрация ионов хлора; ИА – индукция анестезии; ПОД – послеоперационный день; ОГ – основная группа; КГ – контрольная группа.
Таблица 5. Динамика осмолярности и Na+
Примечание: данные представлены как медиана (25–75-й процентили). ОГ – основная группа; КГ – контрольная группа; ПОД – послеоперационный день.
Показатели После индукции
анестезии5 мин после
инфузии10 мин ИК После ИК 5 мин 2 ч 4 ч 1-й ПОД Осмолярность, мосмоль/л ОГ 304
(301–311)331
(325–337)†336
(330–340)†337
(333–340)339
(332–341)336
(332–343)326
(320–330)КГ 306
(306–314)309
(304–316)321
(316–324)323
(319–324)326
(321–327)327
(320–346)321
(311–328)Na+ (ммоль/л) ОГ 137
(136–140)
(144–149)‡143
(140–146)‡144
(142–147)‡150
(147–152)‡149
(147–150)‡146
(142–148)†КГ 137
(136–137)137
(136–138)137
(135–139)137
(135–139)141
(140–143)141
(140–144)142
(139–144)
* – p<0,05; † – p<0,01; ‡ – p<0,001 достоверные различия между группами согласно критерию Фишера – Питмана.Таблица 6. Динамика периоперационного баланса жидкости
Примечание: данные представлены как медиана (25–75-й процентили). Баланс кристаллоидных растворов равен сумме объёмов всех введённых кристаллоидных растворов. Баланс коллоидных растворов равен сумме объёмов всех введённых коллоидных растворов. Суммарный баланс жидкости к концу операции равен разнице между всеми введёнными растворами и диурезом. Суммарный баланс жидкости к 1-му послеоперационному дню равен разнице между всеми введёнными растворами, диурезом и кровопотерей. ПОД – послеоперационный день.
Показатели Конец операции 1-й ПОД Баланс кристаллоидных растворов, мл Основная группа 900 (900–1100) 2095 (1550–2450) Контрольная группа 1150 (1000–1300) 1550 (1225–2060) Баланс коллоидных растворов, мл Основная группа 350 (275–425) p<0,05* 500 (225–1135) Контрольная группа 500 (500–640) 500 (500–1025) Суммарный баланс жидкости, мл Основная группа -1069 (-1550; -625) p<0,001* -325 (-875; 195) Контрольная группа -275 (-550; -25) -325 (-785; 565) Диурез, мл Основная группа 2125 (1700–2475) 2775 (2325–2980) Контрольная группа 1600 (1300–2050) 2425 (2175–2575)
* – достоверные различия между группами согласно критерию Фишера – Питмана.Таблица 7. Динамика маркёров повреждения почек
Примечание: данные представлены как медиана (25–75-й процентили).
Показатели После индукции
анестезииПосле ИК 1-й ПОД 5 мин 2 ч 4 ч Креатинин (мкмоль/л) ОГ % 82 (73–89)
10084 (79–92)*
102 (96–112)97 (93–115)
118 (113–140)112 (105–124)
136 (128–149)96 (92–102)*
117 (112–124)КГ % 93 (76–100)
10093 (81–108)
100 (87–116)109 (96–115)
117 (103–123)117 (106–124)
125 (113–133)114 (96–121)
122 (103–130)Цистатин С (мг/л) ОГ % 0,8 (0,71–0,93)
1000,72 (0,65–0,79)†
90 (78–103)0,72 (0,63–0,82)†
90 (78–103)0,75 (0,68–0,9)†
94 (85–113)0,83 (0,73–0,87)
104 (91–109)КГ % 0,89 (0,77–0,99)
1000,9 (0,76–0,96)
101 (85–108)0,91 (0,76–1,04)
102 (85–116)0,91 (0,82–1,1)
102 (92–112)0,91 (0,77–1,13)
102 (87–127)uNGAL (нг/мл) ОГ 2,4 (1,83–6,4) 7,6 (2,9–11,73) 8,0 (5,6–17,1) 9,9 (6,5–33,5) 16,6 (12,0–29,6)* КГ 5,9 (5,0–7,3) 9,2 (5,5–13,4) 6,2 (5,15–11,5) 12,8 (9,5–20,2) 29,6 (17,7–58,2)
* – p<0,05; † – p<0,01 достоверные различия между группами согласно критерию Фишера – Питмана.
Креатинин сыворотки крови; цистатин С сыворотки крови (референсные значения 0,63–1,44 мг/л для здоровых добровольцев старше 50 лет); uNGAL, нейтрофильный желатиназо-ассоциированный липокалин мочи (референсные значения 0,7–9,6 нг/мл в моче здоровых добровольцев); ОГ – основная группа; КГ – контрольная группа; ПОД – послеоперационный день.
Рис. Динамика плазменных уровней интерлейкина-6 (IL-6, норма: <5 пг/дл), эндотелиальных молекул адгезии лейкоцитов (sE-selectin, норма: 7–137 нг/мл), молекул межклеточной адгезии (sICAM-1, норма: 200–300 нг/мл) в обеих группах.
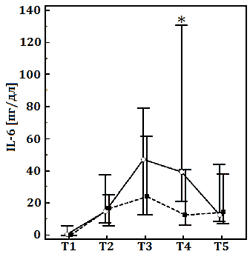
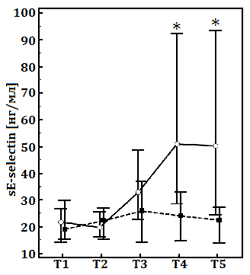
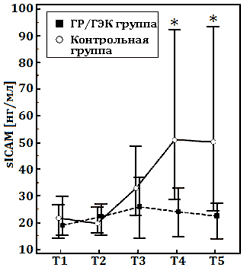
Данные представлены как медиана (25–75-й процентили). ГР/ГЭК, раствор 7,2% NaCl/гидроксиэтилированного крахмала 200/0,5. Этапы исследования: Т1, после индукции анестезии; Т2, 5 мин после ИК; Т3, 2 ч после ИК; Т4, 4 ч после ИК; Т5, 1-й послеоперационный день.
* – p<0,05 – достоверные различия между группами согласно критерию Фишера – Питмана.В данном клиническом исследовании показано, что применение ГР/ГЭК у больных ИБС до начала ИК сопровождается менее выраженным накоплением внесосудистой воды лёгких после реваскуляризации миокарда. Полученные данные вполне объяснимы увеличением осмотического давления плазмы вследствие введения ГР/ГЭК, которое приводит к перемещению жидкости из интерстициального пространства во внутрисосудистый компартмент лёгких. Тканевый отёк, способствуя нарушению микроциркуляции и оксигенации тканей, приводит к нарушению функционирования многих органов, включая легкие, сердце, головной мозг и определяет неблагоприятные исходы [1, 7, 10]. Меньшее количество внесосудистой воды выражалось в лучшей защите оксигенирующей функции лёгких у пациентов в группе с ГР/ГЭК, на что указывают более высокие значения PaO2/FiO2 и существенно низкие показатели AaDO2.
Применение ГР/ГЭК потребовало существенно меньшего количества коллоидных растворов во время операции, в итоге к концу оперативного вмешательства суммарный баланс жидкости был значительно меньше в основной группе по сравнению с контрольной. Данный факт также способствовал лучшей функции лёгких в послеоперационном периоде после проведения ИК [4].
Одним из результатов настоящего исследования является кратковременное улучшение гемодинамики при применении ГР/ГЭК. Через 5 мин после введения раствора отмечали более высокие значения ИУО и, соответственно, СИ. Механизм увеличения сердечного выброса при использовании ГР на сегодняшний день остаётся до конца не выясненным. Несмотря на то что исследования на изолированной сердечной ткани и сердцах, а также эксперименты на животных демонстрируют усиление миокардиальной сократимости, данные A. Goertz et al. (1995) указывают на сомнительную клиническую значимость положительного инотропного действия ГР/ГЭК [2,6,8,13]. Авторы работы прирост СИ объясняют увеличением как преднагрузки (более высокие значения давлений заполнения камер сердца ЦВД и ДЗЛК), так и уменьшением постнагрузки в результате снижения ИОПСС. В итоге увеличение СИ и менее нарушенная оксигенация крови в лёгких привели к более высокой доставке кислорода тканям после инфузии ГР/ГЭК. В отличие от работ, указывающих на увеличение АД при введении ГР, а иногда и на уменьшение данного параметра при быстрой скорости инфузии, в настоящем исследовании изменений САД не зарегистрировано.
Следующим результатом настоящего исследования является меньшая выраженность системного воспалительного ответа, вызванного ИК, в основной группе. На это указывает более низкое содержание провоспалительных цитокинов и молекул межклеточной адгезии в группе с использованием ГР/ГЭК. Системное воспаление, являясь неспецифическим патофизиологическим процессом, имеет сложный механизм развития. Оно представлено не только гуморальным, но и клеточным компонентом, а также имеет многофакторный характер взаимодействия составляющих его элементов [2]. Мы выявили достоверные отличия лишь в содержании отдельных маркёров воспаления. Соответственно, авторы заявляют только о возможном иммуномодулирующем эффекте ГР/ГЭК. Тем не менее наши данные соотносятся с выводами других исследователей, которые показали, что применение ГР способно уменьшать провоспалительную реактивность макрофагов, ослаблять секвестрацию нейтрофилов в лёгких за счёт подавления их адгезии и миграции через эндотелий капилляров [5,22].
Применение ГР NaCl приводит к повышению плазменной концентрации натрия, что может повреждать нервную систему вследствие клеточной дегидратации. В настоящем исследовании, несмотря на высокую скорость введения ГР/ГЭК, концентрация натрия и осмолярность плазмы не превышали 160 ммоль/л и 350 мосмоль/л соответственно. При этом случаев неврологических расстройств у больных не зарегистрировано. Другим неблагоприятным эффектом ГР/ГЭК является вероятность объёмной перегрузки сердца вследствие внезапного увеличения объёма циркулирующей крови [24]. В данном исследовании признаков прогрессирования сердечной недостаточности у пациентов не наблюдали.
Острое почечное повреждение является одним из наиболее серьёзных осложнений операций в условиях ИК. Было показано, что повреждение почек у кардиохирургических пациентов связано с удлинением сроков госпитализации, а также увеличением уровня летальности и снижением выживаемости даже после полного восстановления ренальной функции [11, 12, 18]. В настоящее время вопрос негативного влияния ГЭК на функцию почек является крайне актуальной и до конца не решённой проблемой. Так, в исследовании J. Rioux et al. (2009) было обнаружено, что растворы пента-крахмала являются независимым фактором риска острого почечного повреждения у кардиохирургических пациентов [5]. С другой стороны, результаты S. Magder et al. (2010) не выявили различий в почечной функции при лечении гиповолемии у кардиохирургических пациентов при использовании 10% ГЭК 200/0,5 и 0,9% NaCl [15]. Применяемый в настоящем исследовании препарат является комбинированным раствором с содержанием 6% ГЭК 200/0,5. Помимо ГЭК, высокое содержание ионов Cl- (1232 ммоль/л) также может приводить к повреждению почек. Ионы Cl-, модифицируя чувствительность сосудов почек к вазоконстрикторным агентам, способствуют повышению почечного сосудистого сопротивления, что приводит к снижению скорости клубочковой фильтрации [20, 29]. Однако при оценке ренальной функции авторы не выявили признаков острой почечной недостаточности среди пациентов обеих групп, уровни креатинина и цистатина С сыворотки не превышали 150% от исходных значений на протяжении всего периода исследования (согласно критериям RIFLE) [27]. Не выявлено различий в уровнях диуреза к концу операции и в 1-й ПОД среди пациентов обеих групп. Более того, на этапах исследования регистрировали достоверно меньшее содержание креатинина и цистатина С в сыворотке крови пациентов основной группы, что свидетельствует о меньшей степени повреждения почек больных группы с ГР/ГЭК. Достоверно более низкие уровни NGAL в моче пациентов с применением ГР/ГЭК в 1-й ПОД также свидетельствуют о меньшей степени повреждения почечных канальцев.
Помимо прямого потенциально отрицательного действия ГЭК и гиперхлоремии, высвобождение провоспалительных цитокинов также оказывает влияние на почечную функцию [19]. Соответственно, более низкие уровни IL-6, sE-selectina и ICAM-1 в основной группе также могут объяснять меньшую степень повреждения почечных канальцев при использовании ГР/ГЭК.
Настоящее исследование имеет ряд ограничений. Во-первых, исследуемая группа включала пациентов с нормальной фракцией выброса, без тяжелой сопутствующей патологии и непродолжительным ИК. Следовательно, мы не можем относить полученные результаты к более тяжёлой категории пациентов ИБС, имеющих низкую фракцию выброса левого желудочка, тяжёлые сопутствующие заболевания и длительную перфузию. Во-вторых, мы не проводили мониторинг массы тела наших пациентов, изменения которого отражают истинный суммарный баланс жидкости. Кроме того, не исследовали показатели гемостаза, тем не менее следует указать на отсутствие различий между группами в объеме кровопотери в 1-й ПОД. Третьим ограничением данной работы является тот факт, что в контрольной группе использовали не ГЭК, а 0,9% раствор NaCl. Очевидно, что присутствие коллоидного компонента (ГЭК 200/0,5) в составе применяемого ГР NaCl могло бы способствовать более высокому уровню коллоидно-осмотического давления по сравнению с 0,9% раствором NaCl. Необходимо понимать, что установление конкретных связей между системным воспалительным ответом, эндотелиальным повреждением, почечной функцией и использованием ГР/ГЭК является трудной задачей. Данные процессы находятся в сложном взаимодействии друг с другом и, соответственно, выводы, которые мы делаем на основании измерения определенных маркёров, не являются строго специфичными.
Выводы
- Применение ГР/ГЭК у пациентов ИБС до начала ИК приводит к достоверному снижению содержания внесосудистой воды лёгких после реваскуляризации миокарда, обеспечивая тем самым эффективную защиту оксигенирующей функции лёгких.
- Однократное введение ГР/ГЭК вызывает кратковременное повышение индекса ударного объёма и, соответственно, сердечного индекса.
- В результате улучшения гемодинамики и лучшей защиты респираторной функции введение ГР/ГЭК приводит к улучшению транспорта кислорода к тканям.
- Использование ГР/ГЭК способно уменьшать системный воспалительный ответ у больных ИБС после реваскуляризации миокарда в условиях ИК.
- Однократное введение ГР/ГЭК в дозе 4 мл/кг является относительно безопасным в отношении нарушения функции почек, гемостаза и развития неврологических расстройств.
Для корреспонденции:
ННИИПК им. акад. Е. Н. Мешалкина
630055, г. Новосибирск, ул. Речкуновская, д. 15.Ломиворотов Владимир Владимирович
доктор медицинских наук, профессор, руководитель отдела анестезиологии и реаниматологии.Фоминский Евгений Васильевич
врач-анестезиолог-реаниматолог отделения реанимации и интенсивной терапии взрослых.Ефремов Сергей Михайлович
кандидат медицинских наук, старший научный сотрудник отдела анестезиологии и реаниматологии.Непомнящих Валерий Анатольевич
доктор медицинских наук, ведущий научный сотрудник отдела анестезиологии и реаниматологии.Шилова Анна Николаевна
доктор медицинских наук, заведующая лабораторией клинико-биохимических исследований.Чернявский Александр Михайлович
доктор медицинских наук, профессор, руководитель центра аорты, коронарных и периферических артерий.Ломиворотов Владимир Николаевич
доктор медицинских наук, професcор, заместитель директора по научной работе.
Список использованной литературы
- Apostolakis E., Filos K. S., Koletsis E. et al. Lung dysfunction following cardiopulmonary bypass // J. Card. Surg. - 2010. - Vol. 25. - P. 47-55.
- Bassani J. W., Bassani R. A., Rocha-e-Silva M. Inotropic effect of hyperosmotic NaCl solutions on the isolated rat cardiac tissue // Arch. Int. Physiol. Biochim. - 1990. -Vol. 98. - P. 397-402.
- Bennett M., Dent C. L., Ma Q. et al. Urine NGAL predicts severity of acute kidney injury after cardiac surgery: a prospective study // Clin. J. Am. Soc. Nephrol. - 2008. -Vol. 3. - P. 665-673.
- Boldt J., von Bormann B., Kling D. et al. The influence of extracorporeal circulation on extravascular lung water in coronary surgery patients // Thorac. Cardiovasc. Surg. -1986. - Vol. 34. - P. 110-115.
- Cuschieri J., Gourlay D., Garcia I. et al. Hypertonic preconditioning inhibits macrophage responsiveness to endotoxin //J. Immunol. - 2002. -Vol. 168. - P. 1389-1396.
- Delayance S., Mion G., Souktani R. et al. Effects of hypertonic saline on coronary blood flow and myocardial performance of a blood-perfused isolated rabbit heart //Anesthesiology. - 1993. - Vol. 79. - P. 573-579.
- Dongaonkar R. M., Stewart R. H., Geissler H. J. et al. Myocardial microvascular permeability, interstitial edema, and compromised cardiac function // Cardiovasc. Res. -2010. - Vol. 87. - P. 331-339.
- Goertz A. W., Mehl T., Lindner K. H. Effect of 7,2% hypertonic saline/6% hetastarch on left ventricular contractility in anesthetized humans // Anesthesiology. -1995. - Vol. 182. - P. 1389-1395.
- Herget-Rosenthal S., Marggraf G., Husing J. et al. Early detection of acute renal failure by serum cystatin C // Kidney Int. - 2004. - Vol. 66. - P. 1115-1122.
- Hirleman E., Larson D. F. Cardiopulmonary bypass and edema: physiology and pathophysiology // Perfusion. -2008. - Vol. 23. - P. 311-322.
- Hobson C. E., Yavas S., Segal M. S. et al. Acute kidney injury is associated with increased long-term mortality after cardiothoracic surgery // Circulation. - 2009. -Vol. 119. - P. 2444-2453.
- Karkouti K., Wijeysundera D. N., Yau T. M. et al. Acute kidney injury after cardiac surgery: focus on modifiable risk factors // Circulation. - 2009. -Vol. 119. -P. 495-502.
- Kien N. D., Reitan J. A., White D. A. et al. Cardiac contractility and blood flow distribution following resuscitation with 7.5% hypertonic saline in anesthetized dogs // Circ. Shock. - 1991. - Vol. 35. - P. 109-116.
- Kvalheim V. L., Farstad M., Steien E. et al. Infusion of hypertonic saline/starch during cardiopulmonary bypass reduces fluid overload and may impact cardiac function // Acta Anaesthesiol. Scand. - 2010. - Vol. 54. - P. 485-493.
- Magder S., Potter B. J., Varennes B. D. et al. Fluids after cardiac surgery: a pilot study of the use of colloids versus crystalloids // Crit. Care Med. - 2010. - Vol. 38. -P. 2117-2124.
- Mattox K. L., Maningas P. A., Moore E. E. et al. Prehospital hypertonic saline/dextran infusion for post-traumatic hypotension. The U.S.A. Multicenter Trial // Ann. Surg. -1991. - Vol. 213. - P. 482-491.
- McAlister V., Burns K. E., Znajda T. et al. Hypertonic saline for peri-operative fluid management//Cochrane Database Syst. Rev. - 2010. - 1: CD005576.
- Moore E. M., Simpson J. A., Tobin A. et al. Preoperative estimated glomerular filtration rate and RIFLE-classified postoperative acute kidney injury predict length of stay postcoronary bypass surgery in an Australian setting // Anaesth. Intens. Care. - 2010. - Vol. 38. - P. 113-121.
- Nechemia-Arbely Y., Barkan D., Pizov G. et al. IL-6/IL-6R axis plays a critical role in acute kidney injury // J. Am. Soc. Nephrol. - 2008. - Vol. 19. - P. 1106-1115.
- Quilley C. P., Lin Y. S., McGiff J.C. Chloride anion concentration as a determinant of renal vascular responsiveness to vasoconstrictor agents // Br. J. Pharmacol. - 1993. - Vol. 108. - P. 106-110.
- Rioux J. P., Lessard M., De Bortoli B. et al. Pentastarch 10% (250 kDa/0.45) is an independent risk factor of acute kidney injury following cardiac surgery // Crit. Care Med. - 2009. - Vol. 37. - P. 1293-1298.
- Rizoli S. B., Kapus A., Fan J. et al. Immunomodulatory effects of hypertonic resuscitation on the development of lung inflammation following hemorrhagic shock // J. Immunol. - 1998. - Vol. 161. - P. 6288-6296.
- Schroth M., Plank C., MeiBner U. et al. Hypertonic-hyperoncotic solutions improve cardiac function in children after open-heart surgery // Pediatrics. - 2006. -Vol. 118. - P. e76-e84.
- Sirieix D., Hongnat J. M., Delayance S. et al. Comparison of the acute hemodynamic effects of hypertonic or colloid infusions immediately after mitral valve repair // Crit. Care Med. - 1999. - Vol. 27. - P. 2159-2165.
- Toraman F., Evrenkaya S., Yuce M. et al. Highly positive intraoperative fluid balance during cardiac surgery is associated with adverse outcome // Perfusion. - 2004. -Vol. 19. - P. 85-91.
- Vassar M. J., Perry C. A., Holcroft J. W. Prehospital resuscitation of hypotensive trauma patients with 7.5% NaCl versus 7.5% NaCl with added dextran: a controlled trial // J. Trauma. - 1993. - Vol. 34. - P. 622-632.
- Venkataraman R., Kellum J.A. Defining acute renal failure: the RIFLE criteria // J. Intens. Care Med. - 2007. -Vol. 22. - P. 187-193.
- Warren O. J., Smith A. J., Alexiou C. et al. The inflammatory response to cardiopulmonary bypass: part 1-mechanisms of pathogenesis // J. Cardiothorac. Vasc. Anesth. - 2009. -Vol. 23. - P. 223-231.
- Wilcox C. S. Regulation of renal blood flow by plasma chloride // J. Clin. Invest. - 1983. - Vol. 71. - P. 726-735.
- Younes R. N., Aun F., Accioly C. Q. et al. Hypertonic solutions in the treatment of hypovolemic shock: a prospective, randomized study in patients admitted to the emergency room // Surgery. - 1992. - Vol. 111. -P. 380-385.
| Ноябрь 2012 г. |