Опубликовано в журнале:
«Рецепт» »» №3 (29), 2003, стр. 107-111 Оптимизация белкового обмена у больных с хронической почечной недостаточностью (ХПН)
проф. Пилотович В.С.,
БелМАПО, г. МинскПочки – орган поддержания стабильного гомеостаза организма, что обеспечивается экскреторной и эндокринной функциями. Если вследствие многочисленных болезней почек нарушается парциальная функция по выведению токсичных продуктов, то возникает синдром уремии или самоотравления продуктами распада эндогенного белка.
Известно, что почки обладают большими функциональными резервами, в связи с чем клинические, да и большинство лабораторных признаков уремического синдрома, возникают лишь при утере 80% массы действующих нефронов. Обычно больной с хроническими первичными и вторичными заболеваниями почек проходит четыре стадии функциональных расстройств.
При латентной (скрытой) стадии определенный уровень нарушения экскреторной функции почек может быть выявлен лишь при углубленном лабораторном исследовании, но способность почек к выведению токсичных метаболитов в этой стадии еще достаточно высока.
При компенсированной стадии хронической почечной недостаточности (ХПН) полное выведение продуктов распада и обмена белков становится невозможным, и они медленно начинают накапливаться в ограниченном количестве, которое еще длительный промежуток времени не вызывает каких-либо проявлений заболевания.
Интермиттирующая стадия характеризуется накоплением уже значительного количества токсичных метаболитов, которые вызывают первые признаки уремического эндотоксикоза – общую слабость, недомогание, головную боль, анорексию, тошноту и другие проявления.
Если не принимать определенных лечебных и диетических мероприятий, то интермиттирующая стадия ХПН быстро переходит в конечную (терминальную), при которой жизнь человека может поддерживаться лишь методами почечно-заместительной терапии (гемодиализ, перитонеальный диализ и трансплантация почки).
В этой связи уже несколько столетий проводятся попытки с помощью диетических мероприятий снизить клинические и лабораторные проявления тяжелого самоотравления организма белковыми метаболитами у больных с хроническими болезнями почек. Эффективность малобелковой диеты (МБД) при ХПН особенно интенсивно изучалась в Италии [6, 7], в России [3, 4] и других регионах [1, 2].
Было показано уменьшение клинических проявлений хронической уремии при ограничении приема белковых продуктов и возможность продления жизни больных ХПН без применения методов почечно-заместительной терапии (ПЗТ). Однако длительное использование малобелковой диеты с резким ограничением белка до 20 г/сутки ведет к дефициту незаменимых аминокислот, началу дистрофии, которая, в свою очередь, сопровождается повышенным катаболизмом эндогенного белка и резко ухудшает состояние пациентов с ХПН.
Промышленный синтез незаменимых аминокислот и использование их в качестве добавок к диетическому питанию открыл путь к получению реальных положительных результатов лечения больных, как с ранними, так и поздними стадиями ХПН, что позволяет отодвигать сроки начала методов ПЗТ и более рационально использовать дефицитные места в отделениях гемодиализа и трансплантации почки.
Целью настоящей работы было изучение клинико-лабораторных аспектов длительного применения комплекса кетоаналогов группы незаменимых аминокислот, выпускаемых промышленным способом фирмой «Fresenius Kabi» (Германия) в виде лекарственного препарата «Кетостерил», рекомендуемого как дополнение к диетическому питанию у больных с ХПН.
В исследование включены результаты лечения 130 больных с различными стадиями ХПН, которые наблюдались в двух отделениях нефрологии Республиканского центра нефрологии и трансплантации почек на базе 4-й клинической больницы г. Минска в течение 1997-2001 гг. Информация о причинах развития ХПН и особенностях ее течения представлена в табл. 1.
Таблица 1
Характеристика исследуемых больных
Изучаемые показатели
Опытная
группа (n=67)Контрольная
группа (n=63)Причины развития ХПН:
хронический гломерулонефрит сахарный диабет I типа хронический пиелонефрит артериальная гипертензия поликистоз почек
35
10
7
11
4
37
10
8
4
5Стадия ХПН:
II (компенсированная) III (интермиттирующая, фаза обострения) III (интермиттирующая, фаза ремиссии) IV (терминальная)
24
12
13
13
18
23
20
12Частота нефротического синдрома:
при гломерулонефритах при сахарном диабете
6
5
7
4Характеризуя контингент исследованных пациентов, представленных в табл. 1, можно говорить о схожести двух групп по основным показателям. Все пациенты в качестве основного метода лечения получали малобелковую диету, в зависимости от остаточной функции почек. Так, лица с компенсированной и интермиттирующей (фаза ремиссии) стадиями ХПН получали стол 7б, включающий до 40 г белка в сутки, а больные с обострением интермиттирующей и терминальной стадиями ХПН – стол 7а (до 20 г белка в сутки).
Дополнительно назначались антиагреганты и анаболики (ретаболил, тестостерон пропионат) парентерально, а в опытной группе малобелковая диета дополнялась приемом незаменимых аминокислот - препарата «Кетостерил», который приобретен Министерством здравоохранения Республики Беларусь для нужд нефрологической службы.
В состав каждой таблетки Кетостерила входят следующие компоненты:
- DL-3-метил-2-оксо-валериановая кислота
(альфа-кетоаналог изолейцина, соль кальция) 67 мг- 4-метил-2-оксо-валериановая кислота
(альфа-кетоаналог лейцина, соль кальция) 101 мг- 2-оксо-3-фенил-пропионовая кислота
(альфа-кетоаналог фенилаланина, соль кальция) 68 мг- 3-метил-2-оксо-масляная кислота
(альфа-кетоаналог валина, соль кальция) 86 мг- DL-2-гидрокси-4-метилтио-масляная кислота
(альфа-гидрокси-кетоаналог метионина, соль кальция) 59 мг- L-лизин моноацетат 105 мг
- L-треонин 53 мг
- L-триптофан 23 мг
- L-гистидин 38 мг
- L-тирозин 30 мг
- общий азот 36 мг
- Кальций 1,25ммоль 0,05 г
Препарат принимался по 4-6 таблеток 3 раза в день во время еды в течение 3 - 18 месяцев с редкими перерывами. Доза препарата зависела от стадии ХПН и суточной потери белка с мочой. При поздних стадиях ХПН и выраженном нефротическом синдроме доза Кетостерила была максимальная.
Учитывая наличие нефросклероза различной степени выраженности, методы патогенетической иммунодепрессивной терапии гломерулонефрита не применялись. У больных с обострением первичного или вторичного пиелонефрита проводились короткие курсы антибиотикотерапии с учетом микрофлоры мочи. Повышенное АД корригировалось ингибиторами АПФ и/или блокаторами каналов Са++.
В качестве критериев оценки эффективности действия «Кетостерила» были определены следующие показатели:
- оценка самочувствия по 5-бальной шкале;
- динамика массы тела в кг;
- динамика гемоглобина крови;
- уровень артериального давления;
- суточная протеинурия;
- концентрация мочевины и креатинина в сыворотке крови;
- расчет скорости клубочковой фильтрации (СКФ) по эндогенному креатинину.
Мы имели возможность отследить динамику исследуемых показателей у достаточно большого количества больных, чтобы судить о влиянии Кетостерила на течение ХПН (табл. 2).
Таблица 2
Продолжительность наблюдения за больными
Группа
3 мес.
6 мес.
9 мес.
12 мес.
18 мес.
Контрольная (n=63)
63
62
44
32
24
Опытная (n=67)
67
58
50
43
38
Преимущество кетоаналогов незаменимых аминокислот состоит в снижении поступления азота в организм больного, уменьшении при этом внутриклубочковой гиперфильтрации и оптимизации белковой нагрузки на проксимальные отделы канальцев, ингибиции выработки глюкагона и падении активности паратгормона, а так же уменьшении интенсивности реакций эндогенного протеолиза, что, в конечном итоге, снижает уровень мочевины и креатинина крови [8].
Индивидуальная непереносимость препарата выявлена у 5 пациентов и проявлялась кожными зудящими мелкоточечными высыпаниями, слезотечением, тошнотой и повышением температуры тела. Из дальнейшего наблюдения эти пациенты были исключены. Остальные больные, вошедшие в опытную группу, удовлетворительно переносили диетическое лечение в комплексе с Кетостерилом. Чувство голода в первый месяц такого режима отмечены у 10 из 67 пациентов, которое постепенно прошло у 5, а у остальных ликвидировалось после увеличения потребления углеводов или жиров (сало).
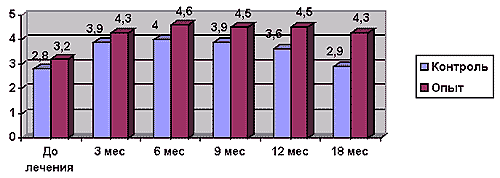
Самооценка общего состояния пациентов показала существование различий между опытной и контрольной группами на протяжении всего периода наблюдения, особенно заметных к концу периода (рис.1.).
Рис. 1.
Общее самочувствие больных в процессе лечения
В среднем по опытной группе через 3 месяца лечения отмечено увеличение массы тела на 2,2% против снижения этого показателя в контроле на 3,3% (р <0,05). Динамика снижения АД в этот срок была положительной в обеих группах, но если в контрольной группе артериальная гипертензия снизилась в среднем на 1,8% по сравнению с исходным уровнем, то в опытной группе снижение составило 6,6% (р<0,05), причем отмечено уменьшение частоты тяжелых гипертонических кризов и более быстрый ответ на усиление гипотензивной терапии.
Ограничение потребления белка, как в контрольной, так и в опытной группе привело к снижению суточной протеинурии, причем это было особенно заметно у лиц с нефротическим синдромом. В целом, в группе лиц, получавших Кетостерил, снижение протеинурии в течение первых трех месяцев лечения составило 5,2%, а в контрольной группе – 1,3% (р<0,05), причем достигнутый уровень протеинурии поддерживался и в последующий период наблюдения.
Интересна динамика концентрации основных компонентов остаточного азота в сыворотке крови до и после начала длительного применения МБД как в изолированном виде, так и в сочетании с аминокислотами. Если накануне исследования у большинства пациентов отмечалось постепенное ухудшение функциональных почечных показателей, сопровождавшихся нарастанием, и клинических признаков уремического синдрома, то после начала лечения, в ближайшие три месяца, отмечено снижение уровня мочевины у лиц контрольной группы на 2,2%, а креатинина – на 7,8%. В группе пациентов, получавших Кетостерил, снижение этих метаболитов белкового обмена было более значимым – соответственно на 5,7% и 8,7%, хотя различия между показателями в обеих группах оказались недостоверными.
Малобелковая диета позволила длительно сохранять достигнутый уровень азотемии у большинства больных, особенно в компенсированной стадии ХПН. Лишь у нескольких больных в терминальной стадии ХПН (5 в контрольной группе и 3 в опытной группе) в период от 6 до 12 месяцев лечения был начат программный гемодиализ. Причем 5 из 13 лиц с терминальной стадией ХПН, получавших МБД в сочетании с аминокислотами, наблюдались от 12 до 18 месяцев, в то время как в контрольной группе в эти сроки 5 больных начали диализотерапию, а 2 погибли от осложнений уремии.
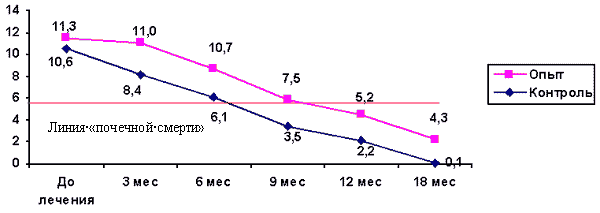
Динамика показателей скорости клубочковой фильтрации в двух исследуемых группах с терминальной стадией ХПН (рис.2) свидетельствует, что наступление так называемой «почечной смерти», т.е. достижение скорости клубочковой фильтрации уровня 5-6 мл/мин, когда возникают прямые показания для начала внепочечного очищения крови, у пациентов, получавших Кетостерил, наступает, по крайней мере, на 6 месяцев позже. Это дает реальную возможность в условиях ограниченной доступности диализотерапии для отечественных больных [5], регулировать сроки начала лечения методами ПЗТ и избегать гибели больных от уремии.
Рис.2.
Динамика СКФ у больных с терминальной стадией ХПН, получавших МБД
Таким образом, сама малобелковая диета, длительно применяемая у больных с ранними стадиями ХПН, оптимизирует белковый обмен, замедляет прогрессирование нефросклероза и отодвигает сроки наступления терминальной стадии. Дополнительное введение незаменимых аминокислот в виде препарата «Кетостерил» усиливает противоазотемический эффект диетотерапии и благоприятно отражается на клиническом состоянии больных с диффузными заболеваниями почек, позволяет планировать поступление пациентов в диализные центры для почечно-заместительной терапии. Поэтому, препараты, содержащие незаменимые аминокислоты или их кетоаналоги, можно отнести к средствам выбора при преддиализном лечении больных как с ранними, так и поздними стадиями ХПН.
ЛИТЕРАТУРА
1. Бергман П., Розе В. Картофельно-яичная диета при лечении хронической почечной недостаточности//Клиническая медицина.-1977.-№5.-С.113-116.
2. Бреннер Б.М. Механизмы прогрессирования заболеваний почек//Сборник трудов нефрологического семинара - Санкт-Петербург.-1995.-С.97-102.
3. Методические рекомендации по диетотерапии больных с хронической почечной недостаточностью и больных терминальной уремией, находящихся на регулярном гемодиализе. Тареев Е.М., Самсонова М.А., Ермоленко В.М., Коробкина Г.С. Москва.-1979.-70с.
4. Николаев А.Ю., Милованов Ю.С. Лечение почечной недостаточности: Руководство для врачей.-М.: ООО «Медицинское информационное агентство».-1999.-363 с.
5. Пилотович В.С. Состояние почечно-заместительной терапии при хронической почечной недостаточности в Республике Беларусь// Белорусский медицинский журнал.-2003.-№1.-С.2-7.
6. Giordano C., Esposito R., Pluvio M. The effects of oxidized starch on blood and faecal nitrogen in uremia//Proc.Eur.Dial.Transpl.Assoc.-1973.-№10.-Р.136-137.
7. Giordano C., Esposito R. Studies on oxystarch and uremia//Proc.8th Annual Contractors. Conf. Artific. Kidney Programm//NIAMDD, ed. By B.Mackey, DHEW publ.-1975.-Р.125-125.
8. Jones R., Dalton N., Turner Ch., Start K. Oral essential aminoacid and ketoacid supplement in children with chronic renal failure//Kidney intern.-1983.-24.-№1.-P.95-103.
Кетостерил -
| Март 2005 г. |