Опубликовано в:
СОВРЕМЕННАЯ ОНКОЛОГИЯ, ТОМ 7 N24Принципы инфузионно-трансфузионной терапии при массивной операционной кровопотере
Е.С.Горобец
Российский онкологический научный центр им. Н.Н.Блохина РАМН, МоскваПотеря значительного объема кропи всегда опасна и представляет прямую угрозу жизни больного или раненого. В то же время трудно сравнивать острую кровопотерю, происходящую во внегоспитальной обстановке, с кровотечением при выполнении хирургического вмешательства, проходящего под наркозом с ИВЛ в условиях операционной при участии квалифицированного анестезиолога. Очевидно, что массивная операционная кровопотеря (МОК) при прочих равных условиях может и должна переноситься больными лучше, чем утрата значительно меньшего объема крови вне операционной. Однако так бывает лишь при правильном построении всего комплекса анестезиологического обеспечения, одно из ведущих звеньев которого - рациональная инфузионно-трансфузионная терапия (ИТТ).
В большинстве случаев даже при выполнении обширных и травматичных хирургических вмешательств потеря крови происходит постепенно, что позволяет анестезиологу своевременно ее восполнять, избегая резких расстройств гемодинамики, грубых изменений состава циркулирующей крови и гомеостаза в целом.
Многолетние наблюдения за течением операций, сопровождающихся кровотечением, позволили сделать вывод что. диагноз МОК обычно правомочен при ее величине, превышающей 50% объема циркулирующей крови (ОЦК). До достижения такого объема потери крови ее компенсация, как правило, состоит из рутинного внутривенного введения солевых растворов и синтетического коллоида, причем выбор последнего не имеет особого значения из-за небольшой дозы.
Медленно нарастающая потеря крови в объеме около 2,5-3.5 л (для взрослого человека это около 60-70%ОЦК) заставляет анестезиолога сосредоточить особое внимание на объеме и составе инфузии, контроле и профилактике нарушений гемостаза и гемодинамики, т.е. прибегать к мерам интенсивной терапии. Даже при невысоком темпе кровопотери и непрерывном ее возмещении суммарная утрата 80-100% ОЦК всегда опасна для жизни и требует высокопрофессионального лечения. Также угрожают жизни и требуют энергичных лечебных мероприятий случаи кровотечения со стремительной одномоментной утратой 3040% ОЦК, что бывает при повреждении крупного магистрального сосуда, сосудистого сплетения либо камеры сердца.
В основе эффективной ИТТ МОК лежат:
поддержание достаточной преднагрузки путем интенсивной и опережающей внутривенной инфузии; поэтапное манипулирование составом инфузии с ориентировкой на объем как уже произошедшей, так и ожидаемой потери крови с учетом показателей гемокоагулограммы (ГКГ): своевременное использование кардиовазотоников (эфедрина, допамина. норадрсналина, мезатона, иногда адреналина) для поддержания пост- и преднагрузки в случаях возможного или развивающегося кризиса гемодинамики и гиповолемического шока*); профилактика и лечение расстройств в системе гемостаза. * Среди некоторых врачей анестезиологов-реаниматологов бытует крайне опасное мнение, основанное на представлениях 60-70-х годов прошлого столетия, о необходимости коррекции гемодинамических расстройств, возникающих при острой гиповолемии, исключительно интенсивной внутривенной инфузией без использования вазопрессоров, которые якобы приводят к развитию тяжелых органных расстройств и необратимого шока. Напротив, только незамедлительное применение кардиовазотоников наряду с энергичной инфузией при тяжелой острой гиповолемии с падением сердечного выброса способно спасти жизнь пациента и избежать необратимого повреждения паренхиматозных органов.Кровопотеря и операционная травма
Необходимо обратить внимание на весьма важное обстоятельство, накладывающее серьезный отпечаток на течение и исход операции, сопровождающейся МОК, - ее травматичность. Изредка большая потеря крови возникает при ранении крупного сосуда во время ограниченного и малоинвазивного вмешательства, но, как правило, она сопровождает высокотравматичные и продолжительные операции. В первом случае выраженность гиповолемии и тяжесть состояния пациента бывают обусловлены кровопотерей как таковой. При правильных и своевременных действиях анестезиолога развивающиеся патологические процессы обычно легко обратимы и не достигают степени тяжелого шока.
При длительных, травматичных операциях большая потеря крови как бы "наслаивается" на тяжелую тканевую травму и мощную патологическую импульсацию из операционного поля, подавить которую полностью не всегда удается, даже используя самые современные методы анестезии. Такая травма сама по себе способна вызвать глубокую персистирующую гиповолемию, расстройства микроциркуляции и провоцировать развитие ДВС. Для больших полостных и неполостных операций характерна скрытая массивная экстравазация жидкости в интерстиций тканей, усугубляющая гиповолемию. Тяжелая тканевая травма и гипоперфузия тканей вследствие гиповолемии приводят к развитию системной воспалительной реакции, которая вызывает повреждение эндотелия с повышением его проницаемости, что усугубляет потерю жидкости из сосудистого русла и способствует возникновению гиповолемического шока. Развитие шока провоцирует неадекватная анестезия, не обеспечивающая должную блокаду мощной афферентной ноцицептивной импульсации из рефлексогенных зон операционного поля в ЦНС с последующим неконтролируемым стрессорным симпатоадреналовым ответом. В патогенезе шока также присутствует охлаждение организма, закономерное при длительных операциях с большой открытой операционной раной, причем напрямую - через угнетение компенсаторных симпатоадреналовых реакций и косвенно - путем углубления гипокоагуляции и увеличения кровопотери.
Таким образом, МОК, сопровождающая большинство хирургических вмешательств, представляет собой специфическое критическое состояние, в патогенезе которого доминируют тяжелая персистирующая гиповолемия, анемия и угрожающая коагулопатия в сочетании с мощным шокогенным симпатоадреналовым стрессом и выбросом медиаторов воспаления, а также охлаждением организма. Зачастую события развиваются на неблагоприятном фоне, обусловленном сопутствующей патологией и осложнениями основного заболевания, что характерно, например, для больных, оперируемых по поводу злокачественных опухолей [1].
Подобные ситуации способен разрешить только комплекс энергичных, продуманных и своевременных мер интенсивной терапии, в которых рациональная ИТР играет ключевую роль.
Общая тактика инфузионно-трансфузионной терапии массивной операционной кровопотери
При подготовке к операции, во время которой можно ожидать значительную кровопотерю, необходимо обеспечить доступ в венозное русло, позволяющий поддерживать высокую скорость инфузии, превышающую темп потери крови. Для этой цели обычно канюлируют 3-4 крупные вены (центральные и/или периферические) канюлями (катетерами) калибра 14 G. Эти канюли должны быть расположены в венах, которые находятся в функционирующем сосудистом русле, не блокированном патологическим образованием и не подлежащем перевязке в процессе хирургических манипуляций. Расположение канюль (катетеров) в центральных или периферических венах не имеет принципиального значения. Вопреки сложившемуся мнению использование более коротких периферических канюль предпочтительно, поскольку при одинаковом диаметре обеспечивает большую скорость инфузии (закон Хагена-Пуазейля). Проблему быстрого массивного переливания можно решить установкой в одну из центральных вен так называемого гемодиализного двухпросветного катетера калибра 12+12 G.
При том что поддержание приемлемого гематокрита (количества циркулирующих эритроцитов) чрезвычайно важно для пациента, страдающего от потери крови, безусловный приоритет в интенсивной терапии должен быть отдан поддержанию необходимой преднагрузки сердца, т. е. восполнению дефицита ОЦК. В условиях ожидаемого или продолжающегося кровотечения анестезиолог должен стремиться к опережающей по объему инфузии. Степень желаемого опережения зависит от интенсивности потери крови, но обеспечить необходимую объемную скорость внутривенного вливания в ряде случаев непросто, особенно при внезапном кровотечении, когда приходится в срочном порядке налаживать дополнительный доступ в венозное русло. В целом для поддержания устойчивого ОЦК обычно следует стремиться перелить внутривенно в 1,5-2 раза больше жидкости, чем утрачено крови.
До определенного момента (на первом этапе ИТТ) состав переливаемой жидкости не имеет решающего значения, главное - обеспечить наполнение камер сердца и достаточный сердечный выброс. В противном случае неизбежно разовьется синдром малого выброса с централизацией кровообращения и гипоперфузией органов и тканей, а затем гиповолемический шок. Именно на эффекте быстрого восстановления кровообращения под воздействием интенсивной внутривенной инфузии любого раствора (главное - быстро и много!) была построена концепция лечения острой гиповолемии кристаллоидами, которые дешевы, доступны и не вызывают реакций непереносимости. Есть немало приверженцев кристаллоидной терапии острой гиповолемии, преимущественно в США, поскольку в этой стране не разрешены к применению современные синтетические коллоидные плазмозаменители (КП)**, заслуженно получившие широкое распространение в Европе [2].
** В последнее время появился термин "объемозамещающий" препарат. Действительно, этот термин точнее отражает назначение и действие растворов обсуждаемой группы, однако мы придерживаемся более привычного названия "плазмозаменитель", пришедшего в свое время на смену совсем уж неточному термину "кровезаменитель".Мы относимся к сторонникам кристаллоидно-коллоидной инфузии, ибо без поддержания коллоидно-осмотического давления кристаллоиды быстро мигрируют из сосудистого русла в интерстиций тканей, что приводит к рецидиву гиповолемии и развитию отечного синдрома.
В интенсивной терапии МОК большую роль играет этапностъ ИТТ - переход от инфузии кристаллоидов и синтетических коллоидов к своевременному и обоснованному переливанию компонентов крови - свежезамороженной плазмы (СЗП). эритромассы и тромбоконцентрата (табл. 1).
Таблица 1. Этапное построение инфузионной терапии кровопотери
Этап Кровопотеря, % ОЦК Состав инфузии I <20 Кристаллоиды II 20-40 Кристаллоиды + синтетические коллоиды III 40-100 Кристаллоиды + синтетические коллоиды (до максимальной суточной дозы) + СЗП + эритроцитная масса IV >100 Кристаллоиды + СЗП + эритроцитная масса + волювен (до 50 мл/кг) Принцип этапности ИТТ при продолжающемся кровотечении позволяет анестезиологу управлять непрерывным внутривенным вливанием (обычно с высокой объемной скоростью), поддерживая необходимый ОЦК и не создавая избыточную гемодилюцию с потерей минимально приемлемого коагуляционного потенциала и кислородотранспортной функции крови.
На первых этапах операции до окончательного хирургического гемостаза целесообразно так планировать ИТТ, чтобы при восполнении дефицита ОЦК развивалась гемодилюция, предельно допустимая для данного пациента. Смысл разведения крови состоит в стремлении минимизировать утрату форменных элементов на том этапе операции, когда потеря определенного объема крови неизбежна. Если гемодилюция не влечет за собой клинически значимую повышенную кровоточивость, то можно рассчитывать и на меньшую утрату компонентов крови (при потере равного объема) из-за малой концентрации форменных элементов в условиях низкого гематокрита. Только после остановки кровотечения стремятся восстановить оптимальные показатели красной крови.
Не так просто бывает определить, какой гематокрит приемлем для конкретного больного и в какой ситуации. Известные рекомендации: гемоглобин 80 г/л и гематокрит 2530% - могут служить лишь очень приблизительным ориентиром в такой оценке. Для принятия правильного решения требуется определенный опыт, так как приходится одновременно принимать во внимание множество различных факторов и обстоятельств, прежде всего вероятную индивидуальную толерантность пациента (исходное состояние, наличие сердечно-сосудистых, дыхательный, почечных заболеваний и т.п.).
Обязательное условие эффективной и безопасной гемодилюции - недопущение и своевременная коррекция гиповолемии, поддержание хорошей оксигенации. Наркоз, мышечная релаксация и неизбежная относительная гипотермия обеспечивают крайне малое потребление кислорода, поэтому достижение даже очень низких показателей гемоглобина и гематокрита, как правило, хорошо переносится пациентами. В результате оказывается возможным существенное кровосбережение без риска циркуляторной и гемической гипоксии.
Гемодилюции достигают внутривенной инфузией кристаллоидных растворов и синтетических КП. При значительном объеме вливания (при массивной потере крови это неизбежно) большое значение приобретает выбор КП.
Проблема выбора коллоидного плазмозаменителя
Требования к КП, применяемому для лечения МОК, мы формулируем так
быстрое и устойчивое объемозамещение: отсутствие влияния на свертывание крови; отсутствие анафилактических реакций; отсутствие влияния на иммунную систему; отсутствие воздействия на эндотелий сосудов; удержание препарата в сосудистом русле при поврежден ном эндотелии сосудов; отсутствие нефротоксичности; хорошие (но не избыточные) реологические свойства. В этом контексте весьма интересен и важен вопрос о выборе адекватного препарата, способного быстро и надежно обеспечить восполнение дефицита ОЦК без развития побочных эффектов, тем более что взгляды клиницистов и исследователей на этот счет не совпадают,
Первые 3 пункта перечисленных требований кажутся очевидными: КП должен обеспечивать быстрое и устойчивое восполнение ОЦК и не вызывать при этом гипокоагуляции и анафилаксии - хорошо известных и опасных побочных явлений, присущих традиционным для нашей страны плазмо-экспандерам полиглюкину и желатинолю. Важно отметить, что анафилактические (анафилактоидные) реакции на декстраны и препараты желатины практически не прогнозируемы и дозонезависимы. Нередки случаи, когда непереносимость связана не с самим веществом, составляющим коллоидную основу препарата, а с недостаточной очисткой в процессе его изготовления. Анафилактоидные реакции, т.е. реакции высвобождения гистамина, серотонина и других биологически активных медиаторов, развивающиеся не в результате предварительной сенсибилизации организма, а вследствие попадания в системный кровоток примесей - "либераторов", по-видимому, составляют большинство реакций непереносимости КП. Нетрудно представить отчаянную ситуацию, когда у больного на фоне массивной кровопотери развивается анафилактическая реакция.
Проблема дилюционной коагулопатии может выглядеть по-разному в зависимости от выраженности дезагрегационных и антикоагулянтных свойств переливаемых препаратов и их дозы (рис. 1).
Рис. 1. Механизмы формирования нарушений гемостаза при МОК.
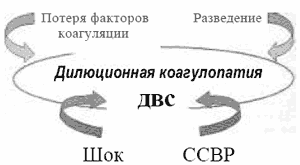
По эффективности дезагрегации лидирующее положение занимают декстраны [3]. Эта их способность может быть целебной при патологических состояниях, вызывающих гиперкоагуляцию и нарушения микроциркуляции (реперфузионный синдром и т.п.). Однако в случае массивного кровотечения, когда требуется форсированная внутривенная инфузия больших доз КП для удержания приемлемого ОЦК и сердечного выброса, она может приводить к неконтролируемой кровоточивости. В ситуациях критического падения АД и развития гиповолемического шока анестезиологу бывает очень трудно удержаться от превышения максимально допустимых доз КП, а разрешенные 5 флаконов полиглюкина исчезают в венах пациента мгновенно! Вот почему мы так стремимся получить в руки препараты, которые способны эффективно поддерживать преднагрузку сердца, но при использовании в больших дозах не провоцируют развитие несвертывания крови - наиболее грозного осложнения массивного кровотечения,
Надо отметить, что дилюционная коагулопатия не столь опасна в сравнении с развернутым синдромом ДВС и при условии умеренной дезагрегации форменных элементов крови полезна, так как препятствует развитию коагулопатии потребления. Смещение структуры гипокоагуляции от диссеминированного свертывания в сторону гемодилюции может служить показателем эффективности интенсивной терапии МОК (рис. 2).
Рис. 2. Динамика структуры нарушений свертывания крови на высоте МОК под влиянием изменений принципов инфузионной терапии в РОНЦ РАМН.
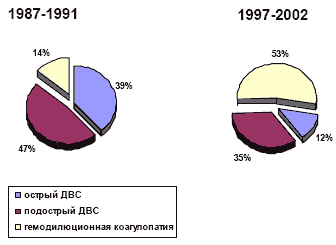
Разбавление крови даже на фоне потери плазменных факторов свертывания и тромбоцитов до определенного момента не представляет угрозы. Декомпенсации гемостаза может способствовать свойство КП не просто "разводить" кровь, а специфически нарушать гемокоагуляцию. КП ведут себя по-разному, причем это касается не только производных веществ с различной химической структурой (декстрана, желатины, ГЭК), но и представителей одной и той же группы в зависимости от заданных физико-химических свойств.
Специалисты, изучавшие гемостаз во время операции у пациентов с его исходными расстройствами, также полагают, что наиболее опасны декстраны, способные нарушить как сосудисто-тромбоцитарную, так и плазменную составляющие [4]. Нет особых причин считать, что ситуация острой массивной кровопотери, неизбежно сопровождающаяся гемодилюцией и утратой всех факторов свертывания, существенно различается. Поэтому выбор КП при массивной потере крови всегда склоняется в пользу препаратов, минимально нарушающих коагуляцию. Существует два вида веществ, обладающих такими качествами, - препараты желатины и производные гидроэтилкрахмала (ГЭК) со средней молекулярной массой и определенной конфигурацией молекулы. Дальнейший выбор диктуется другими свойствами КП (табл. 2).
Таблица 2. Сравнительная характеристика плазмоэаменителей, применяемых для лечения массивной потери крови
Альбумин 5-10-20% Полиглюкин Желэтиноль, гелофузин ГЭК 200/0,4 ГЭК 130/0,4 Максимальная разрешенная суточная доза _ 2000 мл
(30 мл/кг)2000 мл
(30 ил/кг)6% - 33 мл/кг
10% - 20 мл/кг50 мл/кг Быстрое и устойчивое объемозамещение + + + - + + Отсутствие анафилактических реакций + - - - + + Отсутствие влияния на свертывание крови + - - + - + Отсутствие влияния на систему иммунитета - - - + + Отсутствие воздействия на эндотелий + - - + + Удержание в сосудистом русле при поврежденном эндотелии + - - - + + Отсутствие действия на почки + - + + + Хорошие реологические свойства + + + - + - +
Примечание. "+" - желательный эффект, "-" -нежелательное действие,"+-" - неоднозначная оценка действия.До сравнительно недавнего времени многие клиницисты не придавали особого значения неочевидным реакциям иммунитета на инфузионные среды. С появлением концепции системной воспалительной реакции (СВР) и доказательств роли противовоспалительный медиаторов в патогенезе критических состояний ситуация изменилась, появился практический интерес к способности тех или иных лекарственных средств усугублять или смягчать реакцию тканей и органов на воспаление. В настоящее время не вызывает сомнений факт развития СВР при тяжелой травме любого происхождения, в том числе ятрогенной, операционной.
По этой причине особую ценность приобретают сведения о способности инфузионных сред влиять на эндотелий сосудов с повышением или понижением их проницаемости, активации молекул адгезии к эндотелию, которые появились в литературе последних лет. Нетрудно себе представить важность подобных данных в ситуациях МОК, сопровождающих тяжелую операционную травму. Во время кровотечения врач в первую очередь стремится компенсировать острую гиповолемию массивной инфузией препаратов, которые, по его представлениям, должны обеспечивать быстрый и стабильный волемический эффект, Для этой цели и созданы КП. Однако свойства многих из них влиять посредством медиаторов воспаления на сосудистую проницаемость и свертывание крови не поддаются клинической оценке по внешним признакам, хотя способны незаметно для глаза серьезно усугублять тяжесть состояния больного в течение операции и особенно раннего послеоперационного периода.
Весьма интересен и важен вопрос о роли и свойствах раствора человеческого альбумина. В течение многих лет вокруг него существовал ореол практически идеального плазмозаменителя, применение которого сдерживали только естественная ограниченность сырьевых ресурсов и высокая цена. Не одно поколение врачей было воспитано в этом убеждении. Однако все оказалось не так просто. Всем нам хорошо известны пирогенные реакции на многие отечественные коммерческие образцы раствора альбумина разных. производителей. Поэтому, наверное, так легко легли на подготовленную почву результаты нескольких зарубежных метаанализов, из которых наибольшую известность приобрело исследование Cohrane Injuries Group Albumine Reviewers, опубликованное в 1998 г. [5]. В этих публикациях были приведены данные о более высокой смертности пациентов отделений реанимации, получавших растворы альбумина. Вслед за этим появился ряд работ, в которых было показано, что при многих критических состояниях, сопровождающихся повреждением эндотелия (т.е. при развитии системной воспалительной реакции), альбумину свойственно переходить в межклеточный сектор внесосудистого русла, притягивая к себе воду и усугубляя интерстициальный отек тканей, прежде всего легких [6].
Существует критика упомянутых исследований и противоположная точка зрения, согласно которой переливание раствора человеческого альбумина не утратило своего значения при строгом соблюдении показаний [7]. При анализе результатов исследований КП необходимо принять во внимание, что вряд ли можно говорить об альбумине вообще. Медицинская промышленность разных стран производит коммерческие препараты альбумина с соблюдением различных стандартов качества и в разных концентрациях (4, 5,10,20 и 25%), что в большой, если не решающей, степени влияет на эффективность и безопасность лечения.
При оценке различных КП, исходящей от американских специалистов, необходимо учитывать, что в США разрешены к клиническому использованию только альбумин, декстран-40, декстран-70 и ГЭК-450. По этой причине во всех сравнительных исследованиях последний обозначают просто как "hetastarch", или "HES" (ГЭК), без уточнения молекулярной массы и различий структуры. На самом же деле именно эти особенности решающим образом влияют на ведущие фармакологические свойства препаратов ГЭК, в том числе способность вызывать коагулопатию и нефротоксичность. Без учета указанных обстоятельств нельзя безоговорочно принимать информацию, содержащуюся в американских статьях, где констатируется, что "HES" провоцирует кровоточивость и небезопасен для почек (впрочем, как и декстраны). В этой американской специфике кроются причины широко распространенного ложного представления о том, что все синтетические коллоиды небезопасны [7].
Свойства производных ГЭК и их место в ряду коллоидных плазмозаменителей
В течение последних лет произошло резкое улучшение качества синтетических КП. Разработаны и внедрены в клиническую практику в Европе и России новые производные ГЭК, специально созданные для того, чтобы устранить уже упомянутую способность макромолекулярных препаратов этой группы способствовать кровоточивости, накапливаться в тканях и вызывать осмотический нефроз.
ГЭК производят из кукурузного или картофельного крахмала, и его химическая структура очень сходна с гликогеном. По-видимому, сходством с этим естественным для иммунной системы человека веществом обусловлены биологическая инертность и очень хорошая переносимость ГЭК, выгодно отличающие их от других КП.
Установлено, что фармакологические свойства ГЭК (как желательные, так и побочные) в первую очередь связаны с размером молекулы. В то же время поведение препаратов ГЭК в организме существенно отличается от свойственного другим синтетическим и природным коллоидам, длительность циркуляции которых в крови определяется в первую очередь "почечным" порогом (около 50 кД), ибо крахмал очень быстро расщепляется α-амилазой, Придание молекуле крахмала способности противостоять активности α-амилазы приводит к изменению скорости гидролиза и приданию производному веществу принципиально новых свойств. Достигают этого путем замещения -ОН-групп гидроксиэтиловыми -ОСН2СН7ОН, т.е. получают гидроксиэтилкрахмал (ГЭК). Конкретные же свойства каждого препарата ГЭК зависят от числа замещенных гидроксильных молекул гидроксиэтиловыми (степень замещения) и их положения в глюкозном кольце. Чем выше степень замещения и больше молекул в положении С, по отношению к замещенным в положении Cg, тем более вещество устойчиво к гидролизу амилазой. Поэтому совершенствование препаратов ГЭК происходит путем манипулирования молекулярной массой, степенью замещения и соотношением С2:С6
Нельзя сказать, что задача получить максимально устойчивое к гидролизу вещество - главная цель создания препаратов ГЭК. Напротив, чрезмерно длительная циркуляция в крови и депонирование в тканях - недостатки, обусловливающие целый ряд побочных эффектов. Правильно рассчитанный гидролиз приводит к образованию в кровеносном русле крупных осколков молекул, число которых превышает первоначальное, а значит, создает коллоидно-осмотическое давление больше исходного. Оптимальный КП из группы ГЭК должен состоять из достаточно однородных по размеру молекул, не очень быстро подвергающихся гидролизу in vivo с равномерным постепенным образованием, молекул масса которых немного превышает почечный порог. Эти молекулы в свою очередь подвергаются лизису и выведению из организма с мочой.
Препараты выпускают в виде 6% и 10% растворов, что прямо влияет на скорость повышения коллоидно-осмотического давления плазмы крови при быстрой инфузии.
По-видимому, наиболее совершенным КП может быть признан препарат ГЭК 3-го поколения с мол. массой 130, степенью замещения 0,4 и соотношением С2-.С6 9:1, получивший коммерческое название "Волювен" ("Фрезениус-Каби"). В 6% растворе этот КП обеспечивает1100% волемический эффект с 4-часовым плато и волемической стабилизацией до 6 ч. Волювен может быть использован в суточной дозе до 50 мл/кг (Г)***, поскольку практически не влияет на свертывание крови и существенно меньше накапливается в тканях по сравнению с производными ГЭК 2-го поколения ХАЭС - стерилом, инфуколом, рефортаном и т.п. Развитие гиперонкотической почечной недостаточности, случаи которой описаны при использовании всех видов КП, включая концентрированные растворы альбумина, по-видимому, больше зависит от состояния почечного кровотока, концентрации КП и длительности инфузии, чем от особенностей препарата.
Мы располагаем собственным опытом использования волювена в качестве единственного синтетического КП в составе ИТТ у 184 больных во время травматичных онкологических операций, сопровождавшихся МОК более 50% ОЦК (из них 24,5% потеряли 100-200% ОЦК и 14,1% - более 200% ОЦК). Наши больные получили ИТТ, в которой волювен был перелит в течение 1-х операционных суток в средней дозе 41,6 (33,1; 46,7) мл/кг. Лабораторные признаки коагулопатии выявлены у 8 больных с потерей более 200% ОЦК, а клинические - лишь у 2 пациентов этой подгруппы. В целом, несмотря на значительную потерю крови (Me кровопотери 4 л), мы отметили довольно высокую стабильность показателей гемостаза.
Гемотрансфузия
Когда-то переливание крови казалось не просто вершиной и сутью инфузионной терапии, а неким универсальным спасительным средством, почти панацеей, которое употребляли и для лечения анемии, и для восполнения кровопотери, и для лечения сепсиса, и для восстановления "жизненных сил" организма.
Многочисленные убедительные клинические наблюдения и тонкие лабораторные исследования показали мировому сообществу врачей, что переливание чужеродной крови не только может быть жизнеспасительным, но и способно таить в себе скрытую угрозу, часто неочевидную, но от этого не менее опасную. Хорошо известны посттрансфузионные расстройства свертывающей системы крови, тяжелые пирогенные реакции с гипертермией и сердечно-сосудистой декомпенсацией, анафилактические реакции, гемолиз, острая почечная недостаточность и т.д. В основе большинства осложнений, связанных с переливанием донорской крови, лежит реакция отторжения организмом чужеродной ткани, т.е. сложный, многокомпонентный и еще недостаточно изученный универсальный механизм иммунитета. Не последнюю роль в сдерживании широкого применения гемотрансфузий играют инфекции, прежде всего вирусные (гепатит В и С, ВИЧ и т.д.), которые могут передаваться с перелитой кровью или ее компонентами, несмотря на все современные меры профилактики. По этим причинам гемотрансфузия может рассматриваться только как вынужденная мера, показания к применению которой приближены к абсолютным: тяжелая анемия - переливание донорской эритроцитной массы, угроза коагулопатического кровотечения - применение СЗП. Другие поводы к гемотрансфузий должны быть категорически исключены. Специальными исследованиями было доказано, что предпочтительность переливания цельной крови -умозрительная иллюзия, поскольку кровь, покинувшая живое сосудистое русло, утрачивает качества живой ткани и ее преимущества, ухудшает переносимость трансфузии [9]. Плазма же, отделенная от эритроцитов и подвергнутая быстрому замораживанию, напротив, приобретает новые свойства, состоящие в активизации ряда важнейших факторов свертывания.
В последние годы все шире используется процедура возврата ex tempore отмытых собственных эритроцитов пациента, полученных из операционной раны и обработанных с помощью специального аппарата "селл-сейвера". По нашему многолетнему опыту (более 400 процедур), это весьма эффективный способ быстрого восстановления кислородотранспортного потенциала крови больного при отсутствии иммунных конфликтов [10]. Однако необходимо иметь в виду, что метод аппаратной реинфузии нельзя считать панацеей уже потому, что вся аутоплазма раневой крови, поступающая в аппарат, отмывается и сбрасывается. В связи с этим ИТТ МОК всегда предусматривает переливание СЗП - основы профилактики и лечения коагулопатии.
Профилактика и лечение расстройств гемостаза при лечении массивной кровопотери
Большой опыт успешного лечения массивных, в том числе экстремальных, кровопотерь позволяет утверждать, что в подавляющем большинстве случаев можно предотвратить их наиболее опасное осложнение - неконтролируемое коагулопатическое кровотечение, неминуемо приводящее к смерти. Так, в наших наблюдениях последних лет (с 7998 г. ежегодно более 200 случаев операционной кровопотери более 50% ОЦК) смертность от кровотечения и гиповолемического шока составляет 3,8-6%, причем все эти случаи приходятся на высокотравматичные продолжительные вмешательства с потерей более 200% ОЦК. Из 8 наших пациентов, операции у которых сопровождались потерей более 20 л крови (до 25 л), 7 ее перенесли [11].
Профилактика и лечение расстройств гемостаза основываются на следующих принципах:
недопущение развития тяжелой гиповолемии и шока; максимально приемлемая гемодилюция (менее опасна, чем ДВС); при потере более 50% ОЦК - переливание СЗП в качестве средства, нормализующего плазменный гемостаз; своевременное назначение апротинина. Адекватная анестезиологическая защита и энергичная превентивная внутривенная инфузия - основа основ благоприятного течения операции, сопровождающейся МОК Максимально допустимая гемодилюции на этапах операции до выполнения основного хирургического гемостаза позволяет снизить потери форменных элементов и факторов свертывания как прямым путем (кровь вытекает пополам с плазмозаменителем), так и за счет предотвращения ДВС с развитием коагулопатии потребления.
Лишь своевременное включение в схему ИТТ быстрого переливания значительной дозы СЗП (10-15 мл/кг и более) позволяет поддерживать коагуляционныш потенциал. При очень большой потере крови (>100% ОЦК), когда дальнейшее переливание КП становится небезопасным, интенсивная инфузия СЗП обеспечивает необходимое коллоидно-осмотическое давление крови.
Важную роль в профилактике развития неконтролируемой коагулопатии играет применение апротинина (трасилола, гордокса, контрикала) в дозах до 2-3 млн КИЕ. Полагают, что апротинин действует путем ингибирования избыточного фибринолиза и стабилизирует агрегационную функцию тромбоцитов.
Весьма актуален вопрос о переливании донорских тромбоцитов при МОК. Согласно классическим представлениям и авторитетным рекомендациям [9], применение концентрата тромбоцитов необходимо при массивном некоагулопатическом кровотечении и снижении числа кровяных пластинок ниже 50 х 109/л и даже 100 х 109/л. Мы не сомневаемся в том, что эта мера способствует повышению коагуляционного потенциала крови пациента в период массивной потери крови, и принципиально присоединяемся к этим рекомендациям. В то же время мы располагаем значительным опытом лечения МОК без донорских тромбоцитов, в том числе при снижении числа тромбоцитов пациента до 20-30 х 109/л. Так, в уже упомянутом исследовании на 184 наблюдения МОК концентрат тромбоцитов был использован только в 4 случаях. Разумеется, этот опыт вынужденный, связанный с отсутствием тромбоконцентрата в нужное время, и мы не можем рекомендовать его тиражирование. Тем не менее, он показывает, что успешное лечение МОК возможно и без использования донорских тромбоцитов при условии соблюдения рациональной тактики интенсивной терапии, прежде всего ее инфузионной составляющей.
В самое последнее время появились исследований, в которых с целью борьбы с коагулопатическим кровотечением во время хирургических вмешательств применяли большие дозы рекомбинантного активированного VII фактора "Novo-Seven" ("Novo Nordisk"). Этот генно-инженерный препарат был создай для борьбы с кровотечением у больных гемофилией, затем его успешно использовали при различных ситуациях неконтролируемого коагулопатического кровотечения у пациентов с травмой, после операций с искусственным кровообращением и общехирургических вмешательств у пациентов без болезней крови [12]. Однако очень высокая стоимость не только резко ограничивает возможности широкого клинического использования фактора Vila, но и создает определенным психологический барьер для его своевременного применения. Дело в том, что до установления лабораторных и клинических ориентиров врач не может принять решение о введении препарата, цена одной дозы которого значительно превышает все расходы на хирургическую операцию и анестезиологическое обеспечение вместе взятые.
Заключение
Таким образом, подводя итог сказанному, роль рациональной инфузионно-трансфузионной терапии в достижении благоприятных результатов интенсивной терапии массивной операционной кровопотери является ведущей. В ней есть место всем "классическим" составляющим: солевым (кристаллоидным) растворам, синтетическим коллоидам и. компонентам крови - эритроцитной массе, свежезамороженной плазме, донорским тромбоцитам, но это место должно быть четко осознано и определено. По-видимому, для многих врачей наиболее спорным остается массивное переливание синтетических коллоидных плазмозаменителей. По нашему мнению, в этой области произошел значительный прорыв за счет внедрения в клиническую практику новых препаратов с высокой степенью эффективности и безопасности, которые вносят несомненный вклад в решение проблемы переносимости потери крови в объеме, еще недавно считавшемся не совместимым с жизнью.
Литература
1. Горобец Е.С., Свиридова С.П.. Анест. и Реаниматол. 2001; 5; 44-7
2. Dietrich H-JJ Trauma 2003; 54: S26-S30.
3. Гипокоагуляция-декстраны
4.Буланов А.Ю. Клин. геронтол. 2003; 2:41-7.
5. Cobrane Injuries Group Albumin Reviewers: Human albumin administration in critically ill patients: a systematic review ofrandomized controlled trials. Br Med J 1998; 317:235-40.
6. Pulimood T.B, Park G.R. Crit. Care 2000; 4(3): 151-5.
7. Sedrakyan A, Gondek K, Paltiel D. Chest 2003; 123(6): 1853-7.
8. NeffTA, Doelberg M, Jungbeinrich C et al Anesth Analg 2003; 96:1453-9.
9. Воробев А.И., Городецкий В.М., Шулутко Е.М. Васильев С. А. Острая массивная кровопотеря. М.: ГЭОТАР-Мед, 2001.
10. Горобец Е.С., Костяк О.С., Буйденок Ю.В., Феоктистов П.И. Анест. и реаниматол. 2004; 2:40-3.
11. Феоктистов П.И., Горобец Е.С., Костяк О.С., Мед. критических состояний. 2004; 6:30-5.
12. Дементьева И.И., Чарная М.А., Морхвов Ю.А. и др. Использование гемостатика НовоСевен у ббольнх с массивной кровопотерей при крупных хирургических вмешательствах. Пособие для врачей, М.: МАКС Пресс, 2004.,
| Август 2008 г. |