Опубликовано в:
Атмосфера. Нервные болезни »» № 2 2010
Применение Фенотропила у больных с хронической ишемией мозга и умеренными когнитивными нарушениями. Результаты рандомизированного двойного слепого плацебоконтролируемого исследования
А.И. Федин, Е.В. Амчеславская, Е.Н. Красноперов, А.В. Белопасова
Анатолий Иванович Федин – докт. мед. наук, профессор, зав. кафедрой неврологии ФУВ Российского государственного медицинского университета (РГМУ).
Елена Владимировна Амчеславская – канд. мед. наук, доцент кафедры неврологии ФУВ РГМУ.
Евгений Николаевич Красноперов – канд. мед. наук, зав. неврологическим отделением КДЦ городской клинической больницы № 15 им. О.М. Филатова г. Москвы.
Анастасия Владимировна Белопасова – клинический ординатор кафедры неврологии ФУВ РГМУ.
Рост числа лиц пожилого и старческого возраста наряду с увеличением в популяциях количества сосудистых и нейродегенеративных заболеваний определяет значительную распространенность когнитивных расстройств [1–3]. Особое внимание в последнее время уделяется додементным формам когнитивных расстройств, которые согласно современным представлениям называют умеренными когнитивными нарушениями (УКН) [4]. Это обусловлено их важным социально-экономическим значением, поскольку распространенность синдрома УКН в популяции достигает у лиц старше 65 лет от 11 до 17% и имеет тенденцию к нарастанию по выраженности, составляя 55–70% риска развития деменции в течение 5 лет [5]. Своевременное выявление этих нарушений повышает качество жизни больных и расширяет потенциальные возможности терапевтического воздействия, в том числе и с использованием препаратов ноотропного ряда [6].
Наряду с назначением мономодально-специфических ноотропных препаратов, воздействующих на одну из нейромедиаторных систем мозга, перспективным является применение нейромодуляторов, оказывающих опосредованное полисинаптическое воздействие на многие нейромедиаторные системы. Как было показано в ряде экспериментальных и клинических исследований, нейромодулирующий потенциал, проявляемый при выраженной неврологической патологии и пограничных психиатрических заболеваниях, определяется совокупностью таких взаимодополняющих эффектов, как психостимулирующий, противосудорожный, антидепрессантный, анксиолитический, ноотропный, антигипоксантный и адаптогенный [9]. К группе препаратов, оказывающих такое комплексное действие, относится N-карбамоил-метил-4-фенил-2-пирролидон (Фенотропил), представляющий собой фенильное производное рацетамового ряда, близкое по химическому строению к эндогенным медиаторам и оказывающее полимодальное действие [8].
Эффект Фенотропила в отношении когнитивных нарушений различной этиологии изучался в целом ряде клинических исследований. Так, Г.Н. Бельская и соавт. оценивали эффективность Фенотропила в остром периоде нетяжелого ишемического инсульта [11]. Влияние Фенотропила на когнитивные расстройства в остром периоде ишемического инсульта было изучено в работе М.М. Герасимовой и соавт. [12]. Аналогичные исследования были проведены у больных с начальными проявлениями недостаточности кровообращения головного мозга, последствиями перенесенного ишемического инсульта [13, 14].
Целью исследования являлось изучение эффективности и безопасности Фенотропила в дозе 100 и 200 мг/сут у больных с хронической ишемией мозга (ХИМ) и синдромом УКН.Материал и методы исследования
В исследование было включено 75 пациентов пожилого возраста с установленным диагнозом “хроническая ишемия мозга I–II стадии с умеренными когнитивными нарушениями”, из них 32 мужчины и 43 женщины в возрасте от 60 до 90 лет, средний возраст 70,9±5,2 года.
Уровень когнитивных расстройств устанавливался следующими способами:Определение когнитивных нарушений базировалось на результатах комплексного исследования при наличии активных жалоб пациента на снижение памяти, внимания, умственной работоспособности. Принимались во внимание показатели не менее 2 из 5 применяемых нейропсихологических тестов.
- по Краткой шкале оценки психического статуса (Mini Mental State Examination – MMSE), адаптированная Folstein et al. (1985);
- по батарее тестов лобной дисфункции (Frontal Assessment Battery – FAB);
- по тесту “Отыскивание чисел” (таблицы Шульте);
- по Гериатрической шкале депрессии;
- по Субъективной шкале оценки астении (MFI-20);
- по анкетам оценки сна;
- количественная оценка выраженности неврологических расстройств на основании адаптированной количественной неврологической шкалы А.И. Федина (1995).
При неврологическом исследовании у пациентов были выявлены симптомокомплексы, характерные для клинических проявлений ХИМ:Помимо основного заболевания в анамнезе у больных имели место заболевания сердечно-сосудистой системы: артериальная гипертензия (36 больных), атеросклероз сосудов головного мозга (23), артериальная гипертензия и атеросклероз сосудов головного мозга (16), ишемическая болезнь сердца (47), перенесенный ранее инфаркт миокарда (19). У 29 больных имелись сопутствующие хронические заболевания вне фазы обострения: хронический пиелонефрит (9 человек), хроническая почечная недостаточность (5), язвенная болезнь двенадцатиперстной кишки (4), хронический гастрит (11).
- общемозговые симптомы в виде головной боли – у 66 больных;
- астенический симптомокомплекс (повышенная утомляемость, снижение работоспособности, нарушение сна) – у 74 больных;
- вестибулокохлеарные расстройства (шум, звон в ушах, снижение слуха, головокружение) – у 68 больных;
- пирамидная и кортиконуклеарная недостаточность в виде оживления сухожильных и периостальных рефлексов, анизорефлексии, снижения кожных рефлексов, псевдобульбарных рефлексов – у 70 больных;
- вегетативные расстройства (лабильность пульса и артериального давления, эмоционально-волевые нарушения, сухость кожи или гипергидроз) – у 75 больных;
- координаторные расстройства с признаками статической и динамической атаксии – у 58 больных;
- когнитивные нарушения, проявлявшиеся в затруднении оперативной памяти, снижении концентрации, внимания, замедленности психических процессов, – у 75 больных;
- аффективные расстройства в виде тревоги и депрессии – у 64 больных.
Исследование было двойным слепым плацебоконтролируемым.
Больные были отобраны в соответствии с разработанными критериями включения и исключения. До включения в клинические испытания больные давали письменное информационное согласие об участии в исследовании.
Критерии включения:Критерии исключения:
- возраст от 60 до 90 лет;
- диагноз хронической ишемии мозга I–II стадии с умеренными когнитивными нарушениями;
- балл по Краткой шкале оценки психического статуса не менее 25;
- наличие подписанного и датированного информированного согласия пациента.
Дизайн исследования предусматривал 3 визита пациента к лечащему врачу. Включение пациентов в группы основывалось на принципе рандомизации методом конвертов. Каждому пациенту при его соответствии критериям включения присваивался порядковый номер (от 1 до 75) и вскрывался конверт с соответствующим номером. Внутри конверта находилась информация с номером коробки исследуемого препарата, который будет назначен пациенту.
- тяжелые, декомпенсированные или нестабильные соматические заболевания (любые заболевания или состояния, которые угрожают жизни больного или ухудшают прогноз больного);
- перенесенный инсульт давностью менее года;
- наличие когнитивных нарушений вследствие другого подтвержденного неврологического или психиатрического заболевания (болезнь Альцгеймера, болезнь Паркинсона и др.);
- глубокая степень двигательного или сенсорного дефекта;
- терминальные состояния;
- одновременный или менее чем за 4 нед до включения в исследование прием ноотропных и метаболических препаратов, а также препаратов, влияющих на системный кровоток; если пациент получал курс лечения вышеуказанными препаратами, то они либо отменялись, либо курс заканчивался, и только через 2 нед пациент включался в исследование;
- изменение режима дозировки психотропных препаратов (антидепрессанты, нейролептики, транквилизаторы);
- непереносимость исследуемого препарата.
Начиная со дня исходного визита пациент принимал исследуемый препарат. Каждый пациент получал по 2 таблетки препарата утром в 9:00 из коробки с соответствующим порядковым номером.
Комплаентность пациента (правильность приема им препарата) оценивал исследователь на втором визите.
В конце 2-й недели терапии проводился второй визит, целью которого было: проверка добросовестности пациента в отношении приема препарата, контроль безопасности и переносимости лечения, выдача второй коробки Фенотропила для приема в последующие 15 дней. В конце 4-й недели терапии проходил третий визит, в ходе которого проводилось повторное нейропсихологическое исследование, заполнялась анкета оценки сна, оценивалось наличие и выраженность нежелательных явлений.
Помимо исследуемого препарата все пациенты получали также ацетилсалициловую кислоту, антигипертензивные и антиангинальные препараты.
После окончания работы и получения информации о распределении пациентов были сформированы три группы сравнения:Свидетельством клинической эффективности исследуемого препарата считалась статистически и клинически значимая положительная динамика, оцениваемая по применяемым нейропсихологическим шкалам.
- 25 человек, которые получали Фенотропил в дозе 100 мг/сут в течение 30 дней (1-я группа);
- 25 человек, которые получали Фенотропил в дозе 200 мг/сут в течение 30 дней (2-я группа);
- 25 человек, которые получали плацебо в течение 30 дней (3-я группа).
Для оценки динамики функционального состояния головного мозга до и после курсового лечения всем пациентам проводилось ЭЭГ-обследование. Регистрацию ЭЭГ проводили с помощью 20-канального энцефалографического компьютеризированного комплекса “Нейрокарто-граф-01-МБН” фирмы МБН (Россия). Анализ данных ЭЭГ осуществляли по следующему алгоритму:Всем больным проводилась МРТ головного мозга.
- расчет показателей когерентности в α- и θ-диапазоне, δ-диапазоне для межполушарных лобных пар;
- расчет средних суммарных значений по обоим полушариям головного мозга отношения мощностей ритмов α + β/δ + θ(F/S) [16].
У 2 больных в динамике до и после курсового лечения Фенотропилом изучались результаты магнитно-резонансной (МР)-спектроскопии. МР-спектроскопия проводилась в отделе лучевой диагностики (руководитель – докт. мед. наук Т.А. Ахадов) НИИ неотложной детской хирургии и травматологии (директор – профессор Л.М. Рошаль). Результаты спектроскопии оценивала докт. биол. наук Н.А. Семенова.
Оценка безопасности и переносимости лечения производилась в соответствии с частотой и тяжестью нежелательных явлений, которые фиксировались на фоне приема препарата. Фиксировались все нежелательные явления, которые могли произойти у пациента после приема первой дозы исследуемого препарата и до окончания лечения.
Результаты исследования подвергались статистическому анализу на персональном компьютере с использованием статистических пакетов Systat v. 10.2 и Statistica v. 6.0.Результаты
Из 75 пациентов, включенных в исследование, 69 прошли предусмотренный протоколом месячный курс лечения. Преждевременно прекратили участие в исследовании ввиду нежелательных побочных явлений 6 пациентов, поэтому дальнейшая статистическая обработка результатов проводилась у 69 больных.Динамика неврологических расстройств
При оценке неврологических расстройств на основании адаптированной количественной неврологической шкалы А.И. Федина после курсового лечения выявлена статистически значимая динамика синдромов в разделах “общемозговые симптомы”, “кохлеовестибулярные нарушения”, “координаторные расстройства” и “вегетативные расстройства” в 1-й и 2-й группах в сравнении как с их исходным уровнем до лечения, так и с показателями 3-й группы (плацебо). Так, в 1-й и 2-й группах (данные обеих групп ввиду незначительности различий были объединены) регресс общемозговых симптомов был с 1,6±0,1 до 1,1±0,2 балла (р<0,05), кохлеовестибулярных нарушений – с 4,91±0,4 до 2,7±0,3 балла (р<0,05), координаторных расстройств – с 2,8±0,2 до 1,6±0,3 балла (р<0,05) и вегетативных расстройств – с 14,1±0,7 до 10,1±0,9 балла (р<0,05). Динамика этих синдромов была более выраженной по сравнению с показателями 3-й группы (р<0,05).
Динамика показателей нейропсихологического тестирования
При сравнении между группами показателей, полученных по результатам проведения нейропсихологических тестов в начале исследования (1-й визит), статистически значимых различий между группами пациентов выявлено не было (табл. 1).
После курсового лечения статистически значимые отличия от 3-й группы имелись в 1-й и 2-й группах по нейропсихологическим шкалам “Краткая шкала оценки психического статуса” (MMSE), “Тест Шульте”, “Шкала астении” (MFI-20). Между 1-й и 2-й группами отмечались статистически значимые различия по шкалам “Тест Шульте” и “Шкала астении” с более выраженной положительной динамикой во 2-й группе. При сравнении между собой средних показателей остальных нейропсихологических тестов в 1-й, 2-й и 3-й группе не выявлено статистически значимых различий.
До лечения у исследуемых пациентов трех групп были жалобы на снижение памяти, внимания, повышенную утомляемость, истощаемость, физическую усталость, головокружение, головную боль. При исходной оценке уровня когнитивных функций при помощи шкалы MMSE у пациентов всех трех групп выявлялось их снижение по сравнению с нормой. После проведенного курса лечения у пациентов 1-й и 2-й групп была выявлена статистически значимая динамика суммарного балла по шкале MMSE по сравнению с исходным фоном, что сопровождалось уменьшением выраженности жалоб на снижение памяти. Наиболее выраженная динамика отмечалась в 1-й и 2-й группах по сравнению с 3-й группой по субтестам “Память” и “Серийный счет” (табл. 2). В 3-й группе статистически значимых отличий по сравнению с исходным уровнем не выявлено.Таблица 1. Данные нейропсихологических тестов и шкал (М±m) по группам до и после лечения (в баллах)
Шкалы 1-я группа (n = 21) 2-я группа (n = 24) 3-я группа (n = 24) до лечения после лечения до лечения после лечения до лечения после лечения Краткая шкала оценки
психического статуса (MMSE)25,4±0,2 27,3±0,2* 25,6±0,3 27,2±0,2* 25,8±0,2 26,1±0,2 Батарея тестов лобной
дисфункции (FAB)14,3±0,3 15,5±0,3 14,2±0,2 15,2±0,2 14,5±0,2 14,6±0,2 Гериатрическая шкала
депрессии13,9±0,7 13,6±0,7 13,7±0,6 13,4±0,6 13,7±0,7 13,8±0,8 Шкала оценки сна 17,6±0,6 17,8±0,5 16,9±0,7 17,2±0,8 16,3±0,8 16,4±0,9 Тест Шульте 71,6±0,6 67,1±0,1* 69,9±0,8 65,2±0,1*# 70,2±0,6 70,9±0,2 Шкала астении (MFI-20) 73,5±0,4 67,6±0,5* 73,0±0,5 64,6±0,5*# 72,6±0,3 72,4±0,3 * Различия достоверны (p<0,05) по сравнению с группой плацебо.
# Различия достоверны (p<0,05) при сравнении между 1-й и 2-й группами.Таблица 2. Динамика показателей шкалы MMSE (М±m) по группам до и после лечения (в баллах)
Показатели шкалы MMSE 1-я группа (n = 21) 2-я группа (n = 24) 3-я группа (n = 24) до лечения после лечения до лечения после лечения до лечения после лечения Суммарный балл 25,4±0,2 27,2±0,2*# 25,4±0,2 27,1±0,2*# 25,4±0,2 26,2±0,2 Ориентировка 9,5±0,1 9,7±0,1 9,5±0,1 9,7±0,09 9,5±0,1 9,5±0,1 Восприятие 2,8±0,08 3,0±0,0 2,8±0,08 2,9±0,06 2,8±0,08 2,9±0,04 Серийный счет 3,4±0,2 3,8±0,1*# 3,4±0,2 3,9±0,2*# 3,4±0,2 3,5±0,1 Память 1,8±0,1 2,3±0,1*# 1,8±0,1 2,2±0,09*# 1,8±0,1 2,0±0,1 Речь 6,4±0,1 6,6±0,1 6,4±0,1 6,4±0,1 6,4±0,1 6,5±0,1 Чтение, письмо 1,7±0,08 1,8±0,08 1,7±0,08 1,8±0,07 1,7±0,08 1,7±0,09 * Различия достоверны (р<0,05) в сравнении с группой плацебо.
# Различия достоверны (p<0,001) при сравнении в группах до и после лечения.Таблица 3. Динамика показателей теста Шульте (М ± m) по группам до и после курса лечения (в баллах)
Показатели теста Шульте 1-я группа (n = 21) 2-я группа (n = 24) 3-я группа (n = 24) до лечения после лечения до лечения после лечения до лечения после лечения Эффективность работы 69,6±0,1 67,1±0,1*^ 70,1±0,1 65,2±0,1*#^ 68,8±0,1 70,9±0,2 Степень врабатываемости 1,9±0,08 1,8±0,07 1,8±0,09 1,7±0,01 1,9±0,08 2,1±0,07 Психическая устойчивость 1,9±0,01 1,7±0,01*^ 1,9±0,01 1,5±0,01*#^ 1,9±0,01 2,0±0,09 * Различия достоверны (p<0,05) в сравнении с группой плацебо.
# Различия достоверны (p<0,05) при сравнении между 1-й и 2-й группами.
^ Различия достоверны (p<0,001) при сравнении в группах до и после лечения.
Исследование памяти, внимания и умственной работоспособности у исследуемых пациентов при помощи нейропсихологического теста Шульте исходно выявило увеличение времени работы с таблицами по сравнению с нормой (в норме на одну таблицу уходит от 30 до 50 с). На фоне лечения у пациентов 1-й и 2-й групп отмечено статистически значимое улучшение показателей шкалы по сравнению с исходным уровнем (табл. 3). При проверке этого теста уменьшилось время работы со всеми пятью таблицами, а также уменьшилось время работы с 5-й таблицей, что отражено в параметрах “Эффективность работы” и “Психическая устойчивость” соответственно. Время работы с 1-й таблицей в обеих группах уменьшилось (параметр “Степень врабатываемости”), но различие не достигло достоверных величин. Темп выполнения задания стал носить более равномерный характер, что свидетельствует об уменьшении истощаемости умственных процессов. При этом более выраженной динамика показателей теста была во 2-й группе по сравнению с 1-й группой. В 3-й группе имелась тенденция к улучшению показателей теста, но она была незначительной и носила недостоверный характер.
При оценке уровня астенических расстройств до лечения по шкале MFI-20 у всех пациентов наблюдался повышенный уровень общей, физической и психической астенизации, снижение активности и мотивации. Динамика нейропсихологического статуса по субтестам шкалы MFI-20 представлена в табл. 4.
По сравнению с исходным уровнем статистически значимая динамика была в 1-й и 2-й группах. У пациентов данных групп снизился уровень общей и физической астенизации, повысилась активность. Более выраженный антиастенический эффект выявлен у пациентов 2-й группы, получавших курсовое лечение Фенотропилом в дозе 200 мг.
По субтестам “Психическая астения” и “Мотивация” статистически значимая динамика не определялась. В 3-й группе пациентов, получавших плацебо, не было значимой динамики по субтестам “Общая астения”, “Физическая астения”, “Психическая астения” и “Мотивация”, но отмечалась тенденция к улучшению показателей по субтесту “Активность”, не достигавшая барьера статистической значимости и связанная, повидимому, с так называемым психологическим “эффектом плацебо”.
По батарее тестов лобной дисфункции (FAB), гериатрической шкале депрессии, шкале оценки сна статистически значимых различий между исходным уровнем до лечения и после лечения в трех группах не выявлено (р>0,05).Таблица 4. Динамика показателей шкалы MFI-20 (М±m) по группам до и после курса лечения (в баллах)
Показатели шкалы MFI−20 1-я группа (n = 21) 2-я группа (n = 24) 3-я группа (n = 24) до лечения после лечения до лечения после лечения до лечения после лечения Суммарный балл 73,5±0,4 67,6±0,5*^ 73,2±0,5 64,6±0,5*#^ 72,8±0,4 73,3±0,3 Общая астения 16,6±0,2 14,8±0,2*^ 16,2±0,2 13,5±0,2*#^ 16,4±0,1 16,3±0,1 Физическая астения 13,5±0,2 12,5±0,2*^ 14,1±0,2 12,0±0,2*^ 14,5±0,2 14,7±0,2 Активность 17,5±0,1 14,5±0,2*^ 17,6±0,1 13,3±0,3*#^ 17,4±0,1 17,4±0,2 Мотивации 13,0±0,1 12,9±0,2 12,7±0,2 12,6±0,2 12,4±0,2 12,4±0,2 Психическая астения 12,9±0,2 12,8±0,2 12,4±0,2 12,0±0,2 12,0±0,2 12,5±0,2 Обозначения те же, что и в табл. 3. Динамика функционального состояния головного мозга по данным компьютерной электроэнцефалографии
До начала лечения у исследуемых пациентов спонтанная биоэлектрическая активность головного мозга характеризовалась общей дезорганизацией ритмики, снижением мощностей быстроволновой активности α- и β-диапазонов, преобладанием диффузных медленных волн θ- и δ-диапазонов. Расчет средних суммарных значений исследуемых параметров ЭЭГ по обоим полушариям головного мозга (отношения мощностей ритмов α + β/δ + θ, индекс F/S) показал, что средняя величина индекса F/S во всех группах была меньше 1 (в норме F/S>1), что соответствовало преобладанию медленноволновой активности θ- и δ-диапазонов. После курсового лечения у пациентов 1-й и 2-й групп отмечалась статистически значимая динамика средней величины индекса F/S по сравнению с исходным уровнем и с показателем 3-й группы, что свидетельствовало об увеличении мощности быстроволновой активности α- и β-диапазонов и уменьшении медленноволновой активности. Статистически значимых различий между 1-й и 2-й группами не выявлено. Данные по динамике средней величины индекса F/S по группам представлены в табл. 5.
Таблица 5. Динамика индекса F/S до и после курсового лечения в трех группах больных
Группа Индекс F/S до лечения после лечения 1-я группа (n=21) 0,73±0,2 1,31±0,1*# 2-я группа (n=24) 0,83±0,2 1,38±0,1*# 3-я группа (n=24) 0,68±0,3 0,61±0,1 * Различия достоверны (p<0,05) в сравнении с показателем до лечения.
# Различия достоверны (p<0,05) в сравнении с группой плацебо.Таблица 6. Динамика показателей когерентности по лобным межполушарным парам до и после курсового лечения в трех группах больных
Группа Когерентность α-активность θ-активность до лечения после лечения до лечения после лечения 1-я группа (n=21) 0,18±0,01 0,23±0,01*# 0,42±0,01 0,38±0,01*# 2-я группа (n=24) 0,20±0,02 0,24±0,01*# 0,39±0,02 0,34±0,02*# 3-я группа (n=24) 0,19±0,02 0,19±0,02 0,40±0,02 0,41±0,02 * Обозначения те же, что и в табл. 5.
У здоровых людей уровень когерентности в различных топографических зонах колеблется в пределах 0,5–0,8 и редко уменьшается ниже 0,4. При исследовании уровня внутримозговой интеграции по данным когерентного анализа ЭЭГ у пациентов всех трех групп выявлено снижение уровня интеграционных межполушарных процессов (межполушарные лобные пары) в виде снижения абсолютных показателей когерентности во всех межполушарных парах. Достоверных различий исходных показателей когерентности между группами не было.
При анализе когерентности ЭЭГ после проведенного лечения в группах выявлены изменения в виде увеличения абсолютных показателей когерентности по лобным межполушарным парам F3–F4, F7–F8 в α- и β-диапазонах и снижения в θ- и δ-диапазонах у пациентов 1-й и 2-й групп по сравнению с исходным фоном и с 3-й группой. Данные носили статистически значимый характер. Достоверных различий между 1-й и 2-й группами, а также в 3-й группе между исходным фоном и показателями после лечения выявлено не было. Динамика показателей когерентности α- и θ-диапазонов по лобным межполушарным парам представлена в табл. 6.
Корреляционный анализ нейрофизиологических и нейропсихологических параметров показал, что как до начала лечения, так и после курсового лечения имеется выраженная прямая связь между значениями когерентности α-и β-ритмов (r=0,8) и функциями памяти и внимания, работоспособности, а также обратная взаимосвязь между значениями когерентности θ- и δ-диапазонов и индексом F/S.МР-спектроскопия головного мозга
МР-спектроскопия головного мозга наряду с МРТ головного мозга проводилась у 2 больных до и после курсового лечения Фенотропилом.
МР-спектроскопия является одним из новейших методов лучевой диагностики. Использование этого метода основано на определении особенностей изменения содержания метаболитов и их соотношений в различных областях мозга, а также на наличии корреляции между метаболическими нарушениями и тяжестью когнитивных расстройств. В нашем исследовании определялось содержание метаболитов (N-ацетиласпартата, лактата и креатинина) в коре лобной и затылочной долей. N-ацетиласпартат является маркером здоровых нейронов. Креатинин характеризует состояние энергетического обмена в нейронах, так как является источником образования АТФ и АМФ, при старении его содержание в головном мозге снижается. Лактат, как известно, представляет собой маркер ишемии, в здоровом мозге при аэробном окислении глюкозы определяемого лактата не должно быть. Таким образом, вышеперечисленные метаболиты можно использовать для оценки степени ишемического поражения мозга и динамики процесса при приеме нейропротективных препаратов.
На основании данных анамнеза, клинического обследования, результатов нейропсихологического тестирования, МРТ головного мозга и других методов инструментального исследования обеим пациенткам был выставлен диагноз: “Цереброваскулярная болезнь; хроническая ишемия мозга с умеренными когнитивными нарушениями”. По данным МРТ головного мозга в первом случае были выявлены изменения в веществе головного мозга, соответствующие возрастной норме, во втором – определялись ишемические кисты в подкорковом белом веществе обоих полушарий мозга, характерные для ХИМ. Эти данные коррелировали с результатами, полученными при нейропсихологическом тестировании.
Динамика результатов тестирования по нейропсихологическим шкалам до и после курсового приема Фенотропила в дозе 100 мг представлена в табл. 7. Как видно из этой таблицы, у пациенток после курсового лечения выявлена положительная динамика почти всех показателей, за исключением шкал депрессии и оценки сна. Отмечается улучшение показателей, отражающих выраженность когнитивных нарушений, – суммарного результата тестов MMSE и тестов лобной дисфункции. Улучшились параметры, характеризующие оперативную память, скорость восприятия и переработки информации по тесту Шульте.
Уменьшилась степень выраженности общей и физической астении, повысилась активность.Таблица 7. Динамика результатов нейропсихологического тестирования двух больных до и после курсового лечения (в баллах)
Нейропсихологический тест Пациентка № 1 Пациентка № 2 до лечения после лечения до лечения после лечения Шкала MMSE суммарный балл 26 27 24 25 Батарея тестов лобной дисфункции суммарный балл 16 17 15 16 Шкала астении
общая астения16 14 17 15 физическая астения 14 13 15 14 снижение активности 12 11 13 11 Гериатрическая шкала депрессии 10 10 10 10 Шкала оценки сна 15 15 17 17 Тест Шульте 65,7 52,9 76,6 66,8
На рис. 1 и 2 приведены МР-спектрограммы первой больной, выполненные в динамике до начала лечения и после завершения приема Фенотропила в суточной дозе 100 мг. Область исследования – серое вещество лобной доли. Объем образа – 2x10x1,5 мм. Амплитудные характеристики сигналов каждой спектрограммы и их изменения в динамике отсчитываются относительно “эталонного” сигнала Cr, который обычно принимается за единицу отсчета. Сопоставление спектров сигналов пациентки до курса лечения и после его завершения показало, что в спектре лобной коры выросла интенсивность сигнала миоинозитола (ml), глутамата/глутамина (Glx) и незначительно – N-ацетиласпартата (NAA). Уровни других метаболитов существенно не изменились. Таким образом, локальная МР-спектрограмма в проекции серого вещества лобной доли показывает, что исследуемый препарат увеличил уровень функционально полноценных нейронов (возрастание интенсивности сигналов от NAA и Glx), а также активировал процессы пролиферации, на что указывает увеличение сигнала от миоинозитола.
Рис. 1. МР-спектрограмма первой больной до начала лечения (справа – МРТ головного мозга).
Glx – глутамат/глутамин, ml – миоинозитол, Cho – холин и холинсодержащие соединения (фосфохолин, глицерофосфохолин), Cr – креатин и фосфокреатин, Lac – лактат, NAA – N-ацетиласпартат и N-ацетиловые группы.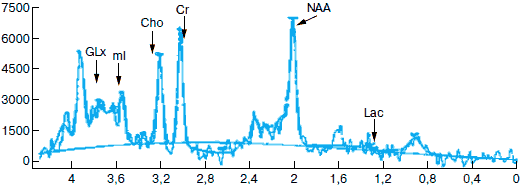
Рис. 2. МР-спектрограмма первой больной после курса лечения Фенотропилом.
Здесь и на рис. 3 и 4 обозначения те же, что и на рис. 1. Объяснения в тексте.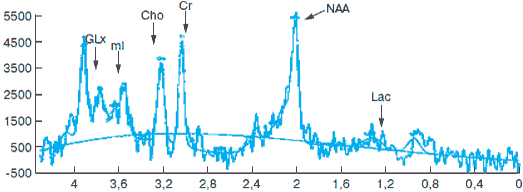
Рис. 3. МР-спектрограмма второй больной до начала лечения (справа – МРТ головного мозга). Объяснения в тексте. 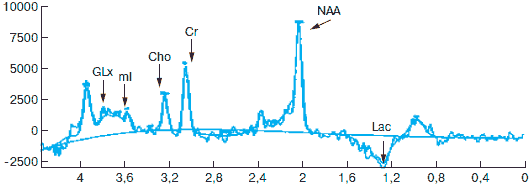
Рис. 4. МР-спектрограмма второй больной после курса лечения Фенотропилом. Объяснения в тексте. 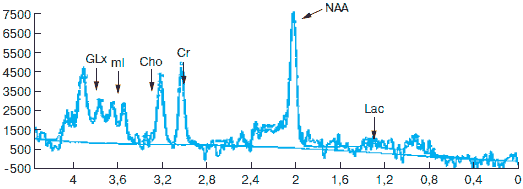
На рис. 3 и 4 приведены МР-спектрограммы в динамике у второй больной. Область исследования – серое вещество лобной доли. Объем образа – 2x10x1,5 мм. Сопоставление спектров сигналов пациентки до курса лечения и после его завершения показало, что в спектре лобной коры исчез сигнал лактата. Выросла интенсивность сигнала N-ацетиласпартата. Увеличилась интенсивность сигнала миоинозитола, что указывает на активацию пролиферации астроцитов. Уровни других метаболитов существенно не изменились. Данные исследования показывают, что исследуемый препарат проявил антигипоксическое действие (увеличение активности NAA – возрастание функциональной активности нейронов). На фоне проведенного лечения нивелировались процессы анаэробного гликолиза в исследуемой области мозга (исчезновение пика лактата – на рисунках учитывается не положение пика в отношении изолинии, а его амплитуда – интенсивность сигнала Lac), увеличился уровень функционально полноценных нейронов с активизацией процессов пролиферации астроцитов (возрастание амплитуд пиков миоинозитола и глутамата/глутамина).
Таким образом, МР-спектроскопическое исследование в нашей серии наблюдений подтвердило наличие гипоксических и обменных нарушений в нервной ткани вещества головного мозга, сопутствующих ХИМ. Отмечена определенная взаимосвязь выраженности этих изменений и тяжести заболевания. МР-спектроскопия позволила проследить комплексное действие исследуемого ноотропного препарата Фенотропила в дозе 100 мг при его курсовом назначении. Результатом курсового применения препарата стало уменьшение гипоксических нарушений, улучшение энергетических процессов в нервной ткани (переход с анаэробного на аэробный путь гликолиза), улучшение процессов миелинизации, увеличение пула возбуждающих медиаторов в ткани мозга и возрастание числа функционально полноценных нейронов в этой области мозга. Полученные данные совпали с клинической оценкой динамики неврологического и нейропсихологического статуса по соответствующим шкалам.Безопасность и переносимость терапии
Шесть пациентов прекратили участие в исследовании преждевременно по разным причинам. У двух пациентов (по одному из каждой группы) с хроническим гастритом возникли диспепсические явления (изжога, отрыжка).
Три пациента 1-й группы отмечали повышенную раздражительность и нарушение сна (бессонницу, сон с частыми пробуждениями и кошмарами). У 1 больной из 3-й группы возникла патологическая сонливость в дневное время суток. Данные нежелательные явления стали причиной отказа этих больных продолжить участие в исследовании.
Таким образом, можно говорить о том, что в 92% случаев изучаемый препарат показал хороший уровень безопасности и переносимости.Обсуждение
Ноотропные препараты в настоящее время являются неотъемлемой составляющей комплексной терапии ХИМ[6]. Это обусловлено их влиянием на метаболические и биоэнергетические процессы в нервной клетке [17]. Эффекты ряда ноотропных препаратов опосредуются через нейромедиаторные системы головного мозга, среди которых наибольшее значение имеют моноаминергическая и глутаматергическая системы [18].
Появление нового отечественного препарата из группы ноотропов – Фенотропила – знаменует собой новый этап в применении ноотропных средств в связи с рядом особенностей Фенотропила, определяющих его нейромодуляторную активность [19]. В отличие от “родоначальника” применяемых ноотропов пирацетама (ноотропил) у Фенотропила имеется фенильный радикал, что определило, по результатам многочисленных экспериментальных и предварительных клинических исследований, его положительное влияние на обменные процессы и кровообращение в мозге наряду со способностью повышать устойчивость тканей мозга к гипоксии и токсическим воздействиям, улучшать интегративную деятельность головного мозга, стимулировать концентрацию внимания и умственную деятельность, облегчать процессы обучения, повышать скорость передачи информации между полушариями мозга. Такая поливалентность клинических эффектов объяснялась еще и тем, что Фенотропил оказался активным в первую очередь в отношении рецепторов никотинового ряда и NMDA-типа глутаматных рецепторов. Но если в отношении первых препарат обнаружил прямое действие, то увеличение концентрации вторых можно объяснить только через механизм нейромодуляции [19]. Также было показано, что данный препарат стимулирует окислительно-восстановительные процессы, увеличивает утилизацию глюкозы, повышает энергетический потенциал за счет ускорения оборота АТФ, повышает активность аденилатциклазы и глутаматдекарбоксилазы, усиливает синтез ядерной РНК. В дозах 100–300 мг Фенотропил увеличивает содержание в головном мозге дофамина, норадреналина и серотонина [20].
Всё это патогенетически обосновывает целесообразность назначения Фенотропила при лечении больных с ХИМ и синдромом когнитивных нарушений. Результатом курсового лечения Фенотропилом как в дозе 100 мг, так и в дозе 200 мг (1-я и 2-я группы пациентов) стали статистически значимые положительные изменения неврологических симптомов и синдромов при оценке их динамики с помощью адаптированной количественной неврологической шкалы А.И. Федина. Ранее другими исследователями было показано, что при лечении Фенотропилом достоверно улучшаются суммарные показатели когнитивных функций больных (по шкале MMSE). Препарат оказывает положительное влияние на память и другие интеллектуальные функции, а также на эмоциональные нарушения у больных в раннем восстановительном периоде инсульта. У больных, перенесших инсульт, отмечены повышение мобильности, способности к самообслуживанию и бытовой активности, нормализация сна, снижение степени дискомфорта, депрессии и астении [21]. В нашем исследовании комплексная оценка динамики симптомов с использованием шкал и тестов позволила выявить статистически значимые отличия от исходного состояния пациентов, а также в сравнении с группой плацебоконтроля. Более значимые результаты достигнуты при назначении суточной дозы 200 мг.
Особо следует подчеркнуть, что у исследуемых больных на фоне курсового лечения Фенотропилом значительно уменьшилась степень астенических расстройств при оценке их по шкале MFI-20. У пациентов было отмечено статистически значимое уменьшение уровня общей и физической астении, повысилась активность, улучшилось настроение. Достоверно более выраженный антиастенический эффект был выявлен у пациентов 2-й группы. Эти данные совпадают с ранее полученными результатами других исследователей у ограниченного числа пациентов с различными формами нарушений мозгового кровообращения [22, 23], а также у больных с последствиями черепно-мозговой травмы [24–26].
Препарат исходно был разработан с целью формирования и поддержки оптимальной работоспособности в условиях космических полетов, что обусловило его способность повышать устойчивость центральной нервной системы к гипоксии наряду с коррекцией функциональных систем организма человека в экстремальных условиях [27, 28]. Помимо повышения устойчивости тканей мозга к гипоксии и токсическим воздействиям Фенотропил способен улучшать интегративную деятельность головного мозга, стимулировать концентрацию внимания и умственную деятельность, облегчать процессы обучения, повышать скорость передачи информации между полушариями мозга [29].
МР-спектроскопическое исследование в нашей серии наблюдений подтвердило наличие гипоксических и обменных нарушений в нервной ткани вещества головного мозга, сопутствующих ХИМ. Отмечена определенная взаимосвязь степени выраженности этих изменений и тяжести заболевания, оцениваемой клинически и инструментально.
В то же время МР-спектроскопия позволила проследить нейромодулирующее действие Фенотропила при его курсовом назначении. Результатом применения препарата по истечении 1 мес лечения стало уменьшение гипоксических нарушений, увеличение энергетических процессов в нервной ткани (переход с анаэробного на аэробный путь гликолиза), превалирование процессов миелинизации, увеличения пула возбуждающих медиаторов в ткани мозга и возрастание числа функционально полноценных нейронов в этой области мозга. Полученные данные совпали с клинической оценкой динамики неврологического и нейропсихологического статуса у обследованных больных по соответствующим шкалам. Таким образом, метод МР-спектроскопии позволил прижизненно визуализировать морфологический эквивалент действия препарата – процесс ишемизации вещества головного мозга через 1 мес приема Фенотропила значительно уменьшился. Об этом можно судить по увеличению количества активно функционирующих нейронов (в зоне исследования), нормализации процессов клеточного дыхания и медиаторных систем, а также по преобладанию процессов структуризации (миелинизации) в нервной ткани. Всё это в совокупности позволяет предположить о наличии еще одного, ранее не описанного другими исследователями эффекта препарата – его нейротрофического и структурообразующего действия на мозг, что подтверждает его комплексный нейромодулирующий эффект.
Корреляционный анализ нейрофизиологических и нейропсихологических параметров показал, что как до начала лечения, так и после курсового лечения Фенотропилом имеется значительная прямая связь между показателями когерентности α- и β-ритмов (r=0,8) и функциями памяти, внимания и работоспособности при существовании обратной зависимости со значениями когерентности θ- и δ-диапазонов и индексом F/S. Ранее рядом авторов была прослежена положительная динамика выраженности микроочаговых симптомов, данных нейрокартирования и транскраниальной ультразвуковой допплерографии у больных в остром периоде инфаркта мозга легкой и средней степени тяжести [11], а также у пациентов с последствиями черепно-мозговой травмы на фоне курсового лечения Фенотропилом [30]. В нашем исследовании впервые на большом числе больных методом компьютерной ЭЭГ была выявлена статистически значимая положительная динамика функциональных параметров ЭЭГ по сравнению с исходным уровнем, а корреляционный анализ нейрофизиологических и нейропсихологических параметров показал, что как до начала лечения, так и после курсового лечения Фенотропилом имеется значительная прямая связь между значениями когерентности ритмов ЭЭГ и функциями памяти, внимания и работоспособности.
Список использованной литературы
- Захаров В.В. Возрастные когнитивные нарушения. М., 2004.
- Локшина А.Б. Легкие и умеренные когнитивные расстройства при дисциркуляторной энцефалопатии: Дис. ... канд. мед. на ук. М., 2005.
- Яхно Н.Н., Захаров В.В. // Рус. мед. журн. 2002. № 12–13. С. 539.
- Захаров В.В., Яхно Н.Н. Когнитивные расстройства в пожилом и старческом возрасте: Методическое пособие для врачей. М., 2005.
- Dubois B. et al. // Neurology. 1999. V. 55. P. 1621.
- Федин А.И. // Атмосфера. Нервные болезни. 2006. № 4. С. 22.
- Lezak M.D. Neuropsychology Assessment. N.Y., 1983.
- Арсеньева К.Е. // Рус. мед. журн. 2007. № 6. С. 519.
- Ахапкина В.И. // Поликлиника. 2009. № 2. С. 4.
- Ахапкина В.И., Воронина Т.А. // XI Российский нац. конгресс “Человек и лекарство”: Тез. докл. М., 2004. С. 70.
- Бельская Г.Н. и др. // Атмосфера. Нервные болезни. 2005. № 1. С. 25.
- Герасимова М.М. и др. // Журн. неврол. и психиатр. 2005. № 5. С. 63.
- Чайковский Ю.Н., Ельчанинов А.П. // Атмосфера. Нервные болезни. 2007. № 1. С. 35.
- Савченко А.Ю. и др. // Журн. неврол. и психиатр. 2005. № 12. С. 22.
- Калинский П.П. и др. // Журн. неврол. и психиатр. 2008. № 6. С. 15.
- Федин А.И. // Неврол. журн. 1996. № 1. С. 36.
- Захаров В.В. // Рус. мед. журн. 2007. № 4. С. 206.
- Ковалев Г.И. и др. // Атмосфера. Нервные болезни. 2007. № 4. С. 1.
- Белоусов Ю.Б., Мухина М.А. // Кач. клин. практ. 2005. № 3. С. 1.
- Захаров В.В. // Рус. мед. журн. 2005. № 22. С. 10.
- Багирь Л.В. и др. // Consilium Medicum. 2006. № 8. С. 2.
- Ахапкина В.И. // Атмосфера. Нервные болезни. 2004. № 3. С. 28.
- Калинский П.П. и др. // Журн. неврол. и психиатр. 2008. № 6. С. 10.
- Алешина Н.В. и др. // Трудный пациент. 2005. № 5. С. 15.
- Филиппова С.Ю. и др. // Мед. кафедра. 2005. № 15. С. 158.
- Чикина Е.С., Левин В.В. // Русский врач. 2005. № 11. С. 9.
- Разсолов Н.А. и др. Нормобарическая гипокситерапия: Методические рекомендации для авиационных врачей. М., 2002.
- Краснов В.Н. и др. // XI Российский нац. конгресс “Человек и лекарство”: Тез. докл. М., 2004. С. 615.
- Вахов В.П., Ахапкина В.И. // XI Российский нац. конгресс “Человек и лекарство”: Тез. докл. М., 2004. С. 603.
- Одинак М.М. и др. // XI Российский нац. конгресс “Человек и лекарство”: Тез. докл. М., 2004. С. 278.
- Burns A., Zaudig M. // Lancet. 2002. V. 360. P. 1963.
- Petersen R.S. et al. // Int. Psychogeriatr. 1997. V. 9. P. 37.
| Ноябрь 2009 г. |