За малые деньги для вас совсем недорого. . Для вас выставочные стенды |
Опубликовано в журнале:
педиатрия №2 | 2007 | репринт | приложение consilium medicumКларитромицин в педиатрии: фокус на инфекции дыхательных путей
Н.В.Белобородова
Кабинет рациональной антибиотикотерапии Департамента здравоохранения МосквыДаже среди равных можно выбрать лучшего, но это не значит, что остальные хуже.
Козьма ПрутковНовейшая история макролидов
Первый антибиотик группы макролидов - эритромицин, был синтезирован в 1952 г. и по-прежнему широко применяется в клинической практике. Однако возможность его применения ограничена из-за большой частоты неопасных, но неприятных нежелательных явлений, низкой биодоступности, неудобства приема 4 раза в день, низкой активности против гемофильной палочки и взаимодействия с рядом препаратов.
Были разработаны новые макролидные антибиотики следующего поколения, из которых наиболее удачными представителями оказались кларитромицин и азитромицин. Эти препараты отличаются от эритромицина значительно улучшенной фармакокинетикой, более низкой частотой побочных эффектов, большей активностью против ряда значимых возбудителей, сниженной способностью взаимодействовать с другими препаратами. Время создания современных макролидов совпало с открытием новых внутриклеточных возбудителей, поэтому уместной оказалась способность новых макролидов накапливаться внутри клетки и их активность против микоплазм, хламидий, легионелл. Наступил период "ренессанса" для этой фармакологической группы, особенно в педиатрической практике: новые макролиды стали популярны из-за хорошего профиля безопасности, удобства применения, высокой эффективности, быстрого исчезновения основных симптомов заболевания. Макролидные антибиотики стали препаратами выбора при лечении внебольничных инфекций верхних и нижних дыхательных путей, кожи и мягких тканей, отитов и многих других заболеваний и составили серьезную конкуренцию защищенным пенициллинам и цефалоспоринам [29, 32, 34, 46].
Кларитромицин обладает рядом выгодных преимуществ, выделяющих его среди других новых макролидов (диритромицина, рокситромицина, азитромицина).
Механизм действия
Кларитромицин, как и другие макролиды, тормозит синтез белка в бактериях за счет связывания с активным центром рибосомальной 50S-субъединицы и подавления формирования пептидной цепи. В последнее время обнаружена еще одна способность макролидов - нарушать сборку самой 50S-субъединицы. При этом активность кларитромицина в этих двух процессах выше, чем у эритромицина (в 2 раза) и азитромицина (в 33 раза) [5]. Возможно, этим обусловлена большая активность кларитромицина против многих возбудителей.
Характер действия макролидов обычно бактериостатический, но в высоких концентрациях они могут оказывать бактерицидное действие на стрептококки, находящихся в фазе роста [6].
Антибактериальная активность
Кларитромицин обладает in vitro и in vivo активностью против многих грамположительных и грамотрицательных бактерий, а также против микоплазм, хламидий и микобактерий [34, 41].
По своей активности против метициллиночувствительных стафилококков, стрептококков, гемофильной палочки, моракселлы и легионеллы (основных возбудителей инфекций дыхательных путей) кларитромицин превосходит другие макролиды [16].
Несмотря на то что эритромицин неэффективен в лечении инфекций, вызванных гемофильной палочкой, кларитромицин справляется с этим возбудителем, что обусловлено антибактериальной активностью основного метаболита препарата (14-гидроксикларитромицина), который в 3 раза активнее против гемофильной палочки, чем сам кларитромицин [19, 41]. Во взаимодействии препарата и его метаболита отмечается синергизм. Благодаря этому in vitro эффективность кларитромицина может быть ниже, чем реальная активность лекарства, так как не учитывается антибактериальное действие метаболита [16]. Ранее считалось, что из макролидов только азитромицин достаточно активен против гемофильной палочки, но оказалось, что благодаря своему метаболиту кларитромицин не уступает азитромицину. Эта особенность существенна, потому что гемофильная палочка входит в число трех наиболее распространенных возбудителей инфекций дыхательных путей.
Макролиды обладают высокой активностью против большинства внутриклеточных возбудителей хламидий, микоплазм, уреаплазм [33]. По воздействию на Chlamydia trachomatis кларитромицин превосходит другие препараты [34, 41].
Кларитромицин наиболее активно по сравнению с другими макролидами воздействует на Helicobacter pylory, он активнее других антибактериальных средств и непосредственно влияет на внутриклеточные формы возбудителя [17], поэтому широко используется в детской гастроэнтерологии.
В отличие от других макролидов кларитромицин высокоактивен против атипичных микобактерий (M. avium, M. leprae) и превосходит азитромицин in vitro в 4 раза [6, 41], что имеет значение при лечении оппортунистических инфекций у больных иммунодефицитами.
Практически все макролиды подавляют возбудителя токсоплазмоза. Наиболее высокой активностью обладают новые макролиды [16].
Природной устойчивостью к макролидам обладают многие грамотрицательные бактерии, так как антибиотик не проникает через клеточную стенку. Однако кларитромицин показал значительную in vitro и in vivo активность против таких грамотрицательных возбудителей инфекции дыхательных путей, как Legionella pneumophiia, Moraxella catarrhalis, Bordetella pertussis [7, 15].
Однако на грамотрицательные бактерии семейства Enterobacteriaceae, Pseudomonas и Acinetobacter макролиды не действуют. Эти бактерии часто являются возбудителями при хронических заболеваниях дыхательных путей и внутрибольничных инфекциях, вот почему в этом случае макролиды будут менее эффективны в качестве эмпирической терапии и меньше используются как препараты первого выбора [50].
Кларитромицин эффективен против риккетсий, возбудителей раневой инфекции вследствие укусов животных, активен против некоторых анаэробов, включая Bacteroidesfragilis, а также бактерий рода Campylobacter [16].
Показания
Учитывая спектр антибактериальной активности, а также хорошую переносимость кларитромицина, его можно рекомендовать как препарат первого выбора для лечения следующих инфекций у детей [29-32, 34, 52]:
домашние (внебольничные) инфекции верхних дыхательных путей (тонзиллит, фарингит, ларингит, коклюш); домашние инфекции нижних дыхательных путей (бронхиты, пневмонии); острый средний отит; острый синусит; инфекции кожи и мягких тканей; язвенная болезнь желудка и двенадцатиперстной кишки. Накоплен значительный мировой опыт применения кларитромицина в педиатрии и показана его высокая эффективность при лечении этих заболеваний.
Кларитромицин также эффективен при лечении одонтогенных инфекций, болезни Лайма, риккетсиях, лепры, болезни кошачьих царапин, оппортунистических инфекций, развивающихся при СПИДе и вызванных атипичными микобактериями, а также некоторых других инфекций.
Противовоспалительный эффект
Не так давно у кларитромицина в дополнение к антибактериальной активности была обнаружена еще одна способность - оказывать противовоспалительное действие, что свойственно также некоторым другим новым макролидам, например азитромицину [83] и рокситромицину [10]. В эксперименте кларитромицин повышал продукцию моноцитами противовоспалительного цитокина интерлейкина-10. Выработка провоспалительных медиаторов моноцитами (интерлейкин-1, факторы некроза опухоли) и лимфоцитами (интерлейкин-2), напротив, снижалась. Этот эффект может благоприятно отражаться на развитии заболевания, когда после эрадикации бактерий воспалительный процесс быстрее затихает и быстрее уходят основные симптомы [54].
Резистентность
Против бактерий, резистентных к эритромицину, кларитромицин, как и другие 14-членные макролиды и азитромицин, будет неэффективен [1, 8], потому что эти штаммы, как правило, вырабатывают фермент метилазу, которая видоизменяет саму мишень действия препаратов. Резистентность к макролидам вырабатывается быстро, но резистентные штаммы после удаления препарата из среды обитания через некоторое время утрачивают способность вырабатывать метилазы.
Следует отметить, что метициллин-резистентные штаммы стафилококков всегда устойчивы к макролидам, в том числе и к кларитромицину [6, 16]. Другие грамположительные бактерии, продуцирующие β-лактамазу, могут сохранять чувствительность к кларитромицину. Так, ампициллин-резистентная гемофильная палочка остается чувствительна к кларитромицину и азитромицину [33]. В то же время пенициллин-резистентные пневмококки скорее всего будут резистентны и к макролидам [21, 25].
Легче всего резистентность к макролидам развивается у таких возбудителей, как пневмококк, стрептококки группы А, гемофильная палочка [20]. В некоторых странах, например на Тайване, у госпитальных штаммов пенициллин-резистентных пневмококков устойчивость к макролидам встречается в 90-95% [21, 35]. В связи с этим макролиды являются препаратами выбора только для лечения внебольничных инфекций, при которых резистентность к ним не столь существенна.
Среди детей резистентные к пенициллинам и макролидам штаммы пневмококков, гемофильной палочки, моракселлы встречаются все чаще [45]. Так, внебольничная гемофильная палочка, устойчивая к кларитромицину, среди детей Германии выявляется в 1-5% случаев [22], а стрептококк группы А - приблизительно в 4% [23]. Отмечается, что частота встречаемости резистентных штаммов увеличивается с каждым годом. Так, по данным итальянских исследователей, частота выделения у детей с фаринготонзиллитами, резистентных к макролидам внебольничных штаммов стрептококков группы А, в 1990 г. составила 4%, в 1991 -4,4%, а в 1994 г. - 15,5% [23]. Последние сообщения из Испании свидетельствуют о том, что резистентность S. pyogenus к макролидам - эритромицину, кларитромицину и азитромицину - среди детей составляет до 19% [37]. В связи с этим применение макролидов должно быть рационально и преимущество имеют препараты, обладающие меньшей способностью индуцировать резистентность. В этом отношении кларитромицин обладает преимуществом перед азитромицином [1-3, 18].
Фармакокинетика
Кларитромицин относится к группе 14-членных макролидов и представляет собой метилированное производное эритромицина. Благодаря этой небольшой химической модификации кларитромицин является наиболее устойчивым макролидом к гидролизу в кислой среде. Это значительно повысило его биодоступность (до 68%), снизило число нежелательный явлений со стороны желудочно-кишечного тракта (ЖКТ) и сделало независимым от приема пищи.
Пища может оказать существенное влияние на биодоступность макролидов. Кларитромицин можно назначать независимо от еды [8, 41], тогда как эритромицин лучше принимать только натощак из-за гидролиза в кислой среде желудка. Пища также замедляет скорость всасывания рокситромицина и азитромицина, поэтому эти препараты не следует принимать меньше чем за 1 ч до еды и раньше чем через 2 ч после приема пищи [9].
Приблизительно 1/2 дозы кларитромицина метаболизируется микросомальными ферментами печени с образованием активного метаболита 14-гидроксикларитромицина [8, 41]. Антибактериальная активность 14-гидроксикларитромицина мало уступает предшественнику, поэтому эффект первого прохождения через печень практически не влияет на активность лекарства и парентеральное введение имеет мало преимуществ. Благодаря синергизму со своим активным метаболитом кларитромицин все равно будет сохранять высокую активность, даже если уровень препарата в крови несколько ниже минимальной подавляющей концентрации. Метаболиты других макролидов антибактериальной активностью не обладают.
Связывание с гликопротеинами плазмы у макролидов различается. Наибольшим связыванием характеризуется рокситромицин (до 96%). Это может создавать трудности при назначении детям, склонным к гипопротеинемиям (недоношенные, дети с паренхиматозными заболеваниями печени, нефротическим синдромом, гипотрофией, кахексией, ферментопатиями), из-за опасности развития токсических реакций [10]. Кларитромицин значительно меньше связывается с белками (приблизительно на 50%) [11] и может назначаться всем детям независимо от состояния белкового обмена.
Максимальная сывороточная концентрация препарата достигается уже через 2 ч после перорального приема. Время полувыведения кларитромицина при приеме 2 раза в день составляет около 5 ч.
Достоинством новых макролидов является их способность создавать очень высокие и стабильные концентрации в тканях, превышающие уровень препарата в сыворотке крови. Кларитромицин в отношении распределения в организме занимает "золотую середину" - сбалансированное промежуточное положение в ряду других макролидов [8, 13]. Наиболее высокие сывороточные концентрации отмечаются при приеме рокситромицина, что связано с его относительно низкой способностью проникать в ткани (концентрации в тканях меньше, чем в крови из-за связывания с белками плазмы). Самые низкие концентрации в крови из-за избыточного накопления в тканях характерны для азитромицина, что теоретически может создавать проблемы при инфекциях, сопровождающихся бактериемией [6]. Быстро достигая высокой сывороточной концентрации, кларитромицин хорошо проникает в ткани, накапливается в них, но при этом остается и в крови.
Кларитромицин благодаря хорошей растворимости как в воде, так и в липидах хорошо проникает не только в ткани, но и внутрь клеток и накапливается в них в несколько раз большей концентрации (табл. 1) [4]. При воспалении проницаемость препарата в очаг увеличивается. Это связано с тем, что макролиды, а особенно кларитромицин и азитромицин, имеют особенный тропизм к клеткам иммунной системы. Так, отношение внутриклеточной концентрации кларитромицина к внеклеточной для полиморфно-нуклеарных лейкоцитов составляет 20-38, для мононуклеаров - 16-24. В результате макрофаги, нагруженные кларитромицином, во время своей миграции транспортируют препарат в очаг воспаления, создавая там особенно высокие концентрации препарата [12]. Высокие внутриклеточные концентрации препарата имеют большое значение для лечения инфекций, вызванных внутриклеточными возбудителями (хламидиями, микоплазмами, легионеллами). Однако большинство инфекций развиваются в межклеточном пространстве. Кларитромицин свободно обменивается между межклеточной и внутриклеточной средой и уровень антибиотика в очаге всегда превышает минимальную подавляющую концентрацию [14].
Таблица 1. Концентрации кларитромицина (в мкг/мл) в плазме и в тканях легкого на 5-й день лечения (доза 500 мг 2 раза в день)
Время проведения бронхоальвеолярного лаважа после последней дозы, ч Плазма Альвеолярная жидкость Альвеолярные макрофаги 4 2,00±0,6 34,5±29 480±533 8 1,55±0,4 26,1±7 220±86 12 1,22±0,3 15,1±11 181±79 24 0,23±0,1 4,6±3 99,4±50 Примечание. *Материал получен путем бронхоальвеолярного лаважа [14].Тканевое накопление кларитромицина обеспечивает постоянное присутствие препарата в высоких концентрациях в очаге инфекции во время интервала между его приемами и некоторое время после окончания курса лечения (табл. 1). Это также позволило получить хорошие терапевтические результаты при попытке принимать кларитромицин 1 раз в день и укороченным курсом [52-54,73, 74, 78].
Выведение кларитромицина осуществляется печенью, почками и трансинтестинальным путем. При почечной недостаточности необходимо снижать дозу препарата. При печеночной недостаточности дозу уменьшать не следует [41].
Применяемая в педиатрии суспензия кларитромицина не имеет существенных отличий по фармакокинетическим характеристикам от таблетированной формы препарата. После приема суспензии образуется несколько меньшее количество метаболита 14-гидроксикларитромицина, но средняя сывороточная концентрация препарата выше [36].
Резистентность и фармакокинетика
При лечении инфекционного процесса антибиотики воздействуют не только на непосредственных возбудителей, но и на все чувствительные микроорганизмы микрофлоры. При этом возможна селекция резистентных штаммов и флора становится резервуаром для устойчивых микроорганизмов и детерминант резистентности. Это может затруднить лечение инфекций у пациента в будущем. Длительное действие препарата способствует развитию резистентности, особенно если концентрации антибиотика на слизистых оболочках долго держатся на субингибиторном уровне [3]. Это наиболее важно для макролидов, так как резистентность к ним развивается быстро и нерациональное их применение сегодня может сделать эти хорошие препараты неэффективными в дальнейшем [20].
Новые макролиды, азитромицин и кларитромицин, быстро достигают высоких концентраций в тканях. При этом после окончания курса лечения азитромицин, имеющий очень длительный период полувыведения (50-100 ч), в течение 4-6 нед присутствует в тканях в концентрациях, которые ниже минимально ингибирующей и выше минимально активной. Препарат еще действует на бактерии и убирает чувствительные формы, но его концентрации уже не хватает для того, чтобы убить бактерии, которые генетически предрасположены к развитию устойчивости, поэтому под действием постоянного антибактериального давления происходит отбор менее восприимчивых форм. Создаются благоприятные условия для селекции резистентных штаммов. Этот пролонгированный период был назван "окном резистентности". В отличие от азитромицина концентрации кларитромицина по окончании лечения быстро, в течение нескольких часов, падают ниже минимально активного порога, и препарат перестает действовать на микрофлору и индуцировать развитие резистентности [3]. Имеются клинические работы, свидетельствующие о справедливости этих размышлений.
ALeach сообщает о том, что дети с трахомой через 2 мес после успешного лечения азитромицином были колонизированы азитромицин-резистентным S. pneumoniae в 21% случаев, тогда как до лечения только в 1,3% [2].
J.Guggenblicher и соавт. провели рандомизированное исследование, в котором было проанализировано действие антибиотиков на микрофлору ротовой полости детей от 6 мес до 15 лет [1, 18]. Наблюдались 100 пациентов с инфекциями дыхательного тракта. Часть детей получали кларитромицин 2 раза в день в дозе 15 мг/кг/сут в течение 7 дней, а другие - азитромицин 10 мг/кг/сут однократно в течение 3 дней. Проводили микробиологический мониторинг резистентности микрофлоры к макролидам. Пробы брали перед лечением, а затем еженедельно в течение 4 нед и на 6-й неделе. В обеих группах в 1-ю и 2-ю неделю наблюдалось резкое увеличение числа пациентов, носителей резистентных к макролидам штаммов бактерий, но затем картина резко изменилась. В группе кларитромицина со 2-й недели началось уменьшаться число резистентных микроорганизмов, тогда как после лечения азитромицином оно продолжало неуклонно увеличиваться. К 6-й неделе в группе азитромицина резистентные к макролидам микроорганизмы были обнаружены у 86% пациентов, тогда как в группе кларитромицина - только у 18% (см. рисунок). Таким образом, было подтверждено теоретическое предположение о существовании у азитромицина окна резистентности, а преимущество азитромицина в виде длительного периода полувыведения оказалось его недостатком. Устойчивыми к макролидам микроорганизмами, выявленными на 6-й неделе в группе азитромицина, были H. influenzae, M. catarrhalis, S. aureus, S. pneumoniae - типичные возбудителями инфекций дыхательных путей.
Частота выявления штаммов бактерий, резистентных к макролидам, после лечения азитромицином и кларитромицином [18].
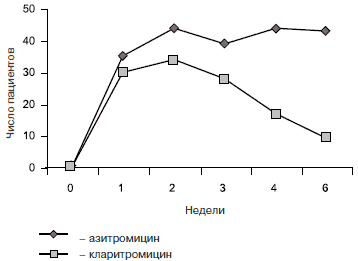
Для снижения развития резистентности следует выбирать препараты, которые наименьшим образом воздействуют на естественную микрофлору человека, а также назначать адекватную суточную дозу и режим применения. Из антибиотиков группы новых макролидов наиболее щадящей фармакокинетикой обладает кларитромицин, который значительно меньше способствует селекции резистентности, чем азитромицин.
Кларитромицин при лечении инфекций нижних дыхательных путей у детей
Долгое время основными возбудителями инфекций нижних дыхательных путей у детей были пневмококк и гемофильная палочка и традиционные препараты вполне справлялись с этими возбудителями. В настоящее время эти бактерии остаются основными возбудителями пневмоний у новорожденных [40]. В последнее десятилетие на фоне неуклонного роста резистентности стрептококков, стафилококков и других возбудителей к препаратам пенициллинового ряда и другим широко применяемым антибиотикам наблюдается усиление значимости атипичных возбудителей, к которым относят хламидии, микоплазмы, легионеллы. Частота пневмоний, вызванных этими внутриклеточными возбудителями, постоянно увеличивается и в настоящее время варьирует в пределах 5-30%. Наиболее характерны атипичные пневмонии для детей школьного возраста [40, 52].
Кроме того, все чаще пневмония становится смешанной инфекцией, в которой могут одновременно участвовать и традиционные бактерии, и внутриклеточные микроорганизмы, и даже анаэробы. Участие нескольких возбудителей при достаточной тщательности исследования встречается почти в 1/2 случаев [24].
В этих условиях для лечения инфекций нижних дыхательных путей должны применяться препараты, обладающие активностью против всех наиболее вероятных возбудителей: стрептококков, пневмококков, стафилококков, гемофильной палочки, моракселлы, хламидий, микоплазм, легионелл, анаэробов. Кларитромицин обладает такой активностью, не уступает традиционным препаратам, а нередко и превосходит их по эффективности и имеет хорошую переносимость. Кларитромицин можно рекомендовать как препарат первого выбора для лечения внебольничных инфекций нижних дыхательных путей у детей [20, 40, 41, 46, 48, 52].
В крупном многоцентровом исследовании [25] эффективность кларитромицина при лечении типичных внебольничных пневмоний (131 ребенок) составила 94%, а атипичных пневмоний (64 ребенка) - 98%, эффективность при бронхитах (179 детей) была достигнута в 95% случаев. В целом при лечении инфекций дыхательных путей почти у 3 тыс. детей эффективность кларитромицина была расценена как "отличная" (исчезновение всех симптомов) в 74,6%, как "хорошая" (исчезновение основных симптомов) - в 21,7%, "умеренная" (уменьшение симптоматики) - в 1,3% случаев. Неэффективен кларитромицин был в 0,5% случаев. При лечении кларитромицином 150 детей с пневмонией в Пакистане [27] клинический эффект был получен в 90%.
По сравнению с эритромицином кларитромицин показывает сходную эффективность, но наблюдается значительно меньше нежелательных явлений [41]. Так, в многоцентровом рандомизированном двойном слепом исследовании сравнивали эритромицин и кларитромицин при лечении пневмоний у 268 подростков [47]. Клиническая, рентгенологическая и микробиологическая эффективность препаратов была одинакова как для типичных, так и для атипичных пневмоний и составила 97% для кларитромицина и 96% для эритромицина. Однако пациенты, получавшие эритромицин, в 2 раза чаще страдали от побочных эффектов со стороны ЖКТ и в 5 раз чаще вынуждены были прервать лечение препаратом.
При лечении пневмонии, вызванной M. pneumoniae, у 32 детей кларитромицин показал 100% эффективность, как и эритромицин, при этом исчезновение рентгенологических признаков пневмонии наблюдалось быстрее у получавших кларитромицин [26]. В другом рандомизированном исследовании сравнивали эффективность кларитромицина и эритромицина у 260 детей с пневмонией [38]. По данным культурального и иммуноферментного исследования, а также полимеразной цепной реакции у 28% пациентов она была вызвана Chlamydia pneumoniae, а у 27% - M. pneumoniae. Клиническое и радиологическое излечение в группе кларитромицина было достигнуто в 98%, в группе эритромицина - в 95% случаев, эрадикация микоплазм наблюдалась в 100% в обеих группах, а хламидий - в 79 и 86% случаев соответственно. При исследовании in vitro все 49 штаммов Chlamydia pneumoniae, выделенных у детей с пневмонией, были чувствительны к макролидам, но кларитромицин был на порядок активнее эритромицина [39].
По клинической эффективности при лечении инфекций дыхательных путей между эритромицином и новыми макролидами нет значимых различий. Новые макролиды имеют преимущество как препараты со значительно лучшей переносимостью и более удобным режимом приема, что особенно важно для детей.
По эффективности кларитромицин не уступает не только другим макролидам, но также цефалоспоринам I и II поколений, защищенным и незащищенным пенициллинам [40-42]. Более того, по активности против стафилококков, пневмококков и гемофильной палочки он может превосходить такие широко применяемые при лечении респираторных инфекций антибиотики, как рокситромицин, цефаклор и амоксициллин [29].
J.Macklin и соавт. в многоцентровом слепом рандомизированном исследовании сравнивали действие суспензии кларитромицина и амоксициллина при лечении инфекций нижних дыхательных путей у детей [44]. Участвовали 145 пациентов. Между группами не было различий по клинической эффективности препаратов. Кларитромицин был эффективен в 96%, а амоксициллин - в 95% случаев. По частоте и тяжести побочных явлений группы также не различались. В слепом рандомизированном исследовании [57] сравнивали суспензии кларитромицина, цефаклора и амоксициллина/клавуланата при пневмониях у детей (n=49). Все три препарата были высокоэффективными и не различались по частоте излечения и побочным эффектам.
Некоторые авторы отмечают, что основные симптомы заболевания исчезают значительно быстрее при лечении кларитромицином, чем другими макролидами, а также фторхинолонами, пенициллином, амоксициллином и цефалоспоринами [28]. Возможно, это связано с высокой степенью антибактериальной активности кларитромицина. Данный факт имеет фармакоэкономическое значение, так как уменьшает затраты на симптоматическую терапию.
В последнее время появились сообщения, свидетельствующие о связи между бронхиальной астмой и инфицированием Chlamydiapneumoniae. Так, в работе U.Emre и соавт. у 11% детей с приступом удушья были обнаружены антитела к этому внутриклеточному возбудителю [43]. У 75% детей после эрадикации хламидий эритромицином или кларитромицином отмечали улучшение состояния по данным клинического и лабораторного обследования. Авторы предлагают включить макролиды в курс терапии детей с приступом бронхиальной астмы.
Кларитромицин при лечении ангин у детей
Почти 30% детей хотя бы 1 раз в жизни переносят стрептококковые тонзиллофарингиты [60]. Макролиды традиционно рассматриваются как альтернатива пенициллинам при ангине, вызванной β-гемолитическим стрептококком группы А, например, у пациентов с аллергией к пенициллину. Однако макролиды могут применяться и как препараты первого ряда. Они столь же эффективны, как пенициллины, и обеспечивают эрадикацию возбудителя из миндалин более чем в 90-95% случаев, тем самым осуществляют надежную профилактику серьезных осложнений ангин - ревматизма и гломерулонефрита. При этом лечение новыми макролидами значительно удобнее и комфортнее для маленького пациента, чем эритромицином [61].
По данным крупного европейского многоцентрового исследования, при лечении тонзиллита или фарингита у 1065 детей кларитромицин был эффективен в 95% случаев [25].
Так, J.Still и соавт. провели рандомизированное исследование с участием 367 детей, страдающих стрептококковым, серологически подтвержденным фарингитом. В работе сравнивалась эффективность кларитромицина и пенициллина V. Оба препарата были высокоэффективны клинически, но по частоте эрадикации, исследуемой на 10-й день после окончания лечения, кларитромицин достоверно был эффективнее. Клиническое излечение в группе кларитромицина наблюдалось в 96%, а в группе пенициллина в 94% случаев. Эрадикация стрептококка была достигнута в 92 и 81% случаев соответственно [56]. Похожие данные, свидетельствующие о равной клинической эффективности макролида и пенициллина, но о лучшей эрадикации возбудителя в группе кларитромицина, были получены в другом контролируемом исследовании [63]. Более полная эрадикация в группе кларитромицина может быть связана с тем, что макролиды не разрушаются β-лактамазами стафилококков, гемофильных палочек и моракселл, присутствующих в ротоглотке, как это нередко происходит с препаратами пенициллинового ряда, когда стрептококк in vitro проявляет чувствительность, а эффективность in vivo существенно меньше из-за резистентной β-лактамазапродуцирующей сопутствующей микрофлоры и полной эрадикации не наблюдается [60].
При сравнении кларитромицина с азитромицином в контролируемом итальянском исследовании [59] при лечении подтвержденных стрептококковых тонзиллитов у детей оба препарата показали равную эффективность. Частота излечения в группе кларитромицина составила 96,8%, а в группе азитромицина - 95,9%. Частота бактериологической эрадикации на 20-й день после лечения составила 95,2 и 94,6% соответственно. За счет лучшей комплаентности азитромицина (длительность лечения -3 дня) его эффективность была несколько выше (93 против 82%) после включения в анализ детей, которые по тем или иным причинам не получили всего курса терапии.
Данные об одинаково высокой клинической (98 и 97% соответственно) и бактериологической (86 и 88% соответственно) эффективности кларитромицина и амоксициллина при тонзиллофарингите были получены в контролируемом британском исследовании с участием 191 ребенка [62].
Не менее эффективны при ангинах у детей оказались укороченные курсы кларитромицина - в течение 5 дней.
Так, при сравнении кларитромицина, назначаемого в стандартной дозе в течение 5 дней, и 10-дневного курса терапии пенициллином оба препарата были высокоэффективны клинически, но частота эрадикации была значительно выше при применении кларитромицина (94 и 78% соответственно) [74].
В некоторых районах России встречаемость штаммов стрептококков, резистентных к эритромицину и другим макролидам, среди детей и взрослых достигает 13% [6]. По данным испанских педиатров, резистентные к кларитромицину штаммы были обнаружены в 7,8% из 750 наблюдений [55], в то же время в США, по данным широкомасштабного исследования, среди 700 детей резистентность пиогенного стрептококка к кларитромицину составляет меньше 2% и не является значимой клинической проблемой [58]. Ввиду быстрого развития резистентности повторное лечение макролидами в случае рецидива нежелательно, а первичное лечение лучше проводить кларитромицином, так как он благодаря своим фармакокинетическим способностям меньше способствует индукции резистентности.
Кларитромицин при лечении среднего отита у детей
Основными возбудителями среднего отита являются Streptococcus pneumoniae, Moraxella catarrhalis, Haemophilus influenzae. У детей старшего возраста возбудителем может быть также пиогенный стрептококк, у маленьких детей - хламидии [68]. Если эритромицин имел ограниченные возможности из-за недостаточной активности против гемофильной палочки, то спектр действия кларитромицина включает все основные возбудители среднего отита и может уверенно использоваться при этом распространенном заболевании, благодаря активности основного метаболита препарата, 14-гидроксикла-ритромицина, против гемофильной палочки [76].
При остром среднем отите макролиды можно использовать в качестве хорошей альтернативы к аминопени-циллинам и котримоксазолу, фармакокинетика которых не позволяет достигать высоких концентраций в полости среднего уха, тогда как кларитромицин обладает способностью накапливаться в очаге воспаления. Так, концентрация препарата в жидкости среднего уха у детей, страдающих острым средним отитом, была в 3-5 раз выше, чем в плазме крови [67]. Кроме того, β-лактамные антибиотики (пенициллины, цефалоспорины) могут разрушаться β-лактамазами пенициллин-резистентных штаммов пиогенного стрептококка и гемофильной палочки, которые получают все большее распространение [68, 69]. β-Лактамазы могут вырабатывать также другие бактерии, составляющие микрофлору носоглотки [68]. В России высока резистентность к котримоксазолу, поэтому макролиды можно рекомендовать использовать не как альтернативные препараты, а как лекарственные средства первого выбора и наибольшее предпочтение имеют новые макролиды, особенно кларитромицин [69].
По данным ряда многоцентровых исследований, суспензия кларитромицина высокоэффективна при среднем отите у детей. В германском исследовании с участием 102 пациентов на 5-й день терапии кларитромицином клиническое излечение было достигнуто в 99% случаев [66]. Побочные эффекты наблюдались у 3% детей. В испанском исследовании эффективности кларитромицина при респираторных инфекциях у детей [25] участвовали 310 больных острым средним отитом. Препарат показал свою эффективность в 96,1% случаев.
В большом количестве контролируемых сравнительных исследований было показано, что кларитромицин не уступает защищенным и незащищенным пенициллинам, цефалоспоринам, другим новым макролидам, а нередко и превосходит некоторые препараты, особенно пенициллины, по эффективности или безопасности [68-73].
Так, в рандомизированной работе с участием 736 детей кларитромицин показал одинаковую эффективность с амоксициллином/клавуланатом и цефаклором. При этом частота побочных эффектов у кларитромицина была в 2 раза меньше, чем в группе получавших амоксициллин/клавуланат, и составила 16% (36/221) для кларитромицина и 30% (74/244) для защищенного пенициллина [71].
При рандомизированном сравнении [70] суспензий кларитромицина и амоксициллина отдаленный эффект клинического излечения был получен в группе кларитромицина у 95% (20/21) детей, а в группе амоксициллина у 86% (19/22). Частота побочных эффектов не различалась и составила по 1 ребенку в каждой группе, но если в группе макролида тяжесть нежелательных явлений позволила продолжить лечение, то ребенок, получавший амоксициллин, был вынужден прервать терапию.
В слепом рандомизированном сравнительном исследовании кларитромицина и цефуроксима аксетила оказалось, что препараты одинаково высокоэффективны при лечении среднего отита, хорошо переносятся детьми и не различаются по частоте развития побочных эффектов [72].
Обычный курс лечения острого среднего отита составляет 10 дней. Более короткий 5-дневный курс терапии оказался не менее эффективным и более удобным для пациента [73, 75]. В рандомизированном слепом плацебо-контролируемом исследовании с участием 138 детей было показано, что назначение кларитромицина в течение 5 дней также эффективно и безопасно, как и 10-дневный курс лечения [75]. При сравнении кларитромицина и азитромицина, назначаемых в течение 5 дней, оба препарата были одинаково эффективны в 99% случаев при лечении детей со средним отитом; не различались они и по частоте нежелательных явлений.
Риносинуситы
Кларитромицин высокоактивен против основных возбудителей синуситов у детей и превосходит эритромицин по активности против гемофильной палочки. Кроме того, кларитромицин хорошо проникает в слизистую пазух носа и накапливается в них в концентрациях, превышающих сывороточные и минимальные подавляющие концентрации для возбудителей синусита [8, 79].
По данным многоцентрового европейского исследования с участием 310 детей, страдающих острым синуситом, и 15 детей с ринитом, эффективность кларитромицина при синусите составила 97,3%, а при рините - 93,8% [25].
Контролируемых сравнительных исследований эффективности кларитромицина при синуситах у детей не проводилось. Однако на основании многоцентровых слепых рандомизированных сравнительных исследований, проведенных с участием взрослых, можно утверждать, что кларитромицин сопоставим по эффективности с ципрофлоксацином [82], левофлоксацином [80] и азитромицином [81].
Коклюш
У детей с коклюшем макролиды хотя и не влияют на продолжительность заболевания, но уменьшают тяжесть его клинических проявлений и вызывают быструю эрадикацию Bordetella pertussis из носоглотки [52, 76]. По этой причине макролиды, в том числе кларитромицин, могут применяться как препараты выбора для лечения коклюша у детей, а также для профилактического лечения членов семьи больного [77].
Обычно рекомендуемый курс лечения эритромицином составляет 12 дней. Однако благодаря улучшенным фармакокинетическим характеристикам новые макролиды, кларитромицин и азитромицин, могут применяться в течение 7 дней. Показано, что эффективность терапии при этом не уменьшается [78].
Дозировка
Стандартный режим назначения кларитромицина - 2 раза в день. Такой подход связан со скоростью полувыведения кларитромицина, составляющей 4 ч. Данный режим удобнее, чем таковой для эритромицина, требующий приема 4 раза в день. В педиатрии удобство приема препарата для пациента имеет особенное значение, поэтому чем реже принимать препарат, тем больше шансов, что он будет принят.
В последнее время, учитывая, что концентрации препарата в очаге воспаления намного превышают сывороточные, все чаще начинают говорить о возможности применения суточной дозы препарата однократно и о более коротком курсе терапии [41, 34]. В рандомизированном перекрестном исследовании на добровольцах было показано, что при назначении кларитромицина 1 раз в день в суточной дозе 500 мг или 2 раза в день в дозе 250 мг форма фармакокинетической кривой была одинакова [52]. При назначении 1 раз в день в тканях легкого высокие концентрации препарата сохранялись постоянно. Концентрация в альвеолярной жидкости превышала минимальную подавляющую для типичных бактериальных патогенов инфекций дыхательных путей, а концентрация в альвеолярных макрофагах превышала минимальную подавляющую концентрацию для важнейших внутриклеточных возбудителей. Таким образом, появились теоретические предпосылки для применения кларитромицина 1 раз в день, которые уже получили клиническое подтверждение.
Так, в двойном слепом рандомизированном многоцентровом исследовании эффективность кларитромицина, применяемого 2 или 1 раз в день, была одинакова при лечении обострения хронического бронхита у 265 взрослых пациентов [52]. Одинаковой также была частота побочных эффектов в целом, хотя нежелательные явления со стороны ЖКТ чаще наблюдались у получавших кларитромицин 2 раза в день.
В одном из исследований курс лечения был намного короче традиционного - всего 5 дней - и эффективность составила 97,5% [53]. В ряде других исследований у детей также было показано, что короткие курсы (5 дней) равны по эффективности при лечении у детей фарингита [54, 74], острого среднего отита [73, 75] и коклюша [78] обычными 7- и 10 дневными режимами терапии, но, несомненно, более удобны для пациентов.
Возможно, что в ближайшем будущем при наличии достаточного числа исследований будет показана правомерность применения кларитромицина 1 раз в сутки при лечении инфекций дыхательных путей у детей коротким 5-дневным курсом. В этом случае кларитромицин по комплаентности не будет уступать основному своему конкуренту - азитромицину, который можно применять 1 раз в сутки в течение 3 дней.
В настоящее время при инфекциях дыхательных путей кларитромицин у детей принято назначать в дозе 7,5 мг/кг массы тела в сутки, разделенной на 2 приема. Максимальная суточная доза составляет 500 мг, длительность лечения - 7-10 дней.
При инфекциях дыхательных путей, особенно при тяжелых пневмониях, требующих стационарной терапии, может потребоваться внутривенное введение макролидов. К сожалению, до последнего времени парентеральные формы макролидов отсутствовали на российском рынке. У кларитромицина есть внутривенная форма, и она доступна в России.
При лечении инфекций дыхательных путей в стационаре в настоящее время популярна так называемая ступенчатая терапия, когда лечение начинается с внутривенного введения препарата, а затем через 1-3 дня переходят на пероральную форму того же лекарственного средства. Этим обеспечивается и больший комфорт для пациента, и меньше сил и средств затрачивается на лечение при равной эффективности. Благодаря наличию внутривенной формы и суспензии для перорального приема ступенчатую терапию можно использовать при лечении кларитромицином. В многоцентровом исследовании сравнивали кларитромицин и комбинацию цефуроксима и эритромицина при ступенчатой терапии внебольничных пневмоний у 235 пациентов [51]. Значимых различий между группами по частоте клинической или бактериологической эффективности не отмечено, тогда как нежелательных явлений (тошнота, рвота, диарея, боль в животе) было значительно больше среди получавших цефуроксим и эритромицин.
Переносимость и лекарственные взаимодействия
В целом макролиды, особенно представители нового поколения, относятся к препаратам с благоприятным профилем безопасности и хорошо переносятся детьми. Наиболее характерны для детей при приеме кларитромицина нежелательные явления со стороны ЖКТ, такие как тошнота (1%), рвота (6%), диарея (7%), боли в животе (2%) и головные боли (2%). Реже встречаются аллергические реакции, симптомы гепато- и ототоксичности, нежелательные явления со стороны нервной системы [65]. В целом нежелательные явления у эритромицина, кларитромицина и азитромицина не намного различаются и наблюдаются в 4-27% случаев [64]. Это сопоставимо с частотой побочных эффектов, наблюдающихся при приеме детьми суспензий β-лактамных антибиотиков (ампициллина, ампициллина/клавуланата, цефаклора и др.) [65].
Одно из отличий новых макролидов от традиционного эритромицина - меньшее число расстройств со стороны ЖКТ. Метаболиты новых макролидов меньше стимулируют мотилиновые рецепторы кишечника, которые усиливают тонус и перистальтику, и, соответственно, реже возникает тошнота и рвота, которая после приема эритромицина наблюдается в 10-20% случаев [50].
Отклонения со стороны лабораторных показателей встречаются при применении кларитромицина в 0-1% случаев, тогда как при использовании эритромицина - в 2-4% [64]. Наиболее распространены подъемы печеночных ферментов.
Активное использование макролидов в последние годы и расширяющаяся полипрагмазия увеличили вероятность развития лекарственных взаимодействий с препаратами, подвергающимися инактивации системой микросомальных ферментов цитохрома P-450. Поскольку метаболизация кларитромицина осуществляется микросомальными ферментами печени с участием системы цитохрома P-450, то кларитромицин может оказывать влияние на метаболизм всех препаратов, проходящих через эту систему [41]. При этом кларитромицин обладает меньшей способностью, чем эритромицин, увеличивать концентрации в сыворотке таких препаратов, как циклоспорин, варфарин, теофиллин, карбамазепин, терфенадин, но совместное назначение кларитромицина с последними тремя лекарственными средствами противопоказано [64].
Заключение
В настоящее время не утихли споры относительно сравнения преимуществ и недостатков эритромицина и новых макролидов. Еще сложнее разобраться в различиях между наиболее удачными новыми макролидами, азитромицином и кларитромицином [49]. Несмотря на равную клиническую эффективность при лечении инфекций дыхательных путей и мягких тканей, эти препараты имеют существенные различия по таким показателям, как фармакокинетические характеристики, профиль безопасности, комплаентность, частота эрадикации, которые нередко недооцениваются, хотя их необходимо учитывать (табл. 2).
Таблица 2. Сравнительная характеристика эритромицина и кларитромицина
Показатель Эритромицин Кларитромицин Активность против гемофильной палочки 0 ++ Активность против стафилококков, пневмококков, стрептококков, хламидий + ++ Независимость от приема пищи 0 + Активность метаболита 0 + Накопление в очаге воспаления 0 + Противовоспалительная активность 0 + Частота приема 4 раза в сутки 2 раза в сутки Нежелательные явления ++ + Лекарственные взаимодействия ++ + Примечание. "0" - отсутствуют, "+" - умеренные, "++" - выраженные.В настоящее время выбор эмпирической терапии инфекций у детей должен основываться на таких свойствах препаратов, как эффективность, безопасность (нежелательные явления), комплаентность (возможность перорального применения, независимость от приема пищи, назначение 1-2 раза в день, приятный вкус, короткий курс терапии) [45, 48].
Кларитромицин обладает почти всеми характеристиками идеального антибиотика для лечения респираторных инфекций у детей [7, 8]: высокая биодоступность при пероральном применении, высокая эффективность при относительно низких дозах препарата, длительный интервал между приемами, сбалансированная концентрация в тканях и крови, высокая внутриклеточная концентрация, высокая активность основных метаболитов, широкий спектр антибактериальной активности, включающий всех основных возбудителей инфекций дыхательных путей, и, наконец, безопасность и хорошая переносимость.
Литература
1. Kastner U, Guggenbichler JP. Influence of macrolide antibiotics on the oral flora. European Congress of Chemotherapy (ECC) Hamburg, Germany, May 10-13,1998.
2. Leach AJ. Aprospective study of the impact of community-based azithromicin treatment of trachoma on carriage and resistance of Streptococcus pneumoniae. Clin Infect Dis 1997; 24:356-62.
3. Low DE. The evolution and dissemination of resistance: antibiotic influence on the normal flora. Infect in Med 1999; 16: 18-23.
4. Ishi K Saito Y, Itai S et al. Comparative study of pharmacokinetic parameters between clarithromicin and erythromycin stearate in relation to their physicochemical properties. Drug Develop andPharm 1998; 24(2): 129-37.
5. Champney WS, Burdine R. Azithromycin and clarithromycin inhibition of 50S ribosomal subunit formation in Staphylococcus aureus cells. Curr Microbiol 1998; 36: 119-23.
6. Страчунский Л.С., Козлов СН. Клиническая фармакология макролидов РМЖ1997; 5(21): 1392-4047. Charles L, Segreti G. Choosing the right macrolide antibiotic. A guide to selection Drugs 1997; 53(3): 349-57.
8. PeritiP, Mazzei T. Clarithromicin:pharmacokinetic and pharmacodynamic interrelationships and dosage regimen. J Chemother 1999; 11(1): 11-27.
9. Guay DRP. Macrolide antibiotics in pediatric infectious diseases. Drugs 1996; 51:515-36.
10. Самсыгина ГА, Братнина НП., Богомильский МР. Рулид (рокситромицин) в лечении заболеваний респираторного тракта у детей. М., 1997.
11. Carbon C. Clinical relevance of intracellular and extracellular concentrations of macrolides Infect 1995; 23: 10-4.
12. Drusano GL, Craig WA Relevance of pharmacokinetics and pharmacodynamics in the selection of antibiotics for respiratory tract infections J Chemother 1997; 9(3): 38-44.
13. Nightingale CH. Pharmacokinetics and pharmacodynamics of newer macrolides Pediatr Infect Dis J1997; 16:438-43.
14. Rodvold KA, Gotfrierd MH, Danziger LH, Servi RJ. Intrapulmonary steady state concentrations of clarithromycin and azithromycin Antimicrob Agents Chemother 1997; 41(6): 1399-402.
15. FraschiniF, Scaglione F, Demartini G. Clarithromycin clinical pharmacokinetics. Clin Pharmacokinet 1993; 25(3): 189-204.
16. Paters DH, Clissold SP. Clarithromycin: a review of its antimicrobial activity,pharmacokinetic properties and therapeutic potential. Drugs 1992; 44(1): 117-64
17- Piccolomini R, Di Bonavetura C, Catamo G, Neri M. In vitro activity of clarithromycin against intracellular Helicobacter pylori ICMASK, Barcelona, 1998.
18. Kastner U, Guggenbichler JP. Influence of macrolide antibiotics on the oral flora. ICMASK, Barcelona, 1998.
19. FongIW. An overview of the activity of clarithromycin againstH. influenzae. Infect Med 1993; 41-6.
20. Alvarez-Elcoro S, EnzlerMJ. The macrolides: erythromycin, clarithromycin, and azithromycin. Mayo Clin Proc 1999; 74(6): 613-34.
21. Hsueh PR, Teng LJ, Lee LN et al. Extremely high incidence of macrolide and trimethoprim-sulfamethoxazole resistance among clinical isolates of Streptococcus pneumoniae in Taiwan.J Clin Microbiol 1999; 37(4): 897-901.
22. Doern GV. Resistance among problem respiratory pathogens in pediatrics. Pediatr Infect DisJ 1995; 14(5): 420-3.
23. Millesimo M, Savoia D. Group A streptococci: evaluation of in vitro resistance to two macrolides.Microbios 1995; 82(332): 141-7.
24. LoCicero SC, Vetter N. Emergingpathogens and mixed infections In: Macrolides in New Millenium1998; Crete: 2-3.
25. Farhat CK. Use of clarithromicin in respiratory infection in pediatrics Modern Pediatr 1995; 31(2): 4-12.
26. CraftJC, Aynilian G, CoxS. Clarithromycin in the treatment of community-acquired pneumoniae due to M.pneumoniae in adult and pediatric patients ICMASK 1996; 10-11.
27. Bhutta TI, Sheikh MI, Khan MIJaved T. Efficacy of clarithromycin oral suspension in pediatric pneumoniae and follicular tonsillitis in Pakistan. ICMASK 1998; 134-5.
28. VogelF, OberenderP. Pharmacoeconomical evaluation therapy with clarithromycin versus other antibiotics in the treatment of lower respiratory tract infections ICMASK 1996; 40-1.
29. Klein JO. History of macrolide use in pediatrics. Pediatr Infect DisJ 1997; 16(4): 427-31.
30. Wiedermann BL. Macrolides: clarithromycin and azithromycin. Pediatr Rev 1998; 19(7): 238-9
31. Salpietro CD, Bisignano G, Fulia F et al. Chlamydia trachomatis conjunctivitis in the newborn. Arch Pediatr 1999; 6(3): 317-20.
32. Guay DR. Macrolide antibiotics in pediatric infectious diseases. Drugs 1996; 51(4): 515-36.
33. Langtry HD, Balfour JA Azithromycin. A review of its use in pediatric infectious diseases. Drugs 1998;56(2): 273-97.
34. KleinJO. Clarithromycin: where do we go from here? Pediatr Infect Dis J. 1993; 12(3): 148-51.
35. Chiou CC; Liu YC; Huang TS et al. Extremely high prevalence of nasopharyngeal carriage of penicillin-resistant Streptococcus pneumoniae among children in Kaohsiung, Taiwan.J Clin Microbiol 1998;
36(7): 1933-736. Guay DR, Craft JC. Overview of the pharmacology of clarithromycin suspension in children and a comparison with that in adults. Pediatr Infect DisJ 1993; 12(3): 106-11.
37. Gene A, Gonzalez-Cuevas A,Juncosa T et al. Sensibilidad antibiotica de Streptococcus pyogenes en pediatria. Enferm Infecc Microbiol Clin 1998; 16(6): 272-4
38. Block S, Hedrick J, HammerschlagMR et al. Mycoplasma pneumoniae and Chlamydia pneumoniae in pediatric community-acquired pneumonia: comparative efficacy and safety of clarithromycin vs. Erythromycin ethylsuccinate. Pediatr Infect DisJ. 1995; 14(6): 471-7.
39. Roblin PM, Montalban G, Hammerschlag MR. Susceptibilities to clar-ithromycin and erythromycin of isolates ofChlamydia pneumoniae from children with pneumonia. Antimicrob Agents Chemother. 1994; 38(7): 1588-9.
40. Harris JA. Antimicrobial therapy of pneumonia in infants and children. Semin-Respir-Infect. 1996; 11(3): 139-47
41. Langtry HD, Brogden RN. Clarithromycin. A review of its efficacy in the treatment of respiratory tract infections in immunocompetent patients. Drugs 1997; 53(6): 973-1004
42. Paffetti A, Mastropietro C, Mannozzi P et al. La claritromicina nelleta pediatrica. Esperienzapersonale. Minerva Pediatr 1994; 46(4): 181-3.
43. Emre U, Roblin PM, Gelling M et al. The association of Chlamydia pneumoniae infection and reactive airway disease in children. Arch Pediatr AdolescMed 1994; 148(7): 727-32.
44. Macklin JL,James I, Kearsley NJ, Coles SJ. A single-blind, randomised, comparative study of clarithromycin and amoxicillin suspensions in the treatment of children with lower respiratory tract infections. J Chemother 1993; 5(3): 174-80.
45. Pichichero ME. Empiric antibiotic selection criteria for respiratory infections in pediatric practice. Pediatr Infect DisJ 1997; 16(3): 60-4.
46. Rodriguez WJ, Wiedermann BL. The role of newer oral cephalosporins, fluoroquinolones, and macrolides in the treatment of pediatric infections. Adv Pediatr Infect Dis. 1994; 9: 125-59.
47. Chien SM, Pichotta P, Siepman N, Chan CK. Treatment of communityacquired pneumonia. A multicenter, double-blind, randomized study comparing clarithromycin with erythromycin. Canada-Sweden Clar-ithromycin-Pneumonia Study Group. Chest. 1993; 103(3): 697-701.
48. Schaad UB. Antibiotic therapy of childhood pneumonia. Pediatr Pulmonol Suppl 1999; 18: 146-9.
49. Amsden GW. Erythromycin, clarithromycin, and azithromycin: are the dfferences real? Clin Ther 1996; 18(1): 56-72.
50. Белобородова НВ., Богданов МБ., Черненькая ТВ. Алгоритмы антибиотикотерапии. Руководство для врачей. М, 1999.
51. VetterN, Stamler DJNeill S et al. Clarithromycin versus combined cefuroxime and erythromycin in the treatment of hospitalized community acquired pneumoniae patients - intravenous followed by oral therapy. Clin Drug Invest 1997; 14(6): 439-49
52. Tarlow MJ, Block SL, Harris J, Kolokathis A Future indications for macrolides. Pediatr Infect DisJ 1997;16(4):457-62.
53- Bouros D. Clarithromycin once-a-day: safety and efficacy. Macrolides in New Millenium 1998; Crete: 10-1.
54- MacLeon CM. Novel clarithromycin research. In: Macrolides in New Millenium 1998; Crete: 34-5.
55- Still JG, Palmer RAn evaluation of clarithromycin and penicillin in patients with streptococcal pharyngitis. ICMASK 1996; 22-3. м56. Garcia de Lomas J, Gimeno C, Diez J et al. Sensibilidad a eritromicina y claritromicina de aislados de Streptococcus betahemolitico delgrupo A productores de faringoamigdalitis en la edad pediatrica: estudio multicentrico en atencion primaria. Grupo Espanol para el Estudio de la Sensibilidad a Macrolidos en Atencion Primaria. Enferm Infecc Microbiol Clin 1999; 17(1): 24-8.
57. Gatchhalian SR, Tiangco B, Medalla C et al. A single-blind randomized, phase III comparative study of clarithromycin, cefaclor and amoxicillin/clavulanic acid suspensions in the treatment of patients with lower respiratory tract infections. ICMASK 1998; 275-6.
58. Kaplan EL,Jonhson DR. The spectrum of macrolide susceptibility among group A streptococci isolated from the upper respiratory tract in the United States, 1996-97ICMASK 1998; 244-5
59. Venuta A, Laudizi L, Beverelli A et al. Azithromycin compared with clarithromycin for the treatment of streptococcal pharyngitis in children.JInt Med Res 1998; 26(3): 152-8.
60. Pichichero ME. Group A streptococcal tonsillopharyngitis: cost-effective diagnosis and treatment Ann EmergMed 1995; 25(3): 390-403
61. Tarlow MJ. Macrolides in the management of streptococcal pharyngitis/tonsillitis. Pediatr Infect DisJ 1997;16(4): 444-8.
62. Kearsley NL, Campbell A, Sanderson AA et al. Comparison of clarithromycin suspension and amoxicillin syrup for the treatment of children with pharyngitis and/or tonsillitis. Br J Clin Pract 1997; 51(3): 133-7
63. Still JG, Hubbard WC, Poole JM et al. Comparison of clarithromycin and penicillin VK suspensions in the treatment of children with streptococcal pharyngitis and review of currently available alternative antibiotic therapies. Pediatr Infect DisJ 1993; 12(3): 134-41
64. Principi N, Esposito S. Comparative tolerability of erythromycin and newer macrolide antibacterials in paediatric patients. Drug Saf 1999; 20(1): 25-41
65. Craft JC, Siepman N. Overview of the safety profile of clarithromycin suspension in pediatric patients. Pediatr Infect DisJ 1993; 12(3): 142-7
66. Horst S. Study of the efficacy and toleration of clarithromycin suspension in children with acute otitis media. The Pediatrician 1996; 4(27): 540-3.
67. Gan VN, McCartyJM, Chu SY, Carr R Penetration of clarithromycin into middle ear fluid of children with acute otitis media. Pediatr Infect DisJ. 1997; 16(1): 39-43.
68. Block SL. Causative pathogens, antibiotic resistance and therapeutic considerations in acute otitis media. Pediatr Infect DisJ 1997; 16(4): 449-56.
69. Cohen R. The antibiotic treatment of acute otitis media and sinusitis in children Diagn Microbiol Infect Dis 1997; 27(1-2): 35-9
70. Craft JC, Siepman N, Palmer RN, Hom R Treatment of acute otitis media in children comparing clarithromycin and amoxicillin suspension. Macrolides in New Millenium, Crete 1998; 2: 4-5.
71. McCarty J, Good C, Renteria A et al. Comparative safety of clarithromycin vs amoxicillin/clavulanate or cefaclor in the treatment of acute otitis media in children. ICMASK 1996; 24-5.
72. Kafetzis DA, Makaka-Zafiriou C, Bairamis T. Cpmparison of the efficacy and tolerability of clarithromycin suspension in the treatment of acute otitis media in pediatric patients. Clin Drug Invest. 1997; 14(3): 192-9
73. Ramet J. A comparative safety and efficacy study of clarithromycin and azithromycin suspensions in the short course treatment of children with acute otitis media. Macrolides in New Millenium, Crete 1998; 4:26-7.
74. McCarthy J, Hedrick J, Gooch M. A short course of clarithromycin suspension vs.penicillin V suspension in children with streptococcal pharyngitis. ICMASK, Barcelona 1998; 140-1.
75. LebelMH, SchlossM, Mehra S. A Prospective, Double-Blinded, Placebo-Controlled Studyof a 5-Day Versus 10-Day Course of Clarithromycin Suspension in Canadian Children with Acute Otitis Media. ICMASK, Barcelona 1998; 148-9.
76. Jacobs RF, Schutze GE, Young RA et al. Antimicrobial agents. In: Principles and practice of pediatric infectious diseases/Eds. SSLong, LKPickering, C.GProber. New York, 1997; 1604-62.
77. SturmbergJP, Watt P. Could it be whooping cough? Aust Fam Physician 1999; 28(2): 129-31
78. Aoyama T, Sunakawa K, Iwata S et al. Efficacy of short-term treatment of pertussis with clarithromycin and azithromycin.JPediatr 1996; 129(5): 761-4
79. Miyazawa T, Iino Y, Ogawa K et al. Mucous pathology and macrolide treatment of paranasal sinusitis in children Jpn J Antibiot 1998; 51: 100-2.
80. AdelglassJ, Jones TM, Ruoff G et al. A multicenter, investigator-blinded, randomized comparison of oral levofloxacin and oral clarithromycin in the treatment of acute bacterial sinusitis. Pharmacotherapy 1998; 18(6): 1255-63.
81. Muller O. Comparison of azithromycin versus clarithromycin in the treatment of patients with upper respiratory tract infections. J Antimicrob Chemother 1993; 31(E): 137-46.
82. CliffordK Huck W, Shan M et al. A Double-blind comparative trial of ciprofloxacin versus clarithromycin in the treatment of acute bacterial sinusitis. Sinusitis Infection Study Group. Ann Otol Rhinol Laryngol 1999; 108(4): 360-7.
83. Jun-ichiKadota Njn-antibiotic effect of antibiotics Clin Microb and Infect 1996; 1(2): 20-2.
Март 2009 г.